Method Article
Behandlung von Ligamentenkonstrukten mit ausüberschüssigem Serum: Ein Translations-Gewebe-Engineering-Modell
In diesem Artikel
Zusammenfassung
Wir präsentieren ein Modell des Bandgewebes, in dem dreidimensionale Konstrukte mit dem menschlichen Übungskonditionierten Serum behandelt und auf Kollagengehalt, Funktion und Zellbiochemie analysiert werden.
Zusammenfassung
In-vitro- Experimente sind essentiell, um biologische Mechanismen zu verstehen; Allerdings ist die Kluft zwischen der monolayer Gewebekultur und der menschlichen Physiologie groß, und die Übersetzung der Befunde ist oft schlecht. So gibt es genügend Gelegenheit für alternative experimentelle Ansätze. Hier stellen wir einen Ansatz vor, in dem menschliche Zellen aus menschlichen vorderen Kreuzband-Geweberesten isoliert, in Kultur erweitert und zur Bildung von konstruierten Bändern verwendet werden. Übung ändert das biochemische Milieu im Blut, so dass die Funktion vieler Gewebe, Organe und Körperprozesse verbessert wird. In diesem Experiment wurde das Ligamentenkonstruktionskulturmedium mit experimentellem Humanserum ergänzt, das durch Übung "konditioniert" wurde. Somit ist die Intervention biologisch relevanter, da ein experimentelles Gewebe dem vollen endogenen biochemischen Milieu ausgesetzt ist, einschließlich bindender Proteine und ergänzender Verbindungen, die im Zusammenhang mit der Aktivität von a verändert werden könnenUnbekannter Agent von Interesse. Nach der Behandlung können konstruierte Bänder für mechanische Funktion, Kollagengehalt, Morphologie und zelluläre Biochemie analysiert werden. Insgesamt gibt es vier große Vorteile gegenüber herkömmlichen Monolayer-Kultur- und Tiermodellen, dem hier vorgestellten physiologischen Modell des Bandgewebes. Zuerst sind die Ligamentenkonstrukte dreidimensional, so dass mechanische Eigenschaften ( dh Funktion), wie z. B. Zugspannung, maximale Zugbelastung und Modul, quantifiziert werden können. Zweitens kann die Enthesis, die Schnittstelle zwischen boney und sinew elements, im Detail und im funktionalen Kontext untersucht werden. Drittens ermöglicht die Vorbereitung von Medien mit Post-Übungs-Serum die Auswirkungen des ausübung-induzierten biochemischen Milieus, das für das breite Spektrum der gesundheitlichen Vorteile der Übung verantwortlich ist, in einer unvoreingenommenen Weise zu untersuchen. Schließlich schreitet dieses experimentelle Modell die wissenschaftliche Forschung auf eine humane und ethische Weise vor, indem sie die Verwendung vonTiere, ein Kernmandat der National Institutes of Health, das Center for Disease Control und die Food and Drug Administration.
Einleitung
Sehnen- und Bandverletzungen sind häufig und können schwächende Konsequenzen für die normale Mobilität und Lebensqualität haben. Chirurgische Eingriffe sind oft notwendig, können aber einen begrenzten und vielfältigen Erfolg haben 4 , 5 . Das gegenwärtige Verständnis davon, wie sich Sehnen und Bänder entwickeln, reifen und auf Verletzungen reagieren, ist unvollständig, und so sind wirksame Forschungsmodelle erforderlich, um einen Einblick in die Entwicklung effektiverer Behandlungen zu geben. Um diese Wissenslücke zu bewältigen, können Tiermodelle verwendet werden, aber in vivo Studien sind inhärent komplex mit Schwierigkeiten bei der Kontrolle der Umwelt und direkt auf Interventionen auf das beabsichtigte Gewebe. Im Gegensatz dazu kann die experimentelle Umgebung in vitro mit der traditionellen Monolayerzellkultur leicht kontrolliert und überwacht werden . Diese Technik kann jedoch die chemische und mechanische Umgebung übertreffen und kann daher nicht rekapitulierenSpät das in vivo Verhalten der Zellen. Tissue Engineering ist in der Lage, die Vorteile der komplexen in vivo Umgebung in Tiermodellen mit der Kontrolle der in vitro Umwelt zu heiraten und bietet ein zusätzliches Werkzeug, um Physiologie zu studieren. Darüber hinaus, bewaffnet mit einem besseren Verständnis der Ligament-Entwicklung, Tissue Engineering kann auch eine Quelle von Transplantat Gewebe, wenn chirurgische Rekonstruktion erforderlich ist 6 . Somit validiert das hier beschriebene Verfahren ein in vitro 3D-konstruiertes Gewebe, das verwendet werden kann, um die Bandfunktion und die Morphologie zu untersuchen.
Fibrin-basierte Sehnen- oder Ligamentenkonstrukte wurden als In-vitro- Modell verwendet, um physiologische Prozesse einschließlich Kollagenfibrillogenese 7 und Sehnenentwicklung 8 sowie Translationsanwendungen zu untersuchen, bei denen ihre Nützlichkeit als Pfropfgewebe in einem Schafmodell von anterior cru ausgewertet wurdeLigament (ACL) Rekonstruktion 9 . Unser Labor hat zuvor ein 3D-konstruiertes Ligamentmodell mit zwei Brushit, einem Calciumphosphat-Knochenersatzmaterial, Zementankern, hergestellt. Dieses Modell kann durch einfache Ergänzung des Kulturmediums mit biologischen Faktoren 10 oder durch Anwendung mechanischer Stimulation 11 verschiedenen experimentellen Bedingungen unterworfen werden. Wichtig ist, dass dieses Knochen-zu-Knochen-Ligament-Modell die eingehende Analyse der Enthesis, der Schnittstelle zwischen Boney- und Sehnenelementen, ermöglicht, die anfällig für Verletzungen ist.
In der Studie, die hier gezeigt wurde, um diese Methodik zu präsentieren, interessierten wir uns für die Wirkung von trainationsbedingten Veränderungen im biochemischen Milieu auf die Bandfunktion. Übung verbessert die Zell- und Organfunktion in einer Vielzahl von Geweben im ganzen Körper 2 , 3 , 12 , ein Effekt, der auf die Freisetzung verschiedener bekannter (z. B. IL-6 13 , IL-15 14 , Meteorin-artiger 15 , Exosomen 16 , 17 ) und anderer unbekannter biochemischer Faktoren zurückzuführen ist, die in den systemischen Kreislauf freigesetzt werden . Darüber hinaus ist das biochemische Nachjoch-Milieu mit übung reaktionsfähigen Hormonen angereichert, deren Freisetzung durch sympathische Nervensystemstimulation von Sekretionsdrüsen stimuliert wird ( zB Cortisol und Katecholamine aus der Nebenniere 18 und Wachstumshormon aus der anterioren Hypophyse) ). Allerdings ist es unmöglich, die Auswirkungen des mechanischen Stimulus der Übung von ausübung-induzierten biochemischen Veränderungen zu unterscheiden. Während einige Studien den erwarteten Anstieg von bestimmten zirkulierenden Hormonen und Zytokinen als Reaktion auf Übungen charakterisiert habenE wie oben erwähnt, gibt es zu viele Faktoren, sowohl bekannt als auch unbekannt, um in vitro genau zu rekapitulieren . Das heißt, die Isolierung einiger Faktoren für eine In-vitro- Studie adressiert die Komplexität der biochemischen Antwort unzureichend. In dieser Studie haben wir untersucht, wie sich Veränderungen im serumbiochemischen Milieu, angetrieben durch Übung, auf die entwickelte Ligamentfunktion auswirken. Um die Effekte der biochemischen Veränderungen zu isolieren, erhielten wir Serum von menschlichen Teilnehmern vor und nach einem Kampf der Resistenz-Übung und verwendeten es behandeln 3D-konstruierte Bänder, die mit menschlichen vorderen Kreuzbandlibament (ACL) Fibroblasten gebildet wurden. Mit diesem Modell können wir funktionale Daten erhalten, einschließlich Auswirkungen auf die mechanischen Eigenschaften und den Kollagengehalt sowie die quantitativen Effekte auf die molekulare Signalisierung.
Protokoll
Die folgenden Verfahren halten sich an ein Protokoll, das von der Institutional Review Board der University of California, Davis genehmigt wurde; Konsultieren Sie die örtliche Ethikbehörde vor Beginn der Forschung.
1. Primäre Fibroblasten von menschlichen ACL-Resten isolieren
HINWEIS: Sterilität beibehalten und alle Schritte in einem biologischen Sicherheitsschrank (BSC) durchführen.
- Erhalten Sie die Genehmigung von der entsprechenden Ethik-Prüfungsstelle für die Sammlung und Verwendung von menschlichen Geweben, wie unten beschrieben.
- Vorbereitung der 5x Antibiotika / Antimykotika (ABAM) -Lösung durch Verdünnen von 100x Antibiotika / Antimykotika in 1X Phosphat-gepufferter Kochsalzlösung (PBS)
- Collect ACL Gewebe Fragmente in 5X ABAM Lösung in einem 50 ml konischen Rohr, speichern bei 4 ° C bis zum Verdauungsschritt. Schneiden Sie das Gewebe in kleinere Fragmente mit einer Rasierklinge, wenn nötig, bis zu einer maximalen Größe von 1 x 1 x 1 cm 3 .
ACHTUNG: Entsprechen die örtlichen BiohazardvorschriftenOrdnungsgemäße Verwendung von Biohazard-Material und Dekontamination und Entsorgung von Biohazard-Abfällen. - Bereiten Sie ein ausreichendes Volumen an Kollagenase-Lösung vor, um die Gewebefragmente zu tauchen. Auflösen von Kollagenase Typ II (1 mg / ml) in hochglukose Dulbecco's modifiziertem Eagle-Medium (DMEM) mit 1x Penicillin / Streptomycin und 20% fötalem Rinderserum (FBS) und filtrieren bei 0,22 μm.
- Spülen Sie ACL-Gewebe 3 mal in PBS.
- Gewebe ausweichen Übertragen Sie das ACL-Gewebe auf ein neues 50 ml konisches Röhrchen und fügen Sie ein ausreichendes Volumen an Collagenase-Lösung hinzu, um das Gewebe zu tauchen. Inkubieren bei 37 ° C über Nacht (~ 17 h).
- Bevor die Verdauungsdauer abgeschlossen ist, bereiten Sie Wachstumsmedien (GM) durch Ergänzung von DMEM-Hochglukosemedien mit 10% FBS und 100 U / ml Penicillin vor.
- 15 min vor Ablauf der Verdauungszeit das Gewebe-haltige 50 mL Röhrchen 3 mal alle 5 min kurz vortexen.
- Mit einer 25 mL serologischen Pipette, triturate das verdaute Gewebe kräftig, um die ti zu brechenSsue weiter und löse Zellen.
- Zentrifuge bei 1.500 xg für 5 min. Saugen Sie den Überstand und resuspend Pellet in 10 ml GM.
- Wiederholen Sie die Schritte 1.8-1.9 drei weitere Male.
- Nach der letzten Zentrifugation das Pellet in 5-10 ml GM resuspendieren. Verwenden Sie eine kleine Probe der Zellsuspension, um eine Zellzahl mit einem Hämocytometer durchzuführen und die Lebensfähigkeit der Zellen mit Trypan Blue zu beurteilen.
- Die Zellsuspension auf 15 cm Gewebekulturplatten mit einer Dichte von 3-4 x 10 5 Zellen pro Platte auftragen.
- Kultur zu 70% Zusammenfluss in einem sterilen Inkubator bei 37 ° C und 5% CO 2 gehalten , die Änderung der GM alle drei Tage. Benutzen oder lagern (siehe unten) Zellen innerhalb von 5 Passagen.
- Gefrierzellen für zukünftige Verwendung.
- Trypsinize Zellen mit 70% Konfluenz wie folgt. Medien einspülen und Zellen mit PBS waschen. Fügen Sie genügend vorgewärmtes (37 ° C) 0,05% Trypsin hinzu, um nur den Boden der Gewebekulturplatten zu bedecken. Legen Sie Platten in den Kultur-InkubAtor für ~ 5 min, bis die Zellen abgelöst sind (überprüfen, dass die Zellen mit einem Lichtmikroskop schweben). Verwenden Sie eine Pipette, um Zellen zu sammeln und in eine Falcon-Röhre zu verzichten.
- Zentrifugieren, um Zellen zu pelletieren und Zellen in DMEM-hochglukosem Medium, enthaltend 20% FBS und 10% Dimethylsulfoxid (DMSO), zu resuspendieren. Aliquot-Zellsuspension in Kryovials und kühlen bei -1 ° C / min für mindestens 24 h ab. Gefrorene Kryovials in flüssigem Stickstoff aufbewahren.
2. Silikonbeschichtete Platten vorbereiten
- 35 mm Gewebekulturplatten vorbereiten: Deckel entfernen und offene Platten auf einer ebenen Fläche auflegen.
- Mischen Sie das Silikon-Elastomer-Kit gemäß den Anweisungen des Herstellers.
- Verwenden Sie eine 10 ml Spritze, um ca. 2 ml pro 35 mm Platte zu verteilen.
- Silikon bei Raumtemperatur für 2-3 Tage aushärten lassen.
3. Brushit-Zement-Anker vorbereiten
- Im Voraus, vorbereiten Silikon-Reverse-Formen mit zylindrischen wirFür die Ankerbildung. Rückwärtsformen können nach den Vorgaben der gewünschten Ankerform und -größe hergestellt werden.
- Bestimmen Sie die gewünschte Höhe und den Durchmesser des Endankers. Dieses Protokoll verwendet eine maßgeschneiderte Form, die aus Basissilikon in einer 35 mm Gewebekulturschale gebildet ist, in der Kunststoffzylinder mit einem Durchmesser von etwa 3,25 mm platziert wurden, was eine endgültige Formhöhe von etwa 6,5 mm ermöglicht. Die Endankerabmessungen sind etwa 3-3,5 mm in der Höhe und etwa 3,4 mm im Durchmesser mit 1,5 mm Stift, der von der Unterseite des Ankers vorsteht.
- Fügen Sie ungehärtetes Silikon zu einer 35 mm Schale hinzu, in der die Form hergestellt wird. Legen Sie Kunststoffzylinder entsprechend ein.
HINWEIS: Die Größe der Kunststoffzylinder bestimmt den Durchmesser der Endanker. Die Platzierung der Kunststoffzylinder und die Menge des verwendeten Silikons können modifiziert werden, um Anker unterschiedlicher Höhe zu erzeugen. Die Dicke zwischen dem Boden der Vertiefungen in der Form und dem Boden der Form selbst wird dWie viel von der Stange aus dem Boden des Ankers herausragen kann, so dass der Anker später sicher in der silikonbeschichteten Schale fixiert werden kann. - Nach dem Aushärten des Silikons entfernen Sie die Plastikzylinder und entfernen Sie die Form aus der 35 mm Schale.
- Vorbereitung einer 3,5 M orthophosphor / 100 mM Zitronensäurelösung. Man löst 0,961 g Zitronensäure in 11,5 ml Orthophosphorsäure. Bringen Sie das Volumen der Lösung bis zu 50 ml mit MilliQ Wasser. Lösung bei Raumtemperatur aufbewahren und vor Licht schützen.
- Vorbereiten von Formen: Legen Sie einen Minutien-Stift in die Mitte jedes zylindrischen Brunnens in den Formen.
- Kombinieren Sie β-Tricalciumphosphat und Orthophosphorsäure / Zitronensäurelösung bei einer Konzentration von 1 g / ml in einem Plastikwägeboot auf Eis.
- Mischen Sie den Zement kräftig mit einem Plastikzellenschaber.
- Triturieren Sie den Zement, um das Mischen und Pipettengemisch in die Form fortzusetzen
- Die gefüllte Form für 1 min bei 2 250 x g zentrifugieren
- Brushit Zementanker auf Raumtemperatur über Nacht einstellen lassen.
- Entfernen Sie Anker aus der Form und ziehen Sie zwei Anker 12 mm auseinander in jede silikonbeschichtete Platte.
- Sterilisierte gepinnte Platten durch Besprühen mit 70% Ethanol, Füllen sowohl der Platten und Deckel, und Platzierung in einem BSC. Nach mindestens 30 min aspirieren und ersetzen Deckel, Lagerung in der BSC bis benötigt.
4. Erhalten Sie menschliches Serum
- Sicherstellen, dass die Genehmigung durch die entsprechende Ethik-Prüfungsausschuss für dieses Protokoll erhalten wurde.
- Sicherstellen, dass eine schriftliche Einverständniserklärung von menschlichen Personen erhalten wurde, um an einer bestimmten Intervention teilzunehmen ( z. B. Übung, Nahrung oder Drogenintervention), die die erwünschten Veränderungen im Serum beeinflussen wird. Hier beschreiben wir die Sammlung in Ruhe und 15 min nach Widerstand Übung.
- Mit einem trainierten Phlebotomisten, erhalten Sie eine ruhende Blutprobe von einem Teilnehmer durch Venenpunktion in einen geeigneten evakuierten Behälter. Sammeln Sie eine nach der Übung Blutprobe 15 min, nachdem die Teilnehmer in das gewünschte Übungsprotokoll eingegangen sind. Wie bereits beschrieben 1 , verwenden Sie das Resistenz-Übungsprotokoll in diesem Experiment, um eine endogene biochemische Antwort zu stimulieren.
- Haben die Teilnehmer fünf Sätze Beinpresse mit einer Minute Ruhe zwischen Sätzen. Als nächstes haben die Teilnehmer eine Reihe von Knie-Erweiterungen und eine Reihe von Oberschenkel Locken nacheinander ohne Ruhe und dann wiederholen Sie die Back-to-Back-Übungen dreimal mit 1 min Rest zwischen Sets.
- Blut zugerissen lassen, bevor man bei 1000 xg für 10 min zentrifugiert. Unter sterilen Bedingungen Transfer von Serum zu sterilen Röhrchen zur zukünftigen medienergänzung (Serum bei 4 ° C gelagert) und biochemische Analyse (ein kleines Aliquot von Serum bei -20 ° C gelagert).
5. Formulierte Bänder
HINWEIS: Im Voraus, erweitern primäre fiBrühe und bereiten silikonbeschichtete Platten mit gepinnten Brushit-Anker vor.
- Berichte vorbereiten:
- Thrombin zubereiten. Rinder-Thrombin bei 200 U / ml in DMEM-Hochglukosemedium auflösen. Bei 0,22 μm filtrieren, aliquotieren und bei -20 ° C aufbewahren.
- Fibrinogen vorbereiten Rinderfibrinogen bei 20 mg / ml in DMEM-Hochglukosemedium auflösen. Inkubieren für 3-4 h in einem 37 ° C Wasserbad, wirbeln alle 30 min, um die Auflösung zu unterstützen. Filter bei 0,22 μm (Mehrfachfilter können benötigt werden), Aliquot und bei -20 ° C lagern.
- Aprotinin vorbereiten. Aprotinin in 10 mg / ml in Wasser auflösen. Bei 0,22 μm filtrieren, aliquotieren und bei -20 ° C aufbewahren.
- Vorbereiten von Aminohexansäure. Die Aminohexansäure mit 0,1 g / ml in Wasser auflösen. Bei 0,22 μm filtrieren, aliquotieren und bei 4 ° C aufbewahren.
- Ascorbinsäure zubereiten Ascorbinsäure in DMEM-Hochglukosemedium bei einer Konzentration von 50 mM auflösen. Bei 0,22 μm filtrieren und bei 4 ° C aufbewahren.
- L-Prolin vorbereiten L-Prolin in PBS bei einer Konzentration von 50 mM auflösen. Bei 0,22 μm filtrieren und bei 4 ° C aufbewahren.
- Vorbereitung des Transformationswachstumsfaktors-β1 (TGF-β1). Rekonstituieren Sie TGF-β1 gemäß den Anweisungen des Herstellers bei einer Konzentration von 10 μg / ml. Aliquot und bei -20 ° C aufbewahren.
- Bestimmen Sie die Anzahl der Konstrukte, die für das Experiment erforderlich sind, und stellen Sie sicher, dass eine ausreichende Anzahl von gepinnten Platten vorbereitet wird. Sowohl biologische als auch technische Replikate werden empfohlen. In der Studie 1 , die hier hervorgehoben wird, verwenden Sie doppelte technische Replikate und 12 biologische Replikate (Serum von 12 Individuen in Ruhe und nach Übung).
HINWEIS: Führen Sie die folgenden Schritte unter sterilen Bedingungen in einem BSC durch. - Erweitern Sie Zellen durch Kultivierung in 15 cm Platten bis 70% Konfluenz. Es werden 2,5 x 10 5 Zellen pro Konstrukt benötigt.
- Trypsinize Zellen und resuspend in GM in einer Konzentration von 3,67 x 105 Zellen / ml.
- Generieren Sie eine Mastermischung für die Anzahl der benötigten Konstrukte: Für 1 Konstrukt enthält die Mastermischung 681 μl Zellsuspension (mit 2,5 x 10 5 Zellen), 29 μl Thrombin, 2 μl Aprotinin und 2 μl Aminohexansäure.
- Nach dem Mischen der Master-Mischung gut 714 μl zu jeder gepinnten Platte in einem "8" -Muster um die Brushit-Zement-Anker. Vergewissern Sie sich, dass die Mastermischung direkt die Seiten der Anker berührt.
- Tippen Sie vorsichtig auf jede Platte, um die Mastermischung gleichmäßig über die Platte zu verteilen.
- Für eine Platte zu einer Zeit, fügen Sie schnell 286 μL Fibrinogen in einer tropfenweise Weise gleichmäßig über eine Platte hinzu und schieben Sie die Platte sofort hin und her und Seite zur Seite über die Oberfläche des BSC, um das Fibrinogen zu verteilen, um die zellgebundenen Fibringele zu bilden . Weiter zum nächsten Teller
- Legen Sie die Konstrukte in einen sterilen Inkubator, der bei 37 ° C und 5% CO 2 gehalten wird, und inkubierenFür mindestens 15 min, um die Polymerisation des Fibrinogens zu ermöglichen.
- Bereiten Sie genügend Futtermittel (FM) für 2 mL pro Konstrukt vor. Nachtrag GM mit 200 μM Ascorbinsäure, 50 μM Prolin und 5 ng / mL TGF-β1.
- Füge 2 mL FM hinzu, um jedes Konstrukt zu decken. Kultur die Konstrukte in einem sterilen Inkubator bei 37 ° C und 5% CO 2 für insgesamt 14 Tage oder auf den gewünschten Endpunkt gehalten, erfrischen die Medien jeden zweiten Tag mit 2 mL FM
6. Tensile Testing Engineered Bänder
HINWEIS: Die Zugversuche wurden mit einem maßgeschneiderten Zugprüfgerät in einem PBS-Bad durchgeführt. Reverse-geformte Griffe, die mit dem Kraftaufnehmer gekoppelt sind, halten Bürsten-Zement-Anker während des Tests an Ort und Stelle.
- Bestimmen Sie die Länge und Breite der Ligamentenkonstrukte mit digitalen Bremssätteln; Berechnen Sie die Querschnittsfläche des Gewebes.
- Das Bänderkonstrukt von der Platte abheben und die Anker in dieUmgekehrt geformte Griffe, um sicherzustellen, dass das Konstrukt in PBS untergetaucht ist.
- Stellen Sie den Abstand zwischen den Griffen ein und stellen Sie die Länge des Konstrukts auf die ursprüngliche Länge ein.
- Beginne den Test: Das Konstrukt mit einem Dehnungsgrad von 0,4 mm / s (oder ~ 3% / s) belasten.
- Nach Beendigung des Tests die Gewebereste auf Kollagengehalt verarbeiten (siehe Abschnitt 7).
- Aus den resultierenden Lastverformungsdaten berechnen Sie Spannungs-Dehnungsdaten und quantifizieren mechanische Eigenschaften von Interesse; Z. B. maximale Zugbelastung, Zugfestigkeit und -modul ( dh elastische Eigenschaft über einen linearen Bereich der Spannungs-Dehnungskurve).
7. Quantifizierung des Kollagengehalts der konstruierten Bänder
- Ausgebaute Bänder aus Brushit-Zementankern entfernen und bei 120 ° C für 25 min trocknen.
- Bestimmen Sie die Trockenmasse von Konstrukten und legen Sie sie in einzelne 1,5 ml Röhrchen. Trockene Konstrukte können bei Raumtemperatur gelagert werdenBis zur weiterverarbeitung
- Zu jedem Konstrukt 200 μL 6 M HCl zugeben. Kochen bei 120 ° C in einem Heizblock für 2 h in einer Abzugshaube.
ACHTUNG: HCl ist stark korrosiv und sauer, der Einsatz von kochsicheren / sicheren Schleusen oder anderen Verfahren zur Sicherung von Rohren wird empfohlen. - Zentrifugieren Sie die Röhrchen kurz, um Flüssigkeit zu sammeln, und lassen Sie sie ungekapselt, um bei 120 ° C in einem Heizblock für 1,5 h in einer Abzugshaube zu verdampfen.
- Das erhaltene Pellet in 200 μl Hydroxyprolinpuffer resuspendieren. Bei -20 ° C aufbewahren bis nötig.
- Hydroxyprolinpuffer vorbereiten In 300 ml Wasser werden 16,6 g Zitronensäure, 4 ml Essigsäure, 11,4 g NaOH gegeben und gerührt, bis es gelöst ist. PH-Wert bis 6-6,5 und bringen Volumen bis zu 500 ml. Füge 250 μl Toluol als Konservierungsmittel hinzu und lag bei 4 ° C vor Licht geschützt.
- Reagenzien vorbereiten
- Vorbereiten von trans-4-Hydroxy-L-prolin. Auflösen in Wasser, um eine 4 mg / ml Lösung zu machen.
- Chloramin-T vorbereiten. Auflösen in Wasser, um eine 14,1 mg / ml Lösung zu machen.
- Aldehyd-Perchlorat zubereiten. 1,5 g 4-Dimethylaminobenzaldehyd in 6 ml 1-Propanol, 2,6 ml Perchlorsäure (ACHTUNG: korrosiv, starkes Oxidationsmittel, geeignete Vorsichtsmaßnahmen) und 0,5 ml Wasser auflösen.
- In einem Satz neuer 1,5 ml Röhrchen eine Probe jedes resuspendierten Pellets in Hydroxyprolinpuffer auf ein Volumen von 200 μl verdünnen.
HINWEIS: Verdünnungen können von 1: 4 bis 1:50 der Probe: Puffer in Abhängigkeit vom erwarteten Kollagengehalt der Probe liegen; Somit kann ein Test- und Fehlerversuch erforderlich sein, um einen Verdünnungsfaktor zu bestimmen, der für den gegebenen Probensatz geeignet ist (dh die Proben in die Mitte der Standardkurve stellen). - Hyxyprolin-Standards vorbereiten. Verdünnen Sie Hydroxyprolin in Hydroxyprolinpuffer (siehe Abschnitt 7.5.1) auf 80 μg / ml. Führen Sie serielle Verdünnungen durch, um 6-8 200 μL Standards zwischen 0-20 μg / ml zu machen.
- Zugabe von 150 μl 14,1 mg /Ml Chloramin T Lösung für jeden Standard und verdünnte Probe. Vortex und inkubieren bei Raumtemperatur für 20 min.
- Füge 150 μl Aldehyd-Perchlorat-Lösung zu jeder Probe und verdünnte Probe hinzu. Vortex und inkubieren in einem Heizblock bei 60 ° C für 15 min. Entsorgen Sie die überschüssige Aldehyd-Perchlorat-Lösung als gefährlichen Abfall nach den örtlichen Vorschriften (enthält Perchlorsäure).
- Lassen Sie Standards und Proben abkühlen, bevor Sie 200 & mgr; l von jedem, in doppelter, in 96-Well-Platten aliquoten.
- Leseplatte bei 550 nm in einem Spektrophotometer. Entsorgen Sie die Platte und das verbleibende Volumen in 1,5 mL Röhrchen als gefährlicher Abfall nach den örtlichen Vorschriften (enthält Perchlorsäure).
- Berechnung der Gesamtkollagen- und Kollagenfraktion
- Umwandlung des Extinktionswertes für jede Probe in Mikrogramm von Hydroxyprolin unter Verwendung der Hydroxyprolin-Standardkurve.
- Multiplizieren Sie jede Vertiefung mit 2,5, um die Menge an Hydroxyprolin zu berechnenDie verdünnte Probe. Es wird darauf hingewiesen, dass nur 200 der 500 & mgr; l Gesamtmischung (200 & mgr; l verdünnte Probe + 150 & mgr; l Chloramin T + 150 & mgr; l AP-Lösung) zu jeder Probenvertiefung gegeben werden.
- Multiplizieren Sie mit dem Verdünnungsfaktor (Abschnitt 7.7), um die Menge an Hydroxyprolin in der ursprünglichen Probe zu berechnen.
- Teilen Sie um 0.137, um die Menge an Kollagen zu berechnen (setzt voraus, dass Kollagen 13,7% Hydroxyprolin 20 enthält ).
ANMERKUNG: Säugetier-Hydroxyprolin-Häufigkeit in Kollagen variiert leicht über Gewebe und Säugetierarten; Z. B. Schweine- und Schaf-Achillessehnen enthalten 13,5 und 13,7% (Hydroxyprolinmasse / Trockengewebsmasse) bzw. 21 . Hier verwenden Sie 13,7%, um Prozent Hydroxyprolin in Kollagen zu schätzen, das verwendet wird, um den Kollagengehalt einer Gewebeprobe unter Verwendung der folgenden Gleichung zu berechnen: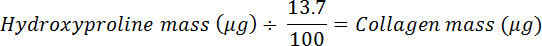
- Teilen Sie die Trockenmasse, um das Kollagen fra zu berechnenUnd in einen Prozentsatz umwandeln.
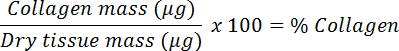
8. Quantifizierung der molekularen Endpunkte
ANMERKUNG: Zusätzlich zu den primären Ergebnissen des Zugversuches und des Kollagengehalts können molekulare Endpunkte auf 2D- oder 3D-Gewebe gemessen werden, um mechanische Einblicke hinzuzufügen. Bioassays können verwendet werden, um molekulare Endpunkte zu bestimmen (siehe nachfolgenden Abschnitt für den Kontext Die Auswirkungen des Nach-Übungs-Serum-Milieus auf die In-vitro- Ligament-Funktion).
- Für 3D-Gewebe:
- Vorbereiten von Konstrukten nach Schritt 5 oben.
- Nach der Konstruktion / Intervention, Snap-Freeze-Konstrukte in flüssigem Stickstoff.
- Mit einem Mörser und Stößel auf Trockeneis gekühlt, Schleifen konstruiert in ein Pulver. Weiter bei Schritt 8.4 / 5).
- Für 2D-Gewebe:
- Kultur menschliche ACL Fibroblasten zum Zusammenfluss in einem MonOlayer in sechs-Well-Platten, die DMEM enthalten.
- Setzen Sie DMEM ein und wenden Sie die Behandlungsmedien nach Ihrer Experimentierstrategie an ( zB Zeitverlauf oder Dosisreaktionsexperimente).
- Medikamente einatmen und Zellen mit PBS waschen.
- Kratzen Sie Zellen, um mit einem geeigneten Extraktionspuffer / Reagenz zu sammeln (siehe weiter).
- Protein-Expressionsanalyse: Verwenden Sie einen Cytosol-Extraktionspuffer ( zB 250 mM Saccharose, 50 mM Tris pH 7,4, 5 mM MgCl2 und Protease / Phosphatase-Inhibitor-Cocktail), um Protein-Lysate zu erhalten. Führen Sie den Protein-Konzentrations-Assay durch und forschen Sie die Analyse nach Standard-Western-Blot-Verfahren fort.
- Genexpressionsanalyse: Isolieren Sie die Gesamt-RNA unter Verwendung von 500 & mgr; l RNA-Isolationsreagenz gemäß den Anweisungen des Herstellers, um qualitativ hochwertige RNA zu erhalten. Führen Sie Reverse-Transkription und Echtzeit-quantitative PCR-Analyse nach Standard-Verfahren.
- DNA-Isolierung: isolieren und quantifizieren gEnomische DNA mit DNA-Isolationsreagenz gemäß den Anweisungen des Herstellers. Quantifizierung der DNA-Konzentration unter Verwendung eines Spektrophotometers zur Messung der Probenabsorption bei 260 nm.
Ergebnisse
Übersicht über die entwickelte Ligamentbildung und experimentelle Intervention
Abbildung 1 zeigt einen Überblick über die Bildung von Konstruktionsbändern. Brushit-Zement wird ein Knochenersatzmaterial 22 durch Kombination einer Orthophosphorsäure / Zitronensäurelösung mit β-Tricalciumphosphat in zylindrischen Vertiefungen hergestellt. Alternativ können, wenn nicht direkt mechanische Funktion der Gewebe gemessen werden, 3-0 Seidennähte als Anker bei der Bildung eines Gewebes verwendet werden. Diese werden in silikonbeschichteten 35-mm-Schalen 12 mm auseinander gehalten und durch Einweichen in 70% Ethanol sterilisiert. Fibroblasten werden aus den vorderen Kreuzbandresten isoliert, die während der ACL-Rekonstruktionsoperation erhalten wurden. Nach der Expansion werden 2,5 x 10 & sup5; Zellen in einem Fibrin-Gel eingekapselt, das in der Brushit-Zement-Anker-gepinnten Schale gebildet wird. Nach der bildung, ligament constrKönnen auf Veränderungen der mechanischen Eigenschaften, des Kollagengehalts, der Zellproliferation, der Genexpression, der Proteinspiegel und der Gewebemorphologie untersucht werden.
Während der Kultur kontrahieren die Zellen das Fibringel und bilden ein lineares Gewebe zwischen den beiden Anker (Abbildung 2A ). Nach 1-2 Tagen in Kultur haben sich die Zellen an das Fibringel gebunden, verlängerte Zellprozesse und begannen, Zugkräfte auszuüben (Abbildung 2B ). Da das Fibringel durch Zugkräfte kontrahiert und durch zelluläre Enzyme zerlegt wird, wird zwischen den beiden Ankerpunkten eine Spannung erzeugt und unsere Zellen parallel zu dieser Achse ausgerichtet ( Abb. 2B ) und beginnen Kollagen zu deponieren. Nach 4-5 Tagen haben sich die Konstrukte um die Anker, die ein lineares zylindrisches Gewebe bilden, zusammengezogen ( Fig. 2A , an diesem Punkt können externe Reize auf das System angewendet werden (IntervEntion zu diesem Zeitpunkt vermeidet die Störung des linearen Gewebebildungsprozesses). Interventionen können die Ergänzung der Kulturmedien mit menschlichem oder tierischem Serum nach einer gegebenen Intervention, exogenen Zytokinen und Wachstumsfaktoren, die mechanische Stimulation oder die Veränderung anderer Umweltfaktoren wie Sauerstoffspannung, umfassen. Unter Verwendung von Wachstumsmedien (DMEM mit 10% FBS und 100 U / ml Penicillin), ergänzt mit 200 & mgr; M Ascorbinsäure, 50 & mgr; M L-Prolin und 5 ng / ml TGF-β1, haben wir festgestellt, dass die Zellproliferation während einer 2-wöchigen Kultur fortgesetzt wird ( Abb. 2C ) und in der Tat zeigt die Lichtmikroskopie ein dichtes Gewebe, das hochgradig ausgerichtete Zellen an 14 Tagen Kultur enthält (Abbildung 2B ).
Bewertung von konstruierten Bändern
Am Ende der Kulturperiode können konstruierte Bänder in einer Varietät beurteilt werdenY von Weisen Ein wesentlicher Vorteil dieses Systems ist die Fähigkeit, funktionelle Veränderungen des Gewebes durch mechanische Tests zu bestimmen, eine wichtige Beurteilung angesichts der mechanischen Rolle des nativen Bandes. Uniaxiale Zugversuche können verwendet werden, um die mechanischen Eigenschaften einschließlich der Last zum Ausfall, der Zugfestigkeit und des Elastizitätsmoduls zu messen. Viskoelastische Eigenschaften können auch mit Spannungsrelaxation und Kriechversuchen gemessen werden. Fig. 3A zeigt ein konstruiertes Ligament, das in umgekehrt geformten Griffen in einem kundenspezifischen uniaxialen Zugprüfgerät gehalten wird. Der rechte Griff ist an einem Kraftaufnehmer angebracht, um die Last über dem Band zu messen, wenn das Gewebe zum Versagen belastet wird. Fig. 3B zeigt eine repräsentative Spannungs-Dehnungs-Kurve für einen Test zum Versagen Nach einer mechanischen Prüfung können dieselben Konstrukte getrocknet und für einen Hydroxyprolin-Assay 23 verarbeitet werden, um den gesamten Kollagengehalt sowie andere Biochs zu beurteilenMische Assays Mit einer ausreichenden Anzahl von zusätzlichen Proben pro Bedingung kann eine gründliche Untersuchung eines experimentellen Eingriffs durchgeführt werden, einschließlich seiner Auswirkungen auf die Zellproliferation, die Gen- und Proteinexpression und die histologische Morphologie. Während 14 Tage ein typischer Endpunkt für unsere Studien sind, verbessern die konstruierten Bänder ihre mechanischen Eigenschaften und ihren Kollagengehalt durch 28 Tage Kultur, wie in Abbildung 3C gezeigt, und kann für mindestens 3 Monate in Kultur 24 überleben.
Spendervariabilität ist ein wichtiger Aspekt für die experimentelle Wiederholbarkeit. Fig. 4 zeigt ein repräsentatives Experiment, das von Lee et al. 25 Vergleich von 7 verschiedenen ACL-Donoren (n = 3 männlich und n = 4 weiblich), die typische Zugeigenschaften und Kollagengehalt nach einer 2-wöchigen Kultur in der zuvor beschriebenen zeigen Ergänzte Wachstumsmedien. Mit Hilfe von Zellen aus ähnlichen ACL-Sammlungen, Alter des Spenders, Zeit nach Verletzung, Geschlecht usw. zeigen die entwickelten Bänder eine geringe Variabilität zwischen Spendern und ähnlichen Eigenschaften zwischen männlichen und weiblichen Spendern mit Ausnahme des Unterschieds in der Kollagenfraktion. In der oben erwähnten Studie wurden konstruierte Bänder als In-vitro- Modell verwendet, um zu untersuchen, warum Frauen ein signifikant größeres Risiko für ACL-Verletzungen haben als Männer und zeigten, dass ACL-Fibroblasten, die von weiblichen Spendern isoliert wurden, nicht inhärent schwächere und weniger kollagene konstruierte Bänder bilden.
Die Auswirkung des Nach-Übungs-Serum-Milieus auf die In-vitro- Ligamentfunktion
Wir haben bisher die Fähigkeit von konstruierten Bändern gezeigt, um physiologische Prozesse 1 ,Ss = "xref"> 25 In dem folgenden repräsentativen Experiment, wie von West et al. 1 , haben wir die biochemischen Effekte der Übung auf die Bandfunktion bestimmt und die Methodik und die Ergebnisse hier hervorgehoben. Wir bildeten konstruierte Bänder mit menschlichen ACL-Zellen und wandten eine Intervention an Tag 7 der Kultur, bestehend aus Kulturmedien, die mit menschlichem Serum konditioniert wurden, vor und nach der Übung. Kurz gesagt, wir rekrutierten gesunde junge männliche Teilnehmer und sammelten Blutproben vor und nach einem akuten Kampf der Resistenz-Übung, die zirkulierende Hormone und Zytokine einschließlich menschliches Wachstumshormon (GH) erhöht. Das menschliche Serum wurde aus Vor- und Nach-Übung-Blutproben isoliert und anstelle von fötalem Rinderserum in den Kulturmedien für die zweite Woche der konstruierten Ligamentenkultur verwendet (Abbildung 5A ). Vor- und Nach-Übungs-Serumproben wurden unter Verwendung von ELISA für Änderungen in GH und insulinähnlichem Wachstumsfaktor 1 (IGF-1) analysiertDeren Konzentration durch Übung verändert werden kann (Abbildung 5B ). Diese Information wurde verwendet, um Serum-Effekte auf die konstruierten Bänder mit Veränderungen im Serum als Reaktion auf Übung zu korrelieren. Nach einer 14-tägigen Kulturperiode wurden die Ligamentenkonstrukte unter Verwendung eines mechanischen Tests und einer Hydroxyprolin-Bestimmung des Kollagengehalts bewertet und zeigten eine signifikante Zunahme sowohl der maximalen Zugbelastung als auch des Kollagengehalts in Reaktion auf das Nachübungsserum. Um zu beurteilen, ob dieser Effekt mit Übungs-induzierten Freisetzungen von GH oder IGF-1 zusammenhängt, wurden in einem separaten Experiment konstruierte Bänder gebildet und mit einer Dosisantwort von entweder humanem rekombinantem GH oder IGF-1 behandelt. Interessanterweise erhöhte die fortschreitende rekombinante GH-Konzentration im Kulturmedium, während das Serum GH im Blut zunahm (Abbildung 5B- i), den Kollagengehalt (Abbildung 5D- i) oder mechanisch nichtEigenschaften (Daten nicht gezeigt) in konstruierten Bändern. Im Gegensatz dazu zeigten die Serum-IGF-1-Spiegel nach dem Training nicht, aber ein Dosis-Wirkungs-Experiment zeigte, dass die Erhöhung der Konzentrationen in den Kulturmedien den Kollagengehalt von Ligamentenkonstrukten verbesserte (Abbildung 4D- ii). Während also die Ausübung zu einer robusten Zunahme des Nachbehandlungs-GH führte, erweckt das Dosis-Response-Experiment mit rhGH Zweifel daran, ob GH direkt für die phänotypische Verstärkung der konstruierten Bänder verantwortlich ist (zumindest die 22 kDa-Isoform allein nicht Scheinen verantwortlich zu sein). Umgekehrt, während Serum IGF-1 nicht bei 15 min nach der Übung verändert wurde, zeigte das RHIGF-1 über ein breites Spektrum von Konzentrationen, dass IGF-1 in der Lage ist, den Kollagengehalt zu verbessern; Es sollte jedoch beachtet werden, dass die Erhöhung der rhIGF-1-Konzentrationen durch einen Bereich, der die physiologischen Konzentrationen schätzte, den Kollagengehalt nicht signifikant erhöhte. So ist das einzigartige Post-Trainings-Serum enviroWar wichtig für die Verbesserung der Mechanik und des Kollagens von konstruierten Bändern.
In der hier betrachteten Studie war das Volumen des experimentellen Serums aufgrund ethischer Erwägungen begrenzt; So wurden kurzfristige 2D-Bioassays, die niedrigere Serumanforderungen hatten, verwendet, um die molekularen Mechanismen, die für die beobachtete Zunahme des Kollagens verantwortlich waren, weiter zu untersuchen. ACL-Fibroblasten wurden bis zur Konfluenz in 6-Well-Platten kultiviert und für 1 Stunde mit Ruhe- oder Nachübungsserum behandelt und mit Dosisreaktionen von rekombinantem GH, IGF-1, TGF-β1 und der Aktivierung von Targets im PI3K / mTORC1 verglichen , ERK1 / 2 und Smad-Signalwege bestimmt. In Gegenwart von Post-Trainings-Serum zeigte der PI3K / mTORC1- und ERK1 / 2-Weg eine stärkere Aktivierung, wie durch Phosphorylierung von S6K (Abbildung 5D- i) bzw. ERK1 / 2 (Abbildung 5D- ii) beurteilt.Im Vergleich zu den Hormon- und Zytokin-Dosisreaktionen, während GH einen kleinen positiven Effekt auf die mTOR-Signalisierung hatte (Abbildung 5D- i) und IGF-1 zeigten eine positive Wirkung bei der niedrigsten Dosis, die drei Behandlungen von GH, IGF-1 und TGF -β1 nicht für den Anstieg der PI3K / mTORC1- und ERK1 / 2-Signalisierung verantwortlich war. Zusammenfassend lässt sich sagen, dass unser 3D-konstruiertes Ligamentmodell und 2D-Bioassay-Daten darauf hindeuten, dass die Post-Trainings-Serum-Umgebung durch die Aktivierung der PI3K / mTORC1- und ERK1 / 2-Wege in der Lage ist, die Ligamentfunktion und den Kollagengehalt zu verbessern.
Zusammenfassend lässt sich feststellen, dass man ein konstruktives Ligamentmodell mit ausübungsbedingtem Serum kombiniert hat. Wir konnten die Wirkung der Post-Trainings-Serumumgebung auf die konstruierte Ligamentfunktion und das Kollagen untersuchen, ii) die Veränderungen des Ligament-Phänotyps mit Veränderungen der Serum-Hormon-Konzentration korrelieren, Mit dem Ziel zu bestimmen, welche Veränderungen im Serum zu chang geführt habenEs in konstruierten Bändern und iii) weiter den Umfang der Arbeit unter Verwendung von 2D-Bioassays, um molekulare Ziele des serumbiochemischen Milieus zu untersuchen, um molekulare Mechanismen zu bestimmen, die durch Nachübungsserum aktiviert werden, die zu Verbesserungen der Ligamentfunktion führen.
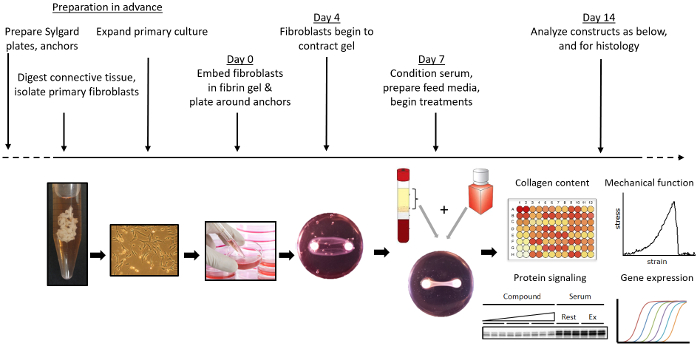
Abbildung 1: Überblick über die Entstehung und Verwendung von konstruierten Bändern. Brushit-Zementanker werden in silikonbeschichtete Platten gefertigt und fixiert. Primäre Fibroblasten werden isoliert und aus ACL-Resten erweitert. Konstruktive Bänder werden durch Einkapselung von Fibroblasten in einem Fibringel um zwei Brushit-Zementanker gebildet. Konstruktive Bänder werden kultiviert und mit jeglichem spezifischen chemischen oder mechanischen ( zB über einen Bioreaktor) stimuliert. Am gewünschten Endpunkt können konstruierte Bänder gesammelt und für Mechanica beurteilt werdenL Eigenschaften, Genexpression, Kollagengehalt, Proteinexpression und Histologie. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
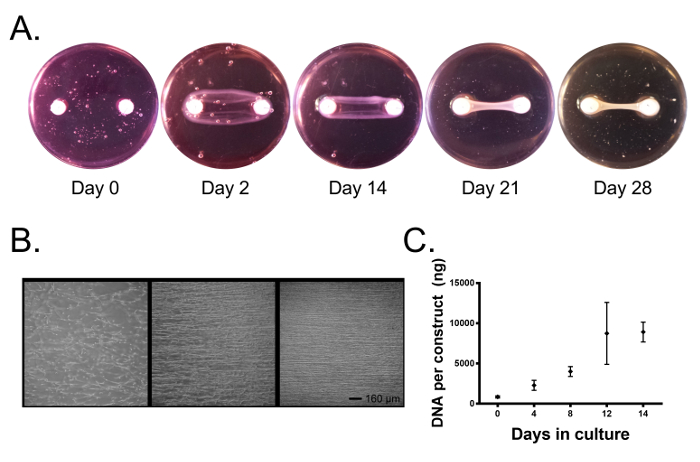
Abbildung 2. Primäre Ligamentfibroblasten bilden ein Fibrin-basiertes Knochen-zu-Knochen-konstruiertes Band, das zwei Brushit-Zement-Anker umfasst. ( A ) Im Laufe der Zeit verteilen die Fibroblasten das Fibringel um die Brushit-Zement-Anker, die ein lineares Gewebe bilden. ( B ) In den ersten drei Tagen hängen die Zellen an das Fibringel an und üben Zugkräfte aus, wobei die Zellen mit der langen Achse des Konstruktes ausgerichtet werden. Über 14 Tage bilden die Zellen ein hoch ausgerichtetes Gewebe. Maßstab = 160 μm. ( C ) Der DNA-Gehalt der konstruierten Bänder nimmt weiter zu oVer 14 Tage in der Kultur, während sich die Zellen vermehren. Die Daten werden als Mittelwert ± SD mit n = 3-4 Konstrukten pro Gruppe dargestellt. Gruppen Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
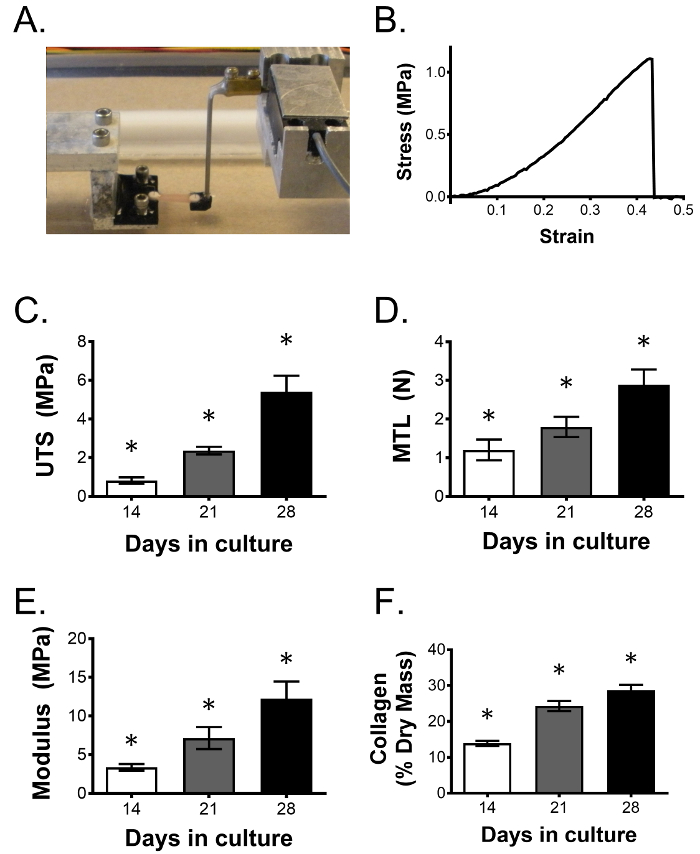
Abbildung 3: Mechanische Eigenschaften des gewogenen Bands und der Kollagengehalt verbessern sich im Laufe der Zeit. ( A ) Ligamentenkonstrukte sind uniaxial spannungsgeprüft, um die Wirkung eines gegebenen Eingriffs auf die Ligamentfunktion zu bestimmen. Wie gezeigt, halten zwei umgekehrt geformte, 3D-bedruckte Griffe wechselseitig geformte Anker, die von der konstruierten Sünde überbrückt werden. Anker sind mit einem Schrittmotor und einem Kraftaufnehmer gekoppelt, um Spannungs- / Dehnungskurven des getesteten Gewebes zu erzeugen, wodurch mechanische Eigenschaften bestimmt werden können. ( B </ Strong>) Repräsentative Spannungs-Dehnungs-Kurve von einem konstruierten Band, das zum Versagen gespannt ist. Im Laufe von 28 Tagen, ( C ) Endzugfestigkeit (UTS), ( D ) maximale Zugbelastung (MTL), ( E ) Elastizitätsmodul und ( F ) Kollagenfraktion weiter zu verbessern. Die Daten werden als Mittelwert ± SD mit n = 5 Konstrukten pro Gruppe dargestellt. * Zeigt signifikanten Unterschied zu allen anderen Gruppen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
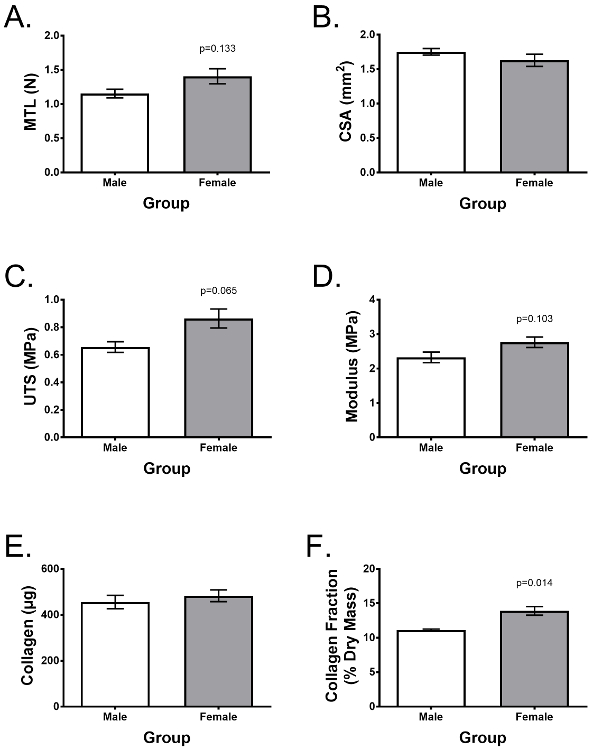
Abbildung 4: Konstruktive Bänder können auf Funktionalität und biochemischen Inhalt beurteilt werden und zeigen eine niedrige Donorvariabilität. Ausgearbeitete Bänder wurden 7 verschiedene Spender gebildet (n = 3 männlich, n = 4 weiblich). Nach 2 Wochen o( C ) Elastizitätsmodul, ( D ) Querschnittsfläche (CSA), ( E ) Gesamtkollagengehalt pro, Konstruieren und ( F ) Kollagen als Bruchteil der trockenen Masse. Die Daten werden als Mittelwert ± SD dargestellt und die statistische Signifikanz wurde mit dem t-Test von Student * Zeigt einen signifikanten Unterschied zu anderen Gruppen (p <0,05). Abbildung von Lee et al. 25 Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
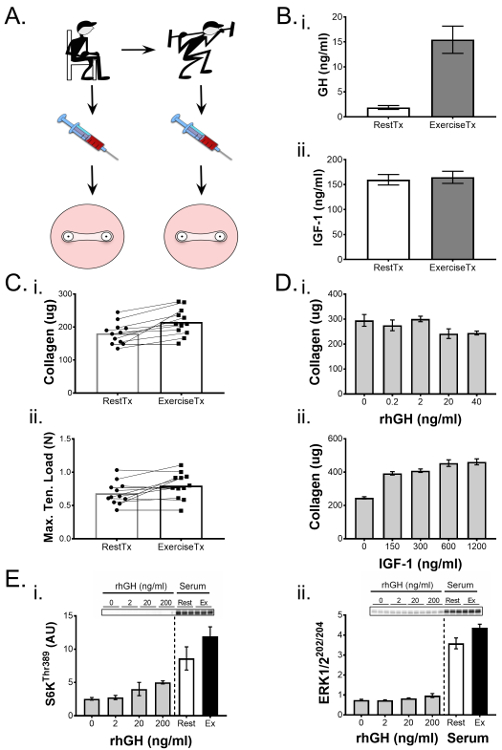
Abbildung 5. Konstruktive Bänder zeigen mechanische und biochemische Veränderungen in Reaktion auf BioloGrafische Interventionen. ( A ) Serum wurde aus Blutspuren isoliert, die von den Probanden vor- (RestTx) und nach der Übung (ExTx) gesammelt wurden und zur Behandlung von Konstruktionsbändern während der zweiten Kulturwoche verwendet wurden. ( B ) (i) Das menschliche Wachstumshormon (GH) und (ii) Insulin-ähnliche Wachstumsfaktor (IGF) -1-Spiegel im Rest- und Übungsserum wurden durch ELISA quantifiziert. ( C ) Konstruierte Bänder, die mit ExTx behandelt wurden, zeigten einen verbesserten (i) Kollagengehalt und (ii) maximale Zugbelastung. Die statistische Signifikanz der gepaarten Vergleiche (RestTx und ExTx) wurde durch einen t-Test mit einem auf p <0,05 eingestellten Signifikanzniveau analysiert. ( D ) Eine Dosis-Antwort von (i) GH und (ii) IGF-1 wurde verwendet, um mögliche Beiträge dieser Faktoren auf die Veränderungen des Kollagengehalts durch ExTx zu bestimmen. E) 2D-Bioassays wurden verwendet, um die Effekte von zunehmenden Dosen von GH, RestTx und ExTx auf molekulare Signalisierungsziele wie die Phosphorylierung von (i) S6K Thr38 zu vergleichen9 und (ii) ERK1 / 2 Thr202 / Tyr204 . Der statistische Vergleich von mehr als zwei experimentellen Gruppen erfolgte mit ANOVA und Tukey's HSD. Die Daten werden als Mittelwert ± SD dargestellt. * Zeigt einen signifikanten Unterschied zur Kontrolle an (p <0,05) und § zeigt einen signifikanten Unterschied von 150 ng / mL und 300 ng / mL IGF-1 an. Abbildung von West et al. 1 Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
Diskussion
Das vorliegende Manuskript beschreibt ein Modell des Bandgewebes, das eine nützliche experimentelle Plattform für Forscher mit einem breiten Spektrum von Forschungsthemen ist, von der Gewebeentwicklung bis hin zu translationalen / klinischen Fragen. Das hier beschriebene Konstruktionsband basiert auf einem vielseitigen Protokoll, das an verschiedenen Stellen während des gesamten Workflows angepasst werden kann ( Abbildung 1 und Diskussionsteil ). Weiterhin kann die inhärent reduktionistische Natur der in vitro Umgebung dem physiologischen Bereich durch Ergänzung von Futtermittelmedien mit konditioniertem menschlichem oder tierischem Serum näher gebracht werden.
Konstrukte können mit Fibroblasten aus einer Vielzahl von Quellen gebildet werden
Während die hier gezeigten Methodik- und Repräsentativresultate auf der Verwendung von primären ACL-Fibroblasten basieren, kann das Zellisolationsprotokoll angepasst werden, um andere Arten von primären Fibroblasten zu sammeln. Wie beschriebenIn Fig. 4 zeigen die mit den primären Zellen, die von jungen menschlichen Spendern isoliert wurden, gebildeten Liganden eine niedrige Donorvariabilität. Primärzellen sind durch anfängliche Isolations- und Durchgangsbeschränkung begrenzt; Die Verwendung von Zelllinien kann die Reproduzierbarkeit von Experimenten verbessern. Die Verwendung anderer Zelltypen kann Modifikationen in Zellkulturmedien und Fibringelformulierungen erfordern. Zum Beispiel haben wir beobachtet, dass menschliche mesenchymale Stammzellen (MSCs) nicht in der Lage sind, lineare Gewebe zwischen den Brushit-Zement-Anker im Laufe von 2 Wochen zu bilden, während equine überlegene digitale Flexor Sehnenfibroblasten, pferdeartige Knochenmark-Stromazellen, Küken embryonale Sehnenfibroblasten , Und murine C3H10T1 / 2 MSCs schnell zusammenziehen und verdauen das Fibrin Gel zu einem linearen Gewebe (unveröffentlichte Beobachtungen) zu bilden. Dieser Kontrast kann eine Folge von Unterschieden in der Zellkontraktilität, Proliferation und fibrinolytischen Enzymproduktion sein.
Anwendung von ChemikalienUnd mechanische Stimulation
Bei dem hier beschriebenen Verfahren bildet sich Fibrin-basiertes Gewebe um Brushit-Zement-Anker herum, was die Anwendung der mechanischen Stimulation über einen Streck-Bioreaktor 11 sowie für die Endpunkt-Zugversuche ermöglicht. Die Anwesenheit von Brushit-Zement-Weichgewebe-Grenzfläche (Enthesis) bietet auch eine Gelegenheit für weitere Untersuchungen und Verbesserungen 22 , 26 (siehe Abschnitt Klinische Anwendungen unten). In diesem in vitro- Umfeld kann der Beitrag der chemischen und mechanischen Faktoren leichter identifiziert werden; Ein Beispiel dafür ist in Fig. 5 gezeigt , wobei die Wirkung der Nach-Übungs-Serumumgebung von den mechanischen Stimuli der Übung getrennt wurde. Pilotstudien können erforderlich sein, um den Zeitrahmen der experimentellen Interventionen, die Zusammensetzung der Behandlungen und die entsprechenden Endpunkte zu bestimmen, um eine beobachtbare Veränderung zu erwarten. FoR Beispiel, in der Nach-Übungs-Serum-Studie 1 , wurde die Länge der experimentellen Behandlung durch die Bereitstellung von Serum zur Ergänzung von Medien, von denen Konstrukte wurden jeden zweiten Tag gezwungen wurde eingeschränkt. Weiterhin wurde während der zweiten Kulturwoche Kulturmedien mit Rest- oder Nachübungsserum mit Ascorbinsäure und L-Prolin ergänzt, während TGF-β1 entfernt wurde. TGF-β1 ist ein bekannter pro-fibrotischer Wachstumsfaktor, der nach dem Training 27 im Serum zunimmt. Um diese TGF-β1-bezogenen Effekte des Nach-Übungs-Serums zu verdecken, wurde dieses Cytokin daher nicht in den Kulturmedien aufrechterhalten.
Dieses konstruierte Ligamentmodell kann auch verwendet werden, um den Effekt der mechanischen Dehnung zu testen. Durch die Konstruktion von umgekehrt modellierten Griffen, um die Brushit-Zement-Ankerenden zu halten (ähnlich dem in Fig. 1 dargestellten uniaxialen Zugprüfgerät), können Streckbioreaktoren entworfen werden, um eng aufzunehmen Ineered bänder Unser Labor hat dieses Modell bisher verwendet, um die molekulare Signalisierungsreaktion von konstruierten Bändern auf eine uniaxiale Zugdehnung in einem maßgeschneiderten Bioreaktor 11 zu untersuchen, der ein besseres Verständnis für die rationale Gestaltung eines in vitro -Streckparadigmas oder sogar potentiell in vivo bietet Stretch / Aktivität / therapeutische Anwendungen.
Bewertung von konstruierten Bändern
Wie bei der traditionellen Monolayer-Kultur können 3D-Konstrukte für die Gen / Protein-Expression untersucht werden. Darüber hinaus bietet ihre 3D-Morphologie auch die Möglichkeit, funktionale und morphologische Veränderungen zu beurteilen und Konstrukte können in Kultur für Langzeitstudien gehalten werden (Abbildung 3 ). Während konstruierte Bänder nicht gleichbedeutend mit einheimischen, reifen Bändern sind, haben sie Ähnlichkeit mit der Entwicklung von Sehnen / Bändern und verhalten sich ähnlich wie natives Gewebe als Reaktion auf Nährstoffe"> 26, Wachstumsfaktoren 10 , Hormone 25 und Übung 11 , 28. Während die Vorsicht vor einer breiten Verallgemeinerung aus jedem in vitro- Modell gerechtfertigt ist, können die Ergebnisse der Ligamentenkonstruktionstests einen bestimmten physiologischen Mechanismus aufdecken oder informieren, der sonst sein könnte Unmöglich in vivo zu untersuchen .
Ergänzen Sie Feedmedien mit konditioniertem Serum für ein flexibles und dynamisches Modell mit breiten Anwendungen
Das menschliche Serummetabolom ist ein Milieu von ~ 4.500 Verbindungen, einschließlich, aber nicht beschränkt auf Glykoproteine, Lipoproteine, Lipidderivate, Energiesubstrate, Metabolite, Vitamine, Enzyme, Hormone, Neurotransmitter und eine Fülle von Bausteinen / Zwischenprodukten. 29 Eine weitere Inspektion des menschlichen Serummetaboloms nach den Compoundklassen 29 zeigt,Vorteile der Integration von experimentellem Serum in in vitro Experimente. Das heißt, die Mehrheit der ~ 4500-Verbindungen im Serum ist hydrophob oder lipid-abgeleitet und unterstreicht die Bedeutung der Bindung von Proteinen für den Transport / die Solubilisierung. Daraus folgt, dass die experimentelle Rekapitulation der endogenen Verbundtransportdynamik und damit der Bioverfügbarkeit und der Compound-Ziel-Wechselwirkungen nahezu unmöglich wäre. So ist das experimentelle Serum besonders wirksam für die Untersuchung von Verbindungen, von denen bekannt ist, dass sie von den Zusatzmolekülen für die Solubilisierung, den Transport, die Zielbindung und den Wirkmechanismus abhängen.
Unser Labor hat ein langjähriges Interesse an den gesundheitlichen Vorteilen der Übung. Übung verbessert die Zell- und Organfunktion in einer Vielzahl von Geweben im ganzen Körper 12 , was auf eine Vielzahl von Faktoren zurückzuführen ist (z. B. IL-6 13 , IL-15 14 , Meteorin-like 15 ,Exosomen 16 , 17 ), die in den systemischen Kreislauf freigesetzt werden. Das biochemische Milieu nach der Übung spiegelt die Faktoren wider, die sowohl von der Verabreichung von Skelettmuskel-Übungsempfindlichen Hormonen als auch von Faktoren, die als Ergebnis der sympathischen Nervensystemstimulation von Sekretionsdrüsen freigesetzt werden ( z. B. Cortisol und Katecholamine aus der Nebenniere 18 und Wachstum, freigesetzt werden Hormon aus der anterioren Hypophyse 19 ). Wir haben vor kurzem ein Modell des Pre- und Post-Trainings-Serums verwendet, um die Effekte des ausübung-induzierten biochemischen Milieus auf Gewebe zu untersuchen. 1 Während zahlreiche wichtige Übungsfragen bestehen bleiben, ist das Modell auf diese Weise keineswegs eingeschränkt. Beispielsweise könnte das Serum entweder aus tierischen oder menschlichen Quellen nach diätetischen oder pharmakologischen Interventionen oder aus verschiedenen Altersgruppen oder klinischen Populationen gewonnen werdenS 30 Auf diese Weise werden exogene oder endogene Verbindungen von Interesse in den Serum- und Behandlungsmedien in bioverfügbaren Mengen vorhanden sein und mit dem Zielgewebe zusammen mit dem endogenen Milieu ( dh in einem physiologischeren Kontext) interagieren. Dieser Ansatz ist dynamisch, da es höchstwahrscheinlich ist, dass eine gegebene Intervention einen Multiorgan (und Multi-Compound) -Effekt ausübt und somit das physiologische Milieu co-modifiziert wird. Während dieser Ansatz gewisse Herausforderungen stellt, da mehrere systemische biochemische Variablen gleichzeitig verändert werden, ist es ein Ansatz, der dazu beitragen kann, Nachteile einer rein reduktionistischen experimentellen Methodik zu überwinden 31 , 32 . Zusammenfassend kann die Implementierung von konditioniertem Serum zusammen mit einem gewebetechnischen ( in vitro biomimetischen ) Gewebe als Werkzeug für Physiologie, Ernährung und klinische Forschungsfragen verwendet werden.
Klinische Anwendungen sind zahlreich
Das hier vorgestellte Tissue Engineering-Modell kann verwendet werden, um anatomische und klinische Forschungsfragen zu untersuchen, die traditionelle In-vitro- Modelle nicht können. Ein Ligament oder Sehne in vivo enthält eine weiche bis harte Gewebeübergangsregion, die die Enthesis genannt wird. Die auf die mechanische Belastungsverletzung 33 anfällige Enthesis kann im Querschnitt über histochemische und Elektronenmikroskopietechniken 22 , 26 untersucht werden . Diese einzigartige Schnittstelle ist für diejenigen mit geringer oder eingeschränkter Beweglichkeit doppelt wichtig, da die physikalische Inaktivität die Fähigkeit des Bindegewebes beeinträchtigt, die Belastung in Regionen mit niedriger bis hoher Compliance 34 zu übertragen, was letztlich zu einer Gesamtabnahme der Gewebe-Compliance und einem erhöhten Verletzungsrisiko führt.
Unser Labor hat vor kurzem dieses Tissue Engineering Modell 25 verwendet/ Sup>, um eine andere Population zu modellieren, weibliche Athleten, die für Bindegewebsverletzungen gefährdet sind: Die Inzidenz von ACL-Verletzungen ist etwa fünfmal größer als ihre männlichen Pendants 35 . Potenzielle Mechanismen, die diese sexbasierte Disparität bei der Verletzung untermauern, wurden untersucht, indem sie Ligamentenkonstrukte mit physiologischen Konzentrationen des weiblichen Sexualhormons, Östrogen, in Konzentrationen behandelt wurden, die die Stadien des Menstruationszyklus nachahmen. Interessanterweise hemmten hohe Östrogenkonzentrationen die Genexpression und -aktivität der Lysoloxidase, das primäre Enzym, das für die Bildung von Lysin-Lysin-Quervernetzungen in der Kollagenmatrix von Bändern und Sehnen verantwortlich ist. Wichtig ist, dass 48 h des hohen Östrogens (um die Follikelphase zu simulieren) die Ligamentenkonstruktionssteifigkeit verringert, ohne die Kollagendichte der Konstrukte zu verändern. Aus physiologischer Perspektive deutet dies darauf hin, dass die Zunahme der Ligament-Laxheit bei Frauen zumindest teilweise zurückgehen kannVernetzungsbildung. Aus einer experimentellen Perspektive heben diese Erkenntnisse 25 den Nutzen des 3D-Konstruktmodells hervor, das eine funktionale Vernetzungsaktivität untersucht hat. Aus klinischer Perspektive kann dieses Modell nun verwendet werden, um schnell Interventionen zu screenen, die die negativen Effekte von Östrogen der Ligamentfunktion verhindern können.
Schlußbemerkungen
Hier haben wir eine detaillierte Methodik für die Bildung von konstruierten Bändern und deren Nutzen als 3D- In-vitro- Gewebemodell vorgestellt. Das Modell ist sehr anpassungsfähig für eine breite Palette von Zielen, die Flexibilität in der Zell-Typ, Interventionen und Ergebnis Maßnahmen von Interesse. Die Ergänzung von Futtermedien mit konditioniertem Serum fügt einen physiologischen Kontext hinzu, der in einer traditionellen in vitro Umgebung nicht erreicht werden kann, wodurch die Modellierung der in vivo Physiologie verbessert wird. Kurz gesagt, wir glauben, dass dies ein breit anwendbarer Modus istL mit spannenden Implikationen für die Förderung der Bereiche Physiologie und Tissue Engineering.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde von einem NSERC Postdoktorandenstipendium (DWDW), einem ARCS Foundation Stipendium (AL) und einem UC Davis College of Biological Sciences Grant (KB) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Austerlitz Insect pins, minutien stainless steel, size 0.20 | Entomoravia | N/A | For brushite cement anchors |
| β-tricalcium phosphate | Plasma Biotal Ltd (Derbyshire, UK) | N/A | For brushite cement anchors |
| o-phosphoric acid, 85% (w/w) | EMD Millipore | PX0995 | For brushite cement anchors |
| Citric acid | Sigma-Aldrich | 251275-500g | For brushite cement anchors |
| Falcon 35 mm tissue culture dishes | Fisher Scientific | 08-772A | For silicone-coated plates |
| Sylgard 184 silicone elastomer kit | Ellsworth Adhesives | 4019862 | For silicone-coated plates |
| 1x Phosphate-buffered saline (PBS) | Fisher Scientific | SH3002802 | For cell isolation and expansion |
| 100x antibiotic/antimycotic solution | VWR | 45000-616 | For cell isolation |
| Type II collagenase | Thermo Fisher Scientific | 17101015 | For cell isolation |
| 100x penicillin/streptomycin solution | Thermo Fisher Scientific | 15140122 | For cell isolation |
| Steriflip-GP, 0.22 µm pore, polyethersulfone, gamma irradiated | EMD Millipore | SCGP00525 | For reagent sterilization |
| DMEM high glucose with sodium pyruvate and L-glutamine | VWR | 10-013-CV | For cell and tissue culture |
| Fetal bovine serum | BioSera | FBS2000 | Component of tissue digestion media and growth media |
| Penicillin G Potassium Salt | MP Biomedicals | 0219453680 - 100 MU | Component of growth media. Dissolve in water to 100,000 U/mL, filter sterilize, aliquot, and store at -20°C. |
| CELLSTAR polystyrene tissue culture dishes (145 mm x 20 mm) | VWR | 82050-598 | For cell culture |
| Trypan blue | Thermo Fisher Scientific | T10282 | For cell isolation |
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200056 | For cell culture. Dilute to 0.05% in PBS |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | For cell freezing media |
| Nalgene Mr. Frosty Cryogenic Freezing Container | Thermo Fisher Scientific | 5100-0001 | For cell freezing |
| BD Vacutainer Red Plastic 10 mL | Fisher Scientific | 367820 | For human serum collection |
| Bound Tree Insyte Autoguard IV Catheters, 22 G x 1 inch Needle | Fisher Scientific | 354221 | For human serum collection |
| Thrombin, bovine origin | Sigma-Aldrich | T4648-1KU | For engineered ligament formation. Dissolve at 200 U/mL in DMEM high glucose media. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| Fibrinogen, bovine origin | Sigma-Aldrich | F8630-5G | For engineered ligament formation. Dissolve at 20 mg/mL in DMEM high glucose media. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| Aprotinin from bovine lung | Sigma-Aldrich | A3428 | For engineered ligament formation. Dissolve at 10 mg/mL in water. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| 6-Aminohexanoic acid | Sigma-Aldrich | 07260-100g | For engineered ligament formation. Dissolve at 0.1g/mL in water. Filter at 0.22 μm, aliquot, and store at 4 °C. |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | Component of feed media. Dissolve in DMEM high glucose media at a concentration of 50 mM. Filter at 0.22 μm and store at 4 °C. |
| L-proline | Sigma-Aldrich | P5607-25G | Component of feed media. Dissolve in PBS at a concentration of 50 mM. Filter at 0.22 μm and store at 4 °C. |
| Transforming growth factor-β1 | Peprotech | 100-21 | Component of feed media. Reconsistute according to manufacturer's instructions at a concentration of 10 μg/mL. Aliquot and store at -20 °C. |
| Stericup-GP, 0.22 µm, polyethersulfone, 250 mL, radio-sterilized | EMD Millipore | SCGPU02RE | For reagent sterilization |
| Hydrochloric acid | Fisher Scientific | A144-212 | Dilute in water to 6 M |
| 4-Dimethylaminobenzaldehyde | Sigma-Aldrich | 39070-50g | For hydroxyproline assay |
| Chloramine-T trihydrate | Sigma-Aldrich | 402869-100g | For hydroxyproline assay |
| trans-4-Hydroxy-L-proline | Sigma-Aldrich | H54409-100g | For hydroxyproline assay |
| 1-propanol | Sigma-Aldrich | 279544-1L | For hydroxyproline assay |
| Perchloric acid | Sigma-Aldrich | 311421-250ml | For hydroxyproline assay |
| Acetic acid, glacial | EMD Millipore | AX0073-9 | For hydroxyproline assay |
| Sodium hydroxide | Fisher Scientific | S318-500 | For hydroxyproline assay |
| Toluene, anhydrous | Sigma-Aldrich | 244511-1L | For hydroxyproline assay |
| Corning Costar Clear Polystyrene 96-Well Plates | Fisher Scientific | 07-200-656 | For hydroxyproline assay |
Referenzen
- West, D. W., et al. The exercise-induced biochemical milieu enhances collagen content and tensile strength of engineered ligaments. J Physiol. 593 (20), 4665-4675 (2015).
- Booth, F. W., Laye, M. J. Lack of adequate appreciation of physical exercise's complexities can pre-empt appropriate design and interpretation in scientific discovery. J Physiol. 587 (Pt 23), 5527-5539 (2009).
- Booth, F. W., Hargreaves, M. Understanding multi-organ pathology from insufficient exercise. J Appl Physiol (1985). 111 (4), 1199-1200 (2011).
- Shearn, J. T., et al. Tendon tissue engineering: progress, challenges, and translation to the clinic. J Musculoskelet Neuronal Interact. 11 (2), 163-173 (2011).
- Liu, C. F., et al. What we should know before using tissue engineering techniques to repair injured tendons: a developmental biology perspective. Tissue Eng Part B Rev. 17 (3), 165-176 (2011).
- Vunjak-Novakovic, G., Altman, G., Horan, R., Kaplan, D. L. Tissue engineering of ligaments. Annu Rev Biomed Eng. 6, 131-156 (2004).
- Bayer, M. L., et al. The initiation of embryonic-like collagen fibrillogenesis by adult human tendon fibroblasts when cultured under tension. Biomaterials. 31 (18), 4889-4897 (2010).
- Guerquin, M. J., et al. Transcription factor EGR1 directs tendon differentiation and promotes tendon repair. J Clin Invest. 123 (8), 3564-3576 (2013).
- Ma, J., et al. Three-dimensional engineered bone-ligament-bone constructs for anterior cruciate ligament replacement. Tissue Eng Part A. 18 (1-2), 103-116 (2012).
- Hagerty, P., et al. The effect of growth factors on both collagen synthesis and tensile strength of engineered human ligaments. Biomaterials. 33 (27), 6355-6361 (2012).
- Paxton, J. Z., Hagerty, P., Andrick, J. J., Baar, K. Optimizing an intermittent stretch paradigm using ERK1/2 phosphorylation results in increased collagen synthesis in engineered ligaments. Tissue Eng Part A. 18 (3-4), 277-284 (2012).
- Safdar, A., et al. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc Natl Acad Sci U S A. 108 (10), 4135-4140 (2011).
- Pedersen, B. K., Febbraio, M. A. Muscles, exercise and obesity: skeletal muscle as a secretory organ. Nat Rev Endocrinol. 8 (8), 457-465 (2012).
- Crane, J. D., et al. Exercise-stimulated interleukin-15 is controlled by AMPK and regulates skin metabolism and aging. Aging Cell. 14 (4), 625-634 (2015).
- Rao, R. R., et al. Meteorin-like is a hormone that regulates immune-adipose interactions to increase beige fat thermogenesis. Cell. 157 (6), 1279-1291 (2014).
- Aswad, H., et al. Exosomes participate in the alteration of muscle homeostasis during lipid-induced insulin resistance in mice. Diabetologia. 57 (10), 2155-2164 (2014).
- Safdar, A., Saleem, A., Tarnopolsky, M. A. The potential of endurance exercise-derived exosomes to treat metabolic diseases. Nat Rev Endocrinol. 12 (9), 504-517 (2016).
- Maling, H. M., Stern, D. N., Altland, P. D., Highman, B., Brodie, B. B. The physiologic role of the sympathetic nervous system in exercise. J Pharmacol Exp Ther. 154 (1), 35-45 (1966).
- Pritzlaff, C. J., et al. Impact of acute exercise intensity on pulsatile growth hormone release in men. J Appl Physiol (1985). 87 (2), 498-504 (1999).
- Creemers, L. B., Jansen, D. C., van Veen-Reurings, A., van den Bos, T., Everts, V. Microassay for the assessment of low levels of hydroxyproline. Biotechniques. 22 (4), 656-658 (1997).
- Neuman, R. E., Logan, M. A. The determination of hydroxyproline. J Biol Chem. 184 (1), 299-306 (1950).
- Paxton, J. Z., Donnelly, K., Keatch, R. P., Baar, K., Grover, L. M. Factors affecting the longevity and strength in an in vitro model of the bone-ligament interface. Ann Biomed Eng. 38 (6), 2155-2166 (2010).
- Woessner, J. F. The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid. Arch Biochem Biophys. 93, 440-447 (1961).
- Paxton, J. Z., Wudebwe, U. N., Wang, A., Woods, D., Grover, L. M. Monitoring sinew contraction during formation of tissue-engineered fibrin-based ligament constructs. Tissue Eng Part A. 18 (15-16), 1596-1607 (2012).
- Lee, C. A., et al. Estrogen inhibits lysyl oxidase and decreases mechanical function in engineered ligaments. J Appl Physiol (1985). 118 (10), 1250-1257 (2015).
- Paxton, J. Z., Grover, L. M., Baar, K. Engineering an in vitro model of a functional ligament from bone to bone. Tissue Eng Part A. 16 (11), 3515-3525 (2010).
- Heinemeier, K., Langberg, H., Kjaer, M. Exercise-induced changes in circulating levels of transforming growth factor-beta-1 in humans: methodological considerations. Eur J Appl Physiol. 90 (1-2), 171-177 (2003).
- Mackey, A. L., Heinemeier, K. M., Koskinen, S. O., Kjaer, M. Dynamic adaptation of tendon and muscle connective tissue to mechanical loading. Connect Tissue Res. 49 (3), 165-168 (2008).
- Psychogios, N., et al. The human serum metabolome. PLoS One. 6 (2), e16957 (2011).
- Nguyen, T., et al. The effects of resting and exercise serum from children with cystic fibrosis on C2C12 myoblast proliferation in vitro. Physiol Rep. 2 (6), e12042 (2014).
- Joyner, M. J., Pedersen, B. K. Ten questions about systems biology. J Physiol. 589 (Pt 5), 1017-1030 (2011).
- Joyner, M. J. Giant sucking sound: can physiology fill the intellectual void left by the reductionists?. J Appl Physiol (1985). 111 (2), 335-342 (2011).
- Benjamin, M., et al. Where tendons and ligaments meet bone: attachment sites ('entheses') in relation to exercise and/or mechanical load. J Anat. 208 (4), 471-490 (2006).
- Arruda, E. M., Calve, S., Dennis, R. G., Mundy, K., Baar, K. Regional variation of tibialis anterior tendon mechanics is lost following denervation. J Appl Physiol (1985). 101 (4), 1113-1117 (1985).
- Arendt, E., Dick, R. Knee injury patterns among men and women in collegiate basketball and soccer. NCAA data and review of literature. Am J Sports Med. 23 (6), 694-701 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten