Method Article
Establishment of a Valuable Mimic of Alzheimer's Disease in Rat Animal Model by Intracerebroventricular Injection of Composited Amyloid Beta Protein
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dies ist ein Protokoll zur Alzheimer-Krankheit bei Ratten durch Bewertung der Beeinträchtigung des räumlichen Gedächtnisses, neuronale pathologischen Veränderungen, neuronale Amyloid Beta Protein (Aβ) Belastung zu imitieren, und kombiniert neurofibrillären Verschlingungen Aggregation, induziert durch die Injektion von Aβ25-35 mit Aluminium Bortrichlorid und rekombinante menschliche Umwandlung Wachstumsfaktor-β1.
Zusammenfassung
Alzheimer-Krankheit (AD) ist eine progressive, irreversible Gehirnerkrankung, die langsam zerstört Speicher und wird begleitet von Neuron Verlust und Struktur ändern. Mit der Zunahme von Alzheimer-Patienten weltweit ist der Pathologie und Therapie der Krankheit ein Schwerpunkt in der internationalen pharmazeutischen Industrie geworden. So ist die Einrichtung das Tiermodell AD im Labor nachahmen von großer Bedeutung.
Hier beschreiben wir ein detailliertes Protokoll für die Gründung eines Mimic Anzeige in eine Ratte Tier Modell aber Intracerebroventricular Injektion von Amyloid Beta Protein 25-35 (Aβ25-35) in Kombination mit Aluminium Bortrichlorid (AlCl3) und Anterodorsal thalamische Kern Injektion von rekombinanten menschlichen Wachstumsfaktor-β1 (RHTGF-β1) in Ratten verwandelt. Die entsprechenden Marker der AD gemessen wurden, einschließlich: räumliche Gedächtnis, neuronale Struktur und Unterkonstruktion, neuronale Aβ und neurofibrillären Verschlingungen (NFT) Produktion. Diese Rattenmodell zeigt Beeinträchtigung des räumlichen Gedächtnisses, neuronale Struktur und pathologischen Veränderungen im Unterbau, Neuron intrazellulären Aβ-Belastung und NFT Aggregation und bietet eine enge Mimik der neuronalen Struktur und Funktion Störung mit der klinischen Alzheimer-Patienten. Damit die vorgestellten AD Ratte Modelprovides eine wertvolle in-Vivo -Tool für die Erkundung der neuronalen Funktion, neuronale Pathologie und Drogen-Screening von AD.
Einleitung
Es ist bekannt, dass Anzeige eine chronische und fortschreitende Neurodegenerative Erkrankung mit stufenweiser Gedächtnisverlust als die wichtigsten klinischen Syndrom ist. In der allgemeinen Pathologie ist Nervengewebe Atrophie, Nervenzelle und Synapse Verlust sowie neuronale subzelluläre Struktur und Funktion Störungen, die alle in der Entwicklung und klinische Manifestation von AD1,2beteiligt sind. Es wird berichtet, dass bei Tieren Intracerebroventricularly mit Aβ injiziert wurden, einige neurotoxischen Ereignisse im Gehirn mit neuronenverlust, Kalzium-Homöostase Störungen, Neuron Apoptose und reaktive Sauerstoff Spezies Überproduktion3auftreten. Jedoch mehrere Faktoren in der Pathogenese der AD und daher ist es wichtig, ein besseres Modell der AD zu etablieren.
Ein detailliertes Protokoll wird hier beschrieben, für den Aufbau einer in Vivo mimischen AD-Modell durch Intracerebroventricular Injektion von Aβ25-35 und AlCl3, kombiniert mit Anterodorsal thalamische Kern Injektion von RHTGF-β1 an Ratten. Diese Ratte Modelhighly imitiert menschliche neuronale Funktion und Histopathogenesis der Werbeanzeige, einschließlich Gedächtnisstörungen, neuronenverlust und Strukturschäden, Apoptose, intrazelluläre Aβ-Belastung und NFT Aggregation4,5,6 , 7 , 8 , 9. the AlCl3 verhindert, dass die hinterlegten Aβ bilden lösliche Aβ und RHTGF-β1 kann hinterlegte Aβ-Produktion fördern und erleichtern AD auftreten10. Dieser Angriff von mehreren Faktoren ab, das Neuron ist im Einklang mit der Multi-Pathogenese der AD.
Das gesamte Experiment überspannt 86 Tage: Abbildung 1 zeigt einen Zeitplan für die experimentelle Gesamtplanung, mit dem Zeitpunkt der tierischen Chirurgie, Tiermodell Screening, tierische räumliche Gedächtnis Test und Probenvorbereitung. Am ersten Tag der Operation war RHTGF-β1 in den Anterodorsal thalamische Zellkern mikroinjiziert. Am zweiten Tag der Operation wurden Aβ25-35 und AlCl3 in den seitlichen Ventrikel täglich für 14 aufeinanderfolgende Tage morgens und 5 aufeinander folgenden Tagen am Nachmittag bzw. mikroinjiziert. Alle Ratten durften für 45 Tage nach der Operation zu erholen. Morris-Wasser-Irrgarten diente, Bildschirm für erfolgreiches Modell Ratten mit Gedächtnisstörungen und Ratten räumliche Gedächtnis zu beurteilen. Die Ratten wurden 4 aufeinander folgenden Tagen der Wasser-Irrgarten training mit 2 Versuche pro Tag, und am 4. Tag der Ausbildung, wurden die Ratten mit Morris Wasser-Labyrinth-Leistung für Gedächtnisstörungen ausgewertet. Alle Ratten weiterhin 37 Tage nach der Vorführung Tiermodell gefüttert werden. Das räumliche Gedächtnis von Ratten wurde in der Morris-Wasser-Irrgarten über 7 aufeinander folgenden Tagen, vom Tag 79 bis 85 Tag nach der Operation getestet. Alle Ratten wurden durch Enthauptung am Tag 86 Gehirn Probenvorbereitung geopfert.
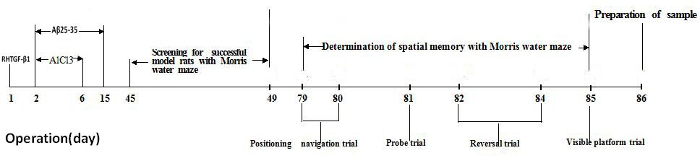
Abbildung 1. Timeline des experimentellen Designs. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protokoll
Dieses Verfahren wurde in Übereinstimmung mit den Vorschriften der experimentellen Tier Verwaltung herausgegeben von der staatlichen Ausschuss of Science and Technology of China am 31. Oktober 198811. Wissenschaftler sollten die Richtlinien festgelegt und genehmigt durch ihre institutionellen und nationalen Tieren Regulierungsorganisationen befolgen.
Hinweis: Tier und Regenten: vier Monate alten männliche Sprague-Dawley Ratten (300-350 g) für dieses Experiment geliefert wurden. Alle Ratten wurden in Gruppen (vier oder fünf pro Käfig) bei einer Temperatur von 23 ± 1 ° C mit einem 12-h-Hell-Dunkel-Zyklus untergebracht. Nahrung und Wasser waren verfügbar Ad Libitum. Die Ratten wurden akklimatisiert, die Wohnverhältnisse für 7 Tage, bevor der Eingriff durchgeführt wurde. Aβ25-35 war aufgelöst in 1 % DMSO Kochsalzlösung bis 1 mg/mL und für 5 min in einen Ultraschall Oszillator bis aufgelöst beschallt. AlCl3 und RHTGF-β1 wurden in Kochsalzlösung bei 1 % und 0,1 mg/mL, aufgelöst. Kongo-rot, Silbernitrat und andere Chemikalien analysenrein waren und wurden von gewöhnlichen kommerziellen Quellen erworben.
1. chirurgischer Eingriff
Hinweis: 20 männliche Sprague-Dawley Ratten wurden mikroinjiziert mit Compositing Aβ in die seitlichen Ventrikel und Anterodorsal thalamische Kern, und als der zusammengesetzten Aβ-behandelten Gruppe bezeichnet. Ein weiteres 20 Ratten die gleiche Operation unterzogen wurden aber 0,1 % DMSO saline Mikroinjektion erhielt, und als der Schein betrieben-Gruppe bezeichnet.
- Die Ratten mit 100 % Isofluran Inhalation betäuben und dann auf einem Gehirn stereotaktischen Apparat zurückhalten.
- Das Fell auf den Scheitelpunkt des Kopfes mit chirurgische Scheren zu rasieren und desinfizieren mit jodophor. Dann Abdeckung Einweg op Handtuch auf den Kopf.
- Machen Sie einen Schnitt an der Kopfhaut entlang die mittlere längs-Calvaria mit chirurgischen Bistouries und Scheren.
- Trennen Sie der Unterhaut und Faszie, wischen Sie den Schädel Calvarium mit einer sterilen trockene Baumwolle für die Blutstillung und markieren Sie die Bregma mit einem Filzstift.
- Beziehen sich auf die Ratte Gehirn stereotaktischen Karte12; in Anbetracht der Bregma als Herkunftsort, markieren Sie die drei Punkte, die Anterodorsal thalamische Kern (n. Chr.) (Posterior (P): 2,0 mm, die Bregma; seitliche (L): 1,4 mm an der Mittellinie) für RHTGF-β1 injizieren und eine Befestigungsschraube, die seitlichen Ventrikel (LV) Bereich ( Posterior (P): 0,8 mm bis Bregma; Lateral (L): 2,0 mm an der Mittellinie) zum Einspritzen von Aβ25-35 und AlCl3 und die zweite Schraube Befestigung Ort (Front (F): 2,0 mm, die Bregma; seitliche (L): 1,5 mm auf der Mittellinie).
- Sanft die Bohrungen drei 1 mm Durchmesser mit einem flexiblen knochenbohrer, bestimmt an die oben genannten drei Punkte des Schädels (1.5. Schritt). Schrauben Sie nicht tiefer als nötig, stechen das Hirngewebe zu vermeiden.
- Die Blutung zu stoppen und die Schädel Oberfläche immer wieder mit sterilen trockenen Baumwolltuch reinigen.
- Nadel verbunden mit der Mikro-Einspritzpumpe des Gehirns bei 4,6 mm Tiefe und sanft Spritzen 1 μl RHTGF-β1 (10 ng) in den Anzeige-Bereich. Nadel 2 min nach der Injektion zu bleiben und langsam Herausziehen der Nadel (ergänzende Datei 1).
- Befestigen Sie die beiden Schrauben in den Schädel, die in der Anzeige und die zweite Schraube Befestigung Ort des Schädels bezeichnet (die waren bestimmt bei 1,5. Schritt) mit einem kleinen Schraubendreher. Schrauben Sie nicht tiefer als nötig, stechen das Hirngewebe zu vermeiden.
- Montieren Sie die Kanüle Implantation System (zusätzliche Datei-2), legen Sie die Dummy-Kanüle in die Guide-Kanüle nach der Desinfektion durch hohen Druck.
- LV-Bereich durch den Schädel Loch (zusätzliche Datei-3), stecken Sie Edelstahl-Rohre Reiseführer Kanüle an das Gehirn bei 4,6 mm mit Hilfe der Kanüle Halter von Ratten stereotaktischen Gerät.
- Mischen Sie den prothesenkunststoff mit Prothese Basis Wasser im Verhältnis von 1,5 g pro 1 mL, setzen Sie die Paste zur Deckung der Führer Kanüle Kunststoff Sockel und zwei Schrauben für die Immobilisierung der Führer-Kanüle und bis Abdeckung der gesamten Hautschnitt für die Infektion der Haut zu vermeiden.
- Am 2. Tag der Operation betäuben Sie die Ratten mit Isofluran Inhalation mit dem kleinen Tier Anästhesiegerät. Die Dummy-Kanüle ziehen Sie, legen Sie die internen Kanüle in die Leitfaden-Kanüle und Schrauben Sie die Befestigungsschraube um die interne Kanüle zu immobilisieren.
- Die Polyethylen-Rohr verbindet die Mikroinjektion Pumpe auf die internen Kanüle und regulieren Sie die Einspritzgeschwindigkeit auf 1 μl/min Microinject Aβ25-35 oder AlCl3, die LV
- Microinject 4 μg (1 μl) Aβ25-35 täglich für 14 Tage in der früh und 3 μL AlCl3 (1 %) täglich für 5 Tage am Nachmittag unter Isofluran-Narkose.
- Warten Sie 5 Minuten nach Beendigung der Injektion, sanft die interne Kanüle ziehen Sie und stecken Sie die Dummy-Kanüle wieder in die Guide-Kanüle.
- Am 15. Tag Post op (entspricht bis zum letzten Tag der Injektion der Aβ25-35) demontieren Sie die Kanüle Implantation System. Schonend entfernen Sie der Prothese basisvolumenkörper Material mit chirurgische Scheren und Pinzetten, Schrauben Sie die zwei, die Leitfaden-Kanüle herausziehen Sie und Desinfizieren Sie die Wunde mit Betadine. Füllen Sie das Loch des Schädels mit Knochenzement und Naht der Haut mit einer einfachen Naht unterbrochen-Methode.
- Den gleichen Vorgang mit der Farce betriebene Gruppe ausführen und microinject 0,1 % DMSO Kochsalzlösung.
-
Postoperative Pflege
- Haus 2 Ratten pro Käfig nach Operation und bieten Nahrung für 30 Tage.
Hinweis: 18 Ratten in der Sham-betrieben Gruppe überlebt (90 % Erfolgsquote der Operation) und 19 Ratten in der Compositing-behandelten Aβ Gruppe überlebt (95 % Erfolgsquote der Operation).
- Haus 2 Ratten pro Käfig nach Operation und bieten Nahrung für 30 Tage.
2. Screening für erfolgreiches Modell Ratten und Beurteilung des räumlichen Gedächtnisses mit Morris Wasser-Irrgarten
-
Morris-Wasser-Irrgarten
Hinweis: Der Morris-Wasser-Irrgarten wurde zur Ratte räumliche Gedächtnis13zu bewerten. Der Morris-Wasser-Irrgarten ist ein Edelstahl-kreisförmigen Tank mit 120 cm Durchmesser und 50 cm Tiefe. Der Wasser-Labyrinth-Test wurde durchgeführt, basierend auf dem "Gold Standard" Paradigma Biopsychologie von J. Nunez14beschrieben.- Das Wasser im Pool mit einigen Tropfen Lebensmittelfarbe zu schwärzen.
- Pflegen Sie die Tiefe des Wassers bei 31,5 cm und die Temperatur auf 23 ± 1 ° C.
- Legen Sie eine 1,5 cm Runde transparente Plexiglas-Plattform unterhalb der Wasseroberfläche.
- Behaupten Sie, dass alle räumlichen Signale durch das Wasser-Labyrinth während der Wasser-Labyrinth-Tests unveränderlich sind.
- Teilen Sie den Pool in 4 gleichen Quadranten durch imaginäre Linien für beschreibende Daten-Sammlung.
- Platzieren Sie das versteckte Plateau im ersten Quadranten (Q1) von Wasser-Irrgarten.
- Erfassen Sie die Ratte Schwimmen Verhaltensweisen (gemessen nach Latenz, Flugbahn, oder Kreuzung) durch eine Video-Kamera, über die Wasser-Irrgarten mit einer Computer-basierte Grafik analytische Software verknüpft.
-
Screening für erfolgreiches Modell Ratten der zusammengesetzten Aβ-behandelten Gruppe
- Am OP-Tag 45 führen Sie die Morris-Wasser-Irrgarten training für 4 aufeinanderfolgende Tage als Erfolgsmodell Ratten mit Beeinträchtigung des Gedächtnisses und die Screening-Ratio (SR) zu sammeln.
Hinweis: Die SR ist definiert als die durchschnittliche Latenzzeit von jedes Compositing Aβ-behandelten Ratten und die Farce betriebene Gruppe von Ratten, das versteckte Plateau unter Wasser zu finden der Oberfläche auf Tag 4 des Wassers Labyrinth Training. "A" ist die durchschnittliche Latenzzeit von jede Compositing Aβ-behandelten Ratte, das versteckte Plateau zu finden und "B" beträgt die durchschnittliche Wartezeit der Schein betrieben Gruppe von Ratten, das versteckte Plateau am 4. Tag des Wasser-Irrgarten, Ausbildung, in der folgenden Gleichung zu finden: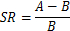
Als SR größer als 0,2 für ein zusammengesetztes Aβ-behandelten Ratte war, galt als ein erfolgreiches Modell Ratte mit Gedächtnisstörungen Compositing Aβ-behandelten Ratten15die Ratte. Die Intraday-Speicher-Performance wurde durch den durchschnittlichen Wert von Ratten, das versteckte Plateau zu finden, die Daten von 2 Studien berechnet. Der Prozess von der Morris-Wasser-Labyrinth-Test wurde so konzipiert, dass die Ratten durften Schwimmen in den Wassertank Labyrinth und Suche nach der verborgenen Plattform innerhalb von 60 s. Wenn nicht, eine Ratte, die versteckte Plattform innerhalb von 60 finden s, dann die Ratte wurde auf der Plattform mit Hand des Experimentators gelegt. Wenn eine Ratte auf das versteckte Plateau erreicht (unabhängig oder assistierten), die Ratte war lassen Sie dort für 20 s. Dann war die Ratte aus dem Tank entfernt und erlaubt eine körperliche Erholung für 10 s zwischen den 2 Studien.
- Am OP-Tag 45 führen Sie die Morris-Wasser-Irrgarten training für 4 aufeinanderfolgende Tage als Erfolgsmodell Ratten mit Beeinträchtigung des Gedächtnisses und die Screening-Ratio (SR) zu sammeln.
(3) Neuron Prüfung
- Auf 86 Post Tageschirurgie, Isoflurane Narkose einschläfern Sie die Ratten durch Enthauptung (Abbildung 1).
- Das Gehirn auf Eis gelegt und vorsichtig trennen die beiden Hemisphären in der Raphe. Nehmen Sie die linke Hemisphäre des optischen Chiasma und Fix in 4 % Formaldehyd für leichte Microcopy Beobachtung der Neuron Hämatoxylin und Eosin (HE), Kongo-rot oder Silbernitrat Flecken (siehe Abschnitte 4 bis 6). Befestigen Sie die rechte Hemisphäre Hippocampus CA1 Bereich in 2,5 % Glutaraldehyd für Elektron Microcopy Beobachtung (Abschnitt 7).
- Verarbeitet das Gehirn für die Probenvorbereitung Licht/Elektron Microcopy wie zuvor beschrieben16,17.
4. Neuron HE Färbung
- Deparaffinize jede Folie (20 min) mit Farbverlauf Alkohol (100 %, 95 %, 90 %, 80 % und 70 % Alkohol), destilliertes Wasser in einer Dampfhaube.
- Fleck für 3 min mit Hämatoxylin (0,5 % w/V), und dann spülen Sie mit Wasser aus dem Wasserhahn, den nicht gebundenen Farbstoff aus Folien zu entfernen.
- Spülen Sie mit 0,1 % iger Salzsäure in Alkohol für 1 s, die Farbe des ungefärbten Kerne zu entfernen.
- Tauchen Sie in 0,5 % Ammoniak-Lösung für 2 min bis der Hintergrund abwechselnd hellblau.
- Fleck für 1 min mit 1 % Eosin.
- 5 min mit Farbverlauf Alkohol (70 %, 80 %, 90 %, 95 % und 100 % Alkohol) zu entwässern.
- In Xylol klar und mit harzigen Eindeckmedium montieren.
- Beobachten Sie und zählen Sie die lebenden Nervenzellen des Flecks HE pro 0,125 mm in der Mitte CA1 des Hippocampus und 0,0352 mm2 in der Großhirnrinde bei einer Vergrößerung von 400 X mit einem optischen Mikroskop durch eine Person geblendet, das experimentelle Design.
(5) Kongo-rot Färbung für Neuron Aβ Belastung prüfen
- Deparaffinize jede Folie (20 min) mit Farbverlauf Alkohol (100 %, 95 %, 90 %, 80 % und 70 % Alkohol), destilliertes Wasser in einer Dampfhaube.
- Fleck für 20 min mit Kongo-rot arbeiten Lösung (0,5 g Kongo-rot, 80 mL Methylalkohol, 20 mL Glycerinum).
- Spülen Sie mit destilliertem Wasser für 5 Minuten.
- Schnell zu unterscheiden, mit 80 % Alkohol-Lauge (0,2 g Alkohol/100 mL Kaliumhydroxid) für 3 s.
- Zweimal, jeweils für 5 min mit destilliertem Wasser abspülen.
- Gegenfärbung in Gills Hämatoxylin 3 Minuten lang.
- Spülen Sie mit Wasser aus dem Wasserhahn für 2 min.
- Tauchen Sie ein in Ammoniakwasser (ein paar Tropfen von Ammonium Hydroxid, Leitungswasser und gut vermischen) für 30 s oder bis die Abschnitte blau leuchten.
- Spülen Sie mit Wasser aus dem Wasserhahn für 5 min.
- Entwässern Sie mit Farbverlauf Alkohol (70 %, 80 %, 90 %, 95 % und 100 % Alkohol).
- In Xylol klar und mit harzigen Eindeckmedium montieren.
- Beobachten Sie und zählen Sie die Zellen mit Kongo-rot bei einer Vergrößerung von 400 X mit einem optischen Mikroskop durch eine Person Blind den Versuchsplan gebeizt.
(6) Silbernitrat Färbung für Prüfung Neuron NFT Bildung
- Deparaffinize jede Folie (20 min) mit Farbverlauf Alkohol (100 %, 95 %, 90 %, 80 % und 70 % Alkohol), destilliertes Wasser in einer Dampfhaube.
- Tauchen Sie in 20 % Silbernitratlösung und Capper Agent für 20 min in der Dunkelheit.
- In destilliertem Wasser zweimal, waschen Sie 5 min für jedes Mal.
- Tauchen Sie in Silber Ammoniak-Lösung. Ammoniak-Lösung in 20 % Silbernitratlösung und fügen Sie hinzu, bis die Lösung von Trübung zur Klärung geht. Gleichzeitig, rühren Sie die Lösung mit einem Glasstab für 15 min und dann in das 1 % verdünnt Ammonium Hydroxid 2 min. lang.
- Legen Sie die Folie in die entwickelnden Arbeitslösung für 3-7 min, bis der schwarze Block in das Axon beobachtet werden kann.
- Tauchen in die 0,1 % verdünnt-Ammoniak-Lösung für 1 min und dann spülen Sie mit Wasser für 1 min.
- Entsorgen mit Natriumthiosulfat 5 % für 2 min und dann spülen Sie mit Wasser für 5 Minuten.
- Entwässern Sie mit Farbverlauf Alkohol (70 %, 80 %, 90 %, 95 % und 100 % Alkohol).
- In Xylol klar und mit harzigen Eindeckmedium montieren.
- Beobachten Sie und notieren Sie die Zelle für Silbernitrat Fleck bei einer Vergrößerung von 400 X mit einem optischen Mikroskop durch eine Person geblendet, das experimentelle Design.
(7) hippocampal Neuronen Ultrastruktur Messung
- Schneiden des Ratte Hippocampus CA1 in mehrere Würfel (1 x 1 x 1 mm-3) und in 2,5 % Glutaraldehyd für 2 h bei 4 ° C.
- Spülen Sie die Würfel mit PBS drei Zeiten (pH 7,2, 10 min für jedes Mal).
- Beheben Sie die Würfel in 1 % Osmic Säure für 2 h bei 4 ° C.
- Spülen Sie die Würfel in doppelt destilliertes Wasser 3 x (10 min für jedes Mal).
- Entwässern Sie mit Farbverlauf Alkohol 50 %, 70 % und 90 % (10 min für jeden), 100 % zweimal (15 min für jedes Mal).
- Ersetzen von Propylenoxid zweimal (15 min für jedes Mal), Propylen oxid: Harz 1:1 (60 min für jedes Mal bei Raumtemperatur) und Propylen oxid: Harz 1:4 (60 min für jedes Mal bei Raumtemperatur). Weichen Sie in Harz (120 min bei Raumtemperatur).
- Einbetten in Verfahrensweisen 812 und polymerisieren (5 h/35 ° C, 5 h/60 ° C, 5 h/80 ° C).
- Schneiden Sie die Ansät Abschnitten (1 µm), Färben von Methylenblau und unter dem Mikroskop zu lokalisieren.
- Flecken auf die ultra-dünnen Abschnitten (50 nm) mit Uranyl-o-Acetat und führen Citrat.
- Überprüfen Sie unter einem Elektronenmikroskop JEM-1400 und sammeln Bilder.
Ergebnisse
Alle Daten werden präsentiert, die SEM. SAS/STAT-Paket verwendet wurde, um die statistische Analyse zu berechnen als Mittelwert ±. Die gruppenunterschiede in Latenz, das versteckte Plateau in Speicher Erwerb und Speichertest neu lernen zu finden wurden von zwei-Wege-Varianzanalyse (ANOVA) mit Messwiederholungen analysiert. Die gruppenunterschiede in die Sonde Versuch und die Anzahl der Neuronen wurden durch einfache ANOVA gefolgt von Duncans Multiple-reichweitentest ausgewertet. p < 0,05 galt als statistisch signifikante18.
Screening für erfolgreiches Modell Ratten mit Beeinträchtigung des Gedächtnisses für das Compositing Aβ-behandelten Gruppe:
Die Ergebnisse in Abbildung 2AA1 und 2AA2 zeigen, dass der Schein betrieben Gruppe von Ratten immer frei schwammen und das Compositing Aβ-behandelten Gruppe Ratten (Abbildung 2AB1, AB2) immer im Umkreis in adaptive Schwimmen im Pool Schwamm die Morris-Wasser-Irrgarten. Über die 4 Tage des Screenings für Speicher Beeinträchtigung Modell Ratten hatten alle Ratten allmählich sinkende Zeiten, das versteckte Plateau (Latenz) (Abbildung 2B) zu finden. Am Tag 4 von Morris Wasser Labyrinth Training, wenn die SR mehr als 0,2 (was auf die Latenz jedes Compositing Aβ-behandelten Ratten und die Farce betriebene Gruppe von Ratten für die Suche nach den versteckten Plattform basierte), dann Compositing Aβ-behandelten Ratten galt ein erfolgreiches Modell Ratte mit Gedächtnisstörungen. 18 der 19 Ratten (94.70 %), die den Betrieb übergeben die Erfolgsmodell Screening. 6 Ratten jeder Gruppe überlebt wurden für die folgenden Experimente ausgewählt.
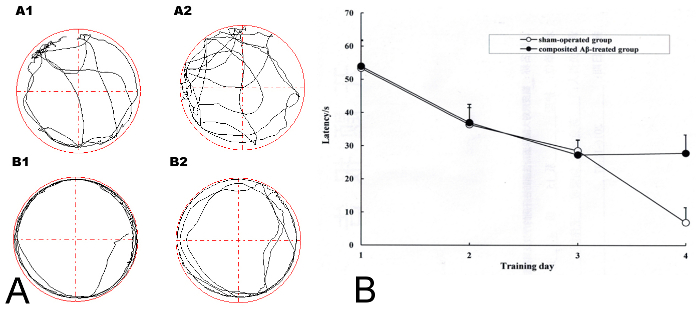
Abbildung 2 . Screening für erfolgreiches Modell Ratten mit Beeinträchtigung des Gedächtnisses in der zusammengesetzten Aβ-behandelten Gruppe mit dem Morris Wasser Labyrinth Training. (A) die adaptive Schwimmen Flugbahn von Ratten in der Morris-Wasser-Irrgarten. (AA1–AA2) Sham-betrieben Gruppe; (AB1–AB2) Compositing Aβ-behandelten Gruppe. (B) mittlere Latenz, das versteckte Plateau für 4 aufeinanderfolgende Tage des Screening-Verfahrens im Morris Wasser finden maze Training für die Gruppe Schein betrieben und der zusammengesetzten Aβ-behandelten Gruppe. Abbildung wurde von Referenz 4 geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Compositing Aβ Ratte Speicher Erwerb und Speicher Wiedererlernen Beeinträchtigungen verursacht:
Die Ratte-Speicher-Übernahme wurde durch die Positionierung Navigation Versuch am Tag 1 und 2 von der Morris Wasser-Labyrinth-Test bestimmt, die 79 und 80 Post Tageschirurgie entsprach. Während der 2 Tage der Speicher mit dem Versuch stellte alle Ratten schrittweise abnehmenden Latenz um das versteckte Plateau zu finden. Wie in Abbildung 3dargestellt, wurden die Latenzen der zusammengesetzten Aβ-behandelten Gruppe für die Suche nach den versteckten Plattform 360.67 % und 558.28 % (F (1, 5) = 238.67, p < 0,01) größer als die des Arbeitskreises Schein betrieben am Tag 1 und 2 des Wassers Morris Labyrinth-Test, beziehungsweise. Dies bedeutet, dass das Compositing Aβ Erwerb Gedächtnisstörungen bei Ratten induzieren kann.
Die Ratte Speicher Wiedererlernen wurde durch die Umkehr am Tag 4, 5 und 6 des Morris Wassertest Labyrinth Test untersucht die 82, 83 und 84 Post Tageschirurgie entsprach. Wie in Abbildung 3dargestellt, wurden die Latenzen der zusammengesetzten Aβ-behandelten Gruppe für die Suche nach den versteckten Plattform 306.20 %, 650.16 % und 936.92 % länger als die des Arbeitskreises Schein betrieben (F (1, 5) = 138.76, p < 0,01). Dies zeigt, dass die zusammengesetzten Aβ Wiedererlernen Beeinträchtigung bei Ratten (Abbildung 3) Speicher erhöhen kann.
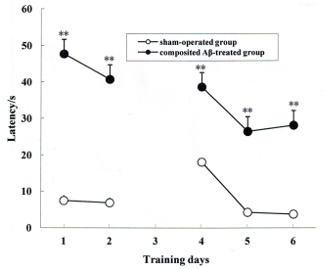
Abbildung 3 . Compositing Aβ Ratte Speicher Erwerb und Speicher Wiedererlernen Beeinträchtigungen verursacht. Die Positionierung Navigation Testversion wurde verwendet, um Speicher-Übernahme durch 2 aufeinander folgende Tage Schwimmen Erfolg am Tag 1 und 2 im Morris-Wasser-Labyrinth-Test zu bewerten. Diese wurden auf 79 und 80 Post Tageschirurgie durchgeführt. Die Umkehr Testversion wurde verwendet, um Speicher Wiedererlernen von 3 aufeinander folgenden Tagen schwimmen Gäste am Tag 4, 5 und 6 im Tag 82, 83 und 84 des Vorgangs entsprach Morris Wasser Labyrinth Test zu bewerten. Die Linie Diagramm Diagramme zeigen die mittlere Wartezeit, das versteckte Plateau für jede Gruppe an Tag 1, 2, 4, 5 und 6 in der Morris Wassertest Labyrinth zu finden. Daten analysiert wurden durch zwei-Wege-ANOVA (Tag x Gruppe) mit Messwiederholung. Meine ± SEM n = 6. ** p < 0,01 vs. Sham betriebene Gruppe. Abbildung wurde von Referenz 4 geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Compositing Aβ verursacht Ratte Gedächtnisstörungen Retention:
Die Ratte Merkfähigkeit wurde durch Sonde Versuch am 3. Tag der Wassertest Labyrinth Morris gemessen die Tageschirurgie 81 Post entsprach. In der 1 Tag Merkfähigkeit Testversion, die Compositing Aβ-behandelten Gruppe nahm weniger Zeit schwimmen, Schwimmen Abstand und Kreuzung Nummer in Q1 innerhalb von 60 s, die 32.14 % und 30.11. % 78,95 % (p < 0,01), bzw. als derjenigen entsprach der Sham-betrieben Gruppe (Abbildung 4A, 4 b). Diese Ergebnisse zeigen, dass die zusammengesetzten Aβ Aufbewahrung Gedächtnisstörungen bei Ratten produzieren kann.
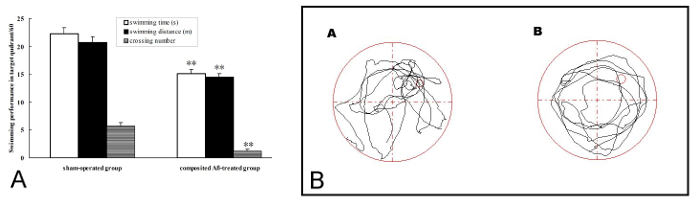
Abbildung 4 . Compositing Aβ produziert Ratte Aufbewahrung Gedächtnisstörungen. Die Sonde Versuch wurde verwendet, um die Merkfähigkeit zu bewerten, um 1 Tag schwimmen Leistung am 3. Tag in der Morris Wasser-Labyrinth-Test, der auf 81 Post Tageschirurgie durchgeführt wurde. (A) Zeit schwimmen, Schwimmen Abstand und Kreuzung Nummer in Q1 innerhalb von 60 s in der Sonde Versuch (ohne Bahnsteig). Durch einfache ANOVA wurden mit Multiple-reichweitentest ausgewertet. Meine ± SEM n = 6. ** p < 0,01 vs. Sham betriebene Gruppe. (B) das Schwimmen Flugbahn von Ratten in der Sonde Versuch. (A) Schein betrieben Gruppe, zeigt größere Badezeit und Distanz im Ziel-Quadranten (Q1). (B) Composited Aβ-behandelten Gruppe, zeigt weniger Badezeit und Distanz im Ziel-Quadranten (Q1). Abbildung wurde von Referenz 4 geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Compositing Aβ beeinflusst Ratte Schwimmen Geschwindigkeit:
Die Ratte Schwimmgeschwindigkeit wurde durch die sichtbare Plattform Test am Tag 7 der Morris-Wasser-Labyrinth-Test, der Tag 85 entsprach Chirurgie Post berechnet. Die Ratte, die Schwimmgeschwindigkeit, basierend auf der Berechnung von Entfernung und Zeit auf der Plattform der einzelnen Gruppen im Pool schwimmen war nicht signifikant unterschiedlich. Daher wäre die individuellen Unterschiede in der Ratte Schwimmgeschwindigkeit auszuschließen, was darauf hinweist, dass Motivation und Motorik in alle Ratten (Abbildung 5) im Wesentlichen intakt waren.
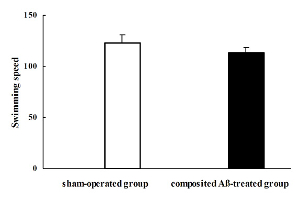
Abbildung 5 . Compositing Aβ beeinflusst Ratte Schwimmen Geschwindigkeit. Die Ratte Schwimmgeschwindigkeit wurde durch die sichtbare Plattform Testversion am 7. Tag von der Morris Wasser-Labyrinth-Test berechnet, die am Tag 85 nach der Operation durchgeführt wurde. Die Ratte Schwimmgeschwindigkeit der einzelnen Gruppen war nicht signifikant unterschiedlich. Durch einfache ANOVA wurden mit Multiple-reichweitentest ausgewertet. Meine ± SEM n = 6. Abbildung wurde von Referenz 4 geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Compositing Aβ Ratte neuronalen morphologische Veränderung verursacht:
Alle Ratten starben durch Enthauptung am Tag 86 der Chirurgie. Die visuelle Inspektion ergab, dass eine gelbe Fläche oder eine dünne oder reduzierten Hirnrinde in mehreren zusammengesetzten Aβ-behandelten Ratten erschienen. Im Vergleich mit der Farce betriebene Gruppe (Abbildung 6AA2), optische Mikroskopie Beobachtung der zusammengesetzten Aβ-behandelten Gruppe indem er gebeizt, hippocampal Neuronen pathologischen Veränderungen, wie neurofibrillären Degeneration, Neuronophagia, nukleare Pyknosis und nukleare Margination (Abbildung 6AB2). Außerdem zeigte der Teil der Großhirnrinde in der zusammengesetzten Aβ-behandelten Gruppe typischen Colliquative Nekrose, charakterisiert durch gestörten Zellmembranen, fragmentierten Kernen und umfangreiche Entzündungszellen Infiltration in die nekrotischen Region ( Abbildung 6A ( B3). Dies bedeutet, dass das Compositing Aβ zu neuronalen strukturelle pathologischen Verletzungen bei Ratten führen kann.
Zusätzlich zu pathologischen Veränderungen der neuronalen Struktur, verglichen mit der Gruppe Schein betrieben wurde die Anzahl der Neuronen im Hippocampus und Hirnrinde (mit Ausnahme der Colliquative Nekrose Probe) von der zusammengesetzten auch deutlich zurückgegangen. Aβ-behandelten Gruppe. Die Neuron-Zahl war 63.86 % (p < 0,01) niedriger als die der Schein betrieben Gruppe in hippocampalen CA1-Abschnitten von 0,125 mm und 55.46 % (p < 0,01) niedriger Großhirnrinde abschnittsweise 0.0352 mm2 (Abb. 6 b), was darauf hindeutet, dass die zusammengesetzten Aβ führen kann eine verminderte Neuron zählen.
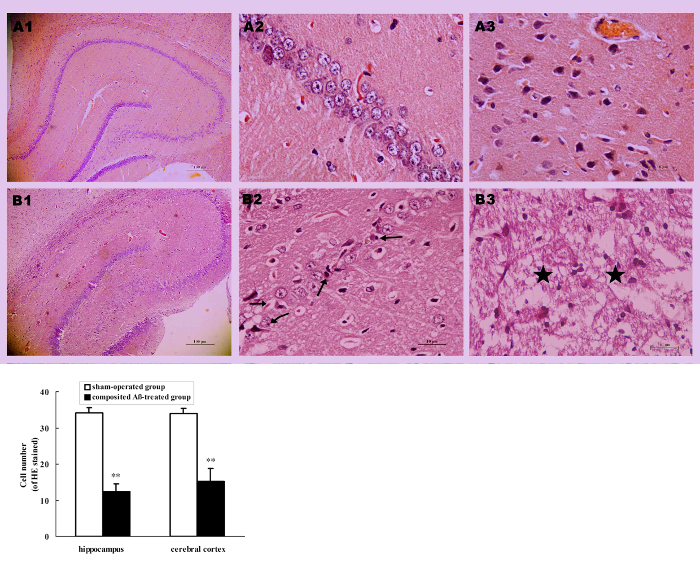
Abbildung 6 . Compositing Aβ Ratte neuronalen morphologische Veränderung verursacht. (A) repräsentative Bilder des Hippokampus und zerebrale kortikale Neuronen mit er befleckt. (A1–B1) Hippocampus 40 X; (A2–B2) Hippocampus CA1 400 X; (A3–B3) Zerebralen Kortex 400 X. (A1–A3) Sham-betrieben Gruppe; (B1–B3) Compositing Aβ-behandelten Gruppe; zeigt neuronenverlust markiert, neurofibrillären Degeneration (→), Neuronophagia (←), nukleare Pyknosis (↗), nukleare Margination (↙) im Hippocampus, typische Colliquative Nekrose (★) gestört Zellmembranen, große Anzahl von Entzündungszellen infiltriert in der Großhirnrinde in einem Teil des zusammengesetzten Aβ-behandelten Gruppe. Maßstabsleiste A1 , B1 = 10 µm; Maßstabsleiste von A2, B2, A3, B3 = 100 µm. (B) Anzahl von Neuronen mit HE Fleck in den Hippocampus und Hirnrinde, die unter einem Lichtmikroskop (400 X) gezählt wurden. Jeder Band stellt Mittelwert ± SEM von 9 Gesichtsfeldes von 3 unabhängigen Proben (n = 3). ** p < 0,01 vs. Sham betriebene Gruppe. Abbildung wurde von Referenz 4 geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Die Elektronenmikroskopie beobachtet die subzelluläre Ultrastruktur der Hippokampus-Neuronen. Die Unterkonstruktion der hippocampal Neuronen in der zusammengesetzten Aβ-behandelten Gruppe (Abb. 7 b1-B4) deutlich vernichtet wurden, zeigt der mitochondrialen Schwellung und Cristae Bruch, erhöhte mitochondriale Elektronendichte, geweitet rau endoplasmatische Retikulum, depolymerisiert Polyribosomes und Polymicrotubules, einige postsynaptischen Dichte (PSD), vielen sekundären Lysosomen und Lipofuszin Sediment im Zytoplasma, im Vergleich zu der Schein betrieben Gruppe (Abbildung 7A1 – A4). Die Kernmembran war roh und versunkenen, das Euchromatin wurde verdichtet und denaturiert, die Myelinscheide Schichten waren Lose oder Degeneration, und interne Axone und Fasern wurden abgeschwächt. Diese Ergebnisse zeigen, dass das Compositing Aβ Unterkonstruktion neuronenschäden in Ratten produzieren kann.
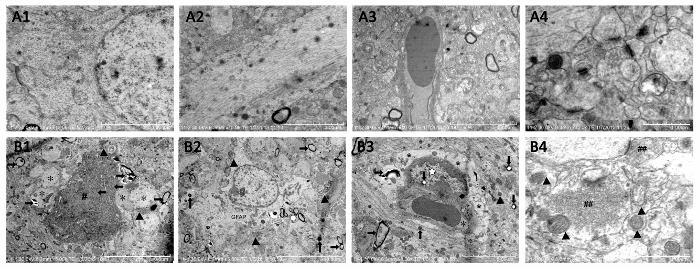
Abbildung 7 . Subzelluläre Struktur der hippocampal Neuronen von Elektron mikroskopische Beobachtung bewertet. A1 -A4: Sham betriebene Gruppe. Maßstab der A1 = 4 µm, 12, 000 X; Maßstabsleiste a2 = 3 µm, 15, 000 X; Maßstabsleiste a3 = 5 µm, 10, 000 X; Maßstabsleiste a4 = 1 µm, 35, 000 X. (B1–(B4) Compositing Aβ-behandelten Gruppe. (B1) Neuron und nukleare Pyknosis (←), Euchromatin Kondensation oder Degeneration (#), Astrozyten Fuß Anschwellen (*), hohe Elektron Dichte Mitochondrien (▲), Myelinscheide Schichten lose oder Dämpfung (→); (B2) Größere GFAP, hohe Elektron Dichte Mitochondrien (▲), Myelinscheide Schichten lose oder (Dämpfung), größere sekundären Lysosomen (↑), perizyten Pyknosis, perizyten Euchromatin Kondensation oder Degeneration (☆), Astrozyten Fuß Anschwellen (*), hohe Elektronendichte Mitochondrien (▲), weitere Lipofuszin (↓), Myelinscheide Schichten lose oder Dämpfung (→). B4: Weitere exzitatorische Neurotransmitter (#), hohe Elektron Dichte oder Verletzungen Membran Mitochondrien (▲), weniger Synapsis. Maßstabsleiste B1 , B2 = 10 µm, 5, 000 X; Maßstab der B3 = 5 µm, 8, 000 X; Maßstabsleiste von B4 = 1 µm, 40, 000 X. Abbildung wurde von Referenz 4 geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Compositing Aβ Aβ-Belastung im Rattenneuronen verursacht:
Kongo-rot Färbung wurde verwendet, um die Aβ Belastung der Neuronen zu erkennen. Die Ergebnisse zeigen, dass die zusammengesetzten Aβ insbesondere die intrazelluläre Aβ-Belastung in der Ratte Hippocampus und Hirnrinde (Abbildung 8A) hervorrufen kann. Die positive Anzahl von Zellen mit Aβ rot gefärbt von Kongo-rot in den Hippocampus und Hirnrinde der zusammengesetzten Aβ-behandelten Gruppe sind 8.05 - und 4.09 - fache (p < 0,01) größer als die der Schein betrieben Gruppe (Abb. 8B). Dies zeigt, dass Compositing Aβ Neuron Aβ Belastung bei Ratten erhöhen kann.

Abbildung 8 . Compositing Aβ Aβ-Belastung in Ratte Neuronen verursacht. (A) repräsentative Bilder von positiven Aβ-Neuron gebeizt von Kongo-rot im Hippocampus und zerebrale kortikale. ()A1–B1) Hippocampus CA1 400 X; (A2–B2) Zerebralen Kortex 400 X. (A1–A2) Sham-betrieben Gruppe; (B1–B2) Compositing Aβ-behandelten Gruppe, zeigt mehr Aβ positive Zellen von Kongo-rot gefärbt. Maßstabsleiste = 10 µm, 400 X. (B) Positive Zahlen von Aβ-Neuronen befleckt von Kongo-rot in den Hippocampus und Hirnrinde, die unter einem Lichtmikroskop (400 X) gezählt wurden. Jeder Band stellt Mittelwert ± SEM von 9 Gesichtsfeldes von 3 unabhängigen Proben (n = 3). ** p < 0,01 vs. Sham betriebene Gruppe. Bitte klicken Sie hier für eine größere Version dieser Figur.
Compositing Aβ verursacht NFT Ablagerung in den Rattenneuronen:
Silbernitrat Färbung wurde verwendet, um die NFT-Abscheidung in Neuronen zu erkennen. Die Ergebnisse zeigen, dass Compositing Aβ spürbar die intrazelluläre NFT-Abscheidung bei der Ratte Hippocampus und Hirnrinde (Abbildung 9A) verursachen kann. Die positive Anzahl von Zellen mit NFT braun gefärbt durch Silbernitrat in den Hippocampus und Hirnrinde der zusammengesetzten Aβ-behandelten Gruppe sind 9,75 - und 4.82 - fache (p < 0,01) größer als die der Schein betrieben Gruppe (Abbildung 9B ). Dies zeigt, dass das Compositing Aβ Neuron NFT Aggregation bei Ratten erhöhen kann.
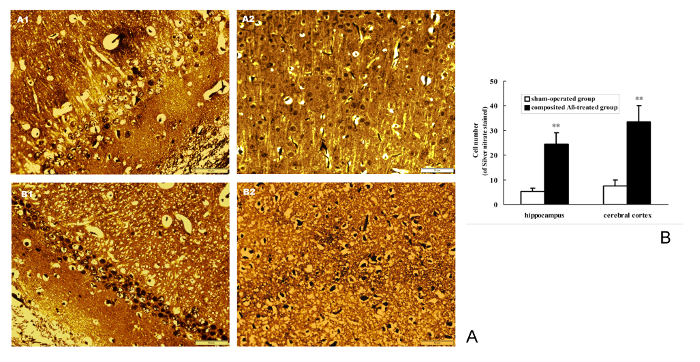
Abbildung 9 . Compositing Aβ NFT Aggregation in Ratte Neuronen verursacht. (A) repräsentative Bilder von positiven NFT Neuronen von Silbernitrat im Hippocampus und Hirnrinde befleckt. (A1–B1) Hippocampus CA1 400 X; (A2–B2) Zerebralen Kortex 400 X. (A1–A2) Sham-betrieben Gruppe; (B1–B2) Compositing Aβ-behandelten Gruppe. zeigt mehr NFT positive Zellen befleckt durch Silbernitrat in Compositing-behandelten Gruppe. Maßstabsleiste = 10 µm, 400 X. (B) Positive NFT Neuronen vieler durch Silbernitrat im Hippocampus befleckt und Hirnrinde, die unter einem Lichtmikroskop (400 X) gezählt wurden. Jeder Band stellt Mittelwert ± SEM von 9 Gesichtsfeldes von 3 unabhängigen Proben (n = 3). ** p < 0,01 vs. Sham betriebene Gruppe. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Es ist bekannt, dass der Verlust von lernen und Gedächtnis sind wichtige klinische Symptome bei AD Patienten2. Das hier beschriebene Verfahren ist eine in-Vivo -Methode AD zu studieren; Wir haben ein zuvor veröffentlichten Protokoll angepasst, die ein Medikament zur Linderung von Gedächtnisstörungen und neuronalen Verletzungen in eine Ratte Modell4getestet. Unser Protokoll liefert wichtige Details zu wertvollen Daten sowie eine hohe Überlebensrate der Tiere, die erfolgreich Betrieb, Gedächtnisstörungen, Neuron Verletzungen, Aβ Belastung und NFT Ablagerung, AD (im vorliegenden Experiment, die Überlebensrate zu imitieren modellieren und erfolgreiches Modell Betrieb mehr als 90 %). Diese Erfolgsmodell Ratten wurden verwendet, um ihre räumliche Gedächtnis mit dem Morris Wasser-Labyrinth-Test zu messen. Die Positionierung Navigation-Studie festgestellt, dass das Compositing Aβ Ratte Erwerb Gedächtnisstörungen verursachen kann; die Sonde Versuch festgestellt, dass das Compositing Aβ Ratte Merkfähigkeit verringern kann; und die Umkehrung Studie festgestellt, dass das Compositing Aβ Ratte Wiedererlernen Beeinträchtigung führen kann. Diese Morris Wasser Labyrinth Testdaten zeigen, dass die zusammengesetzten Aβ Ratte räumliche Gedächtnis hervorrufen kann. Injektion von Ratten Intracerebroventricularly mit Aβ25-35 in Kombination mit AlCl3 und TGF-β1 erstellt insgesamt eine machbare und glaubwürdig in Vivo AD-wie Tiermodell für das Labor.
Frühere Studien haben gezeigt, dass das Hirnvolumen bei Alzheimer-Patienten 10 % geringer als die von gesunden Personen. Die zerebrale Hemisphäre durch visuelle Beobachtung verschiedener verkümmert entnehmen. Der Grad der Kortikale Atrophie bezieht sich positiv auf das Gedächtnis Beeinträchtigung19. In der Histologie stören die große Anzahl der neuronenverlust und schwere morphologische Pathologie direkt die Memory-Funktion im AD Patienten20. In der vorliegenden Studie festgestellt Licht/Elektron mikroskopische Beobachtung, dass die Ratten mit Compositing Aβ mikroinjiziert dramatische Neuropathologische Veränderungen, einschließlich neuronenverlust und Störung der neuronalen und subzelluläre Struktur angezeigt. Dieses Ergebnis bestätigt die Ratte räumliche Gedächtnisstörung durch Compositing Aβ induziert und ist vergleichbar mit dem Zustand der Alzheimer-Patienten.
Es ist bekannt, dass das Gehirn Aβ Belastung und NFT Aggregation der wichtigsten Merkmale der Histopathogenic in AD gelten. Sie können zerstören die neuronale Struktur, stören die neuronale Signalisierung der neuronale Funktion zu stören und führen zu fortgeschrittenen Demenz17. Die vorliegende Tiermodell gefunden Aβ Belastung und NFT Aggregation im Gehirn, die mit den AD Patienten Zustand einverstanden sind. Daher die vorliegende Neuron Verletzungen bei Ratten durch Compositing Aβ induziert als Modell lässt sich um neuronale Pathologie und Behandlungsstrategie Anzeige zu studieren.
Im folgenden werden Beispiele von screening-Drogenwirkungen in AD Ratte Modelle: Zhao Et Al., berichtet, dass beide Flavonoide aus Helmkraut stammt und verlässt (SSF) und Helmkraut Barbata (SBF) Dämpfen kann, Ratte Gedächtnisstörungen und Apoptose induziert durch Compositing Aβ8,9. Guo Et Al., auch berichtet, dass SBF NFT Aggregation und Tau-Protein über Phosphorylierung an Ser199, Ser214, Ser202, Ser404 und Thr231 Seite zu hemmen und GSK-3β, CDK5 und PKA Protein- und mRNA Expression in zusammengesetzten Aβ-behandelten Ratten21 verringern können . Gleichzeitig, Shang Et Al., haben auch berichtet, dass SBF die Astrozyten und Mikroglia Verbreitung und niedriger Aβ1-40, Aβ1-42 unterdrücken kann, und β-Website APP Spaltung Enzym 1 (BACE1) mRNA Expression im Gehirn von Compositing Aβ22 Ratten. Basierend auf den oben genannten Ergebnissen, ist unsere Tiermodell über andere AD-ähnliches Modell, die weitere neuronale Funktion und Struktur Störung sind vorteilhaft.
Bezug auf andere AD-ähnliches Modell einzelne Intracerebroventricular Injektion von Aβ Ratten kann dazu führen, dass Ratte Gedächtnisdefizite, neuronenverlust und Neurogliocyte Verbreitung, aber kann oder haben keine Aβ und NFT Ablagerung23. Ratten, hochdosierte Al ausgesetzt scheinen eine hohe Erfolgsquote, Mimik AD und eine kostengünstige Tiermodell mit Gedächtnisstörungen, neuronenverlust, Neurogliocyte Verbreitung und senile Plaques (SP) und NFT Aggregation im Gehirn zu haben. Doch die hohe Dosis von Al Ratte Leber Verletzungen verursachen und Magersucht, begleitet mit verringert Gewicht24. Die alte Ratte ist eine weitere AD-ähnliches Modell. Die gealterten Ratten zu demonstrieren, Gedächtnisstörungen, krankhafte Veränderungen der neuronalen Struktur/Unterkonstruktion, Lipofuszin Ablagerung, aber ohne Aβ Belastung und NFT Aggregation. Ratten von mehr als 24 Monaten des Alters gelten im Alter für dieses Modell und daher es erfordert eine längere Fütterung und dadurch die Kosten höher17,25. SAMP8 und APP Transgene Mäuse sind die engsten Mimik, AD, und sie sind die idealen Modelle für die Untersuchung von AD. Aber beide Tiermodelle sind höhere Preise und sind nur in der Labor-26,-27. Verglichen mit den oben genannten Tiermodellen, hat unser Modell der zusammengesetzten Aβ-behandelten Tiermodell eine geringere Kosten und hohe Leistung, so dass es ein ideales Werkzeug für die Untersuchung von AD.
Fazit: Intracerebroventricular Injektion von Aβ25-35 kombiniert mit AlCl3 und TGF-β1, Ratten bietet eine wertvolle in Vivo Tiermodell um besser zu verstehen, die Beeinträchtigung des räumlichen Gedächtnisses, neuronalen Verletzungen Aβ Belastung und NFT Ablagerung zugrunde liegenden AD. Dieses Modell bietet eine schnelle und relativ einfaches experimentelle Protokoll mit einem hohen Tier überleben Rate und hohe Modell erfolgreich Rate der Betrieb sowie eine hohe Rate der Vervielfältigung, die erwies sich als wirtschaftlicher. Die vorliegende Tiermodell ist ein wirksames Modell, AD zu imitieren und kann weiter selbst überprüfen, indem wird verwendet, um verschiedene andere Krankheiten imitieren.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Unterstützt wurde das Projekt von der Hebei Provinz Natural Science Foundation (Nr. C2009001007, H2014406048), dem Hebei Provincial Administration der traditionellen chinesischen Medizin (Nr. 05027) und das wichtige Thema Bauprojekt der Hebei Provinz College, China.
Materialien
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley rat | Beijing Vital River Laboratory Animal Technology Co., Ltd, China | SCXK(Jing) 2012-0001 | 300–350 g |
| Morris water maze | Chinese Academy of Medical Sciences and Peking Union Medical Research Institute, China | No | |
| Movable small animal anesthesi | RWD Life Science Co., Ltd. China | R580 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co., Ltd. China | 68001 | |
| Flexible bone drill | Shanghai Soft Long Technology Development Co., Ltd. China | BW-sD908 | |
| Transmission electron microscope | Japan Co., Ltd. Japan | JEM-1400 | |
| Two channel microinjection pump | RWD Life Science Co., Ltd. China | RWD202 | |
| EM microtome | Hitachi Co., Ltd. China | H-7650 | |
| Dummy cannula | RWD Life Science Co., Ltd. China | 62001 | 0.D.0.64×I.D.0.0.45mm/M3.5 http://www.rwdls.com/English/Product/3985102014.html |
| Guide cannula | RWD Life Science Co., Ltd. China | 62101 | 0.D.0.40mm/M3.5 |
| Internal cannula | RWD Life Science Co., Ltd. China | 62201 | 0.D.0.41×I.D.0.25mm/ M3.5 M3.5 |
| Tighten the nut | RWD Life Science Co., Ltd. China | 62501 | 0.D.5.5mm/L7.5mm/M3.5 |
| Fixing screw | RWD Life Science Co., Ltd. China | 62514 | M1.2×L2.0mm(100BAO) |
| The screwdriver | RWD Life Science Co., Ltd. China | 62999 | 45*1mm |
| PE Tubing | RWD Life Science Co., Ltd. China | 62302 | |
| Amyloid beta 25-35 | Sigma Aldrich Co. USA | SCP0002-5MG | |
| Recombinant human transforming growth factor-β1 | PeproTech Inc. USA | 100-21 | |
| Aluminium trichloride | Tianjin Kemiou Chemical Reagent Co., Ltd. China | 3011080 | |
| Congo red | Tianjin Kemiou Chemical Reagent Co., Ltd. China | 3010016 | |
| Silver nitrate | Sinopharm Chcmical Reagent Co., Ltd. China | 20150720 | |
| Zinc phosphate dental cement | Dental Material of Factory Shanghai Medical Instruments Co., Ltd. China | 201311 |
Referenzen
- Robinson, M., Lee, B. Y., Hane, F. T. Recent Progress in Alzheimer's Disease Research, Part 2: Genetics and Epidemiology. J. Alzheimers. Dis. , (2017).
- Hane, F. T., Lee, B. Y., Leonenko, Z. Recent Progress in Alzheimer's Disease Research, Part 1: Pathology. J. Alzheimers Dis. , (2017).
- Perl, D. P. Neuropathology of Alzheimer's disease. Mt. Sinai. J. Med. 77, 32-42 (2010).
- Wu, X. G., Wang, S. S., Miao, H., Cheng, J. J., Zhang, S. F., Shang, Y. Z. Scutellaria barbata flavonoids alleviate memory deficits and neuronal injuries induced by composited Aβ in rats. Behav. Brain Funct. 12, 33-43 (2016).
- Guo, K., Wu, X. G., Miao, H., Cheng, J. J., Cui, Y. D., Shang, Y. Z. Regulation and mechanism of Scutellaria bartata flavonoids on apopotosis of cortical neurons and cytochondriome induced by composited Aβ. Chin Hosp Pharm J. 35, 1994-1999 (2015).
- Guo, K., Miao, H., Wang, S. S., Cheng, J. J., Shang, Y. Z. Scutellaria barbata flavonoids inhibits NFT aggregation and regulatory mechanism in rats induced by composited Aβ. Chin. J. Pathophysio. 32, 2147-2156 (2016).
- Hou, X. C., et al. Scutellaria Barbata flavonoids inhibit the brain's Aβ and NFT abnormal generation and affect the related enzymes expression in rats induced by composited Aβ. Chin J New Drugs. , (2017).
- Zhao, H. X., Guo, K., Cui, Y. D., Wu, X. G., Shang, Y. Z. Effect of Scutellaria barbata flavonoids on abnormal changes of Bcl-2, Bax, Bcl-xL and Bak protein expression in mitochondrial membrane induced by composite Aβ25-35. Chin J Pathophysiol. 30, 2262-2266 (2014).
- Cheng, J. J., et al. Flavonoid extract from Scutellaria stem and leaf attenuates composited Aβ- induced memory impairment and apoptosis in rats. Chin.J. New Drugs. 25, 2627-2636 (2016).
- Fang, F., Yan, Y., Feng, Z. H., Liu, X. Q., Wen, M., Huang, H. Study of Alzheimer's disease model induced multiple factors. Chongqing Med. 36, 146-151 (2007).
- . Regulations for the Administration of Affairs Concerning Experimental Animals. The Ministry of Science and Technology of the People's Republic of China. , 10-31 (1988).
- Bao, X. M., Shu, S. Y. . The stereotaxic atlas of the rat brain. , (1991).
- Morris, R. Developments of a water-maze procedure for studying spatial learning in the rats. J. Neurosic. Methods. 11, 47-60 (1984).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Yu, J. C., Liu, C. Z., Zhang, X. Z., Han, J. X. Acupuncture improved cognitive impairment caused by multi-infarct dementia in rats. Physiol. & Behav. 86, 434-441 (2005).
- Shang, Y. Z., Miao, H., Cheng, J. J., Qi, J. M. Effects of amelioration of total flavonoids from stems and leaves of Scutellaria baicalensis Georgi on cognitive deficits, neuronal damage and free radicals disorder induced by cerebral ischemia in rats. Biol. Pharm. Bull. 29, 805-810 (2006).
- Song, H. R., Cheng, J. J., Miao, H. J., Shang, Y. Z. Scutellaria flavonoid supplementation reverses ageing-related cognitive impairment and neuronal changes in aged rats. Brain Inj. 23, 146-153 (2009).
- Wang, M., et al. Novel RAS inhibitors Poricoic Acid ZG and Poricoic Acid ZH attenuate renal fibrosis via a Wnt/β-Catenin patheway and targeted phosphorylation of smad3 signaling. J Agric Food Chem. 66, 1828-1842 (2018).
- Pini, L., et al. Brain atrophy in Alzheimer's Disease and aging. Ageing Res. Rev. 30, 25-48 (2016).
- Ubhi, K., Masliah, E. Alzheimer's disease: recent advances and future perspectives. J. Alzheimers Dis. 33, 85-94 (2013).
- Guo, K. . Scutellaria barbata flavonoids inhibite NFTs aggregation, tau protein phosphorylation and the regulated mechanism of related enzymes in rats induced by composited Aβ. , (2016).
- Shang, Y. Z. . Effects and Mechanism of Scutellaria Barbata Flavonoids on Rat's Memory Impairment Induced by Compound Aβ25-35. , (2013).
- Zussy, C., et al. Alzheimer's disease related markers, cellular toxicity and behavioral deficits induced six weeks after oligomeric amyloid-β peptide injection in rats. PLoS One. 8, 1-20 (2013).
- Walton, J. R. Aluminum involvement in the progression of Alzheimer's disease. J. Alzheimers Dis. 35, 7-43 (2013).
- Neils-Strunjas, J., Groves-Wright, K., Mashima, P., Harnish, S. Dysgraphia in Alzheimer's disease: a review for clinical and research purposes. J. Speech Lang Hear Res. 49, 1313-1330 (2006).
- Morley, J. E., Farr, S. A., Kumar, V. B., Armbrecht, H. J. The SAMP8 mouse: a model to develop therapeutic interventions for Alzheimer's disease. Curr Pharm Des. 18, 1123-1130 (2012).
- Puzzo, D., Gulisano, W., Palmeri, A., Arancio, O. Rodent models for Alzheimer's disease drug discovery. Expert Opin Drug Discov. 10, 703-711 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten