Method Article
Standardisierte Methode für Hochdurchsatz-Sterilisation von Arabidopsis Samen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Ziel dieser Studie war es, die Auswirkungen der Bleichmittel und Chlor-Gas-Sterilisation auf die Keimung der Samen von einer Reihe von Arabidopsis Genotypen auf sterile Medien gewachsen zu bestimmen. Optimierte Sterilisation Protokolle wurden entwickelt, um das Wachstum von mikrobiellen Verunreinigungen gleichzeitig zufriedenstellend Samen überleben zu verhindern.
Zusammenfassung
Arabidopsis thaliana (Arabidopsis) Sämlinge müssen oft auf sterile Medien angebaut werden. Dies erfordert eine vorherige Samen Sterilisation das Wachstum von mikrobiellen Verunreinigungen auf der Oberfläche der Samen zu verhindern. Derzeit sind Arabidopsis Samen sterilisiert, mit zwei unterschiedlichen Sterilisationstechniken in Bedingungen, die unterscheiden sich leicht zwischen Labors und nicht standardisiert wurden, häufig mit dem Ergebnis nur teilweise effektive Sterilisation oder übermäßige Samen Sterblichkeit. Die meisten dieser Methoden sind auch nicht leicht skalierbar, um eine große Anzahl von Samen Linien der verschiedenen Genotypen. Technologien für Hochdurchsatz-Analyse von Arabidopsis weiterhin vermehren, werden standardisierte Techniken für die große Anzahl von Samen der verschiedenen Genotypen Sterilisierung unerlässlich für die Durchführung derartiger Experimente immer. Die Beantwortung einer Reihe von Arabidopsis Linien zwei verschiedene Sterilisationstechniken wurde anhand des Samen Keimrate und das Niveau der Verunreinigung des Saatgutes mit Mikroben und anderen Krankheitserregern. Die Behandlungen enthalten verschiedene Konzentrationen der Sterilisierung von Agenten und Zeiten der Exposition, kombiniert, um optimale Bedingungen für Arabidopsis Samen Sterilisation zu bestimmen. Optimierte Protokolle wurden für zwei verschiedene Sterilisationsverfahren: Bleach (Flüssigkeit-Phase) und (Cl2) Chlorgas (Dampf-Phase), beide was zu hohen Keimungsraten und minimale mikrobieller Kontamination. Das Dienstprogramm dieser Protokolle wurde durch die Erprobung von Wildtyp und Mutanten Samen mit einer Reihe von Keimen Potenziale dargestellt. Unsere Ergebnisse zeigen, dass Samen wirksam sterilisiert werden können mit beiden Methoden ohne übermäßige Samen Mortalität, obwohl nachteilige Auswirkungen der Sterilisation für Samen mit niedriger als optimale Keimung Potenzial beobachtet wurden. Darüber hinaus wurde eine Formel entwickelt, um Forscher luftdichten Behältern in verschiedenen Größen die standardisierte Chlor Gas Sterilisationsbedingungen zuweisen können. Die hier beschriebenen Protokolle ermöglichen einfache, effiziente und kostengünstige Samen Sterilisation für eine große Anzahl von Arabidopsis Linien.
Einleitung
Arabidopsis thaliana (Arabidopsis) ist eine erstklassige Modellorganismus für Grundlagen- und angewandte Forschung im Werk Biologie1,2,3. Während Standardbedingungen für Arabidopsis Wachstum gut etablierte4wurden, wurde die Wirkung der Samen Sterilisation auf Saatgut Lebensfähigkeit nicht rigoros getestet. Feste Medien in Platten oder Kisten werden routinemäßig verwendet, um Wachstum von Arabidopsis Sämlinge für viele experimentelle Anwendungen, wie z. B. Identifizierung von homozygot letale Mutanten in einer Trennung Bevölkerung, Beobachtung von schießen und Wurzel Phänotypen zu früh zu erleichtern Stufen, Isolierung von Pathogen-freies Gewebe, Sammlung von großen Mengen an Sämling Gewebe, Auswahl der Transformanten oder resistente Pflanzen und Bewertung der Keimung1,2,3,4 . Samen von Pflanzen in einem Gewächshaus geerntet oder Wachstum Kammer gelegentlich mit Mikroorganismen und Staub verunreinigt sind. Wachstum von Arabidopsis Sämlinge auf verschiedene Arten von sterilen Medien erfordert vorherige Samen Sterilisation, mikrobielle Verunreinigungen wie Pilze und Bakterien auf der Oberfläche der Samen zu entfernen. Die Verwendung eines wirksamen Samen Sterilisation Regimes ist entscheidend für ein ausgewogenes Verhältnis von hohen Keimung, minimale Verunreinigung und kräftiges Pflanzenwachstum.
Die zwei am häufigsten verwendeten Methoden zur Arabidopsis Samen Sterilisation basieren auf kommerzielle Bleichmittel (Flüssigkeit-Phase) und Chlor-Gas (Dampf-Phase). Verschiedene Verfahren sind eingesetzt worden, für beide Flüssigkeit-Phase Sterilisation1,4,5,6,7,8,9 , 10 und Dampfphase Sterilisation von Arabidopsis Samen8,10,11,12,13,14,15 ,16. Während diese Verfahren wirksam bei Saatgut Sterilisation der eingesetzten Genotypen zu erreichen gewesen, wurde jedoch eine detaillierte Analyse der Auswirkungen der verschiedenen Sterilisation Behandlungen auf die Samen der verschiedenen Genotypen nicht berichtet. Daher ist die Optimierung dieser Sterilisation Verfahren erforderlich, um die Bedingungen zu definieren, in denen effiziente Sterilisation mit hohe Keimrate kombiniert wird.
The Arabidopsis Biological Resource Center (ABRC) ist einzigartig positioniert, um (a) Saatgut Lebensfähigkeit einer Vielzahl von unterschiedlichen Genotypen in der Sammlung und (b) nutzen Sie die Qualitätskontrollverfahren intern angewendet und als Reaktion auf Nutzer-Feedback zu testen über die Keimung der Samen. Die Ziele der hier vorgestellten Experimente waren die Auswirkungen der verschiedenen Sterilisationsverfahren auf die Keimung der Samen von einer Reihe von Arabidopsis Genotypen zu bestimmen. Optimierte Sterilisationen, die hohen Keimungsraten führen und gleichzeitig minimale Pathogenkontamination präsentieren für Bleichmittel und Chlor-Gas-Sterilisation.
Protokoll
1. Vorbereitung von 1 x Medium Murashige und Skoog (MS)
- hinzufügen 4.31 g MS basale Salzgemisch, 10 g Saccharose und 0,5 g 2-(N-Morpholino) Ethanesulfonic Säure (MES), ein Becher mit 0,8 L destilliertes Wasser und unter Rühren auflösen. Prüfen Sie und einstellen Sie der pH-Wert bis 5,7 mit 1 M Kalilauge (KOH). Hinzufügen von destilliertem Wasser zu 1 L.
- Teilen der Medien in zwei 1-Liter-Flaschen, 500 mL. Jede Flasche 5 g Agar-Agar hinzufügen. Halten Sie den Deckel lose.
- Autoklaven für 20 min bei 121 ° C, 15 Psi mit magnetischen Stir Bar in der Flasche.
- Nach dem Autoklavieren, stellen Sie die Flaschen auf einem Teller Rühren bei niedriger Drehzahl und ermöglichen das MS Medium auf 45-50 ° C abkühlen lassen (bis die Flasche mit bloßen Händen gehalten werden kann).
- Ausgehend von diesem Schritt, alle Schritte unter sterilen Bedingungen in einem Laminar-Flow-Haube. Hinzufügen von 500 µL Gamborg ' s Vitamin Lösung zu jeder Flasche und rühren Sie das MS-Medium, um die Vitamin-Lösung gleichmäßig zu verteilen.
- Platten, etwa die Hälfte der Tiefe der Platte decken genügend Medien gießen.
- Erlauben die Platten abkühlen bei Raumtemperatur ca. 1 h nach dem Agar zu erstarren lassen.
Hinweis: Wenn die Platten nicht sofort verwendet werden, wickeln Sie sie in Kunststoff und bei 4 ° C (Kühlschranktemperatur) zu speichern. Überdachte Platten, Boxen oder Rohre mit erstarrtem Agar können für mehrere Wochen bei 4 ° C in einem luftdichten Behälter gespeichert werden.
2. Sterilisation von Arabidopsis Samen mit Bleichmittel
- bereiten die MS Platten gemäß § 1 des Protokolls. Autoklaven 100 mL destilliertem Wasser zur gleichen Zeit wie der MS-Media. Verwenden Sie diese später als Spülwasser und zu helfen, die Samen zu unterbrechen um Beschichtung unterstützen.
Hinweis: Falls gewünscht, kann 0,8 % Agar Mischung (w/V) (z.B. Phytagar) auch autoklaviert in diesem Schritt werden. Die Agar-Mischung für destilliertes Wasser ersetzt werden kann, während der Beschichtung (Schritt 2.5.3.). Die zusätzliche Viskosität der Agar-Mischung macht es einfacher, Raum Samen auf der Platte oder Anlage in Zeilen ggf.. - Bereiten Sie 50 % (V/V) Bleichen Lösung zum Sterilisieren der Samen verwendet werden. Um Bleichmittel zu verdünnen, fügen Sie 100 mL von Bleichmittel zu 100 mL destilliertem Wasser hinzu. Das Bleichmittel-Lösung 50 µL Tween 20 Spülmittel hinzufügen.
Hinweis: Vorbereitete Bleichmittel-Lösung kann gelagert werden bis zu einem Monat, solange es nur unter sterilen Bedingungen geöffnet wird. - Aliquoten 100 Samen zu einem Microcentrifuge Schlauch 1,5 mL.
- Sterilisieren Sie die Samen mit einer 50 %-Chloridlösung.
- In einem Laminar-Flow-Haube, 500 µL 50 % Bleichmittel-Lösung hinzufügen den Microcentrifuge Schlauch, die Samen enthält. Tippen Sie auf der Unterseite des Rohres, die Samen in das Bleichmittel-Lösung auszusetzen.
Hinweis: Alternativ ein Rotator oder Plattform Shaker verwendet werden die Samen suspendiert halten.
- In einem Laminar-Flow-Haube, 500 µL 50 % Bleichmittel-Lösung hinzufügen den Microcentrifuge Schlauch, die Samen enthält. Tippen Sie auf der Unterseite des Rohres, die Samen in das Bleichmittel-Lösung auszusetzen.
- Spülen Sie das Bleichmittel-Lösung aus der Tube.
- Nach 10 min, entfernen Sie das Bleichmittel-Lösung aus den Microcentrifuge Schlauch mit Hilfe einer Pipette oder eine Absauganlage mit einer Pipettenspitze am Ende ausgestattet.
- Hinzufügen 500 µL sterilem destilliertem Wasser am Rohr. Verschließen Sie das Röhrchen und kehren Sie um zu mischen. Lassen Sie Samen auf den Boden des Röhrchens abrechnen. Entfernen Sie Samen auf den Boden des Röhrchens niedergelassen haben, sorgfältig das Bleichmittel-Lösung durch pipettieren. Wiederholen Sie diesen Vorgang Spülprozess 6mal.
- Fügen Sie 1 mL autoklaviert destilliertem Wasser am Rohr, die Samen auszusetzen.
- Platte die sterilisierten Samen auf MS Platten.
- In einem Laminar-Flow-Haube, beschriften Sie die Unterseite der Platte mit dem Namen und dem aktuellen Datum MS.
- Gießen Sie die Samen aus den Microcentrifuge Schlauch auf die MS-Platte. Verbreiten Sie die Samen um die MS-Platte mit einer sterilen, Einweg-Impfkeimen Schleife oder einer sterilen Pipettenspitze.
Hinweis: Wenn Samen sind in Reihen gesät werden, eine Pipette mit 200 µL Spitze lässt sich individuell Samen in die gewünschten Positionen zu platzieren. Um den Fluss der Samen zu verbessern, kann zum Jahresende die Pipettenspitze von 3-5 mm mit einer Schere abgeschnitten werden. Eine unangebrachte Samen oder Cluster von Samen können dann neu positioniert werden oder getrennt, mit einer sterilen Einweg-Impfkeimen Schleife. - Legen Sie die MS-Platte auf der Rückseite des die Laminar-Flow-Haube mit dem Deckel halb geschlossen. Das überschüssige Wasser von der MS-Platte verdunsten lassen.
- Setzen Sie den Deckel auf der MS-Platte. Siegel die MS-Platte durch das Einwickeln der Platte mit mikroporösen Papier chirurgische tape (siehe die Tabelle der Werkstoffe).
3. Sterilisation von Arabidopsis Saatgut mit Chlorgas
- bereiten die MS Platten gemäß § 1 des Protokolls. Autoklaven 100 mL destilliertem Wasser zur gleichen Zeit wie der MS-Media; Dies wird später verwendet, um dazu beitragen, die Samen zur Beschichtung Unterstützung auszusetzen.
Hinweis: Falls gewünscht, kann 0,8 % Agar Mischung (w/V) (z.B. Phytagar) auch autoklaviert in diesem Schritt werden. Die Agar-Mischung für destilliertes Wasser ersetzt werden kann, während der Beschichtung (Schritt 3.6.2.). Die zusätzliche Viskosität der Agar-Mischung macht es einfacher, Raum Samen auf der Platte oder Anlage in Zeilen ggf.. - Vor Beginn der Sterilisation, berechnen die Mengen an Bleichmittel und Salzsäure (HCl) erforderlich, um produzieren Chlorgas.
- Berechnen Sie die Menge an HCl benötigt, um die 6,1 % Cl 2 erforderlich für die Sterilisation produzieren.
- Verwenden Sie die folgende Formel:
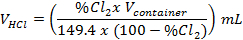
mit 7.000 mL als das Volumen des Behälters Sterilisation und 6,1 % Cl 2; errechnet sich das Volumen der HCl zu 3 mL.
Hinweis: Eine Tabelle, die für die Durchführung der Berechnung für verschiedene Volumina der Container und % Cl 2 programmiert als ergänzende Tabelle1 vorgesehen ist.
- Aliquoten 100 Samen in 0,5 mL Microcentrifuge Schlauch. Schließen Sie die Kappen für jedes Fläschchen, legen Sie die Fläschchen in einem Kunststoff-Rack und beiseite stellen.
Hinweis: Samen können für längere Zeit an dieser Stelle gespeichert werden, solange sie in einem ordnungsgemäßen Zustand befinden. Lagerbedingungen finden Sie in Abschnitt 3.3.2 des Protokolls von Rivero und Kollegen 4. 96-Well-Plattenformat kann auch verwendet werden. - Bereiten Sie die Materialien notwendig, Chlor-Gas-Sterilisation durchzuführen.
- ihre Speicherorte Bleichmittel und HCl einzuholen.
- Schnitt ein Streifen von großen Paraffin film (siehe die Tabelle der Materialien), im Schritt 3.5.3 verwenden., Sterilisation Containers zu versiegeln.
- Legen Sie die Kunststoff-Behälter mit Deckel, in dem die Sterilisation in einer Dampfhaube stattfinden wird. Die Obergrenzen für die Saatgut-Fläschchen öffnen und legen Sie das gesamte Saatgut Rack innerhalb der Kunststoffbehälter.
- Chlor-Gas-Sterilisation bei Raumtemperatur durchführen.
Achtung: Arbeiten Sie mit Bleichmittel und Säure getrennt. Lassen Sie sich nicht entweder Flasche verschlossen, um das Risiko von Leckagen. Verwenden Sie geeignetsten persönliche Schutzausrüstung (PSA) einschließlich Handschuhe und einen Laborkittel. Wenn entweder Bleichmittel oder Säure auf Handschuhe spritzt, ändern Sie Handschuhe vor dem Umgang mit anderen Materialien. Entfernen Sie immer Handschuhe in der Dunstabzugshaube bei Bleichmittel oder Säure Kontamination.- Eine 250 mL-Becherglas im Inneren des Behälters und 100 mL Bleichmittel.
Hinweis: Die Reaktion zwischen HCl und Bleichmittel erfordert mindestens 22 Bänden Übermaß an Bleichmittel. Die Reaktion wird die HCl zu konsumieren und bleichen durch die Freigabe von Cl 2 Gas mit Natriumchlorid (NaCl) und Wasser als Nebenprodukte. Mit einem großen Überschuss von Bleichmittel ermöglicht den Verbrauch von zusätzlichen HCl dährend der Entlüftung Periode, die verringert die Menge an Natriumbicarbonat (Nahco3 3) benötigt, um die Lösung für die Entsorgung neutralisieren.
Vorsicht: Der Becher ist mindestens zweimal das flüssige Gesamtvolumen des Bleiche + HCl. Dies verhindert Spritzer Flucht das Becherglas während der nächste Schritt, die Samen beschädigen, Kleidung bleichen oder exponierten Haut verbrennen können. - Verleihen den Becher mit der Bleiche 3 mL HCl.
Achtung: Die erste Reaktion entstehen Bläschen, vor allem bei Gaskonzentrationen 6,1 % höher. Ein lang-sleeved Kittel ist für diesen Schritt notwendig. - Schließen die Sterilisation-Container und verschließen Sie diese sofort mit Paraffin Film.
- Überwachung des Sterilisation Containers während der Sterilisation Zeit Gas Anhäufung sicherzustellen, die Anhäufung von Chlorgas als ein schwaches gelb Dunst im Inneren des Behälters sichtbar sein soll.
Achtung: Überprüfen Sie in regelmäßigen Abständen Sterilisation Containers um sicherzustellen, dass der Druck im Inneren des Deckels nicht unseated hat oder paraffin Film. Wenn der Deckel hat abgewählt oder Paraffin-Film hat Lose kommen, schließen Sie den Deckel und sorgfältig wickeln Sie den Behälter mit einer zusätzlichen Schicht von Paraffin Film. - Nach 1 h-Sterilisation, öffnen Sie den Container durch Entfernen des Paraffin-Films und Öffnen des Deckels an der Ecke. Den Container, vent für 3 h die Reaktion und das Chlorgas beseitigen lassen.
- Schließen die Kappen von den alle Mikrozentrifugenröhrchen im Samen Rack.
Hinweis: Sterilisierte Samen können gespeichert werden, bis zum Zeitpunkt der Galvanik, solange sie in trockenem Zustand gespeichert werden. - Entfernen Sie die Samen-Ständer und legen Sie sie in eine laminare Strömung Kapuze.
- Neutralisieren Chlor Gas Reaktion
- Add 1,5 g Nahco3 3 Pulver langsam in das Becherglas mit dem Bleichmittel/HCl-Lösung und rühren mit einem Glasstab Nahco3 3 in Lösung aufzulösen. Fügen Sie weitere hinzu Nahco3 3 bis Kohlendioxid (CO 2) Gasblasen bilden aufgehört haben.
Achtung: Fügen Sie langsam um Spritzer zu vermeiden. Verwenden Sie geeignete PSA einschließlich Handschuhe und einen Laborkittel. - Testen Sie den pH-Wert der Lösung mit pH-Streifen oder ein pH-Meter. Fügen Sie zusätzliche Nahco3 3, bei Bedarf kann bis der pH-Wert der Lösung neutral (pH 7,0). An dieser Stelle die Lösung aus der Dunstabzugshaube entfernt und gemäß aller geltenden Entsorgung Richtlinien entsorgt werden kann.
Achtung: Wenn Geruch bei der Entsorgung bemerkt wird, dann die Lösung sollte sofort zurückgegeben werden, der Dampfhaube.
- Add 1,5 g Nahco3 3 Pulver langsam in das Becherglas mit dem Bleichmittel/HCl-Lösung und rühren mit einem Glasstab Nahco3 3 in Lösung aufzulösen. Fügen Sie weitere hinzu Nahco3 3 bis Kohlendioxid (CO 2) Gasblasen bilden aufgehört haben.
- Eine 250 mL-Becherglas im Inneren des Behälters und 100 mL Bleichmittel.
- Platte die sterilisierten Samen auf MS Platten.
- In einem Laminar-Flow-Haube, beschriften Sie die Unterseite der Platte mit dem Namen und dem aktuellen Datum MS.
- Hinzufügen 500 µL von sterilisierten destilliertem Wasser auf jeder Microcentrifuge Schlauch, die Samen auszusetzen. Samen auf der MS Teller gießen und verbreiten die Samen gleichmäßig um die Platte mit einer sterilen, Einweg-Impfkeimen Schleife oder einer sterilen Pipettenspitze.
- Legen Sie die MS-Platte auf der Rückseite des die Laminar-Flow-Haube mit dem Deckel halb geschlossen. Das überschüssige Wasser von der MS-Platte verdunsten lassen.
- Setzen Sie den Deckel auf der MS-Platte. Die MS Dichtplatte durch Umwickeln der Platte mit mikroporösen chirurgische Papierband.
4. Wachstum von Arabidopsis auf MS Platten
- legen Sie die Platten mit den Deckel oben für drei Tage bei 4 ° c und Umgebungsfeuchte.
Hinweis: Dieser Vorgang wird als Schichtung und dient dazu, die Keimung der einzelnen Samen synchronisieren. - Die Platten auf das Wachstum Umfeld übertragen.
- Pflegen Temperatur bei 23 ° C und Lichtintensität bei 120-150 µmol/m 2 s mit 16 h Licht / dunkel 8 h Photoperiode. Teller flach in der Umgebung wachsen mit dem Deckel auf der Oberseite zu platzieren, damit die Wurzeln in das Medium wachsen.
- Lassen Sie die Sämlinge auf Platten für 8 Tage wachsen.
Hinweis: Eine 8-tägige Vegetationsperiode kann spät keimenden Samen zu keimen. Platten können frühestens 8 Tage gewertet werden, ob alle Samen gekeimt haben. - Punkten die Keimrate.
- Rekord die Anzahl der Samen, die gekeimt haben und die nicht gekeimt haben. Keimrate zu berechnen, indem die Anzahl der Samen, die gekeimt haben durch die Gesamtzahl der Samen auf der Platte.
Hinweis: Keimung wird gezählt, wenn die Keimwurzel außerhalb der Samenschale projiziert hat und die zwei Keimblätter sichtbar sind. - Auch die Anzahl der Samen von Form, um die Wirksamkeit der Sterilisationsbedingungen betroffen.
- Rekord die Anzahl der Samen, die gekeimt haben und die nicht gekeimt haben. Keimrate zu berechnen, indem die Anzahl der Samen, die gekeimt haben durch die Gesamtzahl der Samen auf der Platte.
Ergebnisse
Arabidopsis Samen aus eine offene Feld, im Gewächshaus oder Wachstum Kammer sind manchmal durch verschiedene Mikroorganismen wie Pilze und Bakterien1,4kontaminiert. Keimende Samen auf sterile Medien kann besonders schwierig wegen der Verschmutzung der Platten, vor allem, wenn die Versorgung mit Saatgut begrenzt ist. Das optimierte Protokoll für Bleichmittel und Chlor Gassterilisation, deren Ergebnisse nachfolgend präsentiert werden, dieses Problem minimiert und bewahrt die Lebensfähigkeit von Samen für Anwendungen mit hohem Durchsatz.
Auswirkungen der Bleichmittel Sterilisation auf das Keimen der Samen von Arabidopsis Col-0
Bleach ist der am häufigsten verwendeten Agent für Saatgut Sterilisation in zahlreichen Pflanzenarten. Die optimale Konzentration der Sterilisation-Agent und die Belichtungszeit variiert zwischen den Arten. Eine Reihe von Protokollen beschäftigt mit Bleichmittel für die Sterilisation von Arabidopsis Samen1,4,5,6,7,8,9 , 10. vier unterschiedliche Konzentrationen von Bleichmittel mit fünf verschiedenen Belichtungszeit Perioden wurden getestet und die Ergebnisse präsentieren wir Abbildung 1. Die Behandlungen wurden auf Columbia Wildtyp (Col-0) Samen angewendet. Die Wirkung des Bleiche Konzentration auf das Keimen der Samen Col-0 variiert je nach der Sterilisation beweist eine signifikante Wechselwirkung zwischen Bleichmittel Konzentration und Zeit der Sterilisation (Abbildung 1, P < 0,001, ANOVA-Analyse der Varianz).
Behandlungen mit allen Chlorid-Konzentrationen führte in den Experimenten mit Sterilisation Zeit zwischen 5 und 10 min ebenso hohe Keimrate von Col-0 Samen (Abbildung 1). Hohen Keimungsraten wurden auch Haushaltsbleiche Konzentrationen von 40 % und 50 % für alle Sterilisation Zeiten beobachtet. Behandlungen mit 80 % und 100 % Bleichmittel für Zeiträume von mehr als 10 min führte zu einer signifikanten Abnahme der Keimrate im Vergleich zu den durchnässten verkürzt (P < 0,01, ANOVA). Darüber hinaus für 80 % und 100 % Behandlungen für 20 min Chlorid, Keimung wurde signifikant verringert im Vergleich zu den entsprechenden 40 % und 50 % Bleichmittel Behandlungen (P < 0,001, ANOVA).
Samen angezeigt verschiedenen Ebenen der bleichen und Ausdörrende Verwendung hohe Chlorid-Konzentrationen für 15 Minuten oder länger. Zusätzlich zu den relativ hoch (bis zu 32 %) Samen Sterblichkeit, gekeimte Samen sterilisiert in diesen Bedingungen zeigte oft Wachstumsstörungen, spiegelt sich in ein Versagen der Keimblätter und Hypocotyle, zu entfalten und zu verlängern, was zu Entwicklungsstörungen Verhaftung. Die meisten Behandlungen (14 von 20) wurden völlig Schimmel-frei, was zu Schimmel Ebene Gesamtdurchschnitt von 0,21 % ± 0,003 (Tabelle 1).
Eine Behandlung mit 50 % Bleichmittel und einer Einwirkzeit von 10 min wurde als das beste Sterilisation Regime ausgewählt, weil es hohe Keimung Prozentsatz mit guten Hemmung des Wachstums der Oberfläche Pathogen kombiniert. Diese Behandlung wurde ausgewählt, um die Wirkung der Bleichmittel Sterilisation auf verschiedenen Mutante Linien zu testen, wie unten beschrieben.
Auswirkungen von Chlor-Gas-Sterilisation auf das Keimen der Samen Col-0
Um Chlor Gas Sterilisationsbedingungen zu optimieren, wurden drei unterschiedliche Konzentrationen von Chlorgas zur Col-0 Samen für zwei Zeiträume (Tabelle 2) zu sterilisieren. Die Gaskonzentration war das Volumen der konzentrierten HCl und das Volumen des Behälters Sterilisation unter Verwendung der folgenden Gleichung berechnet:
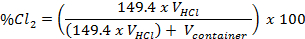
Diese Gleichung wurde abgeleitet, mit dem idealen Gas-Gesetz angenommen, 12,3 M HCl, einer Temperatur von 23 ° C und standard atmosphärischen Druck von 101,3 kPa.
Die Wirkung von Chlor-Gas-Konzentration auf das Keimen der Samen Col-0 wurde gezeigt, dass die Zeit der Sterilisation davon abhängen, wie durch eine signifikante Wechselwirkung zwischen der Zeit und der Konzentration Faktoren angegeben (Abbildung 2A, P < 0,01, ANOVA) . Chlor-Gas-Konzentration hatte keinen signifikanten Einfluss auf das Keimen der Samen der Col-0 1 h Sterilisation unterzogen. Mit diesmal Sterilisation alle Konzentrationen von Chlorgas gefördert ähnlich hohe Keimfähigkeit, über 85 % (P > 0,05, ANOVA). Auf der anderen Seite ein 3 h lang Sterilisation ergab einen signifikanten Rückgang der Keimrate für die höchste Konzentration von Chlorgas, verglichen mit den beiden unteren Gaskonzentrationen (P < 0,05, ANOVA). Diese Ergebnisse deuten darauf hin, dass Behandlungen von Arabidopsis Samen mit keinem der getesteten Chlor Gaskonzentrationen für 1 h oder mit Gaskonzentrationen unter 16,5 % für 3 h ebenso wirksam Samen Lebensfähigkeit zu erhalten sind, da die Keimrate immer größer wurden über 82 %. Samen für 3 h mit 16,5 % Gas sterilisieren war jedoch nachteilig auf die Samenkeimung.
Das Auftreten von Schimmel war auch abhängig von der Gaskonzentration und Belichtungszeit. Schimmelbildung war effektiv mit der relativ hohen Konzentrationen von 6,1 % und 16,5 % Chlorgas für 1 h dauernden Behandlung und alle Gaskonzentrationen für 3 h (Abbildung 2 b) gehemmt.
Basierend auf diesen Ergebnissen wurde eine Behandlung mit einer Gaskonzentration von 6,1 % für 1 h (Tabelle 2) als die besten Dampfphase Sterilisation Zustand ausgewählt, testen Sie die Wirkung der Gassterilisation auf verschiedenen Mutante Linien, da es hohe Keimung Rate kombiniert ( 85 %) mit sehr niedrigen Niveau von Schimmel Verschmutzung (0,02 %).
Auswirkungen der Bleiche und Chlor Gassterilisation auf Samen mit verschiedenen Keimen potenzielle
Statistische Analyse ergab, dass die Keimung Sterilisationsmethoden abhängig von der Keimung Potenzial der Linien reagierte auf (Abb. 3A, P < 0,01, ANOVA). Weder Bleichmittel noch Chlor-Gas-Sterilisation reduziert die Keimfähigkeit der Samen mit hoher Keimung potenzielle (Gruppen 4 und 5). Keine Behandlung wirkten sich auf die ohnehin schon niedrige Keimungsrate der Gruppe mit der niedrigsten KeimungPotenzial (Gruppe 1). Im Gegensatz dazu Chlor Gassterilisation führte zu einer deutlichen Verringerung von ca. 12-18 % (P < 0,01, ANOVA) in die Keimung der Samen mit mittleren Keimung Potenzial (Gruppen 2 und 3). Bleichmittel Sterilisation verringert auch Keimrate von 13 % der Gruppe 2, aber es nicht zu verringern die Keimrate von Gruppe 3. Zwar gab es keinen signifikanten Unterschied in Keimrate zwischen dem Bleichmittel und Chlor Gas Behandlungen in einer beliebigen Gruppe von Keimen (Abb. 3A, P > 0.442, ANOVA), Samen sterilisiert mit Bleichmittel haben eine etwas höhere Keimrate als Gas sterilisiert Saatgut in allen Gruppen der Keimung.
Sterilisation-Behandlungen signifikant verändert (P < 0,001, ANOVA) Prozent der Samen von Schimmel (Abb. 3 b) betroffen. Beide Chlor Gas und Bleichmittel Sterilisation führten zu weniger Schimmelbildung (P < 0,05, ANOVA) im Vergleich zu keine Sterilisation. Es gab keinen Unterschied in der Form-Ebene zwischen Gas und Bleichmittel Sterilisation in einer beliebigen Gruppe festgestellt (Abb. 3 b, P > 0,4, ANOVA).
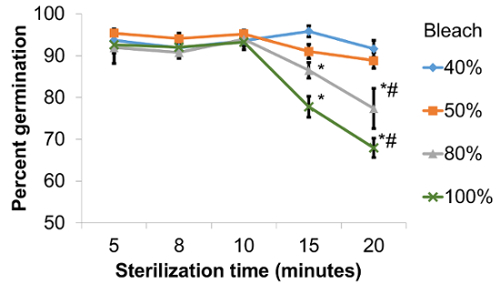
Abb. 1: Auswirkungen von Bleichmittel Konzentration und Sterilisation Zeit auf das Keimen der Samen von Arabidopsis Col-0. Werte sind Mittel ± SD aus 5 unabhängigen Wiederholungen des Experiments gewonnen. * zeigt signifikante Unterschiede im Vergleich zu den 5 min einweichen Dauer für eine Reihe von Chlorid-Konzentrationen (P < 0,01, ANOVA). #zeigt erhebliche Unterschiede von 80 % und 100 % Chlorid-Konzentrationen im Vergleich zu 40 % und 50 % für 20 min Zeit (P < 0,01, ANOVA). Bitte klicken Sie hier für eine größere Version dieser Figur.
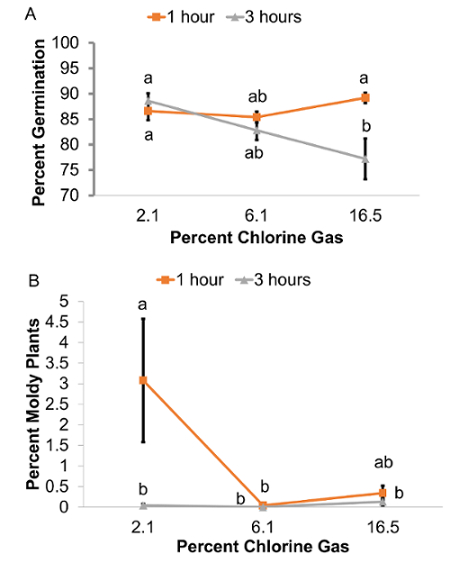
Abbildung 2: Auswirkungen von Chlor gas-Konzentration und Sterilisation Zeit auf Arabidopsis Col-0 Samen. (A) Keimrate und (B) Schimmel-Ebene. Fehlerbalken darzustellen Mittel ± SD 5 biologische und 5 technische Wiederholungen des Experiments entnommen. Bedeutet, dass einen Brief nicht teilen sind signifikant unterschiedlich (P < 0,05, ANOVA). Bitte klicken Sie hier für eine größere Version dieser Figur.
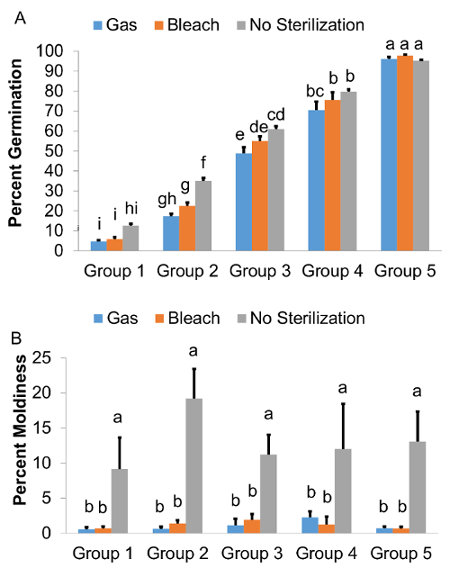
Abbildung 3: Auswirkungen der Bleiche und Chlor Gassterilisation auf Samen mit verschiedenen Keimen potenzielle. (A) Keimrate und (B) Schimmel-Ebene. Die 100 Zeilen SALK T-DNA wurden in fünf Gruppen entsprechend ihrer Keimung potenzielle definiert als die Keimungsrate in Ermangelung jeder Sterilisation Agent eingestuft. Die Gruppen basierend auf die Keimrate waren wie folgt: Gruppe 1 (0-20 %), Gruppe 2 (21-50 %), Gruppe 3 (51-70 %), Gruppe 4 (71-90 %) und Gruppe 5 (91-100 %). Die Linien wurden nach dem Zufallsprinzip ausgewählt und ihre potenziellen Keimung Genotyp nicht abhängig. Werte sind Mittel ± SD aus drei unabhängigen Wiederholungen des Experiments gewonnen. Buchstaben ("a", "Ab", "C", etc.) über jeden Wert zeigen die statistischen Gruppierungen der Kategorie Mittel. Bedeutet, dass einen Brief nicht teilen sind signifikant unterschiedlich (P < 0,05, ANOVA). Bitte klicken Sie hier für eine größere Version dieser Figur.
| Sterilisation-Zeit (min) | Chlorid-Konzentration (%) | |||
| 40 | 50 | 80 | 100 | |
| 5 | 0,00 % | 0,00 % | 0,00 % | 2.13 % |
| 8 | 0,00 % | 0,00 % | 0,00 % | 0,00 % |
| 10 | 0,00 % | 0,50 % | 0,00 % | 0,36 % |
| 15 | 0,00 % | 0,00 % | 0,00 % | 0,68 % |
| 20 | 0,19 % | 0,28 % | 0,00 % | 0,00 % |
Tabelle 1: Schimmel Maß an Bleichmittel sterilisiert Col-0 Samen.
| Bleichmittel | HCl | Zeit | % Chlorgas (Mol Cl2/mol total Gas) |
| (mL) | (mL) | (h) | |
| 25 | 1 | 1 | 2.1 |
| 25 | 1 | 3 | 2.1 |
| 100 | 3 | 1 | 6.1 |
| 100 | 3 | 3 | 6.1 |
| 200 | 9 | 1 | 16.5 |
| 200 | 9 | 3 | 16.5 |
Tabelle 2: Chlor (Cl2) gas-Sterilisation Behandlungen auf Columbia Wildtyp Samen mit einem 7 L-Container.
Zusätzliche Tabelle 1: Eine Tabelle, die für die Durchführung der Berechnung für verschiedene Volumina der Container und % Cl2programmiert. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Beim Anbau von Arabidopsis Samen auf sterile Medien muss irgendeine Form der Sterilisation angewendet werden. Bleichmittel und Chlor-Gas-Sterilisation-Behandlungen führen zu ähnlichen Keimen Rate und Schimmel Wachstumshemmung. Keine Sterilisation Methode bewirkt eine signifikante Reduktion Keimrate für Samen mit potenziellen hohe Keimung; Bleichmittel Sterilisation empfiehlt jedoch für Leitungen mit niedriger Keimung Potenzial (20-70 %), aufgrund der geringen, wenn auch nicht signifikant, Verbesserung der Keimrate im Vergleich zu Gassterilisation (Abbildung 3A).
Arabidopsis Samen mit Bleichmittel Konzentrationen von 40-100 % für bis zu 10 Minuten sterilisieren bietet zufriedenstellende Keimung Prozentsätze und effektive Form der Unterdrückung. Obwohl Chlorid-Konzentrationen von weniger als 40 % bieten ausreichende Sterilisation für die meisten Saatgutpartien, mit einer Konzentration von 40 % oder höher garantiert effektive Sterilisation der auch stark verschmutzte Saatgutpartien. Es ist wichtig, keine 10 min der Sterilisation überschreiten bei Chlorid-Konzentrationen gleich oder höher als 80 % hohen Mortalität und Mängel in der Sämling-Entwicklung zu vermeiden.
Behandlung von Arabidopsis Samen mit Chlor-Gas-Konzentrationen von 6,1 % oder 16,5 % für 1 h führt zu hohen Keimungsraten und angemessene Schimmel Beseitigung. Niedrige Chlor-Gas-Konzentration (2,1 %) kann erfolgreich eingesetzt werden, mit zunehmender Dauer der Sterilisation bis 3 h.
Wenn einige Zeilen werden sterilisiert müssen, wird Flüssigkeit Sterilisation in einer Lösung von 50 % Bleichmittel für 10 min empfohlen. Für eine größere Zahl von Linien ist Gassterilisation mit einer Gaskonzentration von 6,1 % für 1 h eine bessere Option, da viele Zeilen schnell und einfach mit weniger Manipulation sterilisiert werden können.
Unsere Ergebnisse liefern standardisierte Bedingungen für die Sterilisierung, große Anzahl von Samen der verschiedenen Genotypen und die Samen mit potenziellen niedriger Keimung. Die einzige Einschränkung dieser Sterilisation-Techniken ist, dass sie auf die Samen mit Keimungsraten weniger als 20 % durch umfangreiche Samen Sterblichkeit angewendet werden können. Alternative Methoden, wie Beschallung17, Keimrate bei fehlender Sterilisation erhöhen können in diesen Fällen vorteilhaft sein.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchte Gauri Datta Danke für ihre Hilfe bei der Vorbereitung experimentelle Materialien. Wir sind auch dankbar, Bettina Wittler und James Mann für die kritische Überprüfung des Manuskripts. Diese Arbeit wurde durch die NSF Stipendien DBI-1049341 und MCB-1143813 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.65 mL Microcentrifuge tubes | GeneMate | C-3260-5 | Tube in which Arabidopsis thaliana seeds are placed to perform sterilization |
| 1.7 mL Microcentrifuge tube | GeneMate | C-3262-1 | Tube in which Arabidopsis thaliana seeds are placed to perform sterilization |
| 7 L plastic container | Sistema | 1016265438 | Container in which gas sterilization is performed |
| Concentrated HCl | Sigma-Aldrich | 320331 | Chemical used in the process of creating chlorine gas |
| Disposable sterile inoculating loop | Fisher Scientific | 22-363-603 | Loop is used to spread or position Arabidopsis seeds on MS plates |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | Vitamin solution used in the process of making MS media |
| Household bleach | Clorox | Regular-Bleach | Chemical used in the process of creating chlorine gas and liquid sterliziation |
| MES hydrate | Sigma-Aldrich | M2933 | Chemical used in the process of making MS media |
| Micropore surgical tape | 3M | 1530-1 | Microporous surgical paper tape used to seal MS plates |
| Murashige and Skoog basal salt mixture (MS) | Sigma-Aldrich | M5524 | Chemical used in the process of making MS media |
| Parafilm M | Bemis Company | #PM996 | Parraffin film used to seal sterilization container |
| Petri dish 100 X 15 mm | Fisher Scientific | FB0875713 | Petri dishes in which MS media is poured for the purpose of growing Arabidopsis thaliana |
| pH indicator strips | Whatman | 2613991 | Used to check pH of neutralizied chlorine and sodium bicarbonate solution |
| Phytoagar | Fisher Scientific | 50-255-212 | Used to aid in the suspension of Arabidopsis seeds in the process of plating seeds |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Chemical used in the process of neutralizing chlorine gas reaction |
| Sucrose | Sigma-Aldrich | S0389 | Chemical used in the process of making MS media |
| Tween 20 | Fisher BioReagents | BP337-100 | Chemical used in the process of liquid sterilization |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | CS70000 (Col-0) | Arabidopsis wild-type seeds |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_037606C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_041402C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_059101C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_063470C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_072048C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_072240C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_081989C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_084124C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_085049C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_089717C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_107354C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_110111C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_111322C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_113109C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_114702C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_114872C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_115657C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_116803C | Arabidopsis seeds used in testing as a part of Group 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_039445C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_039782C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_043037C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_045828C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_048556C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_049514C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_049725C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_080816C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_081176C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_081770C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_082262C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_082289C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_082702C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_083630C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_084635C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_085337C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_085656C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_093049C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_103332C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_105336C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_105704C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_106388C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_109575C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_110580C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_110617C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_111424C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_111584C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_112097C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_113339C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_115837C | Arabidopsis seeds used in testing as a part of Group 2 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_019535C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_026478C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_046565C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_049258C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_049339C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_056307C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_081292C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_081597C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_083488C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_110573C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_112793C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_113658C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_113904C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_114673C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_114709C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_115455C | Arabidopsis seeds used in testing as a part of Group 3 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_013186C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_018261C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_062509C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_080639C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_088586C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_096651C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_106900C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_110131C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_111051C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_111245C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_113223C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_121391C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_125097C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_201905C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_210001C | Arabidopsis seeds used in testing as a part of Group 4 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_000662C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_029335C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_047760C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_071275C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_080530C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_103881C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_110864C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_120294C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_124390C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_132808C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_137036C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_139519C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_140643C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_142288C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_143304C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_147597C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_209076C | Arabidopsis seeds used in testing as a part of Group 5 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_081081C | Arabidopsis seeds used in testing as a part of Groups 5 and 1 |
| Arabidopsis thaliana seeds | ABRC; order through TAIR www.arabidopsis.org | SALK_107487C | Arabidopsis seeds used in testing as a part of Groups 5 and 2 |
Referenzen
- Weigel, D., Glazebrook, J. . Arabidopsis: a laboratory manual. , (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant J. 61 (6), 909-921 (2010).
- The Arabidopsis Genome Initiative. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Rivero, L., et al. Handling Arabidopsis plants: growth, preservation of seeds, transformation, and genetic crosses. Methods Mol Biol. 1062, 3-25 (2014).
- Yamada, K., et al. Empirical analysis of transcriptional activity in the Arabidopsis genome. Science. 302 (5646), 842-846 (2003).
- Alonso, J. M., Stepanova, A. N. Arabidopsis transformation with large bacterial artificial chromosomes. Methods Mol Biol. 1062, 271-283 (2014).
- Savage, L. J., Imre, K. M., Hall, D. A., Last, R. L. Analysis of essential Arabidopsis nuclear genes encoding plastid-targeted proteins. PLoS One. 8 (9), e73291 (2013).
- Podar, D. Plant growth and cultivation. Methods Mol Biol. 953, 23-45 (2013).
- Xu, W., et al. An improved agar-plate method for studying root growth and response of Arabidopsis thaliana. Sci Rep. 3, 1273 (2013).
- Clough, S. J., Bent, A. F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16, (1998).
- Cederholm, H. M., Benfey, P. N. Distinct sensitivities to phosphate deprivation suggest that RGF peptides play disparate roles in Arabidopsis thaliana root development. New Phytol. 207 (3), 683-691 (2015).
- Ye, G. N., et al. Arabidopsis ovule is the target for Agrobacterium in planta vacuum infiltration transformation. Plant J. 19 (3), 249-257 (1999).
- Kuromori, T., et al. A collection of 11 800 single-copy Ds transposon insertion lines in Arabidopsis. Plant J. 37 (6), 897-905 (2004).
- Fiers, M., et al. The 14-amino acid CLV3, CLE19, and CLE40 peptides trigger consumption of the root meristem in Arabidopsis through a CLAVATA2-dependent pathway. Plant Cell. 17 (9), 2542-2553 (2005).
- Stepanova, A. N., Alonso, J. M. PCR-based screening for insertional mutants. Methods Mol Biol. 323, 163-172 (2006).
- O'Malley, R. C., Alonso, J. M., Kim, C. J., Leisse, T. J., Ecker, J. R. An adapter ligation-mediated PCR method for high-throughput mapping of T-DNA inserts in the Arabidopsis genome. Nat Protoc. 2 (11), 2910-2917 (2007).
- López-Ribera, I., Vicient, C. M. Use of ultrasonication to increase germination rates of Arabidopsis seeds. Plant Methods. 13 (31), (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten