Method Article
Reinigung von Hepatozyten und sinusförmigen Endothelzellen aus Maus Leber Perfusion
In diesem Artikel
Zusammenfassung
Das Ziel dieses Protokolls ist, hohe Wirtschaftlichkeit und hohe Ausbeute von Hepatozyten und sinusförmigen endothelial Zellen von Leber zu erhalten. Dies geschieht durch die Vorrichtung der Leber mit einer Typ IV Kollagenase Lösung über die Pfortader, gefolgt von differentielle Zentrifugation, Hepatozyten und sinusförmigen Endothelzellen zu erhalten.
Zusammenfassung
Dieses Protokoll zeigt eine Methode zur Erlangung von high-Yield und Lebensfähigkeit für Maus Hepatozyten und sinusförmigen Endothelzellen (SECs) geeignet für das züchten oder für den Erhalt der Zelle Lysates. In diesem Protokoll die Pfortader als Standort für die Katheterisierung, anstatt die untere Hohlvene, dient als Verunreinigung von anderen möglichen Zelltypen als letzte Leber Vorbereitung beschränkt. Keine besondere Instrumentierung ist während des Verfahrens erforderlich. Ein Wasserbad wird als Wärmequelle verwendet, um die Temperatur aller Puffer und Lösungen zu halten. Eine standard peristaltische Pumpe wird verwendet, um die Flüssigkeit zu fahren, und eine gekühlte Tischplatte Zentrifuge ist für die Zentrifugation Verfahren erforderlich. Die einzige Einschränkung dieser Technik ist die Platzierung des Katheters in die Pfortader, die auf einige der Mäuse in der Größenordnung von 18-25 g ist eine Herausforderung. Ein Vorteil dieser Technik ist, dass nur eine Vene für die Durchblutung genutzt wird und der Zugriff auf die Vene schnell ist, die minimiert Ischämie und Reperfusion der Leber, die Leber Zellviabilität reduziert. Ein weiterer Vorteil dieses Protokolls ist, dass es einfach zu Leben tot Hepatozyten von Sehvermögen aufgrund der Differenz in zelluläre Dichte während der Zentrifugation Schritte unterscheiden. Zellen aus diesem Protokoll können werden verwendet in der Zellkultur für alle nachgelagerten Anwendungen sowie für jede biochemische Bewertung verarbeitet.
Einleitung
Kollagenase Perfusion der Leber Hepatozyten zu erhalten wurde seit den frühen 1950er Jahren durchgeführt und hat1,2,3,4ständig verbessert worden. Ein sehr schöner Überblick über viele der Methoden, Techniken und Reagenzien in der Leberzelle Reinigung wurde Meyer Et al.5zusammengestellt. Eine zufriedenstellende Rendite von hoch tragfähige Hepatozyten und SECs ist technisch anspruchsvoll. Die mechanischen Kräfte, die die Zellen einschließlich der Qualität der Kollagenase trennen sind einige der Variablen, die schwer zu kontrollieren sind. Durch Hepatozyten Empfindlichkeit gegenüber mechanischen Kräften wird ihre Überlebensfähigkeit unter suboptimalen Bedingungen, woraufhin die Notwendigkeit für ein Protokoll beschreibt die optimale Bedingungen für die Isolierung deutlich reduziert. SECs scheinen nicht so empfindlich auf mechanische Scheren. In Situ Perfusion mit Kollagenase Verdauung ist bei weitem die beste Methode, Zell-Zell-Verbindungen um einzelne Zelle Vorbereitungen von Leber und anderen Organen wie Darm und Milz6zu erhalten zu stören. Dieses Protokoll zeigt eine einfache Methode für die Einführung von Perfusion Puffer in die Pfortader mit einem versenkbaren Kunststoff Katheter anstelle einen Einschnitt, der Pfortader zu kollabieren, verursachen könnten, wie in Smedsrød Et al.7beschrieben.
Dieses Manuskript soll die wichtigsten Schritte für den Erfolg in der Leber Fülle Prozedur zu demonstrieren. Diese Schritte umfassen Katheter Platzierung Strömung der Perfusion Flüssigkeiten und Handhabung des Gewebes nach der Verdauung. Durchflussmengen sind angepasste über den natürlichen Zinssatz des Blutflusses, aber niedrig genug, um die Glisson Kapsel intakt zu halten. Sobald die Leber richtig verdaut und Zellen in Lösung getrennt werden, ist Zelle Reinigung relativ einfach ob sie durch differentielle Zentrifugation, Platte Adhäsion, oder durch magnetische Wulst Reinigung durchgeführt wird. Live Hepatozyten haben eine höhere Dichte und sind leicht von den Nonparenchymal Zellen (NPCs) und tot Hepatozyten mit langsamer Geschwindigkeit Zentrifugation gereinigt. Für die meisten Anwendungen Platte Adhäsion zur Trennung von Kupffer Zellen (KCs) und SECs ist eine gemeinsame Methode8, aber es gibt Berichte, dass es nicht die beste Reinheit der SECs9zu produzieren. KCs haben eine Tendenz zur Einhaltung starrer Festkörperoberflächen schnell und Petrischalen (standard Polystyrol) sind die am häufigsten verwendete Material für dieses Verfahren. SEC oder KC Reinigung mit der Verwendung von magnetischen Beads Antikörper konjugiert ist zweifellos die beste Methode für bedeutende Reinigung dieser Zellen, obwohl das Verfahren eine weitere 3-4 h auf dieses Protokoll fügt und die Gesamtausbeute verminderte9. Dieser Bericht zeigt detailliert den Prozess für eine optimale Leber Perfusion, die in der Regel eine hohe Anzahl der lebensfähigen Zellen ergibt.
Protokoll
Alle Tiere in diesem Protokoll beschriebenen Verfahren wurden von den institutionellen Animal Care und Nutzung Committee (IACUC) an der University of Lincoln - Nebraska Protokolls #1435 genehmigt.
1. Vorbereitung
- Zubereitung von Lösungen und Kulturmedien
- Alle Kultur, Medien und Puffer nach der Tabelle der Materialienvorzubereiten.
- Aufbereitung von Instrumenten
- Richten Sie ein Wasserbad (> 10 L) bei 42 ° C, einer peristaltischen Pumpe mit variabler Geschwindigkeit und Klemmen für die Abhaltung von Flaschen. Bereiten Sie gebogene Scheren und Pinzetten (Abbildung 1).
- Richten Sie auf oder neben dem Wasserbad ein Backblech (ca. 38 x 26 cm) mit einem Styropor-Pad (50 mL konische Rack), überlagert mit einem saugfähigen Unterlage geschnitten, ein 20 x 20 cm Stück (Abbildung 1).
- Legen Sie ein Stück Klebeband (5-8 cm) in der Nähe. Legen Sie ein 20 cm Polyester Nähfaden in der Nähe d. h. Schnitt und einsatzbereit. Erhalten Sie einen Kunststoff-Katheter mit einer versenkbaren Nadel (7 mm x 19 mm, Abbildung 1).
- Herstellung von Glaswaren
- Verwenden Klammern, platzieren und eine 1 L Flasche im Wasserbad mit 200 mL 1 X PBS mit einem Stopfen, der zwei 1 mL Pipetten gehen in die Lösung zu immobilisieren. Der Kautschuk-Kork ist eingekerbt, um Umwälzung der Flüssigkeit in einem geschlossenen Kreislauf zu ermöglichen.
- Legen Sie mit einem anderen Klemme eine 125 mL Flasche mit 45 mL Puffer 2 zusammen mit einem Stopfen, der hat zwei Pipetten 1 mL, von denen in der Flüssigkeit im unteren Teil der Flasche und der andere ist die bleibt oberhalb der Flüssigkeit und Sauerstoff in die Flasche bläst.
Hinweis: Jede Pipette in die Stopper haben eine schnelle Adapter am Ende für einfaches Umschalten der Schläuche zu trennen. Sauerstoff wird sanft in beide Kolben über die Pipette in der Stopper fließen, die nicht in die Flüssigkeit eingetaucht ist. - Zwei sterile kristallisierenden Teller beiseite stellen.
(2) Tier Verfahren
- Die PBS und Puffer 2 Lösungen auf 42 ° C im Wasserbad erwärmen Sie und zirkulieren Sie PBS für mindestens 20 mL/min in den Schlauch in einem geschlossenen Kreislauf die Zufuhrleitungen warm zu halten. Tauchen überschüssigen Schlauch in das Wasserbad bleiben so nah wie möglich an 42 ° C. Entleeren Sie das männlichen Ende des Schlauches in die 1 L Flasche mit PBS.
- Einen Wattebausch auf das saugfähige Unterlage geben Sie und ca. 2 mL 30 % Isofluran (bestehend in Polyethylenglykol 200 das verringert die Verdunstung von Isofluran) auf den Wattebausch mit einer Transferpipette.
- Heben Sie die Maus am Schwanz, legen Sie sie in eines der kristallisierenden Gerichte und dann stürzen Sie schnell die Schüssel auf den Wattebausch, damit die Maus verfügt über einen kleinen Raum, in dem die Narkose zu inhalieren. Beobachten Sie die Atemfrequenz der Maus zu und sicherstellen Sie, dass die Maus effektiv unter Narkose ist.
Hinweis: Die Atemfrequenz sollte langsamer und tiefer, die Rute schlaffen und die Pfoten ausweichenden zu Kneiftest unter Narkose; siehe Richtlinien für IACUC für weitere Details. - Während die Maus unter Narkose geht (Dies dauert ca. 1-2 min.), bereiten Sie den Lauf einer 10 mL Spritze durch Herausziehen des Kolbens und einen kleinen Wattebausch einlegen. Der Wattebausch in den Lauf 1 – 2 mL 30 % Isofluran mit einer Transferpipette hinzu und stellen Sie den Lauf Open-End nach unten auf einen Tisch während des Wartens auf die Maus, um bewusstlos zu werden.
- Schnell kristallisieren Schale nehmen Sie ab, drehen Sie die Maus auf dem Rücken und legen Sie den Spritzenkörper über seine Nase. Überprüfen Sie die Atemfrequenz, Zeh kneifen und schlaffer Schweif. Alle Antworten auf die Zehe Prise und schlaffer Schweif zeigt, dass die Maus nicht vollständig unter Narkose. Halten Sie den Spritzenkörper über die Schnauze zu Bewusstlosigkeit.
- Ort Reißzwecken durch die Pfoten der Maus mit den Gliedmaßen ausgestreckt in Rückenlage. Feuchten Sie den Bauch und Brustkorb mit 70 % Isopropanol oder Ethanol.
- Heben Sie mit der geraden Zange in der Hand die Haut in der Nähe der Basis des Bauches. Schneiden Sie mit einer Schere in der anderen Hand das Zelt Haut und Bauchfell. Der Schnitt sollte horizontal oder auf der Basis der zeltförmige Haut. Achten Sie darauf, alle Schichten der Haut und Bauchfell durchtrennt, um Zugriff auf den Darm. Schneiden Sie seitlich um den Bauch bis zu den Brustkorb auf beiden Seiten ohne nicking eines der Organe.
- Schneiden Sie die Klappe der Haut durch Schneiden in den unteren Brustkorb. Bewegen Sie den Darm auf der rechten Seite am hinteren Teil der Zange, die Pfortader verfügbar zu machen.
Hinweis: Blutungen aus dem Tier sollte minimal sein; das Tier sollte noch atmen und Tiefe Narkose. - Legen Sie die geschlossenen gebogenen Zange unterhalb der Pfortader zwischen Leber und überlegene Pancreaticoduodenal Vene (Abbildung 3 Pfeil).
- Öffnen Sie die Zange während unterhalb der Pfortader. Fassen Sie den Faden und ziehen Sie sie vorsichtig durch, so dass es unter der Pfortader zentriert ist. Binden Sie einen Überhandknoten um die Pfortader, ohne sich frech.
- Legen Sie die gebogene Pinzetten unter die Pfortader und ziehen Sie es vorsichtig nach hinten von der Maus zu begradigen die Vene (Abb. 4A).
- Legen Sie mit dem Katheter in der anderen Hand die schräge der Nadel aufgedeckt und parallel mit dem unteren Teil der Pfortader in der Nähe der Zange (Abb. 4B).
- Sanft Punktion der Vene mit der Nadel (Abb. 4C). Stellen Sie sicher, dass die Abschrägung der Nadel in das Lumen der Vene ist. Die federbelastete Nadel zurückziehen und weiterhin den Polymer-Katheter durch die Vene zu drücken, bis die Abschrägung in der Nähe des venösen verzweigt ist. Dies ist in der Leber. Wenn der Katheter richtig plaziert ist, wird ein Rückfluss des Blutes sichtbar sein. (Abbildung 4D).
- Ziehen Sie den Überhandknoten und ziehen Sie es nach unten, den Katheter zu helfen es zu stabilisieren. Sofort drehen Sie die Pumprate von 20 mL/min bis 4 mL/min und schneiden Sie einen anderen großen Blutgefäß für die Entwässerung. Schneiden Sie die Aorta Abdominalis für optimale Ergebnisse.
- Setzen Sie den Stecker der Schläuche an die Buchse des Katheters (Abb. 5A). Sicherstellen Sie, dass keine Luftblasen in der Zeile vorhanden sind. Achten Sie darauf, dass der Katheter nicht entweder in der Leber oder aus der Vene geschoben. Platzierung des Gewindes ist nicht notwendig, aber es verhindert Rückfluss aus der Vene und verhindert, dass den Katheter in der richtigen Position (Abbildung 5B, C).
- Verwenden Sie Klebeband um den Schlauch auf die Unterlage zu immobilisieren. Der geraden Zange verwenden, um das Abwasser Blutgefäß um die Leber ein paar Mal aufblasen zu pressen um sicherzustellen das Blut hat (Abbildung 5D) abgelassen.
Hinweis: Standard-Labor-Band funktioniert nicht; Masking Tape bleibt jedoch fest an der Unterlage, auch bei Nässe.
3. Leber Perfusion
- Während die Leber mit PBS Spülung, Messen Sie, etwa 24 mg Kollagenase Typ IV und legen Sie sie in die Flasche mit 45 mL Puffer 2 im Wasserbad. Achten Sie darauf, die Flüssigkeit in der Flasche wirbeln, so dass die Kollagenase vollständig gelöst ist und den Kolben zurück in die Klemme zu platzieren, so dass die Flüssigkeit enthaltende Teil des Kolbens vollständig im Wasser untergetaucht ist.
- Beobachten Sie die Veränderung der Farbe der Leber, wie es mit PBS gespült wird. Ändern Sie den Abfluss Schläuche aus der 1 L Flasche in der 125 mL Flasche. Erlauben Sie keine Luftblasen in der Leber fließen.
- Sobald der Puffer Perfusion die Leber erreicht, kurz drücken Sie fest das Abwasser Blutgefäß zum Aufbau etwas Druck innerhalb des Schiffes und lassen Sie diese Flüssigkeit alle Lappen der Leber zu füllen. Achten Sie darauf, nicht abgeschnitten Entwässerung zu lang, denn das kann platzen die dünne Bindegewebe rund um die Leber (Glisson Kapsel) und die Perfusion oder Strömung der Flüssigkeit innerhalb der Kapillare Bett der Leber zerstören.
- Ermöglichen Sie Puffer 2 mit Kollagenase, durch die Leber durchspülen, bis alle 45 mL haben floss durch das Gewebe.
Hinweis: Bei Erfolg der Glisson Kapsel getrennt werden sollten aus dem Parenchym oder das Lebergewebe und die Leber sollte sich amorphe erscheinen. - Die kristallisierenden Schale etwa 10 mL Puffer 1 hinzu, und legen Sie sie neben der Maus.
- Entfernen Sie den Katheter und schalten Sie die Pumpe aus.
- Schneiden Sie mit der geraden Zange und Schere die Leber von der Maus. Wenn die Kollagenase Verdauung sehr effizient war, ist es möglicherweise notwendig, haben einen sauberen, sterilen Löffel auf Seite zu schöpfen die Leber von der Maus und legen Sie sie in Puffer 1.
4. Hepatozyten Reinigung
Hinweis: Manipulation der Zellen sind in einer sterilen Gewebekultur Kapuze, Verschmutzung zu begrenzen, sollen die Zellen kultiviert in alle weiteren Schritte werden durchgeführt.
- Mit steriler Technik, greifen Sie die Leber mit Zange und schütteln Sie die Zellen aus der Leber. Zerreißen oder zurückziehen der Glisson Kapsel: der Puffer wird undurchsichtig, wie Zellen aus der Leber erschüttert werden.
- Gießen Sie die Zelle-Lösung in ein 50 mL konische mit einem 100 µm-Filter über der Oberseite platziert.
- Die Leber Reste mehr Puffer 1 hinzu und schütteln Zellen weiterhin. Fortgesetzt, bis die Leber scheint frei von Zellen oder wenn die unverdaute Teile der Leber nicht mehr Zellen nachgeben.
- Ein weiterer 50 mL konisch mit einem 40 µm-Filter Gießen Sie die zelluläre Flüssigkeit.
- Zentrifugieren Sie die konische in eine schwingende Eimer-Rotor bei 100 X g für 3 min.
Hinweis: Verwenden Sie die maximale Bremse nicht, da dies die Zelle Pellets verdrängen kann. Verwenden Sie die Bremse bei 80 %, die was für alle verbleibenden Schritte der Zentrifugation bei 4 ° C ausreichend ist - Der Überstand (enthält NPCs und tot Hepatozyten) in eine saubere konische abgießen und auf Eis legen. Stellen Sie sicher, dass dies in einer Bewegung, Einhaltung von Pellets zu beobachten.
- Das Pellet in 40 mL Puffer 1 aufzuwirbeln. Wiederholen Sie die Schritte 4.5 und 4.6. Das Pellet in 40 mL Puffer 3 aufzuwirbeln. Wiederholen Sie die Schritte 4.5 und 4.6 zweimal.
- Aufschwemmen der gereinigten Hepatozyten in warmen DMEM + 10 % FBS + 2 x Penicillin-Streptomycin (Pen/Strep).
- Wenn die Zellen auf Kollagen beschichtete Platten kultiviert werden, lassen für 1 h halten und ersetzen die Medien mindestens einmal als dies im Entstehen begriffenen bakterielle Verunreinigungen verhindert.
- Machen Sie die Kollagen beschichtete Platten durch Inkubation sie mit 0,05 % Kollagen in 0,001 % Essigsäure für mindestens 1 h bei 37 ° C, und dann mit 1 X PBS waschen.
- Wenn die Hepatozyten Lebensfähigkeit gering ist und es ein Wunsch ist, gereinigte hoch tragfähige Hepatozyten erhalten dann verwenden Sie das folgende Protokoll vom Ambiente Et Al10angepasst.
- Mix 9 Bände der PvP-Lösung (Percoll, einer 23 % w/w Lösung aus Wasser und 15-30 nm kolloidale Silica-Partikel in Polyvinylpyrrolidon für Dichte Zentrifugation beschichtet) und 1 Volumen von 10 X HBSS, eine Iso-osmotischen PvP-Lösung (SIP) zu machen.
- Fügen Sie ein steril 50 mL konische die in diesen Bedingungen für bis zu 2 Monate bei 4 ° c gespeichert werden kann hinzu, 24 mL von SIP
- Passen Sie die Hepatozyten Konzentration um 5 bis 10 × 106 Zellen/mL mit Kulturmedium wie in Schritt 4.8 notierte.
- Je 24 mL SIP mit konischen 25 mL Zellsuspension hinzu und mischen Sie durch sanfte Umkehrung. Die Dichte dieser Lösung ist 1,06 g/mL.
- Zentrifugieren Sie konisch 50 X g für 10 min bei 4 ° C.
- Aspirieren Sie SIP und Flockungsmittel und aufzuwirbeln Sie Zellen in HBSS.
- Waschen der Zellen durch Zentrifugation bei 50 X g für 10 min bei 4 ° C.
- Wiederholen Sie Schritt 4.10.6 einmal mehr und dann Aufschwemmen Sie Zellen im Wachstumsmedium.
5. s Reinigung
- Pellet-Zellen in die Überstände ab Schritt 4.6 durch Drehen der Röhren bei 163 X g für 10 min. verwerfen die Überstände aus den Rohren und Aufschwemmen aller Zelle Pellets in 5 mL RPMI ohne Serum und bündeln sie zusammen in eine Röhre.
- Sobald alle Pellets gebündelt haben, fügen Sie RPMI Endvolumen von 35 mL hinzu.
- Zentrifugieren der gepoolten konisch 25 X g für 3 min. vorsichtig Aspirieren die Top 25 mL RPMI mit einem 25-mL-Pipette und Ort dieses Medium mit NPCs in eine saubere 50 mL konisch auf Eis.
- 25 mL frisches RPMI das Rohr wieder hinzufügen und das Pellet Aufschwemmen.
- Wiederholen Sie Schritt 5.3 für einen zweiten waschen und Pool überstand. Die restliche 10 mL von Medien und Pellets (Pellet besteht hauptsächlich aus Toten Hepatozyten) zu verwerfen. Zentrifugieren Sie die gepoolten Überstand bei 163 X g für 10 min.
- Während der Zentrifugation bereiten Sie die PvP-Lösung Gradienten in ein 50 mL konisch.
- Hinzugeben Sie 15 mL 50 % PvP-Lösung für die 50 mL konische gefolgt von 20 mL 25 %, die Percoll mit einer Pipette auf die langsamste Geschwindigkeit Auswurf gesetzt überlagert. Achten Sie darauf, eine Brechung Linie an der 15 mL-Marke, die die beiden Schichten abgrenzt zu beobachten, wie das ist, wo die SECs und KCs nach der Zentrifugation aggregiert.
- Die Zellen, die zuvor in Schritt 5.5 von 10 mL kalte RPMI pelleted Aufschwemmen und auf der PvP-Lösung Farbverlauf zu überlagern. Achten Sie darauf, eine klare Abgrenzung zwischen den beiden Schichten zu erhalten. Zentrifugieren Sie die Steigung bei 805 X g für 20 min mit einer Bremse auf 50 % festgelegt.
- Von oben nach unten Richtung bis 20 mL-Markierung auf dem Rohr abzusaugen und dieses Material verwerfen. Mit einer 5 mL-Transfer-Pipette sammeln Sie die SECs und KCs, die sich an der Schnittstelle von 25/50 % befinden. Braunen Klumpen von Zellen zu verwerfen, da diese Toten Hepatozyten sind.
- Legen Sie die Zellen in ein 50 mL konische und summieren Sie RPMI sich die 50 mL-Markierung, die PVP-Lösung zu verdünnen. Zentrifugieren Sie bei 200 X g für 10 min, mit 80 % Bremse.
- Aspirieren und den Überstand verwerfen und Aufschwemmen der Pellets beim Abwaschen des Kegels des konischen in 12 mL warmen RPMI.
- KCs trennen Sie der SECs, indem man den Überstand in Polystyrol Petrischale und in einem befeuchteten Gewebekultur-Inkubator für 8 min bei Raumtemperatur inkubieren.
- Aspirieren Sie die Medien mit einem 25-mL-Pipette und spülen Sie die Platte mit den gleichen Medien, mit der Pipette auf die verbleibenden Sekunden während der KCs sammeln mit der niedrigsten Geschwindigkeit festgelegt haften bis auf den Teller.
- Zentrifugieren Sie die SECs bei 200 X g für 10 min und Aufschwemmen Sie RPMI + 5 % FBS + Pen/Strep. Dann Titer der Zellen und Platz in Kollagen beschichtet Kultur Gerichte.
Ergebnisse
Eine fiktiv, raffinierte Methode zur Leber Durchblutung und Reinigung/Bereicherung der Hepatozyten und SECs wird hier vorgestellt, die ausführliche Tipps für die optimale Zelle Reinigung/Anreicherung ähnlich wie bei anderen gedruckten Berichte zusammengestellt in diesem verwiesen bietet Überprüfen Sie 5. Die entscheidenden Schritte, die für die zelluläre Reinigung Erfolg bestimmen in der Route und die technischen Details des Verfahrens Kollagenase Perfusion auftreten und werden in diesem Protokoll beschrieben. Der Aufbau für das Gerät ist relativ einfach und kostengünstig mit standard Laborgeräten, im Gegensatz zu anderen Systemen, die veröffentlichten11 (Abbildung 1). In diesem Set-up sitzt das Fach mit der Maus auf dem Wasserbad mit einigen der überschüssigen Schlauch in das Wasserbad, die Temperatur der Flüssigkeiten Vorrichtung in der Leber. Die Vorrichtung wie hier gezeigt kann für Mäuse und Ratten, mit einer etwas anderen Geometrie für Ratte Leber Perfusion12 (Abbildung 2) verwendet werden.
In diesem Verfahren ist die Leber über die Pfortader anstelle der Vena Cava (das ist eine andere populäre Perfusion Route) durchblutet, wegen seiner Mühelosigkeit des Zugangs in den Bauch und die Vene führt direkt in die Leber. Der Betrachter sollte bewusst sein, dass die Pfortader hat mehrere kleine Äste, die welche dem Perfusat Kurzschluss können, und der Katheter sollte, vorbei an diese Zweige für optimalen Erfolg13 (Abbildung 3 gelegt werden). Sobald die Pfortader erkannt wird, dienen gebogenen Pinzette zeichnen Sie eine chirurgische Naht oder Polyestergarn unterhalb der Pfortader zwischen der Leber und der überlegenen Pankreas-duodenalen Vene. Die Zangen werden auch verwendet, zu begradigen der Pfortader unter positiven Blutdruck (Abb. 4A). Die Nadel innerhalb der Katheter gelegt werden sollte, parallel und neben die Vene (Abbildung 4B) und die Abschrägung sanft in das Lumen der Vene (Abb. 4C) eingefügt werden soll. Die richtige Platzierung wird durch Blut erscheinen entlang des Katheters angezeigt. Sobald die Nadel zurückgezogen wird der Katheter sollte mit einem Gewinde darauf festgebunden stabilisiert werden und der Blutdruck zwingt Blut durch den Katheter. Es wird empfohlen, dass der Katheter an der Pumpenschläuche angeschlossen werden, bevor Blut heraus (Abbildung 4D) verschüttet. Sobald die Pumpe Schlauch verbunden ist, sofort schneiden Sie eine große Blutgefäße wie die Vena Cava oder Aorta Abdominalis für Blut/Flüssigkeit Entwässerung (Abb. 5A). Es ist in der Regel notwendig, die Seite der Bauchwand der Maus für ausreichende Entwässerung, geschnitten wie eine Ansammlung von Blut im Bauch es schwierig macht, die Perfusion Prozess zu visualisieren, und Blut kann in die Zelle Reinigung (Abbildung 5 übertragen B). Sobald die PBS zu durchspülen die Leber beginnt, wird die Leber mit der Abwesenheit von Blut (Abbildung 5C) blanchieren. Wenn nur ein paar der Lappen blanchieren, dann die wahrscheinlichste Ursache ist, dass der Katheter sich zu weit in die Leber befindet und muss langsam rückgängig gemacht. Nach Platzierung des Katheters bestätigt wird, verwenden Sie wasserdicht Klebeband um den Schlauch im Ort zu sichern. Allgemeine Labor Band ist in der Regel nicht ausreichend. Um die richtige Platzierung des Katheters zu bestätigen, drücken Sie das geschnittene Blutgefäß zur Entwässerung einzustellen und die Erhöhung der Druck in der Leber zu beobachten. Auf diese Weise hilft bei der Spülung Blut aus der Leber (Abbildung 5D). Dies sollte auch erfolgen, wenn die Kollagenase-Lösung geht zunächst in die Leber, um sicherzustellen, dass alle Lappen Kollagenase ausgesetzt sind. Nach der Kollagenase abläuft Lösung, eine gute Kollagenase-Verdauung durch Trennung der Glisson Kapsel aus dem Parenchym bezeichnend ist.
Das allgemeine Verfahren für die zelluläre Reinigung ist in Abbildung 6 skizziert und Abbildung 7 in die Hepatozyten frühzeitig im Verfahren bei der niedrigen Drehzahl geerntet werden dreht sich und sind sehr rein, nachdem 4 in BSA-haltigen Puffer (Abbildung 8 wäscht ). SECs Co mit KCs auf einem PvP-Verlauf (Abbildung 9A) gereinigt und dann durch selektive Haftung auf Kollagen-beschichtetem Polystyrol Petrischale getrennt. Die Reinheit der SECs mit dieser Methode ist 83-90 % rein und hängt weitgehend von der Gesamteffizienz der Kollagenase-Verdauung (Abbildung 9B). Quantitative Messungen mit Hilfe von Licht Mikroskopie (wie Hepatozyten und SECs Unterscheidungsmerkmale von anderen Zellen) zeigen, dass in einer repräsentativen Zubereitung Hepatozyten sind fast 100 % reines und Sekunden sind etwas mehr als 89 % rein (Tabelle 1). Alternativ eine höhere Anreicherung von Sekunden durch magnetische Spalte Trennung nach dem PvP-Steigung, erhalten aber das würde den Rahmen dieses Protokolls. Weitere Informationen über magnetische Trennung der SECs und KCs finden Sie im Meyer Et al. 9 und Liu Et al. 14 es sollte erinnert werden, dass die Lebensfähigkeit der Hepatozyten sinkt rasch in ein unzureichend verdauten Leber, aber dies gilt nicht notwendig für die NPCs. ungenügend verdaute Leber produzieren auch mehr Zelltrümmer, die nicht vollständig ist in die Zentrifugation Schritte eliminiert.
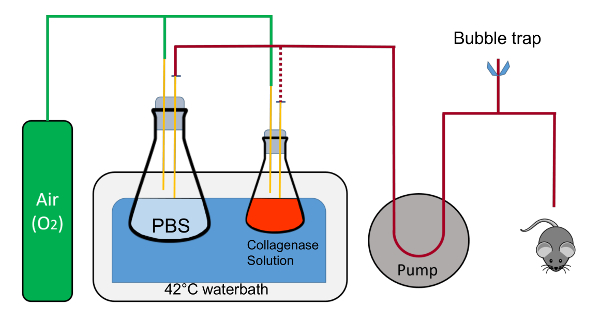
Abbildung 1 : Schematische Darstellung der Perfusion Suite. Die Flaschen werden durch Klemmen (nicht abgebildet); in Position gehalten. der Schlauch, mit dem enthaltenden Flüssigkeit während des Verfahrens aus der 1 L Flasche, die 125 mL Flasche getauscht ist wird durch die rot gepunktete Linie dargestellt. Beachten Sie, dass die Sauerstoff-Zufuhr nicht direkt in die Lösungen in die Fläschchen Blase. Die Korken sollten auch ausgeklinkt werden, um einen geschlossenen Kreislauf Strömung mit dem Schlauch, eingefügt in die Kerbe zu ermöglichen. Dies ist wichtig beim Aufwärmen der Schläuche und zum Auswerfen des Luftverkehrs innerhalb der Schläuche. Die Entlüftung besteht aus den T-Anschluss die Tygon Schlauch und Klemme Klemmen für schnelles Öffnen und Schließung des Systems verbunden ist. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Die Perfusion Suite während Maus Leber Perfusion. Das Fach mit der Maus befindet sich an der Ecke des Wasserbades. Der Sauerstoff ist von der Kollagenase-Lösung getrennt, da, die bereits beim Warm-up Sauerstoff war. Speicherort der Elemente sind Sauerstoff (A) Linien, (B) 1 L Flasche mit PBS, (C) 125 mL Flasche mit 2 Puffer mit Kollagenase, Pumpe (D), E) Pumpensteuerungen, F) Blase Trap, G) Flüssigkeit Linie, die von den Kolben durch die Pumpe und der Maus. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Bild des Gefäßsystems des Bauches Maus. Einführen des Katheters sollte knapp unterhalb der Magen und Pankreas Vene Kreuzungen kommen aus der Pfortader (grüner Punkt) und die Spitze in der Nähe der linken und rechten hepatischen Portal Venen (gelber Punkt) bildet eine Gabel in den wichtigsten Lappen der Leber gelegt werden sollte. Richtige Platzierung erreicht, sollte der Katheter mit Gewinde mit einer einfache Überhandknoten stabilisiert werden. K = Niere, L = Leber, SI = Dünndarm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 : Platzierung der Katheter in der Pfortader. (A) die Zange werden verwendet, um Blut Milchstau von der Pfortader zu gewährleisten und zu begradigen die Vene für die Platzierung des Katheters. (B) wird der Katheter parallel die Pfortader mit der Fase oben aufgereiht. (C) die schräge der Nadel innerhalb der Katheter wird in die Vene, nicht durch die Vene eingefügt. (D) die Nadel des Katheters ist eingefahren und Blut wird Rückfluss durch den Katheter, wie durch die Spitze von der Zange. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : Richtige Leber Perfusion. (A) nach dem Katheter Platzierung, die weiblichen Luer-Ende des Katheters mit männlichen Luer Ende (aus eine 1 mL Spritze geschnitten) der Pumpe Schlauch verbunden ist. (B) nach dem Schneiden eines der wichtigsten absteigenden Blutgefäße, Blut und PBS sind aus dem Bauch abgelassen, von der Seite der Maus mit einer Schere aufschneiden. (C) sollte die Leber blanchieren, während das Blut ausgeschwemmt und (D) wird unter Druck durch Quetschen geschlossen das geschnittene Blutgefäß mit der Pinzette anschwellen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6 : Schematische Übersicht über Hepatozyten Luftreinigungs- und NPC. Die meisten Zentrifugation Schritte sollen lebende und Tote Hepatozyten aus den nicht-parenchymal Zellen zu entfernen. Bitte klicken Sie hier für eine größere Version dieser Figur.
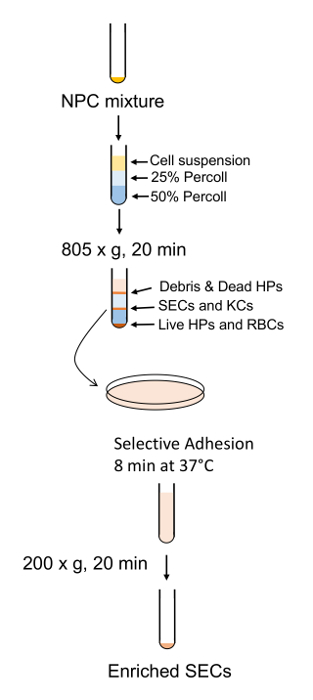
Abbildung 7 : Schematische Gliederung der SEC Bereicherung und Läuterung. NPCs werden durch die PVP-Neigung gefolgt von SEC-Trennung durch kurze Haftung zu einer standard-Polystyrol-Platte getrennt. Bitte klicken Sie hier für eine größere Version dieser Figur.
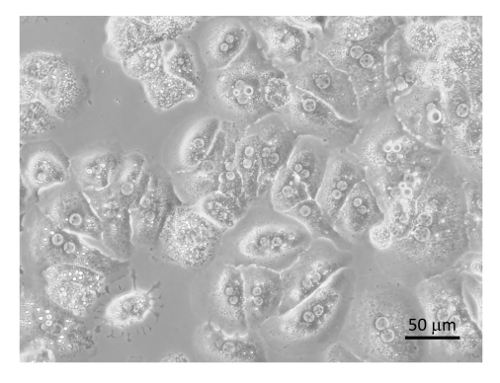
Abbildung 8 : Gereinigtes Hepatozyten. Hepatozyten waren auf Kollagen beschichtet Gewebekultur Platten mit DMEM + 8 % FBS + Pen/Strep überzogen und durch ein Mikroskop bei 400 X 6 h gefolgt von Bildsammlung inkubiert. Bar entspricht 20 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
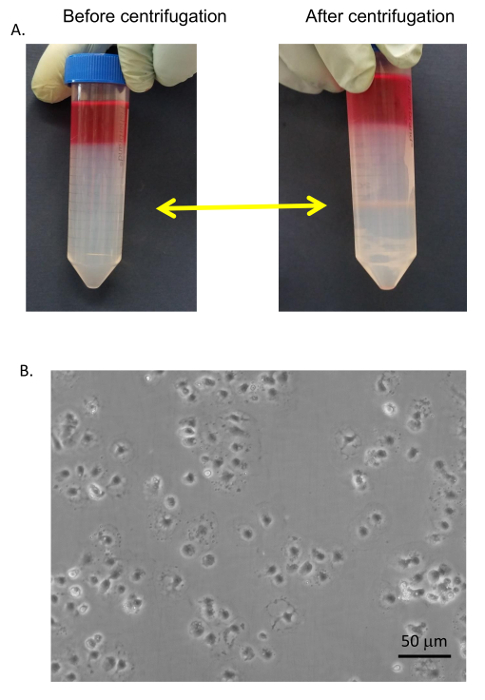
Abbildung 9 : SEC Reinigung. (A) Sekunden und KCs wurden gesammelt von 25/50 % PvP-Interface (gelbe Pfeile) und mit serumfreien Medium gewaschen. (B) die SECs wurden getrennt von der KCs durch selektive Haftung auf standard-Petrischalen, gewaschen und vergoldet auf Kollagen-beschichtete Gewebe-Kultur Gerichte in RPMI + 5 % FBS. Bilder wurden durch ein Mikroskop EVOS invertiert bei 400 X. Bar entspricht 20 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 10 : Rasterelektronenmikroskopie der Maus Leber Anatomie. Eine Maus Leber durchströmt wurde mit PBS gefolgt von Fixativ (100 mM Natrium Cacodylate, 12 mL 25 % Glutaraldehyd, 15,6 mL 16 % Paraformaldehyd, 2,65 mM Kalzium-Chlorid, 180,2 mM Saccharose, in 100 mL Lösung gemischt) mit einer Rate von 1 mL/min für 4 min. Gewebe geschnitten wurden und für Rasterelektronenmikroskopie vorbereitet. Bilder wurden gesammelt auf einem Field Emission SEM um 10, 000 X. Gelbe Pfeile zeigen die Mikrovilli zwischen den Hepatozyten. Bar ist gleich 5 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 11 : Visualisierung der Toten gegenüber live Hepatozyten. Nachdem 2 mit Puffer 1 wäscht, können gebeizte Hepatozyten lebenden/Toten-Verhältnis mit dem Auge beurteilt werden. Ein leichter Pellet (links) zeigt an, dass mindestens die Hälfte der Hepatozyten tot sind. Das dunklere Pellet auf der rechten Seite ist stärker an der Unterseite des Rohres pelleted und ist mehr als 90 % Leben. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Tabelle 1: Zelle Reinigung | ||
| Zelltyp | %-Ziel-Zellen | % andere Zellen |
| Hepatozyten | 99 | 1 |
| Sinsusoidal Endothelzellen | 89,1 | 10.9 |
Tabelle 1: Bewertung der Zelle Reinheit durch Lichtmikroskopie.
Diskussion
Dieses Protokoll unterstreicht die Werkzeuge zur Verfügung stehen und leisten, dass des Benutzers eine hohe Rate des Erfolges in diesem Verfahren. Eine erfolgreiche Perfusion ist von grundlegender Bedeutung für alle nachgelagerten Anwendungen, beim Arbeiten mit Primärzellen.
Es gibt ein paar wichtige Schritte des Verfahrens, die Erfolg bestimmen. Erstens muss die Platzierung der Katheterspitze in die Pfortader korrekt sein. Wenn zu weit innen die Leber platziert, werden nur die kleinere Lappen durchblutet. Die Spitze sollte knapp unterhalb der rechten und linken Zweige der Portalader sein. Der Vorteil der Verwendung eines Polymer-Composite-Katheters über eine Nadel ist, dass die Widerhaken der Nadel eher die Vene während der Perfusion als einen Katheter zu reißen. Zweitens bestimmen Kollagenase qualitativ und quantitativ die Effizienz der Verdauung der Leber. In diesem Verfahren vorqualifizierten Kollagenase Typ 4 diente und es ist Nukleinsäuretablette bei 0,5 mg/mL in Puffer 2 ist größer als 900 IU die Kollagenase-Aktivität untersucht werden.
Am Ende der Kollagenase-Perfusion sollten die Leber eine etwas dunkle Bräune Farbe behalten. Wenn es eine leichte braune Farbe ist, sind die meisten von den Hepatozyten tot. Die Leber sollte beim Schneiden von der Maus zerfallen sein. Unter den besten Bedingungen kann die Leber aus der Körperhöhle der Maus mit einem kleinen Löffel geschöpft werden. Leber in diesem Zustand geben immer sehr hohe Zellviabilität. Dauert es viel Aufwand, um die Zellen auseinander, schütteln, wenn die Leber während der Extraktion noch fest ist, ob es ist viel Kraft erforderlich, um die Hepatozyten durch die Filter zu bewegen, werden die Hepatozyten eine geringere Tragfähigkeit haben. Hepatozyten fallen mit Mikrovilli, wodurch sie eine sehr große Oberfläche (Abbildung 10) haben. Unvollständige Verdauung behält Zell-Zell-Verbindungen zwischen Hepatozyten und mechanische Scherung wird die Plasmamembran auseinander reißen. In Situ Perfusion mit Kollagenase ist die beste Methode, um die Zellen auseinander brechen und hohe Rentabilität zu erhalten. In Abbildung 11zwei Hepatozyten, die Vorbereitungen getroffen werden, in die die Zelle pellets wurden nach ein paar wäscht in Puffer 1 verglichen. Das Pellet auf der linken Seite ist leichter und enthält eine Zellenentwicklungsfähigkeit von etwa 50 %. Das Pellet auf der rechten Seite ist dunkler und hat eine Tragfähigkeit von 92 %. Ebenso, wenn die Flüssigkeit aus den 50 mL konische gegossen wird, ist das dunklere Pellet stationär innerhalb der Röhre, im Gegensatz zu leichteren Pellets, die in die Röhre schieben wird, wie die Flüssigkeit abgegossen. Unteren Zellviabilität oder ineffiziente Verbandwechsel können auftreten, wenn die Leber hohe Sklerose hat.
Da live Hepatozyten eine höhere Dichte als tot Hepatozyten haben, werden die Zentrifugation Verfahren eine Vorbereitung dazu führen, dass hochreines in tragfähige Hepatozyten15. Wenn es eine erhebliche Menge an Toten Hepatozyten gibt (die oft auftritt, wenn suboptimale Bedingungen), live können Zellen weiter angereichert und von abgestorbenen Zellen mit PVP Steigungen getrennt. Darüber hinaus da live Hepatozyten schneller als tot Hepatozyten Pellets, erhöht Aspiration von den Top 3rd des Pellet-auch das Verhältnis von live an abgestorbenen Zellen in das Pellet. Diese Verfahren sind schnelle und einfache Methoden, um separate live aus Toten Hepatozyten und Zelle Rückstand bei Bedarf10,16. Dies ist besonders nützlich, wenn die Probe kostbar ist, und nur ein paar Millionen Zellen für das Experiment benötigt werden.
Zusammenfassend handelt es sich um eine einfache und effiziente Methode für die Ernte von Hepatozyten und Sekunden aus der Leber. Zu laufenden Preisen sind die Kosten für die Durchführung dieses Verfahrens einschließlich aller Reagenzien und Verbrauchsmaterialien unter 75 USD pro Vorbereitung. Wenn mehrere Mäuse gewünscht werden, empfiehlt es sich, fahren mit der Hepatozyten Reinigung und halten die NPC-Fraktion auf Eis, bis alle Mäuse verarbeitet wurden. NPCs sind in der Regel stabil auf Eis für mindestens 5 h, aber längere Zeit nicht in diesem Labor getestet wurden.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Teilweise wird durch das NIH Grant R01HL130864 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 L Erlenmeyer flask | Fisher Scientific | S63274 | |
| 250 mL Erlenmeyer flask | Fisher Scientific | S63271 | |
| silicone tubing | Cole-Parmer | 96400-14 | This tubing runs from the flasks through the pump to the T connector and then to the 1.0 mL syringe that is connected to the catheter. |
| Tygon tubing | Fisher Scientific | R3603 | Used as an adaptor between 96400-14 and pipettes and T connector. This may also be used for the oxygen tubing. |
| T-connectors | Cole-Parmer | EW-06294-82 | |
| Quick dissconnects | Fisher Scientific | 6150-0010 | |
| Pinch Clamps | Fisher Scientific | 6165-0002 | |
| Masterflex L/S Variable speed Pump, model 7553-70 | Cole-Parmer | EW-07559-00 | Periplastic pump with variable speed |
| Pump head, model 7014-20 | Cole-Parmer | EW-07014-20 | |
| glass graduated 1.0 mL pipettes | Fisher Scientific | 13-678 | |
| curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Dumont forceps | Fine Science Tools | 11252-20 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| 10 mL syringe | Fisher Scientific | 03-377-23 | Only barrel of syringe will be needed |
| sterlized spoon | Home supply store | ||
| Cotton ball(s) | Home supply store | ||
| Polyester sewing thread | Home supply store | ||
| Masking tape | Home supply store | ||
| thumb tacks | Home supply store | ||
| styrofoam pad | 50 mL conical rack | ||
| cookie/baking sheet | Home supply store | ||
| Absorbant underpads | Fisher Scientific | 14-206-64 | |
| 19 L water bath | Fisher Scientific | TSCOL19 | |
| BD Insyte Autogaurd Shielded IV Catheter 24 guage | Becton Dickinson | 381412 | Plastic cathetar with retractable needle |
| Crystallizing dishes 100x50 | VWR | 89000-290 | |
| Polystyrene petri dishes | Sigma Aldrich | P5481-500EA | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| graduated pipettes (5 mL) | Fisher Scientific | 170355 | |
| graduated pipettes (25 mL) | Fisher Scientific | 170357 | |
| EasyStrainer 100 μM | Greiner bio-one | 542000 | 100 μm filter |
| EasyStrainer 40 μM | Greiner bio-one | 542040 | 40μm filter |
| Sterile transfer pipettes | Fisher Scientific | 13-711-20 | |
| Refrigerated swinging bucket centrifuge | Sorvall Legend XTR | 75-217-406 | Centrifuge with swinging bucket rotar |
| Galaxy 170R tissue culture incubator | Eppendorf | CO170R-120-0000 | Humidified tissue culture incubator |
| Reagents | |||
| Name | Compound | Grams (g/L) | Millimolar (mM) |
| Buffer 1, pH 7.4 | NaCl | 8.3 | 142 |
| KCl | 0.5 | 6.7 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| Buffer 2, pH 7.4 | NaCl | 3.9 | 66.74 |
| KCl | 0.5 | 6.71 | |
| CaCl2 | 0.7 | 6.31 | |
| HEPES | 24 | 100 | |
| BSA | 15 | 0.226 | |
| Phenol Red | 0.01 | 0.03 | |
| Buffer 3, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.35 | 4.7 | |
| MgSO4 | 0.08 | 0.66 | |
| CaCl2 | 0.18 | 1.62 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| PBS, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.2 | 2.7 | |
| Na2HPO4-7H2O | 1.15 | 4.3 | |
| KH2PO4 | 0.2 | 1.4 | |
| Other reagents | |||
| Name | Company | Catalog Number | Comments |
| Percoll (PVP solution) | GE Healthcare | 288555 | |
| Collagenase Type IV | Sigma Aldrich | C5138 | |
| Isoflurane | Abcam | ab144581 | |
| Hepatocyte Growth Medium | |||
| DMEM | Gibco | 11965118 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Long-term Hepatocyte Growth Medium | |||
| DMEM | |||
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Glucagon | Sigma | G3157-2mg | 14 ng/mL |
| Insulin | Sigma | I9278-5mL | 0.5 U/mL |
| Hydrocortisone | Sigma | H0888-1g | 7.5 mg/mL |
| Epidermal Growth Factor | BD Biosciences | 354001-100ug | 20 ng/mL |
| LSEC medium | |||
| RPMI | Gibco | 11875119 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 |
Referenzen
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods Cell Biol. 13, 29-83 (1976).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. J Exp Med. 94 (5), 431-453 (1951).
- Edstrom, S., Ekman, L., Ternell, M., Lundholm, K. Isolation of mouse liver cells: perfusion technique and metabolic evaluation. Eur Surg Res. 15 (2), 97-102 (1983).
- Meyer, J., Gonelle-Gispert, C., Morel, P., Buhler, L. Methods for Isolation and Purification of Murine Liver Sinusoidal Endothelial Cells: A Systematic Review. PLoS One. 11 (3), 0151945 (2016).
- Sies, H. The use of perfusion of liver and other organs for the study of microsomal electron-transport and cytochrome P-450 systems. Methods Enzymol. 52, 48-59 (1978).
- Smedsrod, B. Protocol for preparation of mouse liver Kupffer cells and liver sinusoidal endothelial cells. Munin open research archive. , 1-10 (2012).
- Smedsrod, B., Pertoft, H., Eggertsen, G., Sundstrom, C. Functional and morphological characterization of cultures of Kupffer cells and liver endothelial cells prepared by means of density separation in Percoll, and selective substrate adherence. Cell Tissue Res. 241 (3), 639-649 (1985).
- Meyer, J., Lacotte, S., Morel, P., Gonelle-Gispert, C., Buhler, L. An optimized method for mouse liver sinusoidal endothelial cell isolation. Exp Cell Res. 349 (2), 291-301 (2016).
- Kreamer, B. L., et al. Use of a low-speed, iso-density percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations. In Vitro Cell Dev Biol. 22 (4), 201-211 (1986).
- Meijer, D. K., Keulemans, K., Mulder, G. J. Isolated perfused rat liver technique. Methods Enzymol. 77, 81-94 (1981).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. J Vis Exp. (57), e3138 (2011).
- Cook, M. J. . The Anatomy of the Laboratory Mouse. , (1965).
- Liu, J., et al. Advanced Method for Isolation of Mouse Hepatocytes Liver Sinusoidal Endothelial Cells, and Kupffer Cells. Methods Mol Biol. 1540, 249-258 (2017).
- Knobeloch, D. E., Ehnert, S., Schyschka, L., Buchler, P., Schoenberg, M., Kleeff, J., Thasler, W. E., Nussler, N. C., Godoy, P., Hengstler, J., Nussler, A. K. Human Hepatocytes: Isolation, Culture, and Quality Procedures. Methods in Molecular Biology. 806, 99-120 (2012).
- Clarke, B. L., Weigel, P. H. Recycling of the asialoglycoprotein receptor in isolated rat hepatocytes. ATP depletion blocks receptor recycling but not a single round of endocytosis. J Biol Chem. 260 (1), 128-133 (1985).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten