Method Article
Очистка гепатоцитов и синусоидальных эндотелиальных клеток от мыши печени перфузии
В этой статье
Резюме
Целью настоящего Протокола является получить высокую жизнеспособность и высокодоходных гепатоцитов и синусоидальных эндотелиальных клеток печени. Это достигается путем perfusing печени с раствором коллагеназы IV типа через воротной вены, следуют дифференциального центрифугирования для получения гепатоцитов и синусоидальных эндотелиальных клеток.
Аннотация
Этот протокол демонстрирует метод для получения высокой урожайности и жизнеспособности для мыши гепатоцитов и синусоидальных эндотелиальных клеток (в секундах) подходит для культивирования или для получения lysates клетки. В этом протоколе воротной вены используется как сайт для катетеризации, вместо верхней полой вены, как это ограничивает загрязнение других типов возможных клеток в окончательной подготовке печени. Без специальных приборов требуется на протяжении всей процедуры. На водяной бане используется в качестве источника тепла для поддержания температуры всех буферов и решения. Стандартный Перистальтический насос используется для привода жидкость, и охлажденных настольная центрифуга для процедур центрифугирования. Единственным ограничением этой методики является размещение катетер в воротной вены, которая является сложной задачей, на некоторых из мышей в диапазоне размеров 18-25 g. Преимущество этой техники, что только один ключе используется для перфузии и доступ к Вену является быстрый, который минимизирует ишемии и реперфузии печени, уменьшает жизнеспособность клеток печени. Еще одно преимущество этого протокола, что это легко отличить жить от погибших гепатоцитов, зрение из-за разницы в клеточных плотности во время центрифугирования шаги. Клетки из настоящего Протокола может используется в культуре клеток для любого приложения, ниже по течению, а также обработаны для любой биохимической оценки.
Введение
Коллагеназы перфузии печени для получения гепатоцитов была выполнена в начале 50-х годов и постоянно улучшал на1,2,3,4. Очень хороший обзор многих методик, методов и реагенты используемые в клетки печени очистки был составлен в Meyer et al5. Получение удовлетворительных доходность весьма жизнеспособной гепатоцитов и SECs является технически сложным. Механических сил, которые отделяют клетки, включая качество коллагеназы являются некоторые из переменных, которые трудно контролировать. Из-за чувствительности гепатоцитов в механических сил их жизнеспособность заметно уменьшается в югу оптимальных условий, вызвав необходимость в протоколе, описывающие оптимальные условия для изоляции. SECs представляется не так чувствительны к механической резки. В situ перфузии с пищеварением коллагеназы на сегодняшний день является лучшим методом сорвать ячеек соединения для получения препаратов одну ячейку из печени и других органов, таких как6кишечника и селезенки. Этот протокол демонстрирует простой метод для внедрения перфузии буфера в воротной вены с помощью раздвижной катетера, вместо того, чтобы надрез, которые могут вызвать воротной вены к краху, как описано в Smedsrød et al7.
Цель этой рукописи должен продемонстрировать наиболее важные шаги, необходимые для успеха в процедуре печени изобилие. Эти шаги включают в себя размещение катетер, поток жидкости перфузии и обработки ткани после переваривания. Скорости потока скорректированные выше скорость кровотока, но достаточно низким, чтобы сохранить Глиссон капсула нетронутыми. После того, как должным образом усваивается печени и клетки отделяются в растворе, очистка ячейки является относительно простой ли оно осуществляется дифференциального центрифугирования, пластина сцепления, или путем очистки магнитный шарик. Живой гепатоциты имеют более высокую плотность и легко очищается от nonparenchymal клеток (НПС) и погибших гепатоцитов с медленным скорость центрифугирования. Для большинства приложений пластина сцепления для разделения Купфера клетки (КИС) и SECs общий метод8, хотя есть сообщения, что она не производит лучшие чистота SECs9. Кис имеют тенденцию придерживаться жестких твердых поверхностей быстро и Петри (стандартный полистирол) являются наиболее часто используемый материал для этой процедуры. Хотя процедура добавляет еще 3-4 h на этот протокол и урожайность снизилась9сек или KC очистки с использованием конъюгированных антител магнитные бусы, несомненно, лучший метод для значительных очистки этих клеток. Этот отчет демонстрирует в деталях процесс для оптимального печени перфузии, которая обычно дает большое количество жизнеспособных клеток.
протокол
Все животные процедуры, изложенные в настоящем протоколе были одобрены институциональный уход животных и использование Комитет (IACUC) в Университете Линкольна - Небраска протоколом #1435.
1. Подготовка
- Подготовка решений и культуры средств массовой информации
- Подготовьте все культуры средств массовой информации и буфера согласно Таблице материалов.
- Подготовка документов
- Настройка на водяной бане (> 10 Л) при 42 ° C, Перистальтический насос с регулируемой скоростью и зажимы для проведения колбы. Подготовьте изогнутые ножницы и щипцы (рис. 1).
- На или рядом с водяной бане настроить лист выпечки (около 38 x 26 см) с площадкой из пенопласта (50 мл конические стойки), обложил с абсорбирующей underpad, нарезать кусок 20 x 20 см (рис. 1).
- Поместите кусок липкой лентой (5-8 см) поблизости. Место 20 см полиэфирные нитки поблизости, вырезать и готова к использованию. Получите катетера с выдвижным иглой (7 мм x 19 мм, рис. 1).
- Подготовка стекла
- С помощью хомутов, место и иммобилизации флакон 1 Л на водяной бане, содержащие 200 мл с пробкой, которая имеет два 1 мл пипетки, идя в раствор ПБС. Резиновые пробки зубчатый разрешить рециркуляции жидкости в замкнутом контуре.
- С другой зажим место 125 мл флакон, содержащий 45 мл буфера 2 наряду с пробкой, которая имеет два 1 мл пипетки, один из которых находится в жидкости в нижней части колбы и другой который остается выше жидкости и дует кислорода в колбу.
Примечание: Каждая Пипетка в пробки будет иметь быстро отсоединить адаптер, прилагается к концу для лёгкого переключения труб. Кислород будет нежно впадающих в обоих колбы через пипетку в пробку, не погружается в жидкость. - Отложите двух стерильных кристаллизации блюда.
2. животных процедура
- Разогреть PBS и буфера 2 решения до 42 ° C на водяной бане и распространить PBS для по крайней мере 20 мл/мин в трубке в замкнутой цепи, чтобы согреться жидкой линии. Погружать любой избыток труб на водяной бане, чтобы оставаться как можно ближе к 42 ° C. Слейте мужской конец трубки в 1 Л флакон содержащий PBS.
- Поместите ватный тампон на абсорбирующий underpad и добавить около 2 мл 30% изофлюрановая (составленная в полиэтиленгликоль 200, что снижает скорость испарения изофлюрановая) на ватный шарик с помощью пипетки передачи.
- Поднимите мыши, хвост, поместите его в одном из кристаллизации блюд и затем быстро перевернуть блюдо на ватный шарик так, что мышь имеет небольшое пространство в котором вдыхать анестезии. Наблюдать за частоту дыхания мыши и убедитесь, что мышь является эффективно под наркозом.
Примечание: Частота дыхания должна быть медленнее и глубже, хвост вялым и лапы свертывать в крайнем случае тест под наркозом; IACUC руководство для получения дополнительной информации см. - В то время как мышь идет под наркозом (это занимает 1-2 мин), подготовьте ствол 10 мл шприц, потянув поршень и вставив маленький ватный шарик. Добавить 1-2 мл 30% изофлюрановая с передачей пипетки ватный шарик внутри ствола и место ствол open-end вниз на столе во время ожидания для мыши, чтобы стать бессознательного.
- Быстро снять кристаллизации блюдо, переверните мышь на его спине и поместите шприц ствол его нос. Дважды проверьте частоту дыхания, мыс Пинч и вялого хвост. Любые ответы на мыс Пинч и вялого хвост означает, что мышь не является полностью под наркозом. Держите ствол шприца над морду поддерживать бессознательного.
- Место пальца тэксы через лапы мыши, с конечностей, протянутой в лежачем положении. Влажные живота и грудной клетки с 70% изопропиловый спирт или этанола.
- С прямой щипцами в одной руке поднимите вверх кожу у основания живота. С ножницами с другой стороны сократить палаточных кожи и брюшины. Разрез должен быть горизонтальным или через базу палаточных кожи. Убедитесь в том, чтобы прорваться через все слои кожи и брюшины для того, чтобы получить доступ в кишечнике. Вырежьте боково вокруг живота до грудная клетка с обеих сторон без уменьшение поперечного сечения любого из органов.
- Cut off лоскут кожи резки по всей нижней грудной клетки. Перемещение вправо кишечника с задней части щипцов подвергать воротной вены.
Примечание: Кровотечение из животного должно быть минимальным; животное должно все еще быть дыхание и глубокие анестезию. - Место закрытой Изогнутый пинцет под воротной вены печени и Улучшенный pancreaticoduodenal вен (Рисунок 3 стрелка).
- Откройте щипцы под воротной вены. Возьмите нить и аккуратно вытяните ее, так что он центрируется под воротной вены. Галстук зашитый узел вокруг воротной вены без обеспечивающая его вниз.
- Разместите изогнутый пинцет под воротной вены и аккуратно потяните его к хвосту мыши чтобы выправить вен (рис. 4A).
- С катетер с другой стороны место скос иглы вверх и параллельно с нижней части воротной вены вблизи щипцы (Рисунок 4B).
- Аккуратно пункции Вены с иглой (рис. 4C). Убедитесь, что скос иглы в просвете Вены. Убрать подпружиненной иглы и продолжать настаивать полимерный катетер через Вену, пока скоса районе венозной разветвленные. Это в пределах печени. Если правильно размещен катетер, обратного потока крови будет видимым. (Рис. 4D).
- Затяните зашитый узел и потяните ее вниз на катетер, чтобы помочь стабилизировать его. Сразу же поверните вниз насоса от 20 мл/мин-4 мл/мин и сократить еще крупных кровеносных сосудов для дренажа. Вырежьте аорты abdominalis для достижения оптимальных результатов.
- Поместите мужской конец трубки в женской конец катетера (рис. 5A). Убедитесь, что в строке нет пузырьков воздуха. Будьте осторожны, что катетер не является ни толкнул в печени или из Вены. Размещение потока не является существенным, хотя это помогает предотвратить обратного потока из Вены и помогает держать катетер в правильном положении (рис. 5B, C).
- Использование клейкой ленты для фиксации труб на underpad. Используйте корнцанг прямой выжать сточных кровеносных сосудов печени надуть несколько раз для обеспечения всех кровь вытекла (рис. 5D).
Примечание: Стандартные лабораторные ленты не может работать; Однако лента будет оставаться застрял в underpad, даже во влажных условиях.
3. печени перфузии
- В то время как печень промывка с PBS, Отмерьте около 24 мг коллагеназы типа IV и поместите его в колбу, содержащие 45 мл 2 буфера в водяной бане. Не забудьте вихрем жидкости в колбу, таким образом, чтобы полностью растворяется коллагеназы и место флакон обратно в держатель так, что жидкости содержащие часть колбы полностью погружен в воду.
- Изменение цвета печени следует наблюдать, как она очищается с PBS. Измените отток труб от флакон 1 Л 125 мл флакон. Не позволяйте пузырьки воздуха поступать в печени.
- Как только буфер перфузии достигает печени, кратко Сожмите туго сточных кровеносного сосуда для создания некоторых давления внутри судна и разрешить эту жидкость для заполнения всех долей печени. Будьте уверены, чтобы не отрезать дренажа слишком долго, как это может лопнуть тонкой соединительной ткани, окружающие печени (Глиссон капсула) и уничтожить перфузии или потока жидкости в пределах капиллярного русла печени.
- Разрешить 2 буфера с коллагеназы perfuse через печень, до тех пор, пока все 45 мл текла через ткани.
Примечание: В случае успеха, Глиссон капсула должны быть отделены от паренхиме или ткани печени и печени сам должен появиться аморфные. - Добавить около 10 мл буфера 1 кристаллизации блюдо и поместить его рядом с мышью.
- Удаление катетера и выключить насос.
- С прямой щипцы и ножницами, вырезать печени от мыши. Если коллагеназы пищеварение было очень эффективно, оно может быть необходимо иметь чистый, стерильной ложкой под рукой, чтобы зачерпнуть печени от мыши и поместить его в буфер 1.
4. гепатоцит очистки
Примечание: Манипуляции клеток выполняются в стерильных культуры ткани капюшоном для ограничения загрязнения, если клетки культивировали во всех последующих шагах.
- Используя стерильную методику, захватить печени с щипцами и осторожно встряхивайте клетки печени. Разорвать или тянуть обратно Глиссон капсула: буфер станет непрозрачным, как клетки сотрясаны из печени.
- Слить раствор клеток в 50 мл конические с 100 мкм фильтром, помещаются над верхней частью.
- Добавить больше буфер 1 в печени остатки и продолжают сотрясать вне клетки. Продолжайте, пока печень появляется лишенный клетки или когда непереваренные часть печени не дают больше клеток.
- Залейте клеточной жидкости в другой 50 мл конические, содержащий 40 мкм фильтром.
- Центрифуга конические в размахивая ведро ротора на 100 x g на 3 мин.
Примечание: Не используйте максимальный тормозной, как это может выбить Пелле ячейки. Используйте тормоз на 80%, что является достаточным для всех оставшихся шагов центрифугированием при температуре 4 ° C - Слить супернатант (который содержит НПС и погибших гепатоцитов) в чистой конические и поместите его на льду. Убедитесь, что это делается в одно движение соблюдать Пелле присоединения.
- Ресуспензируйте гранулы в 40 мл буфера 1. Повторите шаги с 4.5 и 4.6. Ресуспензируйте гранулы в 40 мл 3 буфера. Повторите шаги с 4.5 и 4.6 дважды.
- Ресуспензируйте очищенный гепатоцитов в теплой среде DMEM + 10% FBS + 2 x пенициллин-стрептомицином (Pen/Strep).
- Если клетки культивировали на коллаген покрытием пластин, позволяют им следовать за 1 ч и заменить средства массовой информации по крайней мере один раз как это позволит предотвратить любой зарождающейся бактериальных загрязнений.
- Сделайте коллагена покрытием пластин, инкубации их с 0,05% коллагена в 0,001% уксусной кислоты для по крайней мере 1 ч при 37 ° C, а затем мытье с ПБС.
- Если является низкая жизнеспособность гепатоцитов и есть желание получить очищенный высокой жизнеспособной гепатоцитов, а затем использовать следующий протокол адаптировано из Kreamer et al10.
- Mix 9 томов PVP раствора (Percoll, 23% w/w раствор воды и 15-30 Нм кремнезема коллоидных частиц покрытием в поливинилпиролидон центрифугирования плотности) и 1 объем 10 x HBSS чтобы сделать iso осмотического PVP раствор (SIP).
- Добавить 24 мл SIP в стерильных 50 мл конические который может храниться в этих условиях на срок до 2 месяцев при 4 ° C.
- Регулировка концентрации гепатоцитов к 5-10 × 106 клеток/мл с питательной среды, как отмечается в шаге 4.8.
- Добавить 25 мл суспензии клеток в каждой 24 мл SIP, содержащие конические и смешайте нежно инверсии. Плотность этого решения составляет 1,06 г/мл.
- Центрифуга для конических в 50 g x 10 мин при 4 ° C.
- Аспирационная SIP и флокулянта и Ресуспензируйте клетки в HBSS.
- Вымыть клетки центрифугированием при 50 g x 10 мин при 4 ° C.
- Повторите шаг 4.10.6 еще раз и затем Ресуспензируйте клетки в среднего роста.
5. сек очистки
- Пелле клетки в supernatants из шага 4.6, крутя трубы на 163 x g 10 мин отклонения supernatants из труб и Ресуспензируйте все ячейки гранул в 5 мл RPMI без сыворотки и объединить их вместе в одной из труб.
- После того, как были объединили все гранулы, добавить RPMI окончательный объем 35 мл.
- Центрифуга для пула конические в 25 x g за 3 мин тщательно аспирационная Топ 25 мл RPMI с пипеткой 25 мл и место этот носитель, содержащий НИПы в чистой 50 мл конические на льду.
- Добавить 25 мл свежего RPMI обратно к трубе и Ресуспензируйте гранулы.
- Повторите шаг 5.3 для второй мыть и бассейн супернатант. Отменить оставшиеся 10 мл средства массовой информации и гранулы (пеллеты состоит в основном из погибших гепатоцитов). Центрифуга для пула супернатант в 163 g x 10 мин.
- Во время центрифугирования Подготовьте градиентов решения PVP в 50 мл конические.
- Добавьте 15 мл 50% раствора PVP к 50 мл конические следуют 20 мл 25% Percoll обложил с дозаторов, установить наименьшую скорость эжекции. Обязательно соблюдать линию рефракции на отметке 15 мл, который разграничивает два слоя, как это, где SECs и Кис будет агрегировать после центрифугирования.
- Ресуспензируйте клетки, ранее гранулированных в шаге 5.5 в 10 мл холодного RPMI и обложи их на PVP решения градиента. Не забудьте сохранить четкое разграничение между двумя слоями. Центрифуга градиента на 805 x g 20 мин с тормозом на 50%.
- Аспирационная сверху вниз до отметки 20 мл на трубе и отменить этот материал. С 5 мл передачи пипетки Соберите SECs и Кис, которые расположены в интерфейсе 25/50%. Отменить любые коричневый скопления клеток, как эти мертвые гепатоцитов.
- Место клетки в 50 мл конические и добавить RPMI до отметки 50 мл для разбавления PVP решения. Центрифуга на 200 x g за 10 мин, с 80% тормозом.
- Ресуспензируйте гранулы во время смыва конуса конических в 12 мл теплой RPMI аспирационная и удалить супернатант.
- Отделить секунд от Кис, поместив супернатант в полистирол Петри и инкубировать в увлажненные ткани культуры инкубатор для 8 мин при комнатной температуре.
- Аспирационная СМИ с пипеткой 25 мл и промойте пластины с же СМИ, с дозаторов набор на низкой скорости для сбора оставшихся секунд пока KCs присоединиться к пластине.
- Центрифуга секунд на 200 x g 10 мин и Ресуспензируйте RPMI + 5% FBS + ручка/воспаление. Затем титр клетки и место в коллагена покрытием культуры блюда.
Результаты
Демонстрационные, изысканный для печени перфузии и очистки/обогащение гепатоцитов и SECs представлен метод здесь, предоставляющий подробные советы для оптимального клеток очистки/обогащения похож на других печатных отчетов, компилируются в этом ссылки Обзор 5. Важнейшие шаги, которые определяют успех для сотовых очистки происходят в маршрут и технические детали процедуры перфузии коллагеназы и изложены в настоящем Протоколе. Установка для аппарата является довольно простым и экономически эффективным с стандартным лабораторным оборудованием, в отличие от других систем, которые были опубликованы в11 (рис. 1). В этой настройке лоток держа мышь сидит на водяной бане с некоторыми из избыток труб в водяной бане для поддержания температуры жидкости, perfusing в печени. Аппарат, как показано здесь может использоваться для мышей и крыс, с несколько иной геометрии для крыс печени перфузии12 (рис. 2).
В этой процедуре, печень является увлажненную через воротной вены вместо верхней полой вены (это еще один популярный перфузии маршрут) из-за своей простоты доступа внутри живота и что Вену каналы непосредственно в печени. Средство просмотра следует иметь в виду, что воротной вены имеет несколько небольших филиалов, которые могут короткого замыкания perfusate, и катетер должен находиться в прошлом эти ветви для оптимального успеха13 (рис. 3). После того, как определена воротной вены, изогнутый пинцет используются для рисования шовного или полиэфирной нити под воротной вены между печень и Улучшенный поджелудочной железы дуоденальное Вену. Щипцы, также используются для выправить воротной вены, который находится под положительным давлением крови (рис. 4A). Иглы в катетер должны находиться параллельно и рядом с вен (Рисунок 4B) и скос должен быть аккуратно вставлен в просвет Вены (рис. 4C). Правильное размещение будет указываться крови появляются вдоль катетер. После того, как отказался от иглы катетера должны быть стабилизированы с привязанным на него поток и кровяное давление будет заставить кровь вверх через катетер. Рекомендуется, что катетер быть подключен к трубе насоса до крови выплескивается (рис. 4D). После подключения шланга насоса, немедленно сократить крупных сосудов верхней полой вены или аорты abdominalis для стока крови/жидкости (рис. 5A). Это обычно необходимо сократить стороне брюшной стенки мыши для достаточного стока, как накопление крови в брюшной полости трудно визуализировать процесс перфузии, и кровь может переносить в ячейке очистки (рис. 5 B). как только PBS начинает perfuse печени, печень будет Бланч с отсутствием крови (рис. 5C). Если только несколько долей бланшировать, то вероятной причиной является что катетер был сделан слишком далеко внутри печени и нужно будет подкрепляться медленно. После подтверждения размещения катетера, используйте водостойкие лента для защиты трубы в месте. Общие лабораторные лента обычно не является достаточным. Для подтверждения правильного размещения катетера, сожмите отрезока кровеносного сосуда прекратить дренажа и наблюдать увеличение давления в печени. Делать это будет помощь в очистке крови из печени (рис. 5D). Это должно быть сделано когда коллагеназы решение сначала переходит в печень, чтобы обеспечить, что все лепестки подвергаются воздействию коллагеназы. После коллагеназы решение иссякнут, хороший коллагеназы пищеварение ориентировочный путем разделения Глиссон капсулы из паренхимы.
Общая процедура для сотовых очистки приводится на рисунке 6 и рис. 7 , в котором гепатоцитов собирают рано в процедуре во время низкой скорости спины и очень чистый, после 4 моет в BSA-содержащих буферов (Рисунок 8 ). SECs совместно очищенный с Кис на PVP градиент (рис. 9А) и затем разделенных селективного адгезии на коллаген покрытием полистирола Петри. Чистоту SECs, с помощью этого метода составляет 83-90% чистой и во многом зависит от общей эффективности коллагеназы пищеварения (Рисунок 9B). Количественные измерения с помощью света микроскопии (как гепатоцитов и SECs имеют отличительные особенности от других клеток) показывают, что в представительных подготовки, гепатоциты являются почти 100% чистой и SECs чуть более 89% чистой (Таблица 1). Кроме того выше обогащения SECs могут быть получены путем разделения магнитных столбец после PVP градиента, хотя это выходит за рамки настоящего Протокола. Дополнительную информацию о магнитной сепарации SECs и Кис может найти в Мейер и др. 9 и Лю и др. 14 следует помнить, что жизнеспособность гепатоцитов в недостаточно переваривается печени быстро уменьшается, но это не необходимые true для недостаточно переваривается печень также производят более сотовой мусора, который является не совсем РНУ. ликвидирована в шагах центрифугирования.
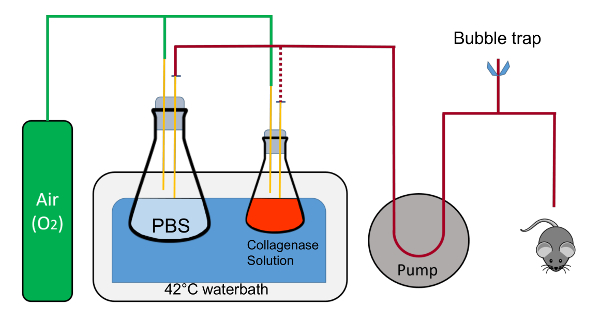
Рисунок 1 : Схематическое представление люкс перфузии. Колбы проводятся в месте хомутами (не показан); трубы, содержащие жидкости выгружается из флакон 1 Л до 125 мл флакон во время процедуры представлена красной пунктирной линией. Обратите внимание, что подача кислорода не пузырь непосредственно в решения в колбах. Пробки должны также зубчатый разрешить поток жидкости замкнутого с трубки вставляется в паз. Это очень важно во время разогрева труб и для выброса всех воздуха внутри труб. Обрез воздуха состоит из Т-коннектор, который соединен шланги Tygon и щепотку зажимы для быстрого открытия и закрытия системы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Люкс перфузии во время мыши печени перфузии. Лоток с помощью мыши помещается на углу водяной бани. Кислорода отключается от коллагеназы решения, как это уже было кислородом во время разминки. Расположение элементов являются A) кислорода линии, B) 1 Л флакон, содержащий PBS, C) 125 мл флакон, содержащий буфер 2 с коллагеназы, D) насос, управления E) насосом, F) пузырь ловушки, G) жидкости линии, проходящей от колбы, через насос и мыши. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : Изображение сосудистую мыши живота. Введение катетера должен быть чуть ниже развязок вен желудка и поджелудочной железы, сходит воротной вены (зеленая точка) и наконечник должен находиться рядом с левой и правой печеночной вены портал (жёлтая точка) которые образует вилкой в основной доли печени. Как только достигается правильное размещение, катетер должны быть стабилизированы с потоком, с помощью простой зашитый узел. K = почек, L = печени, SI = тонкой кишки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Катетер размещение в воротной вены. (A) щипцы используются для обеспечения крови нагрубание воротной вены и выправить из Вены для размещения катетера. (B) катетер выстроились параллельно с воротной вены с багетной рамки. (C) скос иглы в катетер вставляется в Вену, не через Вену. (D) иглы катетера втягивается и кровь будет обратного потока через катетер, как указано на кончик щипцы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5 : Надлежащего печени перфузии. (A) после размещения катетера, женский Luer концу катетера подключается к мужской конца Luer (сокращение от 1 мл шприц) насоса труб. (B) после резки один основных убыванию кровеносных сосудов, кровь и PBS дренируются от живота, нарезая стороне мыши с ножницами. (C) печени следует бланшировать в то время как кровь очищается и (D) будет зыбь когда под давлением сжимая закрыть отрезока кровеносный сосуд с щипцами. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6 : Схематический план гепатоцитов очистки и изоляции NPC. Большинство из центрифугирования шаги направлены для удаления живых и погибших гепатоцитов из не Паренхиматозный клеток. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
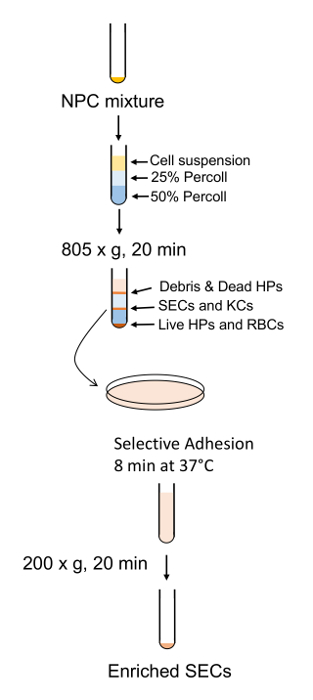
Рисунок 7 : Схематический план очистки и обогащения сек. НИПы разделяются PVP градиент, следуют короткие адгезии к стандартной пенополистирольные плиты, SEC разделения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
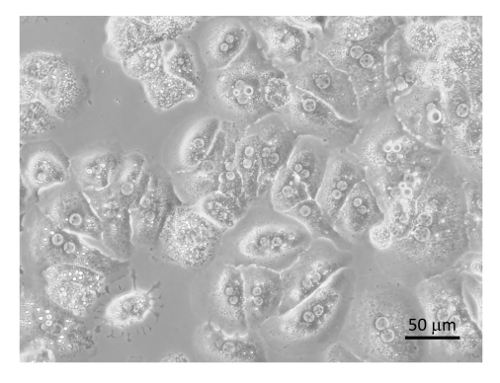
Рисунок 8 : Очищенный гепатоцитов. Гепатоцитов были покрытием на коллаген покрытием культуры ткани пластины с DMEM + 8% FBS + ручка/воспаление и насиживают микроскопом на 400 X 6 ч, следуют коллекции изображений. Бар равен 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
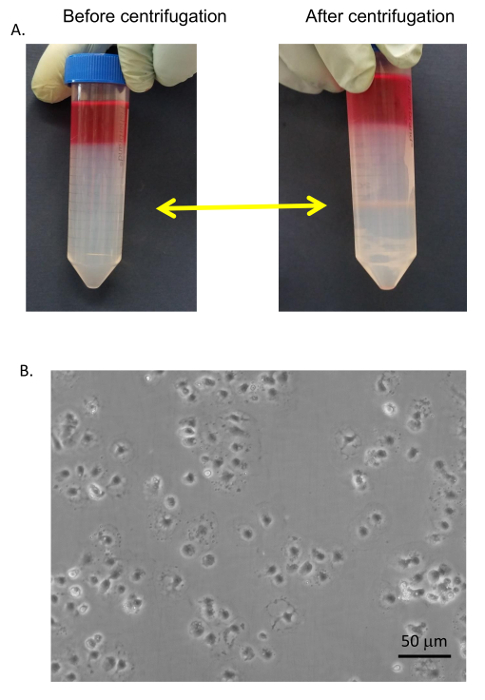
Рисунок 9 : Очищение сек. SECs (A) и Кис были собраны в интерфейсе PVP 25/50% (Желтые стрелки) и промывают с сыворотка свободной среде. (B) SECs были отделены от Кис путем селективного адгезии на стандартных чашек Петри, промывают и гальваническим покрытием коллаген культуры ткани блюда в RPMI + 5% FBS. Изображения были взяты EVOS инвертированным микроскопом на 400 X. Бар равен 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 10 : Растровая электронная микроскопия мыши печени анатомии. Увлажненную мыши печени с PBS, следуют фиксатором (100 мм натрия cacodylate, 12 мл 25% глютаральдегид, 15.6 мл 16% параформальдегида, 2.65 мм кальция хлорид, 180.2 мм сахарозы, смешанные в 100 мл раствора) со скоростью 1 мл/мин на 4 мин были кусочки ткани и подготовлено для сканирования электронной микроскопии. Изображения были собраны на Автоэмиссионные SEM в 10, 000 X. Желтые стрелки показывают микроворсинки между гепатоцитов. Бар равен 5 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 11 : Визуализация Мертвого против живой гепатоцитов. После того, как 2 моет буфер 1, гранулированных гепатоцитов могут быть начислены соотношение жить/мертвые глаза. Легче Пелле (слева) указывает, что по крайней мере половина гепатоцитов мертвы. Темные лепешки на право более твердо гранулированных в нижней части трубки, и жить более чем на 90%. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Таблица 1: Очистка ячейки | ||
| Тип ячейки | клетки-мишени % | % другие клетки |
| Гепатоцитов | 99 | 1 |
| Эндотелиальные клетки Sinsusoidal | 89.1 | 10.9 |
Таблица 1: Оценка чистоты клеток, световой микроскопии.
Обсуждение
Этот протокол выделяет средства, которые доступны и которые будут позволить пользователю высокий уровень успеха в этой процедуре. Успешный перфузии является основополагающим условием для любого приложения, вниз по течению при работе с Главные ячейки.
Есть несколько критических этапов процедуры, которые определяют успех. Во-первых размещение катетера в портальной Вене должно быть правильным. Если поместить слишком далеко в печени, будет увлажненную только незначительные лопастями. Наконечник должен быть чуть ниже правого и левого ветвей воротной вены. Преимущество использования полимерных композиционных катетер через иглу является скорее разрывать вен во время перфузии чем катетер Барб иглы. Во-вторых коллагеназа качество и количество определяют эффективность переваривания печени. В этой процедуре используется предварительно квалифицированных коллагеназы типа 4 и он высокомобильна на 0,5 мг/мл в буфере 2, если действие коллагеназы, чтобы быть assayed больше, чем 900 ме.
В конце коллагеназы перфузии печень должна сохранять несколько темных Тан до коричневого цвета. Если это легкий загар цвета, большинство гепатоцитов мертвы. Печень должна быть разваливается при резке от мыши. В лучших условиях печени может быть черпали из полости тела мыши с небольшой ложкой. Печень в это условие всегда дают жизнеспособность клеток очень высокий. Если это занимает много усилий, чтобы встряхнуть клетки друг от друга, если печень по-прежнему твердо во время извлечения, или если есть много силы, необходимые для перемещения гепатоцитов через фильтры, гепатоцитов будет иметь меньше жизнеспособность. Гепатоциты покрыты микроворсинки, который позволяет им иметь очень большую площадь поверхности (рис. 10). Неполное переваривание сохраняет узлы ячеек между гепатоцитов и механической резки будет разорвать плазматической мембраны. В situ перфузии с коллагеназы является лучшим способом разбить ячейки и поддержания высокой жизнеспособности. В рисунке 11два гепатоцитов, препараты производятся в которой окатыши клетки сравнивали после того, как несколько моет в буфер 1. Гранулы на левой легче и содержит жизнеспособность клеток около 50%. Пелле справа темнее и жизнеспособность 92%. Аналогично когда жидкость заливается от 50 мл конические, темные гранулы стационарных внутри трубы, в отличие от зажигалки Пелле, который будет слайд в трубку, как жидкость заливается выкл. Нижняя жизнеспособность клеток или неэффективных орошений могут возникнуть когда печень имеет высокий уровень склероз.
Так как живой гепатоциты имеют более высокую плотность, чем погибших гепатоцитов, центрифугирование процедуры приведет к подготовки, что является очень чистым в жизнеспособные гепатоцитов15. Если есть значительное количество погибших гепатоцитов (которые часто происходит, когда условия являются оптимальным), живой клетки могут далее обогащенный и отделены от омертвевших клеток с помощью градиентов PVP. Кроме того поскольку живут гепатоцитов Пелле быстрее, чем погибших гепатоцитов, стремление Топ 3rd гранул также увеличит отношение живых мертвые клетки в гранулы. Эти процедуры являются быстрая и легкая методы, чтобы отделить жить от погибших гепатоцитов и клеточной мусора при необходимости10,16. Это особенно полезно, если образец драгоценна, и лишь несколько миллионов клетки необходимы для эксперимента.
В заключение это простой и эффективный метод для уборки гепатоцитов и секунд из печени. В текущих ценах стоимость выполнения этой процедуры, включая все реагенты и расходные материалы — до 75 USD за подготовку. Если несколько мышей, лучше продолжить очистки гепатоцитов и держать NPC дроби на льду, пока не будут обработаны все мышей. НИПы обычно стабильны на льду для по крайней мере 5 h, но времени не были протестированы в лаборатории.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Финансирование обеспечивается частично низ от Грант R01HL130864.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 L Erlenmeyer flask | Fisher Scientific | S63274 | |
| 250 mL Erlenmeyer flask | Fisher Scientific | S63271 | |
| silicone tubing | Cole-Parmer | 96400-14 | This tubing runs from the flasks through the pump to the T connector and then to the 1.0 mL syringe that is connected to the catheter. |
| Tygon tubing | Fisher Scientific | R3603 | Used as an adaptor between 96400-14 and pipettes and T connector. This may also be used for the oxygen tubing. |
| T-connectors | Cole-Parmer | EW-06294-82 | |
| Quick dissconnects | Fisher Scientific | 6150-0010 | |
| Pinch Clamps | Fisher Scientific | 6165-0002 | |
| Masterflex L/S Variable speed Pump, model 7553-70 | Cole-Parmer | EW-07559-00 | Periplastic pump with variable speed |
| Pump head, model 7014-20 | Cole-Parmer | EW-07014-20 | |
| glass graduated 1.0 mL pipettes | Fisher Scientific | 13-678 | |
| curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Dumont forceps | Fine Science Tools | 11252-20 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| 10 mL syringe | Fisher Scientific | 03-377-23 | Only barrel of syringe will be needed |
| sterlized spoon | Home supply store | ||
| Cotton ball(s) | Home supply store | ||
| Polyester sewing thread | Home supply store | ||
| Masking tape | Home supply store | ||
| thumb tacks | Home supply store | ||
| styrofoam pad | 50 mL conical rack | ||
| cookie/baking sheet | Home supply store | ||
| Absorbant underpads | Fisher Scientific | 14-206-64 | |
| 19 L water bath | Fisher Scientific | TSCOL19 | |
| BD Insyte Autogaurd Shielded IV Catheter 24 guage | Becton Dickinson | 381412 | Plastic cathetar with retractable needle |
| Crystallizing dishes 100x50 | VWR | 89000-290 | |
| Polystyrene petri dishes | Sigma Aldrich | P5481-500EA | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| graduated pipettes (5 mL) | Fisher Scientific | 170355 | |
| graduated pipettes (25 mL) | Fisher Scientific | 170357 | |
| EasyStrainer 100 μM | Greiner bio-one | 542000 | 100 μm filter |
| EasyStrainer 40 μM | Greiner bio-one | 542040 | 40μm filter |
| Sterile transfer pipettes | Fisher Scientific | 13-711-20 | |
| Refrigerated swinging bucket centrifuge | Sorvall Legend XTR | 75-217-406 | Centrifuge with swinging bucket rotar |
| Galaxy 170R tissue culture incubator | Eppendorf | CO170R-120-0000 | Humidified tissue culture incubator |
| Reagents | |||
| Name | Compound | Grams (g/L) | Millimolar (mM) |
| Buffer 1, pH 7.4 | NaCl | 8.3 | 142 |
| KCl | 0.5 | 6.7 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| Buffer 2, pH 7.4 | NaCl | 3.9 | 66.74 |
| KCl | 0.5 | 6.71 | |
| CaCl2 | 0.7 | 6.31 | |
| HEPES | 24 | 100 | |
| BSA | 15 | 0.226 | |
| Phenol Red | 0.01 | 0.03 | |
| Buffer 3, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.35 | 4.7 | |
| MgSO4 | 0.08 | 0.66 | |
| CaCl2 | 0.18 | 1.62 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| PBS, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.2 | 2.7 | |
| Na2HPO4-7H2O | 1.15 | 4.3 | |
| KH2PO4 | 0.2 | 1.4 | |
| Other reagents | |||
| Name | Company | Catalog Number | Comments |
| Percoll (PVP solution) | GE Healthcare | 288555 | |
| Collagenase Type IV | Sigma Aldrich | C5138 | |
| Isoflurane | Abcam | ab144581 | |
| Hepatocyte Growth Medium | |||
| DMEM | Gibco | 11965118 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Long-term Hepatocyte Growth Medium | |||
| DMEM | |||
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Glucagon | Sigma | G3157-2mg | 14 ng/mL |
| Insulin | Sigma | I9278-5mL | 0.5 U/mL |
| Hydrocortisone | Sigma | H0888-1g | 7.5 mg/mL |
| Epidermal Growth Factor | BD Biosciences | 354001-100ug | 20 ng/mL |
| LSEC medium | |||
| RPMI | Gibco | 11875119 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 |
Ссылки
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods Cell Biol. 13, 29-83 (1976).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. J Exp Med. 94 (5), 431-453 (1951).
- Edstrom, S., Ekman, L., Ternell, M., Lundholm, K. Isolation of mouse liver cells: perfusion technique and metabolic evaluation. Eur Surg Res. 15 (2), 97-102 (1983).
- Meyer, J., Gonelle-Gispert, C., Morel, P., Buhler, L. Methods for Isolation and Purification of Murine Liver Sinusoidal Endothelial Cells: A Systematic Review. PLoS One. 11 (3), 0151945 (2016).
- Sies, H. The use of perfusion of liver and other organs for the study of microsomal electron-transport and cytochrome P-450 systems. Methods Enzymol. 52, 48-59 (1978).
- Smedsrod, B. Protocol for preparation of mouse liver Kupffer cells and liver sinusoidal endothelial cells. Munin open research archive. , 1-10 (2012).
- Smedsrod, B., Pertoft, H., Eggertsen, G., Sundstrom, C. Functional and morphological characterization of cultures of Kupffer cells and liver endothelial cells prepared by means of density separation in Percoll, and selective substrate adherence. Cell Tissue Res. 241 (3), 639-649 (1985).
- Meyer, J., Lacotte, S., Morel, P., Gonelle-Gispert, C., Buhler, L. An optimized method for mouse liver sinusoidal endothelial cell isolation. Exp Cell Res. 349 (2), 291-301 (2016).
- Kreamer, B. L., et al. Use of a low-speed, iso-density percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations. In Vitro Cell Dev Biol. 22 (4), 201-211 (1986).
- Meijer, D. K., Keulemans, K., Mulder, G. J. Isolated perfused rat liver technique. Methods Enzymol. 77, 81-94 (1981).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. J Vis Exp. (57), e3138 (2011).
- Cook, M. J. . The Anatomy of the Laboratory Mouse. , (1965).
- Liu, J., et al. Advanced Method for Isolation of Mouse Hepatocytes Liver Sinusoidal Endothelial Cells, and Kupffer Cells. Methods Mol Biol. 1540, 249-258 (2017).
- Knobeloch, D. E., Ehnert, S., Schyschka, L., Buchler, P., Schoenberg, M., Kleeff, J., Thasler, W. E., Nussler, N. C., Godoy, P., Hengstler, J., Nussler, A. K. Human Hepatocytes: Isolation, Culture, and Quality Procedures. Methods in Molecular Biology. 806, 99-120 (2012).
- Clarke, B. L., Weigel, P. H. Recycling of the asialoglycoprotein receptor in isolated rat hepatocytes. ATP depletion blocks receptor recycling but not a single round of endocytosis. J Biol Chem. 260 (1), 128-133 (1985).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены