Method Article
Purificação de hepatócitos e células endoteliais sinusoidais de fígado de rato perfusão
Neste Artigo
Resumo
O objetivo do presente protocolo é obter alta viabilidade e alto rendimento de hepatócitos e células endoteliais sinusoidais do fígado. Isso é realizado pela perfusing o fígado com uma solução de colagenase tipo IV através da veia portal, seguida por centrifugação diferencial para obter hepatócitos e células endoteliais sinusoidais.
Resumo
Este protocolo demonstra um método para a obtenção de alto rendimento e viabilidade de hepatócitos de rato e de células endoteliais sinusoidais (SECs) apropriadas para cultivo ou para a obtenção de lisados celulares. Neste protocolo, a veia porta é utilizada como o site para cateterismo, ao invés da veia cava, como isso limita a contaminação de outros tipos de célula possível na preparação final hepática. Sem instrumentação especial é necessária durante todo o procedimento. Um banho de água é usado como uma fonte de calor para manter a temperatura de todos os buffers e soluções. Uma bomba peristáltica padrão é usada para conduzir o líquido, e uma centrífuga de mesa refrigerada é necessária para os processos de centrifugação. A única limitação dessa técnica é a colocação do cateter dentro da veia portal, que é um desafio em alguns dos ratos na faixa de tamanho de 18 a 25 g. Uma vantagem desta técnica é que apenas uma veia é utilizada para a perfusão e o acesso à veia é rápido, que minimiza a isquemia e reperfusão do fígado que reduz a viabilidade celular hepática. Outra vantagem deste protocolo é que é fácil de distinguir ao vivo de hepatócitos mortos pela visão devido à diferença de densidade celular durante as etapas de centrifugação. Células do presente protocolo podem usadas em cultura de células para qualquer aplicação a jusante, bem como processadas para qualquer avaliação bioquímica.
Introdução
Colagenase perfusão do fígado para obter hepatócitos tem sido realizado desde o início dos anos 1950 e tem sido continuamente melhorado1,2,3,4. Uma revisão muito agradável de muitas das metodologias, técnicas e os reagentes utilizados na purificação do fígado célula tiver sido compilada em Meyer et al.5. Obter um rendimento satisfatório de hepatócitos altamente viáveis e SECs é tecnicamente desafiador. As forças mecânicas que separam as células, incluindo a qualidade da colagenase são algumas das variáveis que são difíceis de controlar. Devido à sensibilidade do hepatócito para forças mecânicas, sua viabilidade é marcadamente reduzida em condições sub-ótimas, solicitando a necessidade de um protocolo, descrevendo as condições ideais para o isolamento. Seg (s) não parece ser tão sensíveis ao cisalhamento mecânico. In situ de perfusão com digestão de colagenase é, de longe, o melhor método para interromper as junções célula-célula para obter preparações única célula do fígado e outros órgãos como o intestino e baço6. Este protocolo demonstra um método simples para a introdução buffer de perfusão da veia porta por meio de um cateter de plástico retrátil, ao invés de uma incisão que poderia causar a veia porta para o colapso, conforme descrito em Smedsrød et al7.
O objetivo deste manuscrito é demonstrar as etapas mais críticas necessárias para o sucesso do procedimento da profusão de fígado. Estas etapas incluem a colocação do cateter, fluxo dos líquidos de perfusão e manipulação do tecido após a digestão. Taxas de fluxo são ajustados acima da taxa natural de fluxo sanguíneo, mas baixo o suficiente para manter intacta a cápsula de Glisson. Uma vez que o fígado é digerido corretamente e as células são separadas em solução, purificação de célula é relativamente simples se é realizada por centrifugação diferencial, a aderência da placa, ou purificação magnética do grânulo. Hepatócitos ao vivo tem uma densidade mais elevada e são facilmente purificados a partir das células parênquimas (NPCs) e mortos hepatócitos com centrifugação velocidade lenta. A maioria dos aplicativos, aderência de placa para a separação de Kupffer células (KCs) e SECs é um método comum8, embora há relatos de que ele não produz a melhor pureza de seg (s)9. KCs têm uma tendência a aderir às superfícies sólidas rígidas rapidamente e placas de Petri (poliestireno padrão) são o material mais comumente usado para este procedimento. SEC ou KC purificação com o uso de anticorpo conjugado grânulos magnéticos é sem dúvida o melhor método para a purificação significativo destas células, embora o procedimento adiciona outro 3-4 h para este protocolo e o rendimento global é a diminuição da9. Este relatório demonstra, detalhadamente, o processo para uma perfusão de fígado ideal que normalmente produz um elevado número de células viáveis.
Protocolo
Todos os animais procedimentos descritos no presente protocolo foram aprovados pelo Comitê de uso (IACUC) na Universidade de Lincoln - Nebraska sob protocolo #1435 e institucional Cuidado Animal.
1. preparação
- Preparação de soluções e meios de cultura
- Preparem-se todos os meios de cultura e reserva de acordo com a Tabela de materiais.
- Preparação dos instrumentos
- Configurar um banho de água (> 10 L) no 42 ° C, uma bomba peristáltica com velocidade variável e grampos para segurar os balões. Prepare-se curvas de tesoura e pinça (Figura 1).
- Na ou adjacente para o banho de água, configurar uma folha de cozimento (cerca de 38 x 26 cm) com um bloco de isopor (rack cónico de 50 mL), revestida com um absorvente underpad cortar um pedaço de 20 x 20 cm (Figura 1).
- Coloque um pedaço de fita crepe (5-8 cm) nas proximidades. Coloque um fio de poliéster de costura 20cm nas proximidades, ou seja, corte e pronto para usar. Obter um cateter plástico com uma agulha retrátil (7 mm x 19 mm, Figura 1).
- Preparação de material de vidro
- Usando grampos, coloque e imobilizar um frasco de 1L no banho de água contendo 200 mL de 1X PBS com uma rolha que tem duas pipetas de 1 mL para a solução. A rolha de borracha é entalhada para permitir a recirculação de fluido em circuito fechado.
- Com pinça, coloque um balão de 125 mL contendo 45 mL de tampão 2 junto com uma rolha que tem duas pipetas de 1 mL, um dos quais é no líquido perto do fundo do balão e o outro que fica acima do líquido e sopra oxigênio para o balão.
Nota: Cada pipeta nas rolhas terá um rápido desconectar o adaptador conectado à extremidade para fácil troca da tubulação. Oxigênio vai estar fluindo suavemente os dois balões através da pipeta no batoque que não está imersa no líquido. - Reserve dois pratos de cristalização estéril.
2. procedimento animal
- Aquecer as soluções de PBS e Buffer de 2 a 42 ° C em banho-maria e circular PBS pelo menos 20 mL/min em tubulação em circuito fechado para manter as linhas de líquido quente. Mergulhe qualquer excesso tubagem em banho-maria para permanecer tão próximo quanto possível de 42 ° C. Escorra a extremidade macho do tubo para o balão de 1L contendo PBS.
- Coloque uma bola de algodão sobre o absorvente underpad e adicionar cerca de 2 mL de 30% de isoflurano (composto em polietilenoglicol 200 que diminui a taxa de evaporação de isoflurano) sobre a bola de algodão com uma pipeta de transferência.
- Pegar o mouse pela cauda, coloque-o em um dos pratos cristalização e então rapidamente derrubar o prato para a bola de algodão para que o mouse tem um espaço pequeno inalar a anestesia. Observar a taxa de respiração do rato e certifique-se que o mouse é efetivamente sob anestesia.
Nota: A taxa de respiração deve ser mais lento e mais profundo, a cauda flácida e as patas não responde para o teste do beliscão sob anestesia; consulte IACUC diretrizes para obter detalhes adicionais. - Enquanto o mouse está indo sob anestesia (isto leva 1-2 min), prepare o cano de uma seringa de 10 mL, puxando o êmbolo e inserindo uma bola pequena de algodão. Adicionar 1-2ml de 30% de isoflurano com uma pipeta de transferência para a bola de algodão dentro do barril e coloque o barril encurvada para baixo sobre uma mesa, enquanto aguarda o mouse para se tornar inconsciente.
- Rapidamente, tire o prato de cristalização, vira o mouse de costas e coloque o barril da seringa sobre seu nariz. Verifique a taxa de respiração, pitada de dedo do pé e cauda flácida. Todas as respostas para a pitada do dedo do pé e cauda flácida indica que o mouse não é totalmente sob anestesia. Mantenha o cilindro da seringa sobre o focinho para manter a inconsciência.
- Lugar de aderências de polegar através as patas do rato, com os membros estendidos em posição supina. Molhe o abdômen e tórax com isopropanol 70% ou etanol.
- Com a pinça reta em uma mão, levante a pele perto da base do abdome. Com uma tesoura na outra mão, corte a pele tenda e peritônio. A incisão deve ser horizontal ou através da base da pele tenda. Não se esqueça de cortar todas as camadas da pele e do peritoneu para obter acesso ao intestino. Corte lateralmente em torno do abdômen até o tórax em ambos os lados sem roubar qualquer um dos órgãos.
- Corte o retalho de pele por corte em toda a caixa torácica inferior. Mova os intestinos para a direita, com as costas da pinça para expor a veia porta.
Nota: Sangramento do animal deve ser mínima; o animal deve estar respirando e sob anestesia profunda. - Coloque a pinça curva fechada debaixo da veia portal entre o fígado e a veia pancreaticoduodenal superior (seta daFigura 3 ).
- Abra a pinça enquanto debaixo da veia portal. Segure o thread e cuidadosamente, puxe-o através de modo que está centrado por baixo da veia portal. Amarre um nó de laçada ao redor da veia portal sem cinching-lo para baixo.
- Coloque a pinça curva sob a veia porta e puxe suavemente para o rabo do rato para endireitar a veia(Figura 4).
- Com o cateter na outra mão, coloque o bisel da agulha voltado para cima e paralela com a parte inferior da veia portal perto a pinça (Figura 4B).
- Suavemente, punção da veia com a agulha (Figura 4C). Certifique-se de que bisel da agulha é no lúmen da veia. Retirar a agulha com mola e continuam a empurrar o cateter de polímero através da veia até que o bisel é perto da área ramificada venosa. Isso é dentro do fígado. Se o cateter está colocado corretamente, um refluxo de sangue será visível. (Figura 4D).
- Aperte o nó de laçada e puxe-o para baixo do cateter para ajudar a estabilizá-lo. Imediatamente abaixar a taxa de bomba de 20 mL/min para 4 mL/min e cortar outro grande vaso sanguíneo para drenagem. Corte a aorta abdominalis para resultados óptimos.
- Coloque a extremidade macho do tubo para a final feminina do cateter (Figura 5A). Certifique-se de que não há nenhuma bolha de ar na linha. Cuidado que o cateter também não é empurrado para o fígado ou para fora da veia. Colocação do segmento não é essencial, embora ajuda a prevenir o refluxo da veia e ajuda a manter o cateter na posição correta (Figura 5B, C).
- Use fita adesiva para imobilizar os tubos no underpad. Use a pinça reta para espremer o vaso sanguíneo efluente para inflar o fígado algumas vezes para garantir que todo o sangue foi drenado para fora (Figura 5-D).
Nota: Fita de laboratório padrão pode não funcionar; no entanto, a fita adesiva permanecerá furada para o underpad, mesmo em condições úmidas.
3. fígado perfusão
- Enquanto o fígado é lavagem com PBS, meça cerca de 24 mg de colagenase tipo IV e colocá-lo no frasco contendo 45 mL de tampão 2 em banho-maria. Não se esqueça de agitar o líquido no frasco para que a colagenase é totalmente dissolvido e colocar o balão volta a braçadeira para que a parte líquida contendo do balão é totalmente submerso na água.
- Observe a mudança na cor do fígado, como ele é liberado com PBS. Altere a tubagem de saída de balão de 1L no balão de 125 mL. Não permita que as bolhas de ar a fluir para o fígado.
- Uma vez que a reserva de perfusão atinge o fígado, brevemente aperte firme o vaso sanguíneo efluente para criar alguma pressão no vaso e permitir que este líquido encher todos os lóbulos do fígado. Não se esqueça de cortar drenagem muito tempo, como que pode estourar o fino tecido conjuntivo em torno do fígado (cápsula de Glisson) e destruir a perfusão ou fluxo de líquido dentro do leito capilar do fígado.
- Permita o Buffer 2 com colagenase para perfundir através do fígado, até que todos os 45 mL jorrado através do tecido.
Nota: Se for bem sucedida, a cápsula de Glisson deve ser separada do parênquima ou o tecido do fígado e do fígado em si deve aparecer amorfo. - Adicionar cerca de 10 mL de tampão 1 ao outro prato cristalização e colocá-lo ao lado do mouse.
- Remover o cateter e desligar a bomba.
- Com a pinça reta e tesoura, cortar o fígado de rato. Se a digestão de colagenase foi muito eficiente, pode ser necessário ter uma colher na mão para colher o fígado de rato e coloque-a no Buffer 1 limpa e esterilizada.
4. hepatócito purificação
Nota: A manipulação das células são executadas em uma capa de cultura de tecido estéril para limitar a contaminação se as células devem ser cultivadas em todas as etapas subsequentes.
- Utilizando uma técnica estéril, pegue o fígado com fórceps e agite suavemente as células do fígado. Rasgar ou retirar a cápsula de Glisson: o buffer vai se tornar opaco como células são sacudidas do fígado.
- Decantar a solução de célula para um Erlenmeyer de 50 mL com um filtro de µm 100 colocados por cima.
- Adicionar mais 1 de reserva para os remanescentes de fígado e continuar a agitar para fora de células. Continue até o fígado aparece desprovido de células ou quando as partes não digeridas do fígado não produzir mais células.
- Despeje o líquido celular outro 50ml cónico que contém um filtro de 40 µm.
- Centrifugue a cónica em um rotor de balde balançando a x 100 g por 3 min.
Nota: Não use o freio máximo como isto pode desalojar o centrifugado. Usar o freio em 80%, que é suficiente para todas as restantes etapas de centrifugação a 4 ° C - Decantar o sobrenadante (que contém NPCs e hepatócitos mortos) em um Erlenmeyer limpo e coloque-o no gelo. Certifique-se de que isto é feito em um movimento para observar a aderência da pelota.
- Resuspenda o pellet em 40 mL de tampão 1. Repita os passos de 4.5 e 4.6. Resuspenda o pellet em 40 mL de tampão 3. Repita os passos de 4.5 e 4.6 duas vezes.
- Resuspenda os hepatócitos purificados no quente DMEM + 10% FBS + 2 x penicilina-estreptomicina (caneta/Strep).
- Se as células são cultivadas em placas de colágeno revestida, permitir-lhes a aderir por 1h e substituir a mídia pelo menos uma vez como isto impedirá qualquer nascentes contaminantes bacterianos.
- Fazer as placas de colágeno revestida incubando-os com 0,05% de colágeno em 0,001% de ácido acético pelo menos 1 h a 37 ° C, e então lavando com PBS 1x.
- Se a viabilidade de hepatócitos é baixa e há um desejo de obter hepatócitos viáveis alta purificados, em seguida, use o seguinte protocolo adaptado de Kramer et al.10.
- Mix 9 volumes de solução PVP (Percoll, uma solução de w/w de 23% de água e partículas de sílica coloidal de nm de 15-30 revestidas em polivinilpirrolidona para centrifugação de densidade) e 1 volume de 10 x HBSS tornar-se uma solução iso-osmótica de PVP (SIP).
- Adicione 24 mL de SIP para um estéril 50ml cónico que podem ser armazenado nessas condições por até 2 meses a 4 ° C.
- Ajuste a concentração de hepatócito a 5-10 × 106 células/mL com meio de cultura, como o observado na etapa 4.8.
- Adicionar 25 mL de suspensão de células a cada 24 mL contendo cónico de SIP e misture gentilmente por inversão. A densidade desta solução é 1,06 g/mL.
- Centrifugue o cónico a 50 x g durante 10 minutos a 4 ° C.
- Aspirar o SIP e o floculante e ressuspender as células em HBSS.
- Lavar as células por centrifugação a 50 x g durante 10 minutos a 4 ° C.
- Repita a etapa 4.10.6 mais uma vez e depois Ressuspender as células em meio de crescimento.
5. segundo purificação
- As células os sobrenadantes da etapa 4.6 de Pelotas, girando os tubos a 163 x g durante 10 min. Descarte os sobrenadantes dos tubos e Resuspenda todos de pelotas de célula em 5 mL de RPMI sem soro e piscina-los juntos em um tubo.
- Uma vez que todos os chumbos tem sido agrupados, adicione RPMI para volume final de 35 mL.
- Centrifugue o pool cónico a 25 x g por 3 min. Aspire cuidadosamente com o top 25 mL de RPMI com uma pipeta de 25 mL e coloque essa mídia contendo NPCs em um limpo 50ml cónico no gelo.
- Adicionar 25 mL de RPMI fresco para o tubo e resuspenda o pellet.
- Repita a etapa 5.3 para uma segunda lavagem e piscina o sobrenadante. Descarte os restante 10 mL da mídia e da pelota (a pelota consiste principalmente de hepatócitos mortos). Centrifugue o sobrenadante em pool a 163 x g durante 10 minutos.
- Durante a centrifugação, prepare os gradientes de solução PVP em um Erlenmeyer de 50 mL.
- Adicione 15 mL de solução PVP 50% para os 50 mL cônica seguido de 20ml de Percoll sobreposto com uma pipeta, definida como a menor velocidade de ejeção de 25%. Certifique-se de observar uma linha de refração na marca 15ml que demarca as duas camadas, como este é onde o SECs e KCs agregará após a centrifugação.
- Ressuspender as células anteriormente peletizadas em passo 5.5 em 10 mL de RPMI frio e sobrepô-los para o gradiente de solução PVP. Certifique-se de manter uma demarcação clara entre as duas camadas. Centrifugue o gradiente a 805 x g por 20 min com um freio fixado em 50%.
- Aspire de cima a baixo a direção para a marca de 20 mL no tubo e descartar este material. Com uma pipeta de transferência de 5 mL, colete o SECs e KCs que estão localizados na interface de 25/50%. Descarte qualquer marrons aglomerados de células como estes são hepatócitos mortos.
- Colocar as células em um 50ml cónico e adicionar RPMI até a marca de 50 mL, diluir a solução de PVP. Centrifugar a 200 x g durante 10 minutos, com 80% de freio.
- Aspirar e desprezar o sobrenadante e ressuspender o enquanto lava fora do cone das cônicas em 12 mL de RPMI quente.
- Separar os SECs KCs, colocando o sobrenadante em um prato de Petri de poliestireno e incubá-los numa incubadora de cultura de tecidos umidificado para 8 min à temperatura ambiente.
- Aspire a mídia com uma pipeta de 25 mL e enxágue a placa com a mesma mídia, com a pipeta definido na menor velocidade para coletar os restantes segundos enquanto as KCs aderir à placa.
- Centrifugue os segundos a 200 x g por 10 min e Resuspenda em RPMI + 5% FBS + caneta/Strep. Então o título as células e o lugar em pratos de cultura colágeno-revestido.
Resultados
Um método de demonstração, refinado para perfusão do fígado e da purificação/enriquecimento de hepatócitos e SECs é aqui apresentado que fornece dicas detalhadas para purificação de célula ideal/enriquecimento semelhante a outros relatórios impressos compilados neste referenciado revisão 5. Os passos críticos que determinam o sucesso para purificação celular ocorrem na rota e detalhes técnicos do processo de perfusão de colagenase e estão descritos no presente protocolo. O set-up para o aparelho é bastante simples e eficaz com equipamento padrão de laboratório, em contraste com outros sistemas que têm sido publicados11 (Figura 1). Neste set-up, a bandeja segurando o mouse está sentado sobre o banho de água com um pouco do excesso tubo em banho-maria para manter a temperatura dos líquidos perfusing dentro do fígado. O aparelho, como mostrado aqui pode ser utilizado para ratos, bem como ratos, com uma geometria ligeiramente diferente para perfusão de fígado de rato12 (Figura 2).
Neste procedimento, o fígado é perfundido através da veia porta em vez da veia cava (que é outra rota popular perfusão) devido a sua facilidade de acesso dentro do abdômen e que a veia alimenta diretamente para o fígado. O espectador deve estar ciente que a veia porta tem vários pequenos ramos que podem a curto-circuito o perfusato e o cateter deve ser colocado passado estes ramos para sucesso ideal13 (Figura 3). Uma vez que a veia porta é identificada, pinças curvas são usadas para desenhar uma sutura cirúrgica ou fio de poliéster abaixo da veia portal entre o fígado e a veia pancreático-duodenal superior. A pinça também é usada para endireitar a veia porta, que está sob pressão positiva(Figura 4). A agulha dentro do cateter deve ser colocada paralelo e ao lado da veia (Figura 4B) e o bisel deve ser inserido suavemente o lúmen da veia (Figura 4C). Colocação adequada será indicada pelo sangue aparecendo ao longo do cateter. Uma vez que a agulha está retraída, o cateter deve ser estabilizado com um fio amarrado em cima dele e a pressão de sangue irá forçar o sangue acima através do cateter. É recomendável que o cateter ser conectado à tubulação da bomba antes de sangue derrama para fora (Figura 4-D). Uma vez que a tubulação da bomba é conectada, corte imediatamente um grande vaso sanguíneo como a veia cava ou aorta abdominalis para drenagem de sangue/líquidos (Figura 5A). É geralmente necessário cortar o lado da parede abdominal do mouse para drenagem suficiente, como um acúmulo de sangue no abdômen dificulta a visualizar o processo de perfusão e sangue pode transitar para a purificação da célula (Figura 5 B). uma vez o PBS começa a perfundir o fígado, o fígado vai Escalde com a ausência de sangue (Figura 5-C). Se apenas alguns dos lóbulos blanch, então, a causa provável é que o cateter foi colocado muito longe no interior do fígado e precisará ser recuou lentamente. Uma vez confirmada a colocação do cateter, use Water-resistant fita adesiva para fixar o tubo no lugar. Fita de laboratório geral geralmente não é suficiente. Para confirmar a colocação apropriada do cateter, esprema o vaso sanguíneo cortado para cessar a drenagem e observar a aumento de pressão dentro do fígado. Fazendo isso ajudará no sangue do fígado (Figura 5-D) de lavagem. Isso também deve ser feito quando a solução de colagenase inicialmente vai para o fígado para garantir que todos os lobos são expostos a colagenase. Após a colagenase solução funciona para fora, uma digestão boa colagenase é indicativa pela separação da cápsula de Glisson a partir do parênquima.
O procedimento geral para purificação celular é descrito na Figura 6 e Figura 7 em que hepatócitos são colhidos no início do procedimento durante a baixa velocidade gira e são muito puro, depois de 4 lavagens em BSA-contendo buffers (Figura 8 ). SECs são co purificados com KCs em um gradiente PVP (Figura 9A) e em seguida separados por adesão seletiva sobre um placa de Petri de poliestireno revestido de colágeno. A pureza dos SECs usando esse método é 83-90% de pureza e depende em grande medida a eficácia global da digestão colagenase (Figura 9B). Medições quantitativas usando luz microscopia (como os hepatócitos e SECs têm características distintivas de outras células) mostram que em uma preparação representativa, hepatócitos são quase 100% puro e SECs são pouco mais de 89% de pureza (tabela 1). Alternativamente, um maior enriquecimento de segundos pode ser obtido por separação magnética de coluna após o gradiente PVP, apesar de que para além do âmbito do presente protocolo. Mais informações sobre separação magnética do SECs e KCs podem ser encontradas em Meyer et al. 9 e Liu et al . 14 deve ser lembrado que a viabilidade dos hepatócitos diminui rapidamente em um fígado insuficientemente digerido, mas isso não é necessário verdadeiro para os NPCs. insuficientemente digeridos fígados também produzem restos mais celulares, o que não é inteiramente eliminados nas etapas de centrifugação.
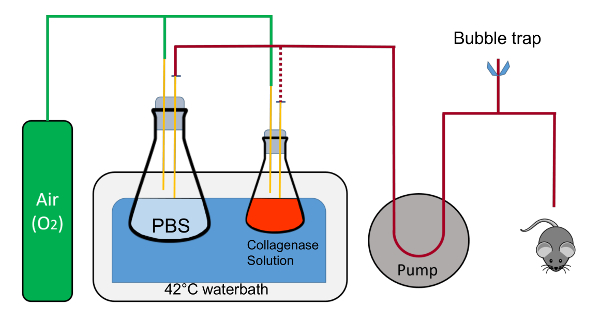
Figura 1 : Representação esquemática da suíte de perfusão. Os frascos são mantidos no lugar por grampos (não mostrados); o tubo contendo líquido é trocado do frasco de 1L para o balão de 125 mL durante o procedimento é representado pela linha vermelha pontilhada. Observe, que a alimentação de oxigênio não bolha diretamente para as soluções nos frascos. As rolhas de cortiça também devem ser entalhadas para permitir um fluxo de fluido de circuito fechado com o tubo inserido dentro do entalhe. Isto é crítico durante o warm-up da tubulação e para expulsão de todo o ar dentro da tubulação. A sangria de ar é composta do T-conector que é ligado à tubulação de Tygon e pitada de grampos para abrir rápida e encerramento do sistema. Clique aqui para ver uma versão maior desta figura.

Figura 2 : A suíte de perfusão durante a perfusão de fígado de rato. A bandeja com o mouse é colocada no canto do banho-maria. O oxigênio é desconectado a solução de colagenase, que já foi oxigenado durante o warm-up. Localização de itens são A) oxigênio linhas, balão B) 1 L contendo PBS, balão de C) 125 mL contendo tampão 2 com colagenase, D) bomba, controles E) bomba, F) o borbulhador, linha G) fluida desde o balão, através da bomba e para o mouse. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Imagem da vasculatura do abdômen rato. Inserção do cateter deve ser logo abaixo das junções de veia gástrica e pancreática, saindo a veia porta (ponto verde) e a ponta deve ser colocada perto de veias de portal hepáticas direita e esquerdas (ponto amarelo) que forma um garfo nos principais lobos do fígado. Uma vez que a colocação correta é alcançada, o cateter deve ser estabilizado com fio usando um simples nó de laçada. K = rim, L = fígado, SI = o intestino delgado. Clique aqui para ver uma versão maior desta figura.

Figura 4 : Colocação do cateter na veia portal. (A) a pinça é usada para garantir o ingurgitamento de sangue da veia portal e endireitar a veia para a colocação do cateter. (B) o cateter está alinhado em paralelo com a veia porta com bisel. (C), o bisel da agulha dentro do cateter é inserido na veia, não na veia. (D), a agulha do cateter está retraída e sangue será refluxo através do cateter, conforme indicado pela ponta da pinça. Clique aqui para ver uma versão maior desta figura.

Figura 5 : Boa perfusão hepática. (A) após a colocação do cateter, a fim de Luer fêmea do cateter está se conectando a extremidade macho Luer (corte de uma seringa de 1 mL) da tubulação da bomba. (B) depois de um corte dos grandes vasos sanguíneos decrescentes, sangue e PBS são drenados do abdômen, cortando do lado do mouse com uma tesoura. (C) o fígado deve branquear enquanto o sangue é liberado para fora e (D) vai inchar quando está sob pressão por espremedura fechada o vaso sanguíneo cortado com fórceps. Clique aqui para ver uma versão maior desta figura.

Figura 6 : Contorno esquemático da NPC isolamento e purificação do hepatócito. A maioria das etapas a centrifugação visa retirar as células não-parenquimatosas hepatócitos ao vivo e mortos. Clique aqui para ver uma versão maior desta figura.
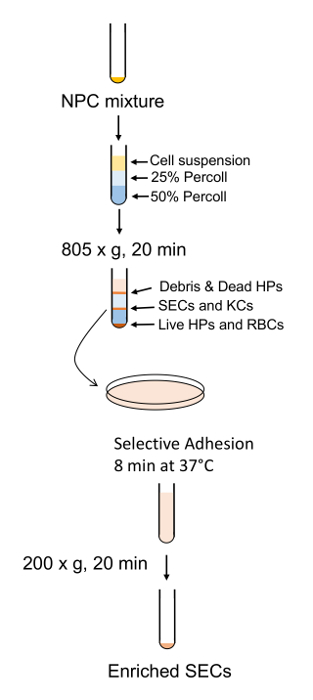
Figura 7 : Contorno esquemático da SEC enriquecimento e purificação. NPCs são separados por gradiente PVP seguido pela separação SEC adesão curto para uma placa de poliestireno padrão. Clique aqui para ver uma versão maior desta figura.
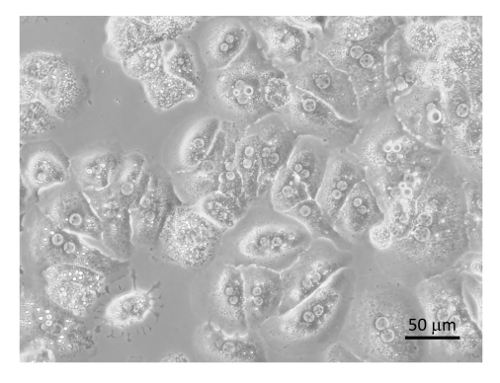
Figura 8 : Purificado hepatócitos. Hepatócitos foram banhados em placas de cultura de tecido colágeno revestida com DMEM + 8% FBS + caneta/Strep e incubados durante 6 h, seguido pela coleção de imagem por um microscópio em 400 X. Bar é igual a 20 µm. clique aqui para ver uma versão maior desta figura.
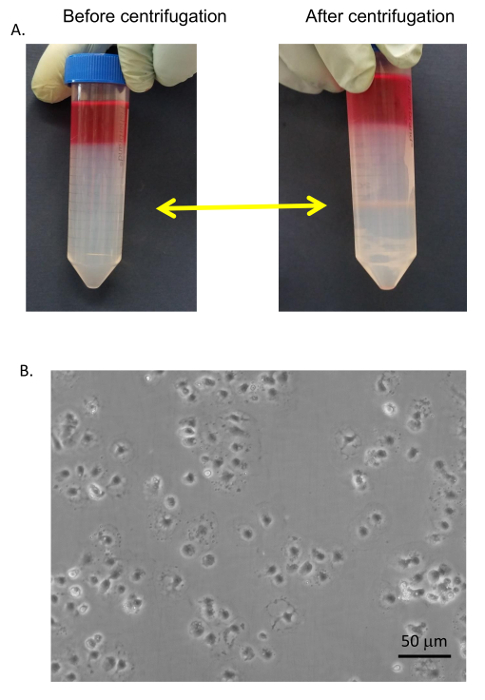
Figura 9 : Purificação do SEC. (A) SECs e KCs foram coletados a partir da interface PVP de 25/50% (setas amarelas) e lavadas com meio livre de soro. (B) o SECs foram separou as KCs por adesão seletiva no padrão placas de Petri, lavados e banhados em pratos de cultura de tecido colágeno-revestido em RPMI + 5% FBS. Imagens foram tiradas por um microscópio invertido de EVOS em 400 X. Bar é igual a 20 µm. clique aqui para ver uma versão maior desta figura.

Figura 10 : Microscopia eletrônica da anatomia do fígado de rato. Um fígado de rato foi perfundido com PBS seguido de fixador (100mm cacodylate de sódio, glutaraldeído 25% de 12 mL, paraformaldeído de 16% de 15,6 mL, 2,65 mM de cloreto de cálcio, sacarose 180,2 mM, misturado em 100 mL de solução) a uma taxa de 1 mL/min durante 4 min. os tecidos foram cortados e preparados para microscopia eletrônica. Imagens foram coletadas em um campo de emissão SEM a 10, 000 X. Setas amarelas indicam a microvilli entre os hepatócitos. Bar é igual a 5 µm. clique aqui para ver uma versão maior desta figura.

Figura 11 : Visualização dos mortos contra hepatócitos ao vivo. Depois de 2 lavagens com Buffer 1, peletizados hepatócitos poderão ser avaliados por relação ao vivo/morto pelo olho. Uma pelota mais leve (à esquerda) indica que pelo menos metade os hepatócitos estão mortos. A pelota mais escura à direita é peletizada mais firmemente no fundo do tubo e mais de 90% é ao vivo. Clique aqui para ver uma versão maior desta figura.
| Tabela 1: Purificação de célula | ||
| Tipo de célula | % nas células-alvo | % outras células |
| Hepatócitos | 99 | 1 |
| Sinsusoidal de células endoteliais | 89.1 | 10.9 |
Tabela 1: Avaliação da pureza de célula por microscopia de luz.
Discussão
Este protocolo destaca as ferramentas que estão disponíveis e que irá permitir ao usuário uma alta taxa de sucesso neste procedimento. Uma perfusão de sucesso é fundamental para qualquer aplicação a jusante ao trabalhar com as células primárias.
Existem algumas etapas críticas do processo que determinam o sucesso. Em primeiro lugar, a colocação da ponta do cateter dentro da veia portal deve estar correta. Se colocado muito longe no interior do fígado, somente os lóbulos menores vão ser perfundidos. A ponta deve ser logo abaixo os ramos direito e esquerdos da veia porta. A vantagem de usar um cateter de polímero-composto por uma agulha é que a barb da agulha é mais provável que rasgar a veia durante a perfusão do que um cateter. Em segundo lugar, a quantidade e a qualidade de colagenase determinam a eficiência de digestão do fígado. Neste procedimento, pré-qualificados colagenase tipo 4 foi usado e é resuspended em 0,5 mg/mL em Buffer 2 se a atividade de colagenase a ser analisada for maior que 900 IU.
Ao final da perfusão colagenase, o fígado deve manter um bronzeado um pouco escuro de cor marrom. Se é uma cor marrom clara, então, a maioria dos hepatócitos está morta. O fígado deve estar caindo aos pedaços quando cortada do mouse. Nas melhores condições, o fígado pode ser escavado fora da cavidade do corpo do mouse com uma pequena colher. Fígados nessa condição sempre dar viabilidade celular muito alta. Se é preciso muito esforço para agitar as células abaixo, se o fígado é ainda firme durante a extração, ou se há um monte de força necessária para mover os hepatócitos através dos filtros, os hepatócitos terá uma menor viabilidade. Hepatócitos são cobertos com microvilli, que lhes permite ter uma área de superfície muito alta (Figura 10). Digestão incompleta retém as junções célula-célula entre hepatócitos, e corte mecânico irá desfazer a membrana plasmática. In situ de perfusão com colagenase é o melhor método para separar as células e manter alta viabilidade. Na Figura 11, hepatócito duas preparações são feitas em que a célula pelotas foram comparadas após algumas lavagens em Buffer 1. A pelota do lado esquerdo é mais leve e contém uma viabilidade celular de cerca de 50%. A pelota à direita é mais escura e tem uma viabilidade de 92%. Da mesma forma, quando o líquido é derramado desde o 50ml cónico, a pelota mais escura é parada dentro do tubo, em contraste com o mais leve da pelota, que deslizará no tubo, como o líquido é coado. Menor viabilidade celular ou ineficientes perfusions podem ocorrer quando o fígado tem altos níveis de esclerose.
Desde que hepatócitos ao vivo tem uma densidade mais elevada do que morto hepatócitos, os procedimentos de centrifugação irão resultar em uma preparação que é altamente pura em hepatócitos viáveis15. Se houver uma quantidade significativa de hepatócitos mortos (que muitas vezes ocorre quando as condições são de qualidade inferior), ao vivo células podem ser ainda mais enriquecidas e separadas de células mortas, usando gradientes PVP. Além disso, desde que hepatócitos ao vivo mais rápido do que morto hepatócitos de Pelotas, aspiração do top 3rd da pelota também aumentará a proporção ao vivo de células mortas na pelota. Estes procedimentos são rápidos e métodos fáceis para separar vivem de hepatócitos mortos e detritos quando necessário da pilha10,16. Isso é particularmente útil se a amostra é preciosa, e somente alguns milhões de células são necessárias para o experimento.
Em conclusão, este é um método fácil e eficiente para a colheita de hepatócitos e segs do fígado. A preços correntes, o custo de executar este procedimento, incluindo todos os reagentes e materiais descartáveis é abaixo dos 75 USD por preparação. Se vários mouses são desejados, é melhor prosseguir com a purificação do hepatócito e manter a fração NPC no gelo, até que todos os ratos foram processados. NPCs são geralmente estáveis no gelo pelo menos 5 h, mas tempos mais longos não foram testados em laboratório.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Financiamento é fornecido em parte pelo NIH de grant R01HL130864.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 L Erlenmeyer flask | Fisher Scientific | S63274 | |
| 250 mL Erlenmeyer flask | Fisher Scientific | S63271 | |
| silicone tubing | Cole-Parmer | 96400-14 | This tubing runs from the flasks through the pump to the T connector and then to the 1.0 mL syringe that is connected to the catheter. |
| Tygon tubing | Fisher Scientific | R3603 | Used as an adaptor between 96400-14 and pipettes and T connector. This may also be used for the oxygen tubing. |
| T-connectors | Cole-Parmer | EW-06294-82 | |
| Quick dissconnects | Fisher Scientific | 6150-0010 | |
| Pinch Clamps | Fisher Scientific | 6165-0002 | |
| Masterflex L/S Variable speed Pump, model 7553-70 | Cole-Parmer | EW-07559-00 | Periplastic pump with variable speed |
| Pump head, model 7014-20 | Cole-Parmer | EW-07014-20 | |
| glass graduated 1.0 mL pipettes | Fisher Scientific | 13-678 | |
| curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Dumont forceps | Fine Science Tools | 11252-20 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| 10 mL syringe | Fisher Scientific | 03-377-23 | Only barrel of syringe will be needed |
| sterlized spoon | Home supply store | ||
| Cotton ball(s) | Home supply store | ||
| Polyester sewing thread | Home supply store | ||
| Masking tape | Home supply store | ||
| thumb tacks | Home supply store | ||
| styrofoam pad | 50 mL conical rack | ||
| cookie/baking sheet | Home supply store | ||
| Absorbant underpads | Fisher Scientific | 14-206-64 | |
| 19 L water bath | Fisher Scientific | TSCOL19 | |
| BD Insyte Autogaurd Shielded IV Catheter 24 guage | Becton Dickinson | 381412 | Plastic cathetar with retractable needle |
| Crystallizing dishes 100x50 | VWR | 89000-290 | |
| Polystyrene petri dishes | Sigma Aldrich | P5481-500EA | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| graduated pipettes (5 mL) | Fisher Scientific | 170355 | |
| graduated pipettes (25 mL) | Fisher Scientific | 170357 | |
| EasyStrainer 100 μM | Greiner bio-one | 542000 | 100 μm filter |
| EasyStrainer 40 μM | Greiner bio-one | 542040 | 40μm filter |
| Sterile transfer pipettes | Fisher Scientific | 13-711-20 | |
| Refrigerated swinging bucket centrifuge | Sorvall Legend XTR | 75-217-406 | Centrifuge with swinging bucket rotar |
| Galaxy 170R tissue culture incubator | Eppendorf | CO170R-120-0000 | Humidified tissue culture incubator |
| Reagents | |||
| Name | Compound | Grams (g/L) | Millimolar (mM) |
| Buffer 1, pH 7.4 | NaCl | 8.3 | 142 |
| KCl | 0.5 | 6.7 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| Buffer 2, pH 7.4 | NaCl | 3.9 | 66.74 |
| KCl | 0.5 | 6.71 | |
| CaCl2 | 0.7 | 6.31 | |
| HEPES | 24 | 100 | |
| BSA | 15 | 0.226 | |
| Phenol Red | 0.01 | 0.03 | |
| Buffer 3, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.35 | 4.7 | |
| MgSO4 | 0.08 | 0.66 | |
| CaCl2 | 0.18 | 1.62 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| PBS, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.2 | 2.7 | |
| Na2HPO4-7H2O | 1.15 | 4.3 | |
| KH2PO4 | 0.2 | 1.4 | |
| Other reagents | |||
| Name | Company | Catalog Number | Comments |
| Percoll (PVP solution) | GE Healthcare | 288555 | |
| Collagenase Type IV | Sigma Aldrich | C5138 | |
| Isoflurane | Abcam | ab144581 | |
| Hepatocyte Growth Medium | |||
| DMEM | Gibco | 11965118 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Long-term Hepatocyte Growth Medium | |||
| DMEM | |||
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Glucagon | Sigma | G3157-2mg | 14 ng/mL |
| Insulin | Sigma | I9278-5mL | 0.5 U/mL |
| Hydrocortisone | Sigma | H0888-1g | 7.5 mg/mL |
| Epidermal Growth Factor | BD Biosciences | 354001-100ug | 20 ng/mL |
| LSEC medium | |||
| RPMI | Gibco | 11875119 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 |
Referências
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods Cell Biol. 13, 29-83 (1976).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. J Exp Med. 94 (5), 431-453 (1951).
- Edstrom, S., Ekman, L., Ternell, M., Lundholm, K. Isolation of mouse liver cells: perfusion technique and metabolic evaluation. Eur Surg Res. 15 (2), 97-102 (1983).
- Meyer, J., Gonelle-Gispert, C., Morel, P., Buhler, L. Methods for Isolation and Purification of Murine Liver Sinusoidal Endothelial Cells: A Systematic Review. PLoS One. 11 (3), 0151945 (2016).
- Sies, H. The use of perfusion of liver and other organs for the study of microsomal electron-transport and cytochrome P-450 systems. Methods Enzymol. 52, 48-59 (1978).
- Smedsrod, B. Protocol for preparation of mouse liver Kupffer cells and liver sinusoidal endothelial cells. Munin open research archive. , 1-10 (2012).
- Smedsrod, B., Pertoft, H., Eggertsen, G., Sundstrom, C. Functional and morphological characterization of cultures of Kupffer cells and liver endothelial cells prepared by means of density separation in Percoll, and selective substrate adherence. Cell Tissue Res. 241 (3), 639-649 (1985).
- Meyer, J., Lacotte, S., Morel, P., Gonelle-Gispert, C., Buhler, L. An optimized method for mouse liver sinusoidal endothelial cell isolation. Exp Cell Res. 349 (2), 291-301 (2016).
- Kreamer, B. L., et al. Use of a low-speed, iso-density percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations. In Vitro Cell Dev Biol. 22 (4), 201-211 (1986).
- Meijer, D. K., Keulemans, K., Mulder, G. J. Isolated perfused rat liver technique. Methods Enzymol. 77, 81-94 (1981).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. J Vis Exp. (57), e3138 (2011).
- Cook, M. J. . The Anatomy of the Laboratory Mouse. , (1965).
- Liu, J., et al. Advanced Method for Isolation of Mouse Hepatocytes Liver Sinusoidal Endothelial Cells, and Kupffer Cells. Methods Mol Biol. 1540, 249-258 (2017).
- Knobeloch, D. E., Ehnert, S., Schyschka, L., Buchler, P., Schoenberg, M., Kleeff, J., Thasler, W. E., Nussler, N. C., Godoy, P., Hengstler, J., Nussler, A. K. Human Hepatocytes: Isolation, Culture, and Quality Procedures. Methods in Molecular Biology. 806, 99-120 (2012).
- Clarke, B. L., Weigel, P. H. Recycling of the asialoglycoprotein receptor in isolated rat hepatocytes. ATP depletion blocks receptor recycling but not a single round of endocytosis. J Biol Chem. 260 (1), 128-133 (1985).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados