Method Article
Hepatocytes에서 마우스 간 사인 내 피 세포의 정화 관류
요약
이 프로토콜의 목표는 간에서 높은 생존 능력 및 hepatocytes 및 정현파 내 피 세포의 높은 수익률을 얻을 것입니다. 이 유형 IV 콜라 솔루션 hepatocytes 및 정현파 내 피 세포 차등 원심 분리 뒤 문맥을 통해 간 perfusing에 의해 수행 됩니다.
초록
이 프로토콜에서는 높은 수율 및 마우스 hepatocytes 및 정현파 내 피 세포 (초) 또는 배양 세포 lysates 얻기 위해 적당 한 생존 하는 방법을 보여 줍니다. 이 프로토콜에는 문맥으로 사용 됩니다 사이트 보다는 베 나 정 맥 도관 법,이 최종 간 준비에 다른 가능한 세포 유형의 오염 제한. 아니 특별 한 계측은 절차에 걸쳐 필요 합니다. 물 목욕 모든 버퍼 솔루션의 온도 유지 하기 위해 열의 소스로 사용 됩니다. 표준 연동 펌프는 유체를 사용 되 고 냉장된 테이블-가기 원심 분리기는 원심 분리 절차에 필요한. 이 기술의 유일한 제한은 18 25 g 크기 범위에서 쥐의 일부에 도전 포털 정 맥 내 카 테 터의 위치입니다. 이 기법의 장점은 관류에 대 한 활용 한 정 맥 정 맥에 대 한 액세스는, 국 소 빈 혈과 reperfusion 간장 세포 생존 능력을 감소 시키는 간 극소화 하입니다. 이 프로토콜에 또 다른 장점은 원심 분리 단계 동안 세포 밀도 차이로 인해 시력에 의해 죽은 hepatocytes에서 라이브 구별 하기 쉽습니다. 이 프로토콜에서 셀 수 수 세포 배양에 사용 하는 모든 다운스트림 응용 프로그램에 대 한 뿐 아니라 어떤 생 화 학적 평가 대 한 처리.
서문
Hepatocytes를 간 콜라 관류 1950 년대 초부터 수행 하 고1,2,,34시 지속적으로 향상 되었습니다. 방법론, 기술, 그리고 간 세포 정화에 사용 되는 시 약의 많은 것의 아주 좋은 검토 메이어 외5에서 컴파일 되었습니다. 매우 가능한 hepatocytes의 초 만족 스러운 수익률을 얻는 기술적 도전 이다. 콜라의 품질을 포함 하 여 셀을 구분 하는 기계적인 힘은 통제 하기 어려운 변수. Hepatocyte 감도 기계적인 힘, 때문 그들의 생존 격리에 대 한 최적의 조건을 설명 하는 프로토콜에 대 한 필요 라는 최적의 조건에서 현저 하 게 감소 된다. 초 하지 기계적 전단에 민감한 것으로 나타납니다. 콜라 소화와 현장에서 관류를 간, 소장, 비장6등 다른 장기에서 단일 셀 준비-셀 연결을 방해 하는 좋은 방법은 까지입니다. 이 프로토콜에서는 Smedsrød 외7에 설명 된 대로 축소, 포털 정 맥을 일으킬 수 있는 절 개 보다는 접이식 플라스틱 카 테 터를 사용 하 여 포털 혈관에 관류 버퍼를 소개 하는 간단한 방법을 보여 줍니다.
이 원고의 목표는 간 풍부 절차에서 성공에 필요한 가장 중요 한 단계. 다음이 단계는 카 테 테 르 배치, 관류 액체, 소화 후 조직의 처리의 흐름. 흐름 요금은 위의 혈액 흐름의 자연 속도 조정 하지만 충분히 낮은 Glisson의 캡슐을 그대로 유지 합니다. 일단 간 제대로 소화 하 고 셀 솔루션에서 분리 되어, 셀 정화는 상대적으로 간단한 차동 원심 분리, 판 접착, 또는 자석 구슬 정화 수행 여부. 라이브 hepatocytes 높은 밀도 있고 쉽게 nonparenchymal 셀 (Npc)와 저속 원심 분리와 죽은 hepatocytes에서 순화 된다. 대부분의 응용 프로그램에 대 한 Kupffer 분리 판 접착 세포 (관세) 이며 초 일반적인 방법8의 경우, 비록 그것이 초9의 최고의 순도 생성 하지 않습니다 보고 있다. 관세는 단단한 단단한 표면에 신속 하 게 준수 하는 경향이 있고 접시 (표준 폴리스 티 렌)는이 절차에 대 한 가장 일반적으로 사용 되는 소재. 하지만이 프로토콜에 또 다른 3-4 h를 추가 하는 절차와 전반적인 수확량은 감소9항 체 활용 자석 구슬의 사용과 초 또는 KC 정화 의심할 여 지 없이이 세포의 중요 한 정화에 대 한 좋은 방법입니다. 이 보고서는 일반적으로 실행 가능한 세포의 높은 번호를 생성 하는 최적의 간 관류에 대 한 과정 자세히 보여 줍니다.
프로토콜
이 프로토콜에서 설명 하는 모든 동물 절차는 기관 동물 관리 및 사용 위원회 (IACUC) 링컨-프로토콜 #1435 네브라스카 대학에 의해 승인 되었습니다.
1입니다. 준비
- 솔루션 및 문화 미디어 준비
- 모든 문화 미디어와 테이블의 재료에 따라 버퍼를 준비 합니다.
- 악기의 준비
- 물 목욕을 설정 (> 10 L) 42 ° C, 연동 펌프, 가변 속도와 플라스 크를 들고 위한 클램프. 곡선된가 위, 집게 (그림 1)를 준비 합니다.
- 또는 물 목욕에 인접 한, 베이킹 시트 (약 38 x 26 cm) 스티로폼 패드 (50 mL 원뿔 랙), (그림 1) 20 x 20 cm 조각으로 잘라 네모난 underpad와 중첩을 설정 합니다.
- 마스킹 테이프 (5-8 cm) 조각 가까이 놓습니다. 장소 근처에 20 cm 폴 리 에스테 꿰매는 실 컷 하 고 준비가 사용 이다. 개폐식 바늘 (7mm x 19 mm, 그림 1) 플라스틱 카 테 터를 얻을.
- 유리의 준비
- 클램프를 사용 하 여, 배치 하 고 포함 하는 솔루션으로가 두 1 mL 펫 스 토퍼와 1 x PBS의 200 mL 물 욕조에 1 L 플라스 크를 무력화. 고무 코르크 폐쇄 회로에 액체의 재순환 수 있도록 노치 이다.
- 다른 클램프와 스 토퍼가 두 1 mL 펫, 중 하나는 액체 액체 위에 유지 하 고 플라스 크에 산소를 불면 플라스 크 및 다른의 아래쪽에 함께 버퍼 2의 45 mL를 포함 하는 125 mL 플라스 크를 배치 합니다.
참고:는 stoppers에서 각 피 펫 빠른 튜브의 쉬운 엇 바꾸기를 위한 끝에 연결 된 어댑터를 분리 해야 합니다. 산소는 액체에 몰입 하지 마 개에 피 펫을 통해 두 플라스 크에 부드럽게 흐르는 될 것입니다. - 두 살 균 crystallizing 요리 따로 설정 합니다.
2. 동물 절차
- 물 목욕에서 42 ° C에 PBS 및 버퍼 2 솔루션을 따뜻하고 따뜻한 액체 라인을 유지 하는 폐쇄 회로에 튜브에 20 mL/min 이상에 대 한 PBS를 순환. 모든 초과 배관 유지 물 목욕에서 담가 42 ° c.에 최대한 가까이 1 L 플라스 크 포함 PBS에 튜브의 남성 끝을 배수 하십시오.
- 흡수 성 underpad에 목화 공을 놓고 전송 피 펫을 사용 하 여 목화 공을에 30 %isoflurane (폴 리 에틸렌 글리콜 200 isoflurane의 증발 속도 감소에 구성)의 약 2 개 mL를 추가 합니다.
- Crystallizing 요리 중 하나에 배치를 다음 신속 하 게 전복 요리 목화 공에 마우스는 흡입 마 취에 있는 작은 공간, 꼬리는 마우스 들고. 마우스의 호흡 속도 관찰 하 고 마우스가 효과적으로 마 취 합니다.
참고: 호흡 속도 느리고, 이어야 한다 꼬리 이완, 그리고 발 마 취; 핀치 테스트에 응답 하지 않습니다 자세한 내용은 IACUC 지침을 참조 하십시오. - 마우스 마 취 (이 1-2 분 소요)가, 하는 동안 플런저를 꺼내 작은 면봉을 삽입 하 여 10 mL 주사기의 배럴을 준비. 총 신 내부 목화 공을에 30 %isoflurane 전송 피 펫과의 1-2 mL를 추가 하 고 의식이 될 마우스를 기다리는 동안 테이블에 배럴을 아래로 오픈 엔드 장소.
- 빨리 crystallizing 접시를 벗고, 그것의 뒤에 마우스를 플립 하 고 그것의 코에 놓고 주사기 배럴. 더블 체크 호흡 속도, 발가락 핀치 및 이완 된 꼬리. 어떤 응답 발가락 핀치와 이완 된 꼬리를 마우스는 완전히 마 취에서 나타냅니다. 무 의식 유지 하기 위해 주 둥이 위에 주사기 배럴을 유지.
- 장소 엄지 tacks 부정사 위치에 뻗은 팔 다리와 마우스의 발을 통해. 복 부 및 70% 소 프로 파 놀 또는 에탄올과 흉 곽에 젖은.
- 한 손으로에 직선 겸 자와 함께 복 부의 기지 근처 피부를 들어올립니다. 다른 한편에서가 위를 덮고 피부 및 복 막 잘라. 절 개는 수평 또는 덮고 피부 베이스에 걸쳐 해야 합니다. 용기에 대 한 액세스를 얻기 위해 피부와 복 막의 모든 레이어를 통해 잘라 해야 합니다. 잘라 옆으로 흉 곽까지 복 부 주위 양쪽 모두 장기의 nicking 없이.
- 잘라 피부 플랩 절단 하 여 낮은 흉 곽에 걸쳐. 포털 정 맥 노출 집게의 뒤와 오른쪽에 내장을 이동 합니다.
참고: 최소화; 있어야 동물에서 출혈 동물 여전히 호흡 한다 고 깊은 마 취. - 장소 간 및 우수한 pancreaticoduodenal 정 맥 (그림 3 화살표) 사이 문맥 아래 닫힌된 곡선된 겸 자.
- 포털 정 맥 아래 집게를 엽니다. 스레드를 잡고 조심 스럽게 포털 정 맥 아래 중심을 빼냅니다. 아래로 cinching 없이 포털 정 맥 주위 overhand 매듭을 묶어.
- 문맥에서 곡선된 겸 자 놓고(그림 4)정 맥 밖으로 똑바르게 하는 마우스의 꼬리 쪽으로 살짝 당겨.
- 반면에 테와 얼굴 및 문맥 집게 (그림 4B) 근처의 낮은 부분으로 병렬 바늘의 경사를 놓습니다.
- (그림 4C) 바늘으로 정 맥을 찔린 부드럽게 합니다. 정 맥의 루멘 바늘의 경사 되어 확인 하십시오. 스프링 바늘을 철회 하 고 경사 지역 근처에 있는 정 맥 분기 될 때까지 정 맥을 통해 폴리머 카 테 터를 밀어 계속. 이것은 간 내입니다. 카 테 터를 올바르게 배치 하는 경우 혈액의 역류 표시 됩니다. (그림 4D).
- Overhand 매듭을 강화 하 고 그것을 안정 수 있도록 카 테 터에 풀 다운. 즉시 20 mL/min에서 펌프 속도 4 mL/min를 거절 하 고 배수 장치를 위한 또 다른 주요 혈관을 잘라. 최적의 결과 위해 대동맥 abdominalis를 잘라.
- 카 테 터 (그림 5A)의 여성 끝에 튜빙의 남성 끝을 놓습니다. 라인에서 아무 공기 방울 인지 확인 합니다. 카 테 터는 간 / 정 맥 밀 하나 다는 것을 조심 하십시오. 그것은 정 맥의 역류를 방지 하 고 올바른 위치 (그림 5B, C)에 카 테 터를 유지할 수 있지만 스레드 배치 필수, 아니다.
- 마스킹 테이프를 사용 하 여는 underpad에 튜브를 고정. 직선 겸 자 사용 하 여 부 풀 려 간 몇 번 유출 혈관을 짜 내 모든 혈액은 (그림 5D) 밖으로 배수 되도록.
참고: 표준 실험실 테이프 작동 하지 않을 수 있습니다; 그러나, 마스킹 테이프 붙어 underpad, 젖은 조건에도 유지 됩니다.
3. 간 관류
- 간은 PBS를 가진 홍 조, 하는 동안 콜라 유형 IV의 약 24 밀리 그램을 측정 하 고 물 목욕에 버퍼 2의 45 mL를 포함 하는 플라스 크에. 콜라는 완전히 용 해 되도록 플라스 크에 액체를 소용돌이 및 플라스 크의 액체 부분을 포함 하는 완전히 물에 빠져들 클램프에 다시 플라스 크를 배치 해야 합니다.
- PBS와 플러시으로 간 색에서 변화를 관찰 합니다. 1 L 플라스 크에서 125 mL 플라스 크 유출 튜브를 변경 합니다. 기포는 간으로 흐르는 것을 허용 하지 않습니다.
- 관류 버퍼 간에 도달 하면, 간단히 짠 다 꽉 선박 내의 일부 압력을 구축 하 고이 액체의 모든 돌출부를 채우기 위해 허용을 유출 혈관. 수는 수 간 (Glisson의 캡슐)를 둘러싼 얇은 결합 조직 고 파괴 관류 또는 간의 모 세관 침대에 내에서 액체의 흐름으로 너무 오래, 배수를 차단 하지 않도록 주의 하십시오.
- 모든 45 mL는 조직을 통해 흘러 때까지 통해 perfuse 하 콜라 버퍼 2 허용.
참고: 성공 하면 Glisson의 캡슐 분리 되어야 한다는 실질 또는 간 조직 및 간 자체 비정 질 표시 되어야 합니다. - 다른 crystallizing 접시 버퍼 1의 약 10 mL을 추가 하 고 마우스 옆에 놓습니다.
- 카 테 터를 제거 하 고 펌프를 해제.
- 스트레이트 집게와가 위, 간 마우스에서 잘라. 콜라 소화 매우 효율적인 있었다면, 그것은 손에을 마우스에서 간 푸 버퍼 1에서 깨끗 하 고 마른 숟가락을가지고 필요할 수 있습니다.
4. hepatocyte 정화
참고: 셀의 조작 오염 되더라도 셀 모든 후속 단계에서 경작 하는 메 마른 조직 문화 후드에서 수행 됩니다.
- 무 균 기술을 사용 하 여, 간 집게와을 부드럽게 간에서 세포를 흔들어. 떨어져 눈물 또는 철수 Glisson의 캡슐: 셀 간에서 동요는으로 버퍼 불투명 될 것입니다.
- 100 µ m 필터 위에 배치 50 mL 원뿔형으로 셀 솔루션을 붓는 다.
- 더 많은 버퍼 1 간 나머지를 추가 하 고 셀 밖으로 동요를 계속. 셀 또는 때 소화 되지 않은 부분의 간 양보 하지 더 이상 세포가 없는 간 표시 될 때까지 계속 합니다.
- 또 다른 50 mL 원뿔 40 µ m 필터를 포함 하에 세포 액체를 부 어.
- 3 분 100 x g에서 진동 물통 회전자에 원뿔 원심.
참고:이 빠질 수도 있습니다. 셀 펠 릿으로 최대 브레이크를 사용 하지 마십시오. 브레이크를 사용 하 여 모든 나머지 원심 분리 단계 4 ° C에 대 한 충분 한 80% - 깨끗 한 원추형으로 상쾌한 (포함 하는 NPCs와 죽은 hepatocytes)을 부 어와 얼음에 그것을 배치. 이 펠 릿 준수를 관찰 한 모션에 이루어집니다 보장 합니다.
- 버퍼 1 40 mL에 펠 릿을 resuspend. 4.5와 4.6 단계를 반복 합니다. 버퍼 3 40 mL에 펠 릿을 resuspend. 4.5와 4.6 단계를 두 번 반복 합니다.
- Resuspend 정화 hepatocytes 따뜻한 DMEM + 10 %FBS + 2 x 페니실린-스 (펜/Strep).
- 셀 콜라겐 코팅 접시에 교양, 1 시간을 준수 하 고 적어도 한 번 대체 미디어가 막을 것 이다 어떤 초기 세균 오염 물질.
- 37 ° C에서 1 시간 이상에 대 한 0.001% 아세트산에 0.05% 콜라겐과 잠복기 하 고 다음 1 x PBS로 세척 하 여 콜라겐 코팅 접시를 확인 합니다.
- Hepatocyte 생존 능력은 낮은 경우 정화 높은 가능한 hepatocytes 얻을 다음 Kreamer 외10에서 적응 하는 다음 프로토콜을 사용 하 여 욕망.
- PVP 솔루션 (Percoll, 물의 23 %w / w 솔루션 및 15-30 nm 콜 로이드 실리 카 입자 밀도 원심 분리에 대 한 polyvinylpyrrolidone에 코팅)의 혼합 9 볼륨 고 iso 삼투성 PVP 솔루션 (SIP) 10 x HBSS의 1 볼륨.
- SIP의 24 mL를 무 균 50 mL 원뿔에서 4 ° c.까지 2 개월 동안 이러한 조건에 저장할 수 있습니다 추가
- 5-10 × 106 셀/ml 한 단계 4.8에서에서 같은 문화 매체와 hepatocyte 농도 조정 합니다.
- 각 24 mL 원뿔 포함 하는 SIP에 세포 현 탁 액 25 mL를 추가 하 고 부드러운 반전에 의해 혼합. 이 솔루션의 밀도 1.06 g/mL 이다.
- 4 ° c.에서 10 분 동안 50 x g에서 원뿔 원심
- SIP 및 flocculant, aspirate 그리고 resuspend HBSS 셀.
- 셀 4 ° c.에서 10 분 동안 50 x g에서 원심 분리 하 여 세척
- 단계 4.10.6를 한 번 더 반복 하 고 셀 성장 매체에 resuspend.
5. 초 정화
- 작은 단계의 4.6 supernatants 셀 공의 10 분 삭제에 대 한 163 x g에서 튜브를 회전 시켜 튜브에서 supernatants 없이 혈 청 RPMI의 5 mL에 셀 알 약의 모든 resuspend 고 한 관에서 함께 수영장.
- 모든 펠 릿 풀링된 되었습니다 RPMI 35 mL의 최종 볼륨을 추가할.
- 원심은 풀링된 원뿔 25 x g에서 3 분 신중 하 게 발음 25 mL 피 펫 및 장소 RPMI의 상위 25 mL를 깨끗 한 50 ml 원뿔 얼음에 Npc를 포함 하이 미디어에 대 한.
- 튜브를 다시 신선한 RPMI의 25 mL를 추가 하 고 resuspend는 펠 릿.
- 두 번째 워시를 수영장에서 상쾌한 5.3 단계를 반복 합니다. 미디어와 펠 렛 (펠 릿 이루어져 주로 죽은 hepatocytes)의 나머지 10 mL를 삭제 합니다. 10 분 동안 163 x g에서 풀링된 상쾌한 원심
- 원심 분리, 중 50 ml 원뿔 PVP 솔루션 그라디언트를 준비 합니다.
- 뒤에 Percoll 입혔다 pipettor 느린 방출 속도를 설정 하는 25%의 20 mL 50 mL 원뿔을 50 %PVP 솔루션의 15 mL를 추가 합니다. 이것이 초 및 관세는 원심 분리 후 집계 합니다 두 개의 레이어를 정하는 15 mL 마크에 굴절 라인을 관찰 해야 합니다.
- PVP 솔루션 그라데이션에 그들을 오버레이 및 resuspend 셀 차가운 RPMI의 단계 10에서 5.5 mL에서 이전 일지도. 두 레이어 사이의 명확한 경계를 유지 해야 합니다. 50%로 설정 하는 브레이크와 805 x g 20 분에 그라데이션 원심.
- 튜브에 20 mL 마크 위에서 방향 아래로 aspirate 그리고이 자료를 삭제. 5 mL 전송 피 펫과 초 및 25 / 50% 인터페이스에 있는 관세를 수집 합니다. 이들은 죽은 hepatocytes 셀의 모든 갈색 덩어리를 삭제 합니다.
- 원뿔 놓고 셀 50 mL에 PVP 솔루션을 희석을 50 mL 마크 RPMI 추가 합니다. 80% 브레이크와 10 분, 200 x g에서 원심.
- 발음 하 고 삭제는 상쾌한 펠 릿 따뜻한 RPMI의 12 ml에서 원뿔의 떨어져 세척 하는 동안 resuspend.
- 폴리스 티 렌 페 트리 접시에에서는 상쾌한을 배치 하 여 관세에서 고 초를 분리 하 고 실 온에서 8 분 습도 조직 문화 인큐베이터에서 품 어.
- 25 mL 피 펫 및 린스 pipettor는 관세 동안 남은 초를 수집 하는 최저 속도로 설정으로 동일한 미디어 접시 접시 준수 미디어 발음
- 10 분 동안 200 x g에서 초 원심 및 FBS + 펜/Strep RPMI + 5 %resuspend. 다음 titer 셀 및 콜라겐 코팅 문화 요리에서.
결과
간 관류 및 정화/농축 hepatocytes의 초 시위 적인, 세련 된 메서드는 여기에 제시 된 최적의 셀 정화/농축 참조이 컴파일된 다른 인쇄 된 보고서와 마찬가지로 대 한 자세한 도움말을 제공 하 5를검토 합니다. 세포질 정화의 성공을 결정 하는 중요 한 단계 경로 및 콜라 관류 절차의 기술적인 세부 사항에 발생 하 고이 프로토콜에 설명 되어 있습니다. 기구에 대 한 설치는 매우 간단 하 고 비용 효율적인 표준 실험실 장비, 다른 시스템에 게시 된11 (그림 1) 되었습니다 달리. 이 설정에서 마우스를 잡고 트레이 간 내 perfusing 액체의 온도 유지 하기 위해 물 욕조에 초과 배관의 일부와 함께 물 욕조에 앉아 있다. 다음과 같이 장치 쥐 간 관류12 (그림 2)에 대 한 약간 다른 형상으로 쥐, 마우스를 사용할 수 있습니다.
이 절차에서는 간 복 부 내의 접근의 용이성 때문 (이 또 다른 인기 있는 관류 경로) 베 나 정 맥 대신 문맥을 통해 끼얹는다는 고 정 맥 간에 직접 피드. 뷰어는 문맥 perfusate, 단락 수 있는 몇 가지 작은 가지 있으며 테 최적의 성공13 (그림 3) 이러한 분기 과거 두어야 한다 알고 있어야 한다. 포털 정 맥을 확인 한 곡선된 겸 자 간 사이의 우수한 췌 장 십이지 장 정 맥 수술 봉합 또는 폴 리 에스테 르 스레드는 문맥 아래를 그리는 데 사용 됩니다. 집게도 긍정적인 혈액 압력(그림 4)은문맥에 밖으로 똑바르게 하는 데 사용 됩니다. 병렬 및 정 맥 (그림 4B) 옆 테 내 바늘 두어야 한다 고 경사 (그림 4C) 정 맥의 루멘에 부드럽게 삽입 해야 합니다. 적절 한 배치 카 테 터를 따라 나타나는 혈액에 의해 표시 됩니다. 일단 바늘 철회 테 그것에 묶여 스레드와 안정 해야 하 고 혈압을 카 테 터를 통해 혈액을 강제할 것 이다. (그림 4D) 밖으로 혈액을 유출 하기 전에 테 펌프 튜브에 연결 될 것이 좋습니다. 펌프 튜브 연결 되 면 즉시 혈액/액체 배수(그림 5)에 대 한 대동맥 abdominalis 베 나 정 맥 등 주요 혈관을 잘라. 그것은 일반적으로 복 부에 혈액의 어려운 관류 프로세스를 시각화 하 고 혈액 세포 정화 (그림 5 로이 월 수 있습니다 충분 한 배수 장치를 위한 마우스의 복 부 벽의 측면을 절단 하는 데 필요한 B). PBS 간 perfuse를 시작, 일단 간 혈액 (그림 5C)의 부재와 함께 희게 됩니다. 돌출부의 약간 희게 하는 경우에 가능성이 원인은 이다 테 간 안에 너무 멀리 배치 되었습니다 고 천천히 밖으로 역행 될 필요가 있을 것 이다. 카 테 터의 위치 확인 방수 마스킹 테이프를 사용 하 여 장소에 튜브를 확보. 일반 실험실 테이프 일반적으로 충분 하지 않습니다. 카 테 터의 적절 한 배치를 확인 하려면 배수 장치를 중단 하 고 간 내에서 증가 압력을 잘라 혈관을 짠 다. 이렇게 간 (그림 5D)에서 피를 홍 조에 도움이 됩니다. 이 또한 할 수 콜라 솔루션은 모든 돌출부 콜라에 노출 되어 있는지 확인을 간 처음 들어갈 때. 콜라 솔루션 실행 된 후, 좋은 콜라 소화는 실질에서 Glisson의 캡슐의 분리에 의해 나타내는 것입니다.
그림 6에서 세포 정화에 대 한 일반적인 절차를 설명 하는 및 그림 7 에 있는 hepatocytes는 수확 초기에 프로시저에서 낮은 속도 동안 회전 매우 순수 4 BSA 포함 된 버퍼 (그림 8에에서 세척 후 ). 초 공동 PVP 그라데이션(그림 9)에 관세와 정화 되며 다음 콜라겐 코팅 된 폴리스 티 렌 페 트리 접시에 선택적 접착으로 구분. 이 메서드를 사용 하 여 초의 순도 순수 83-90% 이며 주로 콜라 소화 (그림 9B)의 전반적인 효과에 따라 달라 집니다. 빛을 사용 하 여 양적 측정 현미경 (hepatocytes와 초 다른 셀에서 구별 되는 특징을가지고) 표시는 대표 준비, hepatocytes는 거의 100% 순수 하 고 초는 넘게 89% 순수 (표 1). 또는, 비록 그이 프로토콜의 범위를 넘어 초의 높은 농축 PVP 그라데이션 후 자기 열 분리에 의해 얻을 수 있습니다. 마이어 외 에 초 관세의 자력 분리에 대 한 더 많은 정보를 찾을 수 있습니다. 9 와 리 우 외. 14 그것은 기억 되어야 한다 hepatocytes의 충분 소화 간 급속 하 게 감소 하지만 이것이 NPCs. 제대로 소화 간은 또한 완전히 아니다 더 세포질 파편 생성 필요한 true 원심 분리 단계에서 탈락.
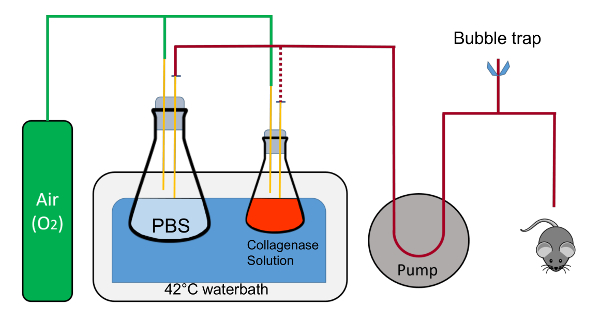
그림 1 : 관류 스위트의 도식 대표. 플라스 크 클램프 (표시 되지 않음);에 의해 장소에서 개최 됩니다. 튜브 포함 액체 절차 동안 125 mL 플라스 크에 1 L 플라스 크에서 바꾼은 빨간 점선으로 표시 됩니다. 참고, 산소 피드는 플라스 크에 솔루션에 직접 버블링 되지 않습니다. corks 노치 내 삽입 튜브와 폐쇄 회로 유체 흐름 수 있도록 노치도 한다. 이것은 중요 한 워밍업 튜브와 튜브 내의 모든 공기의 방출 동안입니다. 공기 블리드 Tygon 튜브 및 빠른 오픈 핀치 클램프 및 폐쇄 시스템에 연결 된 T-커넥터 구성 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 : 마우스 간 관류 동안 관류 스위트. 마우스와 트레이 물 목욕의 모서리에 배치 됩니다. 그는 이미 워밍업 하는 동안 산소로 콜라 솔루션에서 산소 연결이 끊어집니다. 항목의 위치는 A) 산소 라인, PBS, 콜라, D) 펌프, E) 펌프 컨트롤, F) 거품 트랩, 펌프를 통해 및 마우스를 플라스 크에서 실행 하는 G) 유체 라인 버퍼 2를 포함 하는 C) 125 mL 플라스 크를 포함 하는 B) 1 L 플라스 크. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 이미지의 마우스 복 부의 맥 관 구조. 카 테 터의 삽입 문맥 (녹색 점)를 빼야 하는 위장과 췌 장의 정 맥 교차점 바로 아래 고 팁 왼쪽과 오른쪽 간장 포털 정 맥 (노란 점) 간 주요 돌출부에 포크를 형성 하 부근에 위치 한다. 일단 정확한 위치 달성 테 간단한 overhand 매듭을 사용 하 여 스레드를 안정화 해야 합니다. K = 신장, L = 간, SI = 소장. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 : 포털 정 맥에 카 테 테 르 배치. (A)는 집게 포털 정 맥의 혈액 engorgement을 보장 하 고 카 테 테 르 배치에 대 한 정 맥 밖으로 똑바르게 하는 데 사용 됩니다. (B) 카 테 터는 줄지어 경사와 문맥을 병행. (C) 카 테 터 내에서 바늘의 경사 하지 정 맥을 통해 정 맥에 삽입 됩니다. (D)는 카 테 터의 바늘은 철회 하 고 피 카 테 터를 통해 역류는 집게의 끝에 표시 된 대로. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5 : 적절 한 간 관류. (A) 후 카 테 터 배치, 카 테 터의 여성 Luer 끝 남성 Luer 월말 (1 mL 주사기에서 잘라) 펌프 튜브에 연결 합니다. (B) 주요 내림차순 혈관, 혈액과 PBS의 한 절단이 위 마우스의 사이드를 조각화 복에서 물기는 후. (C) 혈액을 밖으로 플러시 및 (D) 집게와 졸라 종료 컷된 혈관에 의해 압박을 받고 때 팽창할 것입니다 하는 동안 간 희게 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 6 : Hepatocyte 정화 및 전인대 격리의 도식 개요. 대부분의 원심 분리 단계 비 parenchymal 세포에서 라이브 하 고 죽은 hepatocytes를 제거 하고자 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
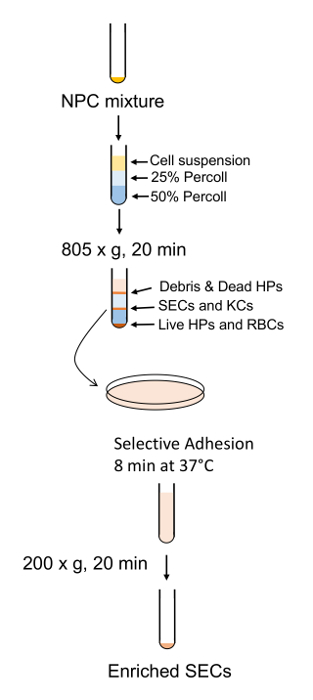
그림 7 : 초 농축 및 정화의 도식 개요. NPCs는 PVP 그라데이션 표준 폴리스 티 렌 격판덮개에 짧은 접착 초 분리에 의해 다음에 의해 구분 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
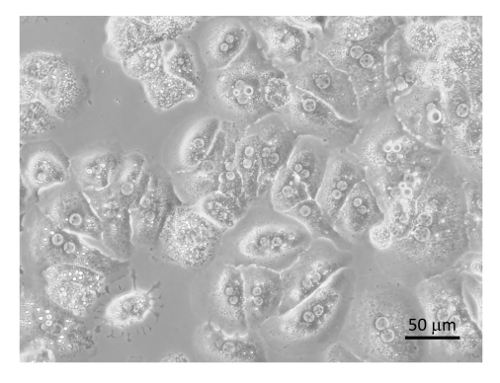
그림 8 : 정화 hepatocytes. Hepatocytes는 DMEM + 8 %FBS + 펜/Strep 콜라겐 코팅 조직 문화 접시에 도금 고 400 X에서 현미경에 의해 6 h 뒤에 이미지 컬렉션에 대 한 인 큐베이 팅. 바 같습니다 20 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
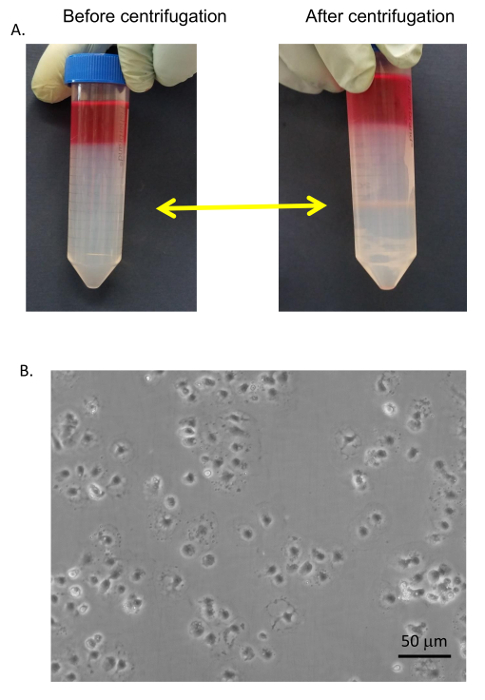
그림 9 : 초 정화. (A) 초 및 관세 25/50 %PVP 인터페이스 (노란색 화살표)에서 수집 된 혈 청 무료 매체와 세척. (B)는 초 선택적 접착 표준 배양 접시에는 관세에서 분리, 세척, 되었고 RPMI + 5% 콜라겐 코팅 조직 문화 접시에 도금 FBS. 이미지는 거꾸로 EVOS 현미경 400 X에 의해 촬영 됐다. 바 같습니다 20 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 10 : 마우스 간 해부학의 전자 현미경 스캐닝. 마우스 간 끼얹는다 했다 PBS 4 분에 1 mL/min의 속도로 정착 액 (100 m m 나트륨 cacodylate, 12 mL 25%도, 15.6 mL 16 %paraformaldehyde, 2.65 m m 칼슘 염화 물, 180.2 mM 자당, 100 mL 해결책에 혼합) 다음으로 조직 했다 슬라이스 고 스캐닝 전자 현미경 검사 법에 대 한 준비. 이미지 수집 필드 방출 SEM에 10, 000 X. 노란색 화살표는 hepatocytes 사이 microvilli 나타냅니다. 바 같습니다 5 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 11 : 라이브 hepatocytes 대의 시각화. 2 버퍼 1 세척, 후 수송과 hepatocytes 눈으로 라이브/죽은 비율에 대 한 평가 될 수 있습니다. 라이터 펠 릿 (왼쪽) 적어도 절반 hepatocytes 죽은 나타냅니다. 오른쪽에는 어두운 펠 릿은 더 단단히 수송과 튜브의 바닥에 고는 90% 이상이 살고 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 표 1: 세포 정화 | ||
| 셀 유형 | % 대상 셀 | % 셀 |
| Hepatocytes | 99 | 1 |
| Sinsusoidal 내 피 세포 | 89.1 | 10.9 |
표 1: 가벼운 현미경 검사 법에 의해 셀 순도의 평가.
토론
이 프로토콜 도구를 사용할 수 있으며이 절차에 성공의 높은 속도 사용자를 줄 것 이다을 강조 한다. 1 차 셀을 작업할 때 성공적인 관류 모든 다운스트림 응용 프로그램에 대 한 근본 이다.
성공을 결정 하는 절차의 몇 가지 중요 한 단계가 있습니다. 첫째, 포털 정 맥 내 카 테 터 팁의 위치는 올바른 수 있어야 합니다. 너무 멀리 간 안에 배치 하는 경우만 작은 돌출부를 끼얹는다 것입니다. 팁 바로 아래 포털 정 맥의 오른쪽과 왼쪽 분기 해야 합니다. 폴리머 복합 카 테 테 르 바늘 사용의 이점은 바늘의 미 늘 더 카 테 터 보다 관류 동안 정 맥을 찢 어 것입니다. 둘째, 콜라 품질과 수량 간 소화 효율을 결정합니다. 이 절차에서는, 그리고 콜라 활동 분석 수 900 IU 보다 크면 버퍼 2에서 0.5 mg/mL에서 resuspended는 사전 자격된 콜라 유형 4 사용.
콜라 관류의 끝에, 간 다소 어두운 황갈색 갈색 색상을 유지 해야 합니다. 빛 황갈색 색깔 인 경우는 hepatocytes의 대부분은 죽 었 다. 간은 떨어져 때 마우스에서 잘라 떨어지고 되어야 한다. 최상의 조건에서 간 수 수 특 종 마우스의 신체 구멍에서 작은 숟가락으로. 이 상태에서 간은 항상 매우 높은 세포 생존 능력을 제공합니다. 간 동안 추출, 여전히 확고 경우 흔들 세포 떨어져, 많은 노력 걸립니다 또는 있는 hepatocytes는 필터를 통해 이동 하는 데 필요한 힘의 많은 경우는 hepatocytes 낮은 생존 능력이 있을 것 이다. Hepatocytes microvilli, 매우 높은 표면 영역 (그림 10)을가지고 그들 수 있습니다 덮여 있다. 불완전 한 소화 hepatocytes, 사이-셀 연결을 보유 하 고 원형질 막 떨어져 눈물 것입니다 기계적 전단. 콜라와 관류 제자리에서 세포를 분리 하 고 높은 생존 능력을 유지 하는 좋은 방법은 이다. 그림 11, 두 hepatocyte 준비는 셀 펠 릿에 만들어진 몇 가지 버퍼 1에서 세척 후 비교 되었다. 왼쪽에 펠 릿 라이터 이며 약 50%의 세포 생존 능력을 포함 합니다. 오른쪽에 펠 릿 어두운 이며 92%의 가능성 있다. 마찬가지로, 액체 50 mL 원뿔에서 부는, 어두운 펠 릿은 액체를 부 어 서 튜브에서 슬라이드 됩니다 라이터 펠 릿 달리 튜브 내에서 고정. 간 경화 증의 높은 수준이 낮은 세포 생존 능력 또는 비효율적인 perfusions 발생할 수 있습니다.
라이브 hepatocytes 죽은 hepatocytes 보다는 더 높은 조밀도 때문에, 원심 분리 절차 가능한 hepatocytes15에서 높은 순수 준비를 발생 합니다. 라이브 (는 종종 조건이 최적이 아닌 경우 발생) 죽은 hepatocytes, 상당한 양의 경우 셀 수 있습니다 더 농축 되며 PVP 그라디언트를 사용 하 여 죽은 세포에서 분리. 또한, 이후 라이브 hepatocytes 죽은 hepatocytes 보다 빠르게 펠 렛, 펠 릿의 상위 3rd 의 열망 또한 죽은 셀 펠 릿에 라이브의 비율을 증가할 것 이다. 이러한 절차는 신속 하 고 분리 하기 쉬운 방법 죽은 hepatocytes에서 살고 파편 필요할 때 셀10,16. 고 몇 백만 세포는 실험에 필요한 샘플, 경우에 특히 유용 합니다.
결론적으로,이 수확 hepatocytes와 초 간에서에 대 한 간단 하 고 효율적인 방법입니다. 현재 가격으로, 모든 시 약 및 disposables를 포함 하 여이 절차를 수행 하는 비용 준비 당 75 달러 미만입니다. 여러 마우스 바란다면 hepatocyte 정화와 함께 진행 하 여 모든 마우스 처리 될 때까지 얼음에 NPC 분수를 계속 최상 이다. NPCs는 적어도 5 h, ice에 일반적으로 안정 하지만 긴 시간이이 실험실에서 테스트 되지 않았습니다.
공개
저자는 공개 없다.
감사의 말
자금 그랜트 R01HL130864에서에서 NIH에 의해 부분에 제공 됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 L Erlenmeyer flask | Fisher Scientific | S63274 | |
| 250 mL Erlenmeyer flask | Fisher Scientific | S63271 | |
| silicone tubing | Cole-Parmer | 96400-14 | This tubing runs from the flasks through the pump to the T connector and then to the 1.0 mL syringe that is connected to the catheter. |
| Tygon tubing | Fisher Scientific | R3603 | Used as an adaptor between 96400-14 and pipettes and T connector. This may also be used for the oxygen tubing. |
| T-connectors | Cole-Parmer | EW-06294-82 | |
| Quick dissconnects | Fisher Scientific | 6150-0010 | |
| Pinch Clamps | Fisher Scientific | 6165-0002 | |
| Masterflex L/S Variable speed Pump, model 7553-70 | Cole-Parmer | EW-07559-00 | Periplastic pump with variable speed |
| Pump head, model 7014-20 | Cole-Parmer | EW-07014-20 | |
| glass graduated 1.0 mL pipettes | Fisher Scientific | 13-678 | |
| curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Dumont forceps | Fine Science Tools | 11252-20 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| 10 mL syringe | Fisher Scientific | 03-377-23 | Only barrel of syringe will be needed |
| sterlized spoon | Home supply store | ||
| Cotton ball(s) | Home supply store | ||
| Polyester sewing thread | Home supply store | ||
| Masking tape | Home supply store | ||
| thumb tacks | Home supply store | ||
| styrofoam pad | 50 mL conical rack | ||
| cookie/baking sheet | Home supply store | ||
| Absorbant underpads | Fisher Scientific | 14-206-64 | |
| 19 L water bath | Fisher Scientific | TSCOL19 | |
| BD Insyte Autogaurd Shielded IV Catheter 24 guage | Becton Dickinson | 381412 | Plastic cathetar with retractable needle |
| Crystallizing dishes 100x50 | VWR | 89000-290 | |
| Polystyrene petri dishes | Sigma Aldrich | P5481-500EA | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| graduated pipettes (5 mL) | Fisher Scientific | 170355 | |
| graduated pipettes (25 mL) | Fisher Scientific | 170357 | |
| EasyStrainer 100 μM | Greiner bio-one | 542000 | 100 μm filter |
| EasyStrainer 40 μM | Greiner bio-one | 542040 | 40μm filter |
| Sterile transfer pipettes | Fisher Scientific | 13-711-20 | |
| Refrigerated swinging bucket centrifuge | Sorvall Legend XTR | 75-217-406 | Centrifuge with swinging bucket rotar |
| Galaxy 170R tissue culture incubator | Eppendorf | CO170R-120-0000 | Humidified tissue culture incubator |
| Reagents | |||
| Name | Compound | Grams (g/L) | Millimolar (mM) |
| Buffer 1, pH 7.4 | NaCl | 8.3 | 142 |
| KCl | 0.5 | 6.7 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| Buffer 2, pH 7.4 | NaCl | 3.9 | 66.74 |
| KCl | 0.5 | 6.71 | |
| CaCl2 | 0.7 | 6.31 | |
| HEPES | 24 | 100 | |
| BSA | 15 | 0.226 | |
| Phenol Red | 0.01 | 0.03 | |
| Buffer 3, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.35 | 4.7 | |
| MgSO4 | 0.08 | 0.66 | |
| CaCl2 | 0.18 | 1.62 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| PBS, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.2 | 2.7 | |
| Na2HPO4-7H2O | 1.15 | 4.3 | |
| KH2PO4 | 0.2 | 1.4 | |
| Other reagents | |||
| Name | Company | Catalog Number | Comments |
| Percoll (PVP solution) | GE Healthcare | 288555 | |
| Collagenase Type IV | Sigma Aldrich | C5138 | |
| Isoflurane | Abcam | ab144581 | |
| Hepatocyte Growth Medium | |||
| DMEM | Gibco | 11965118 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Long-term Hepatocyte Growth Medium | |||
| DMEM | |||
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Glucagon | Sigma | G3157-2mg | 14 ng/mL |
| Insulin | Sigma | I9278-5mL | 0.5 U/mL |
| Hydrocortisone | Sigma | H0888-1g | 7.5 mg/mL |
| Epidermal Growth Factor | BD Biosciences | 354001-100ug | 20 ng/mL |
| LSEC medium | |||
| RPMI | Gibco | 11875119 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 |
참고문헌
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods Cell Biol. 13, 29-83 (1976).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. J Exp Med. 94 (5), 431-453 (1951).
- Edstrom, S., Ekman, L., Ternell, M., Lundholm, K. Isolation of mouse liver cells: perfusion technique and metabolic evaluation. Eur Surg Res. 15 (2), 97-102 (1983).
- Meyer, J., Gonelle-Gispert, C., Morel, P., Buhler, L. Methods for Isolation and Purification of Murine Liver Sinusoidal Endothelial Cells: A Systematic Review. PLoS One. 11 (3), 0151945 (2016).
- Sies, H. The use of perfusion of liver and other organs for the study of microsomal electron-transport and cytochrome P-450 systems. Methods Enzymol. 52, 48-59 (1978).
- Smedsrod, B. Protocol for preparation of mouse liver Kupffer cells and liver sinusoidal endothelial cells. Munin open research archive. , 1-10 (2012).
- Smedsrod, B., Pertoft, H., Eggertsen, G., Sundstrom, C. Functional and morphological characterization of cultures of Kupffer cells and liver endothelial cells prepared by means of density separation in Percoll, and selective substrate adherence. Cell Tissue Res. 241 (3), 639-649 (1985).
- Meyer, J., Lacotte, S., Morel, P., Gonelle-Gispert, C., Buhler, L. An optimized method for mouse liver sinusoidal endothelial cell isolation. Exp Cell Res. 349 (2), 291-301 (2016).
- Kreamer, B. L., et al. Use of a low-speed, iso-density percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations. In Vitro Cell Dev Biol. 22 (4), 201-211 (1986).
- Meijer, D. K., Keulemans, K., Mulder, G. J. Isolated perfused rat liver technique. Methods Enzymol. 77, 81-94 (1981).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. J Vis Exp. (57), e3138 (2011).
- Cook, M. J. . The Anatomy of the Laboratory Mouse. , (1965).
- Liu, J., et al. Advanced Method for Isolation of Mouse Hepatocytes Liver Sinusoidal Endothelial Cells, and Kupffer Cells. Methods Mol Biol. 1540, 249-258 (2017).
- Knobeloch, D. E., Ehnert, S., Schyschka, L., Buchler, P., Schoenberg, M., Kleeff, J., Thasler, W. E., Nussler, N. C., Godoy, P., Hengstler, J., Nussler, A. K. Human Hepatocytes: Isolation, Culture, and Quality Procedures. Methods in Molecular Biology. 806, 99-120 (2012).
- Clarke, B. L., Weigel, P. H. Recycling of the asialoglycoprotein receptor in isolated rat hepatocytes. ATP depletion blocks receptor recycling but not a single round of endocytosis. J Biol Chem. 260 (1), 128-133 (1985).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유