Method Article
Purificazione di epatociti e cellule endoteliali sinusoidali da fegato di topo perfusione
In questo articolo
Riepilogo
L'obiettivo del presente protocollo è quello di ottenere alta attuabilità e ad alto rendimento di epatociti e cellule endoteliali sinusoidali dal fegato. Ciò avviene mediante che irrora il fegato con una soluzione di collagenasi tipo IV tramite la vena portale, seguita da centrifugazione differenziale per ottenere gli epatociti e le cellule endoteliali sinusoidali.
Abstract
Questo protocollo viene illustrato un metodo per ottenere ad alto rendimento e redditività per mouse epatociti e cellule endoteliali sinusoidali (SECs) adatte per la coltura o per l'ottenimento di lisati cellulari. In questo protocollo, la vena viene utilizzata come il sito per cateterizzazione, piuttosto che la vena cava, come questo limita la contaminazione di altri tipi cellulari possibili nella preparazione finale del fegato. Nessuna strumentazione speciale è richiesta durante la procedura. Un bagno d'acqua è usato come una fonte di calore per mantenere la temperatura di tutti i buffer e soluzioni. Una pompa peristaltica standard è usata per guidare il fluido, e una centrifuga refrigerata tavolo è necessaria per le procedure di centrifugazione. L'unica limitazione di questa tecnica è il posizionamento del catetere all'interno della vena portale, che è una sfida su alcuni dei topi nell'intervallo di dimensioni di 18-25 g. Un vantaggio di questa tecnica è che solo una vena è utilizzata per l'aspersione e l'accesso alla vena è rapido, che riduce al minimo l'ischemia e la riperfusione del fegato che riduce l'attuabilità delle cellule epatiche. Un altro vantaggio di questo protocollo è che è facile da distinguere dal vivo dagli epatociti morti vista a causa della differenza nella densità cellulare durante le fasi di centrifugazione. Le cellule da questo protocollo possono essere utilizzate nella coltura cellulare per qualsiasi applicazione a valle come pure trattate per qualsiasi valutazione biochimica.
Introduzione
Collagenasi aspersione del fegato per ottenere epatociti è stata effettuata dal primi anni 1950 ed è stato continuamente migliorato1,2,3,4. Una bella recensione di molte delle metodologie, tecniche e dei reagenti utilizzati nella purificazione delle cellule di fegato è stata compilata in Meyer et al.5. Ottenere un rendimento soddisfacente dei hepatocytes altamente praticabile e SECs è tecnicamente impegnativo. Le forze meccaniche che separano le celle tra cui la qualità della collagenosi sono alcune delle variabili che sono difficili da controllare. Dovuto la sensibilità dell'epatocita a forze meccaniche, la loro sopravvivenza è marcatamente ridotto in condizioni sub-ottimali, che richiede la necessità di un protocollo che descrive le condizioni ottimali per l'isolamento. SECs non sembrano essere sensibili ai meccanici di taglio. Aspersione in situ con digestione della collagenosi è di gran lunga il metodo migliore per interrompere giunzioni della cellula-cellula per ottenere preparazioni di singole cellule di fegato e altri organi come l'intestino e milza6. Questo protocollo viene illustrato un metodo semplice per l'introduzione di buffer di aspersione nella vena portale utilizzando un catetere di plastica retraibile, piuttosto che un'incisione che potrebbe causare la vena porta al collasso, come descritto in Smedsrød et al.7.
L'obiettivo di questo manoscritto è quello di illustrare i passaggi più critici richiesti per il successo della procedura profusione del fegato. Tali passaggi includono la disposizione del catetere, flusso di liquidi di perfusione e manipolazione del tessuto dopo la digestione. Le portate sono regolati sopra il tasso naturale di flusso sanguigno, ma abbastanza basso per mantenere intatta la capsula di Glisson. Una volta che il fegato è digerito correttamente e le cellule sono separate in soluzione, purificazione cellulare è relativamente semplice se viene eseguito tramite centrifugazione differenziale, adesione di piastra, o di purificazione di biglie magnetiche. Epatociti dal vivo hanno una maggiore densità e facilmente sono purificati dalle cellule parenchimale (NPC) e morti epatociti con centrifugazione a bassa velocità. Per la maggior parte delle applicazioni, adesione di piastra per la separazione di Kupffer cellule (KCs) e SECs è un metodo comune8, anche se ci sono rapporti che non produce la migliore purezza di SECs9. KCs hanno la tendenza ad aderire a superfici rigide solide in fretta e capsule di Petri (standard polistirolo) sono il materiale più comunemente utilizzato per questa procedura. Purificazione di SEC o KC con l'uso di biglie magnetiche anticorpo coniugato è senza dubbio il metodo migliore per purificazione significativo di queste cellule, anche se la procedura consente di aggiungere un altro 3-4 h su questo protocollo e la resa è in diminuzione9. Questa relazione illustra in dettaglio il processo per un'ottimale perfusione del fegato che produce in genere un elevato numero di cellule vitali.
Protocollo
Tutte le procedure degli animali descritte in questo protocollo sono state approvate dal istituzionale Animal Care e uso Committee (IACUC) presso l'Università di Lincoln - Nebraska sotto protocollo #1435.
1. preparazione
- Preparazione di terreni di coltura e soluzioni
- Preparare tutti i terreni di coltura e tampone secondo la Tabella dei materiali.
- Preparazione di strumenti
- Impostare un bagno d'acqua (> 10 L) a 42 ° C, una pompa peristaltica con velocità variabile e morsetti per lo svolgimento di boccette. Preparare le forbici curve e forcipe (Figura 1).
- Su o adiacente al bagno d'acqua, impostare una teglia da forno (circa 38 x 26 cm) con un pad di polistirolo (cremagliera conica 50 mL), sovrapposto con un assorbente underpad tagliate un pezzo di 20 x 20 cm (Figura 1).
- Posizionare un pezzo di nastro adesivo (5-8 cm) nelle vicinanze. Posto un cucirino Poliestere 20cm nelle vicinanze che è tagliato e pronto all'uso. Ottenere un catetere di plastica con un ago retrattile (7 mm x 19 mm, Figura 1).
- Preparazione di oggetti di vetro
- Con fascette, posizionare e immobilizzare una L 1 pallone nel bagno d'acqua che contiene 200 mL di 1X PBS con un tappo che ha due pipette da 1 mL andando nella soluzione. Il tappo di gomma è dentellato per consentire il ricircolo del fluido in un circuito chiuso.
- Con un altro morsetto, posto una bottiglia di 125 mL contenente 45 mL di tampone 2 insieme con un tappo che ha due pipette da 1 mL, uno dei quali è nel liquido nella parte inferiore del pallone e l'altro che rimane sopra il liquido e soffia ossigeno nel pallone.
Nota: Ogni pipetta nei tappi avrà un rapido scollegare l'adattatore collegato alla fine per il facile passaggio del tubo. Ossigeno sarà delicatamente che scorre in entrambi palloni tramite la pipetta nel tappo che non è immerso nel liquido. - Mettere da parte due piatti di cristallizzazione sterile.
2. procedura animale
- Riscaldare le soluzioni PBS e Buffer 2 a 42 ° C nel bagno d'acqua e circolare PBS per almeno 20 mL/min della tubazione a circuito chiuso per mantenere le linee di liquide caldo. Immergere ogni tubo in eccesso nel bagno d'acqua a rimanere più vicino possibile a 42 ° C. Drenare l'estremità maschio del tubo nel PBS contenente L 1 boccetta.
- Posizionare un batuffolo di cotone sul underpad assorbente e aggiungere circa 2 mL di 30% isoflurane (composta in polietilene glicole 200 che diminuisce il tasso di evaporazione di isoflurane) sul batuffolo di cotone con una pipetta di trasferimento.
- Sollevare il mouse per la coda, inserirlo in uno dei piatti di cristallizzazione e quindi rapidamente rovesciare il piatto sopra la palla di cotone, così che il mouse ha un piccolo spazio in cui inalare l'anestesia. Osservare la frequenza respiratoria del mouse e verificare che il mouse viene efficacemente nell'ambito dell'anestesia.
Nota: La frequenza respiratoria dovrebbe essere più lento e più profondo, la coda flaccido e le zampe non rispondono alla prova di pizzico sotto anestesia; Vedi linee guida IACUC per ulteriori dettagli. - Mentre il mouse è in corso nell'ambito dell'anestesia (questo richiede 1-2 min), preparare la canna di una siringa da 10 mL tirando fuori lo stantuffo e inserendo un batuffolo di cotone piccolo. Aggiungere 1-2 mL di 30% isoflurane con una pipetta di trasferimento per il batuffolo di cotone all'interno della canna e posizionare la canna fissa giù su un tavolo durante l'attesa per il mouse a diventare inconscio.
- Rapidamente togliere il piatto di cristallizzazione, capovolgere il mouse sul dorso e posizionare il corpo della siringa sul suo naso. Doppio controllo il tasso di respirazione, pizzico di punta e coda flaccida. Tutte le risposte per il pizzico di punta e coda flaccida indica che il mouse non è completamente sotto anestesia. Tenere la siringa sopra il muso per mantenere uno stato di incoscienza.
- Puntine di luogo attraverso le zampe del mouse, con le membra tesato in posizione supina. Bagnare l'addome e la gabbia toracica con 70% isopropanolo o etanolo.
- Con il forcipe dritto in una mano, sollevare la pelle vicino alla base dell'addome. Con le forbici in mano, tagliare la pelle tenda e il peritoneo. L'incisione deve essere orizzontale o attraverso la base della pelle tenda. Assicuratevi di tagliare attraverso tutti gli strati della pelle e del peritoneo per poter accedere all'intestino. Tagliare lateralmente intorno all'addome fino alla gabbia toracica su entrambi i lati senza intaccare qualsiasi organo.
- Tagliato il lembo di pelle dal taglio attraverso la gabbia toracica inferiore. Spostare l'intestino a destra con la parte posteriore delle pinze per esporre la vena portale.
Nota: Sanguinamento dall'animale dovrebbe essere minimo; l'animale deve essere ancora respirando e sotto anestesia profonda. - Posizionare il forcipe curvo chiuso sotto la vena portale tra il fegato e la vena pancreaticoduodenale superiore (freccianella figura 3 ).
- Aprire la pinza mentre sotto la vena portale. Afferrare il filo e passarlo attentamente affinché sia centrato sotto la vena portale. Legare un nodo semplice intorno alla vena portale senza cinching esso giù.
- Posizionare il forcipe curvo sotto la vena portale e tirarlo delicatamente verso la coda del mouse per raddrizzare la vena (Figura 4A).
- Con il catetere in altra mano, posizionare la smussatura dell'ago a faccia in su e in parallelo con la parte inferiore della vena portale vicino il forcipe (Figura 4B).
- Delicatamente la puntura della vena con l'ago (Figura 4C). Garantire che la smussatura dell'ago è nel lume della vena. Ritirare l'ago a molla e continuare a spingere il catetere di polimero attraverso la vena fino a quando la smussatura è vicino alla zona di ramificati venosa. Questo è all'interno del fegato. Se il catetere è posizionato correttamente, è possibile che un riflusso di sangue sarà visibile. (Figura 4D).
- Stringere il nodo alla marinara e tirare verso il basso sul catetere per contribuire a stabilizzare esso. Immediatamente girare verso il basso il tasso di pompa da 20 mL/min a 4 mL/min e tagliare un altro vaso sanguigno principale per il drenaggio. Tagliare il centrifugalis dell'aorta per ottenere risultati ottimali.
- Inserire l'estremità maschio del tubo per l'estremità femmina del catetere (Figura 5A). Assicurarsi che non siano senza bolle d'aria nella linea. Fare attenzione che il catetere non è neppure spinto nel fegato o out of the vein. Posizionamento del thread non è essenziale, anche se aiuta a prevenire il riflusso out of the vein e aiuta a mantenere il catetere nella posizione corretta (Figura 5B, C).
- Utilizzare nastro adesivo per immobilizzare il tubo sulla traversa. Utilizzare il forcipe dritto per spremere il vaso sanguigno degli effluenti per gonfiare il fegato un paio di volte a garantire tutto il sangue fuoriuscire(Figura 5).
Nota: Il nastro di laboratorio Standard potrebbe non funzionare; Tuttavia, nastro adesivo rimarrà bloccato per underpad, anche in condizioni di bagnato.
3. fegato perfusione
- Mentre il fegato è di lavaggio con PBS, misurare circa 24 mg di collagenasi di tipo IV e posizionarlo nel matraccio contenente 45 mL di tampone 2 nel bagno d'acqua. Essere sicuri di turbinio il liquido nel pallone, affinché la collagenasi sia completamente dissolto e posizionare il pallone indietro nel morsetto in modo che la parte liquida contenente del pallone è completamente immersa nell'acqua.
- Osservare il cambiamento di colore del fegato come esso viene svuotata con PBS. Cambiare il tubo di deflusso dalla beuta 1l al pallone da 125 mL. Non lasciare bolle d'aria di fluire nel fegato.
- Una volta che il buffer di perfusione raggiunge il fegato, brevemente spremere stretto il vaso sanguigno degli effluenti per costruire un po' di pressione all'interno del vaso e consentire questo liquido riempire tutti i lobi del fegato. Essere sicuri di non tagliare troppo a lungo, di drenaggio come che potrebbe scoppiare il sottile tessuto connettivo che circonda il fegato (capsula di Glisson) e distruggere la perfusione o il flusso di liquido all'interno del letto capillare del fegato.
- Consentire 2 Buffer con collagenasi per irrorare attraverso il fegato, fino a quando tutti i 45 mL fluito attraverso il tessuto.
Nota: In caso di successo, capsula di Glisson deve essere separato dal parenchima o tessuto del fegato e il fegato stesso dovrebbe apparire amorfo. - Aggiungere circa 10 mL di tampone 1 altro piatto il cristallizzazione e posizionarlo accanto al mouse.
- Rimuovere il catetere e spegnere la pompa.
- Con il dritte pinze e le forbici, tagliare il fegato dal mouse. Se la digestione della collagenosi era molto efficiente, può essere necessario avere un cucchiaio pulito, sterile pronto a scoop il fegato dal mouse e posizionarlo in Buffer 1.
4. dell'epatocita purificazione
Nota: La manipolazione delle cellule vengono eseguiti in una cappa sterile coltura tissutale per limitare la contaminazione se le celle sono di essere colta in tutti i passaggi successivi.
- Utilizzando una tecnica sterile, afferrare il fegato con il forcipe e agitare delicatamente le cellule dal fegato. Lacerare o tirare indietro la capsula di Glisson: buffer diventerà opaco come le cellule sono scossi dal fegato.
- Versare la soluzione di cella in un 50 mL conica con un 100 µm filtro posto sopra la parte superiore.
- Aggiungere più Buffer 1 ai resti del fegato e continuare a scuotere fuori le cellule. Continuare fino a quando il fegato appare privo di cellule o quando le parti non digerite del fegato non danno piu ' cellule.
- Versare il liquido cellulare in un altro 50 mL conico contenente un filtro di 40 µm.
- Centrifugare la conica in un rotore oscillante a 100 x g per 3 min.
Nota: Non utilizzare il freno massimo come questo può sloggiare il pellet cellulare. Usare il freno all'80%, che è sufficiente per tutti i passaggi rimanenti di centrifugazione a 4 ° C - Versare il sovranatante (che contiene gli NPC ed epatociti morti) in un pulito conico e posizionarlo sul ghiaccio. Garantire che ciò avvenga in un unico movimento per osservare l'aderenza della pallina.
- Risospendere il pellet in 40 mL di tampone 1. Ripetere i passaggi da 4.5 e 4.6. Risospendere il pellet in 40 mL di tampone di 3. Ripetere i passaggi da 4.5 e 4.6 due volte.
- Risospendere gli epatociti purificati in caldo DMEM + 10% FBS + 2 x penicillina-streptomicina (Pen/Strep).
- Se le cellule sono coltivate su piastre di collagene rivestito, permettere loro di aderire per 1 h e sostituire i media almeno una volta come questo impedirà eventuali contaminanti batterici nascente.
- Rendere le piastre di collagene rivestito di incubarle con collagene 0.05% in acido acetico 0.001% per almeno 1 h a 37 ° C e successivamente lavate con PBS 1X.
- Se la vitalità dell'epatocita è bassa e c'è un desiderio di ottenere epatociti vitali alta purificati quindi utilizzare il seguente protocollo adattato da Kreamer et al10.
- Mix 9 volumi di soluzione PVP (Percoll, una soluzione di p/p di 23% di acqua e particelle di silice colloidale di 15-30 nm rivestite in polivinilpirrolidone per centrifugazione di densità) e 1 volume di 10 x HBSS per rendere una soluzione isoosmotica PVP (SIP).
- Aggiungere mL 24 di SIP a una sterile 50 mL conica che può essere memorizzato in queste condizioni fino a 2 mesi a 4 ° C.
- Regolare la concentrazione dell'epatocita a 5-10 × 106 cellule/mL con terreno di coltura come quello indicato al punto 4.8.
- Aggiungere 25 mL di sospensione cellulare per ogni mL 24 SIP contenente conico e mescolare capovolgendo. La densità di questa soluzione è 1,06 g/mL.
- Centrifugare la conica a 50 x g per 10 min a 4 ° C.
- Aspirare il SIP e flocculante e risospendere le cellule in HBSS.
- Lavare le cellule mediante centrifugazione a 50 x g per 10 min a 4 ° C.
- Ripetere il passaggio 4.10.6 ancora una volta e quindi risospendere le cellule in coltura.
5. SEC purificazione
- Agglomerare le cellule nei surnatanti dal passaggio 4.6 facendo girare i tubi a 163 x g per 10 min. scartare i surnatanti dai tubi e risospendere tutti delle palline delle cellule in 5 mL di RPMI senza siero e li riunire in una provetta.
- Una volta che tutti i pellet sono stati riuniti, aggiungere RPMI al volume finale di 35 mL.
- Centrifugare il pool conica a 25 x g per 3 min. Aspirare accuratamente la top 25 mL di RPMI con una pipetta da 25 mL e posto questo NPC che contenevano in un pulito 50 mL conica sul ghiaccio.
- Aggiungere 25 mL di RPMI fresco torna alla provetta e risospendere il pellet.
- Ripetere il passaggio 5.3 per un secondo lavaggio e piscina il supernatante. Scartare i rimanenti 10 mL di media e pellet (il pellet consiste principalmente di epatociti morti). Centrifugare il supernatante in pool a 163 x g per 10 min.
- Durante la centrifugazione, preparare i gradienti di soluzione PVP in un 50 mL conica.
- Aggiungere 15 mL di soluzione di PVP del 50% per i 50 mL conico seguita da 20 mL di Percoll overlaid con un pipettatore impostato la più lenta velocità di espulsione il 25%. Assicurarsi di osservare una linea di rifrazione al mark 15 mL che delimita i due strati, come questo è dove il SECs e KCs aggregherà dopo la centrifugazione.
- Risospendere le cellule precedentemente pellettate in punto 5.5 in 10 mL di RPMI freddo e le rivestirai sul gradiente di soluzione PVP. Assicuratevi di mantenere una netta demarcazione tra i due strati. Centrifugare la sfumatura a 805 x g per 20 min con un freno fissato al 50%.
- Aspirare dall'alto verso il basso direzione fino alla tacca di 20 mL sul tubo ed eliminare questo materiale. Con una pipetta di trasferimento di 5 mL, raccogliere il SECs e KCs che si trovano nell'interfaccia di 25/50%. Scartare qualsiasi marrone grumi di cellule come queste sono morti epatociti.
- Mettere le cellule in un 50 mL conica e aggiungere RPMI fino al contrassegno di 50 mL per diluire la soluzione di PVP. Centrifugare a 200 x g per 10 min, con freno di 80%.
- Aspirare e scartare il surnatante e risospendere il pellet durante il lavaggio fuori del cono della conica in 12 mL di RPMI caldo.
- Separare il SECs da KCs inserendo il surnatante in una capsula di Petri di polistirolo e incubare in un incubatore umidificato coltura tissutale per 8 min a temperatura ambiente.
- Aspirare i media con una pipetta da 25 mL e sciacquare la piastra con gli stessi mezzi, con il pipettatore impostato alla velocità minima per raccogliere i restanti SECs mentre la KCs aderire alla piastra.
- Centrifugare il SECs a 200 x g per 10 min e risospendere in RPMI + 5% FBS + Pen/Strep. Quindi titolo le cellule e posto in piastre di coltura rivestite con collagene.
Risultati
Un metodo dimostrativo, raffinato per aspersione epatica e purificazione/arricchimento dei hepatocytes e SECs è presentato qui che fornisce suggerimenti dettagliati per cellulare ottimale purificazione/arricchimento simile ad altri report stampato, compilato in questo riferimento Scrivi una recensione su 5. I punti critici che determinano il successo per purificazione cellulare si verificano nel percorso e dettagli tecnici della procedura di aspersione di collagenasi e sono descritte in questo protocollo. Il set-up per l'apparato è abbastanza semplice e conveniente con normale attrezzatura da laboratorio, a differenza di altri sistemi che sono stati pubblicati11 (Figura 1). In questo set-up, il vassoio tenendo premuto il mouse è posizionato su bagno d'acqua con alcuni del tubo in eccesso nel bagno d'acqua per mantenere la temperatura dei liquidi che irrora all'interno del fegato. L'apparecchio come illustrato di seguito può essere utilizzato per topi e ratti, con una geometria leggermente diversa per aspersione del fegato di ratto12 (Figura 2).
In questa procedura, il fegato è irrorato tramite vena portale invece la vena cava (che è un altro itinerario di aspersione popolare) grazie alla sua facilità di accesso all'interno dell'addome e che la vena alimenta direttamente il fegato. Lo spettatore deve essere consapevole che la vena portale ha parecchi piccoli rami che possono cortocircuitare il perfusato e il catetere deve essere posizionato in passato questi rami per successo ottimale13 (Figura 3). Una volta individuata la vena portale, forcipe curvo vengono utilizzato per disegnare una sutura chirurgica o filo di poliestere sotto la vena portale tra il fegato e la vena pancreatico-duodenale superiore. Le pinze sono utilizzate anche per raddrizzare la vena che è sotto pressione positiva (Figura 4A). L'ago all'interno del catetere deve essere collocata parallelamente e accanto la vena (Figura 4B) e lo smusso deve essere delicatamente inserito nel lumen della vena (Figura 4C). Posizionamento corretto sarà indicato dal sangue che appaiono lungo il catetere. Una volta che l'ago sia retratto il catetere deve essere stabilizzato con un filo legato su di essa e la pressione sanguigna costringerà sangue fino attraverso il catetere. È consigliabile che il catetere essere collegato al tubo della pompa prima di sangue si riversa (Figura 4D). Una volta collegato il tubo della pompa, immediatamente tagliare un vaso sanguigno principale come la vena cava o dell'aorta centrifugalis per drenaggio del sangue/liquido (Figura 5A). È solitamente necessario tagliare il lato della parete addominale del mouse per drenaggio sufficiente, come un accumulo di sangue nell'addome rende difficile visualizzare il processo di aspersione e sangue può continui nella purificazione delle cellule (Figura 5 B). una volta che il PBS comincia a irrorare il fegato, il fegato sarà scottate con l'assenza di sangue (Figura 5C). Se solo alcuni dei lobi blanch, la causa più probabile è che il catetere è stato inserito troppo lontano all'interno del fegato e avrà bisogno di essere tirata indietro lentamente. Una volta che il posizionamento del catetere è confermato, è possibile utilizzare nastro adesivo resistente all'acqua per proteggere il tubo in luogo. Laboratorio generale nastro non è solitamente sufficiente. Per confermare il corretto posizionamento del catetere, spremere il taglio vaso sanguigno per cessare di drenaggio e osservare l'aumento della pressione all'interno del fegato. Questo sarà di aiuto nel lavaggio del sangue dal fegato(Figura 5). Questo dovrebbe essere fatto anche quando la soluzione di collagenasi inizialmente va nel fegato per garantire che tutti i lobi sono esposti a collagenosi. Dopo la collagenosi soluzione SCADA, una digestione della collagenosi buona è indicativa di separazione della capsula di Glisson dal parenchima.
La procedura generale per purificazione cellulare è descritta nella Figura 6 e Figura 7 in cui gli epatociti sono raccolti all'inizio della procedura durante la bassa velocità giri e sono molto puro dopo 4 lavaggi nei buffer contenente BSA (Figura 8 ). Secondi sono co-purificati con KCs su una pendenza PVP (Figura 9A) e poi separati da adesione selettiva su un polistirene rivestite con collagene di Petri. La purezza di SECs utilizzando questo metodo è puro di 83-90% e dipende in gran parte l'efficacia complessiva della digestione della collagenosi (Figura 9B). Misurazioni quantitative utilizzando luce microscopia (come gli epatociti ed in sec hanno caratteristiche distintive da altre cellule) dimostrano che in una preparazione rappresentativa, gli epatociti sono quasi il 100% di puro e SECs sono appena oltre 89% puro (tabella 1). In alternativa, un maggiore arricchimento di SECs può essere ottenuto tramite la separazione magnetica colonna dopo la sfumatura PVP, sebbene che esula dall'ambito del presente protocollo. Ulteriori informazioni su separazione magnetica di SECs e KCs possono essere trovati in Meyer et al. 9 e Liu et al. 14 va ricordato che vitalità degli epatociti diminuisce rapidamente in un fegato insufficientemente digerito, ma questo non è necessario true per la NPC. fegati insufficientemente digeriti anche producono detriti più cellulari, che non sono del tutto eliminata la procedura di centrifugazione.
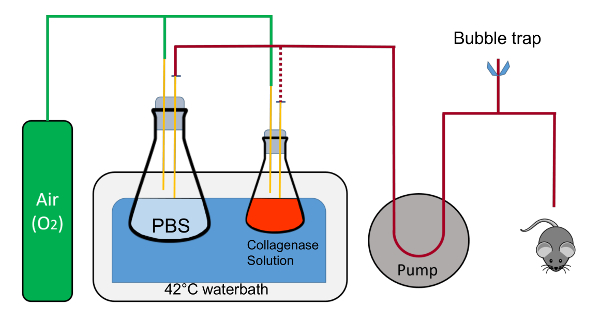
Figura 1 : Rappresentazione schematica della suite aspersione. Le beute sono tenute in posizione da morsetti (non mostrati); i tubi contenente fluido viene scambiato dalla beuta 1l al pallone da 125 mL durante la procedura sono rappresentato dalla linea tratteggiata rossa. Nota, che alimentano l'ossigeno non bolla direttamente nelle soluzioni in beute. I tappi dovrebbero anche essere conquistati per consentire il flusso di un fluido a circuito chiuso con il tubo inserito all'interno della tacca. Questo è fondamentale durante il riscaldamento del tubo e per l'espulsione di tutta l'aria all'interno del tubo. Lo spurgo dell'aria è composto di connettore a T che è collegato alla tubazione di Tygon e pizzico morsetti per rapida aprire e chiusura del sistema. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : La suite di aspersione durante l'aspersione del fegato del mouse. Il vassoio con il mouse è posizionato all'angolo del bagno d'acqua. L'ossigeno viene disconnesso dalla soluzione della collagenosi come che era già ossigenato durante il warm-up. Posizione degli elementi sono A) ossigeno linee, L B) 1 pallone contenente PBS, pallone da C) 125 mL contenente tampone 2 con collagenasi, D) pompa, controlli E) pompa, gorgogliatore F), G) fluido linea in esecuzione dalla beuta, attraverso la pompa e il mouse. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Immagine del sistema vascolare dell'addome mouse. Inserimento del catetere dovrebbe essere appena sotto le giunzioni di vena gastriche e pancreatiche venuta fuori vena portale (puntino verde) e la punta deve essere posizionata vicino l'epatiche di destra e sinistra vene portali (pallino giallo) che forma una forchetta nei lobi principali del fegato. Una volta acquisito il corretto posizionamento, il catetere deve essere stabilizzato con thread utilizzando un semplice nodo alla marinara. K = rene, L = fegato, SI = piccolo intestino. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Posizionamento del catetere nella vena portale. (A) le pinze sono utilizzate per assicurare ingorgo di sangue della vena portale e di raddrizzare la vena per il posizionamento del catetere. (B) il catetere è schierato in parallelo con la vena portale con lo smusso. (C), la smussatura dell'ago all'interno del catetere è inserito nella vena, non attraverso la vena. (D), l'ago del catetere è retratto e sangue saranno riflusso attraverso il catetere come indicato dalla punta della pinza. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Adeguata perfusione epatica. (A) dopo il posizionamento del catetere, l'estremità femmina Luer del catetere si connette l'estremità Luer maschio (tagliato da una siringa da 1 mL) della tubazione della pompa. (B) dopo il taglio, uno dei principali vasi sanguigni discendenti, sangue e PBS vengono drenati dall'addome mediante tranciatura sul lato del mouse con le forbici. (C) il fegato dovrebbe scottare mentre il sangue è risciacquato e (D) si gonfiano quando sotto pressione di spremitura chiusa il taglio vaso sanguigno con il forcipe. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 : Struttura schematica di NPC isolamento e purificazione degli epatociti. La maggior parte delle fasi di centrifugazione mirano a rimuovere gli epatociti vivi e morti dalle cellule non parenchimali. Clicca qui per visualizzare una versione più grande di questa figura.
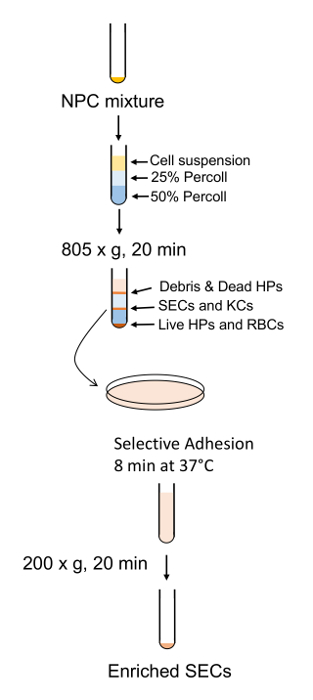
Figura 7 : Struttura schematica di SEC arricchimento e purificazione. Gli NPC sono separati dal gradiente PVP seguito dalla separazione SEC da breve adesione a una lastra di polistirene standard. Clicca qui per visualizzare una versione più grande di questa figura.
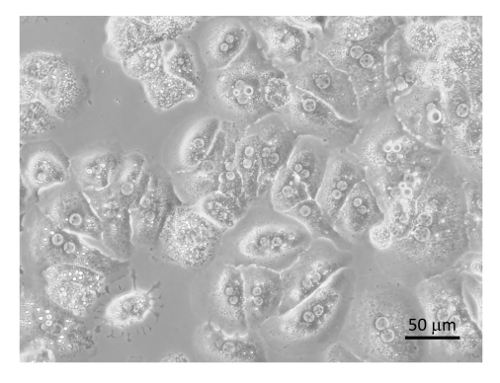
Figura 8 : Purificato epatociti. Epatociti erano placcati sulle piastre di coltura del tessuto collagene rivestito con DMEM + 8% FBS + Pen/Strep e incubati per 6 h seguita da collezione di immagini da un microscopio a 400 X. Bar è uguale a 20 µm. Clicca qui per visualizzare una versione più grande di questa figura.
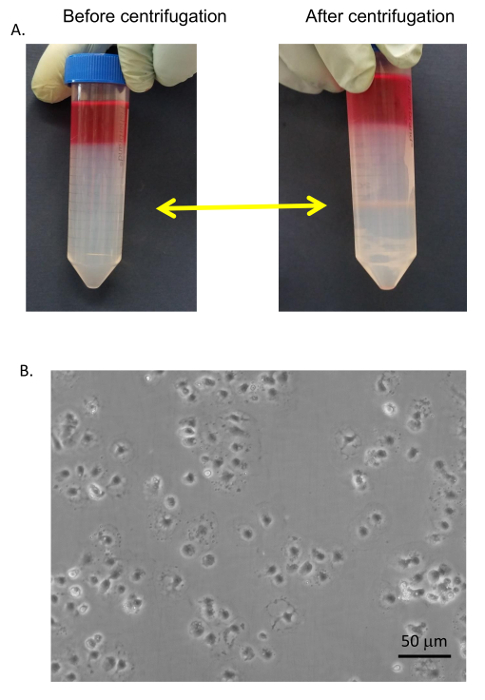
Figura 9 : Purificazione SEC. (A) SECs e KCs sono stati raccolti dall'interfaccia PVP 25/50% (frecce gialle) e lavato con medium senza siero. (B) The SECs erano adesione selettiva su standard di Petri che separa la KCs, lavato e placcato su piastre di coltura di tessuto collagene-rivestito in RPMI + 5% FBS. Immagini sono state scattate da un microscopio invertito EVOS a 400 X. Bar è uguale a 20 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 10 : La microscopia dell'anatomia del fegato del mouse. Un fegato di topo è stato irrorato con PBS seguita da fissativo (100 mM sodio cacodilato, 12 mL 25% di glutaraldeide, paraformaldeide 16% 15,6 mL, cloruro di calcio 2.65 mM, 180,2 mM saccarosio, mescolati in 100 mL di soluzione) ad un tasso di 1 mL/min per un minimo di 4 tessuti sono stati tagliati e preparati per la microscopia elettronica a scansione. Immagini sono state raccolte su un Field Emission SEM a 10, 000 X. Frecce gialle indicano i microvilli tra gli epatociti. Bar è uguale a 5 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 11 : Visualizzazione dei morti contro epatociti live. Dopo 2 lavaggi con tampone 1, pellettati epatociti possono essere valutati per live/dead rapporto dall'occhio. Un pellet più leggero (a sinistra) indica che almeno la metà degli epatociti sono morti. Il pellet più scuro sulla destra è pellettato più saldamente alla parte inferiore del tubo ed è più del 90% dal vivo. Clicca qui per visualizzare una versione più grande di questa figura.
| Tabella 1: Purificazione di cella | ||
| Tipo di cella | % cellule bersaglio | % altre cellule |
| Epatociti | 99 | 1 |
| Cellule endoteliali Sinsusoidal | 89.1 | 10,9 |
Tabella 1: Valutazione della purezza delle cellule da microscopia chiara.
Discussione
Questo protocollo mette in evidenza gli strumenti che sono disponibili e che offrirà all'utente un alto tasso di successo in questa procedura. Un'aspersione di successo è fondamentale per qualsiasi applicazione a valle quando si lavora con le cellule primarie.
Ci sono alcuni punti critici della procedura che determinano il successo. In primo luogo, il posizionamento della punta del catetere all'interno della vena portale deve essere corretto. Se posizionata troppo lontano all'interno del fegato, solo i lobi secondari saranno perfusi. Il suggerimento dovrebbe essere appena sotto i rami di destro e di sinistro della vena portale. Il vantaggio di utilizzare un catetere di polimero composito sopra un ago è che la sbavatura dell'ago è più probabile strappare la vena durante la perfusione di un catetere. In secondo luogo, quantità e la qualità della collagenosi determinare l'efficienza di digestione del fegato. In questa procedura, è stato utilizzato pre-qualificati collagenasi tipo 4 e si è risospeso a 0,5 mg/mL in tampone 2 se l'attività della collagenosi deve essere analizzato è maggiore di 900 UI.
Alla fine della perfusione della collagenosi, il fegato deve mantenere un'abbronzatura un po' scura a colore marrone. Se è un colore marrone chiaro, la maggior parte degli epatociti sono morta. Il fegato dovrebbe essere cade a pezzi quando tagliato dal mouse. Nelle migliori condizioni, il fegato può essere scavato fuori della cavità di corpo del mouse con un piccolo cucchiaio. Fegati in questa condizione sempre dare vitalità cellulare molto alta. Se ci vuole molto sforzo per scuotere le cellule a parte, se il fegato è ancora fermo durante l'estrazione, o se c'è un sacco di forza necessaria per spostare gli epatociti attraverso i filtri, gli epatociti avrà una redditività inferiore. Gli epatociti sono coperti con i microvilli, che permette loro di avere una superficie molto alta (Figura 10). Digestione incompleta conserva giunzioni della cellula-cellula tra epatociti e tosatura meccanica sarà lacerare la membrana plasmatica. Aspersione in situ con collagenasi è il metodo migliore per spezzare le cellule e mantenere alta redditività. Nella Figura 11, due dell'epatocita preparazioni sono fatte in quale cella pellet sono stati confrontati dopo alcuni lavaggi in tampone 1. Il pellet a sinistra è più leggero e contiene una vitalità cellulare del 50% circa. Il pellet a destra è più scuro e ha una vitalità del 92%. Allo stesso modo, quando il liquido è versato da 50 mL conica, il pellet più scuro è fermo all'interno del tubo, in contrasto con il pellet più leggero, che farà scorrere nel tubo come il liquido è versato fuori. La vitalità cellulare inferiore o le aspersioni inefficiente possono verificarsi quando il fegato ha livelli elevati di sclerosi.
Poiché gli epatociti dal vivo hanno una densità maggiore rispetto gli epatociti morti, le procedure di centrifugazione si tradurrà in una preparazione che è altamente pura in epatociti vitali15. Se c'è una quantità significativa di epatociti morti (che spesso si verifica quando le condizioni non ottimali), dal vivo cellule possono essere ulteriormente arricchite e separate dalle cellule morte utilizzando sfumature PVP. Inoltre, poiché gli epatociti dal vivo a pellet più veloce di epatociti morti, aspirazione del top 3rd del pellet aumenterà anche il rapporto di diretta per le cellule morte nel pellet. Queste procedure sono veloci e semplici metodi per separare vivono dagli epatociti morti e detriti quando necessario di cella10,16. Questo è particolarmente utile se il campione è prezioso, e solo poche milioni cellule sono necessari per l'esperimento.
In conclusione, questo è un metodo facile ed efficiente per la raccolta di epatociti e SECs dal fegato. A prezzi correnti, il costo di esecuzione di questa procedura compreso tutti i reagenti e prodotti monouso è inferiore ai 75 USD a preparazione. Se più mouse sono desiderati, si consiglia di procedere con la purificazione dell'epatocita e mantenere la frazione NPC su ghiaccio fino a quando tutti i topi sono stati elaborati. I PNG sono in genere stabili sul ghiaccio per almeno 5 ore, ma tempi più lunghi non sono stati testati in questo laboratorio.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Finanziamento è fornito in parte dal NIH da grant R01HL130864.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 L Erlenmeyer flask | Fisher Scientific | S63274 | |
| 250 mL Erlenmeyer flask | Fisher Scientific | S63271 | |
| silicone tubing | Cole-Parmer | 96400-14 | This tubing runs from the flasks through the pump to the T connector and then to the 1.0 mL syringe that is connected to the catheter. |
| Tygon tubing | Fisher Scientific | R3603 | Used as an adaptor between 96400-14 and pipettes and T connector. This may also be used for the oxygen tubing. |
| T-connectors | Cole-Parmer | EW-06294-82 | |
| Quick dissconnects | Fisher Scientific | 6150-0010 | |
| Pinch Clamps | Fisher Scientific | 6165-0002 | |
| Masterflex L/S Variable speed Pump, model 7553-70 | Cole-Parmer | EW-07559-00 | Periplastic pump with variable speed |
| Pump head, model 7014-20 | Cole-Parmer | EW-07014-20 | |
| glass graduated 1.0 mL pipettes | Fisher Scientific | 13-678 | |
| curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Dumont forceps | Fine Science Tools | 11252-20 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| 10 mL syringe | Fisher Scientific | 03-377-23 | Only barrel of syringe will be needed |
| sterlized spoon | Home supply store | ||
| Cotton ball(s) | Home supply store | ||
| Polyester sewing thread | Home supply store | ||
| Masking tape | Home supply store | ||
| thumb tacks | Home supply store | ||
| styrofoam pad | 50 mL conical rack | ||
| cookie/baking sheet | Home supply store | ||
| Absorbant underpads | Fisher Scientific | 14-206-64 | |
| 19 L water bath | Fisher Scientific | TSCOL19 | |
| BD Insyte Autogaurd Shielded IV Catheter 24 guage | Becton Dickinson | 381412 | Plastic cathetar with retractable needle |
| Crystallizing dishes 100x50 | VWR | 89000-290 | |
| Polystyrene petri dishes | Sigma Aldrich | P5481-500EA | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| graduated pipettes (5 mL) | Fisher Scientific | 170355 | |
| graduated pipettes (25 mL) | Fisher Scientific | 170357 | |
| EasyStrainer 100 μM | Greiner bio-one | 542000 | 100 μm filter |
| EasyStrainer 40 μM | Greiner bio-one | 542040 | 40μm filter |
| Sterile transfer pipettes | Fisher Scientific | 13-711-20 | |
| Refrigerated swinging bucket centrifuge | Sorvall Legend XTR | 75-217-406 | Centrifuge with swinging bucket rotar |
| Galaxy 170R tissue culture incubator | Eppendorf | CO170R-120-0000 | Humidified tissue culture incubator |
| Reagents | |||
| Name | Compound | Grams (g/L) | Millimolar (mM) |
| Buffer 1, pH 7.4 | NaCl | 8.3 | 142 |
| KCl | 0.5 | 6.7 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| Buffer 2, pH 7.4 | NaCl | 3.9 | 66.74 |
| KCl | 0.5 | 6.71 | |
| CaCl2 | 0.7 | 6.31 | |
| HEPES | 24 | 100 | |
| BSA | 15 | 0.226 | |
| Phenol Red | 0.01 | 0.03 | |
| Buffer 3, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.35 | 4.7 | |
| MgSO4 | 0.08 | 0.66 | |
| CaCl2 | 0.18 | 1.62 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| PBS, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.2 | 2.7 | |
| Na2HPO4-7H2O | 1.15 | 4.3 | |
| KH2PO4 | 0.2 | 1.4 | |
| Other reagents | |||
| Name | Company | Catalog Number | Comments |
| Percoll (PVP solution) | GE Healthcare | 288555 | |
| Collagenase Type IV | Sigma Aldrich | C5138 | |
| Isoflurane | Abcam | ab144581 | |
| Hepatocyte Growth Medium | |||
| DMEM | Gibco | 11965118 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Long-term Hepatocyte Growth Medium | |||
| DMEM | |||
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Glucagon | Sigma | G3157-2mg | 14 ng/mL |
| Insulin | Sigma | I9278-5mL | 0.5 U/mL |
| Hydrocortisone | Sigma | H0888-1g | 7.5 mg/mL |
| Epidermal Growth Factor | BD Biosciences | 354001-100ug | 20 ng/mL |
| LSEC medium | |||
| RPMI | Gibco | 11875119 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 |
Riferimenti
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods Cell Biol. 13, 29-83 (1976).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. J Exp Med. 94 (5), 431-453 (1951).
- Edstrom, S., Ekman, L., Ternell, M., Lundholm, K. Isolation of mouse liver cells: perfusion technique and metabolic evaluation. Eur Surg Res. 15 (2), 97-102 (1983).
- Meyer, J., Gonelle-Gispert, C., Morel, P., Buhler, L. Methods for Isolation and Purification of Murine Liver Sinusoidal Endothelial Cells: A Systematic Review. PLoS One. 11 (3), 0151945 (2016).
- Sies, H. The use of perfusion of liver and other organs for the study of microsomal electron-transport and cytochrome P-450 systems. Methods Enzymol. 52, 48-59 (1978).
- Smedsrod, B. Protocol for preparation of mouse liver Kupffer cells and liver sinusoidal endothelial cells. Munin open research archive. , 1-10 (2012).
- Smedsrod, B., Pertoft, H., Eggertsen, G., Sundstrom, C. Functional and morphological characterization of cultures of Kupffer cells and liver endothelial cells prepared by means of density separation in Percoll, and selective substrate adherence. Cell Tissue Res. 241 (3), 639-649 (1985).
- Meyer, J., Lacotte, S., Morel, P., Gonelle-Gispert, C., Buhler, L. An optimized method for mouse liver sinusoidal endothelial cell isolation. Exp Cell Res. 349 (2), 291-301 (2016).
- Kreamer, B. L., et al. Use of a low-speed, iso-density percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations. In Vitro Cell Dev Biol. 22 (4), 201-211 (1986).
- Meijer, D. K., Keulemans, K., Mulder, G. J. Isolated perfused rat liver technique. Methods Enzymol. 77, 81-94 (1981).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. J Vis Exp. (57), e3138 (2011).
- Cook, M. J. . The Anatomy of the Laboratory Mouse. , (1965).
- Liu, J., et al. Advanced Method for Isolation of Mouse Hepatocytes Liver Sinusoidal Endothelial Cells, and Kupffer Cells. Methods Mol Biol. 1540, 249-258 (2017).
- Knobeloch, D. E., Ehnert, S., Schyschka, L., Buchler, P., Schoenberg, M., Kleeff, J., Thasler, W. E., Nussler, N. C., Godoy, P., Hengstler, J., Nussler, A. K. Human Hepatocytes: Isolation, Culture, and Quality Procedures. Methods in Molecular Biology. 806, 99-120 (2012).
- Clarke, B. L., Weigel, P. H. Recycling of the asialoglycoprotein receptor in isolated rat hepatocytes. ATP depletion blocks receptor recycling but not a single round of endocytosis. J Biol Chem. 260 (1), 128-133 (1985).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon