Method Article
Radionuklid-Fluoreszenz-Reporter-Gen Imaging zu Tumorprogression in Nagetier Tumormodellen verfolgen
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Protokoll für die präklinische in Vivo Verfolgung von Krebsmetastasen. Es basiert auf einem Radionuklid-Fluoreszenz-Reporter Kombination von Natrium Iodid Symporter, entdeckt nichtinvasive [18F] Tetrafluoroborate-PET, und ein fluoreszierendes Protein für optimierte ex Vivo Bestätigung. Die Methode ist anwendbar für präklinische in Vivo Zelle tracking über Tumorbiologie.
Zusammenfassung
Metastasierung ist für die meisten Krebstodesfälle verantwortlich. Trotz der umfangreichen Forschung bleibt das mechanistische Verständnis der komplexen Prozesse für Metastasen unvollständig. In-Vivo -Modelle sind von größter Bedeutung für die Metastasierung Forschung, aber erfordern Raffinesse. Tracking-spontane Metastasen durch nicht-invasive in Vivo Bildgebung ist nun möglich, aber bleibt eine Herausforderung, da es langjährige Beobachtung und hohe Empfindlichkeit erfordert. Wir beschreiben ein längs kombinierte Radionuklid und Fluoreszenz Ganzkörper- in-Vivo imaging-Ansatz für die Verfolgung von Tumorprogression und spontane Metastasierung. Dieser Reporter-gen-Methodik beschäftigt die Natrium-Iodid Symporter (NIS) verschmolzen zu einem fluoreszierenden Protein (FP). Krebszellen sind stabil ausdrückliche NIS-FP gefolgt von Auswahl basierend auf Fluoreszenz-aktivierte Zellsortierung entwickelt. Mäuse sind entsprechende Tumormodellen gegründet. NIS-FP mit dem Ausdruck ihrer Krebszellen sind nicht-invasiv verfolgt in Vivo auf Ganzkörper-Ebene durch die Positronen-Emissions-Tomographie (PET) mit der NIS Radiotracer [18F] BF4–. PET ist derzeit das empfindlichste in Vivo imaging-Technologie in dieser Größenordnung zur Verfügung und ermöglicht die zuverlässige und absolute Quantifizierung. Aktuelle Methoden setzen auf großen Kohorten von Tieren, die zur Beurteilung der Metastasen zu unterschiedlichen Zeitpunkten eingeschläfert werden oder verlassen sich auf kaum quantifizierbaren 2D Bildgebung. Die Vorteile des beschriebenen Verfahrens sind: (i) hochsensiblen nichtinvasive in Vivo PET 3D-Bildgebung und Quantifizierung, (Ii), automatische PET-Tracer-Produktion, (Iii) eine signifikante Reduktion erforderlichen Tierzahlen durch bildgebende Wiederholungsoptionen, (iv). die Übernahme der gepaarten Daten aus nachfolgenden bildgebenden Sitzungen bietet bessere statistische Daten und (V) die intrinsische Option für ex-Vivo -Bestätigung der Krebszellen im Gewebe durch Fluoreszenzmikroskopie oder Zytometrie. In diesem Protokoll beschreiben wir alle Schritte, die erforderlich für routinemäßige NIS-FP-bot nicht-invasive in Vivo Krebs Zelle Tracking mit PET/CT und ex-Vivo Bestätigung der in-Vivo -Ergebnisse. Dieses Protokoll hat Anwendungen über Krebsforschung, wann immer in Vivo Lokalisation, Ausdehnung und langjähriger Überwachung einer Zellpopulation ist von Interesse.
Einleitung
Metastasen ist die Ursache für die meisten krebsbedingte Todesfälle 1. Trotz umfangreicher Forschung in metastatische Prozesse ist die zuverlässige Überwachung von Krebsmetastasen im Tiermodell Systeme schwer zu erreichen. Jüngste Fortschritte in Ganzkörper-imaging-Technologien und multimodale Bildgebung Ansätze konnten nicht-invasive in Vivo Zelle tracking-2,3,4,5. Letzteres kann als ein Werkzeug, um die Präsenz, Verteilung, Menge und Lebensfähigkeit der Zellen, nicht-invasiv zu überwachen und immer wieder in ein lebendes Tier oder ein Mensch verwendet werden.
Die hier beschriebene Methode soll längs und nicht-invasiv Krebszellen in 3D in lebende Nagetier Tumormodellen verfolgen. Mit dieser Methode werden Forscher Tumorprogression einschließlich Metastasierung in 3D genau quantifizieren können. Im Vergleich zu herkömmlichen nicht-Imaging-basierte Techniken, bietet diese Methode die Akquisition von quantitativen Daten mit weitgehend reduzierte Tierzahlen. Ein weiteres Merkmal dieser Methode ist, dass es Korrelation von in-Vivo Bildgebung mit optimierten nachgelagerten ex Vivo Analyse der nachverfolgten Zellen in geernteten Geweben durch Histologie oder Zytometrie3,6.
Die Gründe für die Entwicklung dieser Methode war ein in-Vivo -Tool für die Überwachung und Quantifizierung des gesamten metastasierendem Prozesses in Nagetier Tumormodellen. Wichtiger ist, wurde es entwickelt, um Tierversuche bei gleichzeitiger Reduzierung der Inter Tier Variabilität zu minimieren. Längs der nichtinvasiven Ganzkörper-Bildgebung eignet sich hervorragend auf metastasiertem Auswuchs, zu informieren, für welche per se es schwierig ist, genau vorherzusagen, Zeit und Ort ihres Auftretens. Ganzkörper-3D-Bildgebung wurde daher in der Mitte der Methodenentwicklung. Um die Skala Lückenschluss zwischen Ganzkörper- in-Vivo Bildgebung und Potenzial nachgeschalteter Ex Vivo histologische Bestätigung, eine Multi-Scale imaging ein Dual-Mode-Radionuklid-Fluoreszenz-Reporter Ansatz war angenommen3, 6.
Positronen-Emissions-Tomographie (PET) ist die empfindlichste 3D Ganzkörper-imaging-Technologie derzeit bietet hervorragende Eindringtiefe und absolute Quantifizierung7 mit einer Auflösung von < 1 mm8,9. Derzeit kann präklinische Zelle tracking auf der Ganzkörper-Ebene durch Radionuklid Bildgebung zuverlässig detektieren Zellen bei dichten ~ 1.000 Zellen pro Volumen von 1 Million Zellen3,6 mit Auflösungen im Sub-Millimeter-Bereich. Im Gegensatz zu intravitalen Mikroskopie einzelne Krebszellen Verbreitung nicht erkannt, aber es erfordert keine chirurgische Eingriffen (z. B. Fenster Kammern), beschränkt sich nicht auf ein kleines Sichtfeld und nicht durch niedrige Gewebe eindringen und streuen. Biolumineszenz-Bildgebung ist bietet eine kostengünstige Alternative aber zugeordneten Scatter und Lichtabsorption sowie schlechte Eindringtiefe und folglich in Quantifizierung2stark eingeschränkt. Fluoreszenz Ganzkörper-Bildgebung ist für den Erwerb von 3D-Bildern verwendet worden, aber es ist viel unempfindlicher gegenüber Biolumineszenz oder Radionuklid Technologien2. Dennoch, Fluoreszenz bietet die Möglichkeit, ex Vivo nachgelagerten Gewebeanalysen Zytometrie oder Mikroskopie durchzuführen. Letzteres schließt die Skala-Lücke zwischen makroskopischen Ganzkörper-Bildgebung (mm Auflösung) und Fluoreszenz mikroskopisch kleine Gewebe Analyse (µm Auflösung)3. Daher ergänzen Radionuklid und Fluoreszenz Modalitäten, von der ganz-Körper-Ebene bis hin zu den (Sub-) zellulären Skala.
Reporter-Gen Bildgebung eignet sich hervorragend für längere Zelle je nach Bedarf in der Metastasierung Forschung verfolgen. In dieser Anwendung es ist besser als direkte Zelle Kennzeichnung von Label-Verdünnung (i) nicht betroffen und somit unbegrenzt Zeiterfassung und live Zellzahlen (Ii) besser widerspiegelt. Infolgedessen ist Ganzkörper-Handy tracking-besonders nützlich für Anwendungen, in denen nachvollziehbare Zellen vermehren oder in Vivozu erweitern, zum Beispiel bei Krebs Forschung3,6, für den Nachweis von Teratom Bildung im Stamm Zell-Forschung, oder für die Quantifizierung der immunen Zellen-Erweiterung5.
Verschiedenen Radionuklid-basierte Reporter Gene sind vorhanden2. Dazu gehören Enzyme wie Herpes-Simplex-Virus HSV11 Thymidin-Kinase (HSV1 -Tk), Transporter wie z. B. der Natrium-Iodid-Symporter (NIS) oder die Noradrenalin-Transporter (NET) sowie Oberfläche Zellrezeptoren wie Dopamin D2-Rezeptor) D2R). NIS ist ein glykosylierten Trans-Membran-Protein, das Iodid-Aufnahme, z. B. in follikulären Zellen in der Schilddrüse für die anschließende Synthese von Schilddrüsenhormonen10aktiv vermittelt. Dieser Prozess wird durch die Symport Na+ angetrieben und stützt sich auf die zellulären Natrium-Gradienten, von Na+gepflegt werden/+k-ATPase11. Infolgedessen NIS besser widerspiegelt lebenden Zelle Zahlen als andere Journalisten wie Jodid/Radiotracer Aufnahme mit einer aktiven Na+zusammenhängt/k+ Gradienten, anstatt die bloße Anwesenheit des Transporters. Traditionsgemäß Radioiodide ist verwendet worden für die NIS-Bildgebung. Für Handy-Tracking berichteten alternative NIS Radiotracer, die in der Schilddrüse nicht metabolisch eingeschlossen sind überlegene6sein. Das vor kurzem entwickelt PET Radiotracer [18F] Tetrafluoroborate ([18F] BF4–)12,13 zeigt überlegene Pharmakokinetik im Vergleich zu Radioiodide6 während bei bestimmten Aktivitäten mit hohem14 ohne die Notwendigkeit einer komplexen Radiochemie Einrichtungen zur Verfügung. [18F] BF4– kann über zwei verschiedene Wege synthetisiert werden. Die erste Methode basiert auf Isotop Austausch von nicht-radioaktiven 19F BF4– mit radioaktiven 18F12. Die zweite Methode ist durch Zugabe von 18F, nicht radioaktiv Boron Trifluoride14. Die letztere Methode wurde berichtet, dass höhere spezifische Aktivitäten14 ergeben und ist die Methode der Wahl für die vorklinische Bildgebung.
NIS wird hoch in die Schilddrüse Geweben ausgedrückt. Es drückt sich auch in die Speicheldrüsen, Contactlinse und stillende Milchdrüsen sowie den Magen, sondern auf einem niedrigeren Niveau im Vergleich zu der Schilddrüse-10. Daher kann die hervorragenden Kontrast Bildgebung in anderen Körperregionen mit NIS erreicht werden. Es ist auch höchst homologe zwischen Mensch, Ratte und Maus-10. Darüber hinaus gibt es keine Berichte über Toxizität auf ektopische Expression von NIS in nicht-Schilddrüsenhor Zellen. Wichtig ist, wurde NIS auch nicht Host Immune Antworten, weder beim Menschen noch bei Nagetieren zugeordnet. NIS ein Reportergen diente als Promotor-Aktivität15,16,17 und gen Ausdruck18,19,20,21,22 messen ,23 in mehreren unterschiedlichen Kontexten. Es dient auch für die nicht-invasive Bildgebung Gen Therapie Vektoren24,25und Zellen in Herz4, hämatopoetischen26, Entzündung5und neuronale Studien27zu verfolgen. Vor kurzem hat NIS auch als ein Reportergen verwendet Krebs Metastasen in Vivo3,6verfolgen.
Zusammenfassend lässt sich sagen, sind die wesentlichen Vorteile dieser Methode gegenüber früheren Techniken: (i) hochsensiblen nichtinvasive 3D in Vivo Lokalisierung und Quantifizierung von metastasierendem verbreiten, (Ii) automatisierte Produktion von [18F] BF4– am Aktivitäten mit hohem Molaren, (Iii) einen erheblichen Rückgang der benötigten Tiere durch longitudinale Bildgebung, (iv) die Akquisition gepaarte Daten aus nachfolgenden bildgebenden Sitzungen verbesserte statistische Daten, wodurch die Verwendung von Tieren und (V) wiederum weiter reduziert die intrinsische Option für ex-Vivo -Bestätigung der Krebszellen im Gewebe durch Zytometrie oder Fluoreszenz-Mikroskopie.
Protokoll
Dieses Protokoll erfüllt alle Anforderungen, die vom Vereinigten Königreich (UK) Gesetzgebung und das lokale Ethical Review Panel. Wenn Sie dieses Protokoll folgen, sicherzustellen Sie, dass die Verfahren auch alle Anforderungen, die durch nationale Gesetze und lokale Ethical Review Panel diktiert entsprechen. Sicherzustellen Sie, dass jedes Experiment mit Radioaktivität Gesetzen und örtlichen Bestimmungen entsprechen und sicher durchgeführt.
(1) Engineering und Charakterisierung von Krebszellen, die Radionuklid-Fluoreszenz-Fusion-Reporter NIS-FP auszudrücken
Hinweis: Der Einfachheit halber wird mEGFP A206K als "GLP" und mCherry als "Ausschreibung" in den nachfolgenden Abschnitten dieses Protokolls abgekürzt.
- Generation von Lentivirale Partikel
- Um Lentivirus Teilchen erzeugen, Co transfizieren 293T Zellen mit den folgenden vier Plasmiden mit einer geeigneten Transfektion Methode: (i) das Reportergen Plasmid-Codierung (Pflanze SFFV NIS-GFP oder Pflanze SFFV NIS-RFP (siehe ergänzende Informationen), (Ii) die dritten Generation Lentivirale Verpackung Plasmide pRRE und (Iii) pRSV-Rev und (iv) ein Virus Umschlag mit Plasmid, zB, pMD2.G. Pre-Mix Plasmide vor Aufnahme in die Transfektion mischen. Führen Sie Transfektion in eine Zelle Kultur Kapuze.
Hinweis: Zusätzliche Transfektion in Zusatzinformationen Informationen. - Bewerten Sie Transfektion Erfolg nach 48 h, indem standard Weitfeld-Fluoreszenz-Mikroskopie mit Filter-Einstellungen für den gewählten Fusion-Reporter (NIS-GFP oder NIS-RFP) geeignet.
Hinweis: Fluoreszenz-Signale sind bezeichnend für Reporter-gen Transfektion und daher nur ein Surrogat für erfolgreiche Co-Transfektion, kein Indikator für erfolgreiche Virus Produktion. - Den Virus Partikel-haltigen überstand mit einer Spritze zu ernten und schwimmenden Zellen und Zellenrückstand durch Filterung durch einen 0,45 µm sterile Polyethersulfone (PES) Filter entfernen. Auf eine sterile 1,5 mL Polypropylen Reaktionsgefäß übertragen. Virus arbeiten in einer Zelle Kultur Kapuze und sicherzustellen, dass keine live-Virus enthaltene Umwelt hinterlässt.
- Um Lentivirus Teilchen erzeugen, Co transfizieren 293T Zellen mit den folgenden vier Plasmiden mit einer geeigneten Transfektion Methode: (i) das Reportergen Plasmid-Codierung (Pflanze SFFV NIS-GFP oder Pflanze SFFV NIS-RFP (siehe ergänzende Informationen), (Ii) die dritten Generation Lentivirale Verpackung Plasmide pRRE und (Iii) pRSV-Rev und (iv) ein Virus Umschlag mit Plasmid, zB, pMD2.G. Pre-Mix Plasmide vor Aufnahme in die Transfektion mischen. Führen Sie Transfektion in eine Zelle Kultur Kapuze.
- Transduktion und Auswahl der NIS-FP mit dem Ausdruck ihrer Krebs-Zelllinien
- Reine frische Virus aus Schritt 1.1.3 gemischt 1:1 (V/V) mit der optimalen Wachstumsmedium von jeder Krebs-Zell-Linie (DMEM für MDA-MB-231 Zellen und RPMI 1640 für 4T1 Zellen; siehe Materialtabelle für Medienkomposition) verwenden. Transduktion in eine Zelle Kultur Kapuze ausführen.
Hinweis: Ein allgemeiner Protokoll bezeichnet man in Zusatzinformationen. - Transduzieren Krebszellen mit Virus-haltige Mittel in einem Inkubator mit feuchte Atmosphäre mit 5 % (V/V) CO2 bei 37 ° C für 72 h (Arbeit auf 6-Well oder 12-Well Skala mit 1 mL oder 0,4 mL der Virus Mischung aus Schritt 1.2.1).
- Überwachen Sie Zelle NIS-FP Zielausdruck durch Fluoreszenz-Mikroskopie.
- Erweitern Sie erfolgreich ausgestrahlt Zellen auf einer Skala von 3 Millionen Zellen, die unter Verwendung von standard-Kulturbedingungen (siehe ATCC für MDA-MB-231 und 4T1-Zell-Linien).
- Verwenden Sie Fluoreszenz-aktivierte Zelle sortieren (FACS) NIS-FP mit dem Ausdruck ihrer Zellen aus Zellen nicht ausgestrahlt zu reinigen.
Bemerkung: FACS kann eine Quelle von Mykoplasmen-Infektionen; Es wird empfohlen, für Mykoplasmen vor Virus-Produktion und Transduktion sondern auch nach FACS und vor Schritt 1.3 zu überprüfen.
- Reine frische Virus aus Schritt 1.1.3 gemischt 1:1 (V/V) mit der optimalen Wachstumsmedium von jeder Krebs-Zell-Linie (DMEM für MDA-MB-231 Zellen und RPMI 1640 für 4T1 Zellen; siehe Materialtabelle für Medienkomposition) verwenden. Transduktion in eine Zelle Kultur Kapuze ausführen.
- Charakterisierung NIS-FP mit dem Ausdruck ihrer Krebszelllinien
- Bestätigen Sie Reporter Ausdruck von standard Durchflusszytometrie als28an anderer Stelle beschrieben.
- Bestätigen Sie Reporter Integrität durch standard Immunoblotting wie beschrieben an anderer Stelle29.
- Intrazelluläre Fusion Reporter Lokalisierung durch konfokale Fluoreszenzmikroskopie zu analysieren.
Hinweis: Mit beflecken oder Co Ausdruck einer Plasmamembran Markierung6 und anschließende Co Lokalisierung Analyse30 erleichtert diesen Schritt. - Analysieren Sie Radiotracer Aufnahme in NIS-FP mit dem Ausdruck ihrer Zell-Linien.
Hinweis: Radioaktiven NIS Substrat kompatibel mit bestehenden Anlagen eignet, z. B. die Jodid-Isotope (123ich-, 124ich-, 125ich-, 131ich–), 99 m TcO4-, 188ReO4-, [18F] SO3F– oder [18F] BF4–.- Samen 106 Zellen in 6-Well-Platten in ihrer optimalen Wachstumsmedium gereinigt (siehe Tabelle der Materialien) eines Tages vor dem Experiment. Alle Proben in dreifacher Ausfertigung vorbereiten und Kontrollproben enthalten: (i) "Spezifität Steuerelemente", d. h. NIS-FP mit dem Ausdruck ihrer Zellen inkubiert vorab mit einem wettbewerbsfähigen NIS Substrat testen Sie Aufnahme Spezifität; (Ii) "elterliche Zelle Kontrollen", d.h. die Zellen nicht auszudrücken NIS-FP aber empfangen Radiotracer um basale Aufnahme im elterlichen Zellen zu testen.
- Am nächsten Morgen waschen Sie Zellen einmal mit serumfreien Wachstumsmedium.
- Inkubieren Sie die Zellen in serumfreien Wachstumsmedium in Anwesenheit von 50 kBq 99 mTcO4– oder [18F] BF4– für 30 min bei 37 ° C (1 mL Gesamtvolumen). Für Spezifität Steuerelemente, vorab inkubieren Sie die Zellen für 30 min mit dem Wettbewerb Substrat NaClO4– (12,5 µM Endkonzentration). Die wettbewerbsfähigen Substratkonzentration während des Experiments konstant zu halten.
- Den Überstand zu sammeln und 100 µL auf eine vorbereitete Sammelröhrchen mit der Bezeichnung "überstand" übertragen.
- Waschen Sie die Zellen zweimal mit 1 mL eiskaltes Phosphat-gepufferte Kochsalzlösung (PBS) mit Ca2 +/Mg2 +. Sammeln Sie jedes Waschlösung und übertragen Sie 100 µL der einzelnen in eine vorbereitete Sammelröhrchen mit der Aufschrift "wash1" oder "wash2", bzw. zu.
- Heben Sie die Zellen durch Zugabe von 500 µL PBS mit 0,25 % (w/V) Trypsin und 0,53 mM EDTA und Inkubation bei 37 ° C, bis die Zellen trennen (überprüfen Sie visuell mit einem Mikroskop). Übertragen Sie die Aufhängung in eine vorbereitete Sammelröhrchen mit der Bezeichnung "Zellen". Waschen Sie die Brunnen mit 500 µL eiskaltem PBS mit Ca2 +/Mg2 + und das Rohr "Zellen" hinzufügen. Pellet-Zellen durch Zentrifugation (250 x g, 4 min, 4 ° C).
- Anzahl der alle vier Probentypen aus jeder gut mit einem Gamma entsprechend Zähler gesetzt für das Radioisotop Wahl (hier: 99 mTc oder 18F).
Hinweis: Aufgrund der großen Anzahl von Proben in diesem Assay empfiehlt es einen automatisierte γ-Zähler in der Lage, automatische Zerfall Korrektur verwenden. - Analysieren von Daten durch Addition erhaltene Gamma Grafen von Proben aus jedem Brunnen einen Radioaktivität Zähler pro Bohrloch zu bestimmen.
: Beachten Aliquotierung in Schritten 1.3.4.4 und 1.3.4.5 Berücksichtigung von multiplizierenden Zahlen für "überstand" und "waschen" Brüche durch 10. - Drücken Sie zellulare Radiotracer Aufnahme % Aufnahme wie in Equ.1 angegeben. Mittelwerte und Standardabweichungen von dreifacher Experimente zu berechnen.
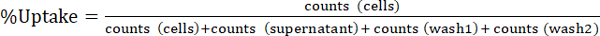 (Equ.1)
(Equ.1)
Hinweis: Hier werden Reporter Validierung Experimente beschrieben, aber nicht-Reporter-bezogenen Zellfunktionen (z.B. Verbreitung, Krebs Zellinvasion, Genexpression etc.) sind letztlich Anwendungs- und die Verantwortung jedes Benutzers.
2. Schaffung von in Vivo Tumor-Modelle
- Verwenden Sie nur vollständig charakterisiert und Zellen für in Vivo Experimenten validiert. Fluoreszenz von Zellen vor der Verabreichung bei jeder Gelegenheit durch eine geeignete Technik (z.B. Fluoreszenz-Mikroskopie, Durchflusszytometrie) überprüfen.
- Das Tumor-Modell in ca. 5-6 Wochen alten jungen Erwachsenen weiblichen Mäusen zu etablieren. Für das 4T1-Tumor-Modell und NOD BALB/cAnNCrl oder Mäusen BALB/cAnN.Cg-Foxn1-Nu (BALB/c nackt) verwenden. CG-Prkdcscid Il2rgtm1WjI/SzJ (NSG) Mäuse für das MDA-MB-231-basierte Tumor-Modell. Tiere vor Ort zu rasieren und aseptische Technik verwenden. Direkt injizieren 50 µL einer Suspension mit 106 NIS-FP mit dem Ausdruck ihrer Krebs Zellen/mL in der Mamma Fettpolster zwischen dem vierten und fünften Nippel31.
Hinweis: Um Injektion Genauigkeit zu verbessern, empfiehlt es die Injektion unter Vollnarkose mit Hilfe eines inhalierbaren Betäubung wie Isofluran (1-2 % (V/V) in O2) durchführen.
Hinweis: Chirurgische Implantation von Tumor-Stücke von NIS-FP mit dem Ausdruck ihrer Tumoren ist ein alternativer Ansatz zur Tumor-Modell-Einrichtung-31. - Fluoreszenz von Zellen an Injektionsstellen nach Verabreichung und in den frühen Tagen Post Injektion zu überprüfen. Benutzen Sie eine Fluoreszenz Lampe und Filter Brille geeignet für die FP Wahl.
- Tumorwachstum und prüfen, ob klinischen Symptome (besonders zu späteren Zeitpunkten) zu überwachen.
Hinweis: Bei oberflächlichen Tumoren, d. h. der orthotopen Brust-Tumoren in diesem Protokoll, Verwendung Bremssättel und die Formel für die mittlere Tumor Durchmesser (MTD) = ½· (L + W) 32.
3. Herstellung von [18 F] BF 4– mit Hilfe einer automatisierten Radiotracer Synthese (ARS) Plattform.
Hinweis: Hier wird die automatisierte [18F] BF4– Synthese basiert auf der Methode von 18F neben Boron Trifluoride beschrieben. Benutzer einer zugänglicher ARS-Plattform (siehe Tabelle der Materialien), können die entsprechenden Extensible Markup Language (XML) Datei benötigt der automatisierte Ablauf auf dieser Plattform (ergänzende Datei) herunterladen. Eine ausführliche Erläuterung des in Abbildung 1 dargestellte Kassette Layouts hat (Tabelle 1) sowie eine detaillierte Beschreibung der einzelnen Schritte in der XML-Sequenz Datei (Tabelle 2), Übersetzung in andere automatisierte Plattform zu unterstützen.
- Die ARS-Plattform eingerichtet, wie in Tabelle 1 beschrieben und sicherzustellen, dass es funktioniert mit der richtigen XML-Datei auf den Rechner geladen. Sicherstellen Sie, dass die ARS-Plattform in eine chemische Kapuze geeignet für sicheres Arbeiten mit GBq Mengen an radioaktiver Strahlung befindet.
- Aspirieren das Zyklotron hergestellt [18F] F– (in der Regel 1,5-2 GBq 2-7 mL [18O] H2O) über den Einlass-Stausee (V6).
- Falle der Radioaktivität auf ein Anion Austausch Harz (z. B. quartäre Ammonium Anion Austausch Patrone; V5, V4), wiederherstellen [18O] H2O in einer separaten Durchstechflasche (V1).
- Eluieren [18F] F– (reverse Elution, V5, V4) in den Reaktor (V8) mit 750 µL Kochsalzlösung 0,9 % (w/V) (V2), gefolgt von 1,5 mL Acetonitril (V16).
- Entfernen Sie das Wasser durch azeotrope Verdampfung unter Vakuum und Stickstoff fließen durch Erhitzen bei 105 ° C und 120 ° C für 5 Minuten.
- Reduzieren Sie die Reaktortemperatur auf 80 ° C.
- Fügen Sie 800 µL 15-Krone-5 in wasserfreien Acetonitril (46 mg, 0,21 Mmol) zu den trockenen [18F] F– durch den zentralen Hafen des Reaktors (V8).
- Fügen Sie 850 µL BF-3. OEt2 in wasserfreien Acetonitril (0,16 mg, 1.13 µmol) in den Reaktor.
- Für 5 min während der Rückkehr zur Raumtemperatur reagieren.
- Übergeben Sie das Reaktionsgemisch durch eine Aluminiumoxid-Patrone (V17, V18) um die Trifluoroborate zu fangen.
- Das Reaktionsgemisch zu Spritze S2 zurückkehren und verdünnen mit Wasser (ca. 1,6 mL).
- Übergeben Sie das Reaktionsgemisch durch eine zweite Anion-Austausch-Patrone (V19, V20) [18F] BF4– Produkt auffangen.
- Waschen Sie den Reaktor mit Wasser (ca. 5,5 mL).
- Passieren Sie die resultierende Lösung durch die Tonerde und die zweite Anion Austausch Patronen.
- Spülen Sie S2 und S3 Spritzen mit Wasser.
- Waschen Sie die zweite Anion-Austausch-Patrone mit Wasser und trocknen Sie ihn mit Stickstoffgas.
- Das Produkt eluieren (V19, V20) mit 1 mL 0,9 % NaCl (V14) in Spritze S3.
- Das Produkt (400-500 µL) auf eine 1 mL Glasflasche Sammlung über die Auslassleitung (V21) übertragen.
Hinweis: Molare Aktivität ist ein wichtiger Bestandteil jeder Radiotracer. Die routinemäßige Bestimmung ist nicht nur zeitaufwendig aber erfordert auch erhebliche Mengen an frisch synthetisierte [18F] BF4-, so wird es ein limitierender Faktor für die Anzahl der Tiere, die abgebildet werden können. Reproduzierbarkeit und molare Aktivitäten der resultierenden [18F] testen BF4–, es empfiehlt sich, ein paar engagierte Testläufe für diesen Zweck zu planen. Finden Sie für mehr Details über molare Aktivitäten in Abschnitt Diskussion.
4. in-Vivo Bildgebung der NIS-FP Ausdruck Zellen durch NanoPET/CT
- Tierische Vorbereitung
- Mäuse mit 1,5-2,0 % (V/V) Isofluran in O2 mit einer Durchflussrate von 1,0-1,5 L/min in einer Induktion Kammer zu betäuben. Für ausreichende Anästhesie-Look für Abwesenheit der Reflex-Pedal zu überprüfen.
- Stellen Sie sicher zum Tierarzt Salbe anwenden auf Tieraugen Trockenheit während der Narkose zu verhindern
- Bewegen Sie die Maus auf ein Heizkissen mit der Nase in einer Narkose Versorgung-Maske und warm das Heck (z. B. durch Eintauchen in Wasser von 37 ° C oder über eine Infrarot-Lampe).
- Verdünnen Sie die frisch zubereiteten steril gefiltert [18F] BF4– Lösung 5 MBq pro 50 µL mit steriler Kochsalzlösung 0,9 %.
- Mit einer Injektionsnadel (Spurweite 29-31) verbunden mit einer Spritze, 100 µL [18F] BF4– Lösung zeichnen, messen die Radioaktivität in der Spritze und notieren Sie den Wert und die Uhrzeit der Messung.
- Intravenös verabreichen Sie 50 µL der Lösung [18F] BF4– in die vorgewärmte Schweif Vene.
- Messen Sie die verbleibenden Radioaktivität in der Spritze zu und notieren Sie den Wert und die Uhrzeit der Messung. Der Unterschied zwischen Schritte 4.1.7 und 4.1.5 gemessenen Werte ist die injizierte Dosis (ID).
- Stellen Sie einen Timer Countdown von 45 min (Startzeit der PET-Bildgebung = 0 min).
- Platzieren Sie den Mauszeiger auf das Bett des NanoPET/CT-Scanners und sicherzustellen Sie, dass die Narkose wieder richtig befestigt ist.
- Check Anästhesie bleibt durch die Prüfung für das Fehlen der Reflex-Pedal komplett.
- Gewährleisten die Maus befindet sich auf dem Bett in der gewünschten Weise, z. B. die "Sphinx"-wie Position.
- Installieren Sie Tier-monitoring-Geräte gemäß den Empfehlungen des Herstellers, z. B. eine rektale Temperatur-Sonde, eine Sonde, Tier Atmung oder für die Aufzeichnung von EKG Elektroden zu messen. Überprüfen Sie die ordnungsgemäße Funktion aller Instrumente.
Hinweis: Für in-vivo Spezifität Tests mit dem NIS Radiotracer [18F] BF4–, Tiere sind abgebildet, wie oben beschrieben, und ruhte dann wach, bis die Radioaktivität ausreichend abgeklungen ist, um als vernachlässigbar angesehen werden z.B. 48 h später als einzige 1.3·10−6 % restliche 18F Radioaktivität wird in das Tier vorhanden sein. In der anschließenden Bildbearbeitung Sitzung wettbewerbsfähige Substrat ClO4– wird in einer Dosis von 200 mg/kg 30 min vor Radiotracer Verwaltung verwaltet und Bildgebung erfolgt wie oben beschrieben.
- Bildgebung von NanoPET/CT
- Legen Sie die gewünschten CT imaging Parameter, z. B. mit der NanoPET/CT 55 kVp Röhrenspannung, setzen Sie die Belichtungszeit auf 1200 ms mit ein Grad Winkel treten und 180-Grad-Projektionen.
- Legen Sie die Parameter für die PET-Bildaufnahme. Verwendung statischen scan-PET-Parameter mit einer Dauer von 30 min, 1:5-Zufall-Modus und 400-600 KeVp Energie Fenster.
- Bei Countdown-Zeit = 15 min Start CT Bildaufnahme.
- Bei Countdown-Zeit = 0 min Start PET Bildaufnahme.
- Wenn serielle Tier Bildgebung erholen benötigt, lassen Sie Tiere vollständig aus der Narkose, d.h. wieder Bewusstsein unter Aufsicht. Anschließend übertragen Sie sie auf eine Wartungseinheit.
- Ist dies das Terminal Sitzung imaging, fahren Sie mit tierischen Euthanasie durch entweder Narkose Überdosierung, steigende Konzentration von Kohlendioxid oder Dislokation des Halses.
5. in-Vivo -Daten-Analyse
- Die PET/CT-Daten mit Hilfe eines Monte-Carlo-basierten 3D iterativen Algorithmus zu rekonstruieren. Stellen Sie sicher, dass Korrekturen für Dämpfung, Totzeit und Radioisotopen Verfall in Betracht gezogen werden. Siehe die Anweisungen des Herstellers der das PET/CT-Gerät im Einsatz.
- Check-CT und PET Bilder Co korrekt registriert sind und sichern Sie die Daten in einer geeigneten Exchange-Format wie "Digital Imaging and Communications in Medicine" (DICOM).
- Analysieren von Bildern
- Laden Sie die rekonstruierten DICOM-Dateien in eine geeignete Bildanalyse-Software, die die Anerkennung und die Abgrenzung der Regionen von Interesse (ROIs) und anschließende PET Signal Quantifizierung in diese ROIs ermöglicht.
- Segment der ROIs mit manuellen oder adaptive Schnittstellenüberwachung, um ROIs33,34 mit einer geeigneten Software zu definieren. Anatomischen Bildinformationen aus der CT-Scan hilft Führer ROI Zuordnung, z. B. oberflächlichen Tumoren oder Lungenvolumen.
- Verwenden Sie die Analysesoftware gemäß Herstellervorschrift und sicherzustellen, dass Daten auf die Dosis der injizierten Radioaktivität kalibriert und für Dämpfung und radioaktiven Zerfall korrigiert.
- Zeichnen Diagramme zeigen Daten aus dieser in Vivo Quantifizierung. Ausdrückliche Daten als entweder Prozent injiziert Dosis/Volumen (%ID/mL) oder standard Aufnahme Wert (SUV), die eine alternative Maßnahme ist unter Berücksichtigung der Radioaktivität in den ganzen Körper des Subjekts.
- Berechnung %ID/g Werte vorausgesetzt, die Gewebe-Dichte wie Wasser, d.h. ~ 1 g/L. Es ist bemerkenswert, dass diese Annahme für Orgeln mit deutlich unterschiedlichen dichten, wie Lunge oder Knochen ungültig sein kann.
- Berechnen Sie verschiedene SUVs zur Abschätzung der wahren SUV (zB. SUVmean, SUVmax); SUVmax ist zuverlässiger für kleine Objekte und dient immer häufiger als SUVmean35.
6. ex Vivo -Analysen
Die aufgeführten nachgeschalteten Analysen: (i) Fluoreszenz-Bildgebung von Organen mit fluoreszierenden Krebszellen (Primärtumor und Metastasen) während tierische Dissektion, (Ii) die Messung der Gewebeverteilung Radiotracer, und (Iii) histologische oder (iv) durchflusszytometrischen Bewertung der krebsartigen Organe.
- Messung der Radiotracer Verteilung von γ-Zählung (ex Vivo Bioverteilung) und Ex Vivo Fluoreszenz-Bildgebung von Krebsgewebe.
- Messen Sie Radioaktivität der ganzen toten Tieres zu und notieren Sie den Wert und die Zeit.
- Die Tiere zu sezieren und ernten die folgenden Geweben: Lunge, Herz, Blut (mit 20 mm Glaskapillaren), Leber, Magen, Nieren, Milz, kleinen und großen Darm, Schilddrüse und Speicheldrüsen, ein Stück vom Bein Muskel und Knochen von den hinteren Oberschenkelknochen und relevant und sezierbar Lymphknoten und Krebsgewebe.
- Messen Sie die Radioaktivität der übrigen Karkasse einschließlich zunächst ausgenommen das Heck und notieren Sie die Werte und die Zeit der Messung.
Hinweis: Radioaktivität im Heck kann aus Radiotracer, die falsch injiziert wurde und somit konnte keine Zirkulation betrachtet werden; Daher wurde dieser Betrag von Radiotracer nicht der injizierten Dosis beiträgt. Die Rute Radioaktivität dient auch als Retrospektive Parameter der Injektion Qualität. - Wiegen Sie alle Gewebe (vorgewogene Röhrchen verwenden).
- Fotografieren Sie Krebs Organe, im Tageslicht und unter Fluoreszenzlicht.
Hinweis: Verwenden Sie einen Kamera Stand, den Abstand zwischen Objektiv und Orgel konstant zu halten (oder verwenden Sie eine dedizierte kommerzielle Instrument für diesen Zweck). - Betten Sie Organe/Gewebe für den nachgeschalteten Histologie in OCT ein oder Tauchen sie ein in Formalin zur Fixierung. Für andere downstream-Anwendungen kann Probenvorbereitung unterscheiden.
- Bereiten Sie Radiotracer Kalibrierstandards in doppelte, z. B. 0 bis 1000 kBq [18F] BF4–.
Hinweis: Kalibrierstandards sind verpflichtet, (i) beziehen sich die gemessenen Impulse pro min auf Radioaktivität (in kBq), und (Ii) Verfall Korrektur zu vereinfachen; 18 F– können zu ersetzen [18F] BF4–. - Zählen Sie die Radioaktivität aller geernteten Gewebe mit einem γ-Zähler zusammen mit Radioaktivität Kalibrierstandards aus Schritt 6.1.7. Notieren Sie sich die Zeit der Messung. Wenn Zählraten zu hoch sind (d. h. außerhalb der Linearität der Kalibrierung standard oder durch zu hohe Detektor Totzeiten), erneut zählen die Proben zwei Radiotracer Halbwertszeiten später.
- Stellen Sie die Daten entweder als %ID/g oder standard Aufnahme Werte (SUV) (Equ.2).
SUV =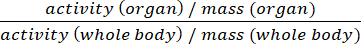 (Equ.2)
(Equ.2) - Entsorgen Sie alle geernteten Gewebe, die nicht für die weitere nachgelagerte Analysen nach lokalen Abfallwirtschaft Regeln erforderlich sind.
- Analysieren Krebsgewebe durch Zytometrie oder Histologie nach der Benutzer-Einstellungen und Standard-Protokolle (wie an anderer Stelle beschrieben3,6,28).
Ergebnisse
Der erste Schritt erfordert Gentechnik der Krebszellen von Interesse. Hier, die Ergebnisse der Lentivirale Transduktion von metastasierendem murinen entzündliche 4T1 Brustkrebs-Zellen und menschliche metastasierendem MDA-MB-231 Zellen mit Lentivirus Partikel tragen DNA Kodierung NIS-GFP oder NIS-RFP gezeigt werden. Transduktion Effizienz variiert zwischen Krebszelllinien (Abb. 2A, linke Spalte). Jedoch alle daraus resultierenden ausgestrahlt Krebszelle Linien durch FACS Reinheit (Abb. 2A, rechts) ausgewählt wurden. Konfokale Fluoreszenzmikroskopie (Abb. 2 b) demonstriert richtige Plasmamembran Lokalisierung von NIS-FPs. NIS-FP-Funktion wurde quantifiziert mit NIS gewährt Radiotracer Aufnahme (Abbildung 2-2E) und NIS-Funktion demonstriert und Spezifität. Vor allem, keine signifikanten Unterschiede zwischen den 4T1. NIS-GFP und 4T1. NIS-RFP mit dem Ausdruck ihrer Zell-Linien mit ähnlicher NIS Ausdruck gefunden (Abbildung 2).
Nach vollen in-vitro- Zelle Zeile Charakterisierung wurden mit dem neu generierten nachvollziehbar Krebszelllinien Tumormodellen eingerichtet. Als Beispiel, die 4T1. NIS-GFP Tumor Modell, ein Modell für entzündliche Brustkrebs erscheint hier (Abbildung 3). In Tumor-tragenden Tieren längs Ganzkörper-PET-Bildgebung dann informiert auf Tumorprogression einschließlich Metastasierung (Abb. 3 b). Die PET Radiotracer [18F] BF4– war notwendig für die Bildgebung und frisch am Morgen jedes Tier imaging-Sitzung hergestellt. Synthese von [18F] BF4– erfolgte mittels der beschriebenen Methode der ARS. In der Regel war ~1.6 GBq 18F– als Eingabe verwendet und erhalten ~ 244 MBq [18F] BF4– in 40.5±3.9 min (N = 17). Das Produkt wurde von Radio Dünnschichtchromatographie oder Ionenchromatographie analysiert und zeigte eine radiochemische Reinheit von 94.7±1.4 %. Die radiochemische Ausbeute betrug 19.4±4.0 % (Zerfall-korrigiert).
Am Tag 19 nach Tumor-Impfung der Primärtumor war eindeutig mit PET, aber keine Metastasen gefunden. Zehn Tage später (Tag 29), die gleichen Tumor-tragenden Mäusen wurden neu abgebildeten und Fernmetastasen an verschiedenen Standorten in allen Tieren (Lunge Metastasen, Metastasen in verschiedenen leisten-und/oder axillären Lymphknoten) identifiziert. Das Beispiel in Abbildung 3 gezeigt umfangreiche Lunge Metastasen mit mehreren eindeutig identifizierbar und quantifizierbarer Knötchen in der Lunge (Abb. 3 b-3E). Darüber hinaus präsentiert das Tier mit regionalen Ausbreitung des Tumors in den peritonealen Wand sowie Metastasen in der leisten- und beide axillären Lymphknoten. % ID-Werte der einzelnen Metastasen in der Lunge (Abbildung 3E) sehr unterschiedlich, aber so war die besetzten Bände der zugrunde liegenden metastasierten Knötchen. Im Gegensatz dazu wurden Volumen normalisiert %ID/mL Werte (Abbildung 3E) viel gleichmäßiger. Dies war für verschiedene Metastasen verständlich zu ähnlichen Entwicklungsstufen (d. h. zwischen 19 und 29; Tag entwickelt Abb. 3 b). Im Gegensatz dazu war der normalisierten %ID/mL Wert für den primären Tumor niedriger als bei den Lungenmetastasen die steht im Einklang mit einem Tumor-Masse, die hatten mehr Zeit, um Fortschritte und umzugestalten, einschließlich des Zustroms von anderen Zelltypen (Stromazellen Zellen, Immunzellen) , besonders bei diesem Modell der entzündlichen Brustkrebs.
Geleitet von in Vivo Bilder und die Fluoreszenz von Krebszellen (bei tierischen Dissektion unter Fluoreszenz Licht sichtbar), kleine tief sitzenden Organe wie Lymphknoten wurden zuverlässig geerntet und zum gleichen Zeitpunkt für Inhalte (cancerous Knötchen bewertet Abbildung 4A). Während das Fluoreszenzsignal während tierische Dissektion bezeichnend für Tumor Zelle präsent war, war es wichtig, sicherzustellen, dass diese Klassifizierung von ex-Vivo Messungen der Radioaktivität der geernteten Gewebe begleitet wurde. Abbildung 4 b zeigt die standard Aufnahme Werte (SUV) für die verschiedenen Gewebe in einer Kohorte von drei Tiere, die mit Metastasen vorgestellt. Endogen NIS exprimierenden Organe wie die Schilddrüse und den Speicheldrüsen (geerntet kombiniert) oder der Magen zeigte auch die erwartete hohe Radiotracer-Aufnahme. Darüber hinaus erlaubt dieser Ansatz der NIS-FP unkompliziert Krebs Zelle Identifikation bei Histologie (Abbildung 4). Diese Beispieldaten Immunfluoreszenz Histologie zeigte Tumor Vaskularisierung in der 4T1. NIS-GFP-Tumor-Modell. Diese Daten zeigten auch, dass die NIS-GFP-Reporter lebte überwiegend in den Plasmamembranen der Tumor auch in Vivo (Abbildung 4), Zellen dadurch die Aufnahme Ergebnisse validieren.
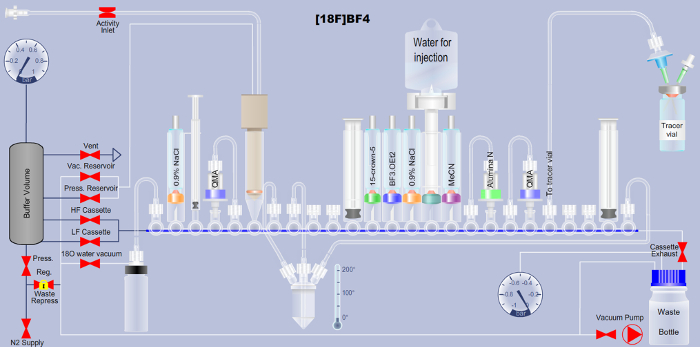
Abbildung 1: Regelung über die Einrichtung der automatisierten Radiotracer Synthese Plattform für die Herstellung von [18F] BF4– über die Fluor-18-Boron Trifluoride Methode. Reagenz-Namen sind auf die jeweiligen Röhren in den Plan gedruckt. QMA ist die Abkürzung für quartäre Ammonium Anion Austausch und zeigt das verwendete Festphasen-chromatographische Trennung Material. Weitere Einzelheiten sind in den Tabellen 1 und 2. Bitte klicken Sie hier für eine größere Version dieser Figur.
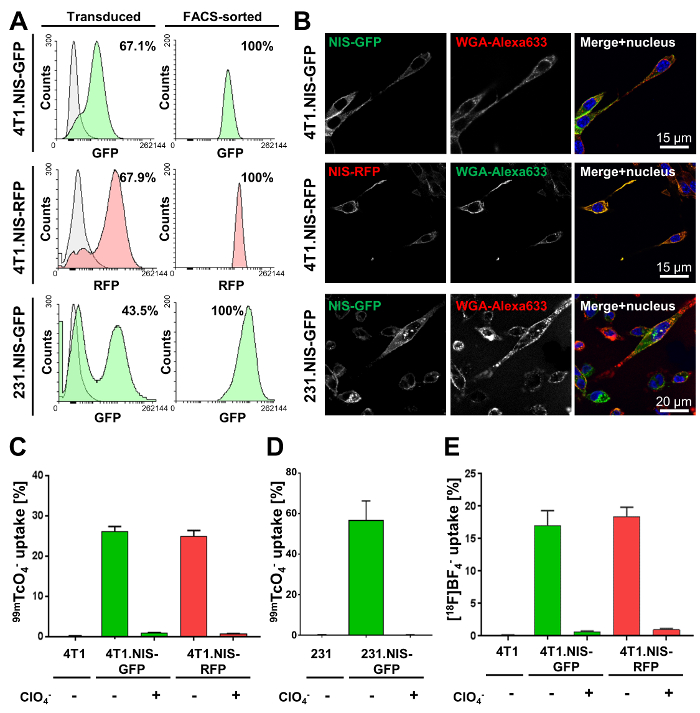
Abbildung 2: Typische Charakterisierung Ergebnisse von Krebszelllinien NIS-GFP oder NIS-RFP stabil zum Ausdruck zu bringen. (A) die angegebenen Zelllinien wurden mit Übertragung von NIS-GFP oder NIS-RFP Lentiviren. Die linke Spalte zeigt die transduced Bevölkerung (grün oder rot fluoreszierende) im Vergleich zu den jeweiligen elterlichen Zellen (grau; 4T1 und MDA-MB-231 Zellen, beziehungsweise). Prozentsätze zeigen Transduktion Effizienz durch Durchflusszytometrie bestimmt. Die Rechte Spalte zeigt die Ergebnisse der Fluss durchflusszytometrischen Analyse nach FACS Reinigung der gemischten Bevölkerung in der linken Spalte. Alle Zelllinien erwiesen sich > 99 % rein für NIS exprimierenden Zellen (durch Durchflusszytometrie) angegeben. (B) konfokale Fluoreszenzmikroskopie von gereinigten Zelllinien zeigt Plasmamembran Lokalisierung von NIS-GFP oder NIS-RFP in die jeweiligen Zelllinien. WGA-Alexa633 wurde als Plasmamembran Marker verwendet. (C, D) Funktionelle Validierung von NIS-FP Protein ausgedrückt in den angegebenen neu generiert Krebszelllinien. NIS-Funktion wurde mit der Radiotracer 99 mTcO4– (50 kBq pro million Zellen) gemessen. Als Kontrollen dienten elterliche Zellen sowie Fusion Reporter mit dem Ausdruck ihrer Zellen, die mit der NIS-Co-Substrat-Perchlorat vor und während der Assay (Spezifität Kontrolle) behandelt wurden. Die Ergebnisse zeigen eindeutig NIS-FP-Funktion und Spezifität in allen Zelllinien. (E) funktionelle Validierung von 4T1. NIS-FP Zelllinien [18F] BF4– als ein Radiotracer für NIS zu verwenden. Alle anderen Bedingungen waren identisch mit (C). Wichtig ist, rechtfertigen sehr ähnlich relative Aufnahme, die für beide 4T1 abgeleitete Zellinien mit beiden Radiotracer (Abbildung 2 und E), damit die Ergebnisse waren die austauschbaren Verwendung von sowohl für in-vitro- funktionelle Charakterisierung von NIS-FP mit dem Ausdruck ihrer Zell-Linien. Bitte klicken Sie hier für eine größere Version dieser Figur.
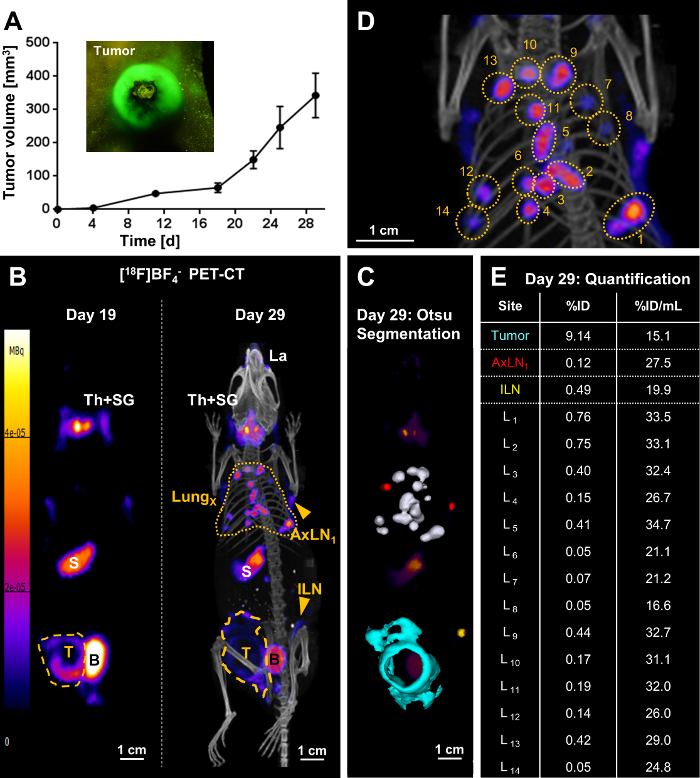
Abbildung 3. Repräsentatives Ergebnis der Metastasierung tracking durch [18F] BF4–-PET/CT-Bildgebung in eine Maus mit einem 4T1. NIS-GFP Tumor. (A) 1 Million 4T1. Wachstum des Tumors erfolgte im Laufe der Zeit mit Bremssättel, NIS-GFP-Zellen wurden in der Mamma Fettpolster von ca. 5-6 Wochen alt BALB/c CanN.Cg-Foxn1Nu/Crl Mäusen injiziert. Grobe visuelle Identifizierung/Wachstum Bewertung war aufgrund der GFP Fluoreszenz der Krebszellen auch möglich mit einem Fluoreszenz-Fackel und geeigneten Filtergläsern (siehe Kasten). (B/links) Am Tag 19 Post Tumor Impfung war der Primärtumor (gelbe gestrichelte Linie) aber keine Metastasen gekennzeichnet. Das Bild ist eine maximale Intensität Projektion (MIP) des PET-Bildes. Endogene NIS Signale (weiße Deskriptoren) auch aufgezeichnet wurden, d.h. die Schilddrüse und Speicheldrüsen (Th + SG), den Magen (S), und auf sehr niedrigem Niveau, einige Teile der Contactlinse und Milch-Drüsen. Die Blase (B) Signal stammt von Tracer-Ausscheidung. (B/rechts) Am 29. Tag Post Tumor Inokulation, Metastasen war eindeutig identifiziert: mehrere Metastasen in der Lunge (gelbe gestrichelte Linie) sowie metastatischen Lymphknoten (ILN, AxLN, gelbe Pfeilspitzen). Das Bild ist ein MIP des PET/CT-Bildes. Der primäre Tumor (gelbe gestrichelte Linie) wuchs nicht nur in eine kugelförmige Form zu diesem Zeitpunkt, aber auch in den peritonealen Wand eingedrungen hatte. (C) eine 3D Umsetzung der Otsu Schnittstellenüberwachung Technik aktiviert das Krebsgewebe Oberfläche 3D-Rendering; Diese sind ein PET MIP überlagert. Lungenmetastasen sind in weiß, metastasierendem axillären Lymphknoten in rot, der metastatischen inguinalen Lymphknoten in gelb und der Primärtumor, die Invasion in den peritonealen Wand in Türkis, dargestellt. (D) ein Blow-up-Bild des PET/CT VMU in (B/rechts), um einzelne Lungenmetastasen anzugeben. (E) Radiotracer Aufnahme in Krebsgewebe wurde von 3D-Bildern (% ID) quantifiziert und durch ihre jeweiligen Bänden (%ID/mL) normiert. Einzelne Lungenmetastasen entsprechen der Nummerierung in (D). Bitte klicken Sie hier für eine größere Version dieser Figur.
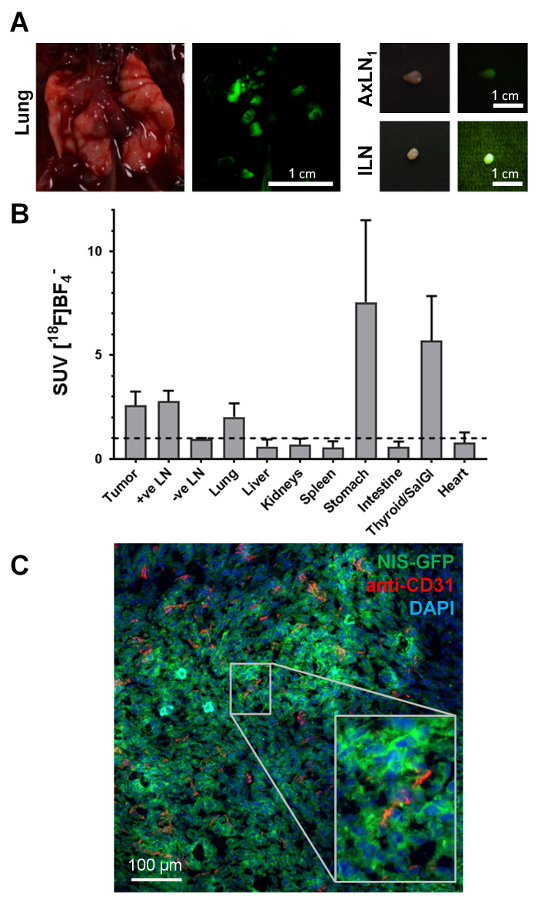
Abbildung 4. Typische Beispiele für ex-Vivo -Daten von NIS-FP Tumor-tragenden Mäusen zugänglich. (A) Gewebe Ernte für nachgelagerte Analysen, die fluoreszierenden Eigenschaften der NIS-FP mit dem Ausdruck ihrer Tumorzellen diente als Indikator Tier Dissektion führen. Als Exemplare, Gewebe des Tieres in Abbildung 3, d.h. die Lunge mit mehreren metastatischen Läsionen und zwei positive Lymphknoten gezeigt. Tageslicht-Fotografie sowie Fluoreszenzbilder angezeigt werden. Die Fluoreszenzbilder wurden mit der gleichen Kamera als Tageslicht Bilder sondern unter blauen Licht Erregung (450±10 nm Bandpassfilter) mit einem grünen Emission Filter (530±30 nm Bandpassfilter) vor das Objektiv der Kamera platziert. (B) Verteilung der Radiotracer in verschiedenen Organen ("Bioverteilung") von Tieren mit 4T1. NIS-GFP Tumoren (N = 3, 29. Tag Post Tumor Beimpfung; 5 MBq [18F] BF4–). Standard Aufnahme (SUV) Werte wurden berechnet und Werte > 1 zeigen spezifische Ansammlung von Radiotracer in den jeweiligen Organen. Die Daten zeigen spezifische Radiotracer Aufnahme in Krebsgewebe, d.h. Primärtumor, metastatischen Lymphknoten (als identifiziert durch Bildgebung und Dissektion unter Fluoreszenz Licht), Lunge (wurde seziert als Ganzes ohne einzelne Metastasen zu trennen), als Organe endogen auszudrücken, NIS, d.h. Schilddrüse und Speicheldrüsen und Magen. (C) Immunfluoreszenz Histologie des Primärtumors aus der gleichen Maus wie in Abbildung 3dargestellt. Der Primärtumor wurde geerntet, eingebettet im OAT und eingefroren, bevor er geschnitten (10 µm) und für Färbung verarbeitet. NIS-GLP mit dem Ausdruck ihrer Krebszellen wurden direkt ohne die Notwendigkeit für Antikörper Färbung identifiziert. Blutgefäße waren voller Flecken mit einem Kaninchen-Antikörper gegen Maus PECAM-1/CD31 (2 µg/mL) und eine Ziege Cy5-konjugierten Anti-Kaninchen Sekundärantikörper. Kerne waren voller Flecken mit 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole (1 µg/mL) und die Probe in Poly (Vinyl-Alkohol - Vinylacetat) mit 2,5 % (w/V) Dabco als eine Antifade montiert. Konfokale Bilder wurden mit einem konfokalen Mikroskop mit Einstellungen für 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole, GFP und Cy5 geeignet. Diese Beispieldaten zeigen deutlich, dass die 4T1. NIS-GFP Tumor durchblutet ist aber auch, dass Vaskularisierung unterscheidet sich in seinem Umfang (vgl. oben mit unten in der Mitte links). Es zeigt auch, dass die NIS-GFP-Reporter in den Plasmamembranen der Tumor Zellen in Vivo (kleines Foto), überwiegend wohnt dabei Validierung der Ergebnisse in Vitro Aufnahme. Bitte klicken Sie hier für eine größere Version dieser Figur.
| FASTlab vielfältigen Ventil | Reagens, Lösungsmittel, Patrone oder Schlauch * | Details | ||
| V1 | Silikonschlauch, [18O] H2O Abfallflasche | 14 cm | ||
| V2 | 0,9 % NaCl-Lösung, 750 µL | 11 mm Fläschchen | ||
| V3 | Spritze S1 | 1 mL | ||
| V4 | Anion Austausch Patrone C1, Pre-Klimaanlage mit 1 M NaCl (10 mL) und H2O (10 mL) | z.b. Sep-Pak Accell Plus QMA Plus Licht (Wasser, Kat. Nein. WAT023525) | ||
| V5 | Silikonschlauch mit Anion Austausch Kartusche C1 | 14 cm | ||
| V6 | [18O] H2O /18F Einlauf Reservoir | Max 5 mL | ||
| V7 | Silikonschlauch, Reaktorbehälter (links; Gaseinlass) | 14 cm | ||
| V8 | Silikonschlauch, Reaktorbehälter (zentralen Hafen, flüssigen Einlass/Auslass) | 14 cm | ||
| V9 | Geschlossen | |||
| V10 | Geschlossen | |||
| V11 | Spritze S2 | 5 mL | ||
| V12 | 15-Krone-5, 46 mg in 800 µL MeCN | 11 mm Fläschchen | ||
| V13 | Trifluoroborate Diethyl Etherate, 0,14 µL in 850 µL MeCN (verdünnte 14 µL BF-3. OEt2 mit 1 mL MeCN. Verdünnen Sie 10 µL dieser Lösung um 850 µL mit MeCN). | 13 mm Fläschchen | ||
| V14 | 0,9 % NaCl-Lösung, 1 mL | 13 mm Fläschchen | ||
| V15 | Wasserbeutel spike | |||
| V16 | Acetonitril (MeCN), 1,5 mL | 13 mm Fläschchen | ||
| V17 | Silikonschlauch mit Aluminiumoxid neutral Kartusche C2 | 14 cm | ||
| V18 | Aluminiumoxid neutral Patrone C2, Pre-bedingt mit H2O (10 mL), Aceton (10 mL) und Luft (20 mL) | z.b. Sep-Pak Aluminiumoxid N Plus Licht (Wasser, Kat. Nein. WAT023561) | ||
| V19 | Silikonschlauch mit Anion Austausch Kartusche C3 | 14 cm | ||
| V20 | Anion Austausch Patrone C3, Pre-Klimaanlage mit 1 M NaCl (10 mL) und H2O (10 mL) | z.b. Sep-Pak Accell Plus QMA Plus Licht (Wasser, Kat. Nein. WAT023525) | ||
| V21 | Silikonschlauch, Sammelbehälter | 40 cm | ||
| V22 | Geschlossen | |||
| V23 | Geschlossen | |||
| V24 | Spritze S3 | 5 mL | ||
| V25 | Silikonschlauch, Reaktorbehälter (rechts; Vakuumanschluss) | 40 cm | ||
| * Hinweis: Aufgrund der Kunststoff Spikes das Totvolumen für 11 mm Fläschchen und Ampullen 13 mm ist etwa 0,35 mL und 0,4 mL, beziehungsweise. Daher sind die tatsächlichen Beträge von Reagenzien übertragen in den Reaktor etwas anders. Alle Mengen, die in dieser Methode beziehen sich auf die tatsächlichen Beträge in jedes Fläschchen Reagenz eingeführt. | ||||
Tabelle 1. Beschreibung des Layouts für die automatisierte [18F] BF4– Synthese über die Fluor-18-Boron Trifluoride Methode Kassette (vgl. Abbildung 1).
| Ablauf vor | Kommentar | ||||
| [1-2] | Setzen Sie das System unter Druck zu und spülen Sie den Verteiler mit N2 | ||||
| [3-15] | Spülen Spritze S3 zweimal mit H2O (V15), spülen Sie den Verteiler mit N2 | ||||
| [16-23] | Beaufschlagen Sie Reagenz-Fläschchen in Positionen V16, V13 und V14, V12, Spülung der Verteiler mit N2 zwischen jedes Fläschchen mit Druck | ||||
| [24-26] | Öffnen Sie die Aktivität Einlass (V6) | ||||
| Schließen Sie das Fläschchen mit 18F. Wenn das Gesamtvolumen > 5 mL, nur legen Sie die Nadel auf halbem Weg in die Flasche bevor Sie fortfahren. | |||||
| [27-39] | In der Nähe der Aktivität Einlass (V6), Falle 18F in QMA Patrone C1 (V5), sammeln [18O] H2O in Abfallflasche (V1). Ist das Gesamtvolumen > 5 mL, Anhalten der Sequenz bei Schritt 37, zurück zu Schritt 26, voll stechen die Nadel in das Fläschchen mit 18F, und den Vorgang fortsetzen. | ||||
| [40] | Schließen Sie den [18O] H2O Abfallflasche (V1), spülen Sie den Verteiler mit N2 | ||||
| [41] | Das Laufmittel Fläschchen in Lage V2 mit Druck beaufschlagen | ||||
| [42-44] | Offenen Reaktor Ventil V8, Aspirat Laufmittel V2 in Spritze S1 | ||||
| [45-50] | Eluieren Sie QMA Patrone C1 in Reaktor (V8) mit Kochsalzlösung aus Spritze S1, setzen Sie die Reaktortemperatur auf 90 ° C | ||||
| [51] | Spülen Sie QMA Patrone C1 mit N2 und erhöhen Sie die Reaktortemperatur bis 105 ° C | ||||
| [52-53] | Acetonitril Entnimm V16 in Spritze S2 | ||||
| [54-57] | Acetonitril aus Spritze S2 zu übertragen, um den Reaktor (V8) | ||||
| [58-60] | Erhitzen Sie den Reaktor bei 120 ° C für 5 min. verflüchtigen das Lösungsmittel mit einem Fluss von N2 in den Reaktor (V7). | ||||
| [61-65] | Stellen Sie die Temperatur auf 105 ° C, trockene Spritze S1 mit N2 | ||||
| [66-69] | Ziehen Sie die Krone-15-5-Lösung von V13 in Spritze S2, erhöhen Sie die Reaktortemperatur bis 120 ° C | ||||
| [70 / 71] | Reduzieren Sie die Temperatur auf 105 ° C, spülen Sie den Verteiler mit N2 | ||||
| [72] | Der Reaktor (Set die Temperatur auf 40 ° C) für 5 min. abkühlen | ||||
| [73-78] | Die Reaktortemperatur auf 80 ° C, übertragen Sie 15-Krone-5-Lösung von Spritze S2, in den Reaktor (V8) | ||||
| [79-81] | Zeichnen Sie den BF-3. OEt-2 -Lösung von V14 in Spritze S2 | ||||
| [82-87] | Die BF-3zu übertragen. OEt2 Lösung aus Spritze S2 in den Reaktor (V8), spülen Sie die Reaktor-Zeile mit N2 | ||||
| [88] | Spülen Sie den Verteiler mit N2 | ||||
| [89] | Für 5 min reagieren Sie, lassen Sie die Temperatur in RT zurückkehren | ||||
| [90-95] | Übertragen Sie das Reaktionsgemisch (V8) auf Spritze S2 | ||||
| [96-104] | Übergeben Sie das Reaktionsgemisch durch Aluminiumoxid N Patrone C2, in Spritze S3 | ||||
| [105] | Spülen Sie den Verteiler mit N2 | ||||
| [106-109] | Das Reaktionsgemisch zu Spritze S2 zurückkehren | ||||
| [110-112] | Leere Spritze S3, ziehen in Spritze S2, das Reaktionsgemisch zu verdünnen, H2O (V15) | ||||
| [113-115] | Laden Sie das Reaktionsgemisch auf QMA Cartridge C3 | ||||
| [116-118] | Ziehen Sie in Spritze S2, H2O (V15) | ||||
| [119-124] | Spülen des Reaktors (V8) mit H2O aus S2, Spritze Aspirieren der Waschungen in Spritze S2 | ||||
| [125-128] | Übergeben Sie die Waschungen durch Patronen C2 und C3 | ||||
| [129-130] | Trocknen Sie die Patronen und der Verteiler mit N2 | ||||
| [131-136] | Waschen Sie Spritze S1 mit H2O (V15) | ||||
| [137-142] | Waschen Sie Spritze S2 mit H2O (V15) | ||||
| [143] | Spülen Sie den Verteiler mit N2 | ||||
| [144-147] | Ziehen Sie in Spritze S2, H2O (V15) | ||||
| [148-151] | Spülen Sie QMA Patrone C3 mit H2O aus Spritze S2 | ||||
| [152-153] | Trocknen Sie QMA Patrone C3 mit N2 und spülen Sie die Verteiler mit N2 | ||||
| [154-157] | Eluieren QMA Patrone C3 mit 0,9 % NaCl (V14) in Spritze S3 | ||||
| [158-161] | Das Produkt aus Spritze S3 zu übertragen, um den Sammelbehälter (V21) | ||||
| [162-163] | Bündig QMA Patrone C3 mit N2 , den Sammelbehälter (V21) | ||||
| [164-166] | Spülen Sie den Verteiler mit N2 | ||||
| [167-170] | Bündig Patronen C2 und C3 (zur Flasche waste) und die Verteiler mit N2 | ||||
| [171] | Spülen Sie die Sammlung Schläuche (V21) mit N2 | ||||
Tabelle 2. Beschreibung der Schritte in der Reihenfolge XML-Datei.
Diskussion
Der erste Schritt zum Rendern Krebs Zellen nachweisbar in Vivo durch diese Methode erfordert Technik sie auszudrücken, die NIS-FP-Fusion-Reporter. Die Wahl des fluoreszierenden Proteins in der Fusion-Reporter ist wichtig, da oligomerizing fluoreszierende Proteine zu künstlichen Reporter clustering, damit negative Auswirkungen auf seine Funktion führen kann. Wir hatten Erfolg mit bewährten Monomeren fluoreszierende Proteine wie mEGFP (mit der monomerizing Mutation A206K36,37), mTagRFP oder mCherry. NIS kann entweder der Mensch oder Maus Ursprungs (hNIS oder MsNIS) je nach Zweck des Experiments und der Krebs-Modell. Transduktion Wirkungsgrade variieren in der Regel zwischen verschiedenen Krebszelllinien. Allerdings sind generierte Krebszelllinien anschließend durch FACS in diesem Protokoll, wodurch die Notwendigkeit für die Optimierung der Transduktion Bedingungen gereinigt. Transduktion mit hoher Multiplizität der Infektion ist nicht immer ratsam, da mehrere Konstrukt-Integration in das Genom nicht nur in höheren Konstrukt Ausdruck, sondern auch in mehr unerwünschte/ungeregelt Genom Modifikation führen dürfte. Daher ist es wichtig, polyklonale ausgestrahlt Zellen wachsen, um die Stabilität des Ausdrucks (überwacht durch Durchflusszytometrie) und vermeiden die hellsten Klone nur durch FACS sortieren zu lassen. Es macht auch funktionelle Validierung-Reporter Funktionen entscheidend, bevor diese Zellen für in Vivo Experimente verwendet werden soll. Eine neu entwickelte Alternative zu viralen Gens Lieferung ist gen Bearbeitung Technologie38, die genauere Kontrolle über virale Integration Websites bietet. Expressionsanalyse von Durchflusszytometrie und Immunoblotting ist wichtig. Durchflusszytometrie ermöglicht die Erfassung von populationsbasierten Einzelzelle Daten, zum Beispiel zu prüfen, ob eine Drift in Reporter Ausdruck Niveaus im Laufe der Zeit. Es stützt sich auf die FP glyko-nur, wenn Zellen mit einem Antikörper gegen Oberflächen- oder total NIS auch gebeizt werden. Durchflusszytometrie informiert nicht über Fusion Reporter Integrität. Im Gegensatz dazu berichtet Immunoblotting über die Integrität der Fusion-Reporter. Das Molekulargewicht von NIS und die FP muss hinzugefügt werden, um die erwarteten Molekulargewicht von der gewählten NIS-RP konfokale Fluoreszenz Mikroskopie demonstriert Fusion Reporter NS1 mit der Plasmamembran Marker Weizenkeime Agglutinin in allen neu bestimmen Zell-Linien gemacht. Dies war der erwarteten zellulären Stelle für den Großteil des Proteins und einen grünes Licht Meilenstein für spätere funktionelle Validierung angegeben. Wenn minimal/Nein NIS-FP auf der Plasmamembran (z.B. nur in internen zellulären Kompartimenten) gefunden wurde dies würde bedeuten, dass eine Zelle biologische Problem mit dem Fusion-Reporter in diese Zelllinie oder eine mögliche Mutation von der Fusion-Reporter, die Auswirkungen auf seine intrazelluläre Menschenhandel. Es ist bemerkenswert, dass wir keine solchen in jedem der Krebszellen, die wir bisher getestet beobachtet haben, die enthalten: A375P, A375M2, SK-Mel28, WM983A/B (menschlichen Melanom); MCF-7, MDA-MB-231, MDA-MB-436 (menschlichen Brustkrebs); NCI-H1975 (menschliche Lungenkrebs); SK-Hep1 (menschliche Leberkrebs); 4T1, 4T1.2, 66cl 4, 67NR, FARN168 (murine entzündlichen Brustkrebs); B16F0, B16F3, B16F10 (murine Melanom); MTLn3 (Ratte Brust Adenokarzinom).
NIS-Funktion muss mit Aufnahme-Assays mit radioaktiven NIS Substraten gemessen werden. Aufgrund der SPECT Radiotracer 99 mTcO4– als Generator produziert und daher weit verbreitet in Krankenhäusern ohne die Notwendigkeit für jede Radiotracer-Synthese sowie eine bequemere längere Halbwertszeit (6,01 h für 99 m TC im Vergleich zu 110 min 18F), wir dieses NIS Substrat für routinemäßige funktionelle Validierung der neuen NIS-FP mit dem Ausdruck ihrer Zelllinien verwendet. Die erwartete Reduzierung/Abschaffung der Radiotracer Aufnahme, so bekunden, Spezifität der Radiotracer Aufnahme führte vor Sperrung von NIS exprimierenden Zellen mit NIS Co Substrat Natrium Perchlorat. Dieser NIS-Spezifität-Test ist eine kritische Überprüfungsschritt. Wenn eine NIS-Spezifität-Experiment nicht vergleichbar mit den jeweiligen elterlichen Zellen reduzierten Radiotracer Aufnahme führen würde, einen technischen Fehler während des Experiments oder die Radiotracer-Aufnahme wurde nicht durch NIS. Es ist auch möglich, dass Natrium Perchlorat vor Sperrung Radiotracer Aufnahme in eine elterliche Zelllinie reduziert; Dies würde Zelllinien mit endogenen funktionaler NIS Ausdruck zu identifizieren (z.B. stimuliert Schilddrüse Zellen6).
Ein entscheidender Vorteil dieses bildgebenden Protokolls ist, dass Informationen in 3D und im Laufe der Zeit gesammelt werden. Dies ermöglicht den Vergleich der Bilder vom selben Tier über Zeit, wodurch gepaarte Daten und somit durch Inter Tier Variabilität verursachte Probleme zu überwinden. Dies kontrastiert mit nicht-abbildende Verwandte Metastasierung Bewertungsmethoden, die basieren auf verschiedene Tieren zu verschiedenen Zeitpunkten zu opfern. In Abbildung 3 b ist es offensichtlich wie metastatische Ausbreitung und Auswuchs im Laufe der Zeit in ein einzelnes Tier fortgeschritten. Die Signale von PET/CT-Bildgebung erkannt werden grundsätzlich durch NIS Ausdruck verursacht. Dazu zählen alle Signale von EXOGEN NIS exprimierenden Krebszellen sowie alle Organe endogen NIS zum Ausdruck zu bringen. Typische endogene NIS-Signale werden in der Schilddrüse und Speicheldrüsen, Magen und auf einem niedrigen Niveau in einigen Teilen der Milch- und Contactlinse Drüsen gefunden. Neben endogenen NIS Ausdruck wird der NIS Radiotracer [18F] BF4– auch über die Nieren, dadurch erklären Radiotracer Aufnahme in Urin gefüllte Blase ausgeschieden. Niere-Aufnahme ist nicht mehr nachweisbar der bildgebenden Zeitpunkt in diesem Protokoll (45 min Post Radiotracer Injektion6) empfohlen. Wenn Signale von Urin gefüllte Blase zu Signal-Hintergrund-Problemen führen sollte, kann die Blase mechanisch unter Narkose vor Bildgebung entleert werden. Wichtig ist, können die körpereigene Signale zwischen tierischen Stämme variieren. Es ist auch bemerkenswert, dass endogene NIS Ausdruck in den Brustdrüsen unter stillende Bedingungen10höher sein kann. Im vorgestellten Fall und in den Fällen von diesen metastasierendem Zelllinien erfolgreich vor (vgl. Liste oben) gekennzeichnet fanden wir nicht endogene NIS Ausdruck zu Metastasen Erkennung erheblich stören. Es ist bemerkenswert, dass [18F] BF4– steht mehr für Aufnahme in Krebsgewebe gegenüber Jodid, da Jod in die Schilddrüsenhormone6verstoffwechselt wird. Dieses Phänomen kann auch größere Mengen an Radioiodide im Blut im Vergleich zu [18F] BF4- 6beitragen. Für verschiedene Anwendungen (Krebszelle Verfolgung in anderen Krebsarten oder nicht-Krebs Zelle tracking-Anwendungen) Dies kann abweichen, und es wird daher empfohlen, zu prüfen, ob endogene NIS Ausdruck zu Signal-Hintergrund-Themen durch führen dürfte Vorversuchen. Ein wichtiger Aspekt in der präklinischen Bildgebung ist die molare Aktivität die Radiotracer. Die hier beschriebene Methode verwendet ~1.5 GBq 18F– als Ausgangspunkt Material14 und hat gezeigt, dass die molare Aktivitäten deutlich über die bisher gemeldeten Substitution Methode12produzieren. [18F] BF-4– produziert bei Molaren Aktivitäten ≤1 GBq/µmol12 führen zu reduzierten Aufnahme in NIS exprimierenden Gewebe. Dies ist von besonderer Bedeutung, wenn die eingespritzte Menge an Radioaktivität pro Kilogramm hoch ist, d.h. wenn kleine Tiere wie Mäuse sind39abgebildet; Es ist weniger wichtig, in die menschliche Einstellung40. Aktivitäten mit hohem molare sind daher unerlässlich für die qualitativ hochwertige präklinische PET-Bildgebung. Molare Aktivitäten erzielten die Boron Trifluoride Zusatz Methode14, die in automatisierter Form in diesem Protokoll aufgeführt ist, überwinden dieses Problem. Darüber hinaus ist es bemerkenswert, dass die vorgestellte Protokoll für [18F] BF4– Synthese nicht konform mit der guten Herstellungspraxis (GMP) ist und daher ungeeignet für den Einsatz in klinischen Studien am Menschen in dieser Form. Ein GMP-Protokoll (über die Substitutionsmethode 18F, BF4–Radiomarkierung) gibt es an anderer Stelle40.
PET/CT-Bildgebung ermöglicht die Visualisierung der Radiotracer-Aufnahme, was bezeichnend für Radiotracer NIS-vermittelte Aufnahme von NIS-FP mit dem Ausdruck ihrer Krebszellen. Noch wichtiger ist, können die damit verbundenen PET-Signale quantifiziert werden. Es ist notwendig, zuverlässigen Schwellwerte Verfahren um eine konsistente und unvoreingenommene Differenzierung der relevanten Signale von jedem potenziellen Hintergrund zu gewährleisten. Da der Hintergrund in verschiedenen Orten in Vivovariiert, ist es wichtig, lokale/regionale Schwellwerte und Segmentierung zu berücksichtigen. Eine solche Methode wurde von entwickelt und benannt nach Otsu34, und die 3D Umsetzung wird für 3D-Rendering der Primärtumor und Metastasen in diesem Protokoll eingesetzt. Im Allgemeinen entspricht das Bild für den Betrachter visuell gesehen am besten den quantifizierten % injiziert Dosis (% ID) Werten. Für Image-basierte Quantifizierung ist es auch wichtig, die gemessenen Radioaktivität Werte der verschiedenen Gewebe, deren Volumen zu normalisieren. Es gibt zwei überwiegend verwendete Möglichkeiten Angabe der normalisierten Ergebnisse, (i) % ID pro Volumen (z.B. %ID/mL) und (Ii) standard Aufnahme Wert (SUV35). Sie unterscheiden sich in diesem %ID/mL die individuelle Lautstärke nur berücksichtigt während SUV ist eine Maßnahme, die im Vergleich zu den durchschnittlichen Radioaktivität über das ganze Tier. Es ist auch wichtig zu beachten, dass NIS Bildgebung das live Tumorvolumen (LTV) zugänglich, rendert weil Tote/sterben Zellen kann nicht synthetisieren ATP nicht mehr Radiotracer10importieren. Dies erklärt die große Low-Signal Fläche innerhalb der Primärtumor ("Donut-förmigen" Tumor) zeigt Bereiche der Tumor Zelle Tod/Nekrose. LTV war ein weitaus zuverlässiger Maßstab für Tumorlast im Vergleich zu der groben Tumorvolumen Bremssattel Messungen erreichbar (das Konto Lebensfähigkeit nicht berücksichtigt und bewertet nur oberflächlichen Tumor Regionen).
Ein großer Vorteil dieser Dual-Mode-Tracking-Strategie zeigt sich bei der Ernte von Geweben nach tierischen Keulung. Von in Vivo Bilder geleitet und unterstützt von fluoreszierenden Krebszellen während tierische Dissektion, kann kleine und tief sitzenden Organe/Metastasen auch zuverlässig geerntet werden. Gefrorenes Gewebe Erhaltung/schneiden Methodik ermöglicht die direkte Fluoreszenz-Bildgebung der GLP ohne Färbung mit einem Anti-GFP-Antikörper, aber auf Kosten der Erhaltung der reduzierten strukturelle Gewebe verglichen mit Formalin fixiert Paraffin-eingebetteten Methodik (FFPE). Letzteres erfordert kritisch auch Anti-FP Färbung, denn die Proteinkinase-Methode ist unvereinbar mit intakten Erhaltung von fluoreszierenden Proteinen (wegen Fixierung/Entwässerung/Rehydratation). Während das Fluoreszenzsignal bezeichnend für Tumor Zelle präsent ist, ist es wichtig, sicherzustellen, dass diese Klassifizierung von ex-Vivo Messungen der Radioaktivität der geernteten Gewebe ("Bioverteilung") bestätigt wird. Ex-Vivo Messungen der Radioaktivität sind empfindlicher als die visuelle Erkennung von Fluoreszenz, daher können die Identifikation von Krebs Zelle-abhängige Signale, die sonst unentdeckt blieben. Im Falle einer Terminal Sitzung imaging ist entscheidend für die injizierten Radiotracer Beträge sowie die Zeiten der Radiotracer Radioaktivität Messungen, tierische Injektion, Tier Keulung genau beachten und Szintillationszähler Messungen kalibriert geernteten Gewebe. Dies ist entscheidend für die Korrektur für Radiotracer Zerfall zu gewährleisten und damit eine zuverlässige Bioverteilung Analyse ermöglichen.
PET/CT-Bildgebung ermöglicht wiederholt nicht-invasive 3D Quantifizierung der Tumorprogression einschließlich der Bewertung der Metastasierung auf Ganzkörper-Ebene. Diese Funktion ist ein wesentlicher Vorteil gegenüber herkömmlichen Methoden, die verlassen sich oft auf großen Kohorten von Tieren, die für die Beurteilung der Tumorprogression zu unterschiedlichen Zeitpunkten eingeschläfert werden. Die Vorteile dieser Bildgebung basierenden Ansatzes sind: (i) hochsensiblen nichtinvasive 3D in Vivo Quantifizierung, (Ii) einen erheblichen Rückgang der Tierzahlen durch die Möglichkeit der Wiederholung, imaging, (Iii) die Akquisition gepaarte Längsschnittdaten aus nachfolgenden imaging-Sitzungen, die Verbesserung der Statistik durch den Ausschluss Inter Tier Variabilität, die wiederum weitere Tierzahlen reduziert, (iv) automatisierte Produktion [18F] BF4– bei hohen spezifischen Aktivitäten und (V) die intrinsische Option für ex-Vivo Bestätigung in Geweben durch Fluoreszenz Methoden wie Mikroskopie oder Zytometrie.
In Vivo Cell tracking ist ein wachsendes Feld. Es wurde angetrieben durch die jüngsten Fortschritte in der imaging-Technologie, die Erhöhung der Auflösung, Nachweisgrenzen und Multiplex-Fähigkeit (über multimodale Bildgebung) geführt. In diesem Protokoll wenden wir dieses Konzept um Tumorprogression auch spontane Krebsmetastasen Zelle in 3D durch wiederholte Bildgebung zu verfolgen. Anwendungen umfassen Studien zur Entschlüsselung der Mechanismen der spontanen Krebsmetastasen Zelle. Beispielsweise könnte nachvollziehbar Tumorzellen verwendet werden, um die Auswirkungen der verschiedenen Immunzellen Komponenten (als Geschenk/funktional in tierischen Stämme von verschiedenen Ebenen der Immunocompromisation) auf der metastatischen Prozess zu studieren. Ebenso konnte die Auswirkungen einzelner Gene, entweder in der tierischen Belastung oder die Krebs-Zell-Linie untersucht werden. Darüber hinaus könnte die vorgestellte Protokoll prüfen/validieren die Wirksamkeit von bestimmten Medikamenten oder Therapiekonzepte auf Tumorprogression verwendet werden. Wichtig ist, diese Reporter-gen: Radiotracer-paar für PET-Bildgebung (NIS: [18F] BF4–) könnte auch für andere Zelle tracking-Anwendungen verwendet werden. Zum Beispiel entstehen mehrere Zelltherapien derzeit so viel versprechende Therapieansätze. Dies beinhaltet zelluläre Therapie für Krebs Behandlung41 , sondern auch in Transplantation42 und regenerative Medizin-43,-44 -Einstellungen. Ganzkörper- in Vivo Zelle tracking gewinnt zunehmend an Bedeutung für die Entwicklung und klinische Übersetzung der zellulären Therapie, zum Beispiel für die Bewertung der Sicherheit und zur Therapieüberwachung.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Die Forschung wurde unterstützt durch die Kings College London und UCL umfassende Cancer Imaging Center, finanziert von Cancer Research UK und EPSRC in Verbindung mit dem MRC und DoH (England); das National Institute for Health Research (NIHR) Biomedical Research Centre am Guy es and St. Thomas' NHS Foundation Trust und Kings College London; Das Centre of Excellence in Medical Engineering gefördert vom Wellcome Trust und EPSRC unter Grant Nummer WT 088641/Z/09/Z; ein Krebs UK multidisziplinäres Projekt Forschungspreis GOF PJB und des Königs Health Partners Zuschuss an GOF. Die NanoPET/CT und NanoSPECT/CT-Scanner waren gekauft und gepflegt durch eine Ausrüstung Zuschuss aus dem Wellcome Trust. Die geäußerten Meinungen sind diejenigen der Autoren und nicht unbedingt der NHS, die NIHR oder die DoH.
Materialien
| Name | Company | Catalog Number | Comments |
| Step 1) Engineering and characterization of cancer cells to express the radionuclide-fluorescnece fusion reporter NIS-FP. | |||
| 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole | Thermo Scientific | H3570 | Trivial name: Hoechst 33342; CAS number: 23491-52-3; Hoechst 33342, Trihydrochloride, Trihydrate - 10 mg/mL Solution in Water. |
| 4T1 murine breast cancer cell line | ATCC | CRl-2539 | for details see ATCC website |
| Automatic Cell Counter, e.g. CASYCounter | Roche Diagnostics GmbH | 5651697001 | CASY Model TT Cell Counter and Analyzer |
| CASYclean Cleaning Reagent | Sedna Scientific | 2501036 | |
| CASYton Isotonic Diluent | Sedna Scientific | 2501037 | |
| Confocal Fluorescence Microscope, e.g. Leica TCS SP5 | Leica, Wetzlar, Germany | Equipped with Plan-Neofluor 25×0.5NA and Plan-Apochromat 63×1.4NA oil UV objectives and Diode (405 nm), Argon-ion (458, 477, 488, 496, 514 nm) and HeNe (543 and 633 nm) lasers; A Leica LAS AF Lite Software 4.0.11706 (Leica Microsystems CMS GmbH) was used for image acquisition and and anaysis | |
| Cover slips No. 1.5 thickness | VWR International | 631-0150 | |
| Dabco | Sigma | 290734 | Stock 125 mg/mL |
| DMEM | Sigma | D5546 | Supplement with 10 % (v/v) FBS and L-glutamine (2 mM) to make up the optimal growth medium for MDA-MB-231 cells. |
| FACS sorter, e.g. BD FACSAria III | BD Biosciences | Equipped with a BD FACS DIVA Software, a 6 Laser System (375/405/488/561/633 nm lasers) - cells sorted with a 100 μm nozzle under 20 psi flow pressure, window extension of 2.0 μm, 2.0 Neutral Density Filter and 3 kV plate voltage | |
| Fetal Bovine Serum (FBS) | Sigma | F9665 | Heat inactivated at 56 °C for 30 min |
| Automated Gamma Counter, e.g. 1282 Compugamma | LKB Wallac Laboratory | 99mTc-pertechnetate energy window 110-155 keV 18F energy window 175-220 keV | |
| Hoechst 33342 solution | Life Technologies | H1399 | 1-3 µg/mL; DAPI (from various supplieres) can be used instead. |
| L-glutamine | Sigma | G7513 | Solution 200 mM concentrated, sterile-filtered |
| Linear polyethylenimine (PEI) | Polyscience | 23966-2 | Linear, 25 kDa; transfection reagent for 293T cell line. |
| MDA-MB-231 human breast cancer cells | ATCC | HTB-26 | for details see ATCC website |
| Mowiol 4-88 | Sigma | 81381 | |
| pLNT SFFV NIS-mEGFP | request from our lab | n/a | For details (generation and maps) see Supplementary Information |
| pLNT SFFV NIS-mCherry | request from our lab | n/a | For details (generation and maps) see Supplementary Information |
| pMD2.G | Addgene | #12259 | plasmids encoding for the VSV-G envelope |
| pRRE | Addgene | #12251 | packaging plasmid |
| pRSV-Rev | Addgene | #12253 | packaging plasmid |
| Paraformaldehyde solution 4 % (w/v) in PBS | Santa Cruz Biotechnology | sc-281692 | |
| Penicillin-Streptomycin | Sigma | P43330 | Containing penicillin (10,000 units/mL) and streptomycin (10 mg/mL), sterile-filtered |
| Phosphate Buffered Saline (PBS) | Sigma | D8537 | pH 7.4, sterile-filtered and without calcium chloride and magnesium chloride |
| Poly(vinyl alcohol - vinyl acetate) | Polysciences | 17951 | Trivial name: Mowiol 4-88; CAS number: 9002-89-5 |
| Puromycin dihydrochloride | Sigma | P8833 | From Streptomyces alboniger, reconstituted in sterile water |
| Benchtop centrifuge, e.g. Rotina 380 R Benchtop centrigfuge | Hettich Lab Technology | ||
| RPMI 1640 | Sigma | R0883 | Supplement with 10% (v/v) FBS and L-glutamine (2mM) to make up the optimal growth medium for 4T1 cells. |
| SFCA Syringe filter 0.45 μm | Corning | ||
| Syringes 10 mL | BD Emerald | Disposable non-sterile syringes | |
| Tissue culture fluorescence microscope, e.g. EVOS-FL | Life Technologies | Cell Imaging System equipped with a 10× objective (PlanFL PH2, 10×/0.25, ∞/1.2) and a colour camera | |
| Trypsin-EDTA solution 10X | Sigma | 59418C | (0.5 % (w/v) trypsin, 0.2 % (w/v) EDTA) gamma irradiated by SER-TAIN process and without phenol red |
| Wheat Germ Agglutinin Alexa Fluor 633 Conjugate | Life Technologies | W21404 | Used at 1:1000 (2 µg/mL) for cell immunofluorescence |
| Step 2) Establishment of in vivo tumor models. | |||
| Digital caliper | World Precision Instruments | 501601 | |
| Isoflurane 1000 mg/g | Isocare | For inhalation | |
| Fluorescence Torch, e.g. NightSea Fluorescence Torch DFP-1 | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters and NightSea filter goggles (DFP-1) |
| Syringes 0.3 mL U-100 insulin | Terumo | 29G × 1/2'' - 0.33 × 12 mm | |
| Standard materials/equipment for aseptic technique and animal maintenance | |||
| Step 3) Production of [18F]BF4- using an automated radiotracer synthesis platform. | |||
| 15-crown-5 | Sigma-Aldrich | 188832 | CAS 33100-27-5 |
| Acetonitrile (anhydrous) | Acros Organics | 326811000 | |
| Boron trifluoride diethyl etherate | Sigma-Aldrich | 216607 | BF3.OEt2, purified by redistillation, ≥46.5 % BF3 basis. CAS 109-63-7 |
| Automated Radiotracer Synthesis (ARS) platform, e.g. FASTLab | GE Healthcare | ||
| Disposable cassettes for ARS platform, e.g. FASTLab cassettes | GE Healthcare | FASTlab Developer pack | |
| Polygram Alox N/UV254 polyester sheets | Macherey-Nagel | 802021 | RadioTLC plates, 40×80 mm |
| Strong anion exchange cartridge, e.g. Sep-Pak Accell Plus QMA Plus Light | Waters | WAT023525 | Condition with 1M NaCl (10 mL) and H2O (10 mL) |
| Alumina neutral cartridge, e.g. Sep-Pak Alumina N Plus Light | Waters | WAT023561 | Condition with H2O (10 mL), acetone (10 mL) and air (20 mL) |
| Water for injection USP | GE Healthcare | ||
| Nitrogen filter | Millipore | SE2M049I05 | Sterile 0.2 µm FG Millex 13 mm |
| Step 4) In vivo imaging of NIS-FP expressing cells by nanoPET/CT. | |||
| Isoflurane 1000 mg/g | Isocare | For inhalation | |
| Preclinical PET/CT multimodal imaging instrument, e.g. nanoScan PET/CT | Mediso Medical Imaging System, Budapest, Hungary | ||
| Fluorescence Torch, e.g. NightSea Fluorescence Torch DFP-1 | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters and NightSea filter goggles (DFP-1) |
| Rodent anesthesia induction chamber | Vet-Tech | AN010R | With three-way valves (x2), tube mount connector for inlet, PVC tubing for gas inlet (2 m) and 22 mm scavenging tube (2 m) |
| Rodent anesthesia system | Vet-Tech | AN001B | Including animal face-mask suitably sized for animal of interest and isolflurane vaporizer |
| Sterile physiological saline | Thermo Scientific Oxoid | BO0334B | |
| Syringes 0.3 mL U-100 insulin | Terumo | 29G × 1/2'' - 0.33 × 12 mm, for intravenous injection of radiotracer | |
| Veterinary Scavenger | Vet-Tech | AN200 | VetScav filter weighing mechanism - 240 V with automatic temperature compensation and LED system |
| 5) In vivo data analysis. | |||
| Tera-Tomo Monte Carlo based full 3D iterative algorithm | Mediso Medical Imaging System, Budapest, Hungary | ||
| VivoQuant Software | Invicro LLC., Boston, USA | ||
| 6) Ex vivo analyses | |||
| 2-Methylbutane | Sigma | 59070-1L-D | Pre-cooled over liquid nitrogen to freeze OCT-embedded tissues |
| Bovine Serum Albumin (BSA) | Sigma | 85040C | |
| Cover slips 22×50 mm | VWR International | SMITMCQ211022X50 | |
| Cryostat, e.g. Cryostat MNT | SLEE Medical | two-piece modular histology embedding machine equipped with an embedding module, a tissue storage compartment and a cold plate | |
| Cy5 AffiniPure Goat anti-Rabbit IgG (H+L) | Jackson/Stratech | 111-175-144 | Used at 1:500 (2 µg/mL) |
| Dabco | Sigma | 290734 | Stock 125 mg/mL |
| Microtome blades, e.g. Feather S35 | CellPath | ||
| Fluorescence Microscope (wide-field or confocal), e.g. Nikon Eclipse Ti-E Inverted Fluorescence Microscope | Nikon | Equipped with 10×, 20× (air) and ideally 40× (oil) objectives and lasers/filters or filter cubes, respectively, that are suitable for Hoechst 33342, GFP and Cy5 | |
| Automated Gamma Counter, e.g. 1282 Compugamma | LKB Wallac Laboratory | 99mTc-pertechnetate energy window 110-155 keV, 18F energy window 175-220 keV | |
| Hoechst 33342 solution | Life Technologies | H1399 | |
| Fluorescence adapter for dissecting microscope, e.g. NightSea Adapter | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters |
| O.C.T. compound | VWR international | 361603E | |
| Wax pen, e.g. PAP-PEN | Dako UK Ltd | Wax pen to draw around tissue section to reduce required staining/washing solution volumes | |
| Paraformaldehyde solution 4 % (w/v) in PBS | Santa Cruz Biotechnology | sc-281692 | |
| Rabbit anti-CD31 | Abcam | ab28364 | Polyclonal anti-mouse used 1:50 (20 µg/mL) for tissues immunofluorescence |
| Microscope slides, e.g. Superfrost slides | VWR, Lutterworth, UK | ||
| Tris-buffered saline (TBS) | available from various suppliers. | Tris-buffered saline; 150 mM NaCl, 25 mM Tris/HCl at pH 7.4 | |
Referenzen
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331 (6024), 1559-1564 (2011).
- Brader, P., Serganova, I., Blasberg, R. G. Noninvasive molecular imaging using reporter genes. J Nucl Med. 54 (2), 167-172 (2013).
- Fruhwirth, G. O., Diocou, S., Blower, P. J., Ng, T., Mullen, G. E. A whole-body dual-modality radionuclide optical strategy for preclinical imaging of metastasis and heterogeneous treatment response in different microenvironments. J Nucl Med. 55 (4), 686-694 (2014).
- Terrovitis, J., et al. Ectopic expression of the sodium-iodide symporter enables imaging of transplanted cardiac stem cells in vivo by single-photon emission computed tomography or positron emission tomography. J Am Coll Cardiol. 52 (20), 1652-1660 (2008).
- Seo, J. H., et al. Trafficking Macrophage Migration Using Reporter Gene Imaging with Human Sodium Iodide Symporter in Animal Models of Inflammation. J Nucl Med. 51 (10), 1637-1643 (2010).
- Diocou, S., et al. [18F]tetrafluoroborate-PET/CT enables sensitive tumor and metastasis in vivo imaging in a sodium iodide symporter-expressing tumor model. Scientific Reports. 7 (1), 946 (2017).
- Lajtos, I., et al. Cold wall effect eliminating method to determine the contrast recovery coefficient for small animal PET scanners using the NEMA NU-4 image quality phantom. Phys Med Biol. 59 (11), 2727-2746 (2014).
- Nagy, K., et al. Performance evaluation of the small-animal nanoScan PET/MRI system. J Nucl Med. 54 (10), 1825-1832 (2013).
- Deleye, S., et al. Performance evaluation of small-animal multipinhole muSPECT scanners for mouse imaging. Eur J Nucl Med Mol Imaging. 40 (5), 744-758 (2013).
- Portulano, C., Paroder-Belenitsky, M., Carrasco, N. The Na+/I- symporter (NIS): mechanism and medical impact. Endocr Rev. 35 (1), 106-149 (2014).
- Dohan, O., et al. The sodium/iodide Symporter (NIS): characterization, regulation, and medical significance. Endocr Rev. 24 (1), 48-77 (2003).
- Jauregui-Osoro, M., et al. Synthesis and biological evaluation of [F-18]tetrafluoroborate: a PET imaging agent for thyroid disease and reporter gene imaging of the sodium/iodide symporter. Eur J Nucl Med Mol Imaging. 37 (11), 2108-2116 (2010).
- Weeks, A. J., et al. Evaluation of [18F]-tetrafluoroborate as a potential PET imaging agent for the human sodium/iodide symporter in a new colon carcinoma cell line, HCT116, expressing hNIS. Nucl Med Commun. 32 (2), 98-105 (2011).
- Khoshnevisan, A., et al. [(18)F]tetrafluoroborate as a PET tracer for the sodium/iodide symporter: the importance of specific activity. EJNMMI Res. 6 (1), 34 (2016).
- Groot-Wassink, T., et al. Noninvasive imaging of the transcriptional activities of human telomerase promoter fragments in mice. Cancer Res. 64 (14), 4906-4911 (2004).
- Chen, L., et al. Radioiodine therapy of hepatoma using targeted transfer of the human sodium/iodide symporter gene. J Nucl Med. 47 (5), 854-862 (2006).
- Sieger, S., et al. Tumour-specific activation of the sodium/iodide symporter gene under control of the glucose transporter gene 1 promoter (GTI-1.3). Eur J Nucl Med Mol Imaging. 30 (5), 748-756 (2003).
- Chisholm, E. J., et al. Cancer-specific transgene expression mediated by systemic injection of nanoparticles. Cancer Res. 69 (6), 2655-2662 (2009).
- Klutz, K., et al. Targeted radioiodine therapy of neuroblastoma tumors following systemic nonviral delivery of the sodium iodide symporter gene. Clin Cancer Res. 15 (19), 6079-6086 (2009).
- Merron, A., et al. Assessment of the Na/I symporter as a reporter gene to visualize oncolytic adenovirus propagation in peritoneal tumours. Eur J Nucl Med Mol Imaging. 37 (7), 1377-1385 (2010).
- Merron, A., et al. SPECT/CT imaging of oncolytic adenovirus propagation in tumours in vivo using the Na/I symporter as a reporter gene. Gene Ther. 14 (24), 1731-1738 (2007).
- Dingli, D., et al. Combined I-124 positron emission tomography/computed tomography imaging of NIS gene expression in animal models of stably transfected and intravenously transfected tumor. Mol Imaging Biol. 8 (1), 16-23 (2006).
- Carlson, S. K., et al. Quantitative molecular imaging of viral therapy for pancreatic cancer using an engineered measles virus expressing the sodium-iodide symporter reporter gene. AJR Am J Roentgenol. 192 (1), 279-287 (2009).
- Barton, K. N., et al. GENIS: gene expression of sodium iodide symporter for noninvasive imaging of gene therapy vectors and quantification of gene expression in vivo. Mol Ther. 8 (3), 508-518 (2003).
- Siddiqui, F., et al. Design considerations for incorporating sodium iodide symporter reporter gene imaging into prostate cancer gene therapy trials. Hum Gene Ther. 18 (4), 312-322 (2007).
- Rad, A. M., et al. AC133+ progenitor cells as gene delivery vehicle and cellular probe in subcutaneous tumor models: a preliminary study. BMC Biotechnol. 9, 28 (2009).
- Hwang do, W., et al. Noninvasive in vivo monitoring of neuronal differentiation using reporter driven by a neuronal promoter. Eur J Nucl Med Mol Imaging. 35 (1), 135-145 (2008).
- Edmonds, S., et al. Exploiting the Metal-Chelating Properties of the Drug Cargo for In Vivo Positron Emission Tomography Imaging of Liposomal Nanomedicines. ACS Nano. 10 (11), 10294-10307 (2016).
- Zhang, R., et al. Probing the Heterogeneity of Protein Kinase Activation in Cells by Super-resolution Microscopy. ACS Nano. 11 (1), 249-257 (2017).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. Am J Physiol Cell Physiol. 300 (4), C723-C742 (2011).
- Pulaski, B. A., Ostrand-Rosenberg, S. Mouse 4T1 breast tumor model. Curr Protoc Immunol. , (2001).
- Workman, P., et al. Guidelines for the welfare and use of animals in cancer research. Br J Cancer. 102 (11), 1555-1577 (2010).
- Foster, B., Bagci, U., Mansoor, A., Xu, Z., Mollura, D. J. A review on segmentation of positron emission tomography images. Comput Biol Med. 50, 76-96 (2014).
- Otsu, N. A Threshold Selection Method from Gray-Level Histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Kinahan, P. E., Fletcher, J. W. Positron emission tomography-computed tomography standardized uptake values in clinical practice and assessing response to therapy. Semin Ultrasound CT MR. 31 (6), 496-505 (2010).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- Snapp, E. L., et al. Formation of stacked ER cisternae by low affinity protein interactions. J Cell Biol. 163 (2), 257-269 (2003).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Hume, S. P., Gunn, R. N., Jones, T. Pharmacological constraints associated with positron emission tomographic scanning of small laboratory animals. Eur J Nucl Med. 25 (2), 173-176 (1998).
- O'Doherty, J., et al. 18F-Tetrafluoroborate, a PET Probe for Imaging Sodium/Iodide Symporter Expression: Whole-Body Biodistribution, Safety, and Radiation Dosimetry in Thyroid Cancer Patients. J Nucl Med. 58 (10), 1666-1671 (2017).
- Couzin-Frankel, J. Breakthrough of the year 2013. Cancer immunotherapy. Science. 342 (6165), 1432-1433 (2013).
- Boardman, D. A., et al. Expression of a Chimeric Antigen Receptor Specific for Donor HLA Class I Enhances the Potency of Human Regulatory T Cells in Preventing Human Skin Transplant Rejection. American Journal of Transplantation. , (2017).
- Rashid, T., Takebe, T., Nakauchi, H. Novel strategies for liver therapy using stem cells. Gut. 64 (1), 1-4 (2015).
- Ellison, G. M., et al. Adult c-kit(pos) cardiac stem cells are necessary and sufficient for functional cardiac regeneration and repair. Cell. 154 (4), 827-842 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten