Method Article
Radionuclídeo-fluorescência Gene do repórter de imagem para controlar a progressão do Tumor em modelos de roedores Tumor
Neste Artigo
Resumo
Descreveremos um protocolo para pré-clínicos em vivo rastreamento de metástases. É baseado em um repórter de radionuclídeos-fluorescência combinando o symporter de iodeto de sódio, detectado pelo não-invasiva [18F] tetrafluoroborate-animal de estimação e uma proteína fluorescente para confirmação simplificada ex vivo . O método é aplicável para pré-clínicos na vivo celular rastreamento além da biologia do tumor.
Resumo
Metástase é responsável pela maioria das mortes por cancro. Apesar de inúmeras pesquisas, a compreensão mecanicista dos complexos processos que regem a metástase permanece incompleta. Modelos in vivo são primordiais para a pesquisa de metástase, mas exigem refinamento. Rastreamento de metástases espontânea pelo não-invasivo na vivo imagem agora é possível, mas permanece um desafio que requer observação de longa data e alta sensibilidade. Descrevemos um longitudinal combinada radionuclídeo e fluorescência corpo inteiro na vivo abordagem para controlar a progressão do tumor e metástases espontânea de imagem. Esta metodologia de gene repórter emprega o iodeto de sódio symporter (NIS) fundida a uma proteína fluorescente (FP). As células cancerosas são projetadas para NIS-FP expressa estàvel, seguido de seleção com base na classificação de fluorescência-ativado da pilha. Modelos de tumor correspondentes são estabelecidos em camundongos. NIS-FP expressando as células cancerosas são controladas não invasiva na vivo a nível de todo o organismo, por emissão de positrões (PET) usando o NIS radiotracer [18F] BF4–. Animal de estimação é atualmente o mais sensível na vivo tecnologia disponível nesta escala de imagem e permite a quantificação confiável e absoluta. Métodos atuais dependem de grandes coortes de animais que são sacrificados para avaliação de metástase em diferentes pontos do tempo ou confiam nas imagens 2D quase não quantificáveis. As vantagens do método descrito são: (i) altamente sensível invasivo na vivo 3D PET imaging e quantificação, (ii) automatizada produção traçador de PET, (iii) uma redução significativa no número de animais necessário devido às opções de repetição de imagem, (iv). a aquisição de dados emparelhados de sessões subsequentes de imagem, proporcionando melhor dados estatísticos e (v) a opção intrínseca para confirmação ex vivo de células cancerígenas nos tecidos por microscopia de fluorescência ou citometria. Este protocolo, descreveremos todos os passos necessários para rotina NIS-FP-oferecidas invasivo na vivo câncer celular rastreamento usando PET/CT e ex vivo de confirmação dos resultados na vivo . Este protocolo tem aplicações além da pesquisa sobre o câncer, sempre que na vivo a localização, ampliação e monitoramento de longa data de uma população celular é de interesse.
Introdução
Doença metastática é a causa para a maioria das mortes relacionadas ao câncer 1. Apesar de inúmeras pesquisas em processos metastáticos, monitoramento confiável de metástases em sistemas modelo animal é difícil de alcançar. Recentes avanços em tecnologias de imagem de corpo inteiro e abordagens de imagiologia multimodais permitiram invasivo na vivo celular rastreamento2,3,4,5. Este último pode ser usado como uma ferramenta para monitorar a presença, distribuição, quantidade e viabilidade de células, de forma não-invasiva e repetidamente em um animal vivo ou um ser humano.
O objetivo do método descrito aqui é para longitudinalmente e de forma não-invasiva acompanhar as células cancerosas em 3D em modelos de tumor roedores vivos. Usando esse método, os pesquisadores será capazes de quantificar com precisão a progressão do tumor incluindo propagação metastática em 3D. Em comparação com as técnicas tradicionais não baseados em imagem latente, este método oferece a aquisição de dados quantitativos com o número de animais em grande parte reduzida. Outra característica desse método é que permite a correlação da imagem latente na vivo com análise simplificada a jusante ex vivo das células controladas em tecidos colhidos por histologia ou citometria de3,6.
A justificativa para o desenvolvimento deste método era fornecer uma ferramenta na vivo para o acompanhamento e a quantificação do processo inteiro metastático em modelos de roedores do tumor. Importante, ele foi projetado para minimizar o uso de animais e, ao mesmo tempo, reduzir a variabilidade de animal para animal. Imagem longitudinal de corpo inteiro invasivo é excelentemente adequada para informar na consequência metastática, para que por si é difícil de prever com precisão o tempo e o local de sua ocorrência. Imagens 3D de todo o corpo, portanto, tem sido o centro de desenvolvimento de um método. Para fechar a lacuna de escala entre todo o corpo na vivo imaging e potencial a jusante ex vivo confirmação histológica, uma abordagem de imagem com base em um repórter radionuclídeo de modo duplo-fluorescência multi-escala foi adotaram3, 6.
Tomografia por emissão de pósitrons (PET) é a mais sensível 3D corpo inteiro imagem tecnologia atualmente disponível, oferecendo excelente profundidade penetração e quantificação absoluta7 com uma resolução de < 1 mm8,9. Atualmente, pré-clínicos celular rastreamento a nível de todo o corpo pela imagem latente do radionuclídeo confiável pode detectar células em densidades de ~ 1.000 células por volume de 1 milhão de células de3,6 com resoluções na região sub milímetros. Ao contrário de microscopia intravital, que não consigo detectar o único espalhar as células cancerosas, mas não requer procedimentos cirúrgicos (por exemplo, câmaras de janela), não está limitado a um pequeno campo de visão e não tecido de baixa penetração e dispersão. Imagens de bioluminescência fornece uma alternativa barata, mas é associada com a dispersão e problemas de absorção da luz, bem como a penetração de profundidade pobre e consequentemente severamente limitada na quantificação2. Imagem de corpo inteiro de fluorescência tem sido utilizada para a aquisição de imagens 3D, mas é muito menos sensível em comparação com bioluminescência ou radionuclídeos tecnologias2. Não obstante, fluorescência oferece a oportunidade de realizar ex vivo tecido a jusante a análise por citometria ou microscopia. O último fecha a diferença de escala entre imagem de corpo inteiro macroscópica (resolução mm) e fluorescência microscópico tecido análise (resolução µm)3. Portanto, radionuclídeos e fluorescência modalidades se complementam, que vão desde o nível de corpo inteiro à escala celular (sub-).
Imagens de gene repórter é ideal para celular prolongada de rastreamento conforme exigido na pesquisa de metástase. Nesta aplicação é superior à célula direta rotulando como é (i) não afetado pela diluição de rótulo e, portanto, não limitado no tempo de acompanhamento e (ii) melhor reflete o número de células vivas. Consequentemente, todo o corpo celular de rastreamento é particularmente útil para aplicações em que células rastreáveis proliferaram ou expandir na vivo, por exemplo, em câncer, pesquisa3,6, para a detecção da formação de teratoma no tronco pesquisa de célula, ou para a quantificação de imune celular expansão5.
Vários genes repórter baseado em radionuclídeos são disponíveis2. Estes incluem enzimas como a herpes simplex vírus HSV11 timidina quinase (HSV1 -tk), transportadores, tais como o iodeto de sódio symporter (NIS) ou o transportador de norepinefrina (NET), bem como receptores de superfície celular como a dopamina D2 receptor ( D2R). NIS é uma proteína trans-membrana glicosilados que medeia activamente a captação de iodeto, por exemplo, em células foliculares na glândula tireoide para a posterior síntese de hormônios da tireoide10. Este processo é conduzido pela symport do at+ e depende do gradiente de celular de sódio, que é mantido pela nd+/k+-ATPase11. Consequentemente, NIS reflecte melhor a vida celular números do que outros repórteres como captação de iodeto/radiotracer está ligada a uma ativo Na+/k+ gradiente ao invés da mera presença do transportador. Tradicionalmente, a radioiodide tem sido usado para a imagem latente de NIS. Para o rastreamento de pilha, radiotracers de NIS alternativos que não são metabolicamente aprisionados na tireoide foram relatados para ser superior6. Este recentemente desenvolvido PET radiotracer [18F] tetrafluoroborate ([18F] BF4–)12,13 mostra farmacocinética superior em comparação com radioiodide6 estando disponível em atividades específicas de alto14 , sem a necessidade de instalações complexas de radioquímica. [18-F] BF4– podem ser sintetizados através de duas maneiras diferentes. O primeiro método é baseado na troca de isótopo não-radioativo 19F em BF4– com radioativo 18F12. O segundo método é através da adição de 18F de trifluoreto de boro não-radioativo14. O último método foi relatado para produzir maior actividades específicas14 e é o método de escolha para a imagem latente pré-clínicos.
NIS é altamente expressa em tecidos da tireoide. Também é expressa em glândulas mamárias salivares, lacrimais e lactantes, bem como o estômago, mas em níveis mais baixos em comparação com a glândula tireoide10. Portanto, imagem excelente contraste em outras regiões do corpo pode ser alcançada usando o NIS. É também altamente homólogo entre humanos, rato e do rato10. Além disso, não existem relatos de toxicidade sobre expressão ectópica de NIS em células não-thyroidal. Importante, NIS também não foi associado com o anfitrião respostas imunes, nem em humanos nem em roedores. NIS tem sido usado como um gene repórter, para medir o promotor atividade15,16,17 e gene expressão18,19,20,21,22 ,23 , em vários contextos diferentes. Ele também tem sido usado para tratamento de imagens não-invasivo de terapia de gene a vetores24,25e para rastrear células cardíacas4, hematopoiéticas26, inflamação5e estudos neurais27. Recentemente, NIS também tem sido usado como um gene repórter para rastrear metástases de câncer em vivo3,6.
Em resumo, as principais vantagens deste método sobre técnicas anteriores são: (i) altamente sensível invasivo 3D na vivo localização e quantificação de metastático espalhar, (ii) automatizada produção de [18F] BF4– no atividades de molares alto, (iii) uma redução significativa nos animais necessários através de imagem longitudinal, (iv) a aquisição de dados emparelhados de sessões subsequentes de imagem, resultando em dados estatísticos melhorados, que por sua vez mais reduz o uso de animais e (v) a opção intrínseca para confirmação ex vivo de células cancerígenas nos tecidos por microscopia de fluorescência e citometria.
Protocolo
Este protocolo atende todos os requisitos estabelecidos pela legislação do Reino Unido (UK) e o painel de revisão ética local. Quando este protocolo a seguir, certifique-se de que procedimentos também satisfaçam todas as exigências ditadas pela legislação nacional e local do painel de revisão ética. Certifique-se de todas as experiências que envolvam radioatividade é realizada de forma segura e em conformidade com a legislação e as normas locais.
1. Engenharia e caracterização de células cancerosas para expressar o repórter de fusão de radionuclídeos-fluorescência NIS-FP
Nota: Para simplificar, mEGFP A206K é abreviado como "GFP" e mCherry como "RFP" nas seções subsequentes do presente protocolo.
- Geração de particulas de Lentivirus
- Para produzir partículas de lentivirus, co transfect 293T células com o quatro plasmídeo seguinte usando um método adequado de transfeccao: (i) o gene repórter codificação do plasmídeo (pLNT SFFV NIS-GFP ou pLNT SFFV NIS-RFP (Veja informações complementares), (ii) a terceira geração Lentivirus embalagem plasmídeos pRRE e (iii) pRSV-Rev e plasmídeo (iv) um vírus envelope contendo, por exemplo, pMD2.G. Pré-mix plasmídeos antes de adicioná-los à mistura do transfection. Execute a transfeccao numa vizinhança de cultura celular.
Nota: Informações adicionais do transfection constam informações suplementares. - Avalie o sucesso de transfeccao após 48 h por microscopia de fluorescência de campo amplo padrão com as configurações de filtro apropriadas para o repórter de fusão escolhido (GFP-NIS ou NIS-RFP).
Nota: Os sinais de fluorescência são indicativos de transfecção do gene repórter e, portanto, apenas um substituto para transfeccao co bem sucedido, não um indicador de produção bem sucedida do vírus. - Colher o sobrenadante contendo partículas de vírus usando uma seringa e remover células flutuantes e restos celulares por filtragem através de um filtro de polietersulfona estéril (PES) de 0,45 µm. Transfira para um tubo de reação polipropileno estéril 1,5 mL. Realizar o trabalho de vírus em uma capa de cultura celular e garantir que nenhum vírus vivo deixa o ambiente fechado.
- Para produzir partículas de lentivirus, co transfect 293T células com o quatro plasmídeo seguinte usando um método adequado de transfeccao: (i) o gene repórter codificação do plasmídeo (pLNT SFFV NIS-GFP ou pLNT SFFV NIS-RFP (Veja informações complementares), (ii) a terceira geração Lentivirus embalagem plasmídeos pRRE e (iii) pRSV-Rev e plasmídeo (iv) um vírus envelope contendo, por exemplo, pMD2.G. Pré-mix plasmídeos antes de adicioná-los à mistura do transfection. Execute a transfeccao numa vizinhança de cultura celular.
- Transdução e a seleção de linhas de células de câncer expressando NIS-FP
- Use o vírus puro fresco da etapa 1.1.3 misturado 1:1 (v/v) com o meio de crescimento ideal de cada linhagem de células de câncer (DMEM para células MDA-MB-231 e RPMI 1640 para células 4T1; Veja a tabela de materiais para composição de mídia). Execute a transdução de um capuz de cultura celular.
Nota: Um protocolo mais geral é referido em informações complementares. - Transduce células cancerosas com vírus contendo médio em uma incubadora com umidificado atmosfera contendo 5% (v/v) CO2 a 37 ° C por 72 h (trabalho em escala 6-poços ou 12-bem usando 1ml ou 0,4 mL da mistura de vírus da etapa 1.2.1).
- Monitorar a expressão NIS-FP célula-alvo por microscopia de fluorescência.
- Expanda células transduzidas com êxito para uma escala de 3 milhões células usando as condições de cultura padrão (consulte ATCC para linhas de celular MDA-MB-231 e 4T1).
- Use fluorescência-ativado da pilha (FACS) de classificação para purificar células expressando de NIS-FP de células não-transfectadas.
Nota: FACS pode ser uma fonte de infecções de micoplasma; recomenda-se verificar para o micoplasma antes da produção de vírus e transdução mas também depois da FACS e antes passo 1.3.
- Use o vírus puro fresco da etapa 1.1.3 misturado 1:1 (v/v) com o meio de crescimento ideal de cada linhagem de células de câncer (DMEM para células MDA-MB-231 e RPMI 1640 para células 4T1; Veja a tabela de materiais para composição de mídia). Execute a transdução de um capuz de cultura celular.
- Linhas de células de câncer expressando caracterização NIS-FP
- Confirme a expressão de repórter por citometria de fluxo padrão conforme descrito em outro lugar,28.
- Confirme a repórter integridade pelo immunoblotting padrão conforme descrito em outro lugar29.
- Analise a localização de repórter de fusão intracelular por microscopia de fluorescência confocal.
Nota: Com a coloração ou expressão co de uma membrana plasmática marcador6 e posterior localização co análise30 irá facilitar essa etapa. - Analise o consumo de radiotracer em linhas de células expressando NIS-FP.
Nota: Qualquer substrato de NIS radioativo compatível com o equipamento existente é adequado, por exemplo, os isótopos de iodeto (123eu-, 124eu-, 125eu-, 131eu–), 99 m TcO4-, 188ReO4-, [18F] Então3F– ou [18F] BF4–.- Purificado de semente 106 células em placas de 6-poços em seu meio de crescimento ideal antes de um dia (ver tabela de materiais) para o experimento. Preparar todas as amostras em triplicata e incluem amostras de controlo: (i) "controles de especificidade", ou seja, NIS-FP expressando células pré-incubadas com um substrato de NIS do competidor para testar a especificidade de captação; (ii) "controles de célula parental", ou seja, as células não expressando NIS-FP, mas recebendo radiotracer para teste de captação basal em células parentais.
- Na manhã seguinte, lave as células uma vez com o meio de crescimento livre de soro.
- Incube as células em um meio livre de soro na presença de 50 kBq 99mTcO4– ou [18F] BF4– por 30 min a 37 ° C (volume total de 1 mL). Para controles de especificidade, pre-Incube as celulas por 30 min com o substrato do competidor NaClO4– (concentração final de 12,5 µM). Manter a concentração de substrato competitivo constante durante todo o experimento.
- Recolher o sobrenadante e transferir 100 µ l para um tubo de coleta preparado rotulado "flutuante".
- Lave as células duas vezes com 1 mL gelada tampão fosfato salino (PBS) contendo Ca2 +/ mg2 +. Recolher cada solução de lavagem e transferir 100 µ l de cada num tubo de colheita preparado rotulado "wash1" ou "wash2", respectivamente.
- Levante as células adicionando 500 PBS de µ l contendo tripsina 0,25% (p/v) e 0,53 mM EDTA e incubar a 37 ° C, até que as células desanexar (Verifique visualmente usando um microscópio). Transferi a suspensão num tubo de colheita preparado rotulado "células". Lavar os poços com 500 µ l gelada PBS contendo Ca2 +/ mg2 + e adicionar ao tubo de "células". Granule as células por centrifugação (250 x g, 4 min, 4 ° C).
- Contagem de todos os quatro tipos de amostra de cada poço usando uma gama combater adequadamente definida para o radioisótopo de escolha (aqui: 99mTc ou 18F).
Nota: Devido ao grande número de amostras neste ensaio, é recomendável usar um γ-contador automatizado capaz de correção automática de decadência. - Analise dados somando gama obtidos contagens de amostras de cada poço de determinar uma contagem total de radioatividade por bem.
Nota: Tome alíquotas nas etapas 1.3.4.4 e 1.3.4.5 em conta pela multiplicação de números por 10 para "flutuante" e "lavar" fracções. - Expressa a absorção celular radiotracer como % absorção conforme indicado em Equ.1. Calcule as médias e desvios-padrão dos experimentos triplicados.
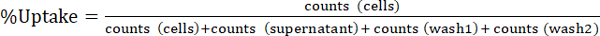 (Equ.1)
(Equ.1)
Nota: Aqui, as experiências de validação do repórter são descritas, mas não relacionadas a repórter funções celulares (por exemplo, a proliferação, invasão de células de câncer, expressão gênica, etc.), finalmente, são específicas do aplicativo e a responsabilidade de cada usuário.
2. estabelecimento de modelos de tumor na vivo
- Use somente totalmente caracterizado e validado células para experiências na vivo . Verifique a fluorescência das células antes da administração por qualquer técnica apropriada (por exemplo, a microscopia de fluorescência, citometria de fluxo) em todas as ocasiões.
- Estabelecer o modelo de tumor em ratos fêmeas de 5-6 semanas de idade jovem-adulta. Use BALB/cAnNCrl ou camundongos BALB/cAnN.Cg-Foxn1nu (BALB/c nu) para o modelo de tumor 4T1 e NOD. CG-Prkdcscid Il2rgtm1WjI/SzJ ratos (NSG) para o modelo MDA-MB-231-baseado do tumor. Raspar os animais localmente e utilizar técnica asséptica. Injetar diretamente 50 µ l de uma suspensão contendo 106 NIS-FP expressando câncer células/mL para a almofada de gordura mamária entre o quarto e o quinto mamilo31.
Nota: Para melhorar a precisão de injeção, é recomendável executar a injeção sob anestesia geral, utilizando um anestésico inalável como isoflurano (1-2% (v/v) em O2).
Nota: Através da implantação cirúrgica de pedaços de tumor de tumores expressando NIS-FP é uma abordagem alternativa para tumor modelo estabelecimento31. - Verifique a fluorescência das células em locais de injeção após a administração e a primeiros dias pós injeção. Use uma fluorescência tocha e filtro óculos apropriado para o FP de escolha.
- Monitorar o crescimento do tumor e verificar se há quaisquer sinais clínicos (especialmente em pontos de tempo posteriores).
Nota: Para os tumores superficiais, ou seja, o ortotópico de mama tumores no presente protocolo, uso de pinças e a fórmula para o diâmetro médio do tumor (MTD) = ½· (L + W) 32.
3. produção de [18 F] BF 4– usando uma plataforma de síntese (ARS) radiotracer automatizado.
Nota: Aqui, a síntese de4– BF automatizado [18F] baseada no método de adição de 18F de trifluoreto de boro é descrita. Os usuários de uma plataforma de ARS mais amplamente disponível (ver tabela de materiais), pode baixar o arquivo correspondente de Extensible Markup Language (XML) necessário para executar a sequência automatizada nesta plataforma (arquivo complementar). Uma explicação detalhada sobre o layout de gaveta, mostrado na Figura 1 é fornecida em (tabela 1) bem como uma descrição detalhada de cada etapa no arquivo XML de sequência (tabela 2) para apoiar a tradução para qualquer outra plataforma automatizada.
- Configurar a plataforma ARS, conforme descrito na tabela 1 e garantir é operacional com o arquivo XML correto carregado para o computador de controle. Certifique-se de que plataforma ARS é colocada em um capuz químico apropriado para o trabalho seguro com GBq quantidades de radioactividade.
- Aspire o ciclotron-produzido [18F] F– (normalmente 1,5 a 2 GBq em 2-7 mL [18O] H2O) através do reservatório de entrada (V6).
- Armadilha a radioatividade em uma resina de troca de ânion (por exemplo, quaternário de amônio ânion troca cartucho; V5 para V4), recuperar o [18O] H2O em um frasco separado (V1).
- Eluir o [18F] F– (eluição reversa, V5 para V4) no reator (V8) com 750 µ l de solução salina 0,9% (p/v) (V2), seguido por 1,5 mL de acetonitrilo (V16).
- Remova a água por evaporação azeotrópica sob vácuo e nitrogênio fluxo por aquecimento a 105 ° C e 120 ° C por 5 min.
- Reduza a temperatura do reator para 80 ° C.
- Adicionar 800 µ l de 5-15-coroa em acetonitrila anidra (46 mg, 0,21 mmol) para o seco [18F] F– através do orifício central do reator (V8).
- Adicione 850 µ l de BF3. OEt2 em acetonitrila anidra (0,16 mg, 1.13 µmol) para o reator.
- Reagir por 5 min, quando retornava à temperatura ambiente.
- Passe a mistura de reação através de um cartucho de óxido de alumínio (V17 a V18) para prender o trifluoroborate.
- Voltar a mistura de reação à seringa S2 e diluir com água (aprox. 1,6 mL).
- Passe a mistura de reação através de um segundo cartucho de troca de ânion (V19 para V20) para interceptar o produto de4– BF [18F].
- Lave o reator com água (aprox. 5,5 mL).
- Passe a solução resultante através do alumina e segundo cartuchos de troca de ânion.
- Seringas S2 e S3 com água de enxágue.
- Lavar o segundo cartucho de troca de ânion com água e secá-lo com gás nitrogênio.
- Eluir o produto (V19 para V20) com 1 mL de 0,9% NaCl (V14) em seringa S3.
- Transferi o produto (400-500 µ l) através da linha de saída (V21) para um frasco de recolha de vidro de 1 mL.
Nota: Atividade Molar é um aspecto importante de cada radiotracer. No entanto, sua determinação de rotina não é apenas demorada mas também requer uma quantidade significativa do recém sintetizada [18F] BF4-, tal que se torna um fator limitante para o número de animais que pode ser fotografada. Para testar a reprodutibilidade e atividades molares da resultante [18F] BF4–, recomenda-se agendar algumas execuções de teste dedicadas para esta finalidade. Para obter mais detalhes sobre atividades molares, por favor consulte a seção de discussão.
4. in vivo por imagens do NIS-FP expressando células por nanoPET/CT
- Preparação de animais
- Ratos com isoflurano 1,5-2,0% (v/v) em O2 com um caudal de 1,0-1,5 L/min em uma câmara de indução de anestesia. Para verificar se há suficiente olhar de anestesia para a ausência do pedal reflexo.
- Certifique-se para aplicar vet pomada nos olhos de animais para evitar ressecamento enquanto sob anestesia
- Mova o mouse sobre uma placa de aquecimento com o nariz em uma máscara anestésica abastecimento e aquecer a cauda (por exemplo, mergulhando-o em água de 37 ° C ou usando uma lâmpada de luz infravermelha).
- Dilua a solução recentemente preparada estéril filtrada [18F] BF4– MBq 5 por 50 µ l com solução salina 0,9%.
- Usar uma seringa conectada a uma agulha hipodérmica (bitola 29-31), desenhar 100 µ l da solução [18F] BF4– , medir a radioatividade na seringa e observe o valor e o tempo da medição.
- Administre por via intravenosa 50 µ l da solução [18F] BF4– na veia da cauda previamente aquecido.
- Medir a radioatividade remanescente na seringa e observe o valor e o tempo da medição. A diferença entre os valores medidos em etapas 4.1.7 e 4.1.5 é a dose injetada (ID).
- Definir um temporizador de contagem regressiva de 45 min (começar a época das imagens de PET = 0 min).
- Coloque o mouse sobre a cama do scanner nanoPET/CT e garantir que o fornecimento do anestésico é corretamente novamente conectado.
- Verifique a anestesia permanece completa por meio de testes para a ausência do pedal reflexo.
- Certifique-se o mouse é posicionado sobre a cama da forma desejada, por exemplo, a Esfinge' '-como posição.
- Instale dispositivos de monitoramento de animais de acordo com as recomendações do fabricante, por exemplo, uma sonda de temperatura rectal, uma sonda de medição animal respirando, ou eletrodos para gravação de eletrocardiogramas. Verificar o funcionamento de todos os instrumentos.
Nota: Para testes de especificidade in vivo com o NIS radiotracer [18F] BF4–, os animais são fotografados como descrito acima e então descansou acordados até a radioatividade é deteriorado suficientemente para ser considerado insignificante, por exemplo, a radioatividade residual 18F 48 h mais tarde, quando a única 1.3·10−6% vai estar presente no animal. Na sessão de imagens subsequente, o substrato do competidor ClO4– é administrado na dose de 200 mg/kg 30 min antes da administração de radiotracer e imagem latente é executada conforme descrito acima.
- Imagem por nanoPET/CT
- Definir os desejado CT imagens parâmetros, por exemplo, usando a tensão de tubo nanoPET/CT 55 kVp, definir o tempo de exposição a 1200 ms com um grau angular pisando e projeções de 180 graus.
- Defina os parâmetros para aquisição de imagens de PET. Uso estático scan parâmetros de PET com uma duração de 30 min, modo de coincidência de 1:5 e 400-600 keVp janela de energia.
- No tempo da contagem regressiva = 15 min iniciar aquisição de imagem de TC.
- No tempo da contagem regressiva = 0 min iniciar aquisição de imagens de PET.
- Imagem animal serial é necessários, deixar animais recuperar completamente da anestesia, ou seja, recuperar consciência sob supervisão. Posteriormente, transferi-los para uma unidade de manutenção.
- Se este é o terminal sessão de imagem, proceda à eutanásia de animais por qualquer overdose de anestésico, crescente concentração de dióxido de carbono, ou desconjunção do pescoço.
5. análise de dados na vivo
- Reconstrua os dados de PET/CT, usando um algoritmo iterativo totalmente 3D baseado em Monte Carlo. Certifique-se de que são consideradas modificações a atenuação, tempo morto e decaimento de radioisótopos. Para detalhes, consulte as instruções do fabricante do instrumento PET/CT em uso.
- Imagens de seleção CT e PET co estão registradas corretamente e salvar os dados em um formato de intercâmbio adequado como 'Digital Imaging and Communications in Medicine' (DICOM).
- Analisar imagens
- Carrega os arquivos DICOM reconstruídos em um software de análise de imagem adequada que permite o reconhecimento e a delimitação das regiões de interesse (ROIs) e quantificação de sinal PET subsequente nestes ROIs.
- Segmente o ROIs usando limiarização adaptativa ou manual para definir ROIs33,34 usando um pacote de software adequado. Informações da imagem anatômica da tomografia computadorizada ajudam guia ROI atribuição, por exemplo, tumores superficiais ou volumes de pulmão.
- Use o software de análise conforme as instruções do fabricante e certifique-se de dados são calibrados para a dose de radioatividade injetado e corrigidos para atenuação e decaimento radioativo.
- Desenhar gráficos apresentando dados desta quantificação na vivo . Expressos dados como qualquer % injetado dose/volume (%ID/mL) ou o valor padrão de captação (SUV), que é uma medida alternativa Considerando a radioatividade em todo o corpo do sujeito.
- Calcular os valores de %ID/g, assumindo que a densidade do tecido a ser como a água, ou seja, ~ 1 g/L. Vale ressaltar que esta suposição pode ser inválida para órgãos com densidades significativamente diferentes, como pulmão ou osso.
- Calcular SUVs diferentes para estimar o verdadeiro SUV (por exemplo. SUVmean, SUVmax); SUVmax é mais confiável para pequenos objetos e é usado com mais frequência do que SUVmean35.
6. análises ex vivo
Realizar as análises mencionadas a jusante: imagens de fluorescência (i) dos órgãos que contém células cancerosas fluorescente (tumor primário e metástases) durante a dissecação de animais, (ii) medição da distribuição de tecido radiotracer e (iii) histológica ou (iv) cytometric avaliação dos órgãos cancerosos.
- Medição da distribuição de radiotracer por γ-contagem (ex vivo biodistribuição) e imagem latente de fluorescência ex vivo dos tecidos cancerosos.
- Medir a radioatividade do animal morto inteiro e observe o valor e o tempo.
- Dissecar os animais e colher os seguintes tecidos: pulmão, coração, sangue (usando capilares de vidro de 20mm), fígado, estômago, rins, baço, intestinos pequenos e grandes, tireoide e glândulas salivares, um pedaço de músculo da perna e osso dos fêmures traseiras, e relevantes e dissectible gânglios linfáticos e tecidos cancerosos.
- Medir a radioactividade da carcaça restante primeiro incluindo, em seguida, excluindo a cauda e observe os valores e os tempos de medição.
Nota: Radioactividade na cauda pode ser considerada decorrente radiotracer que mis foi injetada e, portanto, não chegou a circulação; Portanto, esta quantidade de radiotracer não estava contribuindo para a dose injetada. A radioatividade de cauda também serve como um parâmetro retrospectivo de qualidade de injeção. - Pese todos os tecidos (usar tubos pré-pesados).
- Tira fotografias dos órgãos cancerosos na luz do dia e sob a luz de fluorescência.
Nota: Use um suporte de câmera para manter a distância entre a lente da câmera e órgão constante (ou usar um instrumento comercial específico para essa finalidade). - Incorporar os órgãos/tecidos destinados a jusante histologia em OCT ou mergulhe-os em formol para fixação. Para outras aplicações a jusante a preparação da amostra pode ser diferente.
- Prepare radiotracer padrões de calibração em duplicado, por exemplo, 0 a 1000 kBq [18F] BF4–.
Nota: Padrões de calibração são necessárias para (i) as contagens medidas por min relacionar valores de radioatividade (em kBq) e (ii) simplificar a correção de decadência; 18 F– pode substituir [18F] BF4–. - Contagem de todos os tecidos colhidos usando um contador-γ juntamente com padrões de calibração de radioactividade da etapa 6.1.7 a radioatividade. Observe o tempo de medição. Se taxas de contagem são muito altas (ou seja, fora da linearidade de calibração padrão ou indicada pelo detector muito alto morto vezes), re-contar as radiotracer amostras duas meias-vidas mais tarde.
- Apresente dados como %ID/g ou como valores padrão de captação (SUV) (Equ.2).
SUV =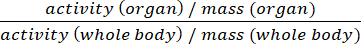 (Equ.2)
(Equ.2) - Descarte todos os tecidos colhidos que não são necessários para ainda mais a jusante análises de acordo com as regras locais de gestão de resíduos.
- Analisar os tecidos cancerosos por citometria ou histologia de acordo com as preferências do usuário e padrão protocolos (conforme descrito em outra parte3,6,28).
Resultados
O primeiro passo requer a engenharia genética de células cancerosas de interesse. Aqui, os resultados de Lentivirus transdução de células de câncer de mama metastático murino 4T1 inflamatórias e células humanas de MDA-MB-231 metastáticas com lentivirus partículas carregando DNA codificação GFP-NIS ou NIS-RFP são mostradas. Eficiências de transdução variaram entre linhas de células de câncer (Figura 2A, coluna da esquerda). No entanto, todos resultante transfectadas célula cancerosa linhas foram selecionadas pela FACS a pureza (Figura 2A, direita). Microscopia de fluorescência confocal (Figura 2B) demonstrou a localização correta de membrana plasmática de NIS-função FPs. NIS-FP foi quantificada usando captação radiotracer NIS-oferecidas (Figura 2-2E) e demonstrou função NIS e especificidade. Notavelmente, não há diferenças significativas entre 4T1. NIS-GFP e 4T1. Linhas de células expressando NIS-RFP com níveis de expressão de NIS semelhantes foram encontradas (Figura 2).
Após completa em vitro caracterização linha de celular, modelos de tumor foram criados com as linhas de célula de câncer rastreável recém-gerado. Como exemplo, o 4T1. Modelo de tumor de NIS-GFP, um modelo para câncer de mama inflamatório, é mostrado aqui (Figura 3). Em animais de tumor-rolamento longitudinal corpo inteiro PET imagem então informada na progressão do tumor incluindo propagação metastática (Figura 3B). O PET radiotracer [18F] BF4– era necessário para a imagem latente e recém produzido pela manhã de cada animal de estimação sessão de imagem. Síntese de [18F] BF4– foi realizada usando o método descrito de ARS. Normalmente, ~1.6 GBq 18F– foi usado como entrada e obteve ~ 244 MBq [18F] BF4– em 40.5±3.9 min (N = 17). O produto foi analisado por cromatografia em camada fina de rádio ou cromatografia iônica e mostrou uma pureza radioquímica de 94.7±1.4%. O rendimento de radioquímica foi 19.4±4.0% (decaimento-corrigida).
No dia 19, após a inoculação do tumor, o tumor primário foi claramente identificado usando PET, mas encontrado sem metástases. Dez dias depois (dia 29), os mesmos tumor-rolamento ratos foram re-imagens e metástase à distância em vários locais em todos os animais (metástase de pulmão, metástase para vários linfonodos inguinais e/ou axilares) foram identificados. O exemplo na Figura 3 mostrou metástase pulmonar extensa com vários nódulos claramente identificáveis e quantificáveis no pulmão (Figura 3B-3E). Além disso, o animal apresentou-se com disseminação regional do tumor em parede peritoneal, bem como metástase para o inguinal e os linfonodos axilares. Valores de ID % de metástases individuais no pulmão (Figura 3E) diferem amplamente, mas assim como os volumes ocupados dos nódulos metastáticos subjacentes. Em contraste, %ID/mL volume normalizado valores (Figura 3E) eram muito mais uniformes. Isto era compreensível para diferentes metástases em similares estágios de desenvolvimento (ou seja, desenvolvida entre os dias 19 e 29; Figura 3B). Em contraste, o valor de %ID/mL normalizado para o tumor primário foi menor do que aqueles para as metástases do pulmão, que está em consonância com uma massa tumoral que tinha mais tempo para progredir e remodelar incluindo o influxo de outros tipos de células (células do estroma, células do sistema imunológico) , particularmente neste modelo de câncer de mama inflamatório.
Guiado por imagens na vivo e a fluorescência das células cancerosas (visíveis durante a dissecção de animais sob a luz de fluorescência), pequenos órgãos profundos como linfonodos foram confiantemente colhidos e, ao mesmo tempo, avaliados para conteúdo (nódulo canceroso Figura 4A). Enquanto o sinal de fluorescência durante a dissecção de animais foi indicação presença de células do tumor, que era importante garantir que essa classificação foi acompanhada por ex vivo medições de radioactividade dos tecidos colhidos. Figura 4B mostra os valores padrão de captação (SUV) obtidos para os vários tecidos através de uma coorte de três animais, os quais apresentavam metástase. NIS-expressando endogenamente órgãos como a tireoide e glândulas salivares (colhidas combinados) ou o estômago também mostrou a absorção radiotracer alta esperada. Além disso, esta abordagem de NIS-FP permitiu a identificação de célula de câncer simples durante a histologia (Figura 4). Esses dados de exemplo de histologia de imunofluorescência mostram a vascularização do tumor no 4T1. Modelo de tumor de NIS-GFP. Esses dados também mostram que o repórter de NIS-GFP residido predominantemente nas membranas plasma do tumor células também na vivo (Figura 4), validando, assim, os resultados de absorção.
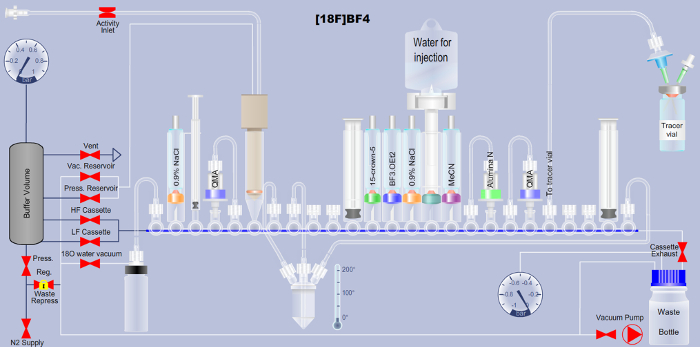
Figura 1. Esquema detalhando a montagem da plataforma de síntese radiotracer automatizados para a produção de [18F] BF4– através do método de adição de flúor-18-para-boro trifluoreto. Nomes de reagente são impressas em tubo correspondente no esquema. QMA é a abreviatura para troca de ânion de quaternário de amônio e indica o material utilizado separação cromatográfica de fase sólida. Detalhes adicionais estão disponíveis nas tabelas 1 e 2. Clique aqui para ver uma versão maior desta figura.
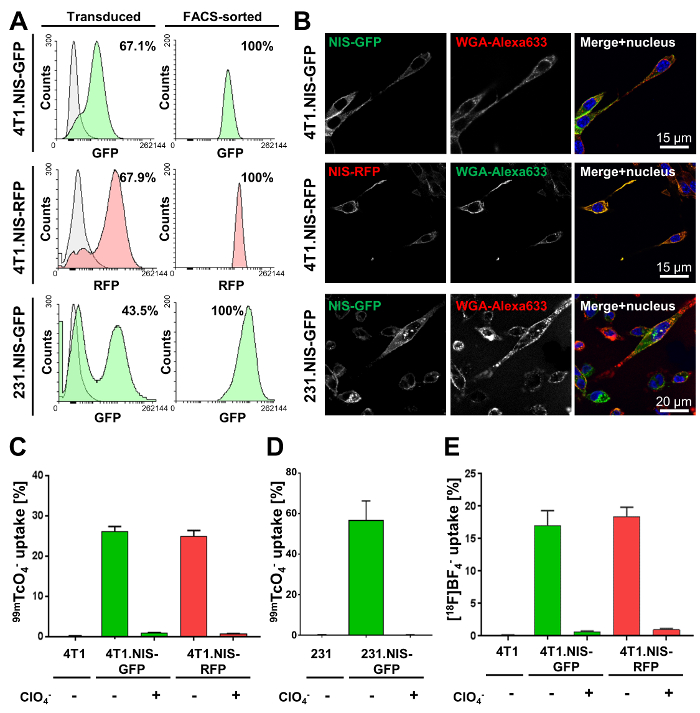
Figura 2. Resultados de caracterização típica de linhas de células de câncer estàvel expressando GFP-NIS ou NIS-RFP. (A) as linhas de célula indicada foram feitas utilizando lentivírus transferir ou NIS-GFP ou NIS-RFP. A coluna da esquerda mostra a população transduzida (verde ou vermelho fluorescente) em comparação com as respectivas células parentais (cinza; 4T1 e células MDA-MB-231, respectivamente). Porcentagens mostram eficiência de transdução, conforme determinado pela citometria de fluxo. A coluna da direita mostra os resultados de fluxo cytometric análises após a purificação de FACS das populações mistas na coluna da esquerda. Todas as linhas de celular foram encontradas para ser > 99% puro para indicado NIS-expressando células (por citometria de fluxo). (B) microscopia de fluorescência Confocal de linhas celulares purificado mostra a localização da membrana plasmática de GFP-NIS ou NIS-RFP em linhas celulares respectivos. WGA-Alexa633 foi usado como um marcador de membrana plasmática. (C, D) Validação funcional da proteína NIS-FP expressada no indicado recentemente gerado linhas de células de câncer. Função de NIS foi medida utilizando o radiotracer 99mTcO4– (50 kBq por milhões de células). Como controles, células parentais foram utilizadas bem como a fusão repórter expressando as células que foram tratadas com o perclorato de substrato co NIS antes e durante o ensaio (controle de especificidade). Os resultados demonstram claramente a função de NIS-FP e especificidade em todas as linhas de célula. (E) validação funcional de 4T1. Linhas de células de NIS-FP usando [18F] BF4– como um radiotracer para NIS. Todas as outras condições eram idênticas a (C). Importante, muito semelhante relativa absorção foram obtidos resultados para ambas as linhas de célula 4T1-derivado com ambos os radiotracers (Figura 2 e E), assim, justificando o uso intercambiável de ambos em vitro caracterização funcional de Linhas de células expressando NIS-FP. Clique aqui para ver uma versão maior desta figura.
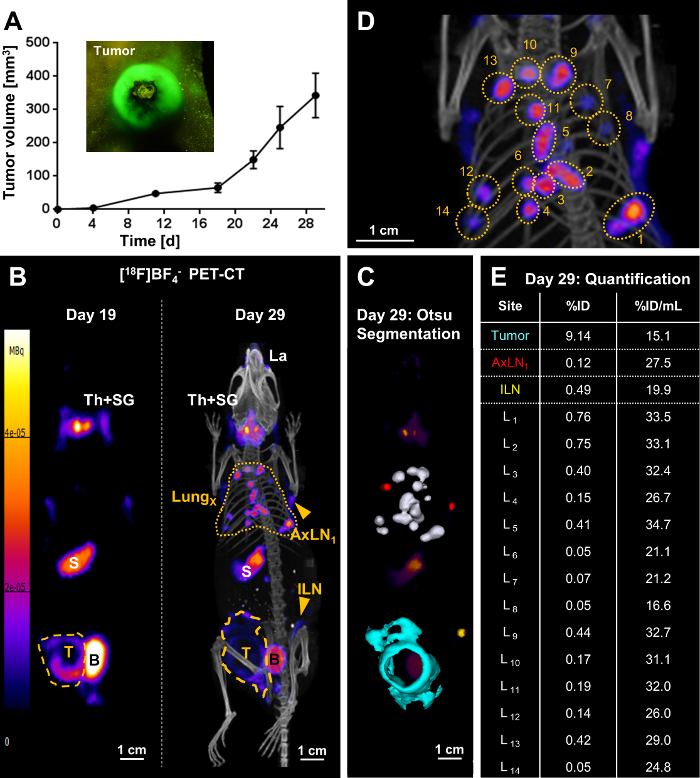
Figura 3. Resultado representativo de metástase tracking por [18F] BF4–-PET/CT imagem em um mouse com um 4T1. Tumor de NIS-GFP. (A) 4T1 1 milhão. Células de NIS-GFP foram injetadas as almofadas de gordura mamárias dos ratos do CRLnuBALB/c CanN.Cg-Foxn1 5-6 semanas de idade e crescimento do tumor foi seguido ao longo do tempo usando pinças. Devido a fluorescência de GFP das pilhas de cancer, avaliação visual bruto de identificação/crescimento foi também possível usar uma tocha de fluorescência e óculos filtro apropriado (ver em baixo-relevo). (B/esquerda) Na inoculação de tumor post dia 19, o tumor primário (linha tracejada amarela) foi claramente identificado mas sem metástase. A imagem apresentada é uma projeção de intensidade máxima (MIP) da imagem PET. Sinais de NIS endógenos (descritores de brancos) também foram registrados, ou seja, a tireoide e glândulas salivares (Th + SG), estômago (S) e, em níveis muito baixos, algumas partes das glândulas mamárias e lacrimais. O sinal da bexiga (B) decorre da excreção do traçador. E (B/d) Na inoculação de tumor post dia 29, a metástase foi claramente identificado: múltiplas metástases no pulmão (linha pontilhada amarela) os gânglios linfáticos metastáticos (ILN, AxLN; setas amarelas). A imagem apresentada é um PMI da imagem PET/CT. O tumor primário (linha tracejada amarela) cresceu não só em uma forma globular neste ponto do tempo, mas também havia invadido na parede peritoneal. (C) uma implementação 3D da técnica de limiarização de Otsu habilitado para renderização 3D de superfície dos tecidos cancerosos; Estes são sobrepostos em um PET PMI. Metástases pulmonares são mostrados em brancos, metastáticos linfonodos axilares em vermelho, o linfonodo inguinal metastático em amarelo e o tumor primário que invadiu na parede em turquesa peritoneal. (D) uma imagem de Blow-up do MIP PET/CT em (B/direita) para indicar metástases pulmonares individuais. (E) absorção Radiotracer nos tecidos cancerosos foi quantificada de imagens 3D (% ID) e normalizada por seus respectivos volumes (%ID/mL). Metástases pulmonares individuais correspondem à numeração em (D). Clique aqui para ver uma versão maior desta figura.
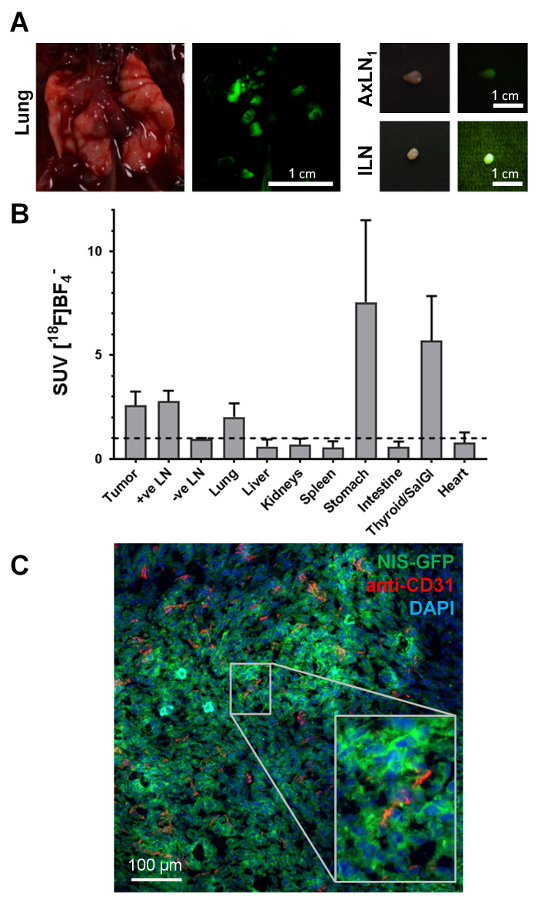
Figura 4. Exemplos típicos de ex vivo dados acessíveis de ratos de tumor-rolamento de NIS-FP. (A) durante a colheita de tecidos para análises a jusante, as propriedades fluorescentes de células de tumor expressando o NIS-FP serviram como um indicador guiando a dissecação de animais. Como exemplos, os tecidos do animal na Figura 3, ou seja, o pulmão com várias lesões metastáticas e dois linfonodos positivos são mostrados. Fotografia do dia, bem como imagens de fluorescência são mostradas. As imagens de fluorescência foram tiradas com a mesma câmera, como as imagens da luz do dia, mas sob excitação luz azul (filtro de passa-banda 450±10 nm) com um filtro de emissão verde (filtro de passa-banda de nm 530±30) colocada na frente da lente da câmera. (B) distribuição de radiotracer em diferentes órgãos ('biodistribuição') de animais com 4T1. Tumores de NIS-GFP (N = 3; inoculação de tumor post dia 29; 5 MBq [18F] BF4–). Fixação padrão foram calculados valores (SUV) e valores > 1 indicam acúmulo específico de radiotracer nos respectivos órgãos. Os dados mostram captação radiotracer específicas em tecidos cancerosos, ou seja, do tumor primário, linfonodos metastáticos (como identificados por imagens e dissecação sob a luz de fluorescência), pulmão (foi dissecado como um todo sem separar individuais metástases), bem como os órgãos endogenamente expressando NIS, ou seja, tireoide e glândulas salivares e estômago. Histologia de imunofluorescência (C) do tumor primário do mouse mesmo como mostrado na Figura 3. O tumor primário foi colhido, incorporado na OCT e congelado antes de ser seccionado (10 µm) e processado para a coloração. Expressando as células cancerosas de NIS-GFP foram identificadas diretamente sem a necessidade de anticorpos. Os vasos sanguíneos foram corados com um anticorpo contra rato PECAM-1/CD31 (2 µ g/mL) e um anticorpo secundário de anticaprinos coelho Cy5 conjugados. Núcleos estavam manchados com 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole (1 µ g/mL) e a amostra montado em poli (álcool vinílico - acetato de vinila) contendo 2,5% (p/v) Dabco como uma Media. Imagens confocal foram obtidas utilizando um microscópio confocal com configurações apropriadas para 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole, GFP e Cy5. Esses dados de exemplo que mostram claramente o 4T1. Tumor de NIS-GFP é vascularizado, mas também a vascularização difere em sua extensão (cf. superior esquerdo com média inferior). Ele também mostra que o repórter de NIS-GFP predominantemente reside nas membranas plasma do tumor células na vivo (inserção), validando, assim, os resultados de absorção em vitro . Clique aqui para ver uma versão maior desta figura.
| FASTlab válvula manifold | Reagente, solvente, cartucho ou tubulação * | Detalhes | ||
| V1 | Tubo de silicone para a garrafa de resíduos [18O] H2O | 14 cm | ||
| V2 | 0,9 solução de NaCl %, 750 µ l | frasco de 11 mm | ||
| V3 | Seringa S1 | 1 mL | ||
| V4 | cartucho de troca de ânion C1, previamente condicionada com 1 M NaCl (10 mL) e H2O (10ml) | por exemplo Sep-Pak Accell Plus QMA Plus Light (águas, gato. Não. WAT023525) | ||
| V5 | Tubo de silicone para cartucho de troca de ânion C1 | 14 cm | ||
| V6 | [18-O] H2O / reservatório de entrada18F | Max 5 mL | ||
| V7 | Tubo de silicone para embarcação de reator (lado esquerdo; entrada de gás) | 14 cm | ||
| V8 | Tubo de silicone para embarcação de reator (porta central; líquido de entrada/saída) | 14 cm | ||
| V9 | Fechado | |||
| V10 | Fechado | |||
| V11 | Seringa S2 | 5 mL | ||
| V12 | 15-coroa-5, 46 mg em 800 µ l MeCN | frasco de 11 mm | ||
| V13 | Trifluoroborate etherate de dietilo, 0,14 µ l em µ l 850 MeCN (diluído µ 14 l de BF3. OEt2 com 1 mL MeCN. Dilua 10 µ l desta solução a 850 µ l com MeCN). | frasco de 13 mm | ||
| V14 | 0,9 solução de NaCl %, 1 mL | frasco de 13 mm | ||
| V15 | Bolsa de água espiga | |||
| V16 | Acetonitrila (MeCN), 1,5 mL | frasco de 13 mm | ||
| V17 | Tubo de silicone para cartucho neutro de Alumina C2 | 14 cm | ||
| V18 | Cartucho neutro de alumina C2, previamente condicionada com H2O (10 mL), acetona (10 mL) e ar (20 mL) | por exemplo Sep-Pak Alumina N Plus Light (águas, gato. Não. WAT023561) | ||
| V19 | Tubo de silicone para cartucho de troca de ânion C3 | 14 cm | ||
| V20 | cartucho de troca de ânion C3, previamente condicionada com 1 M NaCl (10 mL) e H2O (10ml) | por exemplo Sep-Pak Accell Plus QMA Plus Light (águas, gato. Não. WAT023525) | ||
| V21 | Tubo de silicone para frasco de recolha | 40 cm | ||
| V22 | Fechado | |||
| V23 | Fechado | |||
| V24 | Seringa S3 | 5 mL | ||
| V25 | Tubo de silicone para embarcação de reator (lado direito; porta de vácuo) | 40 cm | ||
| * Nota: Devido os picos de plástico, o volume morto para frascos de 11mm e 13mm frascos é aproximadamente 0,35 mL e 0,4 mL, respectivamente. Portanto, os montantes efectivamente transferidos para o reator de reagentes são ligeiramente diferentes. Todas as quantidades indicadas neste método referem-se os montantes efectivamente introduzidos em cada frasco de reagente. | ||||
Tabela 1. Descrição do layout da gaveta para a síntese de4– BF automatizado [18F] através do método de adição de flúor-18-para-boro trifluoreto (cf. Figura 1).
| Sequência de passos | Comentário | ||||
| [1 - 2] | Pressurizar o sistema e liberar o colector com N2 | ||||
| [3-15] | Enxágue a seringa S3 duas vezes com H2O (V15), descarga do colector com N2 | ||||
| [16-23] | Pressurizar os frascos de reagente em posições V16, V14, V13 e V12, o colector com N2 entre cada frasco de lavagem | ||||
| [24-26] | Abrir a entrada da atividade (V6) | ||||
| Conectar o frasco que contém 18F. Se o volume total é > 5 mL, apenas inserir a agulha no meio do caminho dentro do frasco antes de continuar. | |||||
| [27-39] | Perto da entrada da atividade (V6), armadilha 18F no cartucho QMA C1 (V5), recolher o [18O] H2O na garrafa resíduos (V1). Se o volume total é > 5 mL, a sequência na etapa 37, retorno ao passo 26, totalmente, introduza a agulha para o frasco contendo 18F, uma pausa e retomar o processo. | ||||
| [40] | Feche o [18O] H2O frasco resíduos (V1), descarga do colector com N2 | ||||
| [41] | Pressurizar o frasco de eluente na posição V2 | ||||
| [42-44] | Abra a válvula de reator V8, Aspire o eluente de V2 para seringa S1 | ||||
| [45-50] | Eluir cartucho QMA C1 em reator (V8) utilizando soro fisiológico da seringa S1, regule a temperatura do reator para 90 ° C | ||||
| [51] | Liberar o cartucho QMA C1 com N2 e aumentar a temperatura do reator a 105 ° C | ||||
| [52-53] | Retirar acetonitrilo V16 para seringa S2 | ||||
| [54-57] | Transferência de acetonitrilo de seringa S2 para o reator (V8) | ||||
| [58-60] | Aqueça o reator a 120 ° C por 5 min. evaporar o solvente com um fluxo de N2 para o reator (V7). | ||||
| [61-65] | Definir a temperatura de 105 ° C, seca seringa S1 com N2 | ||||
| [66-69] | Retirar a solução de 5-15-coroa V13 em seringa S2, aumentar a temperatura do reator a 120 ° C | ||||
| [70-71] | Reduzir a temperatura de 105 ° C, pode puxar o colector com N2 | ||||
| [72] | Arrefecer o reactor (ajuste a temperatura para 40 ° C) por 5 min | ||||
| [73-78] | Regule a temperatura do reator a 80 ° C, transferir a solução de 5-15-coroa de seringa S2 para o reator (V8) | ||||
| [79-81] | Desenhe o BF3. OEt2 solução de V14 para seringa S2 | ||||
| [82-87] | Transferi o BF3. OEt2 solução da seringa S2 para o reator (V8), liberar a linha reator com N2 | ||||
| [88] | Descarga do colector com N2 | ||||
| [89] | Reagir por 5 min, deixar a temperatura voltar a RT | ||||
| [90-95] | Transfira a mistura de reação (V8) para seringa S2 | ||||
| [96-104] | Passe a mistura de reação através de cartucho de Alumina N C2, para seringa S3 | ||||
| [105] | Descarga do colector com N2 | ||||
| [106-109] | Voltar a mistura de reação à seringa S2 | ||||
| [110-112] | Esvaziar a seringa S3, desenhar H2O (V15) em seringa S2 para diluir a mistura reacional | ||||
| [113-115] | Carregar a mistura de reação em cartucho QMA C3 | ||||
| [116-118] | Desenhar H2O (V15) em seringa S2 | ||||
| [119-124] | Enxágue o reator (V8) com H2O da seringa S2, Aspire as águas de lavagem para seringa S2 | ||||
| [125-128] | Passar as águas de lavagem através de cartuchos, C2 e C3 | ||||
| [129-130] | Secar os cartuchos e o colector com N2 | ||||
| [131-136] | Lave a seringa S1 com H2O (V15) | ||||
| [137-142] | Lave a seringa S2 com H2O (V15) | ||||
| [143] | Descarga do colector com N2 | ||||
| [144-147] | Desenhar H2O (V15) em seringa S2 | ||||
| [148-151] | Retirar o cartucho QMA C3 com H2O da seringa S2 | ||||
| [152-153] | Seque o cartucho QMA C3 com N2 e irrigue o colector com N2 | ||||
| [154-157] | Eluir cartucho QMA C3 com 0,9% NaCl (V14) em seringa S3 | ||||
| [158-161] | Transferir o produto de seringa S3 para o frasco de recolha (V21) | ||||
| [162-163] | Liberar o cartucho QMA C3 com N2 para o frasco de recolha (V21) | ||||
| [164-166] | Descarga do colector com N2 | ||||
| [167-170] | Irrigue cartuchos C2 e C3 (a garrafa de resíduos) e o colector com N2 | ||||
| [171] | Lavar o tubo de coleta (V21) com N2 | ||||
Tabela 2. Descrição das etapas no arquivo XML de sequência.
Discussão
O primeiro passo para processar câncer células rastreáveis na vivo por esse método requer engenharia-los para expressar o repórter de fusão de NIS-FP. A escolha da proteína fluorescente no repórter de fusão é fundamental como oligomerizing proteínas fluorescentes pode levar a repórter artificial de clustering, afectando assim negativamente a sua função. Tivemos sucesso com comprovada monoméricos proteínas fluorescentes como mEGFP (com a mutação monomerizing A206K36,37), mTagRFP ou mCherry. NIS também pode ser de humanos ou origem do mouse (hNIS ou msNIS), dependendo da finalidade do experimento e o modelo de câncer. Eficiências de transdução geralmente variam entre linhas de células de câncer diferente. No entanto, linhas de células de câncer gerado posteriormente são purificadas por FACS neste protocolo, reduzindo assim a necessidade de otimizar as condições de transdução. Transdução com alta multiplicidade de infecção não é sempre aconselhável, como múltiplos construção integração no genoma é susceptível de resultar não só na expressão de construção mais elevado, mas também na modificação de genoma mais indesejados/não regulamentada. Portanto, é importante deixar polyclonal transduzidas células crescem a estabilidade de expressão (monitorado por citometria de fluxo) e evitar classificar os clones mais brilhantes apenas pela FACS. Ele também processa validação funcional de características não-repórter crucial antes que essas células devem ser usadas para experimentos na vivo . Uma alternativa desenvolvida recentemente para entrega do gene viral é gene edição tecnologia38, que oferece controle mais específico sobre os locais de integração viral. Análise da expressão por citometria de fluxo e immunoblotting é importante. Citometria de fluxo permite a aquisição de dados de base populacional única célula, por exemplo, para examinar se há qualquer deriva em níveis de expressão de repórter ao longo do tempo. Ai vem o moiety FP apenas, a menos que as células também estão manchadas com um anticorpo dirigido contra a superfície ou total NIS. Citometria de fluxo não informa na integridade de repórter de fusão. Em contraste, immunoblotting informa sobre a integridade do repórter fusão. O peso molecular do NIS e o FP deve ser adicionado para determinar o peso molecular esperado do escolhido NIS-FP Confocal fluorescência microscopia demonstrada fusão repórter colocalization com as aglutininas de gérmen de trigo-membrana plasmática marcador em todos os recém feita de linha celular. Este foi o local esperado para a maioria das proteínas celular e indicado um marco go-ahead para posterior validação funcional. Se mínima/no NIS-FP foi encontrado na membrana plasmática (por exemplo, somente em compartimentos celulares internos), isto indicaria uma questão biológica de célula com o repórter de fusão nesta linha de celular, ou uma mutação potencial do repórter fusão afetando sua tráfico intracelular. Vale ressaltar que não temos observado nesse caso em qualquer uma das pilhas de cancer testamos até agora, que incluiu: A375P, A375M2, SK-Mel28, WM983A/B (melanoma humano); MCF-7, MDA-MB-231, MDA-MB-436 (câncer de mama humano); ICN-H1975 (câncer de pulmão humano); SK-Hep1 (câncer de fígado humano); 4T1, 4T1.2, 66cl 4, 67NR, FARN168 (câncer de mama inflamatório murino); B16F0, B16F3, B16F10 (melanoma murino); MTLn3 (adenocarcinoma de mama de rato).
Função de NIS deve ser medida utilizando ensaios de absorção com substratos radioactivos do NIS. Devido o SPECT radiotracer 99mTcO4– gerador-produzido e, portanto, amplamente disponível nos hospitais, sem a necessidade de qualquer síntese radiotracer também como tendo uma meia-vida mais longa mais conveniente (6,01 h para 99 m TC em comparação com 110 min para 18F), usamos este substrato de NIS para rotina validação funcional de novas linhas de células expressando de NIS-FP. Pre-bloqueio de células NIS-expressando com o perclorato de sódio NIS co substrato resultou na esperada redução/abolição da captação radiotracer, mostrando assim a especificidade de absorção radiotracer. Este teste de especificidade de NIS é uma etapa crítica de validação. Se um experimento de especificidade de NIS não resultaria na captação reduzida radiotracer comparável às respectivas células parentais, um erro técnico durante o experimento ou a absorção de radiotracer não foi devido ao NIS. Também é possível que o perclorato de sódio pre-bloqueio reduz absorção radiotracer em uma linha da célula parental; Isto identificaria linhas celulares com expressão endógena de NIS funcional (por exemplo, estimulado tireoide células6).
Uma vantagem crucial do presente protocolo de imagem é que informação é recolhida em 3D e ao longo do tempo. Isto permite a comparação de imagens do mesmo animal ao longo do tempo, proporcionando dados emparelhados e, assim, superar os problemas causados pela variabilidade de animal para animal. Isto contrasta com métodos de avaliação de metástase relacionados mais non-imagem latente que se baseiam em sacrificar animais diferentes em pontos diferentes do tempo. Na Figura 3B é evidente como metástase disseminação e consequência progrediram ao longo do tempo em um animal individual. Os sinais detectados por imagens de PET/CT são causados fundamentalmente pela expressão de NIS. Isso inclui todos os sinais de forma exógena NIS-expressando as células cancerosas, assim como todos os órgãos endogenamente expressando NIS. Sinais típicos de NIS endógenos são encontrados na tireoide e glândulas salivares, o estômago e, em níveis baixos em algumas partes das glândulas mamárias e lacrimais. Além de expressão endógena de NIS, NIS radiotracer [18F] BF4– também é excretado através dos rins, assim explicando a captação radiotracer em bexigas cheias de urina. Captação de rim não é mais detectável no ponto de imagem tempo recomendado neste protocolo (45 min post radiotracer injeção6). Se os sinais de bexigas cheias de urina devem conduzir a problemas de sinal-para-plano de fundo, a bexiga pode ser esvaziada mecanicamente sob anestesia antes de imagem. Importante, os sinais endógenos podem variar entre cepas de animais. Também é interessante notar que a expressão endógena de NIS nas glândulas mamárias pode ser mais elevado sob lactantes condições10. No caso apresentado e nos casos dessas linhas de célula metastático caracterizada com sucesso antes (cf. lista acima), não encontramos a expressão endógena de NIS para interferir significativamente com deteção de metástase. Vale ressaltar, que [18F] BF4– permanece mais disponível para captação nos tecidos cancerosos em comparação com o iodeto, porque o iodeto é metabolizado em hormônios tireoidianos6. Este fenômeno também pode contribuir para quantidades maiores de radioiodide na corrente sanguínea em comparação com [18F] BF4- 6. Para diferentes aplicações (acompanhamento em outros cânceres ou células não-cancerosas aplicativos de rastreamento de célula cancerosa), isto pode ser diferente, e, portanto, recomenda-se avaliar se a expressão endógena de NIS é susceptível de causar problemas de sinal-para-fundo através Experimentos preliminares. Um aspecto importante na imagem pré-clínicos é a atividade molar da radiotracer. O método descrito aqui usa ~1.5 GBq 18F– como material inicial14 e foi mostrado para produzir atividades molares significativamente acima o método de substituição anteriormente relatados12. [18-F] BF4– produzido no molar atividades ≤ 1 µmol/GBq12 pode levar a absorção reduzida em NIS-expressando os tecidos. Isto é particularmente importante quando a quantidade injetada de radioatividade por quilograma é alta, ou seja, quando são pequenos animais como ratos, fotografada39; é menos importante no ser humano definindo40. Atividades de alto molares são, portanto, imperativas para a imagem latente PET pré-clínicos de alta qualidade. Atividades molares obtidas por boro trifluoreto adição método14, que é mostrado em sua forma automatizada no presente protocolo, superar esse problema. Além disso, vale ressaltar que o protocolo apresentado para a síntese de4– [18F] BF não é compatível com boas práticas de fabricação (GMP) e, portanto, impróprias para uso em ensaios clínicos humanos neste formulário. Um protocolo de GMP (através do método de substituição de 18F para radiolabel BF4–) está disponível em outros lugares40.
Imagens de PET/CT permite a visualização de captação radiotracer, que é indicativa de absorção mediada por NIS radiotracer decorrentes de células de câncer expressando NIS-FP. Mais importante, os sinais de PET associados podem ser quantificados. É necessário aplicar procedimentos de limiarização confiável para garantir uma diferenciação consistente e imparcial de sinais relevantes de qualquer fundo de potencial. Como o fundo varia em diferentes locais na vivo, é importante levar em consideração a segmentação e limiarização local e regional. Um tal método foi desenvolvido por e nomeado após Otsu34, e sua aplicação 3D é empregada para renderização em 3D do tumor primário e metástases no presente protocolo. Geralmente, a imagem vista pelo observador visualmente melhor corresponda aos valores de dose (% ID) quantificados % injetado. Quanto à quantificação baseada em imagem, é igualmente importante normalizar os valores de medição de radioactividade dos diferentes tecidos para os volumes. Há duas maneiras predominantemente usadas de expressar resultados normalizados, ID de (i) % por volume (por exemplo, %ID/mL) e o valor de (ii) o padrão de captação (SUV35). Eles diferem em que %ID/mL leva em conta o volume individual apenas, enquanto o SUV é uma medida que é relativo a radioatividade média em todo o animal inteiro. Também é importante notar que imagem de NIS processa o volume do tumor ao vivo (LTV) acessível, porque as células morto/morrendo não sintetizar ATP não pode mais importar radiotracer10. Isto explica a grande área de baixo sinal dentro do tumor primário ("em forma de donut" tumor) indicando áreas de tumor de célula morte/necrose. Importante, LTV foi uma medida muito mais confiável do fardo de tumor em comparação com o volume bruto de tumor acessível através de medições de maxila (que não leva em viabilidade de conta e avalia apenas as regiões tumor superficial).
Uma grande vantagem desta estratégia de rastreamento de modo dual é evidente quando a colheita de tecidos após o abate de animais. Guiado por imagens na vivo e assistida por células cancerosas fluorescente durante a dissecção de animais, profundos e pequenos órgãos/metástases pode também ser colhidas confiantemente. Metodologia de preservação/corte de tecido congelado permite que a imagem de fluorescência direta de GFP, sem a necessidade de coloração com um anticorpo anti-GFP, mas em detrimento da preservação de tecido estrutural reduzido em comparação com fixada em formol metodologia de parafina (FFPE). O último criticamente requer também coloração anti-FP, porque o método FFPE é incompatível com preservação intacta de proteínas fluorescentes (devido a fixação/desidratação/reidratação). Enquanto o sinal de fluorescência é indicativo da presença de células do tumor, é importante garantir que essa classificação é confirmada pelo ex vivo medições de radioactividade dos tecidos colhidos ('biodistribuição'). Ex vivo medições de radioactividade são mais sensíveis de detecção visual de fluorescência, portanto, pode permitir que a identificação do câncer de sinais de celular-dependente que caso contrário permaneceria sem ser detectado. No caso de um terminal sessão de imagem, é fundamental observar com precisão os montantes radiotracer injetado, bem como os horários de medições de radioactividade radiotracer, injeção de animal, animal de abate e calibrado contador de cintilação medições de tecidos colhidos. Isto é crucial para garantir a correção para decaimento radiotracer e desse modo permitir análise biodistribuição confiável.
PET/CT imaging permite repetido quantificação 3D não-invasivo de progressão de tumor, incluindo a avaliação da disseminação metastática em um nível de corpo inteiro. Esta característica é uma vantagem significativa sobre os métodos convencionais, que muitas vezes dependem de grandes coortes de animais que são sacrificados para a avaliação da progressão do tumor em diferentes pontos do tempo. As vantagens desta abordagem baseada em imagem são: (i) altamente sensível invasivo 3D na vivo quantificação, (ii) uma redução significativa no número de animais devido à possibilidade de repetição de imagem, (iii) a aquisição de dados emparelhados longitudinais de subsequentes de imagem sessões de aperfeiçoamento das estatísticas, excluindo a variabilidade de animal para animal, que por sua vez mais reduz o número de animais, (iv) automatizada produção de [18F] BF4– em atividades específicas de alto e (v) a opção intrínseca para ex vivo confirmação nos tecidos por metodologias de fluorescência como microscopia ou citometria.
Na vivo celular de rastreamento é um campo crescente. Ele foi alimentado pelos recentes avanços na tecnologia, o que resultou em maior resolução, limites de detecção e capacidade multiplex (através de imagiologia multimodal) de imagem. Neste protocolo, aplicamos esse conceito para controlar a progressão do tumor incluindo metástases celular espontânea em 3D por repetição de imagem. As aplicações incluem estudos vistos desvendar os mecanismos de metástases celular espontânea. Por exemplo, células tumorais rastreável poderiam ser usadas para estudar o impacto dos componentes de diferentes células imunes (como presente/funcional em cepas de animais de diferentes níveis de immunocompromisation) sobre o processo metastático. Da mesma forma, o impacto dos genes individuais, na estirpe animal ou a linhagem de células de câncer, poderia ser estudado. Além disso, o protocolo apresentado pode ser usado para avaliar/validar a eficácia de medicamentos específicos ou conceitos terapêuticos na progressão do tumor. Importante, este par de gene: radiotracer de repórter para a imagem latente de PET (NIS: [18F] BF4–) também poderia ser usado para aplicativos de rastreamento de célula diferente. Por exemplo, várias terapias celulares atualmente estão surgindo abordagens terapêuticas tão promissoras. Isso inclui celular terapêutica para tratamento de câncer41 , mas também em transplante42 e configurações de44 43,medicina regenerativa. Todo o corpo na vivo celular rastreamento está se tornando cada vez mais importante para o desenvolvimento e a tradução clínica de terapias celulares, por exemplo, para avaliar a segurança e para o monitoramento da terapia.
Divulgações
Os autores declaram que eles têm não tem interesses financeiro concorrente.
Agradecimentos
A pesquisa foi apoiada pelo faculdade Londres do rei e UCL abrangente câncer Imaging centro, financiado pelo Cancer Research UK e EPSRC em associação com a MRC e DoH (Inglaterra); o Instituto Nacional de saúde pesquisa (NIHR) centro de investigação biomédica com base no tipo e St Thomas' NHS Foundation Trust e College London do rei; o centro de excelência em engenharia médica de financiado pela Wellcome Trust e EPSRC sob concessão número WT 088641/Z/09/Z; um câncer Research UK multidisciplinar projeto prêmio GOF e PJB e concessão de saúde parceiros do rei a GOF. Os scanners nanoPET/CT e nanoSPECT/CT foram comprados e mantidos por uma doação de equipamentos da Wellcome Trust. As opiniões expressadas são as dos autores e não necessariamente aqueles de NHS, o NIHR ou o DoH.
Materiais
| Name | Company | Catalog Number | Comments |
| Step 1) Engineering and characterization of cancer cells to express the radionuclide-fluorescnece fusion reporter NIS-FP. | |||
| 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole | Thermo Scientific | H3570 | Trivial name: Hoechst 33342; CAS number: 23491-52-3; Hoechst 33342, Trihydrochloride, Trihydrate - 10 mg/mL Solution in Water. |
| 4T1 murine breast cancer cell line | ATCC | CRl-2539 | for details see ATCC website |
| Automatic Cell Counter, e.g. CASYCounter | Roche Diagnostics GmbH | 5651697001 | CASY Model TT Cell Counter and Analyzer |
| CASYclean Cleaning Reagent | Sedna Scientific | 2501036 | |
| CASYton Isotonic Diluent | Sedna Scientific | 2501037 | |
| Confocal Fluorescence Microscope, e.g. Leica TCS SP5 | Leica, Wetzlar, Germany | Equipped with Plan-Neofluor 25×0.5NA and Plan-Apochromat 63×1.4NA oil UV objectives and Diode (405 nm), Argon-ion (458, 477, 488, 496, 514 nm) and HeNe (543 and 633 nm) lasers; A Leica LAS AF Lite Software 4.0.11706 (Leica Microsystems CMS GmbH) was used for image acquisition and and anaysis | |
| Cover slips No. 1.5 thickness | VWR International | 631-0150 | |
| Dabco | Sigma | 290734 | Stock 125 mg/mL |
| DMEM | Sigma | D5546 | Supplement with 10 % (v/v) FBS and L-glutamine (2 mM) to make up the optimal growth medium for MDA-MB-231 cells. |
| FACS sorter, e.g. BD FACSAria III | BD Biosciences | Equipped with a BD FACS DIVA Software, a 6 Laser System (375/405/488/561/633 nm lasers) - cells sorted with a 100 μm nozzle under 20 psi flow pressure, window extension of 2.0 μm, 2.0 Neutral Density Filter and 3 kV plate voltage | |
| Fetal Bovine Serum (FBS) | Sigma | F9665 | Heat inactivated at 56 °C for 30 min |
| Automated Gamma Counter, e.g. 1282 Compugamma | LKB Wallac Laboratory | 99mTc-pertechnetate energy window 110-155 keV 18F energy window 175-220 keV | |
| Hoechst 33342 solution | Life Technologies | H1399 | 1-3 µg/mL; DAPI (from various supplieres) can be used instead. |
| L-glutamine | Sigma | G7513 | Solution 200 mM concentrated, sterile-filtered |
| Linear polyethylenimine (PEI) | Polyscience | 23966-2 | Linear, 25 kDa; transfection reagent for 293T cell line. |
| MDA-MB-231 human breast cancer cells | ATCC | HTB-26 | for details see ATCC website |
| Mowiol 4-88 | Sigma | 81381 | |
| pLNT SFFV NIS-mEGFP | request from our lab | n/a | For details (generation and maps) see Supplementary Information |
| pLNT SFFV NIS-mCherry | request from our lab | n/a | For details (generation and maps) see Supplementary Information |
| pMD2.G | Addgene | #12259 | plasmids encoding for the VSV-G envelope |
| pRRE | Addgene | #12251 | packaging plasmid |
| pRSV-Rev | Addgene | #12253 | packaging plasmid |
| Paraformaldehyde solution 4 % (w/v) in PBS | Santa Cruz Biotechnology | sc-281692 | |
| Penicillin-Streptomycin | Sigma | P43330 | Containing penicillin (10,000 units/mL) and streptomycin (10 mg/mL), sterile-filtered |
| Phosphate Buffered Saline (PBS) | Sigma | D8537 | pH 7.4, sterile-filtered and without calcium chloride and magnesium chloride |
| Poly(vinyl alcohol - vinyl acetate) | Polysciences | 17951 | Trivial name: Mowiol 4-88; CAS number: 9002-89-5 |
| Puromycin dihydrochloride | Sigma | P8833 | From Streptomyces alboniger, reconstituted in sterile water |
| Benchtop centrifuge, e.g. Rotina 380 R Benchtop centrigfuge | Hettich Lab Technology | ||
| RPMI 1640 | Sigma | R0883 | Supplement with 10% (v/v) FBS and L-glutamine (2mM) to make up the optimal growth medium for 4T1 cells. |
| SFCA Syringe filter 0.45 μm | Corning | ||
| Syringes 10 mL | BD Emerald | Disposable non-sterile syringes | |
| Tissue culture fluorescence microscope, e.g. EVOS-FL | Life Technologies | Cell Imaging System equipped with a 10× objective (PlanFL PH2, 10×/0.25, ∞/1.2) and a colour camera | |
| Trypsin-EDTA solution 10X | Sigma | 59418C | (0.5 % (w/v) trypsin, 0.2 % (w/v) EDTA) gamma irradiated by SER-TAIN process and without phenol red |
| Wheat Germ Agglutinin Alexa Fluor 633 Conjugate | Life Technologies | W21404 | Used at 1:1000 (2 µg/mL) for cell immunofluorescence |
| Step 2) Establishment of in vivo tumor models. | |||
| Digital caliper | World Precision Instruments | 501601 | |
| Isoflurane 1000 mg/g | Isocare | For inhalation | |
| Fluorescence Torch, e.g. NightSea Fluorescence Torch DFP-1 | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters and NightSea filter goggles (DFP-1) |
| Syringes 0.3 mL U-100 insulin | Terumo | 29G × 1/2'' - 0.33 × 12 mm | |
| Standard materials/equipment for aseptic technique and animal maintenance | |||
| Step 3) Production of [18F]BF4- using an automated radiotracer synthesis platform. | |||
| 15-crown-5 | Sigma-Aldrich | 188832 | CAS 33100-27-5 |
| Acetonitrile (anhydrous) | Acros Organics | 326811000 | |
| Boron trifluoride diethyl etherate | Sigma-Aldrich | 216607 | BF3.OEt2, purified by redistillation, ≥46.5 % BF3 basis. CAS 109-63-7 |
| Automated Radiotracer Synthesis (ARS) platform, e.g. FASTLab | GE Healthcare | ||
| Disposable cassettes for ARS platform, e.g. FASTLab cassettes | GE Healthcare | FASTlab Developer pack | |
| Polygram Alox N/UV254 polyester sheets | Macherey-Nagel | 802021 | RadioTLC plates, 40×80 mm |
| Strong anion exchange cartridge, e.g. Sep-Pak Accell Plus QMA Plus Light | Waters | WAT023525 | Condition with 1M NaCl (10 mL) and H2O (10 mL) |
| Alumina neutral cartridge, e.g. Sep-Pak Alumina N Plus Light | Waters | WAT023561 | Condition with H2O (10 mL), acetone (10 mL) and air (20 mL) |
| Water for injection USP | GE Healthcare | ||
| Nitrogen filter | Millipore | SE2M049I05 | Sterile 0.2 µm FG Millex 13 mm |
| Step 4) In vivo imaging of NIS-FP expressing cells by nanoPET/CT. | |||
| Isoflurane 1000 mg/g | Isocare | For inhalation | |
| Preclinical PET/CT multimodal imaging instrument, e.g. nanoScan PET/CT | Mediso Medical Imaging System, Budapest, Hungary | ||
| Fluorescence Torch, e.g. NightSea Fluorescence Torch DFP-1 | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters and NightSea filter goggles (DFP-1) |
| Rodent anesthesia induction chamber | Vet-Tech | AN010R | With three-way valves (x2), tube mount connector for inlet, PVC tubing for gas inlet (2 m) and 22 mm scavenging tube (2 m) |
| Rodent anesthesia system | Vet-Tech | AN001B | Including animal face-mask suitably sized for animal of interest and isolflurane vaporizer |
| Sterile physiological saline | Thermo Scientific Oxoid | BO0334B | |
| Syringes 0.3 mL U-100 insulin | Terumo | 29G × 1/2'' - 0.33 × 12 mm, for intravenous injection of radiotracer | |
| Veterinary Scavenger | Vet-Tech | AN200 | VetScav filter weighing mechanism - 240 V with automatic temperature compensation and LED system |
| 5) In vivo data analysis. | |||
| Tera-Tomo Monte Carlo based full 3D iterative algorithm | Mediso Medical Imaging System, Budapest, Hungary | ||
| VivoQuant Software | Invicro LLC., Boston, USA | ||
| 6) Ex vivo analyses | |||
| 2-Methylbutane | Sigma | 59070-1L-D | Pre-cooled over liquid nitrogen to freeze OCT-embedded tissues |
| Bovine Serum Albumin (BSA) | Sigma | 85040C | |
| Cover slips 22×50 mm | VWR International | SMITMCQ211022X50 | |
| Cryostat, e.g. Cryostat MNT | SLEE Medical | two-piece modular histology embedding machine equipped with an embedding module, a tissue storage compartment and a cold plate | |
| Cy5 AffiniPure Goat anti-Rabbit IgG (H+L) | Jackson/Stratech | 111-175-144 | Used at 1:500 (2 µg/mL) |
| Dabco | Sigma | 290734 | Stock 125 mg/mL |
| Microtome blades, e.g. Feather S35 | CellPath | ||
| Fluorescence Microscope (wide-field or confocal), e.g. Nikon Eclipse Ti-E Inverted Fluorescence Microscope | Nikon | Equipped with 10×, 20× (air) and ideally 40× (oil) objectives and lasers/filters or filter cubes, respectively, that are suitable for Hoechst 33342, GFP and Cy5 | |
| Automated Gamma Counter, e.g. 1282 Compugamma | LKB Wallac Laboratory | 99mTc-pertechnetate energy window 110-155 keV, 18F energy window 175-220 keV | |
| Hoechst 33342 solution | Life Technologies | H1399 | |
| Fluorescence adapter for dissecting microscope, e.g. NightSea Adapter | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters |
| O.C.T. compound | VWR international | 361603E | |
| Wax pen, e.g. PAP-PEN | Dako UK Ltd | Wax pen to draw around tissue section to reduce required staining/washing solution volumes | |
| Paraformaldehyde solution 4 % (w/v) in PBS | Santa Cruz Biotechnology | sc-281692 | |
| Rabbit anti-CD31 | Abcam | ab28364 | Polyclonal anti-mouse used 1:50 (20 µg/mL) for tissues immunofluorescence |
| Microscope slides, e.g. Superfrost slides | VWR, Lutterworth, UK | ||
| Tris-buffered saline (TBS) | available from various suppliers. | Tris-buffered saline; 150 mM NaCl, 25 mM Tris/HCl at pH 7.4 | |
Referências
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331 (6024), 1559-1564 (2011).
- Brader, P., Serganova, I., Blasberg, R. G. Noninvasive molecular imaging using reporter genes. J Nucl Med. 54 (2), 167-172 (2013).
- Fruhwirth, G. O., Diocou, S., Blower, P. J., Ng, T., Mullen, G. E. A whole-body dual-modality radionuclide optical strategy for preclinical imaging of metastasis and heterogeneous treatment response in different microenvironments. J Nucl Med. 55 (4), 686-694 (2014).
- Terrovitis, J., et al. Ectopic expression of the sodium-iodide symporter enables imaging of transplanted cardiac stem cells in vivo by single-photon emission computed tomography or positron emission tomography. J Am Coll Cardiol. 52 (20), 1652-1660 (2008).
- Seo, J. H., et al. Trafficking Macrophage Migration Using Reporter Gene Imaging with Human Sodium Iodide Symporter in Animal Models of Inflammation. J Nucl Med. 51 (10), 1637-1643 (2010).
- Diocou, S., et al. [18F]tetrafluoroborate-PET/CT enables sensitive tumor and metastasis in vivo imaging in a sodium iodide symporter-expressing tumor model. Scientific Reports. 7 (1), 946 (2017).
- Lajtos, I., et al. Cold wall effect eliminating method to determine the contrast recovery coefficient for small animal PET scanners using the NEMA NU-4 image quality phantom. Phys Med Biol. 59 (11), 2727-2746 (2014).
- Nagy, K., et al. Performance evaluation of the small-animal nanoScan PET/MRI system. J Nucl Med. 54 (10), 1825-1832 (2013).
- Deleye, S., et al. Performance evaluation of small-animal multipinhole muSPECT scanners for mouse imaging. Eur J Nucl Med Mol Imaging. 40 (5), 744-758 (2013).
- Portulano, C., Paroder-Belenitsky, M., Carrasco, N. The Na+/I- symporter (NIS): mechanism and medical impact. Endocr Rev. 35 (1), 106-149 (2014).
- Dohan, O., et al. The sodium/iodide Symporter (NIS): characterization, regulation, and medical significance. Endocr Rev. 24 (1), 48-77 (2003).
- Jauregui-Osoro, M., et al. Synthesis and biological evaluation of [F-18]tetrafluoroborate: a PET imaging agent for thyroid disease and reporter gene imaging of the sodium/iodide symporter. Eur J Nucl Med Mol Imaging. 37 (11), 2108-2116 (2010).
- Weeks, A. J., et al. Evaluation of [18F]-tetrafluoroborate as a potential PET imaging agent for the human sodium/iodide symporter in a new colon carcinoma cell line, HCT116, expressing hNIS. Nucl Med Commun. 32 (2), 98-105 (2011).
- Khoshnevisan, A., et al. [(18)F]tetrafluoroborate as a PET tracer for the sodium/iodide symporter: the importance of specific activity. EJNMMI Res. 6 (1), 34 (2016).
- Groot-Wassink, T., et al. Noninvasive imaging of the transcriptional activities of human telomerase promoter fragments in mice. Cancer Res. 64 (14), 4906-4911 (2004).
- Chen, L., et al. Radioiodine therapy of hepatoma using targeted transfer of the human sodium/iodide symporter gene. J Nucl Med. 47 (5), 854-862 (2006).
- Sieger, S., et al. Tumour-specific activation of the sodium/iodide symporter gene under control of the glucose transporter gene 1 promoter (GTI-1.3). Eur J Nucl Med Mol Imaging. 30 (5), 748-756 (2003).
- Chisholm, E. J., et al. Cancer-specific transgene expression mediated by systemic injection of nanoparticles. Cancer Res. 69 (6), 2655-2662 (2009).
- Klutz, K., et al. Targeted radioiodine therapy of neuroblastoma tumors following systemic nonviral delivery of the sodium iodide symporter gene. Clin Cancer Res. 15 (19), 6079-6086 (2009).
- Merron, A., et al. Assessment of the Na/I symporter as a reporter gene to visualize oncolytic adenovirus propagation in peritoneal tumours. Eur J Nucl Med Mol Imaging. 37 (7), 1377-1385 (2010).
- Merron, A., et al. SPECT/CT imaging of oncolytic adenovirus propagation in tumours in vivo using the Na/I symporter as a reporter gene. Gene Ther. 14 (24), 1731-1738 (2007).
- Dingli, D., et al. Combined I-124 positron emission tomography/computed tomography imaging of NIS gene expression in animal models of stably transfected and intravenously transfected tumor. Mol Imaging Biol. 8 (1), 16-23 (2006).
- Carlson, S. K., et al. Quantitative molecular imaging of viral therapy for pancreatic cancer using an engineered measles virus expressing the sodium-iodide symporter reporter gene. AJR Am J Roentgenol. 192 (1), 279-287 (2009).
- Barton, K. N., et al. GENIS: gene expression of sodium iodide symporter for noninvasive imaging of gene therapy vectors and quantification of gene expression in vivo. Mol Ther. 8 (3), 508-518 (2003).
- Siddiqui, F., et al. Design considerations for incorporating sodium iodide symporter reporter gene imaging into prostate cancer gene therapy trials. Hum Gene Ther. 18 (4), 312-322 (2007).
- Rad, A. M., et al. AC133+ progenitor cells as gene delivery vehicle and cellular probe in subcutaneous tumor models: a preliminary study. BMC Biotechnol. 9, 28 (2009).
- Hwang do, W., et al. Noninvasive in vivo monitoring of neuronal differentiation using reporter driven by a neuronal promoter. Eur J Nucl Med Mol Imaging. 35 (1), 135-145 (2008).
- Edmonds, S., et al. Exploiting the Metal-Chelating Properties of the Drug Cargo for In Vivo Positron Emission Tomography Imaging of Liposomal Nanomedicines. ACS Nano. 10 (11), 10294-10307 (2016).
- Zhang, R., et al. Probing the Heterogeneity of Protein Kinase Activation in Cells by Super-resolution Microscopy. ACS Nano. 11 (1), 249-257 (2017).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. Am J Physiol Cell Physiol. 300 (4), C723-C742 (2011).
- Pulaski, B. A., Ostrand-Rosenberg, S. Mouse 4T1 breast tumor model. Curr Protoc Immunol. , (2001).
- Workman, P., et al. Guidelines for the welfare and use of animals in cancer research. Br J Cancer. 102 (11), 1555-1577 (2010).
- Foster, B., Bagci, U., Mansoor, A., Xu, Z., Mollura, D. J. A review on segmentation of positron emission tomography images. Comput Biol Med. 50, 76-96 (2014).
- Otsu, N. A Threshold Selection Method from Gray-Level Histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Kinahan, P. E., Fletcher, J. W. Positron emission tomography-computed tomography standardized uptake values in clinical practice and assessing response to therapy. Semin Ultrasound CT MR. 31 (6), 496-505 (2010).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- Snapp, E. L., et al. Formation of stacked ER cisternae by low affinity protein interactions. J Cell Biol. 163 (2), 257-269 (2003).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Hume, S. P., Gunn, R. N., Jones, T. Pharmacological constraints associated with positron emission tomographic scanning of small laboratory animals. Eur J Nucl Med. 25 (2), 173-176 (1998).
- O'Doherty, J., et al. 18F-Tetrafluoroborate, a PET Probe for Imaging Sodium/Iodide Symporter Expression: Whole-Body Biodistribution, Safety, and Radiation Dosimetry in Thyroid Cancer Patients. J Nucl Med. 58 (10), 1666-1671 (2017).
- Couzin-Frankel, J. Breakthrough of the year 2013. Cancer immunotherapy. Science. 342 (6165), 1432-1433 (2013).
- Boardman, D. A., et al. Expression of a Chimeric Antigen Receptor Specific for Donor HLA Class I Enhances the Potency of Human Regulatory T Cells in Preventing Human Skin Transplant Rejection. American Journal of Transplantation. , (2017).
- Rashid, T., Takebe, T., Nakauchi, H. Novel strategies for liver therapy using stem cells. Gut. 64 (1), 1-4 (2015).
- Ellison, G. M., et al. Adult c-kit(pos) cardiac stem cells are necessary and sufficient for functional cardiac regeneration and repair. Cell. 154 (4), 827-842 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados