Method Article
Del radionuclide-fluorescenza Reporter Gene Imaging per monitorare la progressione del tumore nei modelli del roditore del tumore
In questo articolo
Riepilogo
Descriviamo un protocollo per il rilevamento di preclinici in vivo della metastasi del cancro. Si basa su un reporter del radionuclide-fluorescenza combinando lo symporter dello ioduro di sodio, rilevato da non-invasiva [18F] tetrafluoroborate-PET e una proteina fluorescente per semplificata ex vivo conferma. Il metodo è applicabile per preclinici in vivo delle cellule di rilevamento di là di biologia del tumore.
Abstract
La metastasi è responsabile della maggior parte dei decessi per cancro. Malgrado ricerche approfondite, la comprensione meccanicistica dei complessi processi che regolano la metastasi rimane incompleta. Modelli in vivo sono di primaria importanza per la ricerca di metastasi, ma necessitano di perfezionamenti. Rilevamento delle metastasi spontanea da non invasiva in vivo imaging è ora possibile, ma rimane impegnativo in quanto richiede osservazione da lungo tempo e alta sensibilità. Descriviamo un longitudinale combinato del radionuclide e fluorescenza corpo intero in vivo imaging approccio per il tracciamento di progressione del tumore e metastasi spontanea. Questa metodologia di gene reporter impiega lo symporter dello ioduro di sodio (NIS) fuso ad una proteina fluorescente (FP). Le cellule tumorali sono progettate per NIS-FP espressione seguita da selezione basata sulla fluorescenza-attivato delle cellule l'ordinamento. Corrispondenti modelli di tumore sono stabiliti nei topi. NIS-FP che esprimono le cellule tumorali sono monitorati in modo non invasivo in vivo a livello di corpo intero di tomografia a emissione di positroni (PET) usando il NIS radiotraccitore [18F] BF4–. PET è attualmente il più sensibile in vivo imaging tecnologia disponibile a questa scala e consente la quantificazione affidabile ed assoluta. Metodi attuali si basano su larghe coorti di animali che si sono sacrificati per la valutazione di metastasi a diversi intervalli di tempo, o si affidano a malapena quantificabili imaging 2D. I vantaggi del metodo descritto sono: (i) altamente sensibile non invasiva in vivo imaging PET 3D e quantificazione, (ii) produzione automatizzata di PET tracer, (iii) una riduzione significativa del numero di animali necessario dovuto ripetere opzioni di imaging, (iv). l'acquisizione di dati appaiati da successive sessioni di formazione immagine fornire meglio i dati statistici e (v) l'opzione intrinseco per conferma ex vivo di cellule tumorali nei tessuti di microscopia di fluorescenza o cytometry. In questo protocollo, descriviamo tutti i passaggi necessari per routine NIS-FP-accordata non invasiva in vivo cancro cella rilevamento mediante PET/CT ed ex vivo conferma di risultati in vivo . Questo protocollo ha applicazioni oltre la ricerca sul cancro, ogni volta che la localizzazione in vivo , l'espansione e monitoraggio da lungo tempo di una popolazione delle cellule è di interesse.
Introduzione
Malattia metastatica è la causa per la maggior parte delle morti legate al cancro 1. Malgrado ricerche approfondite in processi metastatici, affidabile monitoraggio della metastasi del cancro in sistemi modello animale è difficile da raggiungere. I recenti progressi nelle tecnologie di imaging del corpo intero e approcci di imaging multimodali hanno permesso non invasiva in vivo delle cellule rilevamento2,3,4,5. Quest'ultimo può essere utilizzato come uno strumento per monitorare la presenza, la distribuzione, la quantità e la attuabilità delle cellule, in modo non invasivo e ripetutamente in un animale o un essere umano.
Lo scopo del metodo descritto qui è rintracciare longitudinalmente e in modo non invasivo le cellule tumorali in 3D in modelli di tumore roditore vivente. Utilizzando questo metodo, i ricercatori saranno in grado di quantificare con precisione la progressione del tumore, tra cui la diffusione metastatica in 3D. Rispetto alle tecniche tradizionali non basati su formazione immagine, questo metodo offre l'acquisizione di dati quantitativi con in gran parte ridotto numero di animali. Un'altra caratteristica di questo metodo è che permette di correlazione dell'imaging in vivo con analisi semplificata a valle ex vivo delle cellule rilevate nei tessuti raccolti dall'istologia o citometria a3,6.
La spiegazione razionale per lo sviluppo di questo metodo era quello di fornire uno strumento in vivo per il monitoraggio e la quantificazione del processo intero metastatico nei modelli del roditore del tumore. D'importanza, è stato progettato per ridurre al minimo l'uso di animali mentre allo stesso tempo riducendo la variabilità. Imaging non-invasivo a tutto il corpo longitudinale è perfettamente adatto per informare sulla conseguenza metastatica, per cui per sé è difficile prevedere con precisione il tempo e la posizione della sua comparsa. Imaging 3D corpo intero è stata quindi al centro dello sviluppo del metodo. Per chiudere il divario di scala tra il corpo intero in vivo imaging e potenziale a valle ex vivo conferma istologica, una multi-scala imaging approccio basato su un reporter dual mode del radionuclide-fluorescenza è stata adottato3, 6.
Tomografia a emissione di positroni (PET) è la più sensibile 3D corpo intero tecnologia di imaging attualmente disponibile che offre eccellente profondità penetrazione e la quantificazione assoluta7 con una risoluzione di < 1 mm8,9. Attualmente, preclinico cellula di rilevamento a livello di corpo intero di formazione immagine del radionuclide può rilevare in modo affidabile cellule alle densità di ~ 1.000 cellule per volume di 1 milione cellule3,6 con risoluzioni nella regione sub-millimetrica. A differenza di microscopia intravital, non riesce a rilevare cellule tumorali diffusione singola, ma non richiede interventi chirurgici (es. camere di finestra), non è limitato ad un piccolo campo di vista e non dalla dispersione e penetrazione del tessuto basso. Imaging di bioluminescenza fornisce un'alternativa economica, ma è associata con dispersione e problemi di assorbimento della luce, nonché la penetrazione di scarsa profondità e di conseguenza fortemente limitato nella quantificazione2. Formazione immagine whole-body di fluorescenza è stata utilizzata per l'acquisizione di immagini 3D, ma è molto meno sensibile rispetto a tecnologie bioluminescenza o radionuclidi2. Ciò nonostante, fluorescenza offre la possibilità di eseguire ex vivo l'analisi del tessuto a valle di cytometry o microscopia. Quest'ultimo chiude lo scala-gap tra macroscopica formazione immagine whole-body (risoluzione mm) e fluorescenza dei tessuti al microscopio analisi (µm risoluzione)3. Di conseguenza, le modalità del radionuclide e fluorescenza completano a vicenda, che vanno dal livello del corpo intero alla scala (sub-) cellulare.
Formazione immagine di gene reporter è ideale per cella prolungato monitoraggio come richiesto nella ricerca di metastasi. In questa applicazione è superiore alla cella diretto etichettatura come è (i) non interessato da diluizione di etichetta e così non è limitato nel tempo di monitoraggio e (ii) meglio riflette i numeri di cellule vive. Di conseguenza, tutto il corpo cellulare di monitoraggio è particolarmente utile per applicazioni in cui tracciabili cellule proliferano o espandono in vivo, per esempio nel cancro ricerca3,6, per la rilevazione della formazione di teratoma nel tronco ricerca di cella, o per la quantificazione di immune delle cellule espansione5.
Vari geni reporter del radionuclide-based sono disponibili2. Questi includono gli enzimi come la chinasi della timidina di HSV11 del virus di simplex di erpete (HSV1 -tk), trasportatori quali lo symporter dello ioduro di sodio (NIS) o il trasportatore della noradrenalina (NET), così come i recettori di superficie quali la dopamina D2 receptor ( D2R). NIS è una proteina trans-membrana glicosilata media attivamente la captazione di iodio, per esempio nelle cellule follicolari nella ghiandola tiroide per la successiva sintesi di ormoni tiroidei10. Questo processo è guidato da symport di Na+ e si basa sul gradiente cellulare di sodio, che viene mantenuto dal Na+/k+-ATPasi11. Di conseguenza, NIS rispecchia meglio la vita cellulare numeri rispetto altri reporter come captazione dello ioduro/radiotraccitore è collegato a un attivo Na+/k+ gradiente piuttosto che la semplice presenza del trasportatore. Tradizionalmente, è stato utilizzato radioiodio per l'imaging di NIS. Per il rilevamento delle cellule, alternative radiotraccianti NIS che non sono metabolicamente intrappolate nella tiroide sono stati segnalati essere superiore6. Questo recentemente sviluppato PET radiotraccitore [18F] tetrafluoroborate ([18F] BF4–)12,13 Mostra una farmacocinetica superiore rispetto al radioiodio6 pur essendo disponibile alle attività specifiche ad alto14 senza la necessità di strutture complesse radiochimica. [18F] BF4– possono essere sintetizzati tramite due modi diversi. Il primo metodo si basa sullo scambio di isotopo non radioattivo 19F a BF4– con radioattivo 18F12. Il secondo metodo è attraverso l'aggiunta di 18F a trifluoruro di boro non radioattivo14. Quest'ultimo metodo è stato segnalato per produrre maggiore attività specifiche14 ed è il metodo di scelta per l'imaging preclinico.
NIS è altamente espresso nei tessuti della tiroide. Essa si esprime anche nelle ghiandole mammarie salivare, lacrimale e durante l'allattamento, così come lo stomaco, ma a livelli inferiori rispetto alla ghiandola tiroide10. Quindi, la formazione immagine eccellente contrasto in altre regioni del corpo può essere raggiunto utilizzando NIS. È anche altamente omologo tra umani, ratto e topo10. Inoltre, ci sono rapporti di tossicità su espressione ectopica di NIS in cellule non-thyroidal. D'importanza, NIS non inoltre è stato associato con le risposte immunitarie ospite, in esseri umani né nei roditori. NIS è stato usato come un gene reporter per misurare promotore attività15,16,17 e gene espressione18,19,20,21,22 ,23 in molti contesti diversi. Esso è stato utilizzato anche per l'imaging non invasivo del gene terapia vettori24,25e per tenere traccia di cellule cardiache4, ematopoietico26, infiammazione5e studi neurali27. Recentemente, NIS è stato utilizzato anche come un gene reporter per metastasi di cancro in vivo3,6.
In sintesi, i principali vantaggi di questo metodo rispetto alle tecniche precedenti sono: (i) altamente sensibile non invasiva 3D in vivo localizzazione e quantificazione di metastatico diffuso, (ii) automatizzata produzione di [18F] BF4– alta attività molare, (iii) una riduzione significativa di animali necessari mediante imaging longitudinale, (iv) l'acquisizione di dati appaiati da successive sessioni di formazione immagine con conseguente miglioramento dei dati statistici, che a sua volta ulteriormente riduce l'uso di animali e (v) l'opzione intrinseco per conferma ex vivo di cellule tumorali nei tessuti da microscopia cytometry o fluorescenza.
Protocollo
Questo protocollo soddisfa tutti i requisiti fissati dalla legislazione del Regno Unito (Regno Unito) e il pannello di revisione etica locale. Quando in seguito questo protocollo, garantire che le procedure anche soddisfano tutte le esigenze dettate dalla legislazione nazionale e locale pannello di revisione etica. Garantire ogni esperimento che coinvolge radioattività è eseguita in modo sicuro e conforme alle legislazioni e normative locali.
1. progettazione e caratterizzazione di cellule tumorali per esprimere il reporter di fusione del radionuclide-fluorescenza NIS-FP
Nota: Per semplicità, mEGFP A206K è abbreviato come "GFP" e mCherry come "RFP" nelle sezioni successive del presente protocollo.
- Generazione di particelle lentivirali
- Per produrre le particelle lentivirali, co-transfect 293T cellule con i plasmidi di quattro seguenti utilizzando un metodo di transfezione adatto: (i) il gene reporter codifica plasmide (pLNT SFFV NIS-GFP o pLNT SFFV NIS-RFP (Vedi informazioni supplementari), (ii) i terza generazione lentivirali imballaggio plasmidi pRRE e (iii) OSPRO-Rev e plasmide (iv) un virus busta contenente, ad esempio, pMD2.G. Pre-mix plasmidi prima di aggiungerli al mix di transfezione. Eseguire la transfezione in una cappa di cultura cellulare.
Nota: Transfezione ulteriori informazioni vengono fornite informazioni supplementari. - Valutare il successo di transfezione dopo 48 h da microscopia di fluorescenza di grandangolari standard con impostazioni di filtro appropriate per il reporter di fusione selezionate (NIS-GFP o NIS-RFP).
Nota: I segnali di fluorescenza sono indicativi di transfezione genica reporter e quindi soltanto un surrogato per successo co-trasfezione, non un indicatore della produzione di virus di successo. - Raccogliere il surnatante contenente particelle di virus usando una siringa e rimuovere cellule galleggianti e detriti cellulari filtrando attraverso un filtro sterile in polietersulfone (PES) 0,45 µm. Trasferire in una provetta di reazione in polipropilene sterili da 1,5 mL. Eseguire lavori di virus in una cappa di cultura delle cellule e garantire che nessun virus vivo lascia l'ambiente confinato.
- Per produrre le particelle lentivirali, co-transfect 293T cellule con i plasmidi di quattro seguenti utilizzando un metodo di transfezione adatto: (i) il gene reporter codifica plasmide (pLNT SFFV NIS-GFP o pLNT SFFV NIS-RFP (Vedi informazioni supplementari), (ii) i terza generazione lentivirali imballaggio plasmidi pRRE e (iii) OSPRO-Rev e plasmide (iv) un virus busta contenente, ad esempio, pMD2.G. Pre-mix plasmidi prima di aggiungerli al mix di transfezione. Eseguire la transfezione in una cappa di cultura cellulare.
- Trasduzione e selezione di linee di cellule tumorali esprimenti NIS-FP
- Usare puro fresco virus dal punto 1.1.3 misto 1:1 (v/v) con il mezzo di crescita ottimale di ogni linea cellulare di cancro (DMEM per cellule MDA-MB-231 e RPMI 1640 per 4T1 cellule; Vedi tabella materiali per composizione media). Eseguire trasduzione in una cappa di cultura cellulare.
Nota: Un protocollo più generale si riferisce a informazioni supplementari. - Trasducono le cellule tumorali con contenenti virus medio in un'incubatrice con atmosfera umidificata contenente 5% (v/v) CO2 a 37 ° C per 72 h (lavoro su scala 6 pozzetti o 12-pozzetti utilizzando 1 mL o 0,4 mL della miscela virus dal punto 1.2.1).
- Monitorare espressione di NIS-FP delle cellule bersaglio mediante microscopia a fluorescenza.
- Espandere cellule trasdotte con successo ad una scala di 3 milioni celle utilizzando condizioni di coltura standard (Vedi ATCC per linee di cellule MDA-MB-231 e 4T1).
- Utilizzare fluorescenza-attivato delle cellule ordinano (FACS) per purificare le cellule esprimenti NIS-FP dalle cellule non trasdotte.
Nota: FACS può essere una fonte di infezioni da mycoplasma; si raccomanda di controllare per micoplasma prima produzione del virus e trasduzione ma anche dopo FACS e prima del passaggio 1.3.
- Usare puro fresco virus dal punto 1.1.3 misto 1:1 (v/v) con il mezzo di crescita ottimale di ogni linea cellulare di cancro (DMEM per cellule MDA-MB-231 e RPMI 1640 per 4T1 cellule; Vedi tabella materiali per composizione media). Eseguire trasduzione in una cappa di cultura cellulare.
- Linee cellulari di cancro esprimenti di caratterizzazione NIS-FP
- Confermare espressione reporter mediante citometria di flusso standard come descritto altrove28.
- Confermare l'integrità reporter immunoblotting standard come descritto altrove29.
- Analizzare localizzazione reporter fusione intracellulare mediante microscopia a fluorescenza confocale.
Nota: Con la macchiatura o co-espressione di un marcatore di membrana plasmatica6 e successive co-localizzazione analisi30 faciliterà questo passaggio. - Analizzare l'assorbimento del radiotraccitore nelle linee cellulari che esprime NIS-FP.
Nota: Qualsiasi substrato radioattivo di NIS compatibile con le apparecchiature esistenti è adatto, ad esempio gli isotopi di ioduro (123mi-, 124I-, 125I-, 131mi–), 99 m TcO4-, 188ReO4-, [18F] così3F– o [18F] BF4–.- Seme 106 purificato le cellule in piastre da 6 pozzetti nel loro terreno di crescita ottimale (Vedi tabella materiali) un giorno prima dell'esperimento. Preparare tutti i campioni in triplice copia e includere campioni di controllo: (i) "controlli di specificità", cioè NIS-FP che esprimono le cellule pre-incubate con un substrato competitivo di NIS per testare la specificità di assorbimento; (ii) "controlli cellulare parentale", cioè le cellule non esprimono NIS-FP, ma ricevono radiotraccitore per verificare l'assorbimento basale in cellule parentali.
- La mattina successiva, lavare le cellule una volta con terreno di coltura privo di siero.
- Incubare le cellule in coltura privo di siero in presenza di 50 kBq 99mTcO4– o [18F] BF4– per 30 min a 37 ° C (1 mL di volume totale). Per i controlli di specificità, pre-Incubare le cellule per 30 min con il substrato competitivo NaClO4– (concentrazione finale di 12,5 µM). Mantenere la concentrazione di substrato competitivo costante in tutto l'esperimento.
- Raccogliere il surnatante e trasferire 100 µ l in una provetta di raccolta preparati etichettata "galleggiante".
- Lavare le cellule due volte con 1 mL ghiacciata tampone fosfato salino (PBS) contenente Ca2 +/Mg2 +. Raccogliere ogni soluzione di lavaggio e trasferire 100 µ l di ciascuno in una provetta di raccolta preparata con l'etichetta "wash1" o "wash2", rispettivamente.
- Sollevare le cellule aggiungendo 500 µ l PBS contenente tripsina 0,25% (p/v) e 0,53 mM EDTA e incubare a 37 ° C fino a staccano le cellule (controllare visivamente utilizzando un microscopio). Trasferire la sospensione in una provetta di raccolta preparati etichettata "celle". Lavare i pozzetti con 500 µ l ghiacciata PBS contenente Ca2 +/Mg2 + e aggiungere nella provetta "celle". Agglomerare le cellule mediante centrifugazione (250 x g, 4 min, 4 ° C).
- Conteggio di tutti i quattro tipi di campione da ogni pozzetto usando una gamma contrastare adeguatamente impostato per il radioisotopo di scelta (qui: 99mTc o 18F).
Nota: A causa del gran numero di campioni in questo test, è consigliabile utilizzare un γ-contatore automatizzato in grado di correzione automatica decadenza. - Analizzare dati sommando conteggi ottenuti gamma di campioni da ogni pozzetto per determinare un conteggio di radioattività totale per pozzetto.
Nota: prendere aliquotare nei passaggi 1.3.4.4 e 1.3.4.5 conto da moltiplicarsi numeri di 10 per "galleggiante" e le frazioni di "lavare". - Esprimere l'assorbimento cellulare radiotraccitore come % assorbimento come indicato in Equ.1. Calcolare medie e deviazioni standard da esperimenti in triplice copia.
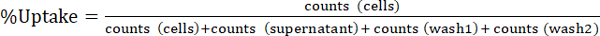 (Equ.1)
(Equ.1)
Nota: Qui, esperimenti di convalida di reporter sono descritti, ma non correlato a reporter funzioni cellulari (ad es. la proliferazione, l'invasione delle cellule di cancro, espressione genica ecc.) sono in ultima analisi specifici dell'applicazione e la responsabilità di ciascun utente.
2. creazione di modelli di tumore in vivo
- Utilizzare solo completamente caratterizzata e convalidato le celle per gli esperimenti in vivo . Controllare la fluorescenza delle cellule prima della somministrazione di qualsiasi tecnica adatta (ad es. microscopia a fluorescenza, citometria a flusso) in ogni occasione.
- Stabilire il modello di tumore nei topi femmina giovane-adulto di 5-6 settimane di vita. Utilizzare BALB/cAnNCrl o topi BALB/cAnN.Cg-Foxn1nu (nudo di BALB/c) per il modello del tumore 4T1 e NOD. CG-Prkdcscid Il2rgtm1WjI/SzJ topi (NSG) per il modello di MDA-MB-231-basato del tumore. Animali localmente la barba e usare una tecnica asettica. Direttamente iniettare 50 µ l di una sospensione contenente 106 NIS-FP esprimenti cancro cellule/mL nel cuscinetto grasso mammario tra il quarto e il quinto capezzolo31.
Nota: Per migliorare la precisione di iniezione, si consiglia di eseguire l'iniezione in anestesia generale usando un anestetico inalabile come isoflurano (1-2% (v/v), O2).
Nota: L'impianto chirurgico di pezzi del tumore dai tumori che esprimono NIS-FP è un approccio alternativo al tumore modello istituzione31. - Controllare la fluorescenza delle cellule in siti di iniezione dopo la somministrazione e nei primi giorni dopo l'iniezione. Utilizzare una fluorescenza torcia e filtro occhiali adatti per la FP di scelta.
- Monitorare la crescita del tumore e controllare per eventuali segni clinici (in particolare in momenti successivi).
Nota: Per i tumori superficiali, cioè il trapianto orthotopic del seno tumori in questo protocollo, uso pinze e la formula per il diametro medio del tumore (MTD) = ½· (L + W) 32.
3. produzione di [18 F] BF 4– utilizzando una piattaforma di sintesi (ARS) radiotraccitore automatizzato.
Nota: Qui, la sintesi di4– BF automatizzati [18F] sulla base del metodo di aggiunta 18F al trifluoruro di boro è descritto. Gli utenti di una piattaforma di ARS più ampiamente disponibile (Vedi tabella materiali), puoi scaricare il corrispondente file di Extensible Markup Language (XML) necessario per eseguire la sequenza automatizzata su questa piattaforma (File supplementari). Una spiegazione dettagliata del layout cassetta illustrato nella Figura 1 viene fornita nella (tabella 1) così come una descrizione dettagliata di ogni passaggio nel file XML sequenza (tabella 2) per supportare la traduzione a qualsiasi altra piattaforma automatizzata.
- Impostare la piattaforma di ARS, come descritto nella tabella 1 e garantire che è operativa con il corretto file XML caricato sul computer di controllo. Garantire che la piattaforma ARS viene inserita in una cappa chimica adatta per lavorare in sicurezza con GBq quantità di radioattività.
- Aspirare il ciclotrone-prodotto [18F] F– (tipicamente 1,5-2 GBq in 2-7 mL [18O] H2O) tramite il serbatoio di aspirazione (V6).
- Trappola la radioattività su una resina a scambio anionico (ad es. ammonio quaternario anione cambio cartuccia; V5 per V4), recuperare [18O] H2O in un flaconcino separato (V1).
- Eluire la [18F] F– (reverse eluizione, V5 per V4) nel reattore (V8) con 750 µ l di soluzione fisiologica 0,9% (p/v) (V2), seguita da 1,5 mL di acetonitrile (V16).
- Rimuovere l'acqua da evaporazione azeotropica sotto flusso di azoto e vuoto da riscaldamento a 105 ° C poi a 120 ° C per 5 min.
- Ridurre la temperatura del reattore a 80 ° C.
- Aggiungere 800 µ l di 15-Corona-5 in acetonitrile anidro (46 mg, 0,21 mmol) a secco [18F] F– attraverso la porta centrale del reattore (V8).
- µ L 850 di BF3. OEt2 in acetonitrile anidro (0,16 mg, 1.13 µmol) al reattore.
- Reagire per 5 min mentre sta tornando a temperatura ambiente.
- Passare la miscela di reazione attraverso una cartuccia di ossido di alluminio (V17 a V18) per intercettare il trifluoroborate.
- Restituire la miscela di reazione alla siringa S2 e diluire con acqua (circa 1,6 mL).
- Passare la miscela di reazione attraverso una seconda cartuccia di scambio anionico (V19 a V20) per intercettare il prodotto di [18F] BF4– .
- Lavare il reattore con acqua (circa 5,5 mL).
- Filtrare la soluzione risultante attraverso l'allumina e la seconda anione cambio cartucce.
- Sciacquare siringhe S2 e S3 con acqua.
- Lavare la seconda cartuccia di scambio anionico con acqua e asciugare con gas azoto.
- Eluire il prodotto (V19 a V20) con 1 mL di 0,9% NaCl (V14) nella siringa S3.
- Trasferire il prodotto (400-500 µ l) tramite la linea di uscita (V21) una fiala di raccolta del vetro da 1 mL.
Nota: Attività molare è un aspetto importante di ogni radiotraccitore. Tuttavia, la determinazione di routine non è solo che richiede tempo ma richiede anche quantità significative di appena sintetizzato [18F] BF4-, tale che diventa un fattore limitante per il numero di animali che possono essere imaged. Per verificare la riproducibilità e molare attività della risultante [18F] BF4–, si raccomanda di pianificare alcune esecuzioni di test dedicati per questo scopo. Per ulteriori dettagli sulle attività molare, si prega di fare riferimento alla sezione di discussione.
4. in vivo imaging di NIS-FP esprimere cellule da nanoPET/CT
- Preparazione degli animali
- Anestetizzare topi con isoflurane 1.5-2.0% (v/v) in O2 ad una portata di 1,0-1,5 L/min in un alloggiamento di induzione. Per controllare per look di anestesia sufficiente per assenza del riflesso del pedale.
- Garantire per applicare unguento veterinario per animali occhi per prevenire la secchezza mentre nell'ambito dell'anestesia
- Spostare il mouse su un blocchetto di riscaldamento con il naso in una maschera anestetica fornitura e caldo la coda (ad es. immersione in acqua a 37 ° C o utilizzando una lampada a raggi infrarossi).
- Diluire la soluzione di4– -BF preparata sterile filtrata [18F] a 5 MBq per 50 µ l con 0,9% soluzione salina sterile.
- Usando una siringa collegata ad un ago ipodermico (calibro 29-31), disegnare 100 µ l della soluzione [18F] BF4– , misurare la radioattività nella siringa e notare il valore e il tempo della misurazione.
- Somministrare per via endovenosa 50 µ l della soluzione [18F] BF4– nella vena caudale pre-riscaldato.
- Misurare la radioattività residua nella siringa e osservare il valore e il tempo della misurazione. La differenza tra i valori misurati a passi 4.1.7 e 4.1.5 è la dose iniettata (ID).
- Impostare un timer per il conto alla rovescia da 45 min (inizio tempo di imaging PET = 0 min).
- Posizionare il mouse sul letto dello scanner nanoPET/CT e garantire che la fornitura di anestetica è correttamente ricostituirlo.
- Verifica l'anestesia rimane completo di test per assenza del riflesso del pedale.
- Garantire il mouse viene posizionato sul letto nel modo desiderato, ad esempio la 'Sfinge'-come posizione.
- Installare dispositivi di monitoraggio degli animali secondo le raccomandazioni del produttore, ad esempio una sonda di temperatura rettale, una sonda che misura la respirazione animale o con gli elettrodi per la registrazione di elettrocardiogrammi. Controllare il corretto funzionamento di tutti gli strumenti.
Nota: Per i test di specificità in vivo con il NIS radiotraccitore [18F] BF4–, gli animali sono imaged come descritto sopra e quindi riposati svegli fino a quando la radioattività è decaduta sufficientemente per essere considerato trascurabile, es. radioattività residua 18F di 48 ore più tardi, quando solo 1.3·10−6% sarà presente nell'animale. La successiva sessione di imaging, il substrato competitivo ClO4– è somministrato alla dose di 200 mg/kg 30 min prima della somministrazione del radiofarmaco, in imaging viene eseguita come descritto sopra.
- Formazione immagine di nanoPET/CT
- Impostare i CT imaging parametri desiderati, ad esempio utilizzando la tensione di tubo nanoPET/CT 55 kVp, impostare il tempo di esposizione a 1200 ms con un grado di fare un passo angolare e proiezioni di 180 gradi.
- Impostare i parametri per acquisizione di immagini PET. Uso statico parametri di PET con una durata di 30 min, 1:5 modalità di coincidenza e 400-600 keVp energia finestra di scansione.
- Al tempo di conto alla rovescia = 15 min inizio acquisizione di immagini di CT.
- Al tempo di conto alla rovescia = 0 min inizio acquisizione di immagini PET.
- Se la formazione immagine animale serie è richiesti, lasciare che gli animali recupero completamente dall'anestesia, cioè riacquistare coscienza sotto supervisione. Successivamente, trasferirli ad un'unità di manutenzione.
- Se questo è il terminale sessione di imaging, procedere all'eutanasia animale o overdose di anestetico, aumento della concentrazione di anidride carbonica, o dislocazione del collo.
5. analisi di dati in vivo
- Ricostruire i dati di PET/CT utilizzando un algoritmo iterativo 3D basato su Monte Carlo. Assicurarsi che le correzioni per attenuazione, tempo morto e deperimento del radioisotopo sono considerate. Per dettagli fare riferimento alle istruzioni del produttore dello strumento PET/CT in uso.
- Immagini di controllo TC e PET Co-sono registrate correttamente e salvare i dati in un formato di scambio adatto come 'Digital Imaging and Communications in Medicine' (DICOM).
- Analisi delle immagini
- Caricare i file DICOM ricostruiti in un software di analisi di immagine adatta che consente il riconoscimento e la delineazione delle regioni di interesse (ROI) e successiva quantificazione del segnale di PET in questi ROIs.
- Segmentare il ROIs utilizzo manuale o adaptive thresholding per definire ROIs33,34 utilizzando un pacchetto di software adatto. Informazioni immagine anatomica dall'esplorazione di CT aiutano guida ROI assegnazione, ad esempio i tumori superficiali o volumi polmonari.
- Utilizzare il software di analisi seguendo le istruzioni del produttore e garantire dati sono calibrati per la dose di radioattività iniettata e corretto per attenuazione e decadimento radioattivo.
- Disegnare grafici visualizzando dati da questa quantificazione in vivo . Dati Express come entrambi per cento iniettato la dose/volume (%ID/mL) o valore di standard di assorbimento (SUV), che è una misura alternativa considerando la radioattività in tutto il corpo del soggetto.
- Calcolare i valori %ID/g, supponendo che la densità del tessuto per essere come l'acqua, cioè ~ 1 g/L. È interessante nota che questo presupposto può essere valido per organi con densità significativamente differenti, ad esempio del polmone o dell'osso.
- Calcolare diversi SUV per stimare il vero SUV (ad es. SUVmean, SUVmax); SUVmax è più affidabile per piccoli oggetti e viene utilizzato più frequentemente oltre SUVmean35.
6. analisi ex vivo
Eseguire le analisi a valle elencate: formazione immagine di fluorescenza (i) degli organi contenenti cellule tumorali fluorescente (tumore primario e metastasi) durante la dissezione animale, (ii) misurazione della distribuzione tissutale radiotraccitore e (iii) istologico o (iv) valutazione cytometric di organi cancerose.
- Misurazione della distribuzione del radiotraccitore γ-contando (ex vivo biodistribuzione) e formazione immagine di fluorescenza ex vivo di tessuti cancerosi.
- Misurare la radioattività dell'animale morto e osservare il valore e il tempo.
- Sezionare gli animali e raccogliere i seguenti tessuti: polmone, cuore, sangue (utilizzando tubi capillari in vetro 20 mm), fegato, stomaco, reni, milza, piccoli e grandi intestini, tiroide e ghiandole salivarie, un pezzo di muscolo della gamba e l'osso dei femori posteriori, e pertinenti e dissectible linfonodi e tessuti cancerosi.
- Misurare la radioattività della carcassa restante prima compreso quindi esclusa la coda e annotare i valori e i tempi di misura.
Nota: Radioattività nella coda può essere considerato derivante da radiotraccitore che mis-è stato iniettato e così non ha raggiunto la circolazione; quindi, questo importo del radiotraccitore non stava contribuendo alla dose iniettata. La radioattività di coda serve anche come un parametro retrospettivo di qualità di iniezione. - Pesare tutti i tessuti (utilizzare tubi pre-pesati).
- Scattare fotografie di organi cancerosi in pieno giorno e sotto la luce di fluorescenza.
Nota: Utilizzare un basamento della macchina fotografica per mantenere costante la distanza tra obiettivo e organo (o utilizzare uno strumento commerciale dedicato per questo scopo). - Incorporare gli organi/tessuti destinati a valle istologia in OCT o immergerli in formalina per la fissazione. Per altre applicazioni a valle possa differire la preparazione del campione.
- Preparare radiotraccitore standard di calibrazione in duplicato, ad esempio 0 a 1000 kBq [18F] BF4–.
Nota: Gli standard di calibrazione sono tenuti a (i) riferiscono i conteggi misurati al minuto ai valori di radioattività (in kBq) e (ii) semplificare la correzione di deperimento; 18 F– può sostituire [18F] BF4–. - Contare la radioattività di tutti i tessuti raccolti utilizzando un contatore di γ insieme con gli standard di calibrazione di radioattività dal punto 6.1.7. Nota al momento della misurazione. Se i tassi di conteggio sono troppo alti (cioè di fuori della linearità della taratura standard o indicato dal rilevatore troppo alto tempi morti), ri-contare le emivite campioni due radiotraccitore più tardi.
- Presentare i dati come %ID/g o i valori standard di assorbimento (SUV) (Equ.2).
SUV =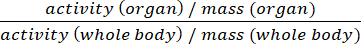 (Equ.2)
(Equ.2) - Eliminare tutti i tessuti raccolti che non sono richiesti per ulteriori analisi successive secondo le regole locali di gestione dei rifiuti.
- Analizzare i tessuti cancerogeni di cytometry o istologia secondo le preferenze dell'utente e standard di protocolli (come descritto altrove3,6,28).
Risultati
Il primo passaggio richiede ingegneria genetica delle cellule tumorali di interesse. Qui, i risultati di trasduzione lentivirale di cellule di carcinoma mammario metastatico 4T1 infiammatoria murino ed umane cellule MDA-MB-231 metastatiche con lentivirus particelle che portano il DNA codifica NIS-GFP o NIS-RFP sono mostrate. L'efficienza di trasduzione varia nelle diverse linee cellulari del cancro (Figura 2A, colonna di sinistra). Tuttavia, tutti i risultante trasdotte cellula tumorale linee sono state selezionate da FACS alla purezza (Figura 2A, destra). Microscopia di fluorescenza confocale (Figura 2B) ha dimostrato la membrana plasmatica corretta localizzazione di NIS-funzione FPs. NIS-FP è stato quantificato utilizzando l'assorbimento radiotraccitore NIS-accordata (Figura 2-2E) e hanno dimostrato la funzione di NIS e specificità. In particolare, nessuna differenza significativa tra 4T1. NIS-GFP e 4T1. Linee di cellule esprimenti NIS-RFP con simili livelli di espressione di NIS sono stati trovati (Figura 2).
In seguito completa in vitro caratterizzazione linea cellulare, modelli del tumore sono stati impostati con linee cellulari del cancro tracciabili appena generato. Ad esempio, il 4T1. Modello del tumore di NIS-GFP, un modello per il carcinoma mammario infiammatorio, è mostrato qui (Figura 3). In animali del tumore-cuscinetto longitudinale corpo intero imaging PET quindi informato sulla progressione del tumore, tra cui la diffusione metastatica (Figura 3B). Il PET radiotraccitore [18F] BF4– era necessaria per l'imaging e appena prodotta la mattina di ogni animale domestico sessione di imaging. Sintesi di [18F] BF4– è stato effettuato usando il metodo descritto di ARS. In genere, ~1.6 GBq 18F– è stato usato come input e ottenuto ~ 244 MBq [18F] BF4– in 40.5±3.9 min (N = 17). Il prodotto era analizzato mediante cromatografia su strato sottile di radio o cromatografia ionica e ha mostrato una purezza radiochimica del 94.7±1.4%. La resa di radiochimica era 19.4±4.0% (decadimento-rettificato).
Il giorno 19 dopo l'inoculazione del tumore, il tumore primario è stato chiaramente identificato usando la PET, ma non trovato nessuna metastasi. Dieci giorni più tardi (giorno 29), i topi del tumore-cuscinetto stessi erano re-imaged e metastasi a distanza in varie località in tutti gli animali (metastasi del polmone, metastasi ai linfonodi inguinali e/o ascellare vari) sono stati identificati. Nell'esempio riportato in Figura 3 ha mostrato la metastasi polmonare estesa con parecchi noduli chiaramente identificabili e quantificabili nel polmone (Figura 3B-3E). Inoltre, l'animale ha presentato con diffusione regionale del tumore nella parete peritoneale così come la metastasi all'inguinale ed entrambi i linfonodi ascellari. % Valori di ID delle singole metastasi nel polmone (Figura 3E) differivano ampiamente, ma così ha fatto i volumi occupati dei noduli metastatici sottostanti. Al contrario, valori di %ID/mL volume normalizzato (Figura 3E) erano molto più uniformi. Questo era comprensibile per le metastasi diverse nelle fasi di sviluppo analoghi (cioè sviluppato tra i giorni 19 e 29; Figura 3B). Al contrario, il valore di %ID/mL normalizzato per il tumore primario era più basso di quelle per le metastasi del polmone, che è in linea con la massa di tumore che ha avuto più tempo per progredire e rimodellare compreso l'afflusso di altri tipi di cellule (cellule stromali, cellule del sistema immunitario) , in particolare in questo modello di cancro al seno infiammatorio.
Guidato da immagini in vivo e la fluorescenza delle cellule tumorali (visibile durante la dissezione animale sotto luce di fluorescenza), piccoli organi profondi come i linfonodi in modo affidabile sono state raccolte e, allo stesso tempo, valutati per contenuto (nodulo canceroso Figura 4A). Mentre il segnale di fluorescenza durante la dissezione animale era indicativo della presenza di cellule del tumore, era importante garantire che questa classificazione è stata accompagnata da misure di radioattività ex vivo dei tessuti raccolti. Figura 4B Mostra i valori standard di assorbimento (SUV) ottenuti per i vari tessuti in una coorte di tre animali, che ha presentato con la metastasi. NIS-esprimendo in modo endogeno di organi come la tiroide e le ghiandole salivari (raccolte combinati) o lo stomaco inoltre hanno mostrato l'assorbimento previsto radiotraccitore alta. Inoltre, questo approccio di NIS-FP ha permesso l'identificazione di cellule di cancro semplice durante l'istologia (Figura 4). Questi dati di esempio di immunofluorescenza istologia ha mostrato il vascularization del tumore nel 4T1. Modello di tumore di NIS-GFP. Questi dati inoltre ha mostrato che il reporter di NIS-GFP riseduto principalmente nelle membrane del plasma del tumore cellule anche in vivo (Figura 4), conseguenza di convalidare i risultati di assorbimento.
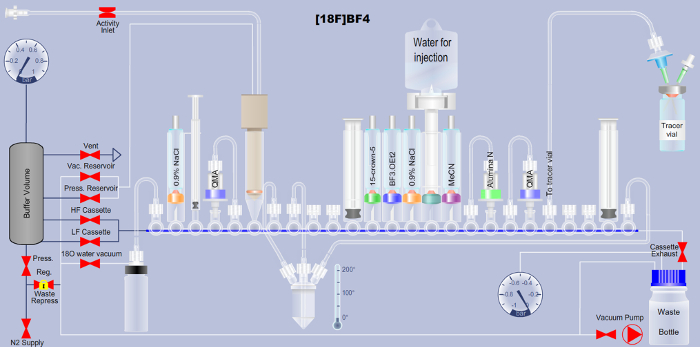
Figura 1. Schema di dettagliare il set-up della piattaforma sintesi radiotraccitore automatizzati per la produzione di [18F] BF4– tramite il metodo di aggiunta di fluoro-18-a-boro trifluoruro. I nomi dei reagenti sono stampati sui rispettivi tubi nello schema. QMA è l'abbreviazione di scambio anionico di ammonio quaternario e indica il materiale usato separazione cromatografica di fase solida. Ulteriori dettagli sono disponibili nelle tabelle 1 e 2. Clicca qui per visualizzare una versione più grande di questa figura.
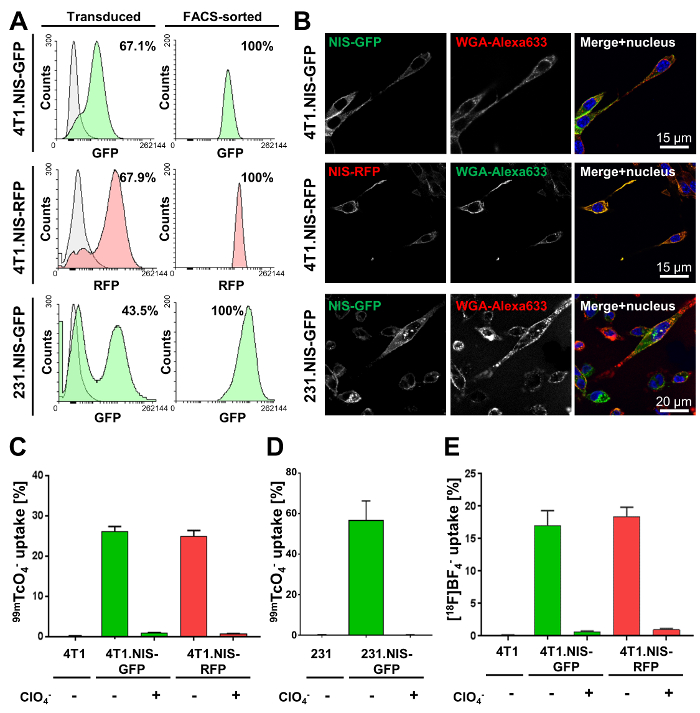
Figura 2. Risultati tipici caratterizzazione di linee cellulari tumorali che esprimono stabilmente NIS-GFP o NIS-RFP. (A) le linee cellulari indicati sono state realizzate utilizzando lentivirus trasferimento o NIS-GFP o NIS-RFP. Colonna di sinistra mostra la popolazione trasdotte (verde o rosso fluorescente) rispetto alle cellule parentali rispettive (grigio; 4T1 e cellule MDA-MB-231, rispettivamente). Le percentuali mostrano efficienze di trasduzione come determinato tramite flusso cytometry. Colonna di destra mostra i risultati di flusso cytometric analisi dopo la purificazione di FACS delle popolazioni miste nella colonna di sinistra. Tutte le linee cellulari sono state trovate per essere > 99% puro per indicato di cellule che esprimono NIS (mediante citometria a flusso). (B) microscopia di fluorescenza confocale di linee cellulari purificate Mostra localizzazione di membrana plasmatica di NIS-GFP o NIS-RFP nelle linee cellulari rispettivi. WGA-Alexa633 è stato utilizzato come marcatore di membrana plasmatica. (C, D) Validazione funzionale della proteina NIS-FP espressa in indicato recentemente generato linee cellulari del cancro. Funzione di NIS è stata misurata utilizzando il radiotraccitore 99mTcO4– (50 kBq per milione cellule). Come controlli, cellule parentali sono state usate come pure di cellule esprimenti reporter di fusione che sono state trattate con il perclorato di co-substrato di NIS, prima e durante l'esecuzione del test (controllo di specificità). Risultati dimostrano chiaramente la funzione di NIS-FP e specificità in tutte le linee cellulari. (E) validazione funzionale del 4T1. Linee cellulari di NIS-FP utilizzando [18F] BF4– come un radiotraccitore per NIS. Tutte le altre condizioni erano identici a (C). D'importanza, l'assorbimento relativo molto simile risultati sono stati ottenuti per entrambe le linee cellulari derivate 4T1 con entrambi radiotraccianti (Figura 2 ed E), quindi giustificando l'uso intercambiabile di entrambi per la caratterizzazione funzionale in vitro di Linee cellulari che esprime NIS-FP. Clicca qui per visualizzare una versione più grande di questa figura.
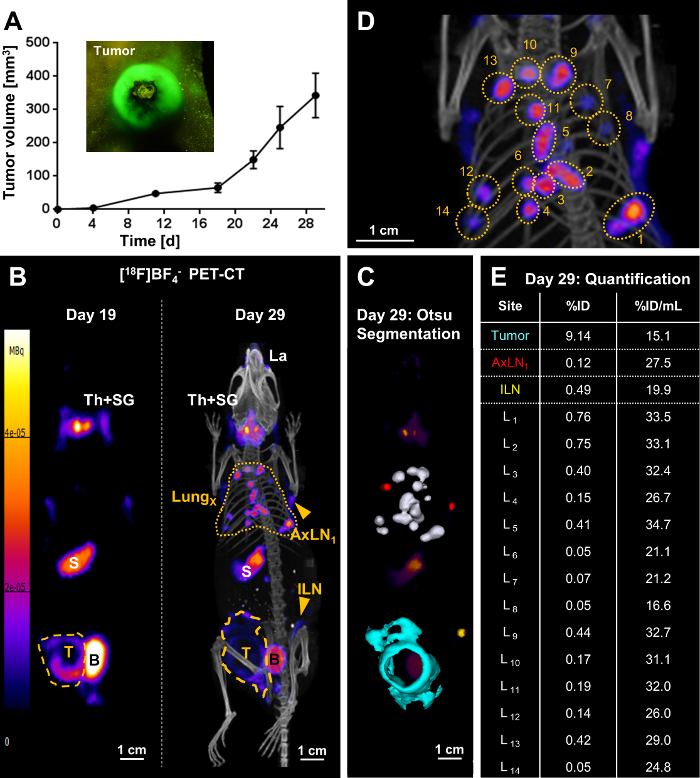
Nella figura 3. Risultato rappresentativo della metastasi rilevamento di [18F] BF4–-PET/CT imaging in un mouse tenendo un 4T1. Tumore di NIS-GFP. (A) 1 milione 4T1. NIS-GFP le cellule sono state iniettate nelle pastiglie di grasso mammarie dei topi di 5-6 settimane BALB/c CanN.Cg-Foxn1nu/CRL. e crescita del tumore è stata seguita nel tempo utilizzando pinze. A causa della fluorescenza di GFP delle cellule tumorali, valutazione visiva grezzo di identificazione/crescita era anche possibile usando una torcia di fluorescenza ed i vetri di filtro adatto (vedi riquadro). (B/sinistra) Il inoculazione di giorno 19 post del tumore, il tumore primario (linea tratteggiata gialla) è stato identificato chiaramente ma nessuna metastasi. L'immagine presentata è una proiezione di massima intensità (MIP) dell'immagine PET. Inoltre sono stati registrati segnali endogeni di NIS (descrittori di bianchi), vale a dire la tiroide e le ghiandole salivari (Th + SG), dello stomaco (S) e, a livelli molto bassi, alcune parti delle ghiandole mammarie e lacrimale. Il segnale della vescica (B) deriva dall'escrezione di tracciante. (B/destra) Sull'inoculazione di giorno 29 post del tumore, metastasi è stato chiaramente identificata: metastasi multiple nel polmone (linea tratteggiata gialla) così come i linfonodi metastatici (ILN, AxLN; frecce gialle). L'immagine presentata è un MIP dell'immagine PET/CT. Il tumore primario (linea tratteggiata gialla) è cresciuta non solo in una forma globulare a questo punto del tempo, ma anche aveva invaso nella parete peritoneale. (C) un'implementazione 3D della tecnica Sogliatura Otsu abilitato rendering 3D superficiale dei tessuti cancerosi; Questi sono sovrapposta di un MIP di PET. Le metastasi del polmone sono mostrate in bianchi, metastatici linfonodi ascellari in rosso, i linfonodi inguinali metastatici in giallo e il tumore primario che ha invaso la parete peritoneale in turchese. (D) un'immagine di Blow-up di PET/CT MIP (B/di destra) per indicare le metastasi del polmone individuali. (E) captazione radiotraccitore tessuti cancerogeni è stato quantificato da immagini 3D (% ID) e normalizzato dai loro rispettivi volumi (%ID/mL). Metastasi polmonari individuali corrispondono alla numerazione in (D). Clicca qui per visualizzare una versione più grande di questa figura.
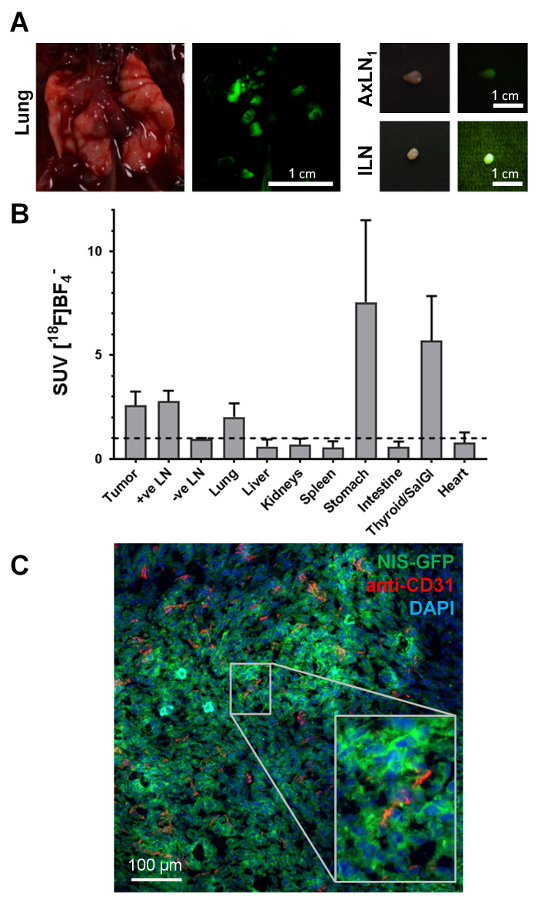
Nella figura 4. Tipici esempi di ex vivo dati accessibili da topi del tumore-cuscinetto NIS-FP. (A) durante la raccolta del tessuto per analisi successive, le proprietà fluorescenti delle cellule del tumore che esprime NIS-FP servito come un indicatore guida dissezione animale. Come esemplari, tessuti dall'animale in Figura 3, cioè il polmone con parecchie lesioni metastatiche e due linfonodi positivi sono mostrati. Fotografia del giorno così come immagini di fluorescenza sono mostrati. Le immagini di fluorescenza sono state scattate con la fotocamera stessa come le immagini del giorno ma sotto eccitazione luce blu (filtro passa-banda di 450±10 nm) con un filtro di emissione verde (filtro passa-banda di 530±30 nm) davanti all'obiettivo della fotocamera. (B) distribuzione del radiotraccitore nei diversi organi ('biodistribuzione') degli animali con 4T1. Tumori di NIS-GFP (N = 3; l'inoculazione del tumore di giorno 29 post; 5 MBq [18F] BF4–). Standard di assorbimento (SUV) valori sono stati calcolati e valori > 1 indicano specifici accumulazione del radiotraccitore negli organi rispettivi. I dati mostrano l'assorbimento specifico radiotraccitore nei tessuti cancerogeni, linfonodi metastatici (come identificato da formazione immagine e dissezione sotto luce di fluorescenza), cioè il tumore primario del polmone (è stata sezionata nel suo insieme senza separare singole metastasi), così come gli organi che esprimono in modo endogeno NIS, cioè della tiroide e delle ghiandole salivari e dello stomaco. (C) l'istologia di immunofluorescenza del tumore primario dal mouse stesso come mostrato nella Figura 3. Il tumore primario era raccolto, incorporato in OCT e congelato prima di essere sezionato (10 µm) e trattato per la colorazione. Le cellule tumorali che esprime NIS-GFP sono state identificate direttamente senza la necessità di macchiatura dell'anticorpo. Vasi sanguigni sono stati macchiati con un anticorpo di coniglio contro topo PECAM-1/CD31 (2 µ g/mL) e un anticorpo secondario anti-coniglio di capra Cy5-coniugati. I nuclei sono stati macchiati con 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole (1 µ g/mL) e il campione montato in poli (alcole del vinile - acetato di vinile) contenente 2,5% (p/v) Dabco come un antifade. Immagini confocal sono state ottenute utilizzando un microscopio confocale con le impostazioni appropriate per 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole, GFP e Cy5. Questi dati di esempio che mostrano chiaramente il 4T1. Tumore di NIS-GFP è vascolarizzato ma quel vascolarizzazione differisce anche nella sua estensione (cfr in alto a sinistra con in basso al centro). Viene inoltre illustrato che il reporter di NIS-GFP risiede principalmente nelle membrane del plasma del tumore le cellule in vivo (inserto), conseguenza di convalidare i risultati in vitro l'assorbimento. Clicca qui per visualizzare una versione più grande di questa figura.
| Valvola del collettore FASTlab | Reagente, solvente, cartuccia o tubazione * | Dettagli | ||
| V1 | Tubazione del silicone di [18O] H2O rifiuti di bottiglia | 14 cm | ||
| V2 | 0,9 soluzione di NaCl %, 750 µ l | flaconcino di 11 mm | ||
| V3 | Siringa S1 | 1 mL | ||
| V4 | cartuccia a scambio anionico C1, pre-condizionato con NaCl di 1m (10 mL) e H2O (10ml) | ad es. Settembre-Pak Accell Plus QMA Plus Light (acque, cat. Lol WAT023525) | ||
| V5 | Tubazione del silicone per cartuccia a scambio anionico C1 | 14 cm | ||
| V6 | [18O] H2O / serbatoio di aspirazione18F | Max 5 mL | ||
| V7 | Tubazione del silicone al contenitore del reattore (lato sinistro; ingresso gas) | 14 cm | ||
| V8 | Tubazione del silicone al contenitore del reattore (porto centrale; liquido entrata/uscita) | 14 cm | ||
| V9 | Chiuso | |||
| V10 | Chiuso | |||
| V11 | Siringa S2 | 5 mL | ||
| V12 | 15-Corona-5, 46 mg a 800 µ l MeCN | flaconcino di 11 mm | ||
| V13 | Trifluoroborate dietilico etherate, 0,14 µ l in µ l 850 MeCN (diluire µ l 14 di BF3. OEt2 con 1 mL MeCN. Diluire 10 µ l di questa soluzione a 850 µ l con MeCN). | flaconcino di 13 mm | ||
| V14 | 0,9 soluzione allo % NaCl, 1 mL | flaconcino di 13 mm | ||
| V15 | Sacca idrica spike | |||
| V16 | Acetonitrile (MeCN), 1,5 mL | flaconcino di 13 mm | ||
| V17 | Tubazione del silicone per cartuccia di allumina neutra C2 | 14 cm | ||
| V18 | Cartuccia di allumina neutra C2, pre-condizionato con H2O (10ml), acetone (10 mL) e aria (20 mL) | ad es. Settembre-Pak allumina N Plus luce (acque, cat. Lol WAT023561) | ||
| V19 | Tubazione del silicone per cartuccia a scambio anionico C3 | 14 cm | ||
| V20 | cartuccia a scambio anionico C3, pre-condizionato con NaCl di 1m (10 mL) e H2O (10ml) | ad es. Settembre-Pak Accell Plus QMA Plus Light (acque, cat. Lol WAT023525) | ||
| V21 | Tubazione del silicone per fiala di raccolta | 40 cm | ||
| V22 | Chiuso | |||
| V23 | Chiuso | |||
| V24 | Siringa S3 | 5 mL | ||
| V25 | Tubazione del silicone al contenitore del reattore (destra; per vuoto) | 40 cm | ||
| * Nota: A causa le punte di plastica, il volume morto per fiale di 11 mm e 13 mm fiale è di circa 0,35 mL e 0,4 mL, rispettivamente. Pertanto, gli importi effettivi dei reagenti trasferiti al reattore sono leggermente diversi. Tutte le quantità indicate in questo metodo si intendono gli importi effettivamente introdotti in ogni flacone di reagente. | ||||
Tabella 1. Descrizione del layout cassetta per la sintesi di4– -BF automatizzati [18F] tramite il metodo di aggiunta di fluoro-18-a-boro trifluoruro (cfr. Figura 1).
| Passaggi della sequenza | Commento | ||||
| [1 - 2] | Pressurizzare il sistema e sciacquare il collettore con N2 | ||||
| [3-15] | Siringa di risciacquo S3 due volte con H2O (V15), sciacquare il collettore con N2 | ||||
| [16-23] | Pressurizzare i flaconi dei reagenti in posizioni V16, V14, V13, V12, vampate di calore del collettore con N2 tra ogni flaconcino | ||||
| [24-26] | Aprite l'attività (V6) | ||||
| Collegare il flaconcino contenente 18F. Se il volume totale è > 5 mL, solo inserire l'ago a metà strada nel flaconcino prima di continuare. | |||||
| [27-39] | Nelle vicinanze dell'ingresso di attività (V6), trappola 18F in cartuccia QMA C1 (V5), raccogliere [18O] H2O in bottiglia dei rifiuti (V1). Se il volume totale è > 5 mL, la sequenza al punto 37, ritorno al punto 26, inserire completamente l'ago nel flaconcino contenente 18F, mettere in pausa e riprendere il processo. | ||||
| [40] | Chiudere la bottiglia di scarico di [18O] H2O (V1), flush il collettore con N2 | ||||
| [41] | Pressurizzare il flaconcino di eluente in posizione V2 | ||||
| [42-44] | Aprire la valvola di reattore V8, aspirare eluente da V2 nella siringa S1 | ||||
| [45-50] | Eluire cartuccia QMA C1 nel reattore (V8) utilizzando la soluzione salina dalla siringa S1, impostare la temperatura del reattore a 90 ° C | ||||
| [51] | Svuotare cartuccia QMA C1 con N2 e aumentare la temperatura del reattore a 105 ° C | ||||
| [52-53] | Attingere acetonitrile V16 in siringa S2 | ||||
| [54-57] | Trasferimento acetonitrile da siringa S2 al reattore (V8) | ||||
| [58-60] | Riscaldare il reattore a 120 ° C per 5 min, far evaporare il solvente con un flusso del N.2 del reattore (V7). | ||||
| [61-65] | Impostare la temperatura a 105 ° C, asciutto siringa S1 con N2 | ||||
| [66-69] | Aspirare la soluzione 15-Corona-5 da V13 nella siringa S2, aumentare la temperatura del reattore a 120 ° C | ||||
| [70-71] | Ridurre la temperatura a 105 ° C, flush il collettore con N2 | ||||
| [72] | Raffreddare il reattore (impostare la temperatura a 40 ° C) per 5 min | ||||
| [73-78] | Impostare la temperatura del reattore a 80 ° C, trasferire la soluzione 15-Corona-5 dalla siringa S2 al reattore (V8) | ||||
| [79-81] | Disegnare il BF3. OEt2 soluzione da V14 nella siringa S2 | ||||
| [82-87] | Trasferire il BF3. OEt2 soluzione dalla siringa S2 al reattore (V8), lavare la linea reattore con N2 | ||||
| [88] | Sciacquare il collettore con N2 | ||||
| [89] | Reagire per 5 min, lasciare che la temperatura torni a RT | ||||
| [90-95] | Trasferire la miscela di reazione (V8) siringa S2 | ||||
| [96-104] | Passare la miscela di reazione tramite cartuccia allumina N C2, in siringa S3 | ||||
| [105] | Sciacquare il collettore con N2 | ||||
| [106-109] | Restituire la miscela di reazione alla siringa S2 | ||||
| [110-112] | Svuotare la siringa S3, disegnare H2O (V15) nella siringa S2 per diluire la miscela di reazione | ||||
| [113-115] | Caricare la miscela di reazione sulla cartuccia QMA C3 | ||||
| [116-118] | H2O (V15) di aspirare nella siringa S2 | ||||
| [119-124] | Sciacquare il reattore (V8) con H2O dalla siringa S2, aspirare i lavaggi in siringa S2 | ||||
| [125-128] | Passare i lavaggi attraverso cartucce C2 e C3 | ||||
| [129-130] | Asciugare le cartucce e il collettore con N2 | ||||
| [131-136] | Lavare la siringa S1 con H2O (V15) | ||||
| [137-142] | Lavare la siringa S2 con H2O (V15) | ||||
| [143] | Sciacquare il collettore con N2 | ||||
| [144-147] | H2O (V15) di aspirare nella siringa S2 | ||||
| [148-151] | Lavare la cartuccia QMA C3 con H2O dalla siringa S2 | ||||
| [152-153] | QMA cartuccia C3 con N2 e sciacquare il collettore con N2 | ||||
| [154-157] | Eluire cartuccia QMA C3 con 0,9% NaCl (V14) nella siringa S3 | ||||
| [158-161] | Trasferire il prodotto dalla siringa S3 a fiala di raccolta (V21) | ||||
| [162-163] | Cartuccia a filo QMA C3 con N2 per fiala di raccolta (V21) | ||||
| [164-166] | Sciacquare il collettore con N2 | ||||
| [167-170] | Cartucce a filo C2 e C3 (per rifiuti di bottiglia) e il collettore con N2 | ||||
| [171] | Sciacquare il tubo di raccolta (V21) con N2 | ||||
Tabella 2. Descrizione della procedura nel file XML sequenza.
Discussione
Il primo passo per eseguire il rendering cancro cellule rintracciabili nel vivo di questo metodo richiede ingegneria ad esprimere il reporter di fusione di NIS-FP. La scelta della proteina fluorescente al reporter di fusione è critica come oligomerizing proteine fluorescenti può condurre a reporter artificiale clustering, quindi influire negativamente sulla sua funzione. Abbiamo avuto successo con proteine fluorescenti monomeriche provate come mEGFP (con la mutazione monomerizing A206K36,37), mTagRFP o mCherry. NIS può essere di umani o origine del mouse (hNIS o msNIS) a seconda dello scopo dell'esperimento e il modello di cancro. L'efficienza di trasduzione varia generalmente tra linee cellulari tumorali differenti. Tuttavia, linee cellulari del cancro generato successivamente sono purificati mediante FACS in questo protocollo, riducendo così la necessità per l'ottimizzazione delle condizioni di trasduzione. Trasduzione con elevata molteplicità di infezione non è sempre consigliabile come più costrutto integrazione nel genoma è suscettibile di provocare non solo nella più alta espressione di costrutto, ma anche nella modifica di genoma più indesiderati/non regolamentata. Pertanto, è importante lasciare che policlonale di cellule trasdotte crescere alla stabilità dell'espressione (monitorata da citometria a flusso) ed evitare l'ordinamento i cloni più brillanti solo da FACS. Rende anche validazione funzionale delle caratteristiche di non-reporter cruciale prima che queste cellule dovrebbero essere utilizzate per gli esperimenti in vivo . Un'alternativa sviluppata di recente di consegna del gene virale è gene editing tecnologia38, che offre controllo più specifico sui siti di integrazione virale. Analisi dell'espressione mediante citometria a flusso e immunoblotting è importante. Citometria a flusso permette l'acquisizione dei dati basati sulla popolazione singola cella, ad esempio, per esaminare se c'è qualsiasi deriva nei livelli di espressione di reporter nel corso del tempo. Si basa sulla frazione FP solo, a meno che le cellule sono anche colorate con un anticorpo diretto contro NIS superficiale o totale. Citometria a flusso non informa sull'integrità del reporter di fusione. Al contrario, immunoblotting report sull'integrità del reporter fusione. Il peso molecolare di NIS e la FP deve essere aggiunto per determinare il peso molecolare previsto della selezionate NIS-FP confocale fluorescenza microscopia ha dimostrata fusione reporter colocalizzazione con l'agglutinina germe di grano marcatore di membrana plasmatica in tutto appena fatto di linee cellulari. Questa era la posizione cellulare prevista per la maggior parte della proteina e indicato una via libera pietra miliare per la successiva validazione funzionale. Se minimal/no NIS-FP è stato trovato sulla membrana plasmatica (ad es. solo in compartimenti cellulari interne), questo indicherebbe un problema biologico delle cellule con il reporter di fusione in questa linea cellulare, o una potenziale mutazione del reporter fusione che interessano la traffico intracellulare. È interessante nota che non abbiamo osservato un tal caso in una qualsiasi delle cellule tumorali abbiamo testato finora, che comprendeva: A375P, A375M2, SK-Mel28, WM983A/B (melanoma umano); MCF-7, MDA-MB-231, MDA-MB-436 (cancro al seno umano); NCI-H1975 (cancro polmonare umano); SK-Hep1 (cancro del fegato umano); 4T1, 4T1.2, 66cl 4, 67NR, FARN168 (cancro al seno infiammatorio murino); B16F0, B16F3, B16F10 (melanoma murino); MTLn3 (adenocarcinoma del seno del ratto).
Funzione di NIS dovrà essere misurati usando analisi di assorbimento con substrati radioattivi di NIS. A causa della SPECT radiotraccitore 99mTcO4– essere prodotta dal generatore e quindi ampiamente disponibile negli ospedali senza bisogno di alcuna sintesi radiotraccitore, oltre ad avere una più conveniente più lunga emivita (6,01 h per 99 m TC rispetto ai 110 min per 18F), abbiamo usato questo substrato di NIS per routine validazione funzionale di nuove linee di cellule esprimenti NIS-FP. Pre-blocco delle cellule che esprimono NIS con il perclorato di sodio co-substrato NIS ha provocato riduzione/abolishment previsto dell'assorbimento del radiotraccitore, dimostrando la specificità della captazione del radiofarmaco. Questo test di specificità di NIS è un passo critico convalida. Se un esperimento di specificità di NIS non comporterebbe l'assorbimento ridotto radiotraccitore paragonabile alle rispettive cellule parentali, o si è verificato un errore tecnico durante l'esperimento, o la captazione del radiofarmaco non era dovuto a NIS. È anche possibile che sodio perclorato pre-blocco riduce l'assorbimento del radiotraccitore in una linea cellulare parentale; Questo sarebbe identificare linee cellulari con espressione endogena di NIS funzionale (ad es. stimolata della tiroide cellule6).
Un vantaggio cruciale di questo protocollo di imaging è che informazioni sono raccolti in 3D e nel corso del tempo. Questo consente il confronto di immagini dall'animale stesso nel tempo, fornendo dati appaiati e superando così i problemi causati da variabilità. Questo contrasta con metodi di valutazione relative metastasi più non-imaging che si basano su sacrificare animali diversi intervalli di tempo diversi. In Figura 3B è evidente diffusione di come metastatico ed escrescenza progredito nel tempo in un singolo animale. I segnali rilevati da formazione immagine di PET/CT sono fondamentalmente causati dall'espressione di NIS. Questo include tutti i segnali da esogenicamente NIS-esprimendo le cellule tumorali, così come tutti gli organi in modo endogeno che esprimono NIS. Endogeno NIS tipici segnali sono trovati nella tiroide e ghiandole salivari, stomaco e, a livelli bassi in alcune parti delle ghiandole mammarie e lacrimale. Oltre a espressione endogena di NIS, NIS radiotraccitore [18F] BF4– anche è escreta attraverso i reni, quindi spiegare l'assorbimento del radiotraccitore in vesciche piene di urina. L'assorbimento del rene non è più rilevabile al punto imaging tempo raccomandato in questo protocollo (45 min post radiotraccitore iniezione6). Se i segnali da vesciche piene di urina dovrebbero portare a problemi di segnale--fondo, la vescica può essere svuotata meccanicamente sotto anestesia prima di formazione immagine. D'importanza, i segnali endogeni possono variare tra ceppi di animali. Si osserva inoltre che l'espressione endogena di NIS nelle ghiandole mammarie può essere superiore sotto allattamento condizioni10. Nel caso presentato e nei casi di quelle linee di cellule metastatico con successo caratterizzati prima (cfr. elenco sopra), non abbiamo trovato espressione endogena di NIS per interferire significativamente con rilevamento di metastasi. È degno di nota, che [18F] BF4– rimane più disponibile per l'assorbimento nei tessuti tumorali rispetto a ioduro, perché ioduro è metabolizzato in ormoni tiroidei6. Questo fenomeno potrebbe anche contribuire a quantità maggiori di radioiodio nel flusso sanguigno rispetto [18F] BF4- 6. Per diverse applicazioni (cellula tumorale in altri cancri o non-cancro cellula monitoraggio delle applicazioni di monitoraggio), questo potrebbe essere diverso, e si raccomanda pertanto di valutare se l'espressione endogena di NIS rischia di causare problemi di segnale--fondo attraverso esperimenti preliminari. Un aspetto importante nell'imaging preclinico è l'attività molare del radiotraccitore. Il metodo qui descritto utilizza ~1.5 GBq 18F– come materiale iniziale14 e ha dimostrato di produrre molare attività significativamente sopra il metodo di sostituzione precedentemente segnalati12. [18F] BF4– prodotta a molare attività ≤ 1 GBq/µmol12 può causare il minor assorbimento nei tessuti che esprimono NIS. Questo è di particolare importanza quando la quantità iniettata di radioattività per chilogrammo è alta, cioè quando sono piccoli animali come topi imaged39; è meno importante nell'essere umano l'impostazione40. Alta attività molare sono quindi imperativo per l'imaging PET preclinici di alta qualità. Molare attività ottenuti con il boro trifluoruro aggiunta metodo14, che è mostrata nella sua forma automatizzata in questo protocollo, superare questo problema. Inoltre, vale la pena nota che il protocollo presentato per la sintesi di4– BF [18F] non è conforme alle pratiche di buona fabbricazione (GMP) e quindi idonei ad essere utilizzati nei test clinici umani in questa forma. Un protocollo GMP (tramite il metodo di sostituzione 18F a medicinali BF4–) è disponibile altrove40.
Formazione immagine di PET/CT permette la visualizzazione della captazione del radiofarmaco, che è indicativo dell'assorbimento di NIS-mediata radiotraccitore derivanti dalle cellule tumorali che esprime NIS-FP. Ancora più importante, i segnali di PET associati possono essere quantificati. È necessario applicare procedure di soglia affidabili per garantire una differenziazione coerenza e imparziale dei segnali rilevanti da qualsiasi contesto potenziale. Come lo sfondo varia in diverse località in vivo, è importante considerare segmentazione e soglia di locali/regionali. Un tale metodo è stato sviluppato da e prende il nome di Otsu34, e la sua attuazione 3D è impiegato per il rendering 3D del tumore primario e metastasi in questo protocollo. In genere, l'immagine vista dall'osservatore visivamente corrisponde al meglio i valori di dose (% ID) quantificati % iniettato. Per quanto riguarda la quantificazione basata su immagine, è anche importante normalizzare i valori di radioattività misurata dei diversi tessuti ai loro volumi. Ci sono due modi principalmente usati esprimere i risultati normalizzati, (i) % ID per volume (ad es. %ID/mL) e valore (ii) standard di assorbimento (SUV35). Differiscono in quanto %ID/mL prende in considerazione il volume individuale solo, mentre il SUV è una misura che è relativo la radioattività media attraverso l'intero animale. È anche importante notare che imaging NIS rende il volume del tumore dal vivo (LTV) accessibile, perché le cellule morti/morendo non sintetizzare ATP non è più possibile importare radiotraccitore10. Questo spiega la grande area di basso segnale all'interno del tumore primario (tumore "a forma di ciambella") che indica aree di morte/necrosi del tumore delle cellule. La cosa importante, LTV era una misura molto più affidabile del carico del tumore rispetto al volume del tumore grezzo accessibile tramite le misure di pinza (che non prende in redditività conto e valuta solo le regioni del tumore superficiale).
Dei principali vantaggi di questa strategia di doppia modalità rilevamento è evidente quando la raccolta di tessuti dopo l'abbattimento degli animali. Guidato da immagini in vivo e assistito da cellule tumorali fluorescente durante la dissezione animale, piccole e profonde organi/metastasi anche può essere raccolto in modo affidabile. Metodologia di conservazione/sezionamento di tessuto congelato consente l'imaging di fluorescenza diretta di GFP senza l'esigenza di colorazione con un anticorpo anti-GFP, ma a scapito della conservazione del tessuto strutturale ridotta rispetto alla formalina-fisso metodologia di paraffina (FFPE). Quest'ultimo criticamente richiede anche anti-FP colorazione, perché il metodo FFPE è incompatibile con la conservazione intatta delle proteine fluorescenti (a causa di fissazione/disidratazione/rehydration). Mentre il segnale di fluorescenza è indicativo della presenza di cellule del tumore, è importante garantire che questa classificazione è confermata tramite le misure di radioattività ex vivo dei tessuti raccolti ('biodistribuzione'). Ex vivo misure di radioattività sono più sensibili di rilevamento visivo della fluorescenza, quindi può consentire l'identificazione del cancro cellula-dipendente di segnali che altrimenti rimarrebbero inosservati. Nel caso di un terminale sessione di imaging, è fondamentale notare con precisione la quantità iniettata radiotraccitore, nonché i tempi di misure di radioattività del radiotraccitore, iniezione animale, animale abbattimento e calibrato contatore a scintillazione misure di tessuti raccolti. Questo è fondamentale per garantire la correzione per il decadimento del radiotraccitore e quindi attivare analisi affidabile biodistribuzione.
Consente di imaging PET/CT ripetuto 3D non invasivo quantificazione della progressione del tumore, compresa la valutazione della diffusione metastatica a livello di tutto il corpo. Questa caratteristica è un vantaggio significativo rispetto ai metodi convenzionali, che spesso si basano su larghe coorti di animali che si sono sacrificati per la valutazione della progressione del tumore a diversi intervalli di tempo. I vantaggi di questo approccio basato su formazione immagine sono: (i) altamente sensibile non invasiva 3D in vivo quantificazione, (ii) una riduzione significativa del numero di animali dalla possibilità di ripetizione di imaging, (iii) l'acquisizione di dati appaiati longitudinali da successive sessioni di miglioramento delle statistiche escludendo variabilità, che a sua volta ulteriormente riduce il numero di animali, di imaging (iv) produzione di [18F] BF4– automatizzata alle attività specifiche ad alto e (v) il intrinseco opzione per ex vivo conferma nei tessuti mediante metodologie di fluorescenza quali microscopia o cytometry.
In vivo delle cellule di rilevamento sono un settore in crescita. Esso è stato alimentato da recenti progressi nella tecnologia, che ha provocato la risoluzione potenziata, limiti di rilevabilità e capacità di multiplex (tramite imaging multi-modale) di imaging. In questo protocollo, applichiamo questo concetto per monitorare la progressione del tumore, tra cui la metastasi delle cellule di cancro spontaneo in 3D da formazione immagine di ripetizione. Le applicazioni includono studi volti a svelare i meccanismi della metastasi delle cellule di cancro spontaneo. Ad esempio, le cellule del tumore tracciabili potrebbero essere utilizzate per studiare l'impatto delle componenti differenti delle cellule immuni (come presente/funzionale in ceppi animali di differenti livelli di immunocompromisation) il processo metastatico. Allo stesso modo, l'impatto dei singoli geni, nel ceppo animale o la linea cellulare di cancro, potrebbe essere studiato. Inoltre, il protocollo presentato potrebbe essere utilizzato per valutare/convalidare l'efficacia di farmaci specifici o concetti terapeutici sulla progressione del tumore. D'importanza, questa coppia di gene: radiotraccitore reporter per l'imaging PET (NIS: [18F] BF4–) potrebbe essere utilizzato anche per applicazioni di rilevamento differenti delle cellule. Ad esempio, diverse terapie cellulari attualmente stanno emergendo come promettenti approcci terapeutici. Questo include cellulare terapeutica per cancro trattamento41 ma anche trapianto42 e impostazioni44 43,di medicina rigenerativa. Corpo intero in vivo delle cellule di rilevamento sta diventando sempre più importante per lo sviluppo e la traduzione clinica della terapia cellulare, ad esempio, per valutare la sicurezza e per il monitoraggio della terapia.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
La ricerca è stata sostenuta dal King College di Londra e UCL completa cancro Imaging centro, finanziato da Cancer Research UK ed EPSRC in associazione con la MRC e DoH (Inghilterra); il National Institute for Health Research (NIHR) centro di ricerca biomedica sede di Guy e St. Thomas' s NHS Foundation Trust e College Londra del re; il centro di eccellenza in ingegneria medica finanziato dalla Wellcome Trust ed EPSRC sotto concessione numero WT 088641/Z/09/Z; un Cancer Research UK multidisciplinare progetto Award GOF e PJB grant Health Partners di un re a GOF. Gli scanner nanoPET/CT e nanoSPECT/CT sono stati acquistati e mantenuti da una sovvenzione attrezzature il Wellcome Trust. Le opinioni espresse sono quelle degli autori e non necessariamente quelle di NHS, la NIHR o il DoH.
Materiali
| Name | Company | Catalog Number | Comments |
| Step 1) Engineering and characterization of cancer cells to express the radionuclide-fluorescnece fusion reporter NIS-FP. | |||
| 2'-(4-ethoxyphenyl)-5-(4-methyl-1-piperazinyl)-2,5'-Bi-1H-benzimidazole | Thermo Scientific | H3570 | Trivial name: Hoechst 33342; CAS number: 23491-52-3; Hoechst 33342, Trihydrochloride, Trihydrate - 10 mg/mL Solution in Water. |
| 4T1 murine breast cancer cell line | ATCC | CRl-2539 | for details see ATCC website |
| Automatic Cell Counter, e.g. CASYCounter | Roche Diagnostics GmbH | 5651697001 | CASY Model TT Cell Counter and Analyzer |
| CASYclean Cleaning Reagent | Sedna Scientific | 2501036 | |
| CASYton Isotonic Diluent | Sedna Scientific | 2501037 | |
| Confocal Fluorescence Microscope, e.g. Leica TCS SP5 | Leica, Wetzlar, Germany | Equipped with Plan-Neofluor 25×0.5NA and Plan-Apochromat 63×1.4NA oil UV objectives and Diode (405 nm), Argon-ion (458, 477, 488, 496, 514 nm) and HeNe (543 and 633 nm) lasers; A Leica LAS AF Lite Software 4.0.11706 (Leica Microsystems CMS GmbH) was used for image acquisition and and anaysis | |
| Cover slips No. 1.5 thickness | VWR International | 631-0150 | |
| Dabco | Sigma | 290734 | Stock 125 mg/mL |
| DMEM | Sigma | D5546 | Supplement with 10 % (v/v) FBS and L-glutamine (2 mM) to make up the optimal growth medium for MDA-MB-231 cells. |
| FACS sorter, e.g. BD FACSAria III | BD Biosciences | Equipped with a BD FACS DIVA Software, a 6 Laser System (375/405/488/561/633 nm lasers) - cells sorted with a 100 μm nozzle under 20 psi flow pressure, window extension of 2.0 μm, 2.0 Neutral Density Filter and 3 kV plate voltage | |
| Fetal Bovine Serum (FBS) | Sigma | F9665 | Heat inactivated at 56 °C for 30 min |
| Automated Gamma Counter, e.g. 1282 Compugamma | LKB Wallac Laboratory | 99mTc-pertechnetate energy window 110-155 keV 18F energy window 175-220 keV | |
| Hoechst 33342 solution | Life Technologies | H1399 | 1-3 µg/mL; DAPI (from various supplieres) can be used instead. |
| L-glutamine | Sigma | G7513 | Solution 200 mM concentrated, sterile-filtered |
| Linear polyethylenimine (PEI) | Polyscience | 23966-2 | Linear, 25 kDa; transfection reagent for 293T cell line. |
| MDA-MB-231 human breast cancer cells | ATCC | HTB-26 | for details see ATCC website |
| Mowiol 4-88 | Sigma | 81381 | |
| pLNT SFFV NIS-mEGFP | request from our lab | n/a | For details (generation and maps) see Supplementary Information |
| pLNT SFFV NIS-mCherry | request from our lab | n/a | For details (generation and maps) see Supplementary Information |
| pMD2.G | Addgene | #12259 | plasmids encoding for the VSV-G envelope |
| pRRE | Addgene | #12251 | packaging plasmid |
| pRSV-Rev | Addgene | #12253 | packaging plasmid |
| Paraformaldehyde solution 4 % (w/v) in PBS | Santa Cruz Biotechnology | sc-281692 | |
| Penicillin-Streptomycin | Sigma | P43330 | Containing penicillin (10,000 units/mL) and streptomycin (10 mg/mL), sterile-filtered |
| Phosphate Buffered Saline (PBS) | Sigma | D8537 | pH 7.4, sterile-filtered and without calcium chloride and magnesium chloride |
| Poly(vinyl alcohol - vinyl acetate) | Polysciences | 17951 | Trivial name: Mowiol 4-88; CAS number: 9002-89-5 |
| Puromycin dihydrochloride | Sigma | P8833 | From Streptomyces alboniger, reconstituted in sterile water |
| Benchtop centrifuge, e.g. Rotina 380 R Benchtop centrigfuge | Hettich Lab Technology | ||
| RPMI 1640 | Sigma | R0883 | Supplement with 10% (v/v) FBS and L-glutamine (2mM) to make up the optimal growth medium for 4T1 cells. |
| SFCA Syringe filter 0.45 μm | Corning | ||
| Syringes 10 mL | BD Emerald | Disposable non-sterile syringes | |
| Tissue culture fluorescence microscope, e.g. EVOS-FL | Life Technologies | Cell Imaging System equipped with a 10× objective (PlanFL PH2, 10×/0.25, ∞/1.2) and a colour camera | |
| Trypsin-EDTA solution 10X | Sigma | 59418C | (0.5 % (w/v) trypsin, 0.2 % (w/v) EDTA) gamma irradiated by SER-TAIN process and without phenol red |
| Wheat Germ Agglutinin Alexa Fluor 633 Conjugate | Life Technologies | W21404 | Used at 1:1000 (2 µg/mL) for cell immunofluorescence |
| Step 2) Establishment of in vivo tumor models. | |||
| Digital caliper | World Precision Instruments | 501601 | |
| Isoflurane 1000 mg/g | Isocare | For inhalation | |
| Fluorescence Torch, e.g. NightSea Fluorescence Torch DFP-1 | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters and NightSea filter goggles (DFP-1) |
| Syringes 0.3 mL U-100 insulin | Terumo | 29G × 1/2'' - 0.33 × 12 mm | |
| Standard materials/equipment for aseptic technique and animal maintenance | |||
| Step 3) Production of [18F]BF4- using an automated radiotracer synthesis platform. | |||
| 15-crown-5 | Sigma-Aldrich | 188832 | CAS 33100-27-5 |
| Acetonitrile (anhydrous) | Acros Organics | 326811000 | |
| Boron trifluoride diethyl etherate | Sigma-Aldrich | 216607 | BF3.OEt2, purified by redistillation, ≥46.5 % BF3 basis. CAS 109-63-7 |
| Automated Radiotracer Synthesis (ARS) platform, e.g. FASTLab | GE Healthcare | ||
| Disposable cassettes for ARS platform, e.g. FASTLab cassettes | GE Healthcare | FASTlab Developer pack | |
| Polygram Alox N/UV254 polyester sheets | Macherey-Nagel | 802021 | RadioTLC plates, 40×80 mm |
| Strong anion exchange cartridge, e.g. Sep-Pak Accell Plus QMA Plus Light | Waters | WAT023525 | Condition with 1M NaCl (10 mL) and H2O (10 mL) |
| Alumina neutral cartridge, e.g. Sep-Pak Alumina N Plus Light | Waters | WAT023561 | Condition with H2O (10 mL), acetone (10 mL) and air (20 mL) |
| Water for injection USP | GE Healthcare | ||
| Nitrogen filter | Millipore | SE2M049I05 | Sterile 0.2 µm FG Millex 13 mm |
| Step 4) In vivo imaging of NIS-FP expressing cells by nanoPET/CT. | |||
| Isoflurane 1000 mg/g | Isocare | For inhalation | |
| Preclinical PET/CT multimodal imaging instrument, e.g. nanoScan PET/CT | Mediso Medical Imaging System, Budapest, Hungary | ||
| Fluorescence Torch, e.g. NightSea Fluorescence Torch DFP-1 | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters and NightSea filter goggles (DFP-1) |
| Rodent anesthesia induction chamber | Vet-Tech | AN010R | With three-way valves (x2), tube mount connector for inlet, PVC tubing for gas inlet (2 m) and 22 mm scavenging tube (2 m) |
| Rodent anesthesia system | Vet-Tech | AN001B | Including animal face-mask suitably sized for animal of interest and isolflurane vaporizer |
| Sterile physiological saline | Thermo Scientific Oxoid | BO0334B | |
| Syringes 0.3 mL U-100 insulin | Terumo | 29G × 1/2'' - 0.33 × 12 mm, for intravenous injection of radiotracer | |
| Veterinary Scavenger | Vet-Tech | AN200 | VetScav filter weighing mechanism - 240 V with automatic temperature compensation and LED system |
| 5) In vivo data analysis. | |||
| Tera-Tomo Monte Carlo based full 3D iterative algorithm | Mediso Medical Imaging System, Budapest, Hungary | ||
| VivoQuant Software | Invicro LLC., Boston, USA | ||
| 6) Ex vivo analyses | |||
| 2-Methylbutane | Sigma | 59070-1L-D | Pre-cooled over liquid nitrogen to freeze OCT-embedded tissues |
| Bovine Serum Albumin (BSA) | Sigma | 85040C | |
| Cover slips 22×50 mm | VWR International | SMITMCQ211022X50 | |
| Cryostat, e.g. Cryostat MNT | SLEE Medical | two-piece modular histology embedding machine equipped with an embedding module, a tissue storage compartment and a cold plate | |
| Cy5 AffiniPure Goat anti-Rabbit IgG (H+L) | Jackson/Stratech | 111-175-144 | Used at 1:500 (2 µg/mL) |
| Dabco | Sigma | 290734 | Stock 125 mg/mL |
| Microtome blades, e.g. Feather S35 | CellPath | ||
| Fluorescence Microscope (wide-field or confocal), e.g. Nikon Eclipse Ti-E Inverted Fluorescence Microscope | Nikon | Equipped with 10×, 20× (air) and ideally 40× (oil) objectives and lasers/filters or filter cubes, respectively, that are suitable for Hoechst 33342, GFP and Cy5 | |
| Automated Gamma Counter, e.g. 1282 Compugamma | LKB Wallac Laboratory | 99mTc-pertechnetate energy window 110-155 keV, 18F energy window 175-220 keV | |
| Hoechst 33342 solution | Life Technologies | H1399 | |
| Fluorescence adapter for dissecting microscope, e.g. NightSea Adapter | Electron Microscopy Sciences | SFA-LFS-RBS/GR | Equipped with GFP and RFP emission filters |
| O.C.T. compound | VWR international | 361603E | |
| Wax pen, e.g. PAP-PEN | Dako UK Ltd | Wax pen to draw around tissue section to reduce required staining/washing solution volumes | |
| Paraformaldehyde solution 4 % (w/v) in PBS | Santa Cruz Biotechnology | sc-281692 | |
| Rabbit anti-CD31 | Abcam | ab28364 | Polyclonal anti-mouse used 1:50 (20 µg/mL) for tissues immunofluorescence |
| Microscope slides, e.g. Superfrost slides | VWR, Lutterworth, UK | ||
| Tris-buffered saline (TBS) | available from various suppliers. | Tris-buffered saline; 150 mM NaCl, 25 mM Tris/HCl at pH 7.4 | |
Riferimenti
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331 (6024), 1559-1564 (2011).
- Brader, P., Serganova, I., Blasberg, R. G. Noninvasive molecular imaging using reporter genes. J Nucl Med. 54 (2), 167-172 (2013).
- Fruhwirth, G. O., Diocou, S., Blower, P. J., Ng, T., Mullen, G. E. A whole-body dual-modality radionuclide optical strategy for preclinical imaging of metastasis and heterogeneous treatment response in different microenvironments. J Nucl Med. 55 (4), 686-694 (2014).
- Terrovitis, J., et al. Ectopic expression of the sodium-iodide symporter enables imaging of transplanted cardiac stem cells in vivo by single-photon emission computed tomography or positron emission tomography. J Am Coll Cardiol. 52 (20), 1652-1660 (2008).
- Seo, J. H., et al. Trafficking Macrophage Migration Using Reporter Gene Imaging with Human Sodium Iodide Symporter in Animal Models of Inflammation. J Nucl Med. 51 (10), 1637-1643 (2010).
- Diocou, S., et al. [18F]tetrafluoroborate-PET/CT enables sensitive tumor and metastasis in vivo imaging in a sodium iodide symporter-expressing tumor model. Scientific Reports. 7 (1), 946 (2017).
- Lajtos, I., et al. Cold wall effect eliminating method to determine the contrast recovery coefficient for small animal PET scanners using the NEMA NU-4 image quality phantom. Phys Med Biol. 59 (11), 2727-2746 (2014).
- Nagy, K., et al. Performance evaluation of the small-animal nanoScan PET/MRI system. J Nucl Med. 54 (10), 1825-1832 (2013).
- Deleye, S., et al. Performance evaluation of small-animal multipinhole muSPECT scanners for mouse imaging. Eur J Nucl Med Mol Imaging. 40 (5), 744-758 (2013).
- Portulano, C., Paroder-Belenitsky, M., Carrasco, N. The Na+/I- symporter (NIS): mechanism and medical impact. Endocr Rev. 35 (1), 106-149 (2014).
- Dohan, O., et al. The sodium/iodide Symporter (NIS): characterization, regulation, and medical significance. Endocr Rev. 24 (1), 48-77 (2003).
- Jauregui-Osoro, M., et al. Synthesis and biological evaluation of [F-18]tetrafluoroborate: a PET imaging agent for thyroid disease and reporter gene imaging of the sodium/iodide symporter. Eur J Nucl Med Mol Imaging. 37 (11), 2108-2116 (2010).
- Weeks, A. J., et al. Evaluation of [18F]-tetrafluoroborate as a potential PET imaging agent for the human sodium/iodide symporter in a new colon carcinoma cell line, HCT116, expressing hNIS. Nucl Med Commun. 32 (2), 98-105 (2011).
- Khoshnevisan, A., et al. [(18)F]tetrafluoroborate as a PET tracer for the sodium/iodide symporter: the importance of specific activity. EJNMMI Res. 6 (1), 34 (2016).
- Groot-Wassink, T., et al. Noninvasive imaging of the transcriptional activities of human telomerase promoter fragments in mice. Cancer Res. 64 (14), 4906-4911 (2004).
- Chen, L., et al. Radioiodine therapy of hepatoma using targeted transfer of the human sodium/iodide symporter gene. J Nucl Med. 47 (5), 854-862 (2006).
- Sieger, S., et al. Tumour-specific activation of the sodium/iodide symporter gene under control of the glucose transporter gene 1 promoter (GTI-1.3). Eur J Nucl Med Mol Imaging. 30 (5), 748-756 (2003).
- Chisholm, E. J., et al. Cancer-specific transgene expression mediated by systemic injection of nanoparticles. Cancer Res. 69 (6), 2655-2662 (2009).
- Klutz, K., et al. Targeted radioiodine therapy of neuroblastoma tumors following systemic nonviral delivery of the sodium iodide symporter gene. Clin Cancer Res. 15 (19), 6079-6086 (2009).
- Merron, A., et al. Assessment of the Na/I symporter as a reporter gene to visualize oncolytic adenovirus propagation in peritoneal tumours. Eur J Nucl Med Mol Imaging. 37 (7), 1377-1385 (2010).
- Merron, A., et al. SPECT/CT imaging of oncolytic adenovirus propagation in tumours in vivo using the Na/I symporter as a reporter gene. Gene Ther. 14 (24), 1731-1738 (2007).
- Dingli, D., et al. Combined I-124 positron emission tomography/computed tomography imaging of NIS gene expression in animal models of stably transfected and intravenously transfected tumor. Mol Imaging Biol. 8 (1), 16-23 (2006).
- Carlson, S. K., et al. Quantitative molecular imaging of viral therapy for pancreatic cancer using an engineered measles virus expressing the sodium-iodide symporter reporter gene. AJR Am J Roentgenol. 192 (1), 279-287 (2009).
- Barton, K. N., et al. GENIS: gene expression of sodium iodide symporter for noninvasive imaging of gene therapy vectors and quantification of gene expression in vivo. Mol Ther. 8 (3), 508-518 (2003).
- Siddiqui, F., et al. Design considerations for incorporating sodium iodide symporter reporter gene imaging into prostate cancer gene therapy trials. Hum Gene Ther. 18 (4), 312-322 (2007).
- Rad, A. M., et al. AC133+ progenitor cells as gene delivery vehicle and cellular probe in subcutaneous tumor models: a preliminary study. BMC Biotechnol. 9, 28 (2009).
- Hwang do, W., et al. Noninvasive in vivo monitoring of neuronal differentiation using reporter driven by a neuronal promoter. Eur J Nucl Med Mol Imaging. 35 (1), 135-145 (2008).
- Edmonds, S., et al. Exploiting the Metal-Chelating Properties of the Drug Cargo for In Vivo Positron Emission Tomography Imaging of Liposomal Nanomedicines. ACS Nano. 10 (11), 10294-10307 (2016).
- Zhang, R., et al. Probing the Heterogeneity of Protein Kinase Activation in Cells by Super-resolution Microscopy. ACS Nano. 11 (1), 249-257 (2017).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. Am J Physiol Cell Physiol. 300 (4), C723-C742 (2011).
- Pulaski, B. A., Ostrand-Rosenberg, S. Mouse 4T1 breast tumor model. Curr Protoc Immunol. , (2001).
- Workman, P., et al. Guidelines for the welfare and use of animals in cancer research. Br J Cancer. 102 (11), 1555-1577 (2010).
- Foster, B., Bagci, U., Mansoor, A., Xu, Z., Mollura, D. J. A review on segmentation of positron emission tomography images. Comput Biol Med. 50, 76-96 (2014).
- Otsu, N. A Threshold Selection Method from Gray-Level Histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Kinahan, P. E., Fletcher, J. W. Positron emission tomography-computed tomography standardized uptake values in clinical practice and assessing response to therapy. Semin Ultrasound CT MR. 31 (6), 496-505 (2010).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- Snapp, E. L., et al. Formation of stacked ER cisternae by low affinity protein interactions. J Cell Biol. 163 (2), 257-269 (2003).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Hume, S. P., Gunn, R. N., Jones, T. Pharmacological constraints associated with positron emission tomographic scanning of small laboratory animals. Eur J Nucl Med. 25 (2), 173-176 (1998).
- O'Doherty, J., et al. 18F-Tetrafluoroborate, a PET Probe for Imaging Sodium/Iodide Symporter Expression: Whole-Body Biodistribution, Safety, and Radiation Dosimetry in Thyroid Cancer Patients. J Nucl Med. 58 (10), 1666-1671 (2017).
- Couzin-Frankel, J. Breakthrough of the year 2013. Cancer immunotherapy. Science. 342 (6165), 1432-1433 (2013).
- Boardman, D. A., et al. Expression of a Chimeric Antigen Receptor Specific for Donor HLA Class I Enhances the Potency of Human Regulatory T Cells in Preventing Human Skin Transplant Rejection. American Journal of Transplantation. , (2017).
- Rashid, T., Takebe, T., Nakauchi, H. Novel strategies for liver therapy using stem cells. Gut. 64 (1), 1-4 (2015).
- Ellison, G. M., et al. Adult c-kit(pos) cardiac stem cells are necessary and sufficient for functional cardiac regeneration and repair. Cell. 154 (4), 827-842 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon