Method Article
Rekonfigurierbare mikrofluidischen Kanal mit Pin-diskretisierten Seitenwangen
In diesem Artikel
Zusammenfassung
Ein mikrofluidischen Kanal mit verformbaren Seitenwangen bietet Flusskontrolle, Partikel Handling, Kanal Dimension Anpassung und andere Umgestaltungen während des Betriebs. Wir beschreiben eine Methode zur Herstellung von mikrofluidischen Kanal mit Seitenwänden, gemacht aus einem Array von Pins, die ihre Form ändern kann.
Zusammenfassung
Mikrofluidische Komponenten müssen verschiedene Formen, verschiedene wichtige mikrofluidischen Funktionen wie mischen, Trennung, Partikel abfangen oder Reaktionen zu realisieren. Ein Mikrofluidik-Kanal, der auch nach der Fertigung unter Beibehaltung der Kanalform verformt sich ermöglicht hohe raumzeitliche Rekonfigurierbarkeit. Diese Rekonfigurierbarkeit ist in solchen wichtigen mikrofluidischen Funktionen erforderlich, die in bestehende "rekonfigurierbare" oder "integrierte" mikrofluidische Systeme schwer zu erreichen sind. Wir beschreiben eine Methode für die Herstellung eines mikrofluidischen Kanals mit einem verformbaren Seitenwand, bestehend aus einer seitlich ausgerichteten Array der Enden des rechteckigen Pins. Betätigung der Pins in ihrer Längsrichtung Richtungen ändert sich die Pins Endlagen, und damit die Form der diskretisierten Kanal Seitenwände. PIN Lücken verursachen unerwünschte Leckagen oder Adhäsion an benachbarten Pins durch Meniskus Kräfte verursacht. Um die Pin-Lücken zu schließen, haben wir Kohlenwasserstoff-Fluorpolymer Aussetzung-basierte Lückenfüller begleitet von einem gummielastischen Barriere eingeführt. Dieses rekonfigurierbare mikrofluidischen Gerät erzeugen starke zeitliche Verschiebung der im Kanal fließen oder den Fluss in jeder Region des Kanals stoppen kann. Dieses Feature wird auf Nachfrage, den Umgang mit nicht-Flüssigkeiten, Zellen, zähflüssigen Flüssigkeiten und Gasblasen erleichtern, auch wenn ihre Existenz oder Verhalten zum Zeitpunkt der Herstellung unbekannt ist.
Einleitung
Mikrofluidische Geräte - Kleinstunternehmen, die geringe Mengen an Flüssigkeit und ihre Bewegungen Steuern - bieten Miniaturisierung der biomedizinischen Verfahren in einem "" chipformat mit erhöhter Mobilität und oft, Erschwinglichkeit. Wie in den letzten Beitrag1beschrieben, wurden verschiedene mikrofluidische Komponenten bestehend aus Räumen und positiven Eigenschaften entwickelt, um Grund- und fluidische Funktionen wie mischen, Trennung, Partikel abfangen oder Reaktionen zu erkennen.
Während das Verhalten vieler mikrofluidischen Geräte in der Planungsphase bestimmt wird, können einige Arten von mikrofluidischen Geräten nach Herstellung Veränderungen ihrer Struktur oder Verhalten. Hier verweisen wir auf diese Funktion als "Rekonfigurierbarkeit". Die Rekonfigurierbarkeit von mikrofluidischen Systemen in der Regel reduziert den Zeit- und Kostenaufwand Geräte zu entwickeln, bzw. ermöglicht die Anpassung der mikrofluidische Layout oder Funktionen im Laufe der Zeit.
Zuvor beschrieben rekonfigurierbare mikrofluidischen Geräte in den folgenden drei Kategorien fallen. In der ersten ermöglicht Verformung von Elastomeren Kanäle Durchflussmengen und Richtungen während der Nutzung verändert werden. Um Rekonfigurierbarkeit zu gewinnen, sind Elastomere Kanäle durch verschiedene externe und kontrollierbaren Kräfte wie pneumatische Quellen2, Braille Aktoren3oder Abdichtung4Kompression verformt. In der zweiten rekonfigurierbare Geräte setzen auf modularen Designs, wie z. B. fluidische Mehrlagenschaltungen, modulare Kanäle mit magnetischen interconnects, und Schlauch-basierte Mikrofluidik-5. In der dritten das Gerät selbst ist nicht rekonfigurierbare, aber Microdroplet Transport auf Elektrode Arrays (oft auch als digitale Mikrofluidik)6,7 und hängenden Tropfen-basierte mikrofluidischen Geräten8 ermöglichen auf Abruf Schalten von den Fluss oder die Route der Flüssigkeit.
Dennoch sind viele von diesen Rekonfigurationen topologische und makroskopischen Ebene beschränkt. Zum Beispiel viele integrierte mikrofluidische Geräte stoppen oder ändern die Flussrichtung von einstürzenden Mikrokanäle in vordefinierte Regionen. Die Position und Anzahl der Regionen reduziert werden, sind jedoch nicht rekonfigurierbare. Obwohl die digitalen Mikrofluidik eine Vielzahl von Flüssigkeit Umgang mit Fähigkeiten hat, sollten mögliche fließt weitgehend durch das Volumen jedes Tropfens begrenzt werden. Wenn Zellen in solchen Tröpfchen von Zellkulturmedien kultiviert werden, ist darüber hinaus zusätzlichen Aufwand erforderlich, Verdunstung und Gas Verlustleistung von Tröpfchen zu verhindern und Osmolalität Schock und plötzliche pH-Wert-Änderung zu vermeiden.
Um Kanal-Funktionsebene Rekonfigurierbarkeit zu realisieren, haben wir eine mikrofluidischen Gerät mit beweglichen Seitenwänden, die Arrays von Maschinenelementen dynamisch konfigurieren sie bei Verwendung9bestand vorgeschlagen. Um eine verformbare Seitenwand zu bilden, wurden kleine rechteckige Stifte aufgereiht, so dass jedes Ende der Stifte ein Segment der Seitenwand definiert. Schiebe die Stifte erlaubt die Verformung an der Seitenwand, die Transport erlaubt oder Strukturierung von Zellen, Luftblasen und Teilchen in den Kanal. Der Abstand zwischen benachbarten Pins musste um Totvolumen minimieren und maximieren Rekonfigurierbarkeit, minimiert werden. Jedoch starke Kapillarwirkung auf die kleine Lücken zwischen den Pins verbinden innen und außerhalb der Microchannel verursacht Austreten von Flüssigkeiten Eingabe den Pin-Abstand, wodurch Medien Verdunstung, bakterielle oder zytotoxische Kontamination und schließlich Zelle der Tod. Daher haben wir leckagefreie diskretisiert Seitenwand-Typ rekonfigurierbare mikrofluidische Kanäle entwickelt, die zyklische Pin Aktionen und langfristige Zelle Kultur10standhalten.
In diesem Artikel bieten wir ein Protokoll zur mikrofluidischen Zelle Kultur Gerät mit einem diskretisiert Seitenwand zu bauen, die nach der allmählichen Zunahme der Zelle Kulturkreis umgestaltet werden können. Luftdichtheit der diskreten Kanal Seitenwände getestet wird, mit Fluoreszenz-Bildgebung. Die Zellkultur Kompatibilität und die Fähigkeit der Zelle Musterung sind mit auf dem Chip Zellkultur ausgewertet.
Mikrofluidischen System ist geeignet, wenn entsprechende Channel-Design kann nicht vorgegeben werden und bei Bedarf geändert werden muss. Beispielsweise könnte dieses System verwendet werden, passen die Kanal-Breite und Flow Rate basierend auf dem Zellwachstum oder Migration Flow oder Falle aktiv Nematoden oder andere kleine Gegenstände, die sich unerwartet in den Kanal, Verhalten oder verschiedene raw-Proben oder Bioprodukte zu akzeptieren, wurden nicht noch zum Zeitpunkt der Konstruktion konzipiert.
Protokoll
(1) Ätzen von Pins (Abb. 2A)
- Entfetten Sie rechteckige Stifte durch Untertauchen in Aceton.
- Die Stifte durch Eintauchen in 4 mL 10 % Salpetersäure passiviert, dann die Lösung bei 65 ° C für 30 min in einem Ofen zu heizen.
- Beschallen Sie die Stifte in entionisiertem Wasser für 5 min Restsäure entfernen und mit einem Papiertuch trocknen. Tauchen Sie die Stifte in 0,5 mL Schimmel Trennmittel für 2 h.Sonicate die Stifte in entionisiertem Wasser für 5 Minuten.
- Fertigen Sie eine Radierung Speise (Abbildung 2C).
- Zeichnen Sie oder schreiben Sie zwei parallele Linien mit einem Abstand von 4 mm auf einem Objektträger mit einem Lineal.
- Anwendung eine chemikalienbeständige und niedrigviskose Klebstoff auf einer Fläche von zwei rechteckigen Schnitt Coverglasses.
- Verbinden Sie die beiden geschnittenen Coverglasses auf den Objektträger in einem Abstand von 4 mm. Verwenden Sie die parallele Linie als Leitfaden.
- Zwei Linien der Silikonkleber auf der Radierung Teller zu verzichten (siehe Abbildung 2C für die Position und die Größe der Kontur).
Hinweis: Eine 3D-gedruckten Vorlage (eine STL-Modell-Datei ist als ein zusätzliches Material enthalten) hilft Linien leicht und genau zu zeichnen. - Setzen Sie die Stifte Radierung Schale, so dass die 2 mm langen Spitzen an ihren geraden enden in den Klebstoff Linienmuster eingetaucht sind. Den Klebstoff erneut, um sicherzustellen, dass die Stifte vollständig bedeckt sind und eine Kontur zeichnen zu verzichten. Übertragen der Radierung Gericht auf eine befeuchtete Fermenter beheizt bis 38 ° C. Warten Sie über Nacht um den Kleber zu heilen.
- 0,2 mL 5.0 M Salzsäure langsam in eine Glasflasche 0,2 mL 0,5 M Salpetersäure hinzufügen.
Achtung: Das Gemisch, auch bekannt als Königswasser, ist stark ätzend und explosionsgefährdeten. Säurefeste Gummihandschuhe und Schutzbrille tragen, und extreme Vorsicht walten beim Umgang mit Säuren. Speichern Sie niemals die Lösung. Reduzieren Sie Salpetersäure, wie möglich, seine Aggressivität zu verringern. - Setzen Sie die Radierung Schüssel auf eine Herdplatte auf 65 ° c erhitzt Aufgedeckt und Umgebung: die Pins übergießen Sie 0,4 mL-Mischung. 10 min warten und die Säure auf einen Becher übertragen.
- Neutralisieren Sie die verbleibenden Säure einschließlich der geätzten Region der Pins mit 5 mL Lösung 0,8 M Natriumbicarbonat in entionisiertem Wasser.
- Ziehen Sie die Stifte aus der Schale der Radierung die Pins längs mit einer Pinzette. Beschallen Sie die Stifte in entionisiertem Wasser für 5 min, gefolgt von Beschallung in Aceton für 5 min.
- Die geätzte Region der Pins wie in Schritt 1.2 passiviert.
- Überprüfen Sie die Breite der geätzte Pins mit einem Shop-Mikroskop mit einem Fadenkreuz. Stellen Sie die Radierung Zeit in 1.7 beschrieben, so dass die Breite der geätzten Region 0,2 beträgt ± 0,02 mm.
- Übertragen Sie die Pins auf eine Glasfläschchen mit 5 ml 70 % igem Ethanol. Bringen Sie das Fläschchen eine laminare Haube. Nehmen Sie die Pins aus dem Fläschchen und trocknen lassen.
2. Herstellung von Silikon-Platte mit Stauseen und ein Platz für Stifte.
- Fertigen Sie eine Form für einen Platz für Stifte und einer festen Seitenwand durch typische lithografischen Prozessen.
- Entfettete Objektträger mit 1 mL negative Epoxy Fotolack mit einem Spin Coater bei 1.000 u/min zu beschichten. Trocknen Sie den Fotolack auf einer Herdplatte 95 ° C für 15 min. wiederholen diesen Schritt einmal.
- Die dritte Schicht des gleichen Fotolack bei 2.000 u/min auf dem Objektträger mit Fotolack beschichtete Mantel Spin. Trocknen Sie der Fotolack auf einer Herdplatte 95 ° C für 30 min.
- Die Photoresist-Schicht aus einem spot UV-Lichtquelle durch einen Photoplotted Film 450 mJ/cm2 von 365 nm UV-Licht aussetzen. Backen der ausgesetzten Photoresist auf einer Herdplatte 95 ° C für 15 min. entwickeln den Fotolack durch ein Lösungsmittel (2-Methoxy-1-Methylethyl-acetat) mit einer Hand Sprayer besprühen und Föhnen mit Stickstoffgas.
- Legen Sie die Glas-Folie mit gemusterten Photoresist am unteren Rand einer Plastikschale.
- Gießen Sie Prepolymer Polydimethylsiloxan (PDMS) auf die Form bis zu einer Dicke von 3 mm. Das PDMS-Prepolymer in einem Vakuum Exsikkator bei-800 kPa für 10 min debubble.
- Das PDMS-Prepolymer in einem Ofen bei 65 ° C für 1 h Demold teilweise gehärtete PDMS-Platte mit einem Skalpell zu heilen. PDMS im Ofen bei 120° C für 1 h vollständig zu heilen.
- Entlang der Leitlinie Muster trim entfernt unregelmäßige Kanten aus der PDMS-Platte mit dem gleichen Skalpell. Machen so präzise und sauber einen Schnitt wie möglich, besonders an der Oberfläche, die den einführschlitz(siehe Abbildung 1)für die Pins definiert.
- Perforieren Sie 2 mm Durchmesser-Löcher für den Einlass/Auslass in die Enden der Hauptkanal der PDMS-Platte mit Biopsie-Stanzen. In ähnlicher Weise Perforieren Sie 1 mm-Dimeter Bohrungen an den Enden der Air-Vent-Kanal. Siehe Abbildung 1A für die Kanallayout und die Position dieser Löcher.
3. Montage des Gerätes mit direkten Herstellung von Lückenfüller und Barriere.
- Fertigen Sie eine Microchannel-Montage.
- Tauchen Sie ein 10 × 20 mm Nr. 4 Deckglas in eine Reinigungslösung auf 60 ° C für 10 min erhitzt.
- Die Coverglasses mit entionisiertem Wasser zweimal spülen und Trocknen bei 120 ° C für 10 Minuten.
- Plasma-Anleihe der PDMS-Decke, um ein Deckglas:
- Legen Sie die PDMS-Platte (Kanal Funktion Seite nach oben) und die gereinigten 10 × 20 mm Nr. 4 Deckglas in der Vakuumkammer ein Sputter Coater.
- Starten Sie die Kammer 60 PA erzeugen Vakuum Luftplasma Abpumpen (20 mA) für 30 s.
- Entlüften Sie sofort der Kammers. Bindung die Kanal Funktion Seite der PDMS auf das Deckglas mit ihren Rändern Platte ausgerichtet.
- Legen Sie die geklebten Schichten in einem 65 ° C Ofen für 10 Minuten.
- Bringen Sie die geklebten Schichten eine laminare Haube mit einem sterilen Behälter. Mit UV-Licht für 30 min zu sterilisieren.
- Fügen Sie in der laminaren Haube die Stifte in den Schlitz, sodass ihre enden die anderen Seitenwand der Microchannel bilden. Benachbarten Pins sollten unterschiedlich lang, Kontakt der beiden vertikalen enden zu vermeiden (siehe Abbildung 1B). Große Abstände zwischen den vertikalen enden ist vorzuziehen. Ein Raum der (N-1) × (Pin-Breite) ist möglich, wenn N Arten von Pins mit einer anderen Pin Länge (L in Abbildung 2A) zubereitet werden.
- Fertigen Sie eine Basis ( Abbildung 2B).
- Oder lesen Sie eine Bauteildatei der Basis und zwei numerische Steuerung (NC) Dateien (enthält Werkzeugwege; als Zusatzmaterial enthalten) mit CAD/CAM-Software. Die erste zusätzliche NC-Datei verwendet eine 4 mm-Durchmesser-Schaftfräser und der zweite ein Durchmesser von 1 mm Ende Mühle.
- Klemmen Sie einen 3 mm dicken klar Polymethylmethacrylat (PMMA)-Board auf einer CNC-Fräse.
- Öffnen Sie die erste NC-Datei auf dem Controller einer Computer-NC (CNC)-Mühle. Installieren Sie ein 4 mm Schaftfräser auf der CNC-Fräse und suchen Sie Werkstücknullpunkt durch berühren den Schaftfräser PMMA-Board. Führen Sie den NC-Code, um das Brett geschnitten.
Hinweis: Gelegentlich Schlag äußersten Ende Mühle mit Druckluft zur Kühlung und Chip Entfernung. - 3.2.3 die zweite NC-Datei mit einer 1 mm Schaftfräser zu wiederholen.
- Die bearbeiteten Teile mit Reinigungsmittel Entfetten und mit einem Papiertuch trocknen. Sprühen Sie die Teile mit 70 % Ethanol und bringt sie zu einer laminaren Kapuze.
- Fertigen Sie eine Pin Lückenfüller und Elastomeren Barriere:
Hinweis: Schritte 3.3.1 - 3.3.7 sollten aseptisch in einem laminaren Abzug durchgeführt werden.- Bereiten Sie Lückenfüllung durch Mischen weiße Vaseline und Polytetrafluorethylen Pulver im Verhältnis 2:1 nach Gewicht. Die Mischung mit einem Ultraschall Homogenisator zu homogenisieren.
- Gießen Sie Auffüllen von Lücken in einem Dispenser-Spritze. Legen Sie einen Kolben und schieben Sie ihn an die Spitze der Spritze gefüllt. Befestigen Sie eine Nadel, und drücken Sie den Kolben wieder, bis die Nadelspitze gefüllt ist. Ebenso bereiten Sie eine Spender-Spritze mit einer Nadel und einem Kolben, und füllen Sie mit Silikonkleber.
- Verbinden Sie jede Spritze mit einem pneumatischen Dispenser mit einem Adapter Schlauch. Passen Sie die dispensierung Drücke für Silikonkleber und Füllstoff zu 250 kPa und 280 kPa.
- Silikonkleber an den Rand einer Tasche der Basis zu verzichten. Ein 10 × 20 mm Nr. 4 Deckglas auf der Tasche und drücken Sie es fest zu binden.
- Silikonkleber bis zu einer Tiefe von ca. 1 mm, zwei Segmente entlang zwei äußeren Schlitze der Basis zeichnen zu verzichten. Verzichten Sie Lückenfüller bis zu einer Tiefe von ca. 1 mm, um Segmente entlang den anderen Steckplatz zu zeichnen.
- Silikonkleber an den Rand einer anderen Tasche zu verzichten. Eine Microchannel-Baugruppe (3.1) auf der Tasche und drücken Sie es fest zu binden.
- 3.3.5 damit Lückenfüller und Silikonkleber vollständig die Pins einbetten und gibt es keine Öffnung an den Slots zu wiederholen.
- Setzen Sie das Gerät in einen sterilen Behälter wie Edelstahl-Box mit Deckel. Transfer der Container eine befeuchtete Fermenter beheizt bis 38 ° C. Heilen Sie in der laminaren Haube die Elastomere-Schranke für einen Tag.
- Verschieben Sie jeweils pin bis zu 1 mm entlang der benachbarten Pins, die Pins von der ausgehärteten Elastomeren Barriere freizugeben.
- Sterilisieren Sie das Gerät mit UV-Licht für 30 min..
4. Evaluierung von mikrofluidischen Gerät
- Erkennen von Leckagen mit Fluoreszenz
- Öffnen Sie den mikrokanal mit ein feines Tool oder ein Desktop-Roboter. Die Kanalbreite als den Kanal möglichst einheitlich zu machen.
- Verdünnen Sie einen grünen Fluoreszenzfarbstoff mit entionisiertem Wasser bei 10 µM, Fluoreszenz-Lösung zu machen.
- Hinzufügen eines End-Anschlüsse von der mikrokanal mit einem Micropipettor Fluoreszenz-Lösung. Dieser Schritt wird den Kanal mit der Lösung füllen.
- Setzen Sie das mikrofluidischen Gerät und zwei Stücke von saugfähigem Papier nass mit entionisiertem Wasser in einer großen Plastikschale. Inkubieren Sie das Gericht bei 37 ° C und 5 % CO2 für mindestens 24 h.
- Grüne Fluoreszenzbilder der mikrokanal mit einem inversen Fluoreszenz-Mikroskop mit einem Mikroskop-Kamera aufnehmen.
- Öffnen Sie die fluoreszierenden Bilder mit einer entsprechenden Bildanalyse-Software und bestätigen Sie, gibt es keine Leckage (grüne Fluoreszenz) an der Schnittstelle zwischen der Lückenfüller und die Pins.
- Samenzellen, die Microchannel.
- Bereiten Sie eine Zelle Kulturgefäß mit 70-80 % konfluierende Zellen (abhängig von Zelltypen). Lösen und die Zellen im Wachstumsmedium auszusetzen.
- Zentrifugieren der Zellen (die Geschwindigkeit und Zeit hängen Zelltypen) und Aspirieren Sie das Medium.
- Die Zellen mit einer kleinen Menge des Mediums aufzuwirbeln. Zählen der Zellen mit einer Zelle Zähler und passen Sie die Zelldichte von 1,5 × 106 bis 1,5 × 107 Zellen/mL.
- Öffnen Sie den mikrokanal mit ein feines Tool oder ein Desktop-Roboter (Abbildung 1B) um einen Kanal direkt 400 µm breit zu machen. Passen Sie die Pin-Positionen um die Seitenwand möglichst flach in den Kanal wie möglich zu machen. Eines der End-Anschluss von der Microchannel Zellsuspension hinzu und füllen Sie den Kanal.
- Suchen Sie einen der Stifte, die definiert, die Seitenwand der Region um Kultur zu starten. Schließen Sie unter einem inversen Mikroskop die zwei benachbarten Pins um Zellen in der Zelle-Kultur-Region umschließen.
- Schließen Sie alle Pins in der Reihenfolge von inneren zu äußeren, alle Zellen aus dem Kanal zu vertreiben. Vorsichtig Aspirieren Sie Suspension aus den End-Anschlüsse und hinzuzufügen Sie Medium, um sie.
- Inkubieren Sie das Gerät wie in 4.1.4 beschrieben. Wenn Zellen sind etwa 70-80 % konfluierende, öffnen Sie langsam eine Pin ein, um den Kulturkreis zu erweitern.
Ergebnisse
Der Bau der rekonfigurierbare Microchannel ist in Abbildung 1dargestellt. Mehrere rechteckige Pins auf einem Glassubstrat gesetzt wurden und wurden aufgereiht, so dass die lange Seite der Pins in Kontakt waren. Eine PDMS-Blatt mit gestanzten Löcher und eine Aussparung für die gleiche Tiefe wie die Pin-Höhe bedeckt die Enden der Stifte die Kanal-Einlass/Auslass-Stauseen, Kanal Decke und eine weitere Seitenwand gegenüber die kanalwandung, die der Pins bestand zu bilden. Die Region umgeben von Pins, eine Wand (eins der Gesichter von PDMS-Blatt) und dem Glassubstrat bilden einen mikrofluidischen Kanal.
Wie zuvor beschrieben wird durch viele kleine Stifte parallel zu sehr klein, aber ungleich NULL Lücken platziert die Rekonfigurierbarkeit des vorgeschlagenen mikrofluidischen Systems erreicht. Das Problem in früheren Berichten wurde die starke Strömung durch die Lücken durch die Kapillarwirkung erzeugt. Um dieses Problem zu überwinden, füllten die Lücken zuerst mit ein Lückenfüller. In diesem Protokoll diente eine Disperse Mischung aus Viskose Kohlenwasserstoff und Fluorpolymer-Pulver als ein Lückenfüller. Jedoch der Lückenfüller selbst unterliegt auch die Kapillarwirkung. Daher hat wie in Abbildung 1dargestellt, die sich daraus ergebenden rekonfigurierbare Microchannel Kohlenwasserstoff/Fluorpolymer Lückenfüller und eine Elastomere Barriere um den äußeren Rand der Lückenfüller gebildet. Ausdünnung der Mitte der Pins ist erforderlich, um eine ausreichende Menge an Lückenfüller um die Dicke zu gewährleisten und die Stärke der Elastomere Barriere zwischen zwei Pins unterzubringen.
Abbildung 2 A zeigt eine Zeichnung einer PIN, die eine Seitenwand Segment bildet. Edelstahl-Grade 316L wurde als das Material wegen seiner Korrosionsbeständigkeit und geringe Auswaschung Eigenschaften ausgewählt. Jedoch musste ein zusätzliche Passivierung Prozess Stifte Zellkultur in Einklang zu bringen. Eine Pin muss eine exakt rechteckige Spitze ohne Grate, erfolgreich ein Seitenwand-Segment bilden. Darüber hinaus muss eine Pin einen "Griff" haben, so dass der Stift leicht bewegt werden kann, indem man den Griff. Da jeder Pin eine schmale Mitte hat, war die Dicke der Elastomer zwischen Pins genug, um Scherkräfte verursacht durch Pin-Bewegung zu widerstehen. Im Gegensatz zu anderen Teilen bestehend aus dem Gerät sollte die Herstellung von Pins, außer mittlere Ausdünnung bestellt werden, von einer Firma, spezialisiert auf elektrische Entladung Bearbeitung (EDM), denn es die präzisen und kostengünstige Methoden ist der Bearbeitung kleiner Teile aus Hartmetall. Durchführung von mittleren Ausdünnung durch Ätzen selbst reduziert die Kosten für die Bearbeitung und das Risiko von verbiegen oder brechen während der Bearbeitung.
Um sicherzustellen, dass der Lückenfüller, die Elastomer-Schranke und schließlich die Dichtigkeit der rekonfigurierbare Microchannel ordnungsgemäß funktionieren, wurde Lecksuche durch Fluoreszenz verwendet. Abbildung 3 zeigt ein fluoreszenzbild der Gegend um den Rand der Elastomere Barriere 3 Tage nach der mikrokanal mit wasserhaltigen Fluoreszenz Tracer Farbstoff gefüllt war. Die fluoreszenzbild zeigt, dass die Flüssigkeit füllt den Kanal erreicht eine Tiefe von ca. 200 µm aus sichtbaren Rand der Elastomer-Schranke. Allerdings hat die Flüssigkeit nicht die Lücke Füllstoff erreicht. Darüber hinaus wurde keine Leckage der Lückenfüllung durch die Elastomer-Schranke beobachtet. Diese Beobachtung zeigt, dass die Enge Passung zwischen schmalen Mitte des Pins und Elastomeren Barriere die Migration von Flüssigkeit durch die Lücken verhindert.
Schließlich führten wir langfristige Zellkultur mit dem Kulturkreis angepasst durch die schrittweise Erweiterung der Seitenwand des Gerätes rekonfigurierbare mikrofluidischen wie in Abbildung 4Agezeigt. Bei 0d waren eine kleine Anzahl von Zellen innerhalb eines Raumes gleich eins beschränkt, die Pin-Breite und anderen Zellen abgesaugt wurden. Bei 2 t die Zellen waren an der Unterseite befestigt und begann wuchern. Zwei Stifte wurden zurückgezogen, so dass alle Zellen deutlich sichtbar waren, obwohl die Konfluenz noch sehr gering war. 5D die Zellen vermehren sich weiterhin und die Konfluenz erhöht. Bei 6 und 9 d waren zwei andere Pins zurückgezogen, um die Zellen Underconfluent zu halten. Die Wirkung der sukzessive Ausbau des Bereichs Kultur ist in Abbildung 4Bdargestellt. Am Tag, den der landesspezifisches eingefahren wurden, gab es plötzliche Änderungen in der Zelldichte. Jedoch war die Zuwachsrate der die Zellzahl konstant gehalten, während im typischen Zellkultur exponential ist.
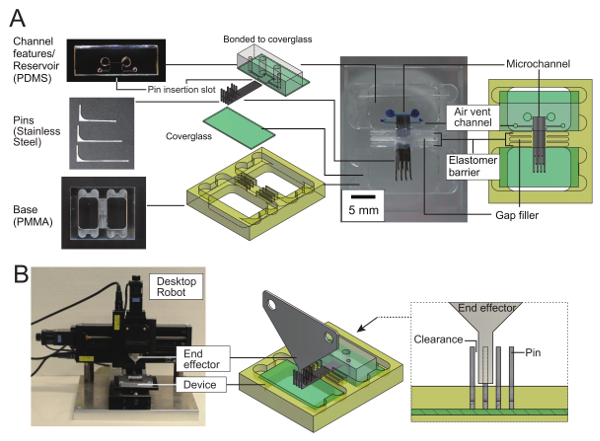
Abbildung 1 : Rekonfigurierbare mikrofluidischen Gerät mit einem Pin-diskretisierten Seitenwand. (A) Teile und Bau eines rekonfigurierbaren mikrofluidischen Geräts. Das Gerät verfügt über einen geraden Kanal mit einer Seitenwand, gebildet durch die Enden der 10 Edelstahl Stifte in PDMS/Glas Microchannel Funktionen eingefügt. Auffüllen von Lücken und eine Elastomere Barriere verhindert undichte durch die Pin Lücken Flüssigkeit. Coverglasses, Auffüllen von Lücken und die Elastomer-Barriere sind an ein Polymethylmethacrylat (PMMA) Basis befestigt. (B) automatische Pin Manipulator. Ein Endeffektor gemacht aus einer Metallplatte ist eine Desktop-3-Achs-Roboter befestigt. Um einen Pin zu verschieben, schiebt der Endeffektor seine vertikale Ende. Stifte mit unterschiedlichen Längen werden in einem Intervall von drei Mal die Pin Breite platziert. Das Intervall wird sichergestellt, dass den Ende Effektor Kumpels ein Pin auf einmal mit genügend Freiraum. Bitte klicken Sie hier für eine größere Version dieser Figur.
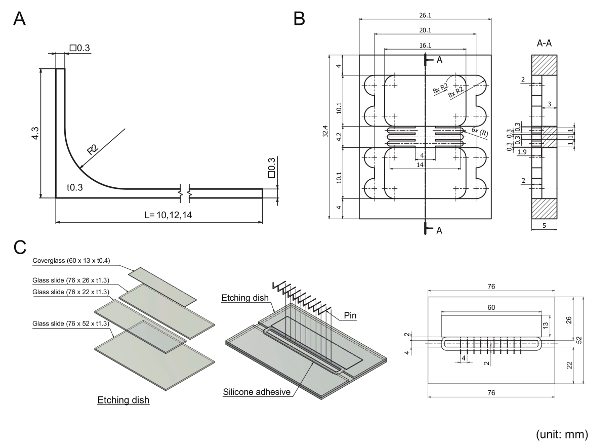
Abbildung 2 : Mechanische Zeichnung der bearbeiteten Teile des Protokolls verwendet. Einheiten sind in Millimeter; R steht für eine Radiusbemaßung; Das quadratische Symbol (□) zeigt Quadratische Funktionen; t gibt Stärke. (A) eine 316 L Edelstahl Pin als Teil der Seitenwand. Pins können bestellt und bearbeitet wie beschrieben. Ausdünnung der Pin Mitte Hund Knochen wie Formen machen wird nicht in dieser Zeichnung wiedergegeben, weil dies nicht im Rahmen der Bearbeitung bestellt aber im Rahmen des Protokolls erfolgte. (B) ein Polymethylmethacrylat (PMMA)-Basis, die Coverglasses, Lückenfüller und Elastomeren Barriere gegen Pin Bewegung an Ihrem Platz hält. (C) eine Radierung-Gericht, die verwendet wird, um die mittleren Pins zu ätzen. Um eine Radierung Speise zu bauen, werden vier Stücke aus Glas mit Silikonkleber verklebt. Eine Konture Muster der Silikonkleber zieht es auf dem Teller, gefolgt von der Platzierung der Pins auf dem Teller wie in der Zeichnung dargestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Fluoreszenz Detektion von Leckagen aus einem rekonfigurierbaren Microchannel durch Pin Lücken. Fluoreszenzbild der grünen Fluoreszenzfarbstoff füllen die rekonfigurierbare Microchannel überlagert auf einer Phase Kontrast Bild der Dichtung Struktur, bestehend aus einem Lückenfüller (undurchsichtig) und Elastomeren Barriere (transluzent). Eine Kante der Elastomer-Schranke ist sichtbar als Meniskus-ähnliche Funktionen und ist gekennzeichnet durch eine obere gestrichelte Linie; die Schnittstelle zwischen Elastomer Barriere und Gap Filler ist als Meniskus-ähnliche Funktionen, die die schwarze Fläche in Berührung und wird durch die untere gestrichelte Linie angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
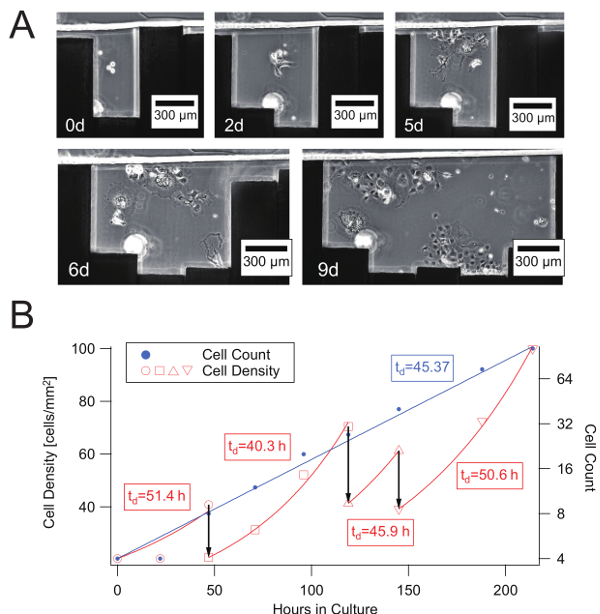
Abbildung 4 : Progressive und kontinuierliche Zellwachstum mit Variable Zelle Kulturkreis in eine rekonfigurierbare Microchannel. (A) COS-7 Wachstum der Zellen in einer Zelle Kulturkreis beschränkt durch Verschieben der Seitenwände. (B) Wachstum Kurve und Zeit Entwicklung der Dichte von COS-7 Zellen in variabler Größe Kulturkreisen in die rekonfigurierbare Microchannel gezeigt in A beschränkt). Drei vertikale Pfeile bezeichnen bzw. Vergrößerung der Zelle Kultur auf 2, 5 und 6 d. Neben der Zellzahl erscheinen Zelldichten für die gleiche Kultur-Bereiche individuell auf jede exponentielle Wachstumskurve und zur Schätzung der lokalen Verdopplungszeit (td [h]) in den Frames angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Pin-diskretisierten Microchannel ist eine voll funktionsfähige mikrofluidischen Kanal, und wir glauben, dass es offensichtlich hohe Rekonfigurierbarkeit Kanalform im Vergleich zu bestehenden mikrofluidische Kanäle hat. Das Protokoll hier bereitgestellten ermöglicht mikrofluidischen Geräte Zellkultur mit sukzessive aus Zelle Kultur Fläche um die Kulturen unter Konfluenz für einen langen Zeitraum zu halten. Das Gerät bietet auch im Kanal Strukturierung von Zellen ohne Musterung Proteine auf das Substrat im Voraus oder eine andere Gegenleistung zum Zeitpunkt der Konstruktion oder Fertigung. Darüber hinaus erzeugt dieses rekonfigurierbare mikrofluidischen Gerät leicht stark im Kanal Verschiebung Flow, der helfen würde implementieren, Umgang mit solchen schwierigen Flow-Materialien, dass sehr wenige vorhandene mikrofluidischen Geräten verarbeiten können. Dies bedeutet, dass die Interaktion zwischen den Zellen und andere Mikroorganismen, Gase und andere nicht-Flüssigkeiten mit diesem Gerät ohne große Änderungen im Gerätedesign ausgewertet werden kann.
Wir haben überlegt, eine Bucht des Kanals als externe Flow Control-Methoden Laplace oder hydrostatischen Druck anwenden. Wir empfehlen nicht, drängen Flüssigkeit am Ende einer Sackgasse, weil es fließen in Richtung der Air-Vent-Kanal durch die Lücken zwischen Bolzen und der Decke/Boden des Kanals zu generieren. Viele flüssige Operationen erfordern keine solche Pin-Operationen. Zum Beispiel kann mischen durch Maischen Flüssigkeit durch einen Pin (d. h. nur ein Pin mehrere Male hin und her bewegen) erreicht werden.
Die wichtigsten Teile des Gerätes sind die Pins. Präzision in der Länge, sind Parallelität, Rechtwinkligkeit und Oberflächenqualität erforderlich für die Pins müssen eine Microchannel bilden, müssen leichtgängig, und muss die Bewegung der benachbarten Pins führen. Wir empfehlen daher, die Stifte von einer Firma bestellt werden müssen, die Präzisionsbearbeitung durch Vorlage einer Zeichnung ähnlich wie Abbildung 2Aspezialisiert. Möglicherweise gibt es Firmen, die erfordern zusätzliche Geometrische Dimensionierung und explizite Oberflächenrauhigkeit Richtungen. Jedoch sind die Pins wiederverwendbar, wenn sie mit Sorgfalt behandelt werden und gelegentlich mit Salpetersäure passiviert.
Die Elastomere-Schranke ist eine weitere wichtige Funktion, und seine Bildung ist der wichtigste Schritt in die Fertigungsprozesse des Geräts. Eine präzise gefräste Basis wird benötigt, um reproduzierbare und zuverlässige Ergebnisse zu erhalten. Platzieren der Pins auf die ausgehärtete Barriere ist auch ein entscheidender Schritt. Die Pins sind gut ausgerichtet und eingebettet in das Auffüllen von Lücken und ohne Luftblasen aufzubewahren. Diese Schritte verhindern Leckage durch die Stifte, die ist ein häufiges Problem mit diesem mikrofluidischen Gerät.
Weitere häufig auftretende Probleme bei der Verwendung dieses Geräts sind (a) kraftschlüssig zurückhaltende Pins und (b) Zelltod, und niedrige Wachstumsrate. Mögliche Ursachen für diese in einem) gehören ungleichmäßige (konisch oder gewellt) Ätzen der Pin Mitte, schlechte Qualität der geätzten Oberfläche und dreidimensionalen Außenseiter zwischen Pin-Tipp-Höhe und die Höhe der Photoresist Schicht auf eine Form für die Silikon-Platten. Anpassung der Formulierung Ätzmittel, Temperatur und Agitation kann dazu beitragen, die Pin-Bewegung. Darüber hinaus wird Testversion Montage ohne Verwendung von Wachs oder Klebstoff Hinweise zur Lösung des Problems bieten. Möglich Faktoren in b) sind nicht ausreichend Passivierung der Stifte, Fehler bei der Auswahl von Klebstoffen für Elastomere Barrieren und unvollständige Heilung der Klebstoffe. Einige Zellen erfordern Innenbeschichtung der mikrokanal mit FIBRONEKTIN, Proteine oder andere Polymere, die Zelladhäsion zu fördern. Darüber hinaus sinkt die Optimierung in der Zelle Kultur Praxis wie Trypsinization und Zentrifugation abgestorbene Zellen in der Microchannel.
Eine Einschränkung des Protokolls präsentiert Fertigung ist, dass nur einer von den Seitenwänden diskretisiert ist. Die Rekonfigurierbarkeit des Kanals wird weiter verbessern, wenn die beiden Seitenwände von Pin-Arrays gebaut werden. Obwohl es doppelt so viele Stifte und längere Fertigungsschritte benötigt, ist dies technisch realisierbar.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Diese Forschung wurde durch KAKENHI (20800048, 23700543) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Oven | Yonezawa | MI-100 | |
| 10% Nitric Acid | Wako Chemicals | 149-06845 | |
| Stainless steel pins | Micro Giken | N/A | 0.3 mm crosssection, Grade 316L stainless steel, wire-cut EDM |
| Mold release agent | Fluoro Technology | FG-5093SH | |
| Polydimethylsiloxane (PDMS) | Shin-Etsu Chemicals | KE-106 | |
| Negative epoxy photoresist | Nippon Kayaku | SU-8 3050 | |
| Coverglasses (Rectangular) | Matsunami Glass | 26 x 60mm No.4 | |
| Acetone | Kanto Chemicals | 01060-79 | |
| Glass slides (Large) | Matsunami Glass | 76 x 52mm No.1 | |
| Silicone adhesive | Shin-Etsu Chemicals | KE-41 | |
| White petrolatum | Nikko Rica | Sun White P-1 | |
| Polytetrafluoroethylene (PTFE) powder | Power House Accele | Microfluon II | |
| Clear acrylic plate (3 mm-thick) | Various | N/A | |
| Pneumatic dispenser | Musashi Engineering | ML-5000XII | |
| Hydrochloric acid | Kanto Chemicals | 180768-00 | |
| Computer numerical control (CNC) mill | Pro Spec Tools | PSF240-CNC | |
| End mill (4 mm diameter) | Mitsubishi Materials | MS2MSD0400 | |
| End mill (1 mm diameter) | Mitsubishi Materials | MS2MSD0100 | |
| Adhesive (chemical-resistant and low viscosity ) | Cotronics | Duralco 4460 | |
| Borisilicate glass vials | Various | To prepare HNO3+HCl solution (Aqua regia). Always select borosilicate glass. | |
| Sodium bicarbonate | Kanto Chemicals | 37116-00 | |
| Ultrasonic cleaner | AS ONE | AS12GTU | |
| Ultrasonic drill | Shinoda Tools | SOM-121 | Used as a ultrasonic homogenizer. |
| Spin coater | Active | ACT-220DII | |
| Hotplate | AS ONE | ND-1 | |
| Photoplotted film (12,700 dpi) | Unno Giken | N/A | Negative image of the recess at the bottom of a PDMS slab are plotted. |
| 2-methoxy-1-methylethyl acetate | Wako Chemicals | 130-10505 | |
| UV spot light source | Hamamatsu | L8327 | Ultraviolet source |
| Nitrogen | Various | N/A | |
| Vacuum desiccator and pump | AS ONE | MVD-100, GM-20S | |
| Scalpels | Various | No.11 | |
| Biopsy punches (1.0mm and 2.0mm) | Kai Medical | BP-10F(1.0m), BP-20F(2.0mm) | |
| Glass engraving pen | Various | N/A | |
| Cleaning solution | Tama Chemicals | TMSC | Dilute 1:100 with deionized water |
| Sputter coater | San-yu Electron | SC-708 | For plasma bonding. |
| Dispenser syringe (5 ml) | Musashi Engineering | PSY-5E | |
| Plunger | Musashi Engineering | FLP-5E | |
| Blunt needle (21G) | Musashi Engineering | PN-21G-B | |
| Adapter tube | Musashi Engineering | AT-5E | |
| Fermenter | Japan Kneader | PF100 | |
| Green fluorescent dye (Alexa Fluor 488 carboxylic acid) | Thermo Fisher | A33077 | |
| Large plastic dish | Greiner bio-one | 688161 | |
| Absorbent paper | Asahi Kasei | BEMCOT M-1 | |
| Inverted microscope | Leica | DMi8 | |
| Microscope camera | Qimaging | Retiga 2000R | |
| Dulbecco modified Eagle medium (DMEM) | GE Health Care | SH30021.01 | |
| Antibiotic-antimycotic solution | Thermo Fisher | 15240-062 | |
| Trypsin/EDTA solution | Thermo Fisher | 25200-056 | |
| Phosphate buffered saline (PBS) | GE Health Care | SH30256.01 | |
| Fetal bovine serum (FBS) | Biowest | S1820 | |
| Cell counter | FPI | OC-C-S02 | |
| Cell culture vessel | VIOLAMO | VTC-D100 | |
| 15 ml conical tube | Corning | 352095 | |
| Shop microscope | PEAK | 2034-20 | |
| Hand sprayer | FURUPLA | No.3530 | |
| Coverglasses (Rectangular) | Matsunami Glass | 10 x 20mm No.4 | |
| CAD/CAM software | Autodesk | Inventor HSM | |
| Nitrogen gas pressure regulator | AS ONE | GF1-2506-RN-V | Set to 0.1 MPa |
Referenzen
- Nge, P. N., Rogers, C. I., Woolley, A. T. Advances in microfluidic materials, functions, integration, and applications. Chem Rev. 113 (4), 2550-2583 (2013).
- Araci, I. E., Brisk, P. Recent developments in microfluidic large scale integration. Curr Opin Biotechnol. 25, 60-68 (2014).
- Gu, W., Chen, H., Tung, Y. -C., Meiners, J. -C., Takayama, S. Multiplexed hydraulic valve actuation using ionic liquid filled soft channels and Braille displays. Appl Phys Lett. 90 (3), 033505(2007).
- Konda, A., Taylor, J. M., Stoller, M. A., Morin, S. A. Reconfigurable microfluidic systems with reversible seals compatible with 2D and 3D surfaces of arbitrary chemical composition. Lab Chip. 15 (9), 2009-2017 (2015).
- Hahn, Y., Hong, D., Kang, J., Choi, S. A Reconfigurable microfluidics platform for microparticle separation and fluid mixing. Micromachines. 7 (8), 139(2016).
- Kintses, B., van Vliet, L. D., Devenish, S. R. A., Hollfelder, F. Microfluidic droplets: new integrated workflows for biological experiments. Curr Opin Chem Biol. 14 (5), 548-555 (2010).
- Jebrail, M. J., Bartsch, M. S., Patel, K. D. Digital microfluidics: a versatile tool for applications in chemistry, biology and medicine. Lab Chip. 12 (14), 2452-2463 (2012).
- Frey, O., Misun, P. M., Fluri, D. A., Hengstler, J. G., Hierlemann, A. Reconfigurable microfluidic hanging drop network for multi-tissue interaction and analysis. Nat Commun. 5, 4250(2014).
- Futai, N. Reconfigurable microchannels with discretized moving sidewalls. Chem Micro-Nano Syst. 10 (1), 24-25 (2011).
- Oono, M., et al. Reconfigurable microfluidic device with discretized sidewall. Biomicrofluidics. 11 (3), 034103(2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten