Method Article
Ein 3D organotypischen Melanom Sphäroid Hautmodell
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll, um eine 3D organotypischen Melanom Sphäroid Hautmodell zu generieren, die sowohl die Architektur rekapituliert und mehrzelligen Komplexität einer Orgel/Tumor in Vivo aber gleichzeitig bietet Platz für systematische experimentelle Intervention.
Zusammenfassung
Maligne Transformation der Melanozyten, die Pigmentzellen der menschlichen Haut verursacht Bildung eines Melanoms, einen sehr aggressiven Krebs mit metastasiertem Potenzial. Vor kurzem, Mono-Chemotherapien weiterhin von Melanom spezifische Kombinationstherapien mit gezielten Kinase-Inhibitoren verbessern. Dennoch bleibt metastasierendem Melanom eine lebensbedrohliche Krankheit weil Tumoren primäre Resistenz aufweisen oder entwickeln Resistenz gegen neuartige Therapien, damit wieder tumorigenic Kapazität. Um den therapeutischen Erfolg des malignen Melanoms zu verbessern, ist die Bestimmung der molekularen Mechanismen, die Übertragung der Resistenz gegen herkömmliche Behandlungsansätze notwendig; jedoch braucht es innovative zelluläre in-vitro- Modelle. Hier stellen wir eine in-vitro- dreidimensionale (3D) organotypischen Melanom Sphäroid Modell, das kann die in Vivo -Architektur des malignen Melanoms darzustellen und kann neue Erkenntnisse rechtfertigen Intra-Tumor sowie Tumor-Wirt Interaktionen. Das Modell enthält definierte Anzahl von Reifen und differenzierte Melanom Sphäroide in einem 3D voll Menschenhaut Wiederaufbau Modell bestehend aus primären Hautzellen. Die zelluläre Zusammensetzung und Differenzierung Status des eingebetteten Melanom Sphäroide ähnelt der eines kutanen Melanom Metastasen in Vivo. Mit diesem organotypischen Melanom Sphäroid Modell, wie ein Drogen-screening-Plattform die Identifizierung der Responder zu unterstützen kann Kombinationstherapien, während erspart unnötige Behandlung Belastung für non-Responder, wodurch des Vorteils ausgewählt therapeutische Interventionen.
Einleitung
Die menschliche Haut besteht aus zwei verschiedenen Fächern, die unterschiedliche Funktionen im Schutz des Körpers vor nachteiligen Auswirkungen auf die Umwelt1dienen. Die untere dermale Fach besteht aus einer Fibro-elastisches Bindegewebe. Es besteht aus lose miteinander verbundenen Kollagen und Elastin-Fasern von Fibroblasten, dient eine mechanische Barrierefunktion synthetisiert. Die Dermis ist von der oberen Epidermis durch die Basallamina getrennt als eine extrazelluläre Matrix durch eine ständige Kommunikation zwischen beiden Kammern der Haut produziert wird. Im Gegensatz zu der Dermis Epidermis ist ein Plattenepithel besteht hauptsächlich aus Keratinozyten und kann in vier Schichten unterschieden werden. Das Stratum Basale besteht aus undifferenzierten basalen Keratinozyten, die ständig aus Vorläuferzellen der Haut durch die Stadien des Stratum Spinosum und Stratum Granulosum in Stratum Corneum stratifiziert , schützen den Körper vor Austrocknung und Infektionen2. Melanozyten sind ausgerichtet auf die Basalmembran und kommunizieren über dendritische Erweiterungen mit mehreren Keratinozyten. Sie produzieren das Pigment Melanin zum Schutz der Haut vor den schädlichen Auswirkungen der UV-Strahlung, wie Hautalterung, Immunsuppression, Entzündung und Induktion von nicht-Melanom-Hautkrebs. UV Strahlungen Beitrag zur Transformation der Melanozyten, malignes Melanom, ist jedoch noch in der Diskussion3.
Melanom Entwicklung differenziert nach verschiedenen Tumorstadien Fortschreiten, und von bestimmten genetischen, morphologischen und histologischen Veränderungen4gekennzeichnet. Sie stammen entweder de Novo oder von einer angeborenen oder erworbenen Nävus aufgrund einer lokalen erhöhen der Melanozyten Proliferation verursachen gutartige Neoplasie. Diese Vorstufe Läsion kann wandeln in strukturell veränderten dysplastische Gewebe werden Zellen, die zu der ersten malignen Phase der radialen Wachstumsphase (RGP) fortsetzen kann. Diese frühen Tumor Progression Phase zeichnet sich durch Zellen vermehren Radial innerhalb der Epidermis, zeigt einige lokal invasive Zellen innerhalb der papillären Dermis. Während der anschließenden vertikales Wachstum Phase (VGP) Melanom zeigen Zellen bereits metastasierendem und invasiven Phänotyp durch das brechen durch die Basallamina, die tieferen Bereiche der Dermis sowie die Unterhaut5zu infiltrieren. Schließlich stellt metastasierendem Melanom (MM) die aggressivste Progression-Bühne mit metastasierenden Zellen systemisch Verbreitung im gesamten System der Blut- und Lymphzirkulation, Organe wie Leber, Lunge und Gehirn6nach distal zu erobern.
Früherkennung, gefolgt von einer Operation bleibt bis heute die effektivste Therapie des malignen Melanoms. Die Prognose bei Patienten mit Fernmetastasen, bleibt allerdings besonders schlecht7, weil klassische Chemotherapie-Regimen nur wenig überleben nutzen8,9übertragen. Allerdings haben die jüngsten Fortschritte in zielgerichtete Therapien nach Jahrzehnten der Stagnation, die Prognose des malignen Melanoms erheblich verbessert.
Dysregulation der zwei wichtige Mitogen aktiviert Signalwege, die RAS-RAF-MEK-ERK und die Signalwege PI3K-AKT-PTEN präsentieren Schlüsselfaktoren der Melanom-Progression, zumal konstitutiv Punktmutationen des Proto-oncogenes BRAFV600 aktivieren und NRB sind vorhanden10. Entsprechend versprach die Erfindung des gezielten Kinase-Inhibitoren therapeutischen Nutzen für Patienten mit metastasierendem Melanom. Eine Vielzahl von klinischen Studien zu diesem Punkt hat erhebliche Vorteile für Patienten mit metastasierendem Melanom nicht erreicht. Fast alle Antworten sind teilweise mit einer Subpopulation von Patienten mit primären Widerstand. Darüber hinaus wurde die Übernahme von sekundären Widerstand bis zum Rezidiv führt in der Mehrzahl der Patienten11,12beobachtet.
Es wird klar, dass Analyse der Mutationsstatus allein nicht ausreichen, um die stärkste therapeutische Strategie zu entwickeln. Neue schnelle und zuverlässige Diagnose-Tools sind notwendig, um systematisch erfassen und analysieren die Reaktionsfähigkeit der einzelnen Krebszellen. Die überwiegende Mehrheit der derzeit verfügbaren Daten zur menschlichen Melanom wurden aus zweidimensionalen (2D) Melanom Zellkulturen gewonnen. Tumorzellen, jedoch gewachsen in 3D ermöglichen interzellulären Übersprechen zwischen differenzierte Krebs Zelle Subpopulationen sowie zwischen Krebszellen und die nicht-transformierten umliegende Wirtsgewebe. Daher wäre es am besten, die 3D-Umgebung zu rekonstruieren, in dem das Melanom entwickelt, als eine präklinische Screening verwendet werden, Modell13,14.
Protokoll
Alle menschlichen Gewebe Arbeiten erfolgte mittels zugelassenen institutionellen Protokolle.
(1) Trennung der Dermis und Epidermis aus der menschlichen Haut (Juvenile Vorhaut von Beschneidung)
- Legen Sie die Vorhaut (in der Regel 1 – 2 cm2) in einer Kulturschale nichtklebenden sterile Zelle (Ø 10 cm) und decken Sie es mit 10-12 mL Phosphat-gepufferte Kochsalzlösung+ (0,5 mM MgCl2, PBS, pH 7,2, 0,9 mM CaCl2= PBS+). Entfernen Sie alle überschüssiges (adipös) Gewebe mit sterilen Skalpell und Pinzette.
- Schneiden Sie die Haut in 3 x 5 mm Stücke mit PBS waschen Sie und übertragen Sie sie auf ein nicht klebendes sterile Zelle Kulturschale (Ø 6 cm). Die Gewebe-Stücke mit ca. 5-7 mL Dispase-Lösung (2 U/mL PBS) zu decken. Versiegeln Sie der Zelle Kulturschale mit Paraffin Film und 16 h bei 4 ° c inkubieren
- Einfahren der epidermalen aus dem dermalen Teil mit zwei sterile Pinzetten. Seziert Gewebe Stücke auf Einzelzelle nichtklebenden Kultur Gerichte (Ø 6 cm) übertragen und jeder von ihnen mit PBS+zu decken.
2. Isolierung der primären Keratinozyten aus der Epidermis
- Sorgfältig die PBS+ aus der Zelle Kulturschale mit einer Pasteurpipette entfernen und die epidermalen Gewebe Stücke (Abschnitt 1.3) mit PBS waschen. Schneiden Sie die Epidermis in kleinere Stücke (1 mm2) und sammeln sie in einem 50 mL konische Röhrchen. Fügen Sie 10 mL 1 x Trypsin-EDTA (vorgeheizt auf 37 ° C) und 5 min im Wasserbad bei 37 ° c inkubieren Wirbel der Gewebe-Aufhängung alle 2 min.
- Stoppen Sie die enzymatische Reaktion durch Zugabe von 1 mL fetalen Kälberserum (FCS). Aufzuwirbeln Sie die Zellen von oben und unten mit einer 10-mL-Kunststoff-Pipette für 4 min. versuchen zur Vermeidung von Luftblasen und Schaum-Bildung pipettieren.
- Pipettieren der Zellsuspension in eine Zelle Sieb (Pore Größe 100 µm), auf eine frische 50 mL konische Rohr platziert, 3 X mit 5 mL PBS spülen. Zentrifugieren Sie die Zellen bei 200 X g, für 5 min. Aufschwemmen der Zelle Pellet in 2-6 mL Kulturmedium mit 1 % (V/V) Gentamycin. Bestimmen Sie die Zellenzahl manuell durch zählen Zellen in einem Hemocytometer und Samen 6 x 105 Zellen in einer T75 Zelle Kultur Kolben.
3. Anbau von primären Keratinozyten
- Inkubieren Sie primären Keratinozyten in Schritt 2.3 in einer Zelle Inkubator bei 37 ° C und 5 % CO2 in Keratinozyten Medium ohne FCS, um 50-70 % Konfluenz isoliert.
- Um die Keratinozyten sorgfältig die passage des Mediums zu entfernen, geben Sie 5 mL PBS-EDTA und die Zellen für 10 min bei 37 ° c inkubieren Überprüfen Sie, ob Zellen begonnen haben, trennen Sie den Kultur-Kolben unter einem Lichtmikroskop (4 X Vergrößerung: Zellen abgerundeten erscheint aber noch befestigt!). Wenn dies nicht der Fall ist, ersetzen Sie alte PBS-EDTA mit frischen PBS-EDTA und erneut für weitere 10 Minuten bei 37 ° c inkubieren
- Geben Sie 5 mL 1 X Trypsin-EDTA zu den abgerundeten Zellen noch bedeckt mit 10 mL PBS-EDTA und wieder lang 1-3 min bei 37 ° c inkubieren Die enzymatische Reaktion durch Zugabe von 1 mL FCS zu stoppen und die freistehenden Zellen in einem 50 mL konische Röhrchen sammeln. Die Zellen bei 200 X g für 5 min zentrifugieren, das Pellet in Keratinozyten Medium und 6 x 105 Samenzellen in einer frischen T75 Zelle Kultur Flasche aufzuwirbeln.
Hinweis: Um organotypischen Haut rekonstruiert zu erzeugen, sollte die primären Keratinozyten spätestens 3-4 Durchgang verwendet werden.
4. Isolierung der primäre Fibroblasten aus der Dermis
- Schneiden Sie das Hautgewebe (Abschnitt 1.3) in kleinere Stücke (1 mm2) und übertragen Sie sie in ein 50 mL konische Röhrchen. 10 mL Kollagenase-Lösung (5 U/mL PBS+) hinzufügen und 45 Minuten im Wasserbad bei 37 ° c inkubieren Zentrifugieren Sie die Mischung von Gewebe und Zellen bei 200 X g für 5 min.
- Waschen Sie die Zelle Pellet zweimal mit 10 mL DMEM mit 4,5 g/L Glucose und L-Glutamin, aber ohne L-Pyruvat. Schließlich erneut die Gewebe-Stücke in 2 mL DMEM mit 10 % FCS 1 % (V/V) Gentamycin. In einem T25 Zelle Kultur Kolben übertragen Sie und inkubieren sie über Nacht in einer Zelle Inkubator bei 37 ° C und 5 % CO2 .
Hinweis: Das geringe Volumen ermöglicht die Fibroblasten, aus dem Gewebe-Schutt zu migrieren und zwingt sie in den Kultur-Kolben befestigen. - Am nächsten Morgen fügen Sie ein weiteres 6 mL DMEM/Gentamycin/FCS hinzu und 2-3 Tage bei 37 ° C inkubieren Sie, bis die Zellen 80-90 % Konfluenz erreicht haben.
5. Anbau der primäre Fibroblasten
- Durchgang der Fibroblasten, entfernen das Medium und adhärente Zellen mit PBS waschen. Geben Sie 5 mL 1 x Trypsin-EDTA und 3 min bei 37 ° c inkubieren
- Die enzymatische Reaktion durch Zugabe von 5 mL DMEM/FCS zu stoppen und die freistehenden Zellen in einem 50 mL konische Röhrchen sammeln. Die Zellen bei 200 X g für 5 min zentrifugieren, Aufschwemmen das Pellet in DMEM Medium, und Saatgut 6 x 105 Zellen in einer frischen T75 Zelle Kultur Kolben.
Hinweis: Um organotypischen Haut rekonstruiert zu erzeugen, sollte die primäre Fibroblasten spätestens 4-6 Gang verwendet werden.
6. Generation der 3D Melanom Sphäroide über der hängenden-Drop-Methode
- Kultur Melanomzellen (z.B., 451-LU oder irgendwelche Melanom-Zell-Linie von Interesse) nach allgemeine Protokolle, mit RPMI mit 10 % FCS15.
- Um Melanom Sphäroide von ähnlicher Größe und Qualität zu erzeugen, waschen Sie die Melanomzellen in PBS, fügen Sie 5 mL 1 X Trypsin-EDTA mit PBS-Puffer für die Zellen in einem T175 Zell-Kultur-Kolben und inkubieren Sie für ca. 3-5 min bei Raumtemperatur (RT). Neutralisieren Sie die Trypsin durch Zugabe von 5 mL RPMI/10% FCS. Ernte der Zellen durch Zentrifugation bei 200 X g für 5 min. die Zelle Pellet in RPMI/FCS eine Endkonzentration von 10.000 Zellen/mL als durch auszählen in einem Hemocytometer wieder aussetzen.
- 40 x 25 µL (= 250 Zellen) der Zellsuspension auf der inneren Oberfläche des Deckels eine sterile nichtklebenden Zelle Kulturschale (Ø 10 cm) mit einer elektronischen Multi-Pipette zu erkennen. Drehen Sie mit einer schnellen aber glatte Bewegung den Deckel um und legen Sie sie auf der jeweiligen Zelle Kulturschale mit 5 mL PBS.
- Kultur "hängenden Tropfen Gerichte" in eine Zelle Inkubator bei 37 ° C und 5 % CO2 10-14 Tage, je nach Zelltyp verwendet.
Hinweis: Zellen aus der MM-Wachstumsphase in der Regel schneller wachsen und bilden solidere Sphäroide in den hängenden Tropfen gegenüber Melanomzellen RGP oder VGP abgeleitet. Beachten Sie bei individuellen Bewertung Sphäroid Wachstum unter Fernglas oder unter einem Lichtmikroskop (4 X Vergrößerung). Sphäroide werden in der Regel nach 48 h unter Fernglas oder unter einem Lichtmikroskop (4 X Vergrößerung) nachweisbar. Nach 10-14 Tagen sind sie ohne Vergrößerung Gerät sichtbar.
- Kultur "hängenden Tropfen Gerichte" in eine Zelle Inkubator bei 37 ° C und 5 % CO2 10-14 Tage, je nach Zelltyp verwendet.
- 5 Tage nach dem ersten Tropfen Schmierblutungen hinzufügen 10 µL des frischen RPMI/10% FCS-Medium zu jedem Tropfen. Anschließend tauschen Sie 10 µL Medium jeden zweiten Tag. Die Verwendung von einem elektronischen Dispenser ist sehr hilfreich in diesem Schritt.
- Je nach Zelltyp ernten Sie die Sphäroide (siehe Abschnitt 10) nach 10-15 Tagen durch sanft abspülen des Zelle Kultur Schale Deckels mit PBS. Sammeln sie in einer Kulturschale nichtklebenden Frischzellen.
Hinweis: Die Anbau Zeit richtet sich nach der Tumor Wachstumsphase der Melanomzellen Wenn sie zunächst abgeleitet wurden, z.B.Sphäroide abgeleitet von 451-LU Zellen wachsen, um etwa 500 µm im Durchmesser innerhalb von 12 Tagen der Kultivierung in den hängenden Tropfen15 .
7. Generation von dermalen Abteil des organotypischen voll Haut rekonstruiert
- Generieren Sie hautmodelle mit 24 Wohlen Zelle mikroporösen Membran Einsätze (pore Größe 8 µm) in 24-Well Platten gelegt.
Hinweis: Stellen Sie sicher, nicht hängend zu verwenden aber ständigen Einsätze, weil sie in einer 6-Well-Platte für den Luft-Flüssigkeit Anbau zu einem späteren Zeitpunkt gestellt werden. - Bereiten Sie das Gel Neutralisation Lösung (GNL)15sowie die Nährmedien als MM und endothelial Wachstum Medien (EGM)16,17bezeichnet. Um die Gerinnung zu verhindern, laden das Kollagen Typ I (in der Regel von Rattenschwanz, 3,5-4 mg/mL in 0,02 N Essigsäure) auf Eis bis zum Gebrauch, denn es beginnt zu Gelieren bei RT
- Neu 1 x 105 Fibroblasten pro Einsatz in GNL und mischen Sie schnell die Zellsuspension mit Kollagen in einem Verhältnis von 1:3 in einem Endvolumen von 500 µL/einfügen. Mix von sanft pipettieren rauf und runter, um Blasenbildung zu vermeiden, da Luftblasen die Qualität der Haut beeinträchtigt zu rekonstruieren.
- Lassen Sie die einzelnen dermal Gele, indem man sie ohne Medium bei RT für 30 min in einem sterilen Abzug zu begleichen. Decken Sie anschließend jedes Gel mit DMEM mit 4,5 g/L Glukose, 1 % L-Glutamin, 10 % FCS, und ohne L-Pyruvat, und über Nacht bei 37 ° c inkubieren
8. Generation der epidermalen Abteil des organotypischen voll Haut rekonstruiert
- Am nächsten Tag entfernen Sie das Medium aus der dermalen Gele und equilibrate sie mit EGM Medien (10 % FCS, 1 % PenStrep, 10 mg/mL Gentamicin) für 2 h bei 37 ° C. Zurückziehen Sie des Mediums und Samen Sie sorgfältig 1 x 105 Keratinozyten in 100 µL EGM auf die dermale Gel Nukleinsäuretablette.
- Inkubieren Sie rekonstruiert für 1,5 h bei 37 ° C um die Keratinozyten zur Einhaltung der dermalen Kompartiment zu ermöglichen.
Hinweis: Während dieser Inkubationszeit beginnt die Gele zu schrumpfen durch Fibroblasten-induzierten Kontraktion und somit zumindest teilweise von den Wänden einfügen lösen. - Decken Sie die Haut Entsprechungen mit rund 800 µL EGM und entfernen Sie vorsichtig das restliche Gel aus der einfügen-Wand mit einer kleinen (weiß) PIPETTENSPITZE. Die Haut-äquivalente untergetaucht in EGM für 7 Tage in einer Zelle Inkubator bei 37 ° C, 5 % CO2, Kultur und das Medium täglich verändern.
Hinweis: Während dieser Zeit werden die Haut Entsprechungen deutlich schrumpfen.
9. Air-Liquid-Anbau von organotypischen voll Haut rekonstruiert
- Am Tag 8 Übertragung jedes stecken Sie in einem einzelnen Brunnen einer 6-Well-Platte. Nur fügen Sie 1,2-1,4 mL MM Medium jedes gut hinzu, so dass die Haut zu rekonstruieren ist mit Medium von der Unterseite des Brunnens geliefert, aber nicht mit Medium fällt.
Hinweis: Anbau an der Luft-Flüssigkeit-Schnittstelle ermöglicht Schichtung der epidermalen Teil und Einrichtung einer vollen Hornschicht (Stratum Corneum). - In den nächsten Tagen von 10-17 verändern Sie das Medium wie in Abschnitt 9,1 jeden zweiten Tag. Während dieser Zeit fügen Sie Drogen oder andere Reize bei Bedarf auf das Medium. Entfernen Sie vorsichtig die volle Haut rekonstruieren aus dem mikroporösen Membran einfügen gebogenen Pinzette für weitere Analysen, z.B.immunhistochemische Analyse (Abbildung 1).
10. Generation der organotypischen Melanom Sphäroid Hautmodelle
- Melanom Sphäroide in der dermalen Fach des organotypischen volle Haut rekonstruiert zu integrieren, spülen Sie sorgfältig die Sphäroide (nach Schritt 6.4) den Deckel der hängenden Tropfen Zelle Kulturschale mit PBS. Sammeln Sie 10-20 Sphäroide/einfügen in eine sterile Zelle nichtklebenden Kulturschale. Entfernen Sie vorsichtig die übermäßige PBS mit einer Pasteurpipette.
- Aspirieren Sie die Sphäroide in die kleinstmögliche Volumen der EGM. Zu diesem Zeitpunkt beobachten Sie und zählen Sie die Sphäroide mit bloßem Auge, ohne jede weitere Vergrößerung Gerät. Nehmen Sie 10-20 Sphäroide pro Haut Modell/Gel, wie in Schritt 10.1 angegeben.
- Übertragen Sie sie auf die gewünschte Lautstärke GNL mit Fibroblasten (während Schritt 7.3) und mischen mit dem Kollagen Typ ich. Von diesem Schritt auf wie in den Abschnitten 7.3-9.1 beschrieben vorgehen.
Hinweis: Tumor Sphäroide werden sichtbar in der dermalen Gel als weiße Flecken (Abbildung 2)
Ergebnisse
Erfolgreicher Behandlung von Melanomen Metastasen kann durch das Übersprechen zwischen Tumorzellen sowie zwischen Tumor und nicht-transformierten Wirtszellen beeinflusst werden. Organotypischen Modelle von Krebs in Vitro zu entwickeln soll geeignete präklinische Testsysteme bereitstellen, die die 3D Organisation und Komplexität der menschlichen Melanom rekapitulieren in-vivo. Dies ermöglicht die Untersuchung der therapeutischen Wirkung auf den Tumor innerhalb einer organotypischen Umgebung und die negativen Auswirkungen auf das umliegende Gewebe der primären parallel.
Um die besten organotypischen hautmodelle zu entwickeln, ist die Qualität der PV-Zellen entscheidend. Es ist vorteilhaft, juvenile primäre Fibroblasten und Keratinozyten, zu verwenden, weil sie in der Regel weniger im Vergleich zu Erwachsenen primäre Hautzellen unterscheiden. Juvenile Haut Zellen können entweder isoliert von juvenile Vorhaut wie beschrieben im Abschnitt "Protokoll" 1-5, sondern auch werden von Firmen wie pränatale primäre Fibroblasten und Keratinozyten erworben. Wenn Kauf, ist es notwendig, Bestellung Zellen von verschiedenen Spendern Spender-spezifische Ergebnisse, z.B.für Drogen Empfindlichkeit zu vermeiden. Das gesamte Protokoll wird als ein Schema in Abbildung 3dargestellt.
Qualitätskontrolle von 3D Full-Haut-äquivalenten erfordert immunhistochemische Analyse. Ein erster Eindruck erhalten Sie durch die Hämatoxylin-Eosin (H & E) Färbung von Paraffin eingebettet Abschnitte (3 µm). Detaillierte Analyse der Qualität der epidermalen Differenzierung und Bildung von der Basallamina zwischen Dermis und Epidermis erfordert immunhistochemische Analyse mit spezifischen Antikörpern gegen einen epidermalen Schichtung-Marker. Dies ermöglicht Unterscheidung zwischen undifferenzierte, hoch proliferativen Zellen liegt in der Nähe der Basalmembran und sehr differenziert und keratinized Zellen an das Stratum Corneum durch die Bildung von epidermalen Schichten dazwischen . Dargestellt durch immun-histologische Färbung (Abbildung 4), Differenzierung der Keratinozyten in der Epidermis ähnlich wie normale Haut erzielt werden konnten: vor allem die undifferenzierten Zellen aus den unteren epidermalen Schichten (Schicht Basale und Stratum Spinosum) positiv für Keratin 14, färben, während die differenzierteren Zellen aus den supra basalen Schichten (Stratum Granulosum und Stratum Corneum) 10 und Involucrin positiv für Keratin färben. Dementsprechend konnte die Filaggrin Färbung nur in hoch differenzierten Zellen des Stratum corneumsbeobachtet werden. Am wichtigsten ist, zeigt Laminin 5 Färbung, dass eine Basallamina generiert wurde, um mit dermalen Abteil des kunsthaut rekonstruieren physiologisch der epidermalen verbinden. Dies beweist, dass eine Verbindungstür organotypischen Mikroumgebung Host Melanomzellen oder Sphäroide für physiologische und pathophysiologische Analyse generiert wurde.
Zum Zwecke der Melanom-Drogen-Screening, können einzelne Melanomzellen auch in der Dermis volle Haut äquivalente erlauben de Novo Melanom Nest Bildung18,19integriert werden. Daher sind Melanomzellen kombiniert mit primäre Fibroblasten in einem Verhältnis von 5:1, zusammen mit 200 X g für 5 min zentrifugiert und Nukleinsäuretablette in GNL vor dem Vermischen mit Kollagen. Infolgedessen bilden die Melanom-Zelle-Nester spontan in der dermalen Kompartiment. Unserer Erfahrung nach phase nur Zellen des metastasierten Wachstums Form richtige Nester, im Vergleich zu Melanomzellen RGP oder VGP15. Ein großer Nachteil dieser Art von Modellen die Tatsache, die die Anzahl und Größe der Melanom-Nester gebildet können nicht vorhergesagt werden ist, variieren zwischen den einzelnen Haut rekonstruiert, unabhängig von jeder Behandlung. Zum Beispiel können 1.000 Zellen ausgesät in der dermalen Fach 10 Nester bestehend aus 100 Zellen oder 100 Nester, bestehend aus 10 Zellen jeweils (Abbildung 5) gewinnen. Diese biologischen Variablen präsentieren mit drei Mängel: Erstens die Anzahl und Größe der Melanom-Nester gebildet sind unvorhersehbar; Zweitens die Metastasen in Vivo sind meist größer als Melanom Nester und zeigen vielfältige komplexer Intra-Tumor; und drittens durch die begrenzte Lebensdauer der Tumor-Nest Modelle Behandlung wird frühzeitig eingeleitet, und folglich eher hemmt Tumor Auswuchs statt verursacht Rückbildung von bestehenden Tumor Nester.
Um diese Einschränkungen organotypischen Melanom Sphäroid hautmodelle überwinden kann generiert werden. Durch die Kultivierung 250 metastasierendem Melanom Zellen in einer hängenden für 14 Tage20fallen, werden Sphäroide reproduzierbar erzeugt bestehend aus lebensfähigen Melanom, die Zellen präsentiert einen kompakten Aufbau mit einem Enddurchmesser von etwa 500 µm imitiert nicht durchblutet Tumor-Knoten, Mikro-Metastasen oder Inter Kapillare Mikro Regionen von soliden Tumoren21,22. In der Regel Melanom-Zell-Linie eignet sich für die Generation der Sphäroide über das HÃ ¤ ngen drop-Methode; Allerdings Zellen abgeleitet weiter fortgeschritten metastasiertem Tumor Stadien Form fester Sphäroide verglichen mit Zelllinien aus Fortschreiten Anfangsphase, z. B.die RGP.
Für einige Zellen ist es vorteilhaft für richtige Sphäroid Bildung zur Verbesserung der Viskosität der hängenden Tropfen Kulturmedium. Dies kann durch die Zugabe von 10-50 % Methylcellulose auf dem Kulturmedium erreicht werden. Für die Methylcellulose Stammlösung Autoklaven 1,2 g Methyl-Zellulose zusammen mit einer magnetischen rühren Bar in einer 100 mL-Glasflasche. Hinzufügen von 100 mL vorgewärmten (60 ° C) Medium und rühren für 20 min bei Raumtemperatur und eine weitere 1-2 h bei 4 ° c Die Stammlösung für 2 h bei 5.000 x g zentrifugieren und viskosen Überstand bei 4 ° C bis zu seiner Verwendung zu speichern.
Ordnungsgemäße Validierung von volle Haut Melanom Sphäroid Modellen erfolgt durch die Tatsache, dass eine definierte Anzahl von Melanom Sphäroide können - zumindest statistisch gesehen - in der dermalen Fibroblasten/Kollagen integriert werden, die ich am 1. Tag des Haut-Modellbau, Gerüst ermöglicht Sie während der epidermalen Differenzierung für 25-27 Tage gemeinsam zu entwickeln. Die Ausbeute an Sphäroide kann direkt nach der Aussaat, analysiert werden, weil Sphäroide erscheinen als weiße Flecken innerhalb der transparenten dermal gel und ohne Vergrößerung Gerät (Abbildung 2) gesehen werden können. Dadurch entsteht eine 3D Hautmodell, dass Häfen Reife Melanom Sphäroide, die kultivierten in Vitro für insgesamt ca. 42 Tage, zeigt das höchste Niveau der Intra-Tumor war-Differenzierung15 Zell.
H & E Färbung der Haut Melanom Sphäroid Modell zeigt die histologischen Erscheinungsbild und zelluläre Verteilung von Melanom Sphäroide sehr ähnlich dem menschlichen Melanom nicht durchblutet Haut Metastasen in Vivo15 (Abbildung 6 zu ). Zwei Subpopulationen von Melanomzellen sind unter diesen Bedingungen deutlich zu unterscheiden: einer peripheren wuchernden Subpopulation und einer zentralen Subpopulation, hauptsächlich bestehend aus geschrumpft, Apoptotic oder nekrotischen Zellen bilden die so genannte "nekrotische" Zentrum. -Proteins Leben und vermehren Subpopulationen detektiert werden mit Antikörpern gegen die Verbreitung Marker KI-67, während Zellen des nekrotischen Center von TUNEL-Färbung15visualisiert werden können. Diese besondere Verteilung der Tumor Zelle Subpopulationen gerechtfertigt ist durch die Sphäroid Größe (≥500 µm), durch einen Mangel an Nährstoffen und Sauerstoff im zentralen Teil denen katabolen Abfall ansammelt. Nach dem Protokoll, sofern hier die Generierung von eine zuverlässige und reproduzierbare organotypischen erlaubt eingebettet voll Dicke Menschenhaut Modell mit menschlichen Melanom Sphäroide, die menschlichen Melanom Haut Metastasen zu imitieren. Anwendungen von diesem Modell gehören Drogentests, screening von Toxinen, kosmetische Substanzen beeinflussen oder laser-Therapie auf Melanom Auswuchs und Behandlung.
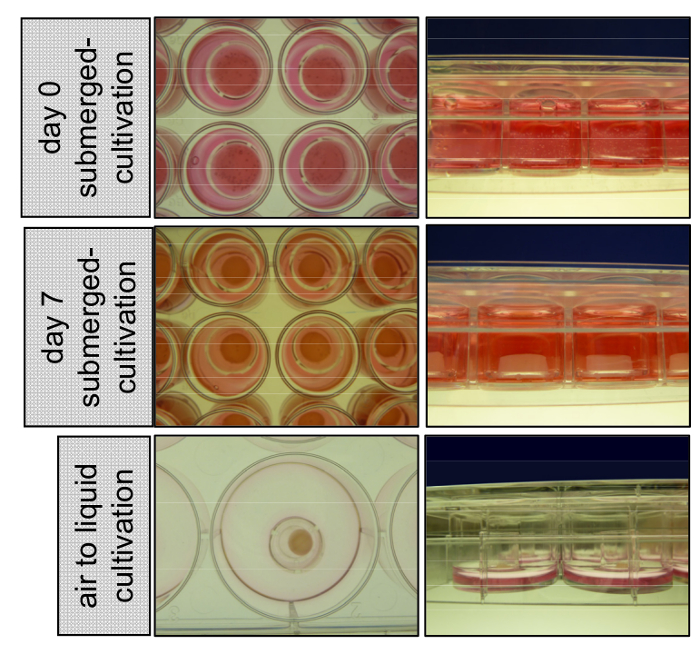
Abbildung 1 : Anbau von 3D organotypischen Haut rekonstruiert untergetaucht mit Medium und an der Grenzfläche Luft-Flüssigkeit. Am Tag 0, die primären Keratinozyten auf der Oberseite der dermalen Kompartiment bestehend aus primären Fibroblasten entkernt sind eingebettet in eine Kollagen-Typ ich Matrix. 3D Haut rekonstruiert kultiviert mit EGM für 7 Tage unter Wasser zu bleiben, trennen Sie die Insert-Wand und schrumpft. Am Tag 8 sind die Einsätze auf 6-Brunnen übertragen und an der Luft-Flüssigkeit-Schnittstelle erlauben epidermalen Schichtung kultiviert. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Melanom Sphäroide eingebettet in das dermal Fach als weiße Flecken erscheinen. Während der Vorbereitung der dermalen Fachs des 3D Haut rekonstruieren, eine definierte Anzahl von Melanom Sphäroide Fibroblasten Kollagen Typ hinzugefügt werden kann mischen ich. Sobald das dermale Gel gelegt hat, werden Melanom Sphäroide als weiße Flecken sichtbar.
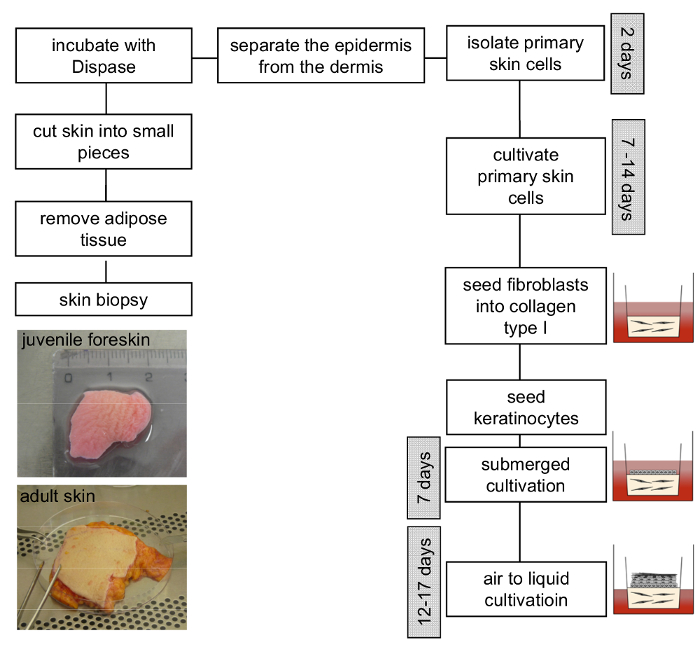
Abbildung 3 : Schema der 3D organotypischen Haut Modellbau. Die Hautprobe Fettgewebe entfernen und in kleine Stücke schneiden. Inkubation mit Dispase Lösung über Nacht bei 4 ° C erleichtert die Trennung der Epidermis von der Dermis. Isolierte primäre Fibroblasten und Keratinozyten sollte separat angebaut und zwischen Durchgang 4-6 und 3-4, bzw. verwendet werden. Anschließend kann die Generierung des Modells 3D Haut wie im Protokoll beschrieben vorgehen. Bitte klicken Sie hier für eine größere Version dieser Figur.
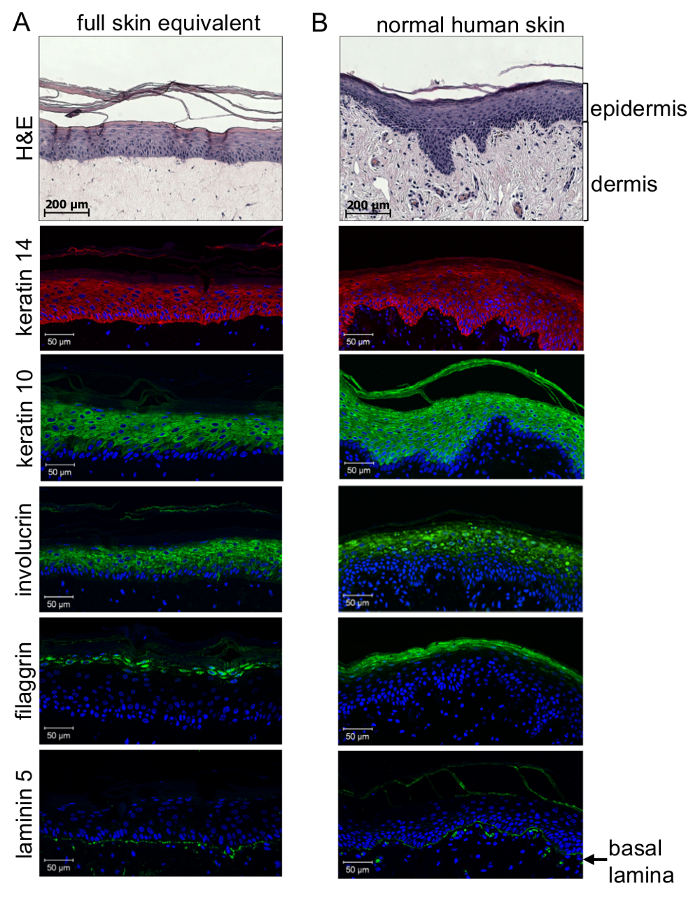
Abbildung 4 : 3D organotypischen Haut rekonstruiert zeigen eine Differenzierung Ebene ähnlich wie normale menschliche Haut. Paraffin Abschnitte Haut äquivalente (A) im Vergleich zu normalen menschlicher Haut (B) waren für den Ausdruck der Keratine 14 gefärbt (rot: λex 554 nm; λEm 568 nm) und 10, Involucrin (grün: λex 490 nm; λEm 525 nm ), Filaggrin (grün: λex 490 nm; λEm 525 nm), und Laminin 5 (grün: λex 490 nm; λEm 525 nm), und mit einem konfokale Fluoreszenzmikroskop analysiert. Zellkerne wurden visualisiert durch DAPI-Färbung (blau: λab 340 nm; λEm 488 nm). Immunhistochemische Untersuchung der 3D Full-dicke Haut äquivalente offenbarten richtige epidermalen Schichtung getrennten Schichten der Epidermis bildet, wie in der normalen menschlichen Haut zu sehen. Während Zellen aus den unteren epidermalen Schichten für Keratin 14 positiv gefärbt, unterschieden je mehr Zellen von der supra-Basalschicht zeigte Keratin 10 und Involucrin Färbung. Hoch differenzierte Zellen in der Nähe des Stratum corneums ausgedrückt Filaggrin. Laminin 5 Färbung zeigt, dass eine Basallamina erzeugt wird, um physiologisch der epidermalen dermalen Kompartiment (niedrigste Panel) herstellen. Diese Zahl wurde von Voersmann Et Al. übernommen 15 mit Erlaubnis. Bitte klicken Sie hier für eine größere Version dieser Figur.
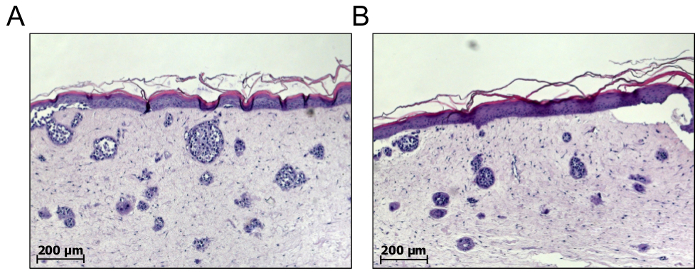
Abbildung 5 : Die Anzahl und Größe der spontan gebildeten Melanom Nester können nicht vorhergesagt werden. De Novo Melanom Nest Bildung im dermalen Fach der volle Haut Mittel erreicht werden können, durch Mischen einer definierten Anzahl von Melanom-Zellen mit primäre Fibroblasten zum Einbetten von beiden Zelltypen in Kollagen Typ ich Matrix. Die Anzahl und Größe der spontan gebildeten Melanom Nester können nur von einer Reife 3D Haut rekonstruieren nach ca. 21 Tagen analysiert werden. Wie abgebildet aus zwei Proben (A) und (B), die Zahlen und die Größen der Melanom-Nester variieren zwischen den einzelnen Haut rekonstruiert. Infolgedessen ist es schwierig, diese Modelle zu validieren und die therapeutische Wirkung vorherzusagen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6 : Melanom Sphäroide integriert Haut äquivalente rekapitulieren Hauptmerkmale des menschlichen kutanen Melanom Metastase. H & E gefärbt Paraffin Abschnitte des Tumors Sphäroide eingebettet in Haut äquivalente offenbart Sphäroide Hauptmerkmale mit nicht durchblutet menschlichen kutanen Melanom Metastasen in Vivozu teilen. Zwei Subpopulationen von Zellen sind deutlich erkennbar: eine periphere lebenden Subpopulation und zentrale Subpopulation, hauptsächlich bestehend aus geschrumpft, Apoptotic oder nekrotischen Zellen, die "nekrotische" Zentrum. Diese Verteilung der Tumor Zelle Subpopulationen garantiert der Sphäroid-Größe. Diese Zahl wurde von Voersmann Et Al. modifiziert 15 mit Erlaubnis. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Organotypischen Melanom Sphäroid Hautmodell hier vorgestellten garantiert neue Erkenntnisse für ein tieferes Verständnis der Intra-Tumor und Tumor-Wirt-Interaktion, und bieten eine erweiterte Screening-Plattform zur Untersuchung von molekularer Mechanismen der Tumorentstehung und Therapieresistenz in der Zukunft.
Um die beste Garantie physiologische und rekonstruiert in Vivo Bedingungen der Haut imitiert, die Qualität der PV-Zellen ist von größter Bedeutung. Wie bereits erwähnt, juvenile oder pränatale Hautzellen zeigen die niedrigsten Differenzierungsgrad und eignen sich daher am besten, voll-dicke Haut Entsprechungen zu generieren. Die erste mögliche Qualitätskontrolle ist das Ausmaß der dermalen Kontraktion am 2. Tag nach der Aussaat der Keratinozyten und äquilibrierung das Gel EGM (Protokoll Abschnitte 8.2 und 8.3). Dermale Gele werden am meisten mit der besten Qualität von Fibroblasten schrumpfen. Auch kann die Integration der zu wenige oder zu viele Fibroblasten dermal Kontraktion und folglich Befestigung der der epidermalen, dermalen Kompartiment beeinträchtigen. Dies beeinträchtigt wiederum epidermalen Differenzierung, weil dieser Prozess eine umfangreiche Übersprechen zwischen den dermalen und epidermalen Zellen erfordert.
Die Qualität von Primärzellen hängt auch die Zelle Konfluenz sowie die Passage der Zellen. Wenn Keratinozyten, ≥80 % Konfluenz angebaut werden sie sofort stoppen, wuchernden und beginnen zu unterscheiden. Es ist daher wichtig Kultur sie zu 40-70 % Konfluenz während passagierung und verwenden Sie sie nicht später als Durchgang 3-4. Fibroblasten sind weniger empfindlich, aber sollte nicht später als 4-6 Durchgang verwendet werden. Bitte beachten Sie, dass alle Primärzellen und Zelllinien zur Erzeugung von organotypischen Melanom Sphäroid hautmodelle kultiviert sind frei von Antibiotika, und daher ist das Kontaminationsrisiko hoch. Aber die Zugabe von Antibiotika ändert sich die Physiologie der einzelnen Zellen und reduziert somit die Qualität der Haut Entsprechungen.
Im Allgemeinen ist Sphäroid Tumorbildung möglich aus fast allen Arten von Tumor-Zell-Linien und auch von Tumorzellen, die frisch von Patientenmaterial isoliert. Die erste Zelle Nummer bzw. Anbau Zeit für die Gewinnung optimaler Sphäroid Größen variieren je nach Zelltyp verwendet. Bis zu einer Größe von 150-200 µm können alle Zellen in einem Sphäroid enthalten noch ausreichend mit Nährstoffen durch einfache Diffusion versorgt werden. Nur Sphäroide mit Größen ≥500 µm zeigen ein hohes Maß der Zelldifferenzierung und typischen Merkmale nicht durchblutet Tumor Gewebe22vertreten.
Die organotypischen Melanom-Sphäroid-Haut-Modell entwickelt, hier eignet sich besonders zur Tumor-Wirt Interaktionen zu untersuchen und für Melanom Drogentests unter in Vivo-Bedingungen15mag. Dennoch ist die Umgebung des Melanoms in Vivo noch komplexer, beherbergen eine Vielzahl von Zelltypen Tumor verbunden sind, einschließlich der Immunzellen und Endothelzellen. Da die Zugabe der richtigen primären Immunzellen Problemen mit Histocompatibility konfrontiert ist, sind diese Modelle noch nicht in der Lage, angemessen zu überwachen, immun-therapeutische Ansätze.
Dennoch, Melanom Sphäroide aus frisch isolierte Patientenmaterial generiert werden und nach in die volle Haut zu rekonstruieren, kann dienen als individuelle Drug screening Plattformen. Auch die Integration der Stücke von Melanom-Metastasen in Haut rekonstruiert ist denkbar, Medikamenten-Kombinationen in einer maßgeschneiderten Therapieansatz zu testen. Einschließlich organotypischen 3D-Modell Haut Melanom in der präklinischen Prüfung dürfte dazu beitragen, dass nur die vielversprechendsten neuartige therapeutische Konzepte in klinischen Tests, vorangebracht werden wodurch die Ausfallrate von potenziellen neuen Behandlungen für diese Krankheit und Erhöhung der Therapieerfolg in klinischen Studien.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Die Autoren danken für die 3D organotypischen Melanom-Sphäroid-Haut-Modell zu etablieren und bietet ausgezeichnete Protokolle Hanna Voersmann. Die Autoren danken auch Silke Busch für wertvolle technische Unterstützung. Die Arbeit wurde unterstützt vom BMBF e: Med Programm "Melanom Sensitivity" 031A423A.
Materialien
| Name | Company | Catalog Number | Comments |
| fetal serum albumin (FCS) | Thermo Fisher Scientific | 10270106 | add 10 % to cell culture medium |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300054 | 1X dilute in PBS |
| RPMI | Thermo Fisher Scientific | 61870010 | for cultivation of melanoma cell lines |
| DMEM | Thermo Fisher Scientific | 41965062 | for cultivation of primary fibroblasts |
| Dispase | Gibco life technologies | 17105041 | 2U/ml, dissolve in PBS |
| Collagen type I | BD Biosciences | 354249 | usually from rat tail, concentration should be 3.5-4 mg/ml |
| 24-well inserts Nunclon | Nunc | 140629 | 8 µm pore size; use standing, not hanging inserts! |
| cell strainer | BD Falcon | 352360 | yellow |
| Gentamycine | Thermo Fisher Scientific | 15750060 | dissolve in PBS |
| Keralife keratincyte medium | Cell Systems | do not add FCS or antibiotics | |
| Collagenase | SERVA | 17454 | NB4 standard grade |
| juvenile human keratinocytes | Cell Systems | FC-0007 | alternative to own preparation from juvenile foreskin |
| juvenile human fibroblasts | Cell Systems | FC-0001 | alternative to own preparation from juvenile foreskin |
| DMEM [+] 4,5 g/l Glucose, [+] L- Glutamine, [-] L- Pyruvate | Gibco life technologies | 41965 | mix 1:1 with Ham´s F-12 for MM medium; mix 3:1 with Ham´s F-12 for EGM medium |
| Ham´s F-12 [+] L-Glutamine | Gibco life technologies | 21765-029 | add to DMEM for the generation of EGM and MM medium (see lane 15) |
| EGF | Gibco life technologies | 13247-051 | add 10 ng/ml only for the generation of EGM medium |
| Calcium chloride | Merck Chemicals | 2381 | add 1.9 mM for the generation of EGM and 3.8 mM for MM medium |
| Selenic acid | Alfa Aesar | 18851 | add 53 nM for the generation of EGM and MM medium |
| Insulin | Lilly | HI0219 Hum Pen 3ml 100 E.I./ml | add 5 µg/ml for the generation of EGM and MM medium |
| Ethanolamine | Sigma-Aldrich | E-0135 | add 0.1 mM for the generation of EGM and MM medium |
| P-Ethanolamine | Sigma-Aldrich | P-0503 | add 0.1 mM for the generation of EGM and MM medium |
| Holo-Transferrine | Sigma-Aldrich | T-0665 | add 5 µg/ml for the generation of EGM and MM medium |
| Triiodthyronine | Sigma-Aldrich | T-6397 | add 20 pM for the generation of EGM and MM medium |
| Hydrocortisone | Sigma-Aldrich | H-088816 | add 0.4 µg/ml for the generation of EGM and MM medium |
| Progesterone | Sigma-Aldrich | P-8783 | add 10 nM only for the generation of EGM medium |
| Hepes | Sigma-Aldrich | H-3784 | add 15 mM for the generation of EGM and MM medium |
| Serine | Sigma-Aldrich | S-4311 | add 1 mM for the generation of EGM and MM medium |
| Cholinchloride | Sigma-Aldrich | C-7017 | add 0.64 mM for the generation of EGM and MM medium |
| dFCS | Sigma-Aldrich | F-0392 Lot 086K0361 | add 2 % for the generation of EGM and MM medium |
| Adenine | Sigma-Aldrich | A-9795 | add 0.18 mM for the generation of EGM and MM medium |
| L-Glutamine | PromoCell | C-42209 | add 7.25 mM for the generation of EGM and MM medium |
| Strontiumchloride | Sigma-Aldrich | 255521 | add 1 mM for the generation of EGM and MM medium |
| anti cytokeratin 10 antibody | Dako | M7002 | 1:50 |
| anti cytokeratin 14 antibody | Santa Cruz | sc-53253 | 1:200 |
| anti laminin 5 antibody | Santa Cruz | sc-32794 | 1:50 |
| anti filaggrin antibody | Thermo Fisher Scientific | MA5-13440 | 1:50 |
| anti involucrin antibody | Acris Antibodies | AM33368PU | 1:50 |
| secondary polyclonal goat anti-mouse IgG FITC labeled | LifeSpan Biosciences | LS-C153907 | 1:50 |
| secondary polyclonal goat anti-mouse IgG Cy3 labeled | Jackson Immuno Research | 115-165-003 | 1:1000 |
| DAPI | Sigma-Aldrich | 10236276001 | 1:100 |
Referenzen
- Boulais, N., Misery, L. The epidermis: a sensory tissue. Eur. J. Dermatol. 18 (2), 119-127 (2008).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat.Rev. Mol. Cell Biol. 10 (3), 207-217 (2009).
- Shain, A. H., Bastian, B. C. From melanocytes to melanomas. Nat. Rev. Cancer. 16 (6), 345-358 (2016).
- Clark, W. H. Human cutaneous malignant melanoma as a model for cancer. Cancer Metastasis Rev. 10 (2), 83-88 (1991).
- Hsu, M. Y., Meier, F., Herlyn, M. Melanoma development and progression: a conspiracy between tumor and host. Differentiation. 70 (9-10), 522-536 (2002).
- Miller, A. J., Mihm, M. C. Melanoma. N. Engl. J. Med. 355 (1), 51-65 (2006).
- Balch, C. M., et al. Final version of 2009 AJCC melanoma staging and classification. J. Clin. Oncol. 27 (36), 6199-6206 (2009).
- Eigentler, T. K., Caroli, U. M., Radny, P., Garbe, C. Palliative therapy of disseminated malignant melanoma: a systematic review of 41 randomised clinical trials. Lancet Oncol. 4 (12), 748-759 (2003).
- Kim, T., Amaria, R. N., Spencer, C., Reuben, A., Cooper, Z. A., Wargo, J. A. Combining targeted therapy and immune checkpoint inhibitors in the treatment of metastatic melanoma. Cancer Biol. Med. 11 (4), 237-246 (2014).
- Lawrence, M. S., et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature. 499 (7457), 214-218 (2013).
- Flaherty, K. T., et al. Inhibition of mutated, activated BRAF in metastatic melanoma. N. Engl. J. Med. 363 (9), 809-819 (2010).
- Rauschenberg, R., Garzarolli, M., Dietrich, U., Beissert, S., Meier, F. Systemic therapy of metastatic melanoma. J. Dtsch. Dermatol. Ges. 13 (12), 1223-1235 (2015).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: the multicellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nat. Rev. Mol. Cell Biol. 8 (10), 839-845 (2007).
- Vorsmann, H., Groeber, F., Walles, H., Busch, S., Beissert, S., Walczak, H., Kulms, D. Development of a human three-dimensional organotypic skin-melanoma spheroid model for in vitro drug testing. Cell Death. Dis. 4, e719 (2013).
- Chen, C. S., Lavker, R. M., Rodeck, U., Risse, B., Jensen, P. J. Use of a serum-free epidermal culture model to show deleterious effects of epidermal growth factor on morphogenesis and differentiation. J. Invest. Dermatol. 104 (1), 107-112 (1995).
- Meier, F., et al. Human melanoma progression in skin reconstructs : biological significance of bFGF. Am. J. Pathol. 156 (1), 193-200 (2000).
- Sinnberg, T., et al. Inhibition of PI3K-AKT-mTOR signaling sensitizes melanoma cells to cisplatin and temozolomide. J. Invest. Dermatol. 29 (6), 1500-1515 (2009).
- Niessner, H., et al. The farnesyl transferase inhibitor lonafarnib inhibits mTOR signaling and enforces sorafenib-induced apoptosis in melanoma cells. J. Invest. Dermatol. 131 (2), 468-479 (2011).
- Foty, R. A. A simple hanging drop cell culture protocol for generation of 3D spheroids. J. Vis. Exp. (51), e2720 (2011).
- Hirschhaeuser, F., Menne, H., Dittfeld, C., West, J., Mueller-Klieser, W., Kunz-Schughart, L. A. Multicellular tumor spheroids: an underestimated tool is catching up again. J. Biotechnol. 148 (1), 3-15 (2010).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol. J. 3 (9-10), 1172-1184 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten