Method Article
Um modelo de pele Melanoma de Organotypic 3D esferoide
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para gerar um modelo de pele de esferoide melanoma de organotypic 3D que recapitula os dois a arquitetura e complexidade multicelular de um órgão/tumor na vivo , mas ao mesmo tempo acomoda sistemática experimental intervenção.
Resumo
Transformação maligna dos melanócitos, as células de pigmento da pele humana, provoca a formação de melanoma, um câncer altamente agressivo com aumento potencial metastático. Recentemente, mono-quimioterapias continuam a melhorar por terapias de combinação específica de melanoma com inibidores da quinase específica. Ainda, melanoma metastático continua a ser uma doença fatal porque tumores exibem resistência primária ou desenvolvem resistência às terapias de romance, assim, recuperar a capacidade oncogenicidade. Para melhorar o sucesso terapêutico de melanoma maligno, a determinação dos mecanismos moleculares que confere resistência contra abordagens de tratamento convencional é necessária; no entanto, requer modelos inovadores celulares em vitro . Aqui, apresentamos um em vitro tridimensional (3D) organotypic melanoma esferoide modelo que pode retratar a arquitetura na vivo de melanoma maligno e pode justificar novos insights sobre intra-tumoral, bem como interações de tumor-hospedeiro. O modelo incorpora números definidos de esferoides melanoma maduras e diferenciadas em um modelo de reconstrução 3D da pele completo humano consistindo de células primárias da pele. O status de composição e de diferenciação celular de esferoides o melanoma incorporado é semelhante da metástase de melanoma cutâneo em vivo. Usar este modelo de esferoide de melanoma organotypic como uma plataforma de despistagem de drogas podem apoiar a identificação dos respondentes para selecionado terapias de combinação, poupando o fardo desnecessário tratamento de não-respondedores, aumentando assim o benefício de intervenções terapêuticas.
Introdução
A pele humana é composta de dois compartimentos distintos que servem diferentes funções em proteger o corpo dos efeitos ambientais adversos1. O compartimento inferior dérmico consiste de um fibro-elástico do tecido conjuntivo. É composto por fibras de colágeno e elastina frouxamente ligadas sintetizadas pelos fibroblastos, servindo a uma função de barreira mecânica. A derme é separadoda da epiderme superior pela lâmina basal, que é produzida como uma matriz extracelular devido a uma comunicação constante entre os dois compartimentos de pele. Em contraste com a derme, a epiderme é um epitélio escamoso, que consiste principalmente de queratinócitos e pode ser diferenciada em quatro camadas. O estrato basale consiste de ceratinócitos basais indiferenciados que constantemente derivam de células progenitoras de pele estratificar através dos estágios do estrato granuloso e estrato spinosum no estrato córneo para proteger o corpo de infecções e desidratação2. Os melanócitos estão alinhados com a membrana basal e comunicam através de extensões dendríticas com vários queratinócitos. Que produzem a pigmento melanina para proteger o tecido da pele contra os efeitos nocivos da radiação UV, como o envelhecimento da pele, imunossupressão, inflamação e indução de câncer de pele não-melanoma. Contribuição de radiações UV para a transformação dos melanócitos de melanoma maligno, no entanto, ainda está em debate3.
Desenvolvimento de melanoma é diferenciado em fases de progressão do tumor diferente e caracterizado por certas mudanças genéticas, morfológicas e histológicas4. Eles se originam de qualquer de novo ou de um nevo inato ou adquirido devido a um local, aumento da proliferação de melanócitos causando neoplasia benigna. Esta lesão precursora pode converter em tecido displásico estruturalmente modificado, contendo células atypic, que podem continuar a primeira fase maligna, a fase de crescimento radial (RGP). Esta fase inicial de progressão de tumor é caracterizada por células proliferando radialmente dentro da epiderme, apresentando poucas células localmente invasivas dentro da derme papilar. Durante o melanoma de fase (VGP) subsequente crescimento vertical as células já apresentam um fenótipo invasivo e metastático através da lâmina basal para infiltrar as partes mais profundas da derme, bem como o tecido subcutâneo5da ruptura. Finalmente, o melanoma metastático (MM) representa o estágio de progressão mais agressivo com células metastáticas sistemicamente se espalhando em todo o sistema de sangue e da linfa para invadir a órgãos como o fígado, pulmão e cérebro6distalmente.
Até à data, diagnóstico precoce, seguido de cirurgia continua a ser a mais eficaz terapia de melanoma maligno. O prognóstico para pacientes com metástase à distância, no entanto, continua a ser particularmente pobre7, porque os regimes de quimioterapia clássica conferem apenas pequena sobrevivência benefício8,9. No entanto, depois de décadas de estagnação, avanços recentes em terapias alvo têm melhorado consideravelmente o prognóstico do melanoma maligno.
Hipotalâmica de duas vias principais mitógeno ativado, o RAS-RAF-MEK-ERK e as vias de sinalização de PI3K-AKT-PTEN, apresentam impulsores-chave de progressão do melanoma, especialmente quando constitutivamente ativando mutações pontuais de BRAFV600 os proto-oncogenes e ARN são presentes10. Nesse sentido, a invenção de inibidores da quinase alvo prometido benefício terapêutico para pacientes que sofrem de melanoma metastático. Uma infinidade de ensaios clínicos realizados a este ponto não tem alcançado significativo benefício para pacientes com melanoma metastático. Quase todas as respostas são parciais, com uma subpopulação de pacientes mostrando resistência primária. Além disso, observou-se a aquisição da resistência secundária, levando a recaída na maioria dos pacientes11,12.
Torna-se claro que a análise do estado de mutação sozinho não é suficiente para desenvolver a estratégia terapêutica mais potente. Novas ferramentas de diagnóstico rápidas e confiáveis são necessárias para sistematicamente registar e analisar a capacidade de resposta das células cancerosas individuais. A grande maioria dos dados disponíveis atualmente no melanoma humano foram Obtida de culturas de células de melanoma (2D) bidimensional. Células tumorais, no entanto, crescidas em 3D permitem intercelular crosstalk entre câncer diferenciado subpopulações de células, bem como entre as células cancerosas e o tecido do hospedeiro circundante não-transformadas. Portanto, seria melhor reconstruir o ambiente 3D, em que o melanoma desenvolvido, para ser usado como um rastreio pré-clínico modelo13,14.
Protocolo
Todo trabalho de tecido humano foi realizado usando protocolos institucionais aprovados.
1. separação de derme e epiderme da pele humana (prepúcio juvenil da circuncisão)
- Coloque o prepúcio (geralmente 1-2 cm2) em um prato de cultura de células estéreis não-adesivas (Ø 10 cm) e cubra-o com 10-12 mL de tampão fosfato salino+ (PBS, 0.5 mM MgCl2, 0.9 mM CaCl2, pH 7,2 = PBS+). Retire todo excesso de tecido (tecido adiposo) usando pinças e bisturi estéril.
- Cortar a pele em pedaços de 3 x 5 mm, lave-os com PBS e transferi-los para um prato de cultura de pilha de estéril não adesivas (Ø 6 cm). Cubra os pedaços de tecido com 5-7 mL de solução de dispase (2 U/mL em PBS). Selar o prato de cultura celular com película de parafina e incubar durante 16 h a 4 ° C.
- Retrai o epidérmico da parte dérmica com duas pinças esterilizadas. Transfira os pedaços de tecido dissecado para pratos de cultura de células individuais não-adesivas (Ø 6 cm) e cubra cada um com PBS+.
2. isolamento de primários queratinócitos da epiderme
- Cuidadosamente remova a PBS+ o prato de cultura de células utilizando uma pipeta Pasteur e lave as peças de tecido epidérmico (ponto 1.3) com PBS. Corte a epiderme em pedaços menores (1 mm2) e cobrá-los em um tubo cónico de 50 mL. Adicionar 10 mL 1 x Trypsin-EDTA (pré-aquecido a 37 ° C) e incube por 5 min em um banho-maria a 37 ° C. Levar a suspensão de tecido cada 2 min.
- Pare a reação enzimática, adicionando 1 mL soro de vitela fetal (FCS). Ressuspender as células pipetando para cima e para baixo com uma pipeta de 10 mL de plástico de 4 min. Try para evitar bolhas e formação de espuma.
- Pipetar a suspensão de células em um coador de célula (poros tamanho 100 µm), colocado em cima de um tubo de cónico de 50 mL e lavar 3x com 5 mL de PBS. Centrifugar as células a 200 x g por 5 min. Ressuspender as células em 2-6 mL de meio de cultura contendo 1% (v/v) gentamicina. Determine o número de células manualmente pela contagem de células em um hemocytometer e semente de 6 x 105 células para um balão de cultura celular T75.
3. cultivo de queratinócitos primários
- Incube os queratinócitos principais isolados na etapa 2.3 em uma incubadora de célula em 37 ° C e 5% CO2 no queratinócito médio sem FCS, a confluência de 50-70%.
- A passagem os queratinócitos cuidadosamente remova o meio, adicionar 5 mL de PBS-EDTA e incube as celulas por 10 min a 37 ° C. Verificar se as células começaram a desapegar do frasco de cultura sob um microscópio (ampliação de 4x: células aparecerá arredondadas mas ainda estejam presos!). Caso contrário, substitua o velho PBS-EDTA com PBS-EDTA fresco e re-incubar durante mais 10 minutos a 37 ° C.
- Adicionar 5 mL 1 x Trypsin-EDTA para as células arredondadas ainda coberto com 10 mL de PBS-EDTA e re-incube-os 1-3 min a 37 ° C. Parar a reação enzimática, adicionando 1 mL FCS e coletar as células isoladas em um tubo cónico de 50 mL. Centrifugar as células a 200 x g por 5 min, resuspenda o pellet em queratinócitos médio e semente 6 x 105 células para um balão de cultura de células T75 fresco.
Nota: Para gerar organotypic pele reconstrói, os queratinócitos principais devem ser usados não mais tarde do que a passagem de 3-4.
4. isolamento de primários fibroblastos da derme
- Corte o tecido cutâneo (ponto 1.3) em pedaços pequenos (1 mm2) e transferi-los para um tubo cónico de 50 mL. Adicionar 10 mL solução de colagenase (5 U/mL de PBS+) e incube por 45 min em um banho-maria a 37 ° C. Centrifugue a mistura de pedaços de tecidos e células a 200 x g por 5 min.
- Lave o centrifugado duas vezes com 10ml DMEM contendo glicose de 4,5 g/L e L-glutamina, mas sem L-piruvato. Finalmente Resuspenda os pedaços de tecido em 2 mL de DMEM contendo 1% (v/v) gentamicina e FCS de 10%. Transferi-los para um frasco de cultura celular T25 e incube-os em uma incubadora de célula em 37 ° C e 5% de CO2 durante a noite.
Nota: O volume pequeno permite que os fibroblastos migrar fora os restos de tecido e obriga-os a anexar para o frasco de cultura. - Na manhã seguinte, adicionar outra 6 mL DMEM/gentamicina/FCS e incubar durante 2-3 dias a 37 ° C, até que chegaram a confluência de 80-90% das células.
5. cultivo de fibroblastos primários
- Passagem os fibroblastos, remover o meio e lavar as células aderentes com PBS. Adicionar 5 mL 1 x Trypsin-EDTA e incubar durante 3 min a 37 ° C.
- Parar a reação enzimática pela adição de 5 mL DMEM/FCS e coletar as células isoladas em um tubo cónico de 50 mL. Centrifugar as células a 200 x g por 5 min, resuspenda o pellet em meio DMEM e semente 6 x 105 células para um balão de cultura de células T75 fresco.
Nota: Para gerar organotypic pele reconstrói, os fibroblastos primários devem ser usados não mais tarde do que a passagem de 4-6.
6. geração de Melanoma 3D esferoides através do método de soltar o enforcamento
- Cultura melanoma células (por exemplo, 451-LU ou qualquer linha de células de melanoma de interesse) de acordo com protocolos gerais, utilizando RPMI contendo 10% FCS15.
- Para gerar esferoides de melanoma de tamanho e qualidade similares, lavar as células de melanoma em PBS, adicionar 5 mL de 1x Trypsin-EDTA em PBS para as células em um T175 frasco de cultura de células e incubar durante 3-5 min à temperatura ambiente (RT). Neutralize a tripsina pela adição de 5 mL RPMI/10% FCS. Colheita que as células por centrifugação a 200 x g durante 5 min. Ressuspender o sedimento celular em RPMI/FCS em uma concentração final de 10.000 células/mL, conforme determinado pela contagem em um hemocytometer.
- Ponto 40 x 25 µ l (= 250 células) de suspensão de células para a superfície interna da tampa de um prato de cultura estéril não-adesivas celular (Ø 10 cm) usando uma pipeta eletrônica multi. Com um movimento rápido, mas suave, vire a tampa e coloque-o sobre o prato de cultura respectiva célula contendo 5 mL de PBS.
- Cultura "pendurado pratos gota" em uma incubadora de célula em 37 ° C e 5% de CO2 por 10-14 dias, dependendo do tipo de célula usada.
Nota: As células da fase de crescimento MM normalmente crescem mais rápido e formam esferoides mais sólidas na gota pendurada em comparação com as células de melanoma derivadas do RGP ou VGP. Para avaliação individual, observe crescimento esferoide sob um par de binóculos ou sob um microscópio (ampliação de 4x). Geralmente, esferoides tornam-se detectáveis após 48 h, sob um par de binóculos ou sob um microscópio (ampliação de 4x). Depois de 10-14 dias, eles são visíveis sem qualquer dispositivo de ampliação.
- Cultura "pendurado pratos gota" em uma incubadora de célula em 37 ° C e 5% de CO2 por 10-14 dias, dependendo do tipo de célula usada.
- 5 dias depois de avistar a queda inicial, adicionar 10 µ l de meio fresco RPMI/10% FCS para cada gota. Posteriormente, troca de 10 µ l de meio todos os dias. O uso de um distribuidor de eletrônico é muito útil nesta etapa.
- Dependendo do tipo de célula, colheita os esferoides (ver secção 10 para detalhes) após 10-15 dias, enxaguando-os suavemente a tampa de prato de cultura celular com PBS. Pegá-los em um prato de cultura fresco não adesivas de célula.
Nota: O período de cultivo varia de acordo com a fase de crescimento do tumor das células de melanoma quando eles foram inicialmente derivados, por exemplo, esferoides derivadas de células 451-LU crescem para cerca de 500 µm de diâmetro dentro de 12 dias de cultivo no enforcamento drop15 .
7. geração do compartimento dérmica da pele Organotypic Full reconstrói
- Gere modelos de pele usando células de 24 poços microporous membrana inserções (poros de tamanho 8 µm) colocadas em placas de 24 poços.
Nota: Certifique-se não usar suspensão mas inserções, de pé, porque eles serão colocados em uma placa de 6 para o cultivo de ar-líquido numa fase posterior. - Prepare o gel de neutralização solução (GNL)15, bem como os meios de cultura, conhecido como MM e crescimento endotelial meios (EGM)16,17. Para evitar a coagulação, loja do colágeno tipo I (geralmente de rabo de rato, 3.5-4 mg/mL em 0,02 N de ácido acético) no gelo até o uso, porque ele começa à RT
- Re-suspender 1 x 105 fibroblastos por inserir em GNL e misturar rapidamente a suspensão de células com colágeno na proporção de 1:3 em um volume final de 500 µ l/inserir. Reconstruir a mistura suavemente pipetando acima e para baixo para evitar a formação de bolhas, como bolhas podem afectar a qualidade da pele.
- Permitir que os geles dérmicos individuais resolver, mantendo-os sem médio em RT por 30 min em uma capa de estéril. Posteriormente, cobrir cada gel com DMEM contendo glicose de 4,5 g/L, 1% L-glutamina, 10% FCS e sem L-piruvato e incubar durante uma noite a 37 ° C.
8. geração do compartimento epidérmica da pele Organotypic Full reconstrói
- No dia seguinte Retire o meio os géis dérmicos e equilibrar os com EGM meios de comunicação social (FCS de 10%, 1% PenStrep, gentamicina 10 mg/mL) por 2 h a 37 ° C. Retirar o meio e cuidadosamente semente 1 x 105 queratinócitos resuspended em 100 µ l EGM do gel dérmica.
- Incube a reconstrói para 1,5 h a 37 ° C, para permitir que os queratinócitos a aderir ao compartimento dérmica.
Nota: Durante este tempo de incubação, os géis começará a encolher devido à contração induzida por fibroblastos e assim, pelo menos parcialmente desapegar das paredes de inserção. - Cobrir os equivalentes de pele com aproximadamente 800 µ l EGM e cuidadosamente, remover o gel residual da parede com uma ponta de pipeta (branca) pequena inserção. Cultura os equivalentes de pele submergidos na EGM para 7 dias em uma incubadora de célula a 37 ° C, 5% de CO2e mudar o meio de todos os outros dias.
Nota: Durante este tempo os equivalentes de pele serão reduzido significativamente.
9. ar-líquido cultivo de Organotypic Full pele reconstrói
- No dia 8, a transferência cada inserir um bem individual de uma placa de 6. Só adicione 1,2-1,4 mL de meio MM para cada poço, assim, reconstruir a pele é fornecida com médio do fundo do poço, mas não é coberta com o meio.
Nota: O cultivo na interface ar-líquido permite estratificação da parte epidérmica e estabelecimento de uma camada completa cornificada (estrato córneo). - Durante os próximos dias 10-17, mude o meio, como indicado na secção 9,1 todos os dias. Durante este período, adicione drogas ou outros estímulos como necessário para o meio. Remova cuidadosamente a reconstruir pele cheia da inserção da membrana microporosa usando uma pinça curva para uma análise mais aprofundada, por exemplo, análise imuno-histoquímica (Figura 1).
10. geração dos modelos de pele Organotypic Melanoma esferoide
- Para integrar o compartimento dérmico do organotypic completo pele reconstrói os esferoides de melanoma, enxaguar cuidadosamente os esferoides (depois passo 6.4) a tampa do enforcamento placa de cultura de células de gota com PBS. Colete 10-20 esferoides/inserir em um prato de cultura estéril não-adesivas de célula. Remova com cuidado excessivo PBS com uma pipeta Pasteur.
- Aspire os esferoides no menor possível volume da EGM. Neste momento, observar e contar os esferoides a olho nu, sem qualquer outro dispositivo de ampliação. Tome esferoides de 10-20 por modelo de pele/gel, tal como indicado no passo 10.1.
- Transferi-los para o volume desejado de GNL contendo fibroblastos (durante a etapa de 7,3) e misture com o colágeno tipo eu. Desta etapa em prossiga conforme descrito nas seções 7.3-9.1.
Nota: Esferoides Tumor tornar-se visível no gel dérmico como manchas brancas (Figura 2)
Resultados
O sucesso do tratamento de metástase de melanoma pode ser influenciado pelo cross-talk entre as células do tumor, bem como entre o tumor e células não-transformadas. O objetivo de desenvolver modelos de organotypic do câncer em vitro é fornecer sistemas de testes pré-clínicos apropriado que recapitular a organização 3D e complexidade de melanoma humano in vivo. Isso permite que o estudo do impacto terapêutico do tumor dentro de um ambiente de organotypic e os efeitos adversos sobre o tecido circundante primário em paralelo.
Para desenvolver os melhores modelos de pele de organotypic, a qualidade das células primárias é crucial. É vantajoso usar juvenis primários fibroblastos e queratinócitos, porque normalmente são menos diferenciados em relação às células adultas cutâneo primário. Juvenil pele células podem tanto ser isolado do prepúcio juvenil conforme descrito nas seções de protocolo 1-5, mas também pode ser comprado de empresas como pré-natal primários fibroblastos e queratinócitos. Se compra, é necessário para as células de ordem de doadores diferentes para evitar resultados específicos do doador, por exemplo, para a sensibilidade de drogas. O protocolo é exibido como um esquema na Figura 3.
Controle de qualidade de 3D cheio-pele equivalentes requer análise imuno-histoquímica. Uma primeira impressão pode ser obtida pela hematoxilina-eosina (H & E) mancha de parafina incorporado seções (3 µm). Análise detalhada da qualidade da diferenciação epidérmica e formação da lâmina basal entre a derme e epiderme requerem análise imuno-histoquímica, utilizando anticorpos específicos contra um marcador de estratificação epidérmico. Isto permite distinguir entre células indiferenciadas, altamente proliferativas localizado perto da membrana basal e altamente diferenciadas e marginalizadas células do estrato córneo , através da formação de camadas epidérmicas distintas entre . Conforme mostrado pela coloração histológica-imune (Figura 4), diferenciação dos queratinócitos em toda a epiderme poderia ser alcançada semelhante à pele normal: principalmente as células indiferenciadas das camadas epidérmicas inferiores (estrato basale e estrato spinosum) mancha positiva para queratina 14, enquanto as células mais diferenciadas das camadas supra basal (estrato granuloso e estrato córneo) mancham positiva para queratina 10 e involucrin. Nesse sentido, filaggrin coloração poderia somente ser observada em células altamente diferenciadas do estrato córneo. Mais importante ainda, coloração de laminina 5 revela que uma lâmina basal foi gerada para se conectar a epidérmica fisiologicamente ao compartimento dérmica de reconstruir a pele artificial. Isto prova que um microambiente organotypic comunicação foi gerada de células de melanoma de host ou esferoides para análise de alterações fisiológica e fisiopatológicas.
Com a finalidade de triagem de drogas de melanoma, células de melanoma único também podem ser integradas dentro da derme de equivalentes de pele completo para permitir de novo melanoma ninho formação18,19. Portanto, as células de melanoma são combinadas com fibroblastos primários na proporção de 5:1, centrifugado juntos em 200 x g durante 5 min e resuspended em GNL antes da mistura com colágeno. Como resultado, os ninhos de células de melanoma formarão espontaneamente no compartimento dérmico. De acordo com nossa experiência, apenas células do crescimento metastático fase ninhos de forma adequada, em comparação com as células de melanoma do RGP ou VGP15. Uma grande desvantagem destes tipos de modelos é o fato de que o número e tamanho dos ninhos de melanoma formado não podem ser previstos e podem variar entre pele individual reconstrói, independentemente de qualquer tratamento. Por exemplo, 1.000 células semeadas no compartimento dérmico podem ganhar 10 ninhos consistindo de 100 células ou 100 ninhos consistindo de 10 células cada (Figura 5). Essas variáveis biológicas apresentam três deficiências: primeiro, o número e o tamanho do melanoma ninhos formados são imprevisíveis; em segundo lugar, as metástases no vivo são geralmente maiores que os ninhos de melanoma e apresentam uma diversidade intra-tumoral mais complexa; e em terceiro lugar, devido a limitada duração dos modelos de tumor-ninho, tratamento é iniciado mais cedo e consequentemente um pouco inibe a consequência do tumor em vez de causar regressão de ninhos de tumor existente.
Para superar estes modelos de pele de esferoide de melanoma organotypic limitações pode ser gerados. Por melanoma metastático 250 cultivo as células em um enforcamento cair para 14 dias20, esferoides reproducibly são gerados consistindo de melanoma viável células apresentando uma estrutura compacta com um diâmetro final de cerca de 500 µm imitando não vascularizadas tumor nós, micrometástase, ou inter capilar micro regiões de tumores sólidos21,22. Em geral, qualquer linha de células de melanoma é adequada para a geração de esferoides através do enforcamento cair método; no entanto, células derivadas de mais avançada forma de estágios do tumor metastático mais sólidas esferoides comparados com linhas de células derivadas de progressão estágios iniciais, por exemplo, a RGP.
Para algumas células, é vantajoso para a formação de esferoide adequada aumentar a viscosidade do enforcamento gota de meio de cultura. Isto pode ser conseguido pela adição de 10-50% de metil-celulose para o meio de cultura. Para a metil-celulose solução-mãe, autoclave 1,2 g de metil-celulose em conjunto com uma barra de agitação magnética em um frasco de vidro de 100 mL. Adicionar 100 mL de meio de pré-aquecido (60 ° C) e mexa por 20 min em temperatura ambiente e o outro 1-2 h a 4 ° C. Centrifugue a solução estoque para 2 h a 5.000 x g e armazenar o sobrenadante viscoso a 4 ° C até o uso.
Adequada validação de modelos de esferoide de melanoma de pele completo é fornecido pelo fato de que um número definido de melanoma esferoides pode - pelo menos estatisticamente - integráveis nos fibroblastos dérmico/colágeno eu andaime no dia 1 de construção do modelo da pele, permitindo que -los para co-desenvolver durante a diferenciação epidérmica mais dias 25-27. O rendimento de esferoides pode ser analisado diretamente após a semeadura, porque esferoides aparecem como manchas brancas dentro o transparente dérmicas do gel e podem ser vistas sem qualquer dispositivo de ampliação (Figura 2). Como resultado, um modelo 3D da pele é gerado que esferoides de melanoma maduro de portos, que tinham sido cultivadas em vitro para um total de cerca de 42 dias, mostrando o alto nível de intra-tumoral celular diferenciação15.
H & E mancha do modelo pele melanoma esferoide revela a aparência histológica e distribuição celular de esferoides melanoma ser muito semelhante de melanoma humano avasculares pele metástases na vivo15 (Figura 6 ). Duas subpopulações de células de melanoma são claramente distinguíveis sob estas condições: uma subpopulação de proliferação periférica e uma central subpopulação composta principalmente de encolhida, apoptose ou necróticas células, formando os chamados "necrótico" centro. Immunohistochemically viver e proliferando subpopulações pode ser detectado usando anticorpos contra o marcador de proliferação KI-67, Considerando que as células do centro necrótico podem ser visualizadas pelo TUNEL-coloração15. Esta distribuição particular de subpopulações de células de tumor se justifica pelo tamanho esferoide (≥500 µm), resultante da falta de nutrientes e oxigênio na parte central, onde acumula resíduos catabólicos. Seguindo o protocolo, desde que aqui vai permitir a geração de um organotypic confiável e reprodutível o modelo de pele humana da cheio-espessura com incorporado esferoides de melanoma humano que imitam a metástase de melanoma humano pele. Aplicações deste modelo incluem drogas testes, triagem de toxinas, a influência de compostos cosméticos ou laser terapia em consequência de melanoma e tratamento.
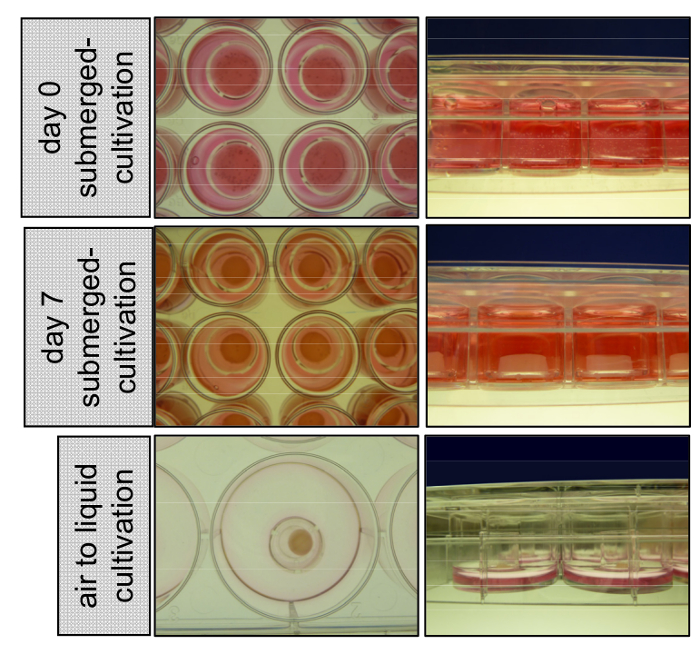
Figura 1 : Cultivo de organotypic 3D pele reconstrói submersa com médio e na interface líquido-ar. No dia 0 queratinócitos primários são semeados no topo do compartimento dérmico consistindo de fibroblastos primários incorporado em um tipo de colágeno eu matriz. Pele 3D reconstrói fica cultivada submersos com EGM por 7 dias, desanexar da parede da inserção e começa a encolher. No dia 8 as inserções são transferidas para poços de 6 e cultivadas na interface ar-líquido para permitir estratificação epidérmica. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Esferoides melanoma incorporados no compartimento dérmico aparecem como manchas brancas. Enquanto prepara o compartimento dérmico do reconstruir pele 3D, um número definido de esferoides de melanoma pode ser adicionado para o tipo de colágeno dos fibroblastos que misturar. Uma vez que o gel dermal se estabeleceu, esferoides melanoma tornam-se visíveis como manchas brancas.
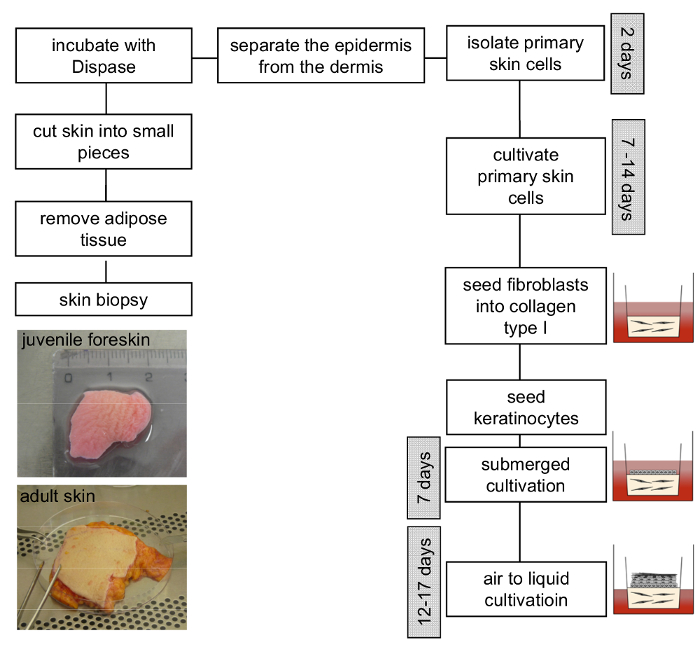
Figura 3 : Esquema de construção do modelo 3D organotypic pele. Remova o tecido adiposo a amostra de pele e corte em pedaços menores. Incubação com solução de dispase durante a noite a 4 ° C facilita a separação da epiderme da derme. Queratinócitos e fibroblastos primários isolados devem ser cultivados separadamente e usados entre passagem 4-6 e 3-4, respectivamente. Posteriormente, a geração do modelo 3D da pele pode proceder como descrito no protocolo. Clique aqui para ver uma versão maior desta figura.
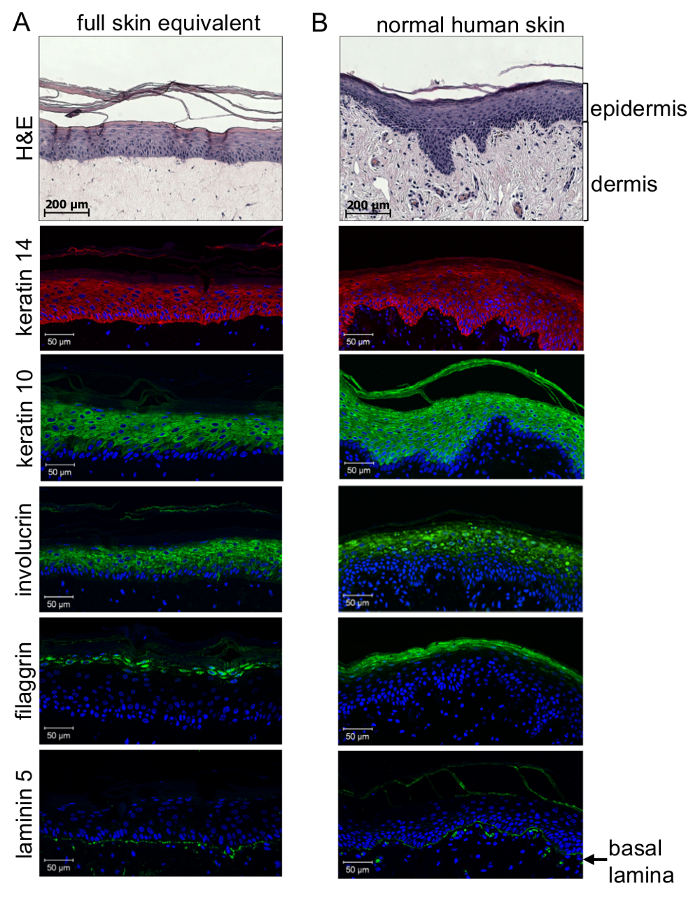
Figura 4 : 3D organotypic pele reconstrói mostra um nível de diferenciação semelhante à pele humana normal. Seções de equivalentes de pele de parafina (A) pele humana em relação ao normal (B) foram corados para a expressão de queratina 14 (vermelho: λex 554 nm; λem 568 nm) e 10, involucrin (verde: λex 490 nm; λem 525 nm ), filaggrin (verde: λex 490 nm; λem 525 nm) e laminina 5 (verde: λex 490 nm; λem 525 nm) e analisadas com um microscópio de fluorescência confocal. Núcleo de células foram visualizado por coloração DAPI (azul: λex 340 nm; λem 488 nm). Exame imuno-histoquímico da cheio-espessura 3D da pele equivalentes revelou adequada epidérmico estratificação formando camadas distintas da epiderme, como pode ser visto na pele humana normal. Enquanto as células das camadas epidérmicas inferiores manchados positivas para queratina 14, o mais diferenciado células da camada basal supra mostrou queratina 10 e coloração involucrin. Células altamente diferenciadas perto do estrato córneo expressaram filaggrin. Coloração de laminina 5 mostra que uma lâmina basal é gerada para fisiologicamente conectar epidérmico ao compartimento dérmica (painel inferior). Esta figura foi tirada de Voersmann et al . 15 com permissão. Clique aqui para ver uma versão maior desta figura.
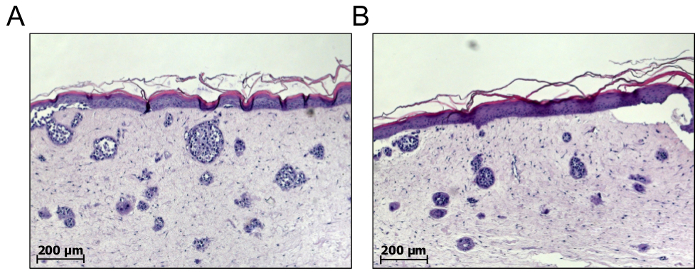
Figura 5 : O número e tamanho dos ninhos de melanoma espontaneamente formada não podem ser previstos. Formação de ninho de melanoma de novo no compartimento da pele completo equivalentes podem ser conseguidos através da mistura de um número definido de melanoma dérmico células com fibroblastos primários para incorporar ambos os tipos de células do tipo colágeno matriz. O número e tamanho dos ninhos de melanoma espontaneamente formado só podem ser analisados de uma pele madura 3D reconstruir após cerca de 21 dias. Como descrito de duas amostras (A) e (B), os números e os tamanhos dos ninhos melanoma podem variar entre reconstrói individuais da pele. Como consequência, é difícil validar esses modelos e para prever o impacto terapêutico. Clique aqui para ver uma versão maior desta figura.

Figura 6 : Esferoides melanoma integrados em equivalentes de pele recapitular as características chaves de metástase de melanoma cutâneo humano. H & E manchado de cortes de parafina de tumor esferoides incorporados em equivalentes de pele revelaram esferoides para compartilhar recursos chaves com melanoma cutâneo humano avasculares metástases na vivo. Duas subpopulações de células são claramente discerníveis: uma subpopulação de vida periférica e central subpopulação composta principalmente de encolhida, apoptose ou necróticas células, formando o centro "necrótico". Esta distribuição de subpopulações de células de tumor é garantida pelo tamanho esferoide. Esta figura foi modificada de Voersmann et al . 15 com permissão. Clique aqui para ver uma versão maior desta figura.
Discussão
O modelo de pele esferoide de melanoma organotypic introduzido aqui garante novas perspectivas para uma compreensão mais profunda de intra-tumoral e interação de tumor-hospedeiro e pode fornecer uma plataforma de triagem avançados para estudar os mecanismos moleculares do desenvolvimento do tumor e resistência de terapia no futuro.
Para garantir o melhor fisiológica e na vivo simulando condições de pele reconstrói, a qualidade das células primárias é de extrema importância. Como dito acima, as células de pele juvenil ou pré-natal mostram o grau de diferenciação menor e são, portanto, melhor adequadas para gerar equivalentes de pele de espessura total. O primeiro controle de qualidade possível é a extensão da contração dérmica no 2º dia após a semeadura os queratinócitos e desenroscada do gel a EGM (seções de protocolo 8.2 e 8.3). Géis dérmicas vão encolher ao máximo com a melhor qualidade dos fibroblastos. Também, a integração de poucos ou muitos fibroblastos pode afectar dérmica contração e, consequentemente, a penhora de epidérmico ao compartimento dérmica. Isto por sua vez irá comprometer a diferenciação epidérmica, porque este processo requer uma extensa conversas cruzadas entre células dérmicas e epidérmicas.
A qualidade das células primárias também depende muito da confluência de célula, bem como a passagem das células. Se os queratinócitos são cultivados para ≥ 80% confluência eles imediatamente parem se proliferando e começarem a diferenciar. Portanto, é importante a cultura da confluência de 40-70% durante a passagem e usá-los não mais tarde do que passagem 3-4. Fibroblastos são menos sensíveis, mas não devem ser usados mais tarde do que a passagem de 4-6. Observe também que todas as células primárias e linhagens celulares utilizadas para gerar modelos de pele de esferoide de melanoma organotypic são cultivadas livres de antibióticos, e, portanto, o risco de contaminação é alto. No entanto, a adição de antibióticos altera a fisiologia das células individuais e, portanto, reduz a qualidade do equivalentes a pele.
Em geral, a formação de tumor esferoide é possível de quase todos os tipos de linhas de células de tumor e também de células tumorais recém isoladas de material paciente. O tempo de número e/ou cultivo de célula inicial para obter tamanhos de esferoide ideal pode variar dependendo do tipo de célula usado. Até um tamanho de 150-200 µm, todas as células incluídas em um esferoide ainda podem ser fornecidas suficientemente com nutrientes através de simples difusão. Esferoides só com tamanhos ≥500 µm mostram um alto grau de diferenciação celular e representam as características típicas de tumor avasculares tecido22.
O organotypic melanoma-esferoide-pele-modelo desenvolvido aqui é particularmente adequado para estudar interações do tumor-hospedeiro e por debaixo na vivode testes de drogas de melanoma-como condições15. Ainda assim, o ambiente do melanoma na vivo é ainda mais complexo, abrigando uma variedade de tipos de células de tumor associado, incluindo as células imunes e células endoteliais. Desde que a adição de células do sistema imune primárias adequadas enfrenta problemas com histocompatibilidade, esses modelos ainda não são capazes de monitorar adequadamente abordagens terapêuticas-imune.
Não obstante, esferoides de melanoma podem ser gerados a partir de material paciente recém isolada e uma vez incluídos em reconstruir a pele cheia, pode servir como droga individual triagem plataformas. Mesmo a integração de peças de metástase de melanoma na pele reconstrói é concebível para testar combinações de drogas em uma abordagem terapêutica sob medida. Incluindo o modelo de pele-melanoma 3D organotypic em testes pré-clínicos é susceptível de ajudar a garantir que somente os mais promissores novos conceitos terapêuticos são tidos para a frente em ensaios clínicos, reduzindo assim a taxa de abandono de potenciais novos tratamentos para este doença e aumentando a taxa de sucesso terapêutico em ensaios clínicos.
Divulgações
Os autores declaram que eles têm não tem interesses financeiro concorrente.
Agradecimentos
Os autores graças a Hanna Voersmann para estabelecer o melanoma-esferoide-pele-modelo 3D organotypic e proporcionando excelentes protocolos. Os autores também agradecer Silke Busch valioso suporte técnico. O trabalho foi apoiado pelo BMBF e: programa Med 031A423A "Sensibilidade de Melanoma".
Materiais
| Name | Company | Catalog Number | Comments |
| fetal serum albumin (FCS) | Thermo Fisher Scientific | 10270106 | add 10 % to cell culture medium |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300054 | 1X dilute in PBS |
| RPMI | Thermo Fisher Scientific | 61870010 | for cultivation of melanoma cell lines |
| DMEM | Thermo Fisher Scientific | 41965062 | for cultivation of primary fibroblasts |
| Dispase | Gibco life technologies | 17105041 | 2U/ml, dissolve in PBS |
| Collagen type I | BD Biosciences | 354249 | usually from rat tail, concentration should be 3.5-4 mg/ml |
| 24-well inserts Nunclon | Nunc | 140629 | 8 µm pore size; use standing, not hanging inserts! |
| cell strainer | BD Falcon | 352360 | yellow |
| Gentamycine | Thermo Fisher Scientific | 15750060 | dissolve in PBS |
| Keralife keratincyte medium | Cell Systems | do not add FCS or antibiotics | |
| Collagenase | SERVA | 17454 | NB4 standard grade |
| juvenile human keratinocytes | Cell Systems | FC-0007 | alternative to own preparation from juvenile foreskin |
| juvenile human fibroblasts | Cell Systems | FC-0001 | alternative to own preparation from juvenile foreskin |
| DMEM [+] 4,5 g/l Glucose, [+] L- Glutamine, [-] L- Pyruvate | Gibco life technologies | 41965 | mix 1:1 with Ham´s F-12 for MM medium; mix 3:1 with Ham´s F-12 for EGM medium |
| Ham´s F-12 [+] L-Glutamine | Gibco life technologies | 21765-029 | add to DMEM for the generation of EGM and MM medium (see lane 15) |
| EGF | Gibco life technologies | 13247-051 | add 10 ng/ml only for the generation of EGM medium |
| Calcium chloride | Merck Chemicals | 2381 | add 1.9 mM for the generation of EGM and 3.8 mM for MM medium |
| Selenic acid | Alfa Aesar | 18851 | add 53 nM for the generation of EGM and MM medium |
| Insulin | Lilly | HI0219 Hum Pen 3ml 100 E.I./ml | add 5 µg/ml for the generation of EGM and MM medium |
| Ethanolamine | Sigma-Aldrich | E-0135 | add 0.1 mM for the generation of EGM and MM medium |
| P-Ethanolamine | Sigma-Aldrich | P-0503 | add 0.1 mM for the generation of EGM and MM medium |
| Holo-Transferrine | Sigma-Aldrich | T-0665 | add 5 µg/ml for the generation of EGM and MM medium |
| Triiodthyronine | Sigma-Aldrich | T-6397 | add 20 pM for the generation of EGM and MM medium |
| Hydrocortisone | Sigma-Aldrich | H-088816 | add 0.4 µg/ml for the generation of EGM and MM medium |
| Progesterone | Sigma-Aldrich | P-8783 | add 10 nM only for the generation of EGM medium |
| Hepes | Sigma-Aldrich | H-3784 | add 15 mM for the generation of EGM and MM medium |
| Serine | Sigma-Aldrich | S-4311 | add 1 mM for the generation of EGM and MM medium |
| Cholinchloride | Sigma-Aldrich | C-7017 | add 0.64 mM for the generation of EGM and MM medium |
| dFCS | Sigma-Aldrich | F-0392 Lot 086K0361 | add 2 % for the generation of EGM and MM medium |
| Adenine | Sigma-Aldrich | A-9795 | add 0.18 mM for the generation of EGM and MM medium |
| L-Glutamine | PromoCell | C-42209 | add 7.25 mM for the generation of EGM and MM medium |
| Strontiumchloride | Sigma-Aldrich | 255521 | add 1 mM for the generation of EGM and MM medium |
| anti cytokeratin 10 antibody | Dako | M7002 | 1:50 |
| anti cytokeratin 14 antibody | Santa Cruz | sc-53253 | 1:200 |
| anti laminin 5 antibody | Santa Cruz | sc-32794 | 1:50 |
| anti filaggrin antibody | Thermo Fisher Scientific | MA5-13440 | 1:50 |
| anti involucrin antibody | Acris Antibodies | AM33368PU | 1:50 |
| secondary polyclonal goat anti-mouse IgG FITC labeled | LifeSpan Biosciences | LS-C153907 | 1:50 |
| secondary polyclonal goat anti-mouse IgG Cy3 labeled | Jackson Immuno Research | 115-165-003 | 1:1000 |
| DAPI | Sigma-Aldrich | 10236276001 | 1:100 |
Referências
- Boulais, N., Misery, L. The epidermis: a sensory tissue. Eur. J. Dermatol. 18 (2), 119-127 (2008).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat.Rev. Mol. Cell Biol. 10 (3), 207-217 (2009).
- Shain, A. H., Bastian, B. C. From melanocytes to melanomas. Nat. Rev. Cancer. 16 (6), 345-358 (2016).
- Clark, W. H. Human cutaneous malignant melanoma as a model for cancer. Cancer Metastasis Rev. 10 (2), 83-88 (1991).
- Hsu, M. Y., Meier, F., Herlyn, M. Melanoma development and progression: a conspiracy between tumor and host. Differentiation. 70 (9-10), 522-536 (2002).
- Miller, A. J., Mihm, M. C. Melanoma. N. Engl. J. Med. 355 (1), 51-65 (2006).
- Balch, C. M., et al. Final version of 2009 AJCC melanoma staging and classification. J. Clin. Oncol. 27 (36), 6199-6206 (2009).
- Eigentler, T. K., Caroli, U. M., Radny, P., Garbe, C. Palliative therapy of disseminated malignant melanoma: a systematic review of 41 randomised clinical trials. Lancet Oncol. 4 (12), 748-759 (2003).
- Kim, T., Amaria, R. N., Spencer, C., Reuben, A., Cooper, Z. A., Wargo, J. A. Combining targeted therapy and immune checkpoint inhibitors in the treatment of metastatic melanoma. Cancer Biol. Med. 11 (4), 237-246 (2014).
- Lawrence, M. S., et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature. 499 (7457), 214-218 (2013).
- Flaherty, K. T., et al. Inhibition of mutated, activated BRAF in metastatic melanoma. N. Engl. J. Med. 363 (9), 809-819 (2010).
- Rauschenberg, R., Garzarolli, M., Dietrich, U., Beissert, S., Meier, F. Systemic therapy of metastatic melanoma. J. Dtsch. Dermatol. Ges. 13 (12), 1223-1235 (2015).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: the multicellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nat. Rev. Mol. Cell Biol. 8 (10), 839-845 (2007).
- Vorsmann, H., Groeber, F., Walles, H., Busch, S., Beissert, S., Walczak, H., Kulms, D. Development of a human three-dimensional organotypic skin-melanoma spheroid model for in vitro drug testing. Cell Death. Dis. 4, e719 (2013).
- Chen, C. S., Lavker, R. M., Rodeck, U., Risse, B., Jensen, P. J. Use of a serum-free epidermal culture model to show deleterious effects of epidermal growth factor on morphogenesis and differentiation. J. Invest. Dermatol. 104 (1), 107-112 (1995).
- Meier, F., et al. Human melanoma progression in skin reconstructs : biological significance of bFGF. Am. J. Pathol. 156 (1), 193-200 (2000).
- Sinnberg, T., et al. Inhibition of PI3K-AKT-mTOR signaling sensitizes melanoma cells to cisplatin and temozolomide. J. Invest. Dermatol. 29 (6), 1500-1515 (2009).
- Niessner, H., et al. The farnesyl transferase inhibitor lonafarnib inhibits mTOR signaling and enforces sorafenib-induced apoptosis in melanoma cells. J. Invest. Dermatol. 131 (2), 468-479 (2011).
- Foty, R. A. A simple hanging drop cell culture protocol for generation of 3D spheroids. J. Vis. Exp. (51), e2720 (2011).
- Hirschhaeuser, F., Menne, H., Dittfeld, C., West, J., Mueller-Klieser, W., Kunz-Schughart, L. A. Multicellular tumor spheroids: an underestimated tool is catching up again. J. Biotechnol. 148 (1), 3-15 (2010).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol. J. 3 (9-10), 1172-1184 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados