Method Article
Un modello di pelle sferoide 3D Organotypic Melanoma
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per generare un modello di pelle 3D organotipiche melanoma sferoide che ricapitola sia l'architettura e pluricellulari complessità di un organo/del tumore in vivo ma allo stesso tempo accomoda sistematica sperimentale intervento.
Abstract
Trasformazione maligna dei melanociti, le cellule del pigmento della pelle umana, provoca la formazione di melanoma, un tumore altamente aggressivo con maggiore potenziale metastatico. Recentemente, mono-chemioterapie continuano a migliorare di terapie di combinazione specifica del melanoma con gli inibitori della chinasi mirati. Melanoma metastatico rimane ancora, una malattia pericolosa per la vita perché i tumori mostrano una resistenza primaria o sviluppano la resistenza alle terapie, quindi recuperare capacità tumorigeniche. Per migliorare il successo terapeutico del melanoma maligno, la determinazione dei meccanismi molecolari che conferiscono resistenza contro gli approcci terapeutici convenzionali è necessaria; Tuttavia, esso richiede modelli innovativi cellulari in vitro . Qui, presentiamo un in vitro tridimensionale (3D) organotipiche sferoide modello melanoma che può rappresentare l'architettura in vivo del melanoma maligno e può giustificare nuove intuizioni intra-tumorali così come interazioni tumore-ospite. Il modello incorpora numeri definiti di sferoidi melanoma maturo e differenziato in un modello di ricostruzione 3D pelle umana completa che consiste delle cellule cutanee primarie. Lo stato di composizione e differenziazione cellulare di sferoidi incorporato del melanoma è simile a quello delle metastasi di melanoma cutaneo in vivo. Utilizzando questo modello di sferoide organotipiche melanoma come una piattaforma di screening di stupefacenti possono sostenere l'identificazione dei radar-risponditore a selezionato terapie di combinazione, mentre risparmia l'onere di trattamento inutile per non-responder, aumentando così il vantaggio di interventi terapeutici.
Introduzione
La pelle umana è composto da due vani distinti che svolgono funzioni differenti nella protezione del corpo dagli effetti ambientali negativi1. Il vano inferiore cutaneo è costituito da un tessuto connettivo fibro-elastico. Esso è composto da fibre di collagene ed elastina vagamente collegate sintetizzate dai fibroblasti, che serve una funzione di barriera meccanica. Il derma è separato dall'epidermide superiore da lamina basale che è prodotto come una matrice extracellulare a causa di una comunicazione costante tra entrambi i compartimenti della pelle. In contrasto con il derma, l'epidermide è un epitelio squamous che consiste principalmente di cheratinociti e possa essere differenziato in quattro strati. Strato basale è costituito da keratinocytes basali indifferenziate che costantemente derivano da cellule progenitrici pelle stratificazione attraverso le fasi del granulosum dello strato e strato spinoso in strato corneo per proteggere il corpo da infezioni e disidratazione2. I melanociti sono allineati alla membrana basale e comunicano attraverso estensioni dendritiche con keratinocytes multipli. Che producono il pigmento melanina per proteggere il tessuto della pelle dagli effetti nocivi delle radiazioni UV, come l'invecchiamento della pelle, immunosoppressione, infiammazione e induzione di tumori cutanei non-melanoma. Contributo di radiazioni UV per la trasformazione dei melanociti al melanoma maligno, tuttavia, è ancora in discussione3.
Sviluppo del melanoma è differenziato nelle fasi di progressione di differenti del tumore e caratterizzato da determinati cambiamenti genetici, morfologici ed istologici4. Essi provengono entrambi de novo o da un nevo innato o acquisito a causa di un locale aumento della proliferazione di melanociti causando neoplasia benigna. Questa lesione precursore può convertire in tessuto dysplastic strutturalmente modificato contenenti cellule atypic, che possono continuare alla prima fase maligna, la fase di crescita radiale (RGP). Questa prima fase di progressione del tumore è caratterizzata da cellule proliferano radialmente all'interno dell'epidermide, mostrando alcune cellule localmente dilagante all'interno del derma papillare. Durante il melanoma di fase (VGP) successiva crescita verticale le cellule già mostrano un fenotipo invasivo e metastatico di rottura attraverso la lamina basale di infiltrare le parti più profonde del derma, come pure il tessuto sottocutaneo5. Infine, il melanoma metastatico (MM) rappresenta la fase di progressione più aggressiva con le cellule metastatiche sistemica diffondendo in tutto il sistema di sangue e la linfa di distalmente invadere organi come fegato, polmone e cervello6.
Fin qui, la diagnosi precoce seguita da chirurgia rimane ancora la più efficace terapia del melanoma maligno. La prognosi per i pazienti con metastasi a distanza, tuttavia, rimane particolarmente poveri7, perché chemioterapici classici conferiscono solo poco sopravvivenza beneficio8,9. Tuttavia, dopo decenni di stagnazione, i recenti progressi nelle terapie mirate hanno notevolmente migliorato la prognosi del melanoma maligno.
Disregolazione delle due vie principali mitogene attivata, il RAS-RAF-MEK-ERK e le vie di segnalazione PI3K-AKT-PTEN, presentare fattori chiave della progressione del melanoma, soprattutto quando si costitutivamente attiva mutazioni puntiformi del gene BRAFV600 proto-oncogeni e Le ANR sono presenti10. Di conseguenza, l'invenzione degli inibitori della chinasi mirati promesso beneficio terapeutico per i pazienti affetti da melanoma metastatico. Un gran numero di studi clinici condotti a questo punto non ha ottenuto benefici significativi per i pazienti con melanoma metastatico. Quasi tutte le risposte sono parziali, con una sottopopolazione di pazienti che mostrano resistenza primaria. Inoltre, l'acquisizione di resistenza secondaria che porta alla ricaduta è stata osservata nella maggior parte dei pazienti11,12.
Diventa chiaro che analisi dello stato della mutazione da sola non è sufficiente a sviluppare la strategia terapeutica più potente. Nuovi strumenti diagnostici veloci e affidabili sono necessari per registrare e analizzare la capacità di risposta delle cellule tumorali singole sistematicamente. La stragrande maggioranza dei dati attualmente disponibili sul melanoma umano è stata ottenuta da colture di cellule di melanoma (2D) bidimensionali. Cellule del tumore, tuttavia, coltivate in 3D permettono intercellulare diafonia tra cancro differenziato sottopopolazioni anche tra cellule tumorali e il tessuto circostante non trasformate di host. Pertanto, sarebbe meglio ricostruire l'ambiente 3D in cui ha sviluppato il melanoma, per essere utilizzato come uno screening preclinico modello13,14.
Protocollo
Tutti i lavori di tessuto umano è stato effettuato usando protocolli istituzionali approvati.
1. separazione del derma e dell'epidermide da pelle umana (Juvenile prepuzio dalla circoncisione)
- Posizionare il prepuzio (solitamente 1-2 cm2) in una piastra di coltura cellulare sterile non adesiva (Ø 10 cm) e coprire con 10-12 mL di tampone fosfato salino+ (PBS, 0,5 mM MgCl2, 0,9 mM CaCl2, pH 7,2 = PBS+). Rimuovere tutto il tessuto in eccesso (adiposo) utilizzando pinze e bisturi sterile.
- Tagliare la pelle in pezzi di 3 x 5 mm, lavarli con PBS e trasferirli su una piastra di coltura cellulare sterile non adesiva (Ø 6 cm). Coprire i pezzi di tessuto con 5-7 mL di soluzione di dispase (2 U/mL in PBS). Piastra di coltura delle cellule con la pellicola di paraffina ed incubare per 16 h a 4 ° C.
- Ritrarre l'epidermico dalla parte cutanea con due pinze sterili. I pezzi di tessuto dissecato per piastre di coltura singola cella non adesivi (Ø 6 cm) e coperchio da ciascuno di essi con PBS+.
2. isolamento dei Keratinocytes primari dall'epidermide
- Con attenzione rimuovere il PBS+ dalla piastra di coltura cellulare, usando una pipetta di Pasteur e lavare i pezzi di tessuto epidermico (sezione 1.3) con PBS. Tagliare l'epidermide in piccoli pezzi (1 mm2) e raccoglierli in una provetta conica da 50 mL. Aggiungere 10 mL 1 x tripsina-EDTA (preriscaldato a 37 ° C) e incubare per 5 minuti in un bagno di acqua a 37 ° C. Vortice la sospensione di tessuto ogni 2 min.
- Fermare la reazione enzimatica aggiungendo 1 mL di siero fetale di vitello (FCS). Risospendere le cellule pipettando su e giù con una pipetta di plastica di 10 mL per 4 min. Try per evitare bolle e formazione di schiuma.
- Dispensare la sospensione cellulare in un colino di cella (poro dimensioni 100 µm), poste sulla parte superiore un tubo conico di fresca 50 mL e lavare 3 volte con 5 mL di PBS. Centrifugare le cellule a 200 x g per 5 min. Risospendere il pellet cellulare in 2-6 mL terreno di coltura contenente gentamicina 1% (v/v). Determinare il numero di cellulare manualmente dal conteggio cellule in un emocitometro e seme 6 x 105 celle in un matraccio di cultura cellulare T75.
3. la coltivazione dei Keratinocytes primari
- Incubare i keratinocytes primari isolato nel passaggio 2.3 in un'incubatrice di cellulare a 37 ° C e 5% di CO2 nel mezzo del keratinocyte senza FCS, al confluency di 50-70%.
- Varco i keratinocytes attentamente rimuovere il mezzo, aggiungere 5 mL di PBS-EDTA e incubare le cellule per 10 min a 37 ° C. Verifica se le cellule hanno iniziato a distaccarsi dal matraccio di cultura sotto un microscopio ottico (ingrandimento 4x: celle appariranno arrotondate ma sono ancora collegate!). In caso contrario, sostituire il vecchio PBS-EDTA con PBS-EDTA fresco e ri-Incubare per altri 10 min a 37 ° C.
- Aggiungere 5 mL 1 x tripsina-EDTA alle cellule arrotondate ancora coperto con 10 mL di PBS-EDTA e ri-li Incubare per 1-3 min a 37 ° C. Fermare la reazione enzimatica aggiungendo 1 mL di FCS e raccogliere le cellule indipendenti in una provetta conica da 50 mL. Centrifugare le cellule a 200 x g per 5 min, risospendere il pellet in mezzo del keratinocyte e seme 6 x 105 cellule in un matraccio di cultura cellulare T75 fresco.
Nota: Per generare organotipiche pelle ricostruisce, i keratinocytes primari deve essere utilizzati entro e non oltre 3-4 del passaggio.
4. isolamento dei fibroblasti primari dal derma
- Tagliare il tessuto cutaneo (sezione 1.3) in piccoli pezzi (1 mm2) e trasferirli in una provetta conica da 50 mL. Aggiungere 10 mL soluzione della collagenosi (5 U/mL in PBS+) e incubare per 45 min in un bagno di acqua a 37 ° C. Centrifugare la miscela di pezzi di tessuto e cellule a 200 x g per 5 min.
- Lavare il pellet cellulare due volte con 10ml DMEM contenente 4,5 g/L glucosio e L-Glutammina, ma senza L-piruvato. Infine Risospendere i pezzi di tessuto in 2 mL di DMEM contenente gentamicina 1% (v/v) e 10% FCS. Trasferirli in un matraccio di cultura cellulare T25 e incubare li in un'incubatrice di cellulare a 37 ° C e 5% CO2 per una notte.
Nota: Il piccolo volume permette i fibroblasti migrare fuori i detriti del tessuto e li costringe a fissare nel matraccio di cultura. - La mattina successiva, aggiungere un altro 6 mL DMEM/gentamicina/FCS e incubare per 2-3 giorni a 37 ° C fino a quando le cellule hanno raggiunto confluency di 80-90%.
5. coltura di fibroblasti primari
- Passaggio i fibroblasti, rimuovere il mezzo e lavare le cellule aderenti con PBS. Aggiungere 5 mL 1 x tripsina-EDTA e incubare per 3 min a 37 ° C.
- Fermare la reazione enzimatica aggiungendo 5 mL DMEM/FCS e raccogliere le cellule indipendenti in una provetta conica da 50 mL. Centrifugare le cellule a 200 x g per 5 min, risospendere il pellet in mezzo DMEM e 6 x 105 celle di semi in un matraccio di cultura cellulare T75 fresco.
Nota: Per generare organotipiche pelle ricostruisce, i fibroblasti primari devono essere utilizzati entro e non oltre il passaggio 4-6.
6. generazione di Melanoma 3D sferoidi tramite il metodo di goccia di sospensione
- Cellule del melanoma cultura (ad es., 451-LU o qualsiasi linea cellulare di melanoma di interesse) secondo protocolli generali, utilizzando RPMI contenente 10% FCS15.
- Per generare sferoidi di melanoma di dimensioni e qualità simili, lavare le cellule del melanoma in PBS, aggiungere 5 mL di 1x tripsina-EDTA in PBS per le cellule in un T175 cellulare cultura pallone e incubare per 3-5 min a temperatura ambiente (TA). Neutralizzare la tripsina aggiungendo 5 mL RPMI/10% FCS. Raccolto che le cellule mediante centrifugazione a 200 x g per 5 min. Risospendere il pellet cellulare in RPMI/FCS ad una concentrazione finale di 10.000 cellule/mL come determinata contando in un emocitometro.
- Spot: 40 x 25 µ l (= 250 cellule) della sospensione delle cellule sulla superficie interna del coperchio di una piastra di coltura sterile non adesiva cella (Ø 10 cm) usando una multi pipetta elettronica. Con un movimento veloce ma liscio, girare il coperchio e metterlo sulla piastra di coltura rispettiva cella contenente 5 mL di PBS.
- Cultura "hanging goccia piatti" in un'incubatrice di cellulare a 37 ° C e 5% CO2 per 10-14 giorni, a seconda del tipo di cella utilizzato.
Nota: Cellule dalla fase di crescita di MM in genere crescono più velocemente e formano sferoidi più solide nella goccia d'attaccatura rispetto alle cellule di melanoma derivate dal RGP o da VGP. Per la valutazione individuale, osservare la crescita di sferoide sotto un paio di binocoli o sotto un microscopio ottico (ingrandimento 4x). Di solito, sferoidi diventano rilevabile dopo 48 h sotto un paio di binocoli o sotto un microscopio ottico (ingrandimento 4x). Dopo 10-14 giorni, sono visibili senza alcun dispositivo di ingrandimento.
- Cultura "hanging goccia piatti" in un'incubatrice di cellulare a 37 ° C e 5% CO2 per 10-14 giorni, a seconda del tipo di cella utilizzato.
- 5 giorni dopo la prima discesa spotting, aggiungere 10 µ l di terreno nuovo FCS RPMI/10% ad ogni goccia. Successivamente, cambio 10 µ l di terreno ogni altro giorno. L'utilizzo di un dispenser elettronico è molto utile in questo passaggio.
- A seconda del tipo di cellula, vendemmia sferoidi (vedere sezione 10 per i dettagli) dopo 10-15 giorni risciacquandole delicatamente il coperchio piatto di cultura cellulare con PBS. Raccoglierli in una piastra di coltura di cellule fresche non adesivo.
Nota: Il periodo di coltivazione dipende la fase di crescita del tumore delle cellule del melanoma quando sono stati inizialmente derivati, per esempio, sferoidi derivati dalle cellule di 451-LU crescono a circa 500 µm di diametro entro i 12 giorni di coltura nella goccia d'attaccatura15 .
7. generazione del compartimento dermico della pelle Organotypic Full ricostruisce
- Generazione di modelli di pelle utilizzando 24 pozzetti cella microporosa membrana inserti (grandezza del poro 8 µm) collocati in piastre da 24 pozzetti.
Nota: Assicurarsi di non utilizzare appeso ma in piedi inserti, perché essi saranno inseriti in una piastra a 6 pozzetti per la coltivazione del aria-liquido in una fase successiva. - Preparare la soluzione (GNL) di neutralizzazione gel15, così come i terreni di coltura indicato come MM e crescita endoteliale media (EGM)16,17. Per evitare la coagulazione, archivio il collagene tipo I (solitamente dalla coda di topo, 3,5-4 mg/mL in 0.02 N di acido acetico) su ghiaccio fino all'utilizzo, perché comincia a gel a TA.
- Risospendere 1x105 fibroblasti per inserto in GNL e mescolare rapidamente la sospensione cellulare con collagene ad un rapporto di 1:3 in un volume finale di 500 µ l/insert. Ricostruire mix pipettando delicatamente su e giù per evitare la formazione di bolle come bolle possono compromettere la qualità della pelle.
- Consentire i singoli gel dermici a stabilirsi tenendole senza mezzo al RT per 30 min in una cappa sterile. Successivamente coprire ogni gel con DMEM contenente glucosio di 4,5 g/L, 1% L-Glutammina, 10% FCS e senza L-piruvato e incubare per una notte a 37 ° C.
8. generazione del compartimento epidermico della pelle Organotypic Full ricostruisce
- Il giorno successivo rimuovere il mezzo dai gel dermici ed equilibrare loro con mezzi di EGM (10% FCS, 1% PenStrep, gentamicina 10 mg/mL) per 2 ore a 37 ° C. Ritirare il mezzo e attentamente seme 1 x 105 keratinocytes risospesi in 100 µ l EGM sulla superficie del gel dermico.
- Incubare la ricostruisce per 1,5 h a 37 ° C per consentire i keratinocytes di aderire al compartimento dermico.
Nota: Durante questo periodo di incubazione, i gel inizierà a ridursi a causa della contrazione del fibroblasto-indotta e così, almeno in parte staccare dalle pareti inserto. - Coprire gli equivalenti di pelle con circa 800 µ l EGM e rimuovere delicatamente il gel residuo dalla parete inserto con una piccola pipetta (bianco). Gli equivalenti di pelle immersi in EGM per 7 giorni in un'incubatrice di cellulare a 37 ° C, 5% CO2, della cultura e cambiare il mezzo ogni altro giorno.
Nota: Durante questo periodo gli equivalenti di pelle si ridurranno in modo significativo.
9. aria-liquido coltura Organotypic Full pelle ricostruisce
- Al giorno 8, trasferimento ogni inserire in un singolo pozzetto di una piastra a 6 pozzetti. Aggiungere solo 1.2-1.4 mL di mezzo MM in ciascun pozzetto, in modo che ricostruire la pelle viene fornito con supporto dal fondo del pozzo ma non è coperto con il mezzo.
Nota: Coltivazione all'interfaccia aria-liquido permette di stratificazione della parte epidermica e istituzione di un intero strato cornified (strato corneo). - Durante i prossimi giorni 10-17, cambiare il mezzo come indicato nella sezione 9,1 ogni altro giorno. Durante questo periodo, aggiungere farmaci o altri stimoli come necessario per il mezzo. Rimuovere con cautela il Ricostruisci pelle completo dall'inserto di membrana microporosa con Pinzette curve per ulteriore analisi, per esempio, l'analisi di immunohistochemical (Figura 1).
10. generazione dei modelli della pelle Organotypic Melanoma sferoide
- Per integrare le sferoidi di melanoma in comparto dermico dell'organotipiche completo pelle ricostruisce, risciacquare accuratamente le sferoidi (dopo passo 6.4) il coperchio dell'impiccagione piastra di coltura cellulare di goccia con PBS. Raccogliere 10-20 sferoidi/inserto in una piastra di coltura sterile non adesiva cellulare. Rimuovere con cautela eccessiva PBS con una pipetta Pasteur.
- Aspirare le sferoidi nel più piccolo possibile di volume di EGM. A questo punto osservare e contare le sferoidi con l'occhio nudo, senza qualsiasi ulteriore dispositivo di ingrandimento. Prendere 10-20 sferoidi a pelle modello/gel, come indicato al punto 10.1.
- Trasferirli al volume desiderato di GNL che contiene fibroblasti (fase 7.3) e mescolare con il collagene di tipo I. A partire da questo punto procedere come descritto nelle sezioni 7.3-9.1.
Nota: Sferoidi tumore diventano visibili nel gel cutanei come macchie bianche (Figura 2)
Risultati
Riuscito trattamento delle metastasi di melanoma può essere influenzato dal cross-talk tra le cellule del tumore come pure tra tumore e cellule non trasformate. Lo scopo di sviluppare modelli organotipiche del cancro in vitro è quello di fornire sistemi di test preclinici adatto che ricapitolano l'organizzazione 3D e la complessità del melanoma umano in vivo. Questo consente lo studio dell'impatto terapeutico sul tumore all'interno di un ambiente organotipiche e gli effetti negativi sul tessuto circostante primario in parallelo.
Per sviluppare i migliori modelli di pelle organotipiche, la qualità delle cellule primarie è fondamentale. È vantaggioso utilizzare giovanile primari fibroblasti e cheratinociti, perché in genere sono meno differenziati rispetto alle cellule epiteliali adulte primario. Giovanile della pelle cellule possono sia essere isolato da prepuzio giovanile come descritto nelle sezioni protocollo 1-5, ma può anche essere acquistati da aziende come pre-Natale primarie fibroblasti e cheratinociti. In caso di acquisto, è necessario alle cellule di ordine da donatori diversi per evitare risultati di donatore-specific, per esempio, per la sensibilità ai farmaci. L'intero protocollo viene visualizzata come uno schema in Figura 3.
Controllo di qualità di 3D full-pelle equivalenti richiede l'analisi di immunohistochemical. Una prima impressione può essere ottenuta da ematossilina-eosina (H & E) colorazione di paraffina incorporato sezioni (3 µm). Analisi dettagliata della qualità della differenziazione epidermica e formazione della lamina basale tra derma ed epidermide richiede l'analisi di immunohistochemical usando gli anticorpi specifici contro un marcatore di stratificazione epidermica. Questo consente di distinguere tra cellule indifferenziate, altamente proliferative situato vicino la membrana basale e altamente differenziato e cheratinizzato cellule dello strato corneo attraverso la formazione di strati epidermici distinti tra . Come mostrato dalla macchiatura istologici immunitario (Figura 4), differenziazione dei cheratinociti durante l'epidermide potrebbe essere realizzata simile a pelle normale: principalmente le cellule indifferenziate dagli strati epidermici inferiori (stratum- basale e spinosum dello strato) macchia positivo per la cheratina 14, mentre le cellule più differenziate dagli strati supra-basale (granulosum dello strato e strato corneo) macchiato positivo per la cheratina 10 e involucrin. Di conseguenza, filaggrin colorazione potrebbe essere osservato solo in cellule altamente differenziate dello strato corneo. La cosa più importante, laminina 5 colorazione rivela che una lamina basale è stata generata per connetterti fisiologicamente epidermico al compartimento dermico di ricostruire la pelle artificiale. Questo dimostra che è stato generato un microambiente organotipiche comunicante per le cellule del melanoma di host o sferoidi per analisi fisiologico e patofisiologico.
Ai fini della selezione della droga del melanoma, cellule del melanoma singolo possono essere integrate anche nel derma di equivalenti di pelle completo per consentire de novo del melanoma nido formazione18,19. Pertanto, le cellule del melanoma sono combinate con i fibroblasti primari ad un rapporto di 5:1, centrifugato insieme a 200 x g per 5 min e risospesi in GNL prima della miscelazione con il collagene. Di conseguenza, i nidi delle cellule del melanoma si formeranno spontaneamente nel compartimento dermico. Secondo la nostra esperienza, solo le celle della crescita metastatica fase nidi corretta forma, rispetto alle cellule del melanoma del RGP o VGP15. Uno svantaggio principale di questi tipi di modelli è il fatto che il numero e le dimensioni dei nidi del melanoma formata non può essere previsto e possono variare tra individuale della pelle ricostruisce, indipendentemente da qualsiasi trattamento. Ad esempio, 1.000 cellule seminate nel compartimento dermico possono guadagnare 10 nidi che consiste di 100 celle o 100 nidi che consiste di 10 celle ciascuna (Figura 5). Queste variabili biologiche presenti con tre carenze: in primo luogo, il numero e le dimensioni dei nidi del melanoma formata sono imprevedibili; in secondo luogo, la metastasi in vivo sono solitamente più grandi di nidi di melanoma e presentano una più complessa diversità intra-tumorali; e in terzo luogo, a causa della durata limitata dei modelli di tumore-nido, trattamento è iniziata presto e di conseguenza piuttosto inibisce escrescenza tumore invece di causare la regressione dei nidi di tumore esistenti.
Per superare questi limitazioni organotipiche melanoma sferoide pelle modelli può essere generato. Dal melanoma metastatico 250 coltura le cellule in una sospensione goccia per 14 giorni20, sferoidi riproducibile generati composto da vitali del melanoma cellule che presentano una struttura compatta con un diametro finale di circa 500 µm che imita non vascolarizzate tumore nodi, micro metastasi, o Inter-capillare micro regioni di tumori solidi21,22. In generale, qualsiasi linea cellulare di melanoma è adatto per la generazione di sferoidi tramite l'impiccagione drop metodo; Tuttavia, le cellule derivate da tumore metastatico fasi forma più avanzata sferoidi più solide rispetto alle linee cellulari derivate dalle prime fasi di progressione, ad esempio, la RGP.
Per alcune cellule, è vantaggioso per la formazione della sferoide adeguato migliorare la viscosità dell'impiccagione goccia di coltura. Ciò può essere ottenuto mediante l'aggiunta di 10-50% metil-cellulosa al terreno di coltura. Per la soluzione madre di metil-cellulosa, autoclave 1,2 g metil-cellulosa insieme un ancoretta magnetica in un flacone di vetro da 100 mL. Aggiungere 100 mL di terreno preriscaldato (60 ° C) e agitare per 20 min a temperatura ambiente e un altro 1-2 h a 4 ° C. Centrifugare la soluzione di riserva per 2 h a 5.000 x g e conservare il supernatante viscoso a 4 ° C fino all'utilizzo.
Corretta convalida di modelli di pelle completo del melanoma sferoide è fornito dal fatto che un numero definito di melanoma sferoidi può - almeno statisticamente - essere integrate nel fibroblasto/collagene dermico di ponteggio al giorno 1 della costruzione del modello di pelle, permettendo loro di Co-sviluppare durante il differenziamento epidermico per 25-27 giorni. La resa di sferoidi possa essere analizzata direttamente dopo la semina, poiché sferoidi appaiono come macchie bianche all'interno il trasparente dermici gel e possono essere visto senza alcun dispositivo di ingrandimento (Figura 2). Di conseguenza, un modello 3D della pelle viene generato che sferoidi maturo melanoma porti, che erano state coltivate in vitro per un totale di circa 42 giorni, mostrando il massimo livello di intra-tumorali delle cellule differenziazione15.
H & E colorazione del modello della pelle melanoma sferoide rivela l'aspetto istologico e la distribuzione cellulare di sferoidi melanoma sia molto simile a quella del melanoma umano non-vascularized pelle metastasi in vivo15 (Figura 6 ). Due sottopopolazioni di cellule del melanoma sono chiaramente distinguibili in queste condizioni: una sottopopolazione proliferanti periferica e una sottopopolazione centrale costituito prevalentemente da rattrappito, apoptotico o cellule necrotiche, formando il cosiddetto "necrotico" centro. Immunohistochemically, vivere e proliferare sottopopolazioni possono essere rilevati usando gli anticorpi contro il marker di proliferazione KI-67, considerando che le cellule del centro necrotico possono essere visualizzate da TUNEL-macchiatura15. Questa particolare distribuzione delle sottopopolazioni delle cellule del tumore è garantita dalle dimensioni della sferoide (≥ 500 µm), derivando da una mancanza di sostanze nutritive e ossigeno nella parte centrale, dove si accumulano rifiuti catabolici. Seguendo il protocollo fornito qui permetterà la generazione di un affidabile e riproducibile organotipiche modello umano della pelle di pieno-spessore con incorporato sferoidi di melanoma umano che imitano la metastasi di melanoma umano della pelle. Applicazioni di questo modello includono droga test, screening delle tossine, influenzano di composti cosmetici o terapia sulla escrescenza del melanoma e il trattamento del laser.
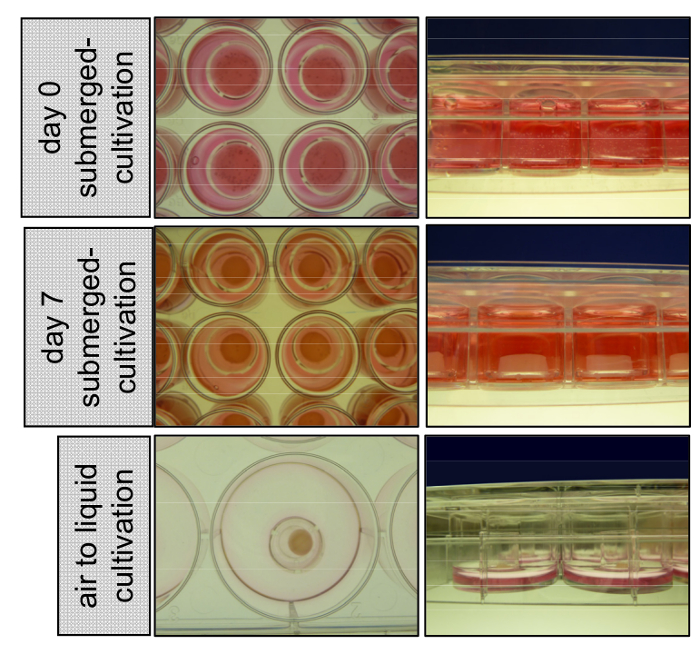
Figura 1 : Coltivazione di 3D organotipiche pelle ricostruisce sommerse con medio e all'interfaccia aria-liquido. Al giorno 0 keratinocytes primari sono seminati in cima il compartimento dermico costituito da fibroblasti primari incorporato in un collagene di tipo I matrix. Pelle 3D ricostruisce soggiorno coltivate sommersa con EGM per 7 giorni, staccano dalla parete inserto e avviare restringimento. Al giorno 8 gli inserti sono trasferiti a 6-pozzetti e coltivati all'interfaccia aria-liquido per consentire la stratificazione epidermica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Sferoidi melanoma incorporati nel compartimento dermico appaiono come macchie bianche. Mentre prepara il vano dermico di ricostruire la pelle 3D, un numero definito di sferoidi del melanoma possa essere aggiunti per il tipo di collagene fibroblasto che mescolo. Una volta che si è stabilito il gel dermico, sferoidi melanoma diventano visibili come macchie bianche.
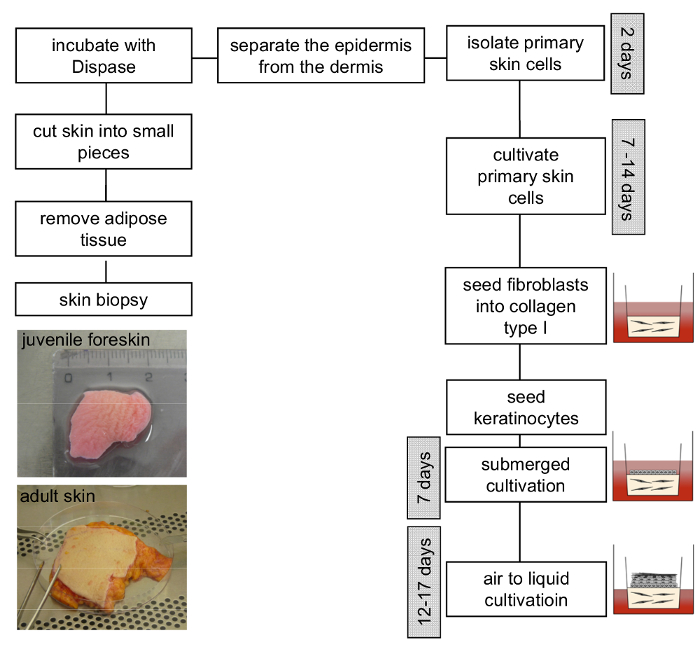
Figura 3 : Schema di costruzione di modello 3D organotipiche pelle. Rimuovere il tessuto adiposo da campione della pelle e tagliatelo a pezzi più piccoli. Incubazione con la soluzione di dispase durante la notte a 4 ° C facilita la separazione dell'epidermide dal derma. Cheratinociti e fibroblasti primari isolati devono essere coltivata separatamente e utilizzato tra passaggio 4-6 e 3-4, rispettivamente. Successivamente, la generazione del modello 3D della pelle può procedere come descritto nel protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
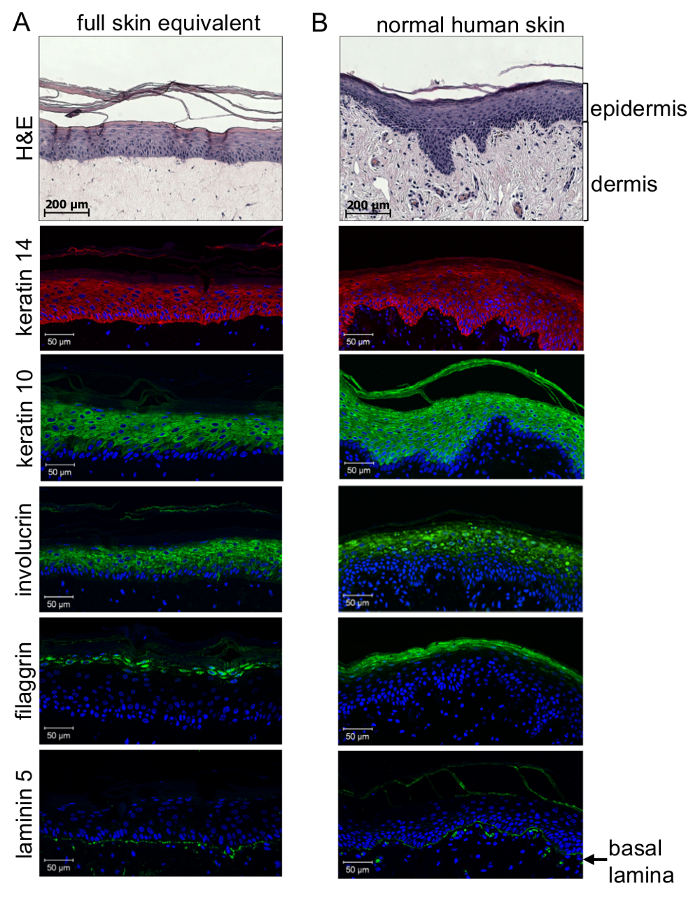
Figura 4 : 3D organotipiche pelle ricostruisce mostrano un livello di differenziazione simile a pelle umana normale. Sezioni di equivalenti di pelle di paraffina (A) rispetto al normale pelle umana (B) sono state macchiate per l'espressione delle cheratine 14 (rosso: λex 554 nm; λem 568 nm) e 10, involucrina (verde: λex 490 nm; λem 525 nm ), filaggrin (verde: λex 490 nm; λem 525 nm) e laminina 5 (verde: λex 490 nm; λem 525 nm) e analizzati con un microscopio a fluorescenza confocale. Nuclei delle cellule sono stati visualizzati tramite colorazione DAPI (blu: λex 340 nm; λem 488 nm). Esame di Immunohistochemical di 3D pieno-spessore di pelle equivalenti rivelata corretta stratificazione epidermico formando strati distinti dell'epidermide, come visto in pelle umana normale. Mentre le cellule dagli strati epidermici inferiori hanno macchiato il positive per la cheratina 14, cellule più differenziate dallo strato basale supra ha mostrato cheratina 10 e involucrin macchiatura. Le cellule altamente differenziate nei pressi dello strato corneo espresso filaggrin. Laminina 5 colorazione viene illustrato che una lamina basale viene generata per connetterti fisiologicamente epidermico al compartimento dermico (minima pannello). Questa figura è stata scattata da Voersmann et al. 15 con permesso. Clicca qui per visualizzare una versione più grande di questa figura.
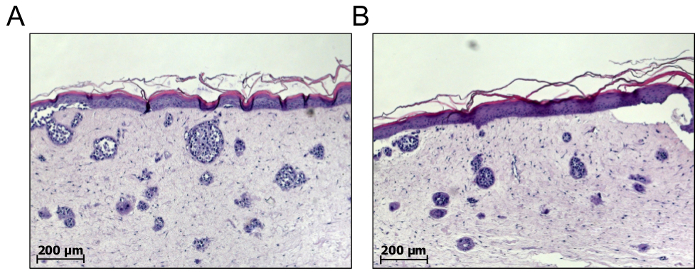
Figura 5 : Non può essere previsto il numero e le dimensioni dei nidi del melanoma spontaneamente formato. Formazione di nido del melanoma de novo nel compartimento dermico della pelle completa equivalenti possono essere realizzati mescolando un numero definito di melanoma cellule con fibroblasti primari per incorporare entrambi i tipi cellulari in collagene di tipo matrice. Il numero e le dimensioni dei nidi spontaneamente formate il melanoma può essere analizzati solo da una pelle matura 3D ricostruire dopo circa 21 giorni. Come raffigurato da due campioni (A) e (B), i numeri e le dimensioni dei nidi del melanoma possono variare tra ricostruisce individuale della pelle. Di conseguenza, è difficile per convalidare questi modelli e per prevedere l'impatto terapeutico. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 : Sferoidi melanoma integrati in equivalenti di pelle ricapitolano le caratteristiche principali di metastasi di melanoma cutaneo umano. H & E sezioni di paraffina del tumore sferoidi incorporati in equivalenti di pelle colorate ha rivelato sferoidi di condividere le funzionalità chiave con metastasi non-vascularized melanoma cutaneo umano in vivo. Due sottopopolazioni di cellule sono chiaramente distinguibili: una sottopopolazione vivente periferico e centrale sottopopolazione costituito prevalentemente da rattrappito, apoptotico o cellule necrotiche, che formano il centro "necrotico". Questa distribuzione delle sottopopolazioni delle cellule del tumore è garantita dalle dimensioni della sferoide. Questa figura è stata modificata da Voersmann et al. 15 con permesso. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il modello di pelle organotipiche melanoma sferoide introdotto qui garantisce nuove comprensioni per una più profonda comprensione di intra-tumorali e interazione tumore-ospite e può fornire una piattaforma di screening avanzato per lo studio dei meccanismi molecolari dello sviluppo del tumore e resistenza di terapia in futuro.
Per garantire il meglio fisiologica e in vivo che imita le condizioni della pelle ricostruisce, la qualità delle cellule primarie è della massima importanza. Come detto sopra, le cellule della pelle giovanile o pre-Natale mostrano il più basso grado di differenziazione e sono quindi adatte generare equivalenti di pelle di pieno-spessore. Il primo controllo di qualità possibile è l'entità della contrazione cutanea al giorno 2 dopo la semina i keratinocytes ed equilibrare il gel a EGM (sezioni protocollo 8.2 e 8.3). Gel dermico si ridurrà al massimo con la migliore qualità dei fibroblasti. Inoltre, l'integrazione dei fibroblasti troppi o troppo pochi può compromettere contrazione cutanea e conseguenza l'attaccamento di epidermico al compartimento dermico. Questo, a sua volta compromette differenziazione epidermica, perché questo processo richiede un'ampio cross-talk tra cellule epidermiche e dermico.
La qualità di cellule primarie dipende anche criticamente la confluenza delle cellule così come il passaggio delle cellule. Se cheratinociti sono cresciuti a confluency di ≥ 80% hanno immediatamente smettere di proliferazione e iniziare a differenziare. Pertanto è importante per loro cultura al confluency di 40-70% durante il passaggio e utilizzarli non oltre il passaggio 3-4. Fibroblasti sono meno sensibili ma non devono essere usati più tardi del passaggio 4-6. Siete pregati di notare che tutte le cellule primarie e linee cellulari utilizzate per generare organotipiche melanoma sferoide pelle modelli sono coltivate gratuita di antibiotici, e pertanto il rischio di contaminazione è elevato. Tuttavia, l'aggiunta di antibiotici cambia la fisiologia delle singole celle e quindi riduce la qualità degli equivalenti della pelle.
In generale, la formazione della sferoide di tumore è possibile da quasi tutti i tipi di linee cellulari del tumore e anche dalle cellule del tumore appena isolate da materiale paziente. Il tempo di numero e/o coltivazione iniziale delle cellule per ottenere dimensioni di sferoide ottimale può variare a seconda del tipo di cella utilizzato. Fino a una dimensione di 150-200 µm, tutte le celle incluse in uno sferoide sufficientemente ancora possono essere fornite con sostanze nutritive tramite diffusione semplice. Solo sferoidi con dimensioni ≥ 500 µm mostrano un alto grado di differenziazione cellulare e rappresentano le caratteristiche tipiche del tumore non-vascularized del tessuto22.
L'organotipiche melanoma-sferoide-pelle-modello sviluppato qui è particolarmente adatto per studiare le interazioni tumore-ospite e per droga del melanoma test sotto in vivo-come condizioni15. Ancora, l'ambiente del melanoma in vivo è ancora più complesso, che ospitano una varietà di tipi di cellule del tumore è associato, tra cui le cellule immunitarie e le cellule endoteliali. Poiché l'aggiunta di cellule immunitarie primarie corrette deve affrontare problemi con istocompatibilità, questi modelli non sono ancora in grado di monitorare adeguatamente approcci terapeutici immunitario.
Tuttavia, sferoidi del melanoma possono essere generati da materiale paziente appena isolato e una volta inclusi nel ricostruire pelle completa, può servire come singolo farmaco screening piattaforme. Anche l'integrazione di pezzi delle metastasi di melanoma in pelle ricostruisce è concepibile per testare combinazioni di farmaci in un approccio terapeutico personalizzato. Nonché un modello 3D del melanoma della pelle organotipiche nei test preclinici è in grado di contribuire a garantire che solo i più promettenti nuovi concetti terapeutici sono presi avanti in sperimentazione clinica, riducendo così il tasso di abbandono di potenziali nuovi trattamenti per questo malattia e aumentare il tasso di successo terapeutico negli studi clinici.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
Gli autori ringraziano Hanna Voersmann per stabilire il melanoma-sferoide-pelle-modello 3D organotipiche e fornendo protocolli eccellente. Gli autori ringraziano anche Silke Busch per il prezioso supporto tecnico. Il lavoro è stato supportato da BMBF e: programma Med 031A423A "Melanoma sensibilità".
Materiali
| Name | Company | Catalog Number | Comments |
| fetal serum albumin (FCS) | Thermo Fisher Scientific | 10270106 | add 10 % to cell culture medium |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300054 | 1X dilute in PBS |
| RPMI | Thermo Fisher Scientific | 61870010 | for cultivation of melanoma cell lines |
| DMEM | Thermo Fisher Scientific | 41965062 | for cultivation of primary fibroblasts |
| Dispase | Gibco life technologies | 17105041 | 2U/ml, dissolve in PBS |
| Collagen type I | BD Biosciences | 354249 | usually from rat tail, concentration should be 3.5-4 mg/ml |
| 24-well inserts Nunclon | Nunc | 140629 | 8 µm pore size; use standing, not hanging inserts! |
| cell strainer | BD Falcon | 352360 | yellow |
| Gentamycine | Thermo Fisher Scientific | 15750060 | dissolve in PBS |
| Keralife keratincyte medium | Cell Systems | do not add FCS or antibiotics | |
| Collagenase | SERVA | 17454 | NB4 standard grade |
| juvenile human keratinocytes | Cell Systems | FC-0007 | alternative to own preparation from juvenile foreskin |
| juvenile human fibroblasts | Cell Systems | FC-0001 | alternative to own preparation from juvenile foreskin |
| DMEM [+] 4,5 g/l Glucose, [+] L- Glutamine, [-] L- Pyruvate | Gibco life technologies | 41965 | mix 1:1 with Ham´s F-12 for MM medium; mix 3:1 with Ham´s F-12 for EGM medium |
| Ham´s F-12 [+] L-Glutamine | Gibco life technologies | 21765-029 | add to DMEM for the generation of EGM and MM medium (see lane 15) |
| EGF | Gibco life technologies | 13247-051 | add 10 ng/ml only for the generation of EGM medium |
| Calcium chloride | Merck Chemicals | 2381 | add 1.9 mM for the generation of EGM and 3.8 mM for MM medium |
| Selenic acid | Alfa Aesar | 18851 | add 53 nM for the generation of EGM and MM medium |
| Insulin | Lilly | HI0219 Hum Pen 3ml 100 E.I./ml | add 5 µg/ml for the generation of EGM and MM medium |
| Ethanolamine | Sigma-Aldrich | E-0135 | add 0.1 mM for the generation of EGM and MM medium |
| P-Ethanolamine | Sigma-Aldrich | P-0503 | add 0.1 mM for the generation of EGM and MM medium |
| Holo-Transferrine | Sigma-Aldrich | T-0665 | add 5 µg/ml for the generation of EGM and MM medium |
| Triiodthyronine | Sigma-Aldrich | T-6397 | add 20 pM for the generation of EGM and MM medium |
| Hydrocortisone | Sigma-Aldrich | H-088816 | add 0.4 µg/ml for the generation of EGM and MM medium |
| Progesterone | Sigma-Aldrich | P-8783 | add 10 nM only for the generation of EGM medium |
| Hepes | Sigma-Aldrich | H-3784 | add 15 mM for the generation of EGM and MM medium |
| Serine | Sigma-Aldrich | S-4311 | add 1 mM for the generation of EGM and MM medium |
| Cholinchloride | Sigma-Aldrich | C-7017 | add 0.64 mM for the generation of EGM and MM medium |
| dFCS | Sigma-Aldrich | F-0392 Lot 086K0361 | add 2 % for the generation of EGM and MM medium |
| Adenine | Sigma-Aldrich | A-9795 | add 0.18 mM for the generation of EGM and MM medium |
| L-Glutamine | PromoCell | C-42209 | add 7.25 mM for the generation of EGM and MM medium |
| Strontiumchloride | Sigma-Aldrich | 255521 | add 1 mM for the generation of EGM and MM medium |
| anti cytokeratin 10 antibody | Dako | M7002 | 1:50 |
| anti cytokeratin 14 antibody | Santa Cruz | sc-53253 | 1:200 |
| anti laminin 5 antibody | Santa Cruz | sc-32794 | 1:50 |
| anti filaggrin antibody | Thermo Fisher Scientific | MA5-13440 | 1:50 |
| anti involucrin antibody | Acris Antibodies | AM33368PU | 1:50 |
| secondary polyclonal goat anti-mouse IgG FITC labeled | LifeSpan Biosciences | LS-C153907 | 1:50 |
| secondary polyclonal goat anti-mouse IgG Cy3 labeled | Jackson Immuno Research | 115-165-003 | 1:1000 |
| DAPI | Sigma-Aldrich | 10236276001 | 1:100 |
Riferimenti
- Boulais, N., Misery, L. The epidermis: a sensory tissue. Eur. J. Dermatol. 18 (2), 119-127 (2008).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat.Rev. Mol. Cell Biol. 10 (3), 207-217 (2009).
- Shain, A. H., Bastian, B. C. From melanocytes to melanomas. Nat. Rev. Cancer. 16 (6), 345-358 (2016).
- Clark, W. H. Human cutaneous malignant melanoma as a model for cancer. Cancer Metastasis Rev. 10 (2), 83-88 (1991).
- Hsu, M. Y., Meier, F., Herlyn, M. Melanoma development and progression: a conspiracy between tumor and host. Differentiation. 70 (9-10), 522-536 (2002).
- Miller, A. J., Mihm, M. C. Melanoma. N. Engl. J. Med. 355 (1), 51-65 (2006).
- Balch, C. M., et al. Final version of 2009 AJCC melanoma staging and classification. J. Clin. Oncol. 27 (36), 6199-6206 (2009).
- Eigentler, T. K., Caroli, U. M., Radny, P., Garbe, C. Palliative therapy of disseminated malignant melanoma: a systematic review of 41 randomised clinical trials. Lancet Oncol. 4 (12), 748-759 (2003).
- Kim, T., Amaria, R. N., Spencer, C., Reuben, A., Cooper, Z. A., Wargo, J. A. Combining targeted therapy and immune checkpoint inhibitors in the treatment of metastatic melanoma. Cancer Biol. Med. 11 (4), 237-246 (2014).
- Lawrence, M. S., et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature. 499 (7457), 214-218 (2013).
- Flaherty, K. T., et al. Inhibition of mutated, activated BRAF in metastatic melanoma. N. Engl. J. Med. 363 (9), 809-819 (2010).
- Rauschenberg, R., Garzarolli, M., Dietrich, U., Beissert, S., Meier, F. Systemic therapy of metastatic melanoma. J. Dtsch. Dermatol. Ges. 13 (12), 1223-1235 (2015).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: the multicellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nat. Rev. Mol. Cell Biol. 8 (10), 839-845 (2007).
- Vorsmann, H., Groeber, F., Walles, H., Busch, S., Beissert, S., Walczak, H., Kulms, D. Development of a human three-dimensional organotypic skin-melanoma spheroid model for in vitro drug testing. Cell Death. Dis. 4, e719 (2013).
- Chen, C. S., Lavker, R. M., Rodeck, U., Risse, B., Jensen, P. J. Use of a serum-free epidermal culture model to show deleterious effects of epidermal growth factor on morphogenesis and differentiation. J. Invest. Dermatol. 104 (1), 107-112 (1995).
- Meier, F., et al. Human melanoma progression in skin reconstructs : biological significance of bFGF. Am. J. Pathol. 156 (1), 193-200 (2000).
- Sinnberg, T., et al. Inhibition of PI3K-AKT-mTOR signaling sensitizes melanoma cells to cisplatin and temozolomide. J. Invest. Dermatol. 29 (6), 1500-1515 (2009).
- Niessner, H., et al. The farnesyl transferase inhibitor lonafarnib inhibits mTOR signaling and enforces sorafenib-induced apoptosis in melanoma cells. J. Invest. Dermatol. 131 (2), 468-479 (2011).
- Foty, R. A. A simple hanging drop cell culture protocol for generation of 3D spheroids. J. Vis. Exp. (51), e2720 (2011).
- Hirschhaeuser, F., Menne, H., Dittfeld, C., West, J., Mueller-Klieser, W., Kunz-Schughart, L. A. Multicellular tumor spheroids: an underestimated tool is catching up again. J. Biotechnol. 148 (1), 3-15 (2010).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol. J. 3 (9-10), 1172-1184 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon