Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
A Whole Body Dosimetrie Protocol for Peptide-Receptor Radionuclide Therapy (PRRT): 2D Planar Image and Hybrid 2D+3D SPECT/CT Image Methods
In diesem Artikel
Zusammenfassung
Diese Methode schätzt die absorbierte Dosis verschiedener Strukturen für die Peptid-Rezeptor-Radionuklid-Therapie (PRRT) mit der Möglichkeit, Organüberlappungen bei 2D-Projektionen zu vermeiden. Serielle ganzkörperplanare Bilder ermöglichen die Abschätzung der mittleren absorbierten Dosen entlang des ganzen Körpers, während der hybride Ansatz, der planare Bilder und 3D-SPECT/CT-Bild kombiniert, die Grenzen der Überlappung von Strukturen überwindet.
Zusammenfassung
Peptid-Rezeptor-Radionuklid-Therapie (PPRT) ist eine gezielte Therapie, die ein Kurzbereichs-Energieradionuklid mit einem Substrat mit hoher Spezifität für Krebszellrezeptoren kombiniert. Nach der Injektion wird der Radiotracer im ganzen Körper verteilt, mit einer höheren Aufnahme in Geweben, wo gezielte Rezeptoren überexprimiert werden. Der Einsatz von Beta-/Gamma-Radionuklidemittern ermöglicht die gleichzeitige Gleichzeitige Therapie-Bildgebung (Beta-Emission) und Post-Therapie-Bildgebung (Gamma-Emission). Sequenzielle Bilder nach der Behandlung ermöglichen eine absorbierte Dosisberechnung basierend auf der lokalen Aufnahme- und Einwasch-/Waschkinetik. Wir haben eine hybride Methode implementiert, die Informationen aus 2D- und 3D-Bildern kombiniert. Serielle Ganzkörperbilder und Blutproben werden erfasst, um die absorbierte Dosis für verschiedene gefährdete Organe und lästige, im ganzen Körper verbreitete Läsionen zu schätzen. Ein einziges 3D-SPECT/CT-Bild, das auf den Bauchbereich beschränkt ist, überwindet Projektionsüberlappungen auf planaren Bildern verschiedener Strukturen wie Darm und Nieren. Die hybride 2D+3D-SPECT/CT-Methode kombiniert die effektiven Halbwertszeitinformationen aus 2D-Planarbildern mit der lokalen Aufnahmeverteilung, die aus 3D-Bildern abgeleitet wird. Wir haben diese Methode implementiert, um die absorbierte Dosis für Patienten, die PRRT unterziehen, mit 177Lu-PSMA-617 zu schätzen. Die Methodik könnte jedoch mit anderen Beta-Gamma-Radiotracern implementiert werden. Bis heute wurden 10 Patienten in die Dosimetrie-Studie mit 177Lu-PSMA-617 in Kombination mit Medikamentenprotektoren für Nieren und Speicheldrüsen (Mannitol- bzw. Glutamattabletten) aufgenommen. Das Medianverhältnis zwischen der Nierenaufnahme bei 24 h, ausgewertet auf planaren Bildern und 3D-SPECT/CT, beträgt 0,45 (Bereich:0,32-1,23). Der Vergleich zwischen Hybrid- und Full 3D-Ansatz wurde an einem Patienten getestet, was zu einer Unterschätzung von 1,6% in Bezug auf volle 3D (2D: 0,829 mGy/MBq, Hybrid: 0,315 mGy/MBq, 3D: 0,320 mGy/MBq) führte. Die Behandlungssicherheit wurde bestätigt, mit einer mittleren absorbierten Dosis von 0,73 mGy/MBq (Bereich:0,26-1,07) für Nieren, 0,56 mGy/MBq (0,33-2,63) für die Ohrspeicheldrüsen und 0,63 mGy/MBq (0,23-1,20) für submandibuläre Drüsen, Werte gemäß zuvor veröffentlichten Daten.
Einleitung
Unter den Peptid-Rezeptor-Radionuklid-Therapien kombiniert 177Lu-PSMA-617 PRRT einen Kurzstrecken-Beta-Emitter 177Lu (1,9 mm maximaler Wasserbereich, Halbwertszeit 6,71 Tage) mit einem Prostata-spezifischen Membranantigen (PSMA) Ligand. Die Überexpression von PSMA bei 90-100% der lokalen Prostatakrebsläsionen und metastasierenden Erkrankungen (Lymphknoten und Knochen) ist der Schlüssel zu dieser Therapie. PsMA-Rezeptoren werden jedoch auch in verschiedenen gesunden Geweben ausgedrückt, in denen eine hohe Aufnahme häufig während der Behandlungen beobachtet wird. Die wichtigsten gefährdeten Organe sind die Nieren, das Rote Mark, der Speichelund und die lachrymalen Drüsen. Die Dosis für diese Organe kann die maximale injizierbare Aktivität reduzieren und das therapeutische Verhältnis beeinträchtigen.
Unser Institut (IRST IRCCS) aktivierte ein Protokoll mit dem Ziel, das therapeutische Verhältnis zwischen Läsionen und gesundem Gewebe zu erhöhen und Medikamentenprotektoren in Kombination mit 177Lu-PSMA-617 Therapien zur Verfügung zu stellen. Mannitol, Polyglutamatfolattabletten in Kombination mit extern aufgetragenen Eispackungen und N-Acetylaspartylglutamatsäure Augentropfen werden für Nieren, Speicheldrüsen und lachrymale Drüsenkonservierung verwendet, bzw.1. Dosimetrische Studien nach der Infusion sind erforderlich, um die effektive Halbwertszeit (d. h. die Kombination von physikalischer und biologischer Halbwertszeit) und die absorbierte Dosis für verschiedene im ganzen Körper lokalisierte Interessensstrukturen (z. B. Nieren, Speicheldrüsen, disseminierte Läsionen) zu schätzen. Dieses Szenario erfordert Ganzkörperinformationen, die durch den Erwerb sequenzieller ganzkörperweiser planarer Bilder2gewonnen werden. Die Überlappung von Strukturen mit hoher Aufnahme (z. B. vorübergehende Darmaufnahme über den Nieren) erfordert jedoch 3D-Informationen, die zwischen verschiedenen lokalen Aufnahmemengen, die auf 2D-Projektionen vermischt werden, unterscheiden können. Wir implementierten eine hybride Methode, die eine dosimetrische Auswertung des gesamten Körpers dank 2D-Planarbildern2ermöglicht und 3D-Informationen über eine ausgewählte Region (z. B. Bauchregion) aufrechterhält. Diese Methode kombiniert die Aktivitätsverteilung von 3D-SPECT/CT-Bildern mit der effektiven Halbwertszeit, die aus planaren Bildern berechnet wird. Informationen, die aus anderen nicht überlappenden Strukturen (z. B. Speicheldrüsen) gewonnen werden, werden nur aus planaren Bildstudien abgeleitet. Die Blutprobenmethode, die für die Beurteilung des Roten Mark verwendet wird, wird in einem anderen Abschnitt beschrieben.
Der Vorteil des hybriden Ansatzes besteht darin, dass der gesamte Körper gescannt werden kann, während eine vollständige 3D-SPECT/CT-Methode die cranio-kaudale Bilderweiterung einschränkt, was es unmöglich machen kann, Strukturen zu untersuchen, die voneinander entfernt sind. Die geringe Bildauflösung der planaren Bildgebung und die Notwendigkeit, eine Überlappungskorrektur mit einer einzigen 3D-SPECT/CT-Aufnahme zu implementieren, stellen jedoch die Hauptnachteile dar.
Um die Sicherheit und Wirksamkeit von PRRT-Therapien zu testen, ist es wichtig, einzelne Institutsdaten mit Daten zu vergleichen, die zuvor von anderen Gruppen veröffentlicht wurden. Die meisten veröffentlichten Daten mit 177Lu-PSMA-617 basieren auf planaren Bildern. Daher könnte die beschriebene Methode auch für die Standardisierung der verwendeten Methoden nützlich sein. Schließlich ist es erwähnenswert, dass die Umsetzung der Methodik ein hohes Maß an Zusammenarbeit zwischen verschiedenen beteiligten Berufspersonen (d. h. Ärzte, Physiker, medizinische Radiologietechniker, Krankenschwestern) erfordert.
Protokoll
Das Dosimetrieverfahren wurde nach dem Behandlungsprotokoll "Radiometabolic Therapy (RMT) with 177Lu-PSMA-617 in advanced castration resistant prostate cancer (CRPC): efficacy and toxicity evaluation" (EUDRACT/RSO-Nummer: 2016-002732-32) (Abbildung 1) durchgeführt. Ausgewählte Patienten wurden einer Dosimetrie-Evaluierung auf der Grundlage des Leistungsstatus unterzogen. Alle Patienten unterzeichneten die Einwilligung in Kenntnis der Sachlage. Vor der Behandlung wurde jeder Patient einem 68Ga-PSMA-11 PET/CT Ganzkörperscan unterzogen.
HINWEIS: Es ist wichtig zu betonen, dass einige Schritte speziell mit dem verwendeten Scanner verknüpft sind.
1. Pre-Infusions-Bildgebung: Transmission und Blank-Bildaufnahme
HINWEIS: Bei dieser ersten Bildaufnahme wird die Wasseräquivalentdicke des Patienten ausgewertet. Dieser Wert wird für die Dämpfungskorrektur von Anzahlen verwendet, die aus 2D-planaren Bildern abgeleitet sind, die nach der Lu-PSMA-617-Injektion von 177Lu-PSMA-617 aufgenommen wurden.
- Stellen Sie niedrigenergetische hochauflösende Kollimatoren (LEHR) ein.
- Öffnen Sie die Bildprotokollaufnahme auf der Workstation und wählen Sie Transmissionscan ganzkörperplanare Bildaufnahme.
- Überprüfen Sie die Tischgeschwindigkeit (z. B. 7 cm/min) und zoomen (z. B. 1). Halten Sie diese Werte für die leere Scanerfassung gleich. Überprüfen Sie, ob die Option Körperkontur deaktiviert ist.
- Positionieren Sie den Patienten auf der Couch Füße-erste Supine mit Armen in Ruhe an der Seite des Körpers. Verwenden Sie diese Position für alle Bilder. Bei Bedarf verfügbare Stützen (Armstütze, Kniekeil, Kissen, Decke) verwenden.
- Beachten Sie die genaue Position des Patienten, mit der Skalennummer entlang der Couch: Scheitelkopfposition, Knieposition, Fußposition, Couchhöhe, alle verwendeten Stützen. Beachten Sie das Gewicht und die Körpergröße des Patienten.
- Stellen Sie die SPECT-Doppelköpfe an den entgegengesetzten Positionen (d. h. 0° und 180°) und im maximalen Abstand zum FOV-Zentrum ein. Heben Sie die Couch so an, dass der Patient im FOV-Zentrum und mit dem Kopf im Detektorzentrum positioniert ist.
- Positionieren Sie die 57Co-Flutunterstützung auf der hinteren Kamera und dann die 57Co Flut selbst auf der Stütze. Starten Sie die Bildaufnahme.
- Entfernen Sie am Ende der Bildaufnahme die 57Co-Flut und -Unterstützung. Drücken Sie Entladen auf dem Teach-Anhänger. Helfen Sie dem Patienten aufzustehen.
- Wiederholen Sie die Bildaufnahme auf die gleiche Weise, aber ohne dass der Patient auf der Couch positioniert ist.
HINWEIS: Couchgeschwindigkeit, Tischhöhe und Kameraabstand sollten auf den gleichen Wert wie das vorherige Übertragungsbild eingestellt werden.
2. Nachinfusion Bildaufnahme: Planares Bild
HINWEIS: Planare Post-Image-Erfassungen werden für eine effektive Halbwertszeit und eine mittlere absorbierte Dosisauswertung verschiedener Strukturen verwendet.
- Erfassen Sie das erste Bild 0,5-1 h nach 177Lu-PSMA-617 Infusion (Tag 1, Abbildung 1).
- Erfassen Sie das erste Bild vor blasenleerung. Wenn der Patient ein dringendes Bedürfnis nach Blasenentleerung verspürt, stellen Sie ein geeignetes Gefäß für die Urinentnahme zur Verfügung. Achten Sie darauf, das Gefäß (oder Urinbeutel, wenn der Patient einen Katheter hat) in das Bild aufzunehmen.
- Sammeln Sie eine 2 ml Blutprobe, schließen Sie das Sammelrohr und legen Sie es in eine abgeschirmte Box, unter Notierung der Zeit.
- Umstellung auf Mittelenergie-Hochauflösungskollimator (MEHR).
- Öffnen Sie die Bildprotokollaufnahme auf der Workstation, und wählen Sie die ganzkörperplanare Bildaufnahme aus. Überprüfen Sie die Tischgeschwindigkeit (z. B. 7 cm/min) und zoomen (z. B. 1). Halten Sie diese Werte für alle anderen Bilder gleich. Überprüfen Sie, ob die Option Körperkontur deaktiviert ist.
- Positionieren Sie den Patienten auf der Couch, um sicherzustellen, dass die Position mit der Position des vorherigen Bildes (d. h. dem Vorinfusionsübertragungsscan) identisch ist.
- Stellen Sie die SPECT-Doppelköpfe auf entgegengesetzte Positionen (d. h. 0° und 180°) ein. Heben Sie den Tisch so an, dass der Patient im FOV-Zentrum und mit dem Kopf im Detektorzentrum positioniert ist.
- Passen Sie mit dem Teach Pendent die Position der hinteren Kamera (d. h. bei 180°) manuell an, um den Mindestabstand vom unteren Couchprofil zu erreichen.
- Stellen Sie manuell die Position der vorderen Kamera (d. h. bei 0° positioniert) ein, um einen Mindestabstand vom Profil des Patienten zu erreichen. Berücksichtigen Sie die gesamte Körperoberfläche entlang der gesamten Patientenhöhe, um Kollisionen beim Scannen zu vermeiden.
- Nehmen Sie die Position der Duellköpfe, starten Sie die Bildaufnahme.
- Am Ende der Bildaufnahme drücken Sie auf den Teach-Anhänger entladen und helfen dem Patienten aufzustehen.
- Wiederholen Sie die gleiche Bildaufnahme mit den gleichen Kameraeinstellungen bei 16-24 h (zweites Bild, Tag 2), 36-48 h (drittes Bild, Tag 3). Zusätzliche Bilder (ein oder mehrere) können bis zu 120 h nach der Infusion (z.B. 66-70 h und 120 h) basierend auf Patientenkonformität und Ressourcen der Institution.
- Sammeln Sie eine 2 ml Blutprobe zur gleichen Zeit wie die SPECT-Bildaufnahme, schließen Sie das Sammelrohr und legen Sie es in eine abgeschirmte Box, um die Zeit zu notieren.
3. Nachinfusion Bildaufnahme: 3D SPECT/CT
HINWEIS: Am 2. Tag (16-24 h nach der Infusion) wird eine 3D-Bildaufnahme zusammen mit der planaren Bildaufnahme durchgeführt. Das 3D-SPECT/CT-Bild konzentriert sich auf den Bauchbereich und ermöglicht es, Organüberlappungen (z.B. Nieren oder Darmschlaufen) auf vorderen/posterioren Projektionen zu vermeiden.
- Wählen Sie nach der planaren Bildaufnahme das 3D-SPECT/CT-Bild innerhalb des Dosimetrieprotokolls auf der Workstation aus.
- Prüfen Sie, ob die richtigen Bildparameter eingestellt sind: Erfassungsmodalität (z. B. Step-and-Shoot), Winkel pro Projektion (z. B. 5°), Anzahl der Frames pro Drehung (z. B. 72), Rahmendauer (z. B. 3.000 ms). Überprüfen Sie, ob Body Contour deaktiviert ist.
- Positionieren Sie den Detektor im maximalen Abstand vom Zentrum, um Kollisionen zu vermeiden. Positionieren Sie den Patienten mit erhobenen Armen über dem Kopf. Positionieren Sie den Patiententisch innerhalb der Kamera, bis der gewünschte Bereich auf dem Detektor zentriert ist (z. B. Nieren und eine bestimmte Läsion, die sich in derselben Region befindet). Starten Sie die Bildaufnahme.
- Erfassen Sie das entsprechende CT-Bild.
- Am Ende der Bildaufnahme drücken Sie auf den Teach-Anhänger entladen und helfen dem Patienten beim Aufstehen.
4. Bildanalyse
HINWEIS: Streu-, Dämpfungs- und Hintergrundkorrekturen werden implementiert. Einzelorgan und Läsionsmasse werden für die Bewertung der absorbierten Dosis berücksichtigt. ROI und VOI sind auf planaren und 3D-Bildern konturiert.
- Senden Sie alle erfassten Bilder von der Erfassungsarbeitsstation an die Analysearbeitsstation.
- Wählen Sie für alle Bilder nach der Infusion emissive, niedrige und hohe Streuungsbilder aus
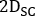 und klicken Sie wie folgt auf das rechte Feld des dedizierten Workflows, um ein streuungskorrigiertes Bild zu erstellen:
und klicken Sie wie folgt auf das rechte Feld des dedizierten Workflows, um ein streuungskorrigiertes Bild zu erstellen: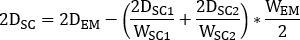
wobei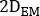
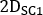 ,
, 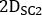 und sind emissiv, niedrigere Streuung und höhere Streuung 2D vorderoder oder hintere planare Ganzkörperbilder, bzw.;
und sind emissiv, niedrigere Streuung und höhere Streuung 2D vorderoder oder hintere planare Ganzkörperbilder, bzw.; 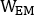 ,
, 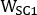
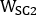 und sind emissive, niedrigere Streuung und höhere Streuenergie Fensterbreiten.
und sind emissive, niedrigere Streuung und höhere Streuenergie Fensterbreiten. - Öffnen Sie jedes hintere Bild, klicken Sie auf Bild, dann neu ausrichten, Schwenken, Zoomen..., Kennung Y Spiegelung, klicken Sie auf Anwenden & Beenden, und speichern Sie dann das gedrehte Bild von links nach rechts.
- Offene vordere und hintere (gedrehte) streuungskorrigierte planare Bilder, die nach der Infusion aufgenommen wurden.
- Wählen Sie das bildseitfest am 2. Tag aufgenommene Bild als am besten geeignet für die ROI-Abgrenzung aus. Konturorgane: Ganzkörper (bei Bedarf auch Uringefäß oder Beutel), Nieren, Leber, Milz (falls sichtbar), Ohrspeicheldrüsen, submandibuläre Drüsen, lachrymale Drüsen. Wenn möglich, konturieren Sie auch einige sichtbare Läsionen. Konturieren Sie die ROIs auf dem nützlichsten Bild zwischen vorderen und hinteren Ansichten (Abbildung 2). Konturieren Sie einen kleinen ROI neben jeder konturierten Struktur für Hintergrund.
- Kopieren und fügen Sie alle ROIs aus dem Bild, das am 2. Tag aufgenommen wurde, in die vorderen und hinteren Ansichten der anderen Bilder einfügen, die nach der Infusion aufgenommen wurden.
- Verwenden Sie nur die ROI-Übersetzung, und ändern Sie sie nicht, um die gleiche Organdimension beizubehalten. Wählen Sie für jede erfasste Postinfusion ein vorderes Bild aus. Speichern Sie konturierte ROIs.
- Beachten Sie für jedes Bild die durchschnittlichen Anzahlen [c] und die Pixeldimension innerhalb jedes ROI (einschließlich Hintergrund-ROIs) für vordere und hintere Ansichten3.
- Öffnen Sie vordere Übertragung und leere Scans, zusammen mit abgegrenzten ROIs. Kopieren und Einfügen von Organ enund und Läsionen ROIs auf Übertragung Scan. Passen Sie die Organinfehlstellung an, und vergrößern oder verringern Sie bei Bedarf die Organkonturen für eine unterschiedliche Bildvergrößerung.
- Für Körperdämpfung, Kontur eine Struktur umfasst Kopf, Schultern, Brust und Bauch, Vermeidung von Armen und Beinen (Abbildung 3).
- Kopieren und fügen Sie alle ROIs von der Übertragung bis zum leeren Scan ein.
- Bewerten Sie die Wasseräquivalentdicke z für jede Struktur, um die Selbstdämpfung zu schätzen. Beachten Sie die durchschnittlichen Zählungen innerhalb jedes ROI sowohl auf Übertragung(I-Übertragung) Übertragung und leere (Ichleer) Scans. Berechnen Sie die Wasseräquivalentdicke z als
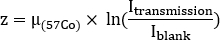
wobei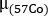 der Dämpfungskoeffizient für 57Co-Hochwasser zuvor mit einem einheitlichen Phantom gemessen wurde.
der Dämpfungskoeffizient für 57Co-Hochwasser zuvor mit einem einheitlichen Phantom gemessen wurde. - Verwenden Sie die Vorbehandlung 68Ga-PSMA-11 PET/CT Scan. Konturorgane auf CT-Bild: Nieren, Leber, Milz, Ohrspeicheldrüsen und submandibuläre Drüsen. Konturläsionen auf PET-Bildern. Unter der Annahme einer gleichmäßigen Wasserzusammensetzung für jede Struktur wird die Masse jeder konturierten Struktur mit einer Einheitendichte (1 g/ml) berechnet.
- Führen Sie die SPECT/CT-Bildrekonstruktion unter Berücksichtigung der Streukorrektur, der CT-Dämpfungskorrektur und der Auflösungswiederherstellung durch. Legen Sie die gleichen iterativen Rekonstruktionswerte fest, die für die SPECT-Kalibrierung verwendet werden (z. B. OSEM-Iteration und Teilmengennummern, Nachrekonstruktionsfilterung).
5. Blutprobenmessungen
HINWEIS: Blutprobenmessungen werden am Hochreinheitsdetektor Germanium (HPGe) zur Schätzung der Red-Marrow-Dosis durchgeführt.
- Lassen Sie die Blutprobe für etwa 2 Wochen zerfallen, um Detektorsättigung und hohe Totzeit zu vermeiden.
- Messen Sie nach 2 Wochen jeweils eine Probe. Aufgrund der geringen Aktivität beginnen Sie mit den Messungen der letzten entnommenen Blutprobe (d. h. ab Tag 6).
- Positionieren Sie das Blutproben-Entnahmeröhrchen auf dem entsprechenden Halter. Verwenden Sie dieselbe Geometrie wie für die HPGe-Kalibrierung. Positionieren Sie ihn auf dem HPGe-Detektor und schließen Sie das Detektor-Abschirmgehäuse.
- Öffnen Sie die Software für die Spektrumerfassung und -analyse. Überprüfen Sie, ob die Totzeit <3% beträgt. Wenn höher, warten Sie noch ein paar Tage und führen Sie die Messungen dann durch.
- Wählen Sie die richtige HPGe-Kalibrierungsdatei aus, die dem 2-ml-Sammelrohrgeometriehalter entspricht. Starten Sie Probenmessungen (mindestens 12 h Messungen).
- Analysieren Sie das Spektrum, indem Sie den mittleren Gamma-Peak identifizieren und die Aktivitätskonzentration berechnen. Beachten Sie sowohl die gemessene Stichprobenaktivität als auch die Zeit- und Datumsmessungen.
- Wiederholen Sie die gleichen Messungen und Analysen für alle Blutproben.
6. Dosimetrie-Evaluierung
HINWEIS: Die Analyse wird mit einer speziellen Dosimetrie-Software durchgeführt, die auf MIRD-Publikationen4,5,6,7,8basiert. Für jede betrachtete Struktur wird die effektive Halbwertszeit auf sequenziellen 2D-Ganzkörperbildern durch bi- oder monoexponentiale Kurven, die in Zeit-Aktivitätskurven passen, ausgewertet. 3D SPECT/CT-Bildgebung wird verwendet, um das Problem der Überlappung des Darms mit hoher Aufnahme auf der Nierenstruktur zu lösen, indem die aus planaren Bildern abgeleiteten Zeitaktivitätskurven skaliert werden. Die mittlere absorbierte Dosis wird dann für jede Strukturmasse berechnet. Für die Bewertung der Red-Marrow-Dosis werden Blutprobenmessungen verwendet und auf das Gewicht des Patienten skaliert.
- Planare Bilder
- Berechnen Sie für jedes Bild und jede
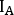 Struktur die Zählungen
Struktur die Zählungen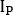 auf anterior ( ) und hintere ( ) Ansicht als
auf anterior ( ) und hintere ( ) Ansicht als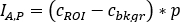
Wobei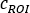 die durchschnittliche Anzahl [c]
die durchschnittliche Anzahl [c] 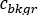 für den berücksichtigten ROI ist, ist
für den berücksichtigten ROI ist, ist 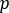 die durchschnittliche Anzahl [c] im entsprechenden Hintergrundbereich und die Pixelzahl innerhalb des ROI.
die durchschnittliche Anzahl [c] im entsprechenden Hintergrundbereich und die Pixelzahl innerhalb des ROI. - Berechnen Sie für jeden ROI die Aufnahme zu jedem Bildzeitpunkt als
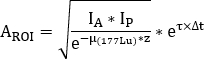
wobei der Dämpfungskorrekturfaktor für 177
der Dämpfungskorrekturfaktor für 177  Lu die physikalische Halbwertszeit von 177Lu ist, ist die Zeitdifferenz zwischen Infusion und Bildaufnahme9, und z ist die wasseräquivalente Dicke, die beim Transmissionsscan ausgewertet wird.
Lu die physikalische Halbwertszeit von 177Lu ist, ist die Zeitdifferenz zwischen Infusion und Bildaufnahme9, und z ist die wasseräquivalente Dicke, die beim Transmissionsscan ausgewertet wird. - Berechnen Sie die relative Aufnahme als
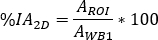
wobei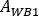
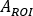 auf dem ersten Post-Infusionsbild für den ganzen Körper ausgewertet wird. Da vollständiger Urin im Bild enthalten ist, wird dies als Referenz für die gesamte effektive infundierte Aktivität betrachtet.
auf dem ersten Post-Infusionsbild für den ganzen Körper ausgewertet wird. Da vollständiger Urin im Bild enthalten ist, wird dies als Referenz für die gesamte effektive infundierte Aktivität betrachtet.
- Berechnen Sie für jedes Bild und jede
- Hybride 2D+3D SCPET/CT-Bilder
- Für die SPECT/CT-Aktivitätskalibrierung ein zylindrisches Phantom mit einer zentralen Sphäre bekannter Aktivität abbilden. Konturieren Sie die zentrale Kugel VOI und berechnen Sie den Kalibrierfaktor [cps/MBq] als
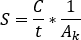
Wobei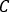 die Gesamtzahlen innerhalb des VOI
die Gesamtzahlen innerhalb des VOI  [c], die
[c], die  Bildaufnahmezeit [sek] und die bekannte injizierte Aktivität [MBq] innerhalb der zentralen Sphäre sind. DAS SPECT/CT-Bild für den Patienten wird mit den gleichen Erfassungs- und Rekonstruktionsparametereinstellungen durchgeführt.
Bildaufnahmezeit [sek] und die bekannte injizierte Aktivität [MBq] innerhalb der zentralen Sphäre sind. DAS SPECT/CT-Bild für den Patienten wird mit den gleichen Erfassungs- und Rekonstruktionsparametereinstellungen durchgeführt. - Öffnen Sie das SPECT/CT-Bild. Konturvolumen (VOIs) (z.B. Nieren, sichtbare Läsion) basieren sowohl auf Aufnahmeinformationen als auch auf CT-Morphologie. Berechnen Sie die Aktivität in der Struktur als
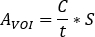
- Berechnen
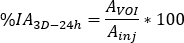
wobei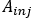 die injizierte Aktivität während der Behandlung erfolgt.
die injizierte Aktivität während der Behandlung erfolgt. - Berechnen Sie den Skalierungsfaktor für die Zeitaktivitätskurve als

wobei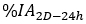 das
das 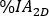 auf planarem Bild berechnete planare Bild am Tag 2 (16-24 h) zerfallskorrigiert für die physische Halbwertszeit zum Zeitpunkt der Injektion ist.
auf planarem Bild berechnete planare Bild am Tag 2 (16-24 h) zerfallskorrigiert für die physische Halbwertszeit zum Zeitpunkt der Injektion ist. - Skalieren Sie die Aktivitätskurve
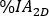 der Niere 2D mit
der Niere 2D mit 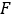 dem Faktor entsprechend. Führen Sie eine Dosimetrieauswertung mit OLINDA/EXM durch, wie unten beschrieben.
dem Faktor entsprechend. Führen Sie eine Dosimetrieauswertung mit OLINDA/EXM durch, wie unten beschrieben.
- Für die SPECT/CT-Aktivitätskalibrierung ein zylindrisches Phantom mit einer zentralen Sphäre bekannter Aktivität abbilden. Konturieren Sie die zentrale Kugel VOI und berechnen Sie den Kalibrierfaktor [cps/MBq] als
- Erwachsene männliche Phantom
- Öffnen Sie Dosimetriesoftware. Wählen Sie das Radionuklid (z.B. 177Lu) im Modul Nuclide Input Formaus. Wählen Sie das Modell (z. B. Adult Male) im Modul Modelleingabeformular aus.
- Wechseln Sie zum Modul Kinetischeeingabeformular, und klicken Sie auf Alle Daten löschen. Klicken Sie auf An Modell anpassen und ein separates Fenster wird geöffnet.
- Fügen Sie in der Spalte Zeit (Hr) die Stunden nach der Infusion für jede Bildaufnahme im Stundenformat ein (z. B. 1 h und 30 min sind 1,50). Scrollen Sie auf dem Organmenü nach unten und wählen Sie Voninteresse sind (z. B. Nieren, Leber, Milz).
- Fügen Sie für jedes Organ
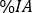 die relative Aufnahme zu jedem Bildzeitpunkt ein. Klicken Sie auf Aktualisieren.
die relative Aufnahme zu jedem Bildzeitpunkt ein. Klicken Sie auf Aktualisieren. - Für gepaarte Organe (d. h. Nieren) fügen Sie einen einzigen Wert
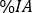 als Summe der linken und rechten einzelnen relativen Aufnahmeeinfügungen ein. Klicken Sie auf Aktualisieren, und überprüfen Sie die Punktverteilungen auf dem linken Seitendiagramm.
als Summe der linken und rechten einzelnen relativen Aufnahmeeinfügungen ein. Klicken Sie auf Aktualisieren, und überprüfen Sie die Punktverteilungen auf dem linken Seitendiagramm. - Führen Sie ein Kurvenfitting mit einer exponentiellen Kurve als
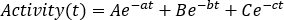
DieParameter A , B und C können positive oder negative Werte für die Ein- bzw. Auswaschphasenmodellierung annehmen. Wenn Daten von Zeitaktivitätskurven zerfallskorrigiert sind, stellen a, b und c Parameter biologische Halbwertszeit -biol dar und sind alle positiv. Wählen Sie ein geeignetes Kurvenanpassungsmodell zwischen Mono-, Bi- oder Triexponentialkurven aus. Kennzeichnen Sie die erforderlichen Parameter, fügen Sie Startwerte ein, und klicken Sie auf Anpassen, bis die Anpassung ausgeführt wird. - Beachten Sie die Kurvenanpassungsparameter. Berechnen Sie die effektive Halbwertszeit als
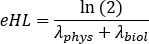
wobei die physikalische Halbwertszeitphys von 177Lu und diebiol biologische Halbwertszeit von 177Lu-PSMA-617-Verbindung ist. Berücksichtigen Sie für die Werte "biol"die niedrigsten Werte unter den Parametern a, b und c, die die Kurve anpassen (d. h. entsprechend der höheren effektiven Halbwertszeit). - Wiederholen Sie dies von Schritt 6.3.3 bis Schritt 6.3.7. für jedes Organ.
- Fügen Sie die relative Aufnahme zu jedem Bildzeitpunkt für den Rest des Körpers (nämlich Gesamtkörper/Rem-Körper) ein, indem Sie die relative Aufnahme aller betrachteten Organe von der Ganzkörperaufnahme subtrahieren. Wiederholen Sie dies von Schritt 6.3.5 bis Schritt 6.3.7 für Total Body/Rem Body. Im Allgemeinen wird eine biexponentielle Kurvenanpassung empfohlen.
- Klicken Sie auf Fertig, und speichern Sie das Modell. Das Programm geht zurück auf das Kinetic Input Form Modul und die Anzahl der Disintegrationen pro Einheit der injizierten Aktivität (nämlich ND, ausgedrückt in Bq*h/Bq) wird für jedes betrachtete Organ visualisiert.
- Wechseln Sie zum Haupteingabeformular. Klicken Sie auf Dosen, und ändern Sie dann die Eingabedaten. In der Box unten Multiplizieren Sie alle Massen mit:, fügen Sie das Verhältnis zwischen dem Gewicht des Patienten und dem Phantomgewicht der Erwachsenen (d. h. 73,7 kg) ein. Klicken Sie auf die Multiply all masses by: button. Alle Orgelmassen werden dann entsprechend neu skaliert. Fügen Sie einzelne Organmassen ein, wie aus der CT-Abgrenzung für die analysierten Organe berechnet. Für gepaarte Organe wie Nieren, legen Sie die Summe der linken und rechten Nierenmassen. Klicken Sie auf Fertig.
- Der Bericht zeigt die mittlere absorbierte Dosis an, die in die injizierte Aktivität normalisiert wird, ausgedrückt in mGy/MBq. Beachten Sie die gesamte absorbierte Dosis für betrachtete Organe (d. h. Nieren, Leber, Milz und Gesamtkörper).
- Wiederholen Sie diesen Vorgang für Zeitaktivitätskurven, die von der hybriden 2D+3D SPECT/CT-Methode abgeleitet wurden.
- Rotes Mark
- Führen Sie die Skalierung für Blutwerte durch, um die Red Marrow-Dosis zu berechnen.
- Berechnen Sie die Blutaufnahme bei jeder Blutentnahme als
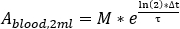
wobei M die Aktivitätsmessung [MBq] ist, die mit HPGe 2 ml Blutprobenmessung erhalten wurde. - Berechnen Sie die
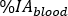 relative Blutaufnahme als
relative Blutaufnahme als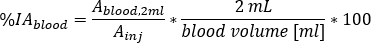
wobei das Blutvolumen [mL] die Gesamtblutvolumenschätzung für den jeweiligen Patienten ist. Dieser Wert wird den Standard-Phantomwerten von Adult Male10entnommen. - Auf Red Marrow (RM) Masse umsleben
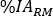 und die rm relative Aufnahme als
und die rm relative Aufnahme als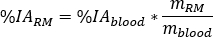
wobei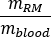 das Verhältnis des Standard-Erwachsenen-Männchen-Phantoms von
das Verhältnis des Standard-Erwachsenen-Männchen-Phantoms von 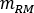 (Roter Marrow-Masse) gleich 1120 g und
(Roter Marrow-Masse) gleich 1120 g und 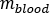 (Ganzkörperblutmasse) gleich 5000 g ist.
(Ganzkörperblutmasse) gleich 5000 g ist. - Wechseln Sie zum Kinetic Input Form-Modul, und klicken Sie auf Alle Daten löschen. Klicken Sie auf Fit to Model. Scrollen Sie in der Orgelkarte nach unten und wählen Sie Red Marrow aus.
- Fügen Sie in der Spalte Zeit (Hr) die Stunden nach der Infusion für jede Blutprobenerfassung im Stundenformat ein (d. h. 1 h und 30 min sind 1,50). Fügen Sie
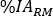 die Werte von ein. Wiederholen Sie die Schritte 6.3.5-6.3.7. für Red Marrow.
die Werte von ein. Wiederholen Sie die Schritte 6.3.5-6.3.7. für Red Marrow. - Scrollen Sie im Orgelmenü nach unten und wählen Sie Gesamtkörper/Rem Body. Fügen Sie in der Spalte Zeit (Hr) die Stunden nach der Infusion für jede Bildaufnahme im Stundenformat ein (d. h. 1 h und 30 min sind 1,50). Fügen Sie
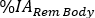 die Werte gleich
die Werte gleich 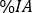 der Differenz zwischen dem
der Differenz zwischen dem 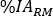 ganzen Körper, der auf planaren Bildern berechnet wird, und .
ganzen Körper, der auf planaren Bildern berechnet wird, und . - Wiederholen Sie dies von Schritt 6.3.5 bis Punkt für Red Marrow.
- Klicken Sie auf Fertig, und speichern Sie das Modell.
HINWEIS: Das Programm geht zurück auf das Kinetic Input Form Modul und die Anzahl der Disintegrationen pro Einheit der injizierten Aktivität (nämlich ND, ausgedrückt in Bq*h/Bq) wird für jede betrachtete Visualisierung visualisiert. - Wechseln Sie zum Haupteingabeformular. Klicken Sie auf Dosen. Skala Organmasse Neuskalierung als die vorherige Analyse auf anderen Organen.
- Kugelmodell
- Verwenden Sie ein Einheitendichtekugelmodell für Strukturen, die im Phantom nicht verfügbar sind (z. B. Läsionen, Ohrspeicheldrüsen und submandibuläre Drüsen).
- Wiederholen Sie bei der Kurvenanpassung von Schritt 6.3.2 bis Schritt 6.3.10, indem Organwerte durch relative Aufnahme für getrennte Speicheldrüsen und Läsionen ersetzt werden.
- Klicken Sie auf Fertig, und speichern Sie das Modell.
- Das Programm geht zurück auf das Kinetic Input Form Modul und die Anzahl der Disintegrationen pro Einheit injizierte Aktivität [Bq*h/Bq] wird für jedes betrachtete Organ visualisiert. Beachten Sie ND für jede betrachtete Struktur.
- Wechseln Sie zum Modelleingabeformular. Klicken Sie auf Kugeln.
- Geben Sie für jede Struktur die berechnete NDein. Klicken Sie auf Dosen berechnen. Der Bericht zeigt die mittlere absorbierte Dosis an, die in die injizierte Aktivität normalisiert wird, ausgedrückt in mGy/MBq, für diskret eincreasing sphere masses (g). Passen Sie die Kurve mit monoexponentiellem Fitting an und berechnen Sie die absorbierte Dosis, die auf die injizierte Aktivität (mGy/MBq) normalisiert wird, für die spezifische Strukturmasse.
- Bei gepaarten Organen (z.B. Speicheldrüsen) führen Sie die Kugelmodellauswertung getrennt für linke und rechte Organe durch. Verwenden Sie den Mittelwert zwischen linker und rechter Struktur für die Bewertung der gesamten Organdosis.
Ergebnisse
Die Dosimetrie wurde bei 10 Patienten durchgeführt (7 durch den ersten Behandlungszyklus, 3 Sekunden Zyklus). Blutproben wurden von allen bis auf 3 Patienten entnommen. Ein Patient gab die Blase vor der ersten Nachinfusionsaufnahme für ungültig. Die injizierte Aktivität betrug 5,5 GBq für 5 Patienten und 4,4 GBq für 5 Patienten.
In Bezug auf die Kurvenanpassung wurde die Mono- oder Biexponentialkurvenanpassung für Organ...
Diskussion
Die beschriebene Methode ermöglicht die Ganzkörperdosimetrie für PRRT-Therapien und ist ein gültiger Kompromiss zwischen 2D-Ganzkörper- und 3D-Dosimetrieinformationen, da sie wertvolle Informationen liefert, ohne die Bildaufnahmebelastung signifikant zu erhöhen. Die Methode ist auch nützlich für die Bewertung der absorbierten Dosis überlappender Strukturen und liefert Informationen über die Strukturen, die außerhalb des eingeschränkten Sichtfeldes 3D SPCET/CT liegen.
Die Umsetzung ...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Unser Dank gilt den professionellen Persönlichkeiten, die an dem Protokoll beteiligt sind (d. h. Ärzte, Physiker und Krankenschwestern) und den Patienten, die sich bereit erklärt haben, an der Studie teilzunehmen. Wir danken auch den medizinischen Radiologietechnikern der Abteilung Nuklearmedizin für ihre Hilfe bei der Protokollumsetzung: Valentina Mautone, Maria Caternicchia, Monia Pancisi, Daniela Fichera und Delia Bevilacqua. Die Autoren würdigen Alessandro Savini und Simone Marzoni für ihre Hilfe bei der Videoaufnahme. Die Arbeit wurde teilweise von AIRC (Italienische Vereinigung für Krebsforschung, Fördernummer: L2P1367 - L2P1520) unterstützt. Die Arbeiten wurden teilweise vom italienischen Gesundheitsminister finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 177Lu EndolucinBeta | ITG - Isotopen Technologien München AG, Lichtenbergstrasse 1, 85748 Garching, Germany, info@itm.ag | Radiotracer 177Lu for therapy purpuse | |
| Biograph mCT Flow PET/CT | Siemens Healthineers, Erlangen, Germany | PET/CT scanner | |
| C-Thru 57Co planar flood - Model MED3709 | Eckert & Ziegler, Strahlen- und Medizintechnik AG, Robert-Rössle-Str. 10, 13125 Berlin, Germany, info@ezag.de | Calibration/planar source | |
| Cylindrical phantom with spheric insert | Data Spectrum Corporation, 1605 East Club Boulevard, Durham NC 27704-3406, US, info@spect.com | Phantom for SPECT/CT calibration | |
| Discovery NM/CT 670 SPECT/CT | International General Electric, General Electric Medical System, Haifa, Israel | SPECT/CT scanner | |
| GalliaPharm 68Ge/68Ga Generator | Eckert & Ziegler, Strahlen- und Medizintechnik AG, Robert-Rössle-Str. 10, 13125 Berlin, Germany, info@ezag.de | 68Ge/68Ga Generator of 68Ga for imaging purposes | |
| GammaVision v 6.08 | Ortec, Ametek - Advanced Measurement Technology, 801 South Illinois Avenue, Oak Ridge, Tennessee 37830, US, ortec.info@ametek.com | Gamma Spectorscopy software | |
| High Purity Germanium HPGe, model GEM30P4-70 | Ortec, Ametek - Advanced Measurement Technology, 801 South Illinois Avenue, Oak Ridge, Tennessee 37830, US, ortec.info@ametek.com | Gamma spectometer | |
| MimVista Software | MIM Software INC, Cleveland, OH 44122, US | Workstation | |
| OLINDA/EXM v 1.1 | RADAR - RAdiation Dose Assessment Resource, West End Ave, Nashville, TN 37235, US (now commercially available as OLINDA/EXM v 2.0, Hermes Medical Solutions, Strandbergsgatan 16, 112 51 Stockholm, Sweden, info@hermesmedical.com) | Dosimetry software | |
| PSMA 11 | ABX advanced biochemical compounds - Biomedizinische,Heinrich-Gläser-Straße 10-14, 01454 Radeberg, Germania, info@abx.de | Carrier for 68Ga radiotracer | |
| PSMA 617 | Endocyte Inc. (Headquarters), 3000 Kent Avenue, West Lafayette, IN 47906 | Carrier for 177Lu radiotracer | |
| Xeleris4.0 | International General Electric, General Electric Medical System, Haifa, Israel | Workstation |
Referenzen
- Matteucci, F., et al. Reduction of 68Ga-PSMA renal uptake with mannitol infusion: preliminary results. European Journal of Nuclear Medicine and Molecular Imaging. , 1-6 (2017).
- Sarnelli, A., et al. Dosimetry of 177 Lu-PSMA-617 after mannitol infusion and glutamate tablet administration: Preliminary results of EUDRACT/RSO 2016-002732-32 IRST protocol. Molecules. 24 (3), (2019).
- Stabin, M. G. . Fundamentals of nuclear medicine dosimetry. , (2008).
- Snyder, W. S., Ford, M. R., Warner, G. G., Watson, S. B. MIRD Pamphlet No. 11: "S" Absorbed dose per unt cumulate activity for selected radionuclides and organs. Society of Nuclear Medicine. , (1975).
- Bolch, W. E., et al. MIRD Pamphlet No. 17: The Dosimetry of Nonuniform Activity Distributions-Radionuclide S Values at the Voxel Level. Journal of Nuclear Medicine. 40 (17), 11s-36s (1998).
- Stabin, M. G., Sparks, R. B., Crowe, E. OLINDA/EXM: The Second-Generation Personal Computer Software for Internal Dose Assessment in Nuclear Medicine. Journal of Nuclear Medicine. 46, 1023-1027 (2005).
- Hippeläinen, E., Tenhunen, M., Mäenpää, H., Heikkonen, J., Sohlberg, A. Dosimetry software Hermes Internal Radiation Dosimetry: from quantitative image reconstruction to voxel-level absorbed dose distribution. Nuclear Medicine Communications. 38 (5), 357-365 (2017).
- Stabin, M. G., Siegel, J. A. RADAR Dose estimate report: a compendium of radiopharmaceutical dose estimates based on OLINDA/EXM version 2.0. Journal of Nuclear Medicine. 59, 154-160 (2018).
- Siegel, J., et al. MIRD pamphlet no. 16: Techniques for quantitative radiopharmaceutical biodistribution data acquisition and analysis for use in human radiation dose estimates. Journal of Nuclear Medicine. 40 (2), 37S-61S (1999).
- Valentin, J. Basic anatomical and physiological data for use in radiological protection: reference values. Annals of ICRP. 32, 5 (2002).
- Frey, E. C., Humm, J. L., Ljungberg, M. Accuracy and precision of radioactivity quantification in nuclear medicine images. Seminars in Nuclear Medicine. 42 (3), 208-218 (2012).
- Violet, J. A., et al. Dosimetry of Lu-177 PSMA-617 in metastatic castration-resistant prostate cancer: correlations between pre-therapeutic imaging and "whole body" tumor dosimetry with treatment outcomes. Journal of Nuclear Medicine. , (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten