É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um protocolo de dosimetria corporal inteira para terapia de radionuclídeo peptídeo-receptor (PRRT): imagem planar 2D e métodos híbridos de imagem 2D+3D SPECT/CT
Neste Artigo
Resumo
Este método estima a dose absorvida de diferentes estruturas para peptídeo-receptor-radionuclídeo-terapia (PRRT) com a possibilidade de evitar a sobreposição de órgãos em projeções 2D. Imagens planares de corpo inteiro em série permitem estimar doses médias absorvidas ao longo de todo o corpo, enquanto a abordagem híbrida, combinando imagens planares e imagem 3D-SPECT/CT, supera as limitações da sobreposição da estrutura.
Resumo
Peptídeo-receptor-radionuclídeo-terapia (PPRT) é uma terapia-alvo que combina um radionuclídeo de energia de curto alcance com um substrato com alta especificidade para receptores de células cancerosas. Após a injeção, o radiorastreador é distribuído por todo o corpo, com uma maior captação em tecidos onde receptores direcionados são superexpressos. O uso de emissores de radionuclídeos beta/gama permite que a imagem terapêutica (beta-emissão) e a imagem pós-terapia (emissão gama) sejam realizadas ao mesmo tempo. As imagens seqüenciais pós-tratamento permitem o cálculo de dose absorvida com base na absorção local e na cinética de lavagem/lavagem. Implementamos um método híbrido que combina informações derivadas de imagens 2D e 3D. Imagens em série do corpo inteiro e amostras de sangue são adquiridas para estimar a dose absorvida para diferentes órgãos em risco e para lesões disseminadas em todo o corpo. Uma única imagem 3D-SPECT/CT, limitada à região abdominal, supera a sobreposição de projeção em imagens planares de diferentes estruturas, como intestinos e rins. O método híbrido 2D+3D-SPECT/CT combina as informações eficazes de meia-vida derivadas de imagens planares 2D com a distribuição de captação local derivada de imagens 3D. Implementamos essa metodologia para estimar a dose absorvida para pacientes submetidos ao PRRT com 177Lu-PSMA-617. A metodologia poderia, no entanto, ser implementada com outros radiorastreadores beta-gama. Até o momento, 10 pacientes foram inscritos no estudo de dosimetria com 177Lu-PSMA-617 combinados com protetores de medicamentos para rins e glândulas salivares (comprimidos de manitol e glutamato, respectivamente). A relação mediana entre a captação renal a 24h avaliada em imagens planares e 3D-SPECT/CT é de 0,45 (intervalo:0,32-1,23). A comparação entre a abordagem híbrida e 3D completa foi testada em um paciente, resultando em uma subestimação de 1,6% em relação ao 3D completo (2D: 0,829 mGy/MBq, híbrido: 0,315 mGy/MBq, 3D: 0,320 mGy/MBq). A segurança do tratamento foi confirmada, com uma dose média absorvida de 0,73 mGy/MBq (faixa:0,26-1,07) para rins, 0,56 mGy/MBq (0,33-2,63) para as glândulas parótidas e 0,63 mGy/MBq (0,23-1,20) para glândulas submandibulares, valores de acordo com dados publicados anteriormente.
Introdução
Entre as terapias de radionuclídeo peptídeo-receptor, 177Lu-PSMA-617 PRRT combina um emissor beta de curto alcance 177Lu (1,9 mm de alcance máximo em água, meia-vida 6,71 dias) com um ligante de membrana específica da próstata (PSMA). A superexpressão do PSMA em 90-100% das lesões locais de câncer de próstata e doença metastática (linfonodo e osso) é a chave para esta terapia. No entanto, os receptores PSMA também são expressos em diferentes tecidos saudáveis onde a alta captação é frequentemente observada durante os tratamentos. Os principais órgãos em risco são os rins, medula vermelha, glândulas salivares e lacrimais. A dose para esses órgãos pode reduzir a atividade injetável máxima, prejudicando a relação terapêutica.
Nosso instituto (IRST IRCCS) ativou um protocolo com o objetivo de aumentar a relação terapêutica entre lesões e tecidos saudáveis, fornecendo protetores medicamentos combinados com 177lu-PSMA-617 terapia. Comprimidos de folato de manitol, poliglutamato combinados com sacos de gelo aplicados externamente e colírios ácidos N-acetilaspartylglutammate são usados para preservação de rins, salivares e glândulas lacrimosas, respectivamente1. Estudos dosimétricos pós-infusão são necessários para estimar a meia-vida eficaz (ou seja, combinação de meia-vida física e biológica) e dose absorvida para diferentes estruturas de interesse localizadas em todo o corpo (por exemplo, rins, glândulas salivares, lesões disseminadas). Este cenário requer informações corporais inteiras obtidas pela aquisição de imagens planares de corpo inteiro seqüencial pós-infusão2. No entanto, a sobreposição de estruturas de alta captação (por exemplo, a captação transitória do intestino acima dos rins) requer informações 3D capazes de discriminar entre diferentes captações locais que são misturadas em projeções 2D. Implementamos um método híbrido capaz de proporcionar uma avaliação dosimétrica de todo o corpo graças àsimagensplanares 2D , mantendo informações 3D sobre uma região selecionada (por exemplo, região abdominal). Este método combina a distribuição de atividade fornecida por imagens 3D SPECT/CT com a meia-vida efetiva calculada a partir de imagens planares. As informações obtidas de outras estruturas não sobrepostas (por exemplo, glândulas salivares) são derivadas apenas do estudo de imagem planar. O método de amostra de sangue utilizado para avaliação da medula vermelha é descrito em outra seção.
A vantagem da abordagem híbrida é que todo o corpo pode ser escaneado, enquanto um método 3D SPECT/CT limita a extensão da imagem cranio-caudal, o que pode tornar impossível estudar estruturas distantes umas das outras. No entanto, a baixa resolução de imagem da imagem planar e a necessidade de implementar uma correção de sobreposição usando uma única aquisição 3D SPECT/CT representam as principais desvantagens.
Para testar a segurança e a eficácia das terapias prrt, é importante comparar dados de instituições únicas com dados publicados anteriormente por outros grupos. A maioria dos dados publicados com 177Lu-PSMA-617 são baseados em imagens planares. Assim, o método descrito também poderia ser útil para a padronização das metodologias utilizadas. Por fim, vale ressaltar que a implementação da metodologia requer um alto grau de colaboração entre diferentes figuras profissionais envolvidas (ou seja, médicos, físicos, técnicos de radiologia médica, enfermeiros).
Protocolo
O procedimento de dosimetria foi realizado de acordo com o protocolo de tratamento "Terapia Radiometabólica (RMT) com 177Lu-PSMA-617 em câncer de próstata resistente à castração avançada (CRPC): avaliação de eficácia e toxicidade" (número eudract/RSO: 2016-002732-32) (Figura 1). Os pacientes selecionados foram submetidos à avaliação da dosimetria com base no estado de desempenho. Todos os pacientes assinaram consentimento informado. Antes do tratamento, cada paciente foi submetido a uma tomografia completa do corpo de 68Ga-PSMA-11 PET/CT.
NOTA: É importante ressaltar que algumas etapas estão ligadas especificamente ao scanner utilizado.
1. Imagem de pré-infusão: Transmissão e aquisição de imagens em branco
NOTA: Nesta primeira aquisição de imagem é avaliada a espessura equivalente de água do paciente. Este valor é usado para correção de atenuação de contagens derivadas de imagens planares 2D adquiridas após 177injeção Lu-PSMA-617.
- Defina collimadores de baixa resolução de alta resolução (LEHR).
- Abra a aquisição do protocolo de imagem na estação de trabalho e selecione a aquisição de imagem planar de corpo inteiro.
- Verifique a velocidade da tabela (por exemplo, 7 cm/min) e zoom (por exemplo, 1). Mantenha esses valores iguais para a aquisição de varredura em branco. Verifique se a opção Contorno Corporal está desativada.
- Posicione o paciente no sofá com os braços em repouso ao longo do lado do corpo. Use esta posição para todas as imagens. Se necessário, use suportes disponíveis (apoio de braço, cunha do joelho, travesseiro, cobertor).
- Anote a posição exata do paciente, utilizando o número de escala ao longo do sofá: posição da cabeça do vértice, posição do joelho, posição do pé, altura do sofá, todos os suportes utilizados. Anote o peso e a altura do paciente.
- Coloque as cabeças duplas SPECT nas posições opostas (ou seja, 0° e 180°) e na distância máxima do centro FOV. Levante o sofá para que o paciente esteja posicionado no centro FOV e com a cabeça no centro detector.
- Posicione o suporte de inundação 57Co na câmera posterior e, em seguida, o 57Co inundar-se sobre o suporte. Iniciar aquisição de imagem.
- No final da aquisição de imagem, remova a inundação e suporte da 57Co. Pressione Descarregar no pingente de ensino. Ajude o paciente a se levantar.
- Repita a aquisição de imagem da mesma forma, mas sem o paciente posicionado no sofá.
NOTA: A velocidade do sofá, a altura da mesa e a distância da câmera devem ser definidas no mesmo valor da imagem de transmissão anterior.
2. Aquisição de imagem pós-infusão: Imagem Planar
NOTA: As aquisições pós-imagem planar são utilizadas para uma avaliação eficaz de meia-vida e média de doses absorvidas de diferentes estruturas.
- Adquira a primeira imagem 0,5-1 h após 177infusão Lu-PSMA-617 (dia 1, Figura 1).
- Adquira a primeira imagem antes da bexiga anular. Se o paciente sentir uma necessidade urgente de esvaziamento da bexiga, forneça um vaso adequado para a coleta de urina. Tome cuidado para incluir o vaso (ou saco de urina se o paciente tiver um cateter) na imagem.
- Coletar uma amostra de sangue de 2 mL, fechar o tubo de coleta e colocá-lo em uma caixa blindada, observando a hora.
- Mude para collimador de alta resolução de energia média (MEHR).
- Abra a aquisição do protocolo de imagem na estação de trabalho e selecione a aquisição de imagem planar de corpo inteiro. Verifique a velocidade da tabela (por exemplo, 7 cm/min) e zoom (por exemplo, 1). Mantenha esses valores iguais para todas as outras imagens. Verifique se a opção Contorno Corporal está desativada.
- Posicione o paciente no sofá, garantindo que a posição seja a mesma usada para a imagem anterior (ou seja, pré-infusão de transmissão).
- Coloque as cabeças duplas SPECT em posições opostas (ou seja, 0° e 180°). Levante a mesa para que o paciente esteja posicionado no centro FOV e com a cabeça no centro do detector.
- Utilizando o pendente ensinar, ajuste manualmente a posição da câmera posterior (ou seja, posicionada a 180°) para atingir a distância mínima do perfil inferior do sofá.
- Ajuste manualmente a posição da câmera anterior (ou seja, posicionada a 0°) para atingir a distância mínima do perfil do paciente. Leve em conta toda a superfície do corpo ao longo de toda a altura do paciente para evitar colisão durante a varredura.
- Tomando nota da posição dos cabeças do duelo, comece a aquisição de imagem.
- No final da aquisição de imagem, pressione Descarregar no pingente de ensino e ajude o paciente a se levantar.
- Repita a mesma aquisição de imagem com as mesmas configurações de câmera às 16-24 h (segunda imagem, dia 2), 36-48 h (terceira imagem, dia 3). Imagens adicionais (uma ou mais) podem ser adquiridas até 120 h após a infusão (por exemplo. 66-70 h e 120 h) com base na conformidade do paciente e recursos da Instituição.
- Coletar uma amostra de sangue de 2 mL ao mesmo tempo que a aquisição de imagem SPECT, feche o tubo de coleta e coloque-o em uma caixa blindada, fazendo uma anotação da época.
3. Aquisição de imagem pós-infusão: 3D SPECT/CT
NOTA: No dia 2 (16-24 h pós-infusão) é realizada uma aquisição de imagem 3D, juntamente com a aquisição de imagem planar. A imagem 3D SPECT/CT concentra-se na região abdominal e permite que a sobreposição de órgãos (por exemplo, rins ou laços intestinais) seja evitada em projeções anteriores/posteriores.
- Após a aquisição de imagem planar, selecione a imagem 3D SPECT/CT dentro do protocolo de dosimetria na estação de trabalho.
- Verifique se os parâmetros de imagem adequados foram definidos: modalidade de aquisição (por exemplo, passo-e-tiro), ângulo por projeção (por exemplo, 5°), número de quadros por rotação (por exemplo, 72), duração do quadro (por exemplo, 3.000 ms). Verifique se o Contorno Corporal está desativado.
- Posicione o detector na distância máxima do centro para evitar colisão. Posicione o paciente com os braços levantados sobre a cabeça. Posicione a mesa do paciente dentro da câmera até quando a região desejada estiver centrada no detector (por exemplo, rins e uma lesão específica situada na mesma região). Iniciar aquisição de imagem.
- Adquira a imagem de tomografia correspondente.
- No final da aquisição de imagem, pressione Descarregar no pingente de ensino e ajude o paciente a se levantar.
4. Análise de Imagens
NOTA: Correções de dispersão, atenuação e antecedentes são implementadas. A massa de órgão único e a lesão são consideradas para avaliação de dose absorvida. ROI e VOI são contornados em imagens planares e 3D.
- Envie todas as imagens adquiridas da estação de trabalho de aquisição para a estação de trabalho de análise.
- Para todas as imagens pós-infusão, selecione imagens emissivas, baixas e altas de dispersão
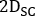 e clique no painel direito do fluxo de trabalho dedicado para criar uma imagem corrigida por dispersão, da seguinte forma:
e clique no painel direito do fluxo de trabalho dedicado para criar uma imagem corrigida por dispersão, da seguinte forma: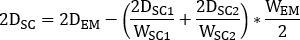
onde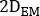
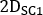 ,
, 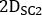 e são emissivas, menor dispersão e maior dispersão 2D imagens de corpo inteiro planar anterior ou posterior, respectivamente;
e são emissivas, menor dispersão e maior dispersão 2D imagens de corpo inteiro planar anterior ou posterior, respectivamente; 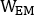 ,
, 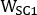
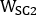 e são emissivas, menor dispersão e maiores larguras de janela de dispersão, respectivamente.
e são emissivas, menor dispersão e maiores larguras de janela de dispersão, respectivamente. - Abra cada imagem posterior, clique em Imagem,depois Reorient, Pan, Zoom..., flag Y mirror, clique em Aplicar e Sair,e depois salve a imagem girada da esquerda para a direita.
- Abrir imagens planares corrigidas anteriores e posteriores (giradas) adquiridas após a infusão pós-infusão.
- Selecione a imagem adquirida no dia 2 como a mais adequada para delineamento do ROI. Órgãos de contorno: corpo inteiro (abrangendo também vaso ou saco de urina quando necessário), rins, fígado, baço (se visível), glândulas parótidas, glândulas submandibulares, glândulas lacrimosas. Se possível, condiz com algumas lesões visíveis. Contorno dos ROIs na imagem mais útil entre visões anteriores e posteriores(Figura 2). Contorno um pequeno ROI adjacente a cada estrutura contornada para fundo.
- Copiar e colar todos os ROIs da imagem adquirida no dia 2 para as visualizações anteriores e posteriores das outras imagens adquiridas após a infusão.
- Use apenas a tradução de ROI e não modifique para manter a mesma dimensão do órgão. Para cada infusão pós adquirida, selecione a imagem anterior. Salvar ROIs contornados.
- Para cada imagem, observe as contagens médias [c] e a dimensão de pixel dentro de cada ROI (incluindo ROIs de fundo) para as visualizações anterior e posterior3.
- Transmissão anterior aberta e varreduras em branco, juntamente com ROIs delineados. Copiar e colar órgãos e lesões ROIs na varredura de transmissão. Ajuste para incompatibilidade de órgãos e, se necessário, amplie ou diminua os contornos dos órgãos para diferentes ampliações de imagem.
- Para atenuação corporal, contorno uma estrutura que abrange cabeça, ombros, peito e abdômen, evitando braços e pernas (Figura 3).
- Copie e cole todos os ROIs da transmissão para a varredura em branco.
- Avalie a espessura equivalente à água z para cada estrutura para estimar a autoatenuação. Observe as contagens médias dentro de cada ROI em ambos os exames de transmissão(i transmissão) e em branco (Iem branco). Calcular a espessura equivalente da água z como
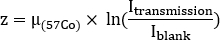
onde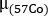 está o coeficiente de atenuação para 57Co inundação previamente medido com um fantasma uniforme.
está o coeficiente de atenuação para 57Co inundação previamente medido com um fantasma uniforme. - Use a varredura pré-tratamento 68Ga-PSMA-11 PET/CT. Órgãos de contorno na imagem da TC: rins, fígado, baço, glândulas parótidas e glândulas submandibulares. Lesões de contorno em imagens PET. Assumindo uma composição de água uniforme para cada estrutura, calcule a massa de cada estrutura contornada usando uma densidade unitária (1 g/mL).
- Realizar a reconstrução da imagem SPECT/CT, levando em conta a correção de dispersão, correção de atenuação da TC e recuperação de resolução. Defina os mesmos valores de reconstrução iterativa usados para calibração SPECT (por exemplo, números de iteração e subconjunto de OSEM, filtragem pós-reconstrução).
5. Medições da amostra de sangue
NOTA: As medições da amostra de sangue são realizadas no detector de germânio de alta pureza (HPGe) para estimativa de dose de medula vermelha.
- Deixe a amostra de sangue decair por aproximadamente 2 semanas para evitar a saturação do detector e o tempo morto alto.
- Após 2 semanas, meça uma amostra de cada vez. Devido à baixa atividade, iniciem as medições da última amostra de sangue adquirida (ou seja, a partir do dia 6).
- Posicione o tubo de coleta de amostras de sangue no suporte dedicado. Use a mesma geometria usada para a calibração HPGe. Posicione-o no detector HPGe e feche a caixa de proteção do detector.
- Abra o software para aquisição e análise de espectro. Verifique se o tempo morto é <3%. Se estiver mais alto, espere mais alguns dias e realize as medições então.
- Selecione o arquivo de calibração HPGe adequado correspondente ao suporte de geometria do tubo de coleta de 2 mL. Iniciar medições da amostra (medições mínimas de 12 h).
- Analisar o espectro identificando o pico gama médio e calculando a concentração de atividade. Observe a atividade da amostra medida e as medidas de hora e data.
- Repita as mesmas medidas e análises para todas as amostras de sangue.
6. Avaliação de dosimetria
NOTA: A análise é realizada com um software de dosimetria dedicado baseado em publicações MIRD44,5,6,7,8. Para cada estrutura considerada, a meia-vida eficaz é avaliada em imagens sequenciais 2D do corpo inteiro por ajuste de curva bi ou monoexponencial das curvas de tempo-atividade. A imagem 3D SPECT/CT é usada para resolver o problema da sobreposição do intestino de alta captação na estrutura renal, escalando as curvas de tempo-atividade derivadas de imagens planares. A dose média absorvida é então calculada para cada massa estrutural. Para avaliação da dose da medula vermelha, são utilizadas medidas de amostras de sangue e dimensionadas para o peso do paciente.
- Imagens planares
- Para cada imagem e estrutura, calcule as contagens na visão anterior (
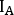 ) e posterior (
) e posterior (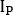 ) como
) como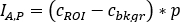
onde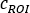 está a contagem média [c]
está a contagem média [c] 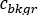 para o ROI considerado, é a
para o ROI considerado, é a 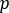 contagem média [c] na região de fundo correspondente, e é o número de pixels dentro do ROI.
contagem média [c] na região de fundo correspondente, e é o número de pixels dentro do ROI. - Para cada ROI, calcule a captação em cada ponto de tempo de imagem como
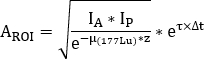
onde está o fator de correção de
está o fator de correção de  atenuação para 177Lu, é a meia-vida física de 177Lu, Δt é a diferença de tempo entre infusão e aquisição de imagem9, e z é a espessura equivalente de água avaliada na varredura de transmissão.
atenuação para 177Lu, é a meia-vida física de 177Lu, Δt é a diferença de tempo entre infusão e aquisição de imagem9, e z é a espessura equivalente de água avaliada na varredura de transmissão. - Calcule a captação relativa como
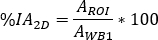
onde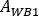
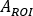 é avaliado para corpo inteiro na primeira imagem pós-infusão. Como a urina inteira está incluída na imagem, esta é considerada como referência para a atividade total efetiva infundida.
é avaliado para corpo inteiro na primeira imagem pós-infusão. Como a urina inteira está incluída na imagem, esta é considerada como referência para a atividade total efetiva infundida.
- Para cada imagem e estrutura, calcule as contagens na visão anterior (
- Imagens híbridas 2D+3D SCPET/CT
- Para calibração de atividade SPECT/CT, imagem de um fantasma cilíndrico com uma esfera central de atividade conhecida. Contornado o VOI da esfera central e calcule o fator de calibração [cps/MBq] como
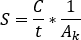
onde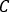 estão as contagens totais dentro
estão as contagens totais dentro  do VOI [c], o tempo de aquisição de imagem [seg] e
do VOI [c], o tempo de aquisição de imagem [seg] e  a atividade injetada conhecida [MBq] dentro da esfera central. A imagem SPECT/CT para o paciente é realizada com as mesmas configurações de parâmetro de aquisição e reconstrução.
a atividade injetada conhecida [MBq] dentro da esfera central. A imagem SPECT/CT para o paciente é realizada com as mesmas configurações de parâmetro de aquisição e reconstrução. - Abra a imagem SPECT/CT. Os volumes de interesse do contorno (VOIs) (por exemplo, rins, lesão visível) baseiam-se tanto em informações de captação quanto em morfologia computadorizada. Calcule a atividade na estrutura como
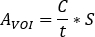
- Calcular
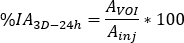
onde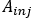 está a atividade injetada durante o tratamento.
está a atividade injetada durante o tratamento. - Calcular o fator de dimensionamento para a curva de atividade de tempo como

onde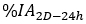 é
é 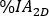 calculado a imagem planar no dia 2 (16-24 h) decaida-corrigido para meia-vida física no momento da injeção.
calculado a imagem planar no dia 2 (16-24 h) decaida-corrigido para meia-vida física no momento da injeção. - Redimensione a curva
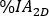 de
de 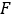 atividade temporal 2D do rim com fator em conformidade. Realizar avaliação de dosimetria com OLINDA/EXM conforme descrito abaixo.
atividade temporal 2D do rim com fator em conformidade. Realizar avaliação de dosimetria com OLINDA/EXM conforme descrito abaixo.
- Para calibração de atividade SPECT/CT, imagem de um fantasma cilíndrico com uma esfera central de atividade conhecida. Contornado o VOI da esfera central e calcule o fator de calibração [cps/MBq] como
- Fantasma masculino adulto
- Abra o software de dosimetria. Selecione o radionuclídeo (por exemplo, 177Lu) dentro do módulo De forma de entrada de Nuclide. Selecione o modelo (por exemplo, Adulto Masculino) dentro do módulo Forma de Entrada do Modelo.
- Vá para o módulo Cinética Input Form e clique em Limpar todos os dados. Clique em Ajustar para modelo e uma janela separada será aberta.
- Na coluna Tempo (Hr), insira as horas pós-infusão para cada aquisição de imagem, em formato de hora (por exemplo, 1h e 30 min será 1,50). Role o menu de órgãos e selecione órgãos de interesse (por exemplo, rins, fígado, baço).
- Para cada órgão, insira a captação
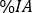 relativa em cada ponto de tempo da imagem. Clique em Atualizar.
relativa em cada ponto de tempo da imagem. Clique em Atualizar. - Para órgãos pareados (ou seja, rins) insiram um único valor
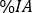 como soma das captações relativas individuais esquerda e direita . Clique em Atualizar e verifique as distribuições de pontos na parcela do lado esquerdo.
como soma das captações relativas individuais esquerda e direita . Clique em Atualizar e verifique as distribuições de pontos na parcela do lado esquerdo. - Realizar um ajuste de curva usando uma curva exponencial como
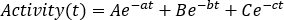
Os parâmetros A, B e C podem assumir valores positivos ou negativos para modelagem de fase de lavagem e lavagem, respectivamente. Se os dados das curvas de atividade temporal forem corrigidos pela decadência, os parâmetros a, b e c representam a metade da vida biológica e são todos positivos. Escolha um modelo de ajuste de curva apropriado entre curvas mono, bi ou triexponencial. Marque os parâmetros necessários, insira valores iniciais e clique em Encaixe até que o ajuste seja realizado. - Anote os parâmetros de ajuste da curva. Calcular a meia-vida efetiva como
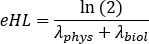
onde λphys é a meia-vida física de 177Lu, e λbiol é a meia-vida biológica do composto 177Lu-PSMA-617. Para λbiol,considere os valores mais baixos entre os parâmetros de ajuste da curva a, b e c (ou seja, correspondendo à maior meia-vida efetiva). - Repita do passo 6.3.3 ao passo 6.3.7. para cada órgão.
- Insira a captação relativa em cada ponto de tempo de imagem para o restante do corpo (ou seja, Corpo Total/Corpo Rem)subtraindo a captação relativa de todos os órgãos considerados da captação do corpo inteiro. Repita da etapa 6.3.5 para a etapa 6.3.7 para Corpo Total de Corpo/Reem. Geralmente, recomenda-se um encaixe de curva biexponencial.
- Clique em Feito e salve o modelo. O programa remonta ao módulo De forma de entrada cinética e o número de desintegrações por unidade de atividade injetada (ou seja, ND, expresso em Bq*h/Bq) é visualizado para cada órgão considerado.
- Vá para o formulário de entrada principal. Clique em Dosese, em seguida, Modifique os dados de entrada. Na caixa na parte inferior Multiplique todas as massas por:, insira a razão entre o peso do paciente e o peso fantasma masculino adulto (ou seja, 73,7 kg). Clique no Multiply all masses por: button. Todas as massas de órgãos serão então redimensionadas em conformidade. Inserir massas de órgãos únicos conforme calculado a partir da delineação da TC para os órgãos analisados. Para órgãos pareados, como rins, insira a soma das massas renais esquerda e direita. Clique em Feito.
- O relatório exibirá a dose média absorvida normalizada para atividade injetada, expressa em mGy/MBq. Tome nota da dose total absorvida para órgãos considerados (ou seja, rins, fígado, baço e Corpo Total).
- Repita para curvas de atividade de tempo derivadas do método híbrido 2D+3D SPECT/CT.
- Medula vermelha
- Realizar escala para valores sanguíneos para calcular a dose de medula vermelha.
- Calcule a captação de sangue em cada aquisição de amostra de sangue como
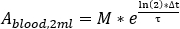
onde M é a medição de atividade [MBq] obtida com medição da amostra de sangue HPGe 2 mL. - Calcule a captação
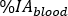 relativa do sangue como
relativa do sangue como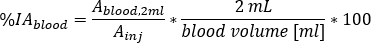
onde o volume sanguíneo [mL] é a estimativa total do volume sanguíneo para o paciente específico. Este valor é retirado dos valores fantasmas padrão Masculino Adulto10. - Redimensionar para massa de Medula Vermelha (RM) e
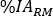 calcular a captação relativa de RM como
calcular a captação relativa de RM como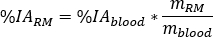
onde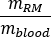 é a razão do
é a razão do 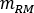 fantasma masculino adulto padrão de (massa de
fantasma masculino adulto padrão de (massa de 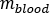 medula vermelha) igual a 1120 g e (massa sanguínea total) igual a 5000 g.
medula vermelha) igual a 1120 g e (massa sanguínea total) igual a 5000 g. - Vá para o módulo De formulário de entrada cinética e clique em Limpar todos os dados. Clique em Ajustar para modelo. Role o menu do órgão e selecione Medula Vermelha.
- Na coluna Tempo (Hr), insira as horas pós-infusão para cada aquisição de amostra de sangue em formato de hora (ou seja, 1h e 30 min será 1,50). Insira
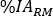 os valores de . Repita as etapas 6.3.5-6.3.7. para A Medula Vermelha.
os valores de . Repita as etapas 6.3.5-6.3.7. para A Medula Vermelha. - Role o menu do órgão e selecione Corpo Total corpo/rem . Na coluna Tempo (Hr), insira as horas pós-infusão para cada aquisição de imagem em formato de hora (ou seja, 1h e 30 min será 1,50). Insira
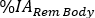 os valores
os valores 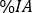 iguais à diferença entre o
iguais à diferença entre o 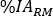 corpo inteiro calculado em imagens planares e .
corpo inteiro calculado em imagens planares e . - Repita do passo 6.3.5 para apontar para A Medula Vermelha.
- Clique em Feito e salve o Modelo.
NOTA: O programa remonta ao módulo Cinético Input Form e o número de desintegrações por unidade de atividade injetada (ou seja, ND, expresso em Bq*h/Bq) é visualizado para cada considerado. - Vá para o formulário de entrada principal. Clique em Doses. Dimensionar a massa de órgãos como a análise anterior em outros órgãos.
- Modelo de esfera
- Use um modelo de esfera de densidade unitária para estruturas que não estão disponíveis no fantasma (por exemplo, lesões, glândulas parotidas e submandibulares).
- Para o encaixe da curva, repita do passo 6.3.2 ao passo 6.3.10, substituindo os valores dos órgãos por uma captação relativa por glândulas salivares separadas e lesões.
- Clique em Feito e salve o modelo.
- O programa remonta ao módulo De forma de entrada cinética e o número de desintegrações por unidade de atividade injetada [Bq*h/Bq] é visualizado para cada órgão considerado. Tome nota de ND para cada estrutura considerada.
- Vá para O Formulário de Entrada do Modelo. Clique em Esferas.
- Para cada estrutura, insira o NDcalculado . Clique em Calcular Doses. O relatório exibirá a dose média absorvida normalizada para atividade injetada, expressa em mGy/MBq, para massas de esferas de aumento discretos (g). Encaixe a curva com encaixe monoexponencial e calcule a dose absorvida normalizada para atividade injetada (mGy/MBq) para a massa específica da estrutura.
- Para órgãos pareados (por exemplo, glândulas salivares), realize a avaliação do modelo de esfera separadamente para órgãos esquerdo e direito. Use o valor médio entre a estrutura esquerda e a direita para avaliação de dose de órgãos inteiros.
Resultados
A dosimetria foi realizada para 10 pacientes (7 em primeiro ciclo de tratamento, 3 segundo ciclo). Amostras de sangue foram adquiridas de todos, menos de 3 pacientes. Um paciente anulou a bexiga antes da primeira aquisição de imagem pós-infusão. A atividade injetada foi de 5,5 GBq para 5 pacientes e 4,4 GBq para 5 pacientes.
No que se refere ao encaixe da curva, foi utilizado o encaixe da curva mono ou biexponencial para a...
Discussão
O método descrito permite que a dosimetria do corpo inteiro seja realizada para terapias PRRT e é um compromisso válido entre informações de doimetria 2D de corpo inteiro e de dosimetria 3D, na medida em que fornece informações valiosas sem aumentar significativamente a carga de aquisição de imagens. O método também é útil para a avaliação da dose absorvida de estruturas sobrepostas e fornece informações sobre as estruturas que estão fora do campo de visão limitado 3D SPCET/CT.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Nossos agradecimentos vão para as figuras profissionais envolvidas no protocolo (ou seja, médicos, físicos e enfermeiros) e para os pacientes que concordaram em participar do estudo. Agradecemos também aos técnicos de radiologia médica da Unidade de Medicina Nuclear pela ajuda na implementação do protocolo: Valentina Mautone, Maria Caternicchia, Monia Pancisi, Daniela Fichera e Delia Bevilacqua. Os autores reconhecem Alessandro Savini e Simone Marzoni pela ajuda na gravação do vídeo. O trabalho foi parcialmente apoiado pela AIRC (Associação Italiana de Pesquisa do Câncer, número de subvenção: L2P1367 - L2P1520). A obra foi parcialmente financiada pelo Ministro da Saúde italiano.
Materiais
| Name | Company | Catalog Number | Comments |
| 177Lu EndolucinBeta | ITG - Isotopen Technologien München AG, Lichtenbergstrasse 1, 85748 Garching, Germany, info@itm.ag | Radiotracer 177Lu for therapy purpuse | |
| Biograph mCT Flow PET/CT | Siemens Healthineers, Erlangen, Germany | PET/CT scanner | |
| C-Thru 57Co planar flood - Model MED3709 | Eckert & Ziegler, Strahlen- und Medizintechnik AG, Robert-Rössle-Str. 10, 13125 Berlin, Germany, info@ezag.de | Calibration/planar source | |
| Cylindrical phantom with spheric insert | Data Spectrum Corporation, 1605 East Club Boulevard, Durham NC 27704-3406, US, info@spect.com | Phantom for SPECT/CT calibration | |
| Discovery NM/CT 670 SPECT/CT | International General Electric, General Electric Medical System, Haifa, Israel | SPECT/CT scanner | |
| GalliaPharm 68Ge/68Ga Generator | Eckert & Ziegler, Strahlen- und Medizintechnik AG, Robert-Rössle-Str. 10, 13125 Berlin, Germany, info@ezag.de | 68Ge/68Ga Generator of 68Ga for imaging purposes | |
| GammaVision v 6.08 | Ortec, Ametek - Advanced Measurement Technology, 801 South Illinois Avenue, Oak Ridge, Tennessee 37830, US, ortec.info@ametek.com | Gamma Spectorscopy software | |
| High Purity Germanium HPGe, model GEM30P4-70 | Ortec, Ametek - Advanced Measurement Technology, 801 South Illinois Avenue, Oak Ridge, Tennessee 37830, US, ortec.info@ametek.com | Gamma spectometer | |
| MimVista Software | MIM Software INC, Cleveland, OH 44122, US | Workstation | |
| OLINDA/EXM v 1.1 | RADAR - RAdiation Dose Assessment Resource, West End Ave, Nashville, TN 37235, US (now commercially available as OLINDA/EXM v 2.0, Hermes Medical Solutions, Strandbergsgatan 16, 112 51 Stockholm, Sweden, info@hermesmedical.com) | Dosimetry software | |
| PSMA 11 | ABX advanced biochemical compounds - Biomedizinische,Heinrich-Gläser-Straße 10-14, 01454 Radeberg, Germania, info@abx.de | Carrier for 68Ga radiotracer | |
| PSMA 617 | Endocyte Inc. (Headquarters), 3000 Kent Avenue, West Lafayette, IN 47906 | Carrier for 177Lu radiotracer | |
| Xeleris4.0 | International General Electric, General Electric Medical System, Haifa, Israel | Workstation |
Referências
- Matteucci, F., et al. Reduction of 68Ga-PSMA renal uptake with mannitol infusion: preliminary results. European Journal of Nuclear Medicine and Molecular Imaging. , 1-6 (2017).
- Sarnelli, A., et al. Dosimetry of 177 Lu-PSMA-617 after mannitol infusion and glutamate tablet administration: Preliminary results of EUDRACT/RSO 2016-002732-32 IRST protocol. Molecules. 24 (3), (2019).
- Stabin, M. G. . Fundamentals of nuclear medicine dosimetry. , (2008).
- Snyder, W. S., Ford, M. R., Warner, G. G., Watson, S. B. MIRD Pamphlet No. 11: "S" Absorbed dose per unt cumulate activity for selected radionuclides and organs. Society of Nuclear Medicine. , (1975).
- Bolch, W. E., et al. MIRD Pamphlet No. 17: The Dosimetry of Nonuniform Activity Distributions-Radionuclide S Values at the Voxel Level. Journal of Nuclear Medicine. 40 (17), 11s-36s (1998).
- Stabin, M. G., Sparks, R. B., Crowe, E. OLINDA/EXM: The Second-Generation Personal Computer Software for Internal Dose Assessment in Nuclear Medicine. Journal of Nuclear Medicine. 46, 1023-1027 (2005).
- Hippeläinen, E., Tenhunen, M., Mäenpää, H., Heikkonen, J., Sohlberg, A. Dosimetry software Hermes Internal Radiation Dosimetry: from quantitative image reconstruction to voxel-level absorbed dose distribution. Nuclear Medicine Communications. 38 (5), 357-365 (2017).
- Stabin, M. G., Siegel, J. A. RADAR Dose estimate report: a compendium of radiopharmaceutical dose estimates based on OLINDA/EXM version 2.0. Journal of Nuclear Medicine. 59, 154-160 (2018).
- Siegel, J., et al. MIRD pamphlet no. 16: Techniques for quantitative radiopharmaceutical biodistribution data acquisition and analysis for use in human radiation dose estimates. Journal of Nuclear Medicine. 40 (2), 37S-61S (1999).
- Valentin, J. Basic anatomical and physiological data for use in radiological protection: reference values. Annals of ICRP. 32, 5 (2002).
- Frey, E. C., Humm, J. L., Ljungberg, M. Accuracy and precision of radioactivity quantification in nuclear medicine images. Seminars in Nuclear Medicine. 42 (3), 208-218 (2012).
- Violet, J. A., et al. Dosimetry of Lu-177 PSMA-617 in metastatic castration-resistant prostate cancer: correlations between pre-therapeutic imaging and "whole body" tumor dosimetry with treatment outcomes. Journal of Nuclear Medicine. , (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados