Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Protocole de dosimétrie du corps entier pour la thérapie par radionucléide Peptide-Receptor (PRRT) : Image planaire 2D et méthodes hybrides d’image 2D-3D SPECT/CT
Dans cet article
Résumé
Cette méthode estime la dose absorbée de différentes structures pour le peptide-récepteur-radionucléide-thérapie (PRRT) avec la possibilité d’éviter le chevauchement d’organe sur les projections 2D. Les images planaires en série du corps entier permettent d’estimer les doses moyennes absorbées le long du corps tout entier, tandis que l’approche hybride, combinant des images planaires et l’image 3D-SPECT/CT, surmonte les limites du chevauchement de la structure.
Résumé
Peptide-récepteur-radionucléide-thérapie (PPRT) est une thérapie ciblée qui combine un radionucléide d’énergie à courte portée avec un substrat avec une spécificité élevée pour les récepteurs des cellules cancéreuses. Après l’injection, le radiotracer est distribué dans tout le corps, avec une absorption plus élevée dans les tissus où les récepteurs ciblés sont surexprimés. L’utilisation d’émetteurs de radionucléides bêta/gamma permet d’effectuer l’imagerie thérapeutique (bêta-émission) et l’imagerie post-thérapie (gamma-émission). Les images séquentielles post-traitement permettent le calcul de la dose absorbée en fonction de l’absorption locale et de la cinétique de lavage/lavage. Nous avons mis en place une méthode hybride qui combine des informations dérivées des images 2D et 3D. Des images et des échantillons de sang en série sont acquis pour estimer la dose absorbée à différents organes à risque et aux lésions disséminées dans tout le corps. Une seule image 3D-SPECT/CT, limitée à la région abdominale, surmonte le chevauchement de projection sur les images planaires de différentes structures telles que les intestins et les reins. La méthode hybride 2D-3D-SPECT/CT combine les informations efficaces en demi-vie dérivées des images planaires 2D avec la distribution d’absorption locale dérivée d’images 3D. Nous avons mis en œuvre cette méthodologie pour estimer la dose absorbée pour les patients subissant PRRT avec 177Lu-PSMA-617. La méthodologie pourrait cependant être mise en œuvre avec d’autres radiotracères bêta-gamma. À ce jour, 10 patients ont été inscrits à l’étude de dosimétrie avec 177Lu-PSMA-617 combinés avec des protecteurs de drogue pour des reins et des glandes salivaires (comprimés de mannitol et de glutamate, respectivement). Le rapport médian entre l’absorption rénale à 24 h évaluée sur les images planaires et 3D-SPECT/CT est de 0,45 (gamme : 0,32-1,23). La comparaison entre l’approche hybride et l’approche 3D complète a été testée sur un patient, résultant en une sous-estimation de 1,6% en ce qui concerne la pleine 3D (2D: 0.829 mGy/MBq, hybride: 0.315 mGy/MBq, 3D: 0.320 mGy/MBq). L’innocuité du traitement a été confirmée, avec une dose moyenne absorbée de 0,73 mGy/MBq (gamme: 0.26-1.07) pour les reins, 0,56 mGy/MBq (0,33-2,63) pour les glandes parotides et 0,63 mGy/MBq (0,23-1,20) pour les glandes submandibulaires, valeurs conformes aux données publiées précédemment.
Introduction
Parmi les thérapies de radionucléide de récepteur de peptide-récepteur, 177Lu-PSMA-617 PRRT combine un bêta-émetteur à courte portée 177Lu (1,9 mm de portée maximale dans l’eau, demi-vie 6,71 jours) avec un antigène à membrane prostate-spécifique (PSMA) ligand. La surexpression de PSMA dans 90-100% des lésions locales de cancer de la prostate et la maladie métastatique (ganglion lymphatique et os) est la clé de cette thérapie. Cependant, les récepteurs PSMA sont également exprimés dans différents tissus sains où une forte absorption est souvent observée pendant les traitements. Les principaux organes à risque sont les reins, la moelle rouge, la salive et les glandes lachrymales. La dose à ces organes peut réduire l’activité injectable maximale, altérant le rapport thérapeutique.
Notre institut (IRST IRCCS) a activé un protocole dans le but d’augmenter le rapport thérapeutique entre les lésions et les tissus sains, fournissant des protecteurs de drogue combinés avec 177Lu-PSMA-617 thérapie. Le mannitol, les comprimés de folate polyglutamate combinés avec des packs de glace appliqués à l’extérieur et des gouttes acides acides N-acetylaspartylglutammate sont utilisés pour la conservation des reins, de la salivaire et de la la lachrymal, respectivement1. Des études dosimétriques post-perfusion sont nécessaires pour estimer la demi-vie efficace (c.-à-d. la combinaison de la demi-vie physique et biologique) et la dose absorbée pour différentes structures d’intérêt localisées dans tout le corps (p. ex., reins, glandes salivaires, lésions disséminées). Ce scénario nécessite des informations corporelles entières obtenues en acquérant des images planaires séquentielles post-infusion du corpsentier 2. Cependant, le chevauchement des structures à absorption élevée (p. ex., l’absorption transitoire de l’intestin au-dessus des reins) nécessite des informations 3D capables de discriminer entre les différentes absorptions locales qui sont mélangées sur des projections 2D. Nous avons mis en œuvre une méthode hybride capable de fournir une évaluation dosimétrique de l’ensemble du corps grâce à des images planaires 2D2, en maintenant des informations 3D sur une région sélectionnée (par exemple, région abdominale). Cette méthode combine la distribution d’activité fournie par les images SPECT/CT 3D avec la demi-vie efficace calculée à partir d’images planaires. Les renseignements obtenus à partir d’autres structures non qui ne se chevauchent pas (p. ex., glandes salivaires) proviennent uniquement de l’étude de l’image planaire. La méthode d’échantillon de sang utilisée pour l’évaluation de moelle rouge est décrite dans une autre section.
L’avantage de l’approche hybride est que tout le corps peut être numérisé, tandis qu’une méthode 3D SPECT/CT complète limite l’extension de l’image cranio-caudale, ce qui peut rendre impossible d’étudier des structures qui sont éloignées les unes des autres. Cependant, la faible résolution d’image de l’imagerie planaire et la nécessité de mettre en œuvre une correction de chevauchement à l’aide d’une seule acquisition 3D SPECT/CT représentent les principaux inconvénients.
Afin de tester l’innocuité et l’efficacité des thérapies PRRT, il est important de comparer les données d’une seule institution avec les données publiées précédemment par d’autres groupes. La majorité des données publiées avec 177Lu-PSMA-617 sont basées sur des images planaires. Ainsi, la méthode décrite pourrait également être utile pour la normalisation des méthodologies utilisées. Enfin, il convient de noter que la mise en œuvre de la méthodologie nécessite un degré élevé de collaboration entre les différentes personnalités professionnelles impliquées (c.-à-d. médecins, physiciens, techniciens en radiologie médicale, infirmières).
Access restricted. Please log in or start a trial to view this content.
Protocole
La procédure de dosimétrie a été effectuée selon le protocole de traitement "Radiothérapie radiométabolique (RMT) avec 177Lu-PSMA-617 dans le cancer de la prostate résistant à la castration avancée (CRPC): évaluation de l’efficacité et de la toxicité" (EUDRACT/RSO numéro: 2016-002732-32)(figure 1). Les patients sélectionnés ont subi l’évaluation de dosimétrie basée sur l’état de performance. Tous les patients ont signé un consentement éclairé. Avant l’accouchement, chaque patient a subi un balayage de 68Ga-PSMA-11 PET/CT entier de corps.
REMARQUE : Il est important de souligner que certaines étapes sont liées spécifiquement au scanner utilisé.
1. Imagerie pré-perfusion : Transmission et acquisition d’images vierges
REMARQUE : Dans cette première acquisition d’image, l’épaisseur équivalente en eau du patient est évaluée. Cette valeur est utilisée pour la correction d’atténuation des comptes dérivés des images planaires 2D acquises après l’injectionLu-PSMA-617.
- Définissez des collimateurs à haute résolution à basse énergie (LEHR).
- Ouvrez l’acquisition du protocole d’image sur le poste de travail et sélectionnez l’acquisition d’images planaires de transmission entière.
- Vérifiez la vitesse de la table (p. ex. 7 cm/min) et zoomez (p. ex., 1). Gardez ces valeurs égales pour l’acquisition d’analyse vierge. Vérifiez que l’option Body Contour est désactivée.
- Placez le patient sur le canapé pieds-premier supine avec des bras au repos le long du côté du corps. Utilisez cette position pour toutes les images. Si nécessaire, utilisez les supports disponibles (soutien des bras, coin genou, oreiller, couverture).
- Prenez note de la position exacte du patient, en utilisant le numéro d’échelle le long du canapé: position de tête vertex, position du genou, position du pied, hauteur du canapé, tous les supports utilisés. Prenez note du poids et de la taille du patient.
- Réglez les têtes doubles SPECT aux positions opposées (c.-à-d. 0 et 180 degrés) et à la distance maximale du centre FOV. Soulevez le canapé de sorte que le patient soit positionné au centre FOV et avec la tête au centre du détecteur.
- Placez le support d’inondation 57Co sur la caméra postérieure, puis le 57Co se donde sur le support. Démarrer l’acquisition d’images.
- À la fin de l’acquisition d’images, retirez l’inondation et le soutien de 57Co. Appuyez sur Déchargez-vous sur le pendentif d’enseignement. Aidez le patient à se lever.
- Répétez l’acquisition d’image de la même manière, mais sans le patient positionné sur le canapé.
REMARQUE : La vitesse du couch, la hauteur de la table et la distance de la caméra doivent être définies à la même valeur que l’image de transmission précédente.
2. Acquisition d’image post-perfusion : Image Planar
REMARQUE : Les acquisitions post-image planaires sont utilisées pour une demi-vie efficace et une évaluation moyenne de la dose absorbée de différentes structures.
- Acquérir la première image 0,5-1 h après 177infusion Lu-PSMA-617 (jour 1, figure 1).
- Acquérir la première image avant l’annulation de la vessie. Si le patient ressent un besoin urgent d’annulation de la vessie, fournir un vaisseau approprié pour la collecte d’urine. Prenez soin d’inclure le vaisseau (ou le sac d’urine si le patient a un cathéter) dans l’image.
- Recueillir un échantillon de sang de 2 ml, fermer le tube de collecte et le placer dans une boîte blindée, en notant l’heure.
- Changement au collimateur à haute résolution à énergie moyenne (MEHR).
- Ouvrez l’acquisition du protocole d’image sur le poste de travail et sélectionnez l’acquisition d’images planaires de corps entier. Vérifiez la vitesse de la table (p. ex. 7 cm/min) et zoomez (p. ex., 1). Gardez ces valeurs égales pour toutes les autres images. Vérifiez que l’option Body Contour est désactivée.
- Placez le patient sur le canapé, en veillant à ce que la position soit la même que celle utilisée pour l’image précédente (c.-à-d. l’analyse de transmission pré-infusion).
- Réglez les têtes doubles SPECT à des positions opposées (c.-à-d. 0 et 180 degrés). Levez la table de sorte que le patient soit positionné au centre FOV et avec la tête au centre du détecteur.
- À l’aide du pendent d’enseignement, ajustez manuellement la position de la caméra postérieure (c.-à-d. positionnée à 180 degrés) pour atteindre la distance minimale du profil inférieur du canapé.
- Ajuster manuellement la position de la caméra antérieure (c.-à-d. positionnée à 0 degrés) pour atteindre une distance minimale par rapport au profil du patient. Prenez en compte toute la surface du corps le long de toute la hauteur du patient pour éviter la collision lors de la numérisation.
- Prenant note de la position des têtes de duel, débutez l’acquisition d’image.
- À la fin de l’acquisition d’images, appuyez sur Unload sur le pendentif d’enseignement et aidez le patient à se lever.
- Répétez la même acquisition d’image avec les mêmes réglages de caméra à 16-24 h (deuxième image, jour 2), 36-48 h (troisième image, jour 3). Des images supplémentaires (une ou plusieurs) peuvent être acquises jusqu’à 120 h post infusion (par exemple. 66-70 h et 120 h) en fonction de la conformité des patients et des ressources de l’établissement.
- Recueillir un échantillon de sang de 2 ml en même temps que l’acquisition d’image SPECT, fermer le tube de collecte et le placer dans une boîte blindée, en prenant note de l’époque.
3. Acquisition d’image post-perfusion : SPECT/CT 3D
REMARQUE : Le jour 2 (16-24 h post infusion) une acquisition d’image 3D est effectuée, ainsi que l’acquisition d’image planaire. L’image 3D SPECT/CT se concentre sur la région abdominale et permet d’éviter le chevauchement des organes (p. ex. reins ou boucles intestinales) sur les projections antérieures/postérieures.
- Après l’acquisition d’images planaire, sélectionnez l’image 3D SPECT/CT à l’intérieur du protocole de dosimétrie sur le poste de travail.
- Vérifiez que les paramètres d’image appropriés ont été définis : modalité d’acquisition (p. ex., step-and-shoot), angle par projection (p. ex., 5 degrés), nombre d’images par rotation (p. ex., 72), durée du cadre (p. ex., 3 000 ms). Vérifiez que Body Contour est désactivé.
- Placez le détecteur à la distance maximale du centre pour éviter la collision. Placez le patient avec les bras levés au-dessus de la tête. Placez la table patiente à l’intérieur de la caméra jusqu’à ce que la région désirée soit centrée sur le détecteur (p. ex., les reins et une lésion spécifique située dans la même région). Démarrer l’acquisition d’images.
- Acquérir l’image CT correspondante.
- À la fin de l’acquisition d’images, appuyez sur Unload sur le pendentif d’enseignement et aidez le patient à se lever.
4. Analyse d’images
REMARQUE : La dispersion, l’atténuation et les corrections d’arrière-plan sont mises en œuvre. La masse d’organe et de lésion simple est considérée pour l’évaluation absorbée de dose. LE ROI et le VOI sont profilés sur les images planaires et 3D.
- Envoyez toutes les images acquises du poste de travail d’acquisition au poste de travail d’analyse.
- Pour toutes les images post-infusion, sélectionnez des images de diffusion d’émuve, de faible et
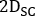 de haute et cliquez sur le panneau droit du flux de travail dédié pour créer une image corrigée de dispersion, comme suit :
de haute et cliquez sur le panneau droit du flux de travail dédié pour créer une image corrigée de dispersion, comme suit :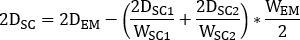
où,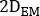
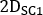 et
et 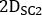 sont emissive, dispersion inférieure et plus de diffusion 2D antérieure ou postérieure planaire images du corps entier, respectivement;
sont emissive, dispersion inférieure et plus de diffusion 2D antérieure ou postérieure planaire images du corps entier, respectivement; 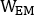 ,
, 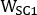
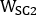 et sont emissive, faible diffusion et plus grande largeur de fenêtre d’énergie de dispersion, respectivement.
et sont emissive, faible diffusion et plus grande largeur de fenêtre d’énergie de dispersion, respectivement. - Ouvrez chaque image postérieure, cliquez sur Image, puis Réorientez, Pan, Zoom..., drapeau Y miroir, cliquez sur Appliquer et Arrêter,puis enregistrer l’image pivotée gauche-droite.
- Ouvrez les images planaires antérieures et postérieures (rotation) corrigées de la dispersion acquises après l’infusion.
- Sélectionnez l’image acquise le jour 2 comme la plus adaptée à la délimitation du retour sur investissement. Organes de contour : corps entier (englobant aussi le vaisseau ou le sac d’urine au besoin), reins, foie, rate (si visible), glandes parotides, glandes sous-mamandibulaires, glandes lachrymales. Si possible, contournent également quelques lésions visibles. Contournez les ROI sur l’image la plus utile entre les vues antérieures et postérieures (figure 2). Contour d’un petit retour sur investissement adjacent à chaque structure profilée pour l’arrière-plan.
- Copiez et collez tous les ROIs de l’image acquise le jour 2 aux vues antérieures et postérieures des autres images acquises après l’infusion.
- Utilisez uniquement la traduction de retour sur investissement et ne modifiez pas pour maintenir la même dimension d’organe. Pour chaque perfusion post acquise, sélectionnez l’image antérieure. Enregistrer les ROI profilés.
- Pour chaque image, prenez note des nombres moyens [c] et de la dimension pixel à l’intérieur de chaque retour sur investissement (y compris les IPP de fond) pour les vues antérieures et postérieures3.
- Ouvrez la transmission antérieure et les balayages vierges, ainsi que les ROI délimités. Copier et coller l’organe et les lésions ROIs sur le balayage de transmission. Ajuster pour l’inadéquation des organes, et si nécessaire, agrandir ou diminuer les contours des organes pour différents grossissement d’image.
- Pour l’atténuation du corps, contour d’une structure englobant la tête, les épaules, la poitrine et l’abdomen, en évitant les bras et les jambes(figure 3).
- Copier et coller tous les ROIs de la transmission à l’analyse vierge.
- Évaluer l’épaisseur z équivalente d’eau pour chaque structure afin d’estimer l’auto-atténuation. Prenez note des comptes moyens à l’intérieur de chaque retour sur investissement sur la transmission (Itransmission)transmission et blanc (Iblank) scans. Calculer l’épaisseur équivalente d’eau z comme
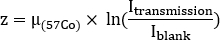
où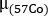 se trouve le coefficient d’atténuation pour l’inondation de 57Co précédemment mesurée avec un fantôme uniforme.
se trouve le coefficient d’atténuation pour l’inondation de 57Co précédemment mesurée avec un fantôme uniforme. - Utilisez le pré-traitement 68Ga-PSMA-11 TEP/CT. Organes de contour sur l’image de CT : reins, foie, rate, glandes parotides et glandes submandibulaires. Lésions de contour sur les images DE PET. En supposant une composition uniforme de l’eau pour chaque structure, calculer la masse de chaque structure profilée à l’aide d’une densité unitaire (1 g/mL).
- Effectuez la reconstruction d’image SPECT/CT, en tenant compte de la correction de la dispersion, de la correction d’atténuation de la CT et de la récupération de résolution. Définissez les mêmes valeurs de reconstruction itérative que pour l’étalonnage SPECT (p. ex., itération et numéros de sous-ensemble OSEM, filtrage post-reconstruction).
5. Mesures d’échantillons de sang
REMARQUE : Des mesures d’échantillon de sang sont effectuées sur le détecteur de germanium de haute pureté (HPGe) pour l’estimation de la dose de moelle rouge.
- Laisser l’échantillon de sang se décomposer pendant environ 2 semaines pour éviter la saturation du détecteur et le temps mort élevé.
- Après 2 semaines, mesurer un échantillon à la fois. En raison de la faible activité, commencez les mesures à partir du dernier échantillon de sang acquis (c.-à-d. à partir du jour 6).
- Placez le tube de collecte d’échantillons de sang sur le support dédié. Utilisez la même géométrie que celle utilisée pour l’étalonnage HPGe. Placez-le sur le détecteur HPGe et fermez le boîtier de protection du détecteur.
- Ouvrez le logiciel pour l’acquisition et l’analyse du spectre. Vérifiez que l’heure morte est de 3%. Si plus haut, attendez quelques jours de plus et effectuez les mesures alors.
- Sélectionnez le fichier d’étalonnage HPGe approprié correspondant au support de géométrie du tube de collecte de 2 ml. Démarrer les mesures de l’échantillon (minimum 12 h de mesures).
- Analyser le spectre en identifiant le pic gamma moyen et en calculant la concentration d’activité. Prenez note de l’activité mesurée de l’échantillon et des mesures de l’heure et de la date.
- Répétez les mêmes mesures et l’analyse pour tous les échantillons de sang.
6. Évaluation de la dosimétrie
REMARQUE: L’analyse est effectuée avec un logiciel dédié dosimétrie basé sur les publications MIRD4,5,6,7,8. Pour chaque structure considérée, la demi-vie efficace est évaluée sur des images séquentielles du corps entier 2D par un ajustement de courbe bi ou mono-exponentiel des courbes d’activité temporelle. L’imagerie 3D SPECT/CT est utilisée pour résoudre le problème du chevauchement de l’intestin à absorption élevée sur la structure rénale en évoluant les courbes d’activité temporelle dérivées des images planaires. La dose moyenne absorbée est ensuite calculée pour chaque masse de structure. Pour l’évaluation de la dose de moelle rouge, les mesures des échantillons de sang sont utilisées et réduites au poids du patient.
- Images Planar
- Pour chaque image et structure, calculer les
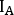 comptes sur
comptes sur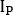 antérieur ( ) et postérieur ( )
antérieur ( ) et postérieur ( )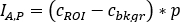
où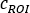 se situe le nombre moyen
se situe le nombre moyen 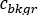 [c] pour le retour sur investissement
[c] pour le retour sur investissement 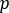 considéré, est le nombre moyen [c] dans la région de fond correspondante et est le nombre de pixels à l’intérieur du retour sur investissement.
considéré, est le nombre moyen [c] dans la région de fond correspondante et est le nombre de pixels à l’intérieur du retour sur investissement. - Pour chaque retour sur investissement, calculez l’absorption à chaque point de temps d’image
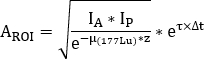
 où est le facteur de correction d’atténuation
où est le facteur de correction d’atténuation  pour 177Lu, est le 177Lu demi-vie physique, 't est le décalage horaire entre l’infusion et l’acquisition d’image9, et z est l’épaisseur équivalente d’eau évaluée sur l’analyse de transmission.
pour 177Lu, est le 177Lu demi-vie physique, 't est le décalage horaire entre l’infusion et l’acquisition d’image9, et z est l’épaisseur équivalente d’eau évaluée sur l’analyse de transmission. - Calculer l’absorption relative comme
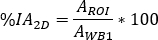
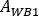 où
où 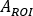 est évalué pour tout le corps sur la première image post-perfusion. Comme l’urine entière est incluse dans l’image, ceci est considéré comme une référence pour l’activité infusée efficace totale.
est évalué pour tout le corps sur la première image post-perfusion. Comme l’urine entière est incluse dans l’image, ceci est considéré comme une référence pour l’activité infusée efficace totale.
- Pour chaque image et structure, calculer les
- Images hybrides 2D-3D SCPET/CT
- Pour l’étalonnage d’activité SPECT/CT, imagez un fantôme cylindrique avec une sphère centrale d’activité connue. Contour de la sphère centrale VOI et calculer le facteur d’étalonnage [cps/MBq] comme
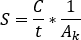
où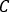 sont les nombres totaux à
sont les nombres totaux à  l’intérieur de la
l’intérieur de la  VOI [c], le temps d’acquisition d’image [sec] et l’activité injectée connue [MBq] à l’intérieur de la sphère centrale. L’image SPECT/CT pour le patient est exécutée avec les mêmes paramètres d’acquisition et de reconstruction.
VOI [c], le temps d’acquisition d’image [sec] et l’activité injectée connue [MBq] à l’intérieur de la sphère centrale. L’image SPECT/CT pour le patient est exécutée avec les mêmes paramètres d’acquisition et de reconstruction. - Ouvrez l’image SPECT/CT. Les volumes d’intérêt de contour (IPU) (p. ex. reins, lésions visibles) sont basés à la fois sur l’information d’absorption et la morphologie de la tomodéologie. Calculer l’activité dans la structure comme
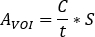
- Calculer
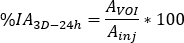
où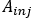 est l’activité injectée pendant le traitement.
est l’activité injectée pendant le traitement. - Calculer le facteur d’échelle pour la courbe d’activité temporelle

où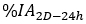
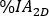 est calculé sur l’image planaire le jour 2 (16-24 h) corrigé pour la demi-vie physique au moment de l’injection.
est calculé sur l’image planaire le jour 2 (16-24 h) corrigé pour la demi-vie physique au moment de l’injection. - Redimensionner la courbe
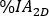 d’activité
d’activité 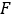 temporelle 2D du rein avec le facteur en conséquence. Effectuez l’évaluation de dosimétrie avec OLINDA/EXM comme décrit ci-dessous.
temporelle 2D du rein avec le facteur en conséquence. Effectuez l’évaluation de dosimétrie avec OLINDA/EXM comme décrit ci-dessous.
- Pour l’étalonnage d’activité SPECT/CT, imagez un fantôme cylindrique avec une sphère centrale d’activité connue. Contour de la sphère centrale VOI et calculer le facteur d’étalonnage [cps/MBq] comme
- Fantôme mâle adulte
- Logiciel de dosimétrie ouverte. Sélectionnez le radionucléide (p. ex. 177Lu) à l’intérieur du module Nuclide Input Form. Sélectionnez le modèle (p. ex. Adult Male) à l’intérieur du module formulaire d’entrée modèle.
- Rendez-vous au module formulaire d’entrée cinétique et cliquez sur Clear All Data. Cliquez sur Fit to Model et une fenêtre séparée s’ouvrira.
- Dans la colonne Time (Hr), insérer les heures après l’infusion pour chaque acquisition d’image, en format heure (p. ex., 1 h et 30 min sera de 1,50). Faites défiler le menu des orgues et sélectionnez les organes d’intérêt (p. ex., reins, foie, rate).
- Pour chaque organe, insérez l’absorption
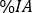 relative à chaque point de temps d’image. Cliquez sur Refresh.
relative à chaque point de temps d’image. Cliquez sur Refresh. - Pour les organes appariés (c.-à-d., les reins) insérer une seule valeur comme somme de gauche et droite des prises relatives simples
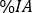 . Cliquez sur Refresh et vérifiez les distributions de points sur l’intrigue latérale de gauche.
. Cliquez sur Refresh et vérifiez les distributions de points sur l’intrigue latérale de gauche. - Effectuer un ajustement de courbe en utilisant une courbe exponentielle comme
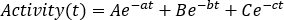
Lesparamètres A, B et C peuvent assumer des valeurs positives ou négatives pour la modélisation des phases de lavage et de lavage, respectivement. Si les données des courbes d’activité temporelle sont corrigées de la pourriture, lesparamètres , b et c représentent le biol biologique de la moitié de la vie et sont tous positifs. Choisissez un modèle approprié d’ajustement de courbe entre les courbes mono, bi ou tri-exponentielles. Signalez les paramètres requis, insérez les valeurs de départ et cliquez sur Fit jusqu’à ce que l’ajustement soit effectué. - Prenez note des paramètres d’ajustement de courbe. Calculer la demi-vie efficace comme
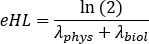
où lamoitié de la vie physique de 177Lu, et lebiol est la demi-vie biologique de 177composé Lu-PSMA-617. Pour lebiol, considérez les valeurs les plus basses parmi un, b et c paramètres de courbe-ajustement (c.-à-d., correspondant à la demi-vie effective plus élevée). - Répétez l’étape 6.3.3 à l’étape 6.3.7. pour chaque organe.
- Insérez l’absorption relative à chaque point de temps d’image pour le reste du corps (à savoir Total Body/Rem Body) en soustrayant l’absorption relative de tous les organes considérés de l’absorption de tout le corps. Répétez l’étape 6.3.5 à l’étape 6.3.7 pour total Body/Rem Body. En général, un ajustement de courbe bi-exponentielle est recommandé.
- Cliquez sur Done et enregistrez le modèle. Le programme remonte au module formulaire d’entrée kinétique et le nombre de désintégrations par unité d’activité injectée (à savoir ND, exprimé dans Bq-h/Bq) est visualisé pour chaque organe considéré.
- Aller au formulaire d’entrée principal. Cliquez sur Les doses,puis modifiez les données d’entrée. Dans la boîte au bas Multipliez toutes les masses par:, insérer le rapport entre le poids du patient et le poids fantôme mâle adulte (c.-à-d., 73,7 kg). Cliquez sur le Multiplier toutes les masses par: bouton. Toutes les masses d’organes seront ensuite redimensionnés en conséquence. Insérez des masses d’organes simples calculées à partir de la délimitation de CT pour les organes analysés. Pour les organes appariés tels que les reins, insérer la somme des masses rénales gauche et droite. Cliquez sur Done.
- Le rapport affichera la dose absorbée moyenne normalisée à l’activité injectée, exprimée dans mGy/MBq. Prenez note de la dose totale absorbée pour les organes considérés (c.-à-d. les reins, le foie, la rate et le corps total).
- Répétez l’opération pour les courbes d’activité temporelle dérivées de la méthode hybride SPECT/CT 2D-3D.
- Moelle rouge
- Effectuez la mise à l’échelle des valeurs sanguines pour calculer la dose de moelle rouge.
- Calculer l’absorption de sang à chaque acquisition d’échantillon de sang
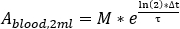
où M est la mesure d’activité [MBq] obtenue avec hpGe 2 mL mesure d’échantillon de sang. - Calculer l’absorption
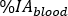 relative du sang comme
relative du sang comme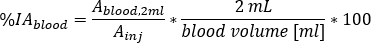
où le volume sanguin [mL] est l’estimation totale du volume sanguin pour le patient spécifique. Cette valeur est tirée des valeurs fantômes standard adult male10. - Redimensionner à red Marrow (RM) masse
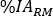 et calculer l’absorption relative RM comme
et calculer l’absorption relative RM comme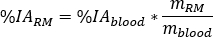
où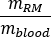 est le rapport de
est le rapport de 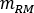 standard Adulte Mâle fantôme de (masse de
standard Adulte Mâle fantôme de (masse de 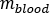 moelle rouge) égal à 1120 g et (masse de sang du corps entier) égale à 5000 g.
moelle rouge) égal à 1120 g et (masse de sang du corps entier) égale à 5000 g. - Rendez-vous au module de formulaire d’entrée cinétique et cliquez sur Clear All Data. Cliquez sur Fit to Model. Faites défiler le menu d’orgue et sélectionnez la moelle rouge.
- Dans la colonne Time (Hr), insérez les heures après l’infusion pour chaque acquisition d’échantillons de sang en format heure (c.-à-d. 1 h et 30 min sera de 1,50). Insérer
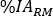 les valeurs de . Répétez les étapes 6.3.5-6.3.7. pour Red Marrow.
les valeurs de . Répétez les étapes 6.3.5-6.3.7. pour Red Marrow. - Faites défiler le menu d’orgue et sélectionnez Total Body/Rem Body. Dans la colonne Time (Hr), insérez les heures post-infusion pour chaque acquisition d’image en format heure (c.-à-d. 1 h et 30 min sera de 1,50). Insérer
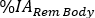 les valeurs d’égal à la différence
les valeurs d’égal à la différence 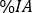
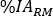 entre l’ensemble du corps calculé sur les images planaires et .
entre l’ensemble du corps calculé sur les images planaires et . - Répétez l’opération de l’étape 6.3.5 au point pour la moelle rouge.
- Cliquez sur Fait et enregistrez le modèle.
REMARQUE : Le programme remonte au module formulaire d’entrée kinétique et le nombre de désintégrations par unité d’activité injectée (à savoir ND, exprimé dans Bq-h/Bq) est visualisé pour chaque personne considérée. - Aller au formulaire d’entrée principal. Cliquez sur Doses. Échelle de masse d’organe rescaling comme analyse précédente sur d’autres organes.
- Modèle de sphère
- Utilisez un modèle de sphère de densité unitaire pour les structures qui ne sont pas disponibles dans le fantôme (p. ex., lésions, glandes parotides et submandibulaires).
- Pour l’ajustement de courbe, répétez de l’étape 6.3.2 à l’étape 6.3.10, remplaçant des valeurs d’organe avec l’absorption relative pour les glandes salivaires séparées et les lésions.
- Cliquez sur Done et enregistrez le modèle.
- Le programme remonte au module formulaire d’entrée kinétique et le nombre de désintégrations par activité injectée unitaire [Bq-h/Bq] est visualisé pour chaque organe considéré. Prenez note de ND pour chaque structure considérée.
- Aller au formulaire d’entrée modèle. Cliquez sur Sphères.
- Pour chaque structure, entrez le NDcalculé . Cliquez sur Calculer les doses. Le rapport affichera la dose absorbée moyenne normalisée à l’activité injectée, exprimée dans mGy/MBq, pour l’augmentation discrète des masses de sphère (g). Adaptez la courbe avec un ajustement mono-exponentiel et calculez la dose absorbée normalisée à l’activité injectée (mGy/MBq) pour la masse de structure spécifique.
- Pour les organes appariés (p. ex., glandes salivaires), effectuez l’évaluation du modèle de sphère séparément pour les organes gauche et droit. Utilisez la valeur moyenne entre la structure gauche et droite pour l’évaluation de la dose d’organe entier.
Access restricted. Please log in or start a trial to view this content.
Résultats
La dosimétrie a été exécutée pour 10 patients (7 subissant le premier cycle de traitement, 3 deuxième cycle). Des échantillons de sang ont été acquis de tous les patients sauf 3. Un patient a annulé la vessie avant la première acquisition d’image post-perfusion. L’activité injectée était 5.5 GBq pour 5 patients et 4.4 GBq pour 5 patients.
En ce qui concerne l’ajustement de courbe, mono ou bi-exponentiel a ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
La méthode décrite permet à la dosimétrie du corps entier d’être effectuée pour les thérapies PRRT et est un compromis valide entre 2D tout-corps et 3D informations de dosimétrie en ce qu’il fournit des informations précieuses sans augmenter considérablement la charge d’acquisition d’image. La méthode est également utile pour l’évaluation de la dose absorbée des structures qui se chevauchent et fournit des informations sur les structures situées en dehors du champ de vision limité SPCET/CT 3D.
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nos remerciements vont aux personnalités professionnelles impliquées dans le protocole (c’est-à-dire médecins, physiciens et infirmières) et aux patients qui ont accepté de participer à l’étude. Nous sommes également reconnaissants aux techniciens en radiologie médicale de l’Unité de médecine nucléaire pour leur aide à la mise en œuvre du protocole : Valentina Mautone, Maria Caternicchia, Monia Pancisi, Daniela Fichera et Delia Bevilacqua. Les auteurs reconnaissent Alessandro Savini et Simone Marzoni pour leur aide dans l’enregistrement vidéo. Les travaux ont été partiellement soutenus par l’AIRC (Association italienne pour la recherche sur le cancer, numéro de subvention: L2P1367 - L2P1520). Les travaux ont été partiellement financés par le ministre italien de la Santé.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 177Lu EndolucinBeta | ITG - Isotopen Technologien München AG, Lichtenbergstrasse 1, 85748 Garching, Germany, info@itm.ag | Radiotracer 177Lu for therapy purpuse | |
| Biograph mCT Flow PET/CT | Siemens Healthineers, Erlangen, Germany | PET/CT scanner | |
| C-Thru 57Co planar flood - Model MED3709 | Eckert & Ziegler, Strahlen- und Medizintechnik AG, Robert-Rössle-Str. 10, 13125 Berlin, Germany, info@ezag.de | Calibration/planar source | |
| Cylindrical phantom with spheric insert | Data Spectrum Corporation, 1605 East Club Boulevard, Durham NC 27704-3406, US, info@spect.com | Phantom for SPECT/CT calibration | |
| Discovery NM/CT 670 SPECT/CT | International General Electric, General Electric Medical System, Haifa, Israel | SPECT/CT scanner | |
| GalliaPharm 68Ge/68Ga Generator | Eckert & Ziegler, Strahlen- und Medizintechnik AG, Robert-Rössle-Str. 10, 13125 Berlin, Germany, info@ezag.de | 68Ge/68Ga Generator of 68Ga for imaging purposes | |
| GammaVision v 6.08 | Ortec, Ametek - Advanced Measurement Technology, 801 South Illinois Avenue, Oak Ridge, Tennessee 37830, US, ortec.info@ametek.com | Gamma Spectorscopy software | |
| High Purity Germanium HPGe, model GEM30P4-70 | Ortec, Ametek - Advanced Measurement Technology, 801 South Illinois Avenue, Oak Ridge, Tennessee 37830, US, ortec.info@ametek.com | Gamma spectometer | |
| MimVista Software | MIM Software INC, Cleveland, OH 44122, US | Workstation | |
| OLINDA/EXM v 1.1 | RADAR - RAdiation Dose Assessment Resource, West End Ave, Nashville, TN 37235, US (now commercially available as OLINDA/EXM v 2.0, Hermes Medical Solutions, Strandbergsgatan 16, 112 51 Stockholm, Sweden, info@hermesmedical.com) | Dosimetry software | |
| PSMA 11 | ABX advanced biochemical compounds - Biomedizinische,Heinrich-Gläser-Straße 10-14, 01454 Radeberg, Germania, info@abx.de | Carrier for 68Ga radiotracer | |
| PSMA 617 | Endocyte Inc. (Headquarters), 3000 Kent Avenue, West Lafayette, IN 47906 | Carrier for 177Lu radiotracer | |
| Xeleris4.0 | International General Electric, General Electric Medical System, Haifa, Israel | Workstation |
Références
- Matteucci, F., et al. Reduction of 68Ga-PSMA renal uptake with mannitol infusion: preliminary results. European Journal of Nuclear Medicine and Molecular Imaging. , 1-6 (2017).
- Sarnelli, A., et al. Dosimetry of 177 Lu-PSMA-617 after mannitol infusion and glutamate tablet administration: Preliminary results of EUDRACT/RSO 2016-002732-32 IRST protocol. Molecules. 24 (3), (2019).
- Stabin, M. G. Fundamentals of nuclear medicine dosimetry. , Springer. (2008).
- Snyder, W. S., Ford, M. R., Warner, G. G., Watson, S. B. MIRD Pamphlet No. 11: "S" Absorbed dose per unt cumulate activity for selected radionuclides and organs. Society of Nuclear Medicine. , (1975).
- Bolch, W. E., et al. MIRD Pamphlet No. 17: The Dosimetry of Nonuniform Activity Distributions-Radionuclide S Values at the Voxel Level. Journal of Nuclear Medicine. 40 (17), 11s-36s (1998).
- Stabin, M. G., Sparks, R. B., Crowe, E. OLINDA/EXM: The Second-Generation Personal Computer Software for Internal Dose Assessment in Nuclear Medicine. Journal of Nuclear Medicine. 46, 1023-1027 (2005).
- Hippeläinen, E., Tenhunen, M., Mäenpää, H., Heikkonen, J., Sohlberg, A. Dosimetry software Hermes Internal Radiation Dosimetry: from quantitative image reconstruction to voxel-level absorbed dose distribution. Nuclear Medicine Communications. 38 (5), 357-365 (2017).
- Stabin, M. G., Siegel, J. A. RADAR Dose estimate report: a compendium of radiopharmaceutical dose estimates based on OLINDA/EXM version 2.0. Journal of Nuclear Medicine. 59, 154-160 (2018).
- Siegel, J., et al. MIRD pamphlet no. 16: Techniques for quantitative radiopharmaceutical biodistribution data acquisition and analysis for use in human radiation dose estimates. Journal of Nuclear Medicine. 40 (2), 37S-61S (1999).
- Valentin, J. Basic anatomical and physiological data for use in radiological protection: reference values. Annals of ICRP. 32, 5(2002).
- Frey, E. C., Humm, J. L., Ljungberg, M. Accuracy and precision of radioactivity quantification in nuclear medicine images. Seminars in Nuclear Medicine. 42 (3), 208-218 (2012).
- Violet, J. A., et al. Dosimetry of Lu-177 PSMA-617 in metastatic castration-resistant prostate cancer: correlations between pre-therapeutic imaging and "whole body" tumor dosimetry with treatment outcomes. Journal of Nuclear Medicine. , (2018).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon