Method Article
Untersuchung der Kavitationstherapie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorgestellte experimentelle Protokoll kann verwendet werden, um Echtzeitmessungen der Kavitationsaktivität in einem Zellkulturgerät durchzuführen, mit dem Ziel, die Untersuchung der Bedingungen zu ermöglichen, die für eine erfolgreiche Wirkstoffabgabe und / oder andere Bioeffekte erforderlich sind.
Zusammenfassung
Das Interesse an den therapeutischen Anwendungen von Ultraschall ist bedeutend und wächst, mit potenziellen klinischen Zielen, die von Krebs bis zur Alzheimer-Krankheit reichen. Kavitation - die Bildung und anschließende Bewegung von Blasen innerhalb eines Ultraschallfeldes - stellt ein Schlüsselphänomen dar, das vielen dieser Behandlungen zugrunde liegt. Es besteht jedoch nach wie vor erhebliche Unsicherheit hinsichtlich der detaillierten Wirkmechanismen, durch die Kavitation therapeutische Wirkungen fördert, und es besteht die Notwendigkeit, zuverlässige Überwachungstechniken zu entwickeln, die klinisch umgesetzt werden können. Insbesondere gibt es signifikante Unterschiede zwischen den Studien bei den Expositionsparametern, von denen berichtet wird, dass sie erfolgreich therapeutische Wirkungen haben, und den entsprechenden akustischen Emissionen. Das Ziel dieses Papiers ist es, Designrichtlinien und ein experimentelles Protokoll unter Verwendung weit verbreiteter Komponenten für die Durchführung von Studien von kavitationsvermittelten Bioeffekten bereitzustellen und eine akustische Echtzeitüberwachung einzubeziehen. Es ist zu hoffen, dass das Protokoll eine breitere Einbeziehung der akustischen Überwachung in therapeutische Ultraschallexperimente ermöglicht und einen einfacheren Vergleich zwischen Studien über Expositionsbedingungen und deren Korrelation mit relevanten Bioeffekten ermöglicht.
Einleitung
Ultraschall (US) wurde aufgrund seiner sicheren und nicht-invasiven Natur, seiner einfachen Implementierung am Krankenbett eines Patienten und seiner Kosteneffizienz weit verbreitet als diagnostische Bildgebungstechnikeingesetzt 1. Neben seinen Diagnose- und Überwachungskapazitäten verfügt US über ein erhebliches Potenzial für therapeutische Anwendungen. Frühe Arbeiten untersuchten seine Verwendung in der Thrombolyse, DNA-Transfektion und Medikamentenabgabe2,3,4 und therapeutische US stellt jetzt ein sehr aktives Forschungsgebiet dar, mit Anwendungen wie Tumorbehandlung5,6,7, Immuntherapie8,9, Blut-Hirn-Schranke (BBB) Störung10,11,12, Thrombolyse13,14,15und bakterielle Infektionsbehandlung16,17. Ein Schlüsselphänomen, das diesen Anwendungen zugrunde liegt, ist die Kavitation: die Keimbildung, das Wachstum und die Schwingung gasförmiger Hohlräume aufgrund von Änderungen des Flüssigkeitsdrucks18,19.
Es gibt eine Reihe von Mechanismen, durch die Kavitation biologische Effekte hervorruft. Zum Beispiel kann die hochgradig nichtlineare Natur von Blasenoszillationen unter dem Einfluss eines angewandten US-Feldes Mikroströmungen in der umgebenden Flüssigkeit erzeugen, die sowohl die Konvektion des Arzneimittels20 verstärken als auch Scherspannungen auf das Gewebe in der Nähe der Blasen ausüben können. Dies ist besonders häufig, wenn sich Blasen in der Nähe einer Grenze befinden, wodurch Blasen nicht-sphärisch oszillieren und möglicherweise die Arzneimittelaufnahme durch scherinduzierte Permeabilisierung fördern können21,22,23,24. Bei höheren Drücken werden größere Amplitudenschwingungen und ein schneller Blasenkollaps beobachtet, die direkte mechanische Spannung25 mit sich bringen und häufig Stoßwellen erzeugen, und daraus resultierende große Druckgradienten, die Gewebe stören und permeabilisieren können26,27. Der Kollaps von Blasen in der Nähe einer Oberfläche kann auch zur Bildung von flüssigen Hochgeschwindigkeits-Mikrojetsführen 28,29,30. Diese Mikrojets können in Gewebe eindringen, wodurch poren erzeugt oder sekundäre Spannungswellen induziert werden31,32. Die Permeabilisierung biologischer Membranen sowohl auf Gewebe- als auch auf zellulärer Ebene wird verschiedentlich als Sonophorese bezeichnet, die hauptsächlich im Zusammenhang mit der US-induzierten Verbesserung der Hautpermeabilität33,34und der Sonoporation verwendet wird, hauptsächlich zur Beschreibung der reversiblen Permeabilisierung der Zellmembran aufgrund der Bildung von Membranporen35,36.
Die viskose Absorption in der unmittelbar die oszillierenden Blase umgebenden Flüssigkeit kann einen erheblichen Erwärmungseffekt erzeugen37. Darüber hinaus erzeugen die stark nichtlinearen Schwingungen akustische Strahlung bei Frequenzen, die höher sind als das treibende US-Feld. Dies führt zu einer erhöhten Absorption im umgebenden Gewebe und weiterer Erwärmung38. Der Blasenkollaps kann auch von chemischen Effekten aufgrund der vorübergehenden hohen Temperaturen und Drücke im Blasenkern begleitet sein, wie z. B. die Erzeugung hochreaktiver Spezies und elektromagnetischer Strahlung, bekannt als Sonolumineszenz32. Diese Effekte wurden untersucht, um mögliche Schäden und/oder Aktivierung relevanter zellulärer Signalwege für dieAbgabe 39 zu bewerten und bei der lokalen Aktivierung lichtempfindlicher Medikamente in einem Ansatz zunutzen,der als sonodynamische Therapie40,41,42,43bekannt ist .
Viele US-vermittelte Bioeffekte können ausschließlich durch die Kontrolle von US-Feldparametern (Druckamplitude, Frequenz, Pulslänge und Wiederholungsfrequenz sowie Expositionsdauer) ausgelöst werden, aber die zuverlässige Erzeugung von Kavitation im biologischen Gewebe erfordert oft hohe Eingangsenergien und birgt daher ein erhöhtes Schadensrisiko. Die Einführung von exogenen oder künstlichen Kavitationskernen kann die Eingangsenergie, die erforderlich ist, um die breite Palette der oben diskutierten Effekte zu erzeugen, erheblich reduzieren und führt weiter zu zusätzlichen Effekten, die mit den USA allein möglicherweise nicht möglich sind. Kavitationskerne umfassen Gasblasen26,44, flüssige Tröpfchen45,46,47 und feste Partikel48,49,50, wobei nanoskalige Kavitationskerne ein emergentes Untersuchungsgebiet für ihre Vorteile in Bezug auf verlängerte Zirkulationszeit, verbesserte Extravasation und verlängerte Kavitationsaktivität sind49,51,52,53.
Die am häufigsten verwendeten Kerne sind Gasmikroblasen (MBs), die ursprünglich als Kontrastmittel in der diagnostischen Bildgebung verwendet wurden. Sie haben typischerweise einen Durchmesser von 1-2 Mikrometern und enthalten einen Kern eines hochmolekularen Gases mit geringer wässriger Löslichkeit im umgebenden Medium. Der Kern ist von einer schützenden Lipid-, Protein- oder Polymerhülle umgeben, die am häufigsten aus Phospholipidenbesteht 54. Wenn sie einem US-Feld ausgesetzt sind, führt die Kompressibilität der MBs dazu, dass sie volumetrischen Schwingungen unterliegen, wodurch eine starke akustische Streuung erzeugt wird, die für den Erfolg von MBs als Kontrastmittel verantwortlich ist. Wie bereits erwähnt, führen diese Schwingungen auch zu den oben genannten mechanischen, thermischen und chemischen Effekten, die in therapeutischen Anwendungen genutzt werden können. Das MB-Beschichtungsverfahren bietet auch einen Mechanismus zur Verkapselung von Arzneimitteln innerhalb der MB-Struktur und zum Anbringen von Arzneimitteln und/oder Zielspezies an der MB-Oberfläche. Diese Technik erleichtert die ausgelöste Freisetzung von Medikamenten zur Verringerung der systemischenToxizität 55. Es wurde kürzlich auch gezeigt, dass Material von der MB-Oberfläche auf biologische Strukturen übertragen werden kann, wodurch die Wirkstoffabgabe durch sogenanntes "Sonoprinting" verbessert wird56,57,58.
Die Überwachung der US-vermittelten Kavitationsaktivität kann Einblicke in die resultierenden biologischen Effekte sowohl in vitro als auch in vivo geben und ermöglicht möglicherweise die Abstimmung und Optimierung dieser Effekte. Die beiden am weitesten verbreiteten Methoden zur Überwachung der Kavitationsaktivität sind i) optische, die Ultrahochgeschwindigkeits-Videomikroskopie verwenden und im Allgemeinen nicht in vivo durchführbarsind; und ii) akustische, die die wieder abgestrahlten Schallfelder aufzeichnen, die durch oszillierende und/oder kollabierende Blasen erzeugt werden. Sowohl die Amplituden- als auch die Frequenzkomponenten des akustischen Signals enthalten Informationen über das Blasenverhalten. Es wurde gezeigt, dass niedrige Konzentrationen von Blasen bei niedrigen einfallenden US-Amplituden überwiegend harmonische Emissionen erzeugen (ganzzahlige Vielfache der Antriebsfrequenz)59. Wenn der Antriebsdruck zunimmt, kann das Blasenemissionsspektrum auch fraktionierte Komponenten enthalten, die als Subharmonik und Ultraharmonik60 bekannt sind und ein stärkeres nichtlineares Verhalten anzeigen, sowie Breitbandrauschen, das auf Trägheitskavitation hinweist. Ganzzahlige Oberschwingungen sind ein Primärindikator für Blasenschwingungen, können aber auch durch Nichtlinearitäten überall in einem experimentellen System verursacht werden, z. B. aufgrund nichtlinearer Ausbreitung. Im Gegensatz dazu korrelieren fraktionierte Oberschwingungen und Breitbandrauschen sehr stark mit der Blasendynamik.
Die Beziehung zwischen dem Blasenverhalten und den detektierten akustischen Emissionen kann durch Faktoren wie das einfallende US-Feld, die Keimbildungsumgebung und die Eigenschaften des Detektionspfads60erschwert werden. Dennoch können wichtige Informationen über das Blasenverhalten und deren Wechselwirkungen mit Zellen gewonnen werden, indem Frequenz- und Energietrends im akustischen Spektrum erkannt werden. Diese Daten können auch wertvolle Informationen liefern, die als Grundlage für klinische Behandlungsüberwachungstechniken verwendet werden können. Um diese Informationen voll ausschöpfen zu können, bedarf es der Entwicklung robuster, übersetzbarer und reproduzierbarer experimenteller Methoden.
Derzeit gibt es erhebliche Unterschiede in den berichteten Protokollen für das Design von Systemen und die Durchführung von Studien zur Unterstützung der Entwicklung von kavitationsgestützten Therapien. In Bezug auf die Apparatur wurde eine Reihe von Designansätzen verfolgt. Mehrere Gruppen haben Parallelplattenkammern56,61,62,63verwendet,entweder kundenspezifisch oder kommerziell erhältlich (z. B. OptiCell, ThermoFisher Scientific). Hu et al. (2013) entwickelten eine Zellkammer in Verbindung mit einem US-Beschallungsmodul und einer konfokalen Echtzeitbildgebung64,Carugo et al. (2015) verwendeten ein System, das eine kommerziell erhältliche Zellkulturschale mit einem maßgeschneiderten PDMS-Deckel umfasst, um das Eintauchen in ein Wasserbad während der US-Exposition zu ermöglichen65,und Pereno et al. (2018) verwendeten ein Gerät, das aus geschichteten akustofluidischen Resonatoren besteht, die eine gleichzeitige optische und akustische Charakterisierung der Blasendynamik und Blasenzellinteraktionen ermöglichen66. Die Verwendung von maßgeschneiderten und anwendungsspezifischen Designs erschwert die Charakterisierung des US-Feldes und anderer Umweltexpositionsbedingungen, was Vergleiche zwischen Studien schwierig macht. Zum Beispiel gibt es erhebliche Unterschiede bei den US-Parametern, die für eine erfolgreiche Sonoporation identifiziert wurden, darunter Mittenfrequenzen von 0,02 bis 15 MHz, Tastzyklen von 1% bis Dauerwelle und seltene Drücke von 0,1 bis 20 MPa23,64,67,68,69,70 ( Tabelle1). Ähnlich stark variieren die spektralen Komponenten (Oberschwingungen, Unteroberschwingungen usw.), die als mit bestimmten Bioeffekten assoziiert identifiziert wurden.
Ziel dieser Arbeit ist es daher, ein leicht reproduzierbares Systemdesign und Implementierungsframework für die In-vitro-Untersuchung kavitationsinduzierter zellulärer Bioeffekte unter spezifischer Einbeziehung einer Kavitationsüberwachungsfähigkeit bereitzustellen.
Protokoll
1. Prinzipien des Systemdesigns
HINWEIS: In diesem Abschnitt werden die Entwurfsprinzipien für die Erstellung von Systemen für die Überwachung der Exposition und Kavitation in den USA erläutert. Diese Prinzipien werden mit zwei bestehenden Systemen für die akustische Transfektion (SAT) veranschaulicht (siehe Abbildung 1). Jedes System besteht aus einem Zellexpositionskompartiment, einer US-Quelle und einem Einzelelementwandler, der als passiver Kavitationsdetektor (PCD) fungiert und alle in eine Benchtop-Testkammer integriert sind. Diese Designs bauen auf der früheren Systementwicklung auf, die in Carugo et al. (2015)65beschrieben wurde.
- Maximieren Sie die Benutzerfreundlichkeit.
- Machen Sie das Zellexpositionskompartiment kompatibel mit bestehenden Kulturtechniken und Bildgebungssystemen, indem Sie vorhandene kommerzielle Zellkulturgeräte als Aussaat- / Wachstumssubstrate verwenden.
- Verwenden Sie für SAT2 eine Kulturschale (35 mm Durchmesser, von denen ein Bereich von 21 mm Durchmesser beobachtbar ist, siehe Materialtabelle).
- Verwenden Sie für SAT3 einen Transwell-Einsatz (6,5 mm Durchmesser, siehe Materialtabelle). Die Transwells haben eine durchlässige Membran und müssen daher in Zellmedien und nicht in Wasser platziert werden.
- Machen Sie das Zellexpositionskompartiment kompatibel mit bestehenden Kulturtechniken und Bildgebungssystemen, indem Sie vorhandene kommerzielle Zellkulturgeräte als Aussaat- / Wachstumssubstrate verwenden.
- Ermöglichen Sie ein schnelles Laden und Versiegeln des Zellexpositionsraums.
- Bilden Sie das SAT2-Zellen-Expositionsfach, indem Sie einen flexiblen Polymerdeckel über die Kulturschale drücken (Carugo et al. 201565). Wie in Abbildung 1Czu sehen ist, hat der Deckel ein Paar Löcher mit einem Durchmesser von 1,2 mm, die es ermöglichen, das Fach mit einer stumpfen 18-G-Nadelspritze zu füllen. Nach dem Befüllen verschließen Sie diese Füllöffnungen mit kurzen Kunststoffstäben (Materialtabelle).
- Füllen Sie das SAT3-Fach mit einer Spritze oder Pipette und versiegeln Sie es, indem Sie einen Gummistopfen/-stopfen andrücken.
- Ermöglichen Sie ein schnelles Laden des versiegelten Zellexpositionsraums in die Prüfkammer. In die Kammerdeckel wurden Halterungen für die Zellexpositionsfächer eingebaut, wo ein leichter Einpressverschluss ausreicht, um eine ordnungsgemäße Ausrichtung zu gewährleisten. Mit den in Abbildung 1gezeigten Systemen kann die Zeit für Probenwechsel bis zu 20 Sekunden betragen, wenn mehrere Zellexpositionskompartimente im Voraus vorbereitet wurden.
- Minimieren Sie das interne Volumen der Kammer, damit das System tragbar ist und die Menge an benötigtem Wasser / Medien minimiert werden kann. Dies beschleunigt auch die Erholung von versehentlichem Verschütten oder Austreten von Kavitationsmitteln aus dem Zellexpositionskompartiment.
HINWEIS: Das SAT2-Innenvolumen beträgt ca. 0,8 L. Das SAT3-Innenvolumen beträgt ca. 7,6 l – größer gemacht, um das Laden und Wechseln des Quellwandlers oder seiner Konfiguration zu erleichtern. Eine Innenkammer von 0,3 L wurde hinzugefügt, um das Einwegvolumen zu minimieren und die Verwendung von biologisch relevanten Flüssigkeiten außer dem Tankfüllwasser (z. B. Zellkulturmedien) zu ermöglichen. Der innere Kammerboden besteht aus 30 μm dickem Mylarblech, um eine maximale akustische Übertragung zu ermöglichen. - Machen Sie die Kammer und die internen Komponenten nach Möglichkeit aus optisch klaren Materialien, so dass Eventuelle Probleme (z.B. Leckagen, eingefangene Makroblasen) schnell beobachtet und behoben werden können.
- Maximierung der akustischen Durchlässigkeit des Belichtungsraums.
- Maximieren Sie die Übertragbarkeit durch die Auswahl an Fachwandmaterialien und -stärken. Unter der Annahme, dass die Flüssigkeiten auf beiden Seiten einer Wand im Wesentlichen gleich sind (z. B. Wasser), beträgt die Größe des normalen Einfallsdruckdurchlässigkeitskoeffizienten71:
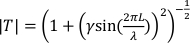 , wobei λ die Wellenlänge in der Wand der Dicke L
, wobei λ die Wellenlänge in der Wand der Dicke L 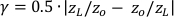 ist, und zL und zo die charakteristischen Impedanzen (Produkte aus Dichte und Schallgeschwindigkeit) für das Wandmaterial bzw. die Flüssigkeit sind. T = 1 steht für perfekte Transmission.
ist, und zL und zo die charakteristischen Impedanzen (Produkte aus Dichte und Schallgeschwindigkeit) für das Wandmaterial bzw. die Flüssigkeit sind. T = 1 steht für perfekte Transmission. - Für die Breitbandüberwachung der Kavitation (z. B. 1-8 MHz) verändern die meisten Laborpolymere (z. B. PDMS, PTFE, Polystyrol) den übertragenen Druck um nicht mehr als 10%, wenn die Dicke des Materials weniger als 1/10 einer Wellenlänge im Materialbeträgt. Diese Bedingung kann mit Standardversorgungen bei hohen Frequenzen (z. B. #1,5 Abdeckungsschlupf bei 8 MHz) schwer zu erfüllen sein, daher ist es eine gute Praxis, den Übertragungsfrequenzgang vorherzusagen oder direkt zu kalibrieren.
- Für die schmalbandige Übertragung des US-Quellsignals in das Zellexpositionskompartiment ist eine dickere Schicht zulässig, wenn es sich um ein ganzes Vielfaches einer halben Wellenlänge im Schichtmaterial handelt. Zum Beispiel wird der PDMS-Deckel in SAT2 bei einer Dicke von 2,0 mm (~ 2 Wellenlänge bei 1 MHz, cPDMS ~ 1000 m / s) verwendet.
- Maximieren Sie die Übertragbarkeit durch die Auswahl an Fachwandmaterialien und -stärken. Unter der Annahme, dass die Flüssigkeiten auf beiden Seiten einer Wand im Wesentlichen gleich sind (z. B. Wasser), beträgt die Größe des normalen Einfallsdruckdurchlässigkeitskoeffizienten71:
- Maximieren Sie den Belichtungsbereich durch Auswahl der Quelle und der Zellumgebung.
- Um die Anzahl der exponierten Zellen zu maximieren, sollten Sie den Bereich der Zellanhaftung so breit wie möglich gestalten und gleichzeitig die Kompatibilität mit den verfügbaren Kultivierungs- und Bildgebungsgeräten aufrechterhalten.
- Verwenden Sie eine US-Quelle mit einem Feld, das den Zellanhangsbereich mit minimaler räumlicher Variabilität umspannt, indem Sie den vorfokussierten Bereich einer großen fokussierten Quelle (SAT2) oder einer fokussierten oder linsengesteuerten Quelle mit einer Hauptlappenbreite verwenden, die dem Durchmesser des Zellbindungsbereichs (SAT3) entspricht. Spezifische Quellen finden Sie in der Materialtabelle.
- Minimieren Sie die feldkomplexität, die durch den Zellkompartimenthalter eingeführt wird, indem Sie das Zellkompartiment mechanisch weit weg vom stärksten Teil des einfallenden Feldes stützen, den Streuquerschnitt des Halters minimieren oder absorbierendes Material auf den Halter legen. Beispiele sind in Abbildung 1A und 1D dargestellt.
- Stellen Sie wiederholbare Belichtungsbedingungen sicher.
- Beenden Sie das akustische Feld in einer festen Grenze, um Variabilität zu eliminieren, die durch Luft-Wasser-Grenzflächen in teilweise gefüllten Kammern entstehen kann. In SAT2 und 3 wird dies durch die Installation eines akustischen Absorbers (siehe Materialtabelle)auf dem Kammerdeckel erreicht, mit einem weiteren Vorteil, die Feldkomplexität zu reduzieren, die durch Grenzreflexionen entstehen kann.
- Überwachen und zeichnen Sie die Spannung des Quellantriebs am Verstärkerausgang/Quelleingang auf, so dass geringfügige Schwankungen oder größere Fehlfunktionen schnell erkannt werden können. Verwenden Sie eine Spannungssonde oder ein anderes Gerät, das sicher über den interessierenden Antriebsspannungsbereich verwendet werden kann. Überprüfen Sie regelmäßig die Kalibrierung der Spannungssonde mit einer bekannten Quelle wie einem Wellenformgenerator.
- Steuern, überwachen und zeichnen Sie die Temperatur der Kammer und ihres Inhalts auf. Die Reaktionen von Zellen, Wandlern und Ausbreitungsmedium können alle temperaturempfindlich sein. In SAT2 erfolgt die Überwachung und Steuerung mit einem Paar Zirkulationsanschlüssen, die an eine Wasseraufbereitungsanlage angeschlossen sind, während SAT3 eine Aquarienheizung verwendet (nicht gezeigt). Stellen Sie die Wassertemperatur nach Bedarf ein, um die relevanten physiologischen Bedingungen für die therapeutische Anwendung nachzuahmen.
HINWEIS: Die Innentemperaturen können sich sowohl aufgrund externer Faktoren als auch durch die in den USA erzeugte Erwärmung des Wandlers und des Mediums ändern. - Entgasen Sie die Kammerflüssigkeit(en) vorsichtig, um die Wahrscheinlichkeit einer unbeabsichtigten Kavitation und/oder Streuung von bereits vorhandenen Blasen im Ausbreitungsweg zu minimieren.
HINWEIS: Wenn keine Entgasung durchgeführt wird, z.B. aufgrund der negativen Auswirkungen auf die Zellen, dann wird es ein erhöhtes Hintergrundniveau der Blasenaktivität geben, für das geeignet.
- Kalibrieren Sie das fertig montierte System.
- Fügen Sie ein Mittel zur Messung des Druckfeldes ein, das auf die exponierten Zellen einwird, wenn alle Systemkomponenten vorhanden sind, einschließlich des Zellexpositionskompartiments. In SAT2 und 3 wird dies durch eine Öffnung im Kammerdeckel erreicht, durch die eine Nadel oder ein faseroptisches Hydrophon eingeführt werden kann, ohne das zu messende Feld zu stören. Machen Sie die Messungen so nah wie möglich an der Stelle, an der sich die Zellen befinden.
- Wählen Sie ein Hydrophon mit einem empfindlichen Radius (einrcv),das klein genug ist, dass es das gemessene Druckfeld nicht falsch anticht. Die akzeptable Größe ist eine Funktion der Quellfrequenz (f) und des Radius ( ein src ) sowie desAbstandszwischen Quelle und Feldscan (zrcv). Ein allgemeines Kriterium für die Größenauswahl von Hydrophonen ist:
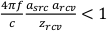 , was zu folgendem
, was zu folgendem 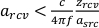 führt: , wobei c die Schallgeschwindigkeit72ist.
führt: , wobei c die Schallgeschwindigkeit72ist. - Stellen Sie sicher, dass das Hydrophon unter den bei der Systemcharakterisierung verwendeten Bedingungen kalibriert ist, einschließlich der Temperatur gemäß Abschnitt 1.6. Insbesondere wenn das Hydrophon in einem Winkel in Bezug auf die Scanebene gehalten wird, muss das Hydrophon in diesem Winkel kalibriert werden, da richtliche Effekte erheblich von denen abweichen können, die allein aufgrund der Geometrie erwartet werden. Die Änderung der Hydrophonempfindlichkeit in Bezug auf die Temperatur sollte beim Hersteller erhältlich sein.
- Scannen Sie den gesamten Bereich, in dem Zellen exponiert werden können. Um eine angemessene Ebene der Felddetails zu erfassen, verwenden Sie einen Scanabstand, der nicht gröber als1/5 einer Wellenlänge bei der höchsten Frequenz von Interesse ist. Wenn unerwartete Feldkomplexität beobachtet wird, sollten Sie die Verwendung kurzer Burst-Signale (z. B. 1-3 Zyklen) in Betracht ziehen, um die Identifizierung und Quantifizierung direkter und verstreuter Feldbeiträge zu ermöglichen.
- Integrieren Sie eine Kavitationsüberwachungsfunktion.
- Bestimmen Sie den Typ und die Platzierung des Überwachungsaufnehmers als Teil des Designs des Gesamtsystems und nicht als Nachrüstung. In der Praxis führt dies zu einem System, das maximal kompakt ist, ohne auf die Fähigkeit zu verzichten, die kritischen Systemkomponenten zuverlässig auszurichten.
- Platzieren Sie ein Kavitationsüberwachungsgerät so im System, dass es mit minimaler zusätzlicher Rüstzeit oder Störung des Workflows wiederholbar positioniert werden kann. In SAT2 wird dies mit einem piezoelektrischen Einzelelementwandler erreicht, der als PKD in den Kammerdeckel eingebaut ist, während SAT3 die PKD mit einem 90°-Reflektor in die Quellbasis integriert.
- Wählen Sie die PKD-Form entsprechend den Zielen der Experimente aus. In Abbildung 2zeigen Berechnungen der Halbamplitudenkonturen von unfokussierten (links) und fokussierten (rechts) Geräten die tiefgreifenden Unterschiede in der räumlichen Empfindlichkeit in Bezug auf die Frequenz. Das unfokussierte Gerät eignet sich besser für die Überwachung großer Bestände mit bescheidenen räumlichen Variationen in Bezug auf die Frequenz, während das fokussierte Gerät besser für radial kompakte Messungen bei den interessierenden Frequenzen geeignet ist.
- Wählen Sie die PCD-Mittenfrequenz und Bandbreite, um den Anforderungen des Experiments gerecht zu werden. Die Mittenfrequenz wird in der Regel so gewählt, dass sie mindestens fünfmal so hoch ist wie die der US-Quelle, um die Empfindlichkeit gegenüber direkten Quellenemissionen zu minimieren. Die Bandbreite wird typischerweise maximiert, um ein breites Spektrum an Blasenverhalten (Oberschwingungs- und Breitbandrauschen) zu beobachten.
- Wählen Sie Konditionierungs-, Aufzeichnungs- und Verarbeitungsmethoden aus, um die Analyse von Kavitationsdaten zu ermöglichen, wie im nächsten Abschnitt beschrieben.
2. Instrumentierung und Verarbeitung für die Kavitationsüberwachung
HINWEIS: In diesem Abschnitt werden die Signalflusskomponenten und -funktionen beschrieben, die für die Erfassung von Kavitationsüberwachungsdaten empfohlen werden, sowie die Datenverarbeitung, die zu qualitativen und quantitativen Bewertungen der Kavitationsaktivität führt.
- Instrumentierung (siehe auch Abbildung 3).
- Sofern die Anwendung kein kundenspezifisches Gerät erfordert, wählen Sie eine PKD aus der breiten Palette kommerziell erhältlicher Einzelelementaufnehmer, die typischerweise für die zerstörungsfreie Prüfung von untergetauchten Targets vermarktet werden. Diese Anbieter haben auch Verkabelung und Zubehör (z.B. den Spiegelreflektor in SAT3).
- Minimieren Sie die PCD-Reaktion auf die US-Quelle. Dies kann sowohl durch Auswahl der PKD (Mittenfrequenz und Bandbreite) als auch durch Verwendung eines Notch- oder Hochpassfilters erfolgen. Letzteres ist entweder als eigenständiges Modul oder als Teil eines Signalkonditionierungsgeräts implementierbar.
- Verwenden Sie einen Digitizer mit einem großen Dynamikbereich (mindestens 12 Bit), um so viele Daten wie möglich mit minimaler Wahrscheinlichkeit eines hohen Signalausschnitts und maximalem Signal-Rausch-Verhältnis (SNR) der kleinsten Signale zu erfassen. Überprüfen Sie beim Vergleich von Geräten die Spezifikationen für Signal zu Rauschen und Verzerrung und / oder effektive Anzahl von Bits, da dies vollständigere Beschreibungen des erreichbaren Dynamikbereichs sind. Überlegen Sie auch, ob die Größe des Speicherpuffers für die gewünschte Länge und Rate der Datenerfassung ausreicht.
- Optimieren Sie die Nutzung des Dynamikumfangs des Digitizers. PCD-Signale können mehrere Größenordnungen abdecken, sowohl aufgrund einer langen Exposition (da Blasen eliminiert werden) als auch wenn Experimente mit unterschiedlichen US-Antriebspegeln durchgeführt werden. Es ist daher zu überprüfen, ob die Signalkonditionierungskette alle Signale skaliert, damit sie ordnungsgemäß aufgezeichnet werden können.
- Schließen Sie einen Vorverstärker in die Signalkette ein, damit die kleinsten erwarteten Signale ausreichend erfasst werden können. Unserer Erfahrung nach liegt das PCD-Eigenrauschen deutlich unter dem der meisten Digitizer, so dass ein bescheidener Grad an Vorverstärkung (z. B. <100x) den SNR des Endergebnisses noch verbessern kann.
- Filtern Sie die US-Quellfrequenz vor der Vorverstärkung, um eine Sättigung des Verstärkers zu vermeiden.
- Wenn ein US-Pulser/Empfänger verwendet wird, um Verstärkungs- und/oder Filterfunktionen bereitzustellen, verwenden Sie ihn im Pulser-Modus, um die Pfadlänge/-ausrichtung zu bestätigen oder nach unerwarteten Streuern im Ausbreitungspfad zwischen der PKD und dem Zellexpositionskompartiment zu suchen.
- Ermöglichen Sie echtzeit-Streaming von Daten in den Speicher. Die SAT2- und SAT3-Systeme verwenden beide 12-Bit-Streaming-USB-Oszilloskope (siehe Materialtabelle),die über die Annehmlichkeiten der Portabilität und gut ausgebaute Benutzeroberflächen verfügen.
- Bestätigen Sie die korrekte Impedanzanpassung in der Signalkette, um Verstärkungs- oder Bandbreitenfehler zu vermeiden. PCD-Geräte haben typischerweise Ausgangsimpedanzen in der Nähe von 50 Ohm, so dass ein geeigneter Prozess darin besteht, die PCD durch ein bekanntes Signal eines Wellenformgenerators (mit 50 Ohm Ausgangsimpedanz) zu ersetzen und zu bestätigen, dass die auf dem Digitizer erscheinende Signalgröße den Erwartungen entspricht, linear skaliert, wenn das injizierte Signal geändert wird, und für das größte Signal von Interesse wird kein Clipping beobachtet.
- Vorverarbeitung
- Korrigieren Sie die Rohspannungssignale für alle bekannten Gewinne und Empfindlichkeiten im Signalpfad, die sich auf die Verarbeitung von Daten im interessierenden Frequenzbereich beziehen.
- Wenn die Daten mit DC-Eingangskopplung aufgezeichnet wurden oder anderweitig einen DC-Offset aufweisen, entfernen Sie diesen Offset durch direkte Subtraktion oder mit einem Hochpassfilter.
- Berechnen Sie das Leistungsspektrum P jedes aufgezeichneten Signals.
- Legen Sie die Fourier-Transformationslänge Nft so fest, dass die Grundfrequenz der US-Quelle f0 ein großes ganzzahliges Vielfaches der Transformationsbreite ist: N ft = nf s / f0, wobei n eine ganze Zahl und fs die Abtastrate der digitalisierten Daten ist. Stellen Sie n ≥ 50 für die klare Erfassung spektraler Merkmale ein. Für das Beispiel eines 1 MHz Fundamentals, das bei 50 MHz abgetastet wurde, ist Nft 2500 und die Bin-Breite 0,02 MHz.
- Da die Transformationslänge Nft normalerweise kleiner ist als die Dauer des aufgezeichneten Signals, verwenden Sie einen Leistungsspektraldichteschätzer(PSD)wie Welchs Methode73. Die Leistung in einem Frequenzband, das f1-f2 umfasst, ist ,
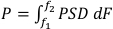 wobei dF die Breite des Transformationsbehälters ist.
wobei dF die Breite des Transformationsbehälters ist. - Um die Blasenaktivität während jeder Exposition zu charakterisieren, schätzen Sie die Beiträge zum Leistungsspektrum aus ganzzahligen Vielfachen von f0 (Oberschwingungen), ungeraden ganzzahligen Vielfachen von f0/ 2 (Ultraharmonik) und Breitbandrauschen (Trägheitskavitation).
- Der harmonische und ultraharmonische Gehalt wird am einfachsten geschätzt, indem die Werte des Leistungsspektrums bei bestimmten Frequenzen ausgewählt werden. Große Amplitudentonantworten können sich jedoch auf eine kleine Anzahl benachbarter Frequenzbehälter ausbreiten (z. B. f0 ± 2-3), so dass diese in die Schmalbandleistungsberechnungen einbezogen und von den Breitbandberechnungen ausgeschlossen werden sollten.
- Schätzen Sie die Kavitationsleistung des Breitbandbands durch Subtraktion der harmonischen und ultraharmonischen Beiträge vom gesamten Leistungsspektrum. Alternativ können diese Beiträge unter Verwendung einer ausgefeilteren Vorverarbeitung geschätzt werden74.
- Schätzen Sie die kumulative Kavitationssignalenergie über die Dauer der Exposition, vorzugsweise nach Spektrummerkmal / Blasenaktivitätstyp.
- Unter der Annahme, dass alle Datensätze die gleiche Dauer Trhatten, ist die kumulative Energie in den aufgezeichneten Daten
 , wobei M die Anzahl der Datensätze angibt.
, wobei M die Anzahl der Datensätze angibt. - Wenn es Lücken zwischen den Aufnahmen gibt, wie es bei kontinuierlicher Belichtung auftreten kann, und die gespeicherten Dateien einen Bruchteil der gesamten Expositionsdauer Teerfassen, kann die kumulative Energie wie möglich geschätzt werden als
- Schätzen Sie die Messung SNR durch Vergleich der Spektrumpegel mit denen von Hintergrundgeräuschen, die in Abwesenheit von US aufgezeichnet wurden.
3. Experimentelles Protokoll
- SAT-Vorbereitung
- Minimieren Sie die Wahrscheinlichkeit einer Kavitation im Ausbreitungsweg, indem Sie die Füllflüssigkeit (typischerweise gefiltertes Wasser) unter einem Druck von -105 Pa für mindestens zwei Stunden entgasen. Es wird empfohlen, mit einer Sonde für gelösten Sauerstoff zu bestätigen, dass der Sauerstoffpartialdruck unter 10 kPa liegt.
- Füllen Sie die Testkammer langsam, um das wiedereintragende Eindringen von Luft in die entgaste Flüssigkeit zu minimieren. Fahren Sie bei Bedarf mit der Entgasung der gefüllten Kammer fort.
- Entfernen Sie alle Restblasen von den Oberflächen des Wandlers und des Medienbehälters unmittelbar nach dem Befüllen und erneut kurz vor Beginn der Belichtungsexperimente.
- Stellen Sie sicher, dass sich die Temperatur der Kammer und ihr Inhalt stabilisiert haben, bevor Sie mit Den Expositionsexperimenten beginnen.
- Lassen Sie den US-Quellleistungsverstärker aufwärmen (gemäß Herstellerempfehlung), so dass Verstärkung und Ausgang in Bezug auf die Zeit stabil sind.
- Vorbereitung des Belichtungsfachs
- Kavitationsmittel-Suspension
- Wenn Sie das Kavitationsmittel verdünnen, rühren Sie vorsichtig und kontinuierlich um, um eine gleichmäßige Suspension zu bilden, ohne Makroblasen einzufangen oder das Mittel zu zerstören (insbesondere wenn es sich um geschälte Blasen handelt).
- Wenn Sie mit MBs arbeiten, ziehen Sie langsam mit der größten verfügbaren Messnadel ab und dosieren Sie sie, um die Zerstörung während des Ladevorgangs zu minimieren75. Eine 18 G stumpfe Füllnadel wurde regelmäßig mit den SAT-Systemen verwendet.
- Kavitationsmittel-Suspension
- SAT2 Vorbereitung
- Sterilisieren Sie den PDMS-Deckel vor der Verwendung in Experimenten mit lebenden Zellen.
- Formen Sie das Zellenbelichtungsfach, indem Sie den PDMS-Deckel an die Kulturschale andrücken.
- Bereiten Sie eine Spritze mit einer 18 G stumpfen Nadel vor und füllen Sie sie mit ca. 10 ml Flüssigkeit (z. B. MB-Suspension oder Wasserkontrolle).
- Führen Sie die Nadel durch eines der PDMS-Fülllöcher ein und füllen Sie die Kammer langsam, wobei Sie kippen, so dass Makroblasen durch das offene Füllloch entweichen können. Um optimale Ergebnisse zu erzielen, neigen Sie die Kammer so, dass sich das offene Loch über dem Füllloch befindet.
- Wenn sie gefüllt sind, schließen Sie das offene Loch, indem Sie einen kurzen (4-5 mm) Polymerstab einführen. Legen Sie die Baugruppe so fest, dass beide Bohrungen horizontal sind.
- Entfernen Sie die stumpfe Füllnadel, während Sie zusätzliche Flüssigkeit injizieren, damit keine Luft angesaugt wird. Schließen Sie das Loch mit einem anderen Polymerstab. Dieser Prozess vervollständigt die Versiegelung des Zellexpositionskompartiments.
- Überprüfen Sie das Fach visuell auf Hinweise auf eingefangene Makroblasen, und wiederholen Sie 3.3.3.-3.3.6, falls welche gefunden werden.
- Drücken Sie auf das Zellenbelichtungsfach in die Fachhalterung. Setzen Sie den Kammerdeckel auf der Kammer ein. Durch Absenken des Deckels mit einem Winkel zur Horizontalen wird verhindert, dass Makroblasen auf den untergetauchten Teilen (Absorber, Halter) ruhen.
- Berücksichtigen Sie den Auftrieb der Partikel in Suspension, wenn Sie die Ausrichtung des Zellexpositionskompartiments (z. B. schwimmende Blasen oder sinkende Nanopartikel) entscheiden und wie sich dies auf ihren Kontakt mit Zellen auswirkt.
- Verwenden Sie bei allen Operationen so wenig Kraft wie möglich, um die Biegung der Zellwachstumsoberfläche und die Ablösung der Zellen zu minimieren.
- SAT3 Vorbereitung
- Füllen Sie den Transwell mit ca. 150 μL Flüssigkeit (z. B. MB-Suspension oder Wasserkontrolle).
- Bilden Sie das Zellexpositionsfach, indem Sie das Transwell vorsichtig mit einem Gummistopfen versiegeln und überlaufene Flüssigkeit mit einem sauberen Papiertuch oder -tuch entfernen. Vor der Verwendung in Experimenten mit lebenden Zellen den Gummistopfen sterilisieren.
- Überprüfen Sie das Fach visuell auf Hinweise auf eingefangene Makroblasen, und wenn welche gefunden werden, entfernen Sie den Stecker, entfernen Sie die Makroblasen und wiederholen Sie 4.4.2.
- Drücken Sie auf das Zellenbelichtungsfach in die Fachhalterung. Setzen Sie den Kammerdeckel auf der Kammer ein. Durch Absenken des Deckels mit einem Winkel zur Horizontalen wird verhindert, dass Makroblasen auf den untergetauchten Teilen (Absorber, Halter) ruhen.
HINWEIS: Wie oben erwähnt, können Makroblasen eine Vielzahl von nicht wiederholbaren und potenziell schädlichen Auswirkungen auf US-Expositionsexperimente haben. Am kritischsten ist, dass Makroblasen, die im Zellexpositionskompartiment eingeschlossen sind, PCD-Reaktionen und lokale zelluläre Bioeffekte verursachen können, die nicht repräsentativ für die beabsichtigte Behandlung sind. Überprüfen Sie immer alle Systemkomponenten visuell, um Makroblasen zu finden und zu entfernen, bevor Sie US-Experimente starten.
4. Datenerhebung
- Ermitteln Sie die PCD-Reaktion im Hintergrund, indem Sie erste Experimente mit einem Zellexpositionskompartiment durchführen, das mit Kontrollflüssigkeit gefüllt ist (z. B. entgastes Wasser oder Zellmedien).
- Zeichnen Sie PCD-Daten auf, ohne die US-Quelle dazu zu bringen, elektronische Hintergrundgeräusche zu ermitteln.
- Zeichnen Sie PCD-Daten auf, während Sie die US-Quelle in der gesamten Bandbreite der geplanten Laufwerksebenen fahren. Diese Daten zeigen, welche Teile der akustischen Reaktion nichts mit den anschließend zu testenden Kavitationsmitteln zu tun haben.
HINWEIS: Gewöhnliche Laborflüssigkeiten (z. B. PBS oder Zellmedien) zeigen Kavitation bei moderaten Drücken (z. B. 0,5 MPa bei 0,5 MHz), wenn sie nicht entgast werden. - Bevor Sie mit den Messungen beginnen, geben Sie Zeit, damit sich die Suspension thermisch mit der Kammertemperatur ausgleichen kann. Ein Feinnadel-Thermoelement kann für diesen Zweck nützlich sein.
- Überwachen Sie die Experimente in Echtzeit sowohl im Zeit- als auch im Frequenzbereich.
- Die Zeitbereichsüberwachung der PKD zeigt, ob die Signale für die aktuellen Instrumentierungseinstellungen angemessen dimensioniert sind. Konkret ist ein Signalschnitt zu vermeiden, da er im Frequenzbereich als mehrfarbige Oberschwingungsreaktion erscheint.
- Die Zeitbereichsüberwachung der PCD zeigt auch, ob Kavitationssignale früher als erwartet gesehen werden, basierend auf der Ausbreitungszeit von der US-Quelle zum Expositionskompartiment zur PCD. Wenn solche Signale zu sehen sind, kann dies auf ein Austreten von Kavitationsmittel in die Prüfkammer hinweisen.
- Die Frequenzbereichsüberwachung der PKD zeigt die Art des Blasenverhaltens an und kann verwendet werden, um die Antriebspegel nach Bedarf anzupassen, um den gewünschten Zellreiz zu erreichen (z. B. niedrigere Antriebspegel für die harmonische Anregung).
- Um sicherzustellen, dass die ersten Belichtungen nicht verpasst werden, starten Sie den Datenerfassungsprozess, bevor Sie das US-Quelllaufwerkssignal einschalten.
- Überwachen Sie das Ausgangssignal des Verstärkers, das die US-Quelle (im Gegensatz zum Ausgang des Wellenformgenerators) während des gesamten Experiments antreibt, um sicherzustellen, dass die Belichtung wie erwartet verläuft. Verwenden Sie für diese Messung eine Hochspannungssonde und stellen Sie sicher, dass das Oszilloskop so eingestellt ist, dass es die Sondendämpfung kompensiert.
- Nachdem Sie eine Probe freigelegt haben, entfernen Sie sie vorsichtig aus der Testkammer.
- Entfernen und reinigen Sie den PDMS-Deckel (SAT2) / Gummistopfen (SAT3) in Vorbereitung auf die spätere Verwendung.
- Übertragen Sie die Kulturschale (SAT2)/Transwell (SAT3) nach Bedarf für die anschließende Analyse (z. B. Mikroskopie, Fluoreszenzbildgebung).
- Nach einer kleinen Anzahl von Expositionen (z. B. 3-5) ist es eine gute Praxis, Kavitationssignale zu Beginn der Baseline (in Abwesenheit von Kavitationsmittel) erneut zu erfassen und mit dem ursprünglichen Datensatz zu vergleichen, um sicherzustellen, dass die Kammermedien nicht kontaminiert wurden.
Ergebnisse
Abbildung 4 zeigt Beispiele für PCD-Reaktionen im Zeit- und Frequenzbereich und veranschaulicht drei verschiedene Kavitationsverhaltensweisen. Alle Daten wurden auf SAT3 unter Verwendung von SonoVue MBs gesammelt, die 5x in PBS verdünnt wurden, mit einer Endkonzentration von ~ 2 * 107 MBs / ml. Die Temperatur für alle Beispiele in diesem Abschnitt betrug 19 ± 1 °C. Die US-Quelle wurde mit einem 2,0-ms-Impuls bei 0,5 MHz angetrieben, um einfallende Spitzenunterdrücke von 0,20(Abbildung 4A und 4B),0,30(Abbildung 4C und 4D)und 0,70 MPa(Abbildung 4E und 4F)zu erreichen. Die Signalaufzeichnungen begannen 1,4 ms vor dem Start des US-Pulses t = 0. Die Inset-Spuren zeigen das Signal als aufgezeichnet (rot) und mit einem 2-MHz-Hochpassfilter (blau) für ein Zeitfenster, das zum Zeitpunkt des Fluges von der Quelle zum Zellexpositionsfach zur PCD zentriert ist. Die Low-Level-Reaktion vor dieser Zeit ist auf direkt empfangene Strahlung von der Quelle zurückzuführen, was in Konfigurationen üblich ist, in denen sich die PCD hinter der US-Quelle befindet.
Beim niedrigsten Einfallsdruck besteht die PCD-Reaktion vollständig aus ganzzahligen Oberschwingungen der 0,5 MHz US-Grundfrequenz. Die Erhöhung von 0,20 auf 0,30 MPa führt zu ausgeprägten Ultraharmoniken im Spektrum sowie zu weiteren erhöhten ganzzahligen Oberschwingungen. Die Zeitbereichswellenformen bei diesen beiden Drücken sehen ähnlich aus, obwohl die Ergebnisse von 0,30 MPa eine größere Variabilität über die Pulsdauer zeigen. Beim höchsten Druck ist die Amplitude der Zeitbereichswellenform im Verhältnis zu den niedrigeren Drücken aufgrund des deutlich erhöhten Breitbandrauschens, das im Spektrum sichtbar ist, nichtlinear gewachsen. Dieses Rauschen wird allgemein als Folge von Trägheitskavitation angesehen und entspricht in diesem Beispiel der Zerstörung von MBs.
Um dies deutlicher zu sehen, sind die PCD-Antworten als Funktion der Zeit in Abbildung 5 dargestellt. Im linken Bereich (Abbildung 5A) werden vollständige Spektren über eine Belichtungszeit von 50 Sekunden gezeigt, während der die Quelle alle 0,20 Sekunden 2,0 ms Impulse aussendete. Entsprechende Gesamt-, Oberschwingungs- und Breitbandleistungen sind im rechten Bereich dargestellt (Abbildung 5B). Die USA wurden bei t = 3,0 s eingeschaltet, zu dieser Zeit wurden Breitbandreaktionen mit großer Amplitude gesehen. Es wird angenommen, dass die anfängliche Spitze der Zerstörung der größten Blasen in der Suspension entspricht (SonoVue ist polydispers) und ist eine häufige Beobachtung in Kavitationsexperimenten mit geschälten Blasen und sogar mit nicht entgasten Medien (z. B. PBS).
Nach einigen Sekunden nahm die Breitbandreaktion schnell ab, offenbar aufgrund der Blasenzerstörung, und das Signal besteht überwiegend aus Oberschwingungen. Dies deutet darauf hin, dass das frei werdende Gas und die verbleibenden MBs stabil und nicht inerterlich vibrieren. Bei t ~ 50s ist die Breitbandkomponente auf das Niveau des ursprünglichen Hintergrundrauschens gefallen. Expositionstests wie dieser sind daher wichtig, wenn man versucht, die Zeitskalen zu verstehen, in denen verschiedene Blaseneffekte auf die Zellen in der Kammer wirken können.
Blasen werden wahrscheinlich als Reaktion auf Strahlungskräfte übersetzt, die während der US-Exposition erzeugt werden, und die Bewegung von MBs in und aus dem PCD-Sichtfeld kann zu einer erhöhten Variabilität des überwachten Kavitationssignals führen, insbesondere wenn es sich um verdünnte Suspensionen handelt. Der empfindliche Bereich der PCD sollte daher so weit wie möglich von der Zellexpositionsoberfläche überspannen. Ein Vergleich der antwortfokussierten und unfokussierten PCDs mit identischen Mittenfrequenzen (siehe Abbildung 2) ist in Abbildung 6dargestellt, wobei eine 20:1-Verdünnung von MBs in normalem PBS SAT2 verwendet wird. Die zeit- und probengemittelten Spektren in Panel Abbildung 6A zeigen, dass die unfokussierte PCD eine stärkere Breitbandantwort aufweist, begleitet von einer reduzierten Variabilität von Probe zu Probe sowohl bei harmonischen (Abbildung 6B) als auch bei ultraharmonischen Kräften (Abbildung 6C).
Es ist wichtig zu erkennen, dass Medien, die für die In-vitro-Zellarbeit verwendet werden, nicht entgast werden und ein erhöhtes Hintergrundniveau der Blasenaktivität aufweisen können. Abbildung 7 zeigt das Ansprechen von PBS in SAT2 in seiner vom Lieferanten bereitgestellten Form und nach zwei Stunden Entgasung unter Vakuum, wonach die Luftsättigung von 92% auf 46% reduziert wurde, wie mit einem optischen Sensor bestimmt (PreSens, Deutschland). Die Spektren in Abbildung 7A wurden über die Belichtungszeit und Wiederholungen mit fünf unabhängigen Proben gemittelt und zeigen deutlich erhöhte Ultraharmonik bei normalem PBS. Die über drei Oberschwingungen summierten Leistungen(Abbildung 7B)liegen deutlich innerhalb der Standardabweichung jedes experimentellen Ausgangs. Im Gegensatz dazu zeigen die ultraharmonischen Summen in Abbildung 7C, dass normales PBS fast eine Größenordnung höher ist und eine wesentlich höhere Variabilität zwischen den Proben aufweist. Diese Beispiele deuten darauf hin, dass ein gängiges zellkompatibles Medium Verhaltensweisen aufweisen kann, die (fälschlicherweise) auf das Vorhandensein von MBs zurückzuführen sind. Da es aufgrund der negativen Auswirkungen auf die Zellen und/oder die Stabilität des Kavitationsmittels in der Regel unpraktisch ist, Kulturmedium zu entgasen, ist es wichtig, in jeder kavitationsbezogenen Studie geeignete Kontrollen durchzuführen.
Abbildung 1: Abbildungen von zwei US-Expositionssystemdesigns mit Kavitationsüberwachung: SAT3 (D-F). (A) SAT2 kommentierte Baugruppe mit entfernter Seitenwand aus Gründen der Übersichtlichkeit. (B) SAT2 mit intakter Seitenwand. (C) SAT2-Zellexpositionskompartiment, zerlegt. (D) SAT3-Anmerkungsbaugruppe. (E) SAT3 in normalen (links) und linsenbesenten (rechts) Konfigurationen für die Anpassung der Strahlbreite bei verschiedenen Frequenzen. (F) SAT3-Zellen-Expositionskompartiment, zerlegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
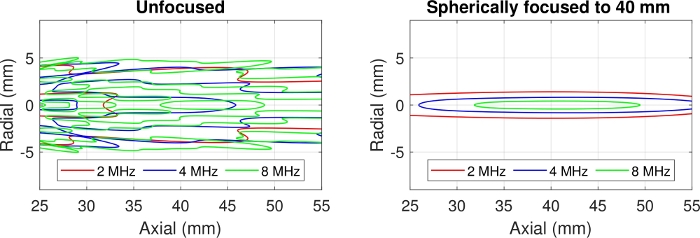
Abbildung 2: Berechnungen von Halbamplituden-Druckfeldkonturen für unfokussierte (links) und sphärisch fokussierte (rechts) Wandler mit einem Durchmesser von 12,7 mm. Frequenzen von 2, 4 und 8 MHz werden als rote, blaue bzw. grüne Konturen für ein PKD-Element am Koordinatenursprung (0,0) angezeigt. Die äußersten Konturen des unfokussierten Geräts sind relativ unempfindlich gegenüber Frequenz, aber die innere Struktur ist frequenzabhängig. Das sphärisch fokussierte Feld zieht sich mit zunehmender Frequenz zusammen, aber innerhalb der Konturen variieren die Felder sanft. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
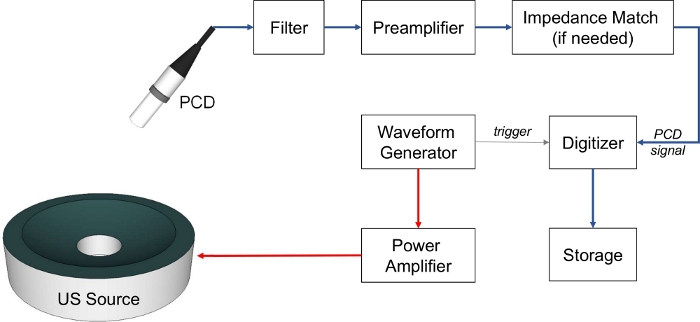
Abbildung 3: Instrumentierung für die Konditionierung und Aufzeichnung von Kavitationssignalen (blaue Pfeile), US-Quellenanregung (rote Linien) und Datenerfassungsauslösung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
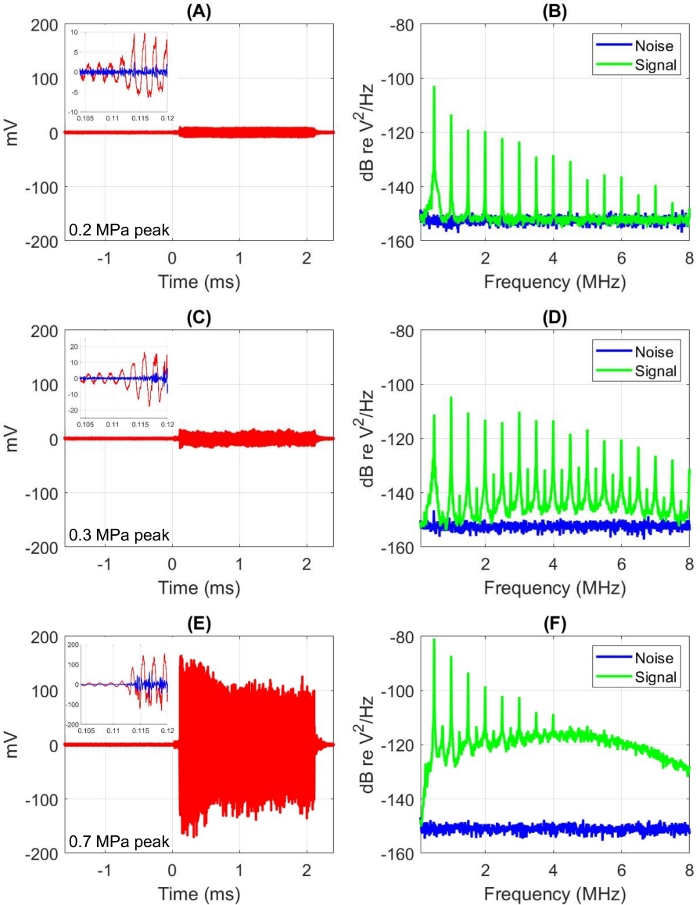
Abbildung 4: Zeit (links) und Frequenz (rechts) Domänen-PCD-Antworten, die mit 5x in PBS verdünnten MBs aufgezeichnet wurden. Die einfallenden Spitzen-Unterdrücke waren (A, B) 0,2 MPa, (C, D) 0,4 MPa, (E, F) 0,7 MPa, alle bei 0,5 MHz. Signalaufzeichnungen beginnen 1,4 ms vor dem t=0-Beginn des 2,0-ms-Ultraschallimpulses. (A, C, E) Zeitbereichssignale (rot) werden auf einer festen vertikalen Skala angezeigt, die angibt, wie sich der Reaktionspegel mit dem einfallenden Druck ändert. Die Inset-Spuren zeigen das Signal als aufgezeichnet (rot) und mit einem 2-MHz-Hochpassfilter (blau) für ein Zeitfenster, das zum Zeitpunkt des Fluges von der Quelle zum Zellexpositionsfach zur PCD zentriert ist. (B, D, F) Die spektralen Rausch- und Signalleistungsdichten werden für t<0 bzw. t>0 berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
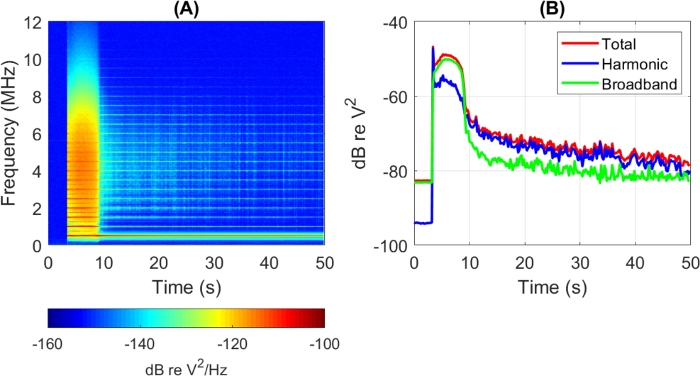
Abbildung 5: Spektrumverläufe über eine 50-Sekunden-Exposition einer Suspension von MB, die 5x in PBS verdünnt wurden. (A) Volle Spektren und (B) Gesamt-, Oberschwingungs- und Breitbandsignalleistungen, alle als Funktion der Zeit. Die Antriebsbedingungen waren 0,5 MHz, 0,7 MPa Spitzennegpressdruck, 2,0 ms Pulsdauer, 200 ms Pulswiederholzeit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
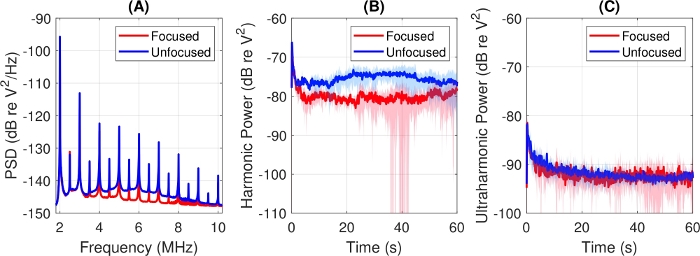
Abbildung 6: Effekt der PKD-Fokussierungsgeometrie, die mit einer 20:1-Verdünnung von Mikroblasen in normalem PBS aufgezeichnet wurde. Antriebsbedingungen waren: 1,0 MHz, 0,50 MPa Spitzennegpressdruck, 3,0 ms Pulsdauer, 10 ms Pulswiederholperiode. (A) Vollständige Spektren, gemittelt über die Belichtungszeit und drei unabhängige Probenwiederholungen. (B) Leistung in Oberschwingungen von 3, 4 und 5 MHz und (C) Leistung in 2,5, 3,5 und 4,5 MHz Ultraharmonik. Dicke Linien sind Beispielmittel, schattierte Bereiche zeigen +/- 1 Standardabweichung an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
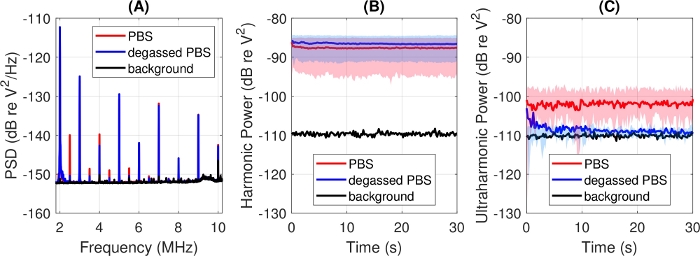
Abbildung 7: Wirkung von entgasten Medien, die mit PBS aufgezeichnet wurden. (A) Vollständige Spektren, gemittelt über die Belichtungszeit und fünf unabhängige Probenwiederholungen. (B) Leistung in Oberschwingungen von 3, 4 und 5 MHz und (C) Leistung in 2,5, 3,5 und 4,5 MHz Ultraharmonik. Dicke Linien sind Beispielmittel, schattierte Bereiche zeigen +/- 1 Standardabweichung an. Die Antriebsbedingungen waren 1,0 MHz, 0,50 MPa Spitzennegpressdruck, 1,0 ms Pulsdauer, 200 ms Pulswiederholzeit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Parameter | Einheit | Minimum | Maximum |
| Frequenz | Mhz | 0.02 | 15 |
| Druck (Peak Negativ) | Mpa | 0.1 | 20 |
| Pulslänge | Zyklen | 1 | Cw |
| Arbeitszyklus | % | 1 | Cw |
| Belichtungszeit | s | 10 | 1000 |
Tabelle 1: Zusammenfassung der Bandbreite der berichteten Parameter, die die Sonoporation in vitroerleichtern.
Diskussion
Die kritischen Schritte für jede akustische Messung wurden 1981 von Apfel76 als "Kenne deine Flüssigkeit, kenne dein Schallfeld, wisse, wann etwas passiert" gekapselt. Im Rahmen dieses Protokolls umfassen diese die Kalibrierung und Ausrichtung des Wandlers sowie die Schritte zur Wasseraufbereitung und Blasenbehandlung. Erstens ist es wichtig, dass das Hydrophon, das zur Kalibrierung des Antriebsaufnehmers und/oder der PKD verwendet wird, selbst durch regelmäßige externe Wartung oder internen Vergleich mit einem Referenzstandard genau kalibriert wird. In ähnlicher Weise muss das Ansprechverhalten sowohl des antriebsenden Wandlers als auch der PKD regelmäßig charakterisiert werden, um eine Änderung der Leistung und / oder einen Verlust der Empfindlichkeit zu überprüfen. Wenn die Fahrbedingungen und die Empfangsempfindlichkeit des Systems unbekannt sind, kann auf einen sinnvollen Zusammenhang zwischen Expositionsbedingungen, Bioeffekten und akustischen Emissionen nicht schließen. In direktem Zusammenhang damit muss die Ausrichtung der Aufnehmer zueinander und zur Probenkammer sorgfältig überprüft werden, um sicherzustellen, dass die Expositionsbedingungen innerhalb der Kammer wie erwartet sind und das Probenahmevolumen für die PKD dem interessierenden Bereich entspricht. Wie bereits erwähnt, können die Temperatur und der Gasgehalt des suspendierenden Mediums die Endergebnisse erheblich beeinflussen, und die Konsistenz ist in dieser Hinsicht äußerst wichtig77,78. In ähnlicher Weise erfordern die Herstellung, Charakterisierung und Handhabung der Kavitationsmittelsuspension sehr genaue Aufmerksamkeit, um sicherzustellen, dass die erwartete Größenverteilung und Konzentration der Partikel in der Probe vorhanden ist. Wenn beispielsweise die Konzentration von Blasen zu hoch ist, wird das Probenvolumen effektiv vor dem einfallenden US-Feld abgeschirmt. MB-Wirkstoffe sind besonders anfällig für Zerstörung und Verschmelzung, und weitere Hinweise zu ihrer Handhabung finden sich in Mulvana et. al. (2012)79.
Ein sehr häufiges Problem bei der Erkennung von Kavitationssignalen ist das Erreichen eines adäquaten SNR. Dies ist zum Teil auf die Art des Signals selbst zurückzuführen, wie beschrieben, kann aber auch auf Quellen elektrischen Rauschens innerhalb des Versuchsaufbaus zurückzuführen sein. Die Überprüfung der Verbindungen zwischen Systemkomponenten, insbesondere solchen mit koaxialen Kabeln, kann dazu beitragen, einige davon zu eliminieren. Der Austausch oder die Reparatur von Koaxialkabeln kann erforderlich sein. Das Identifizieren und Entfernen oder Deaktivieren anderer Geräte im Labor wie Pumpen, die elektrische Geräusche verursachen können, kann ebenfalls hilfreich sein. Eine schlechte Übereinstimmung der elektrischen Impedanz zwischen den Systemkomponenten kann eine weitere Ursache für ein schlechtes Signal-Rausch-Verhältnis und möglicherweise auch für Schäden an Geräten sein und sollte sorgfältig überprüft werden. Die Auslöseeinstellungen am Signalgenerator und Oszilloskop sollten ebenfalls überprüft werden, um zu bestätigen, dass sie für das Experiment entsprechend konfiguriert sind und nicht auf die Standardeinstellungen des Herstellers zurückgesetzt wurden. Wenn während der Handhabung eine signifikante Zerstörung von Blasen vorliegt, kann es im Falle des SAT2 hilfreich sein, eine zweite Spritze am Auslassanschluss anzubringen und damit sanft Flüssigkeit aus der Kammer zu extrahieren und so die Suspension einzusaugen. Dies kann auch dazu beitragen, Makroblasen zu eliminieren oder den Fluss während der US-Exposition zu ermöglichen, falls gewünscht.
Es ist nicht möglich, akustische Reflexionen innerhalb der Probenkammer vollständig zu eliminieren, und daher ist das einfallende Feld nicht vollständig gleichmäßig über das gesamte Probenvolumen. Wie in den Schritten 1.3.2 und 1.3.3 erwähnt, ist die Übertragbarkeit von schalltaktischen Fenstern frequenzabhängig und daher sollte die gewünschte Bandbreite für Schallemissionsmessungen sorgfältig berücksichtigt werden. Insbesondere kann es zu signifikanten Mehrfachreflexionen von Komponenten mit höherer Frequenz geben. Dies ist ein weiterer Grund, warum die Kalibrierung des Feldes innerhalb des vollständig montierten Systems so wichtig ist, um die Unsicherheit des einfallenden Drucks zu minimieren. Eine angemessene Gating der aufgezeichneten Signale sollte ebenfalls in Betracht gezogen werden, um die Auswirkungen mehrerer Reflexionen zu minimieren. Die Verwendung kommerzieller Geräte aus Gründen der Bequemlichkeit und die Notwendigkeit akustischer Transparenz bedeutet, dass eine gewisse optische Transparenz geopfert werden muss. Dies kann sich auf die Qualität der nachfolgenden Bildgebung auswirken, z. B. zur Beurteilung der Zelllebensfähigkeit oder der Arzneimittelaufnahme. Einige der Membranen, die in kommerziellen Geräten verwendet werden, sind auch porös und daher tritt eine unvollkommene Isolierung zwischen der Probenkammer und dem umgebenden Wasserbad auf. Wie oben beschrieben, kann das entsprechende Kontaminationsrisiko durch den Einsatz einer kleineren Unterkammer gemindert werden, deren Inhalt regelmäßig ausgetauscht werden kann. Die in der Materialtabelle angegebenen Zellkulturgeräte eignen sich in erster Linie für Zellmonoschichten, die möglicherweise nicht repräsentativ für Gewebe in Bezug auf alle US/kavitationsvermittelten Bioeffekte sind. Die Nähe der Zellen zu einer festen Oberfläche beeinflusst auch die MB-Dynamik in einer Weise, die möglicherweise nicht die Bedingungen in vivo widerspiegelt, z. B. die Förderung von Microstreaming und Microjetting, wie in der Einleitung beschrieben. Diese Einschränkungen können jedoch durch eine einfache Substitution alternativer Gewebemodelle behoben werden.
Ziel des Vorschlags der SATs ist es, ein Mittel zur Verbesserung der Reproduzierbarkeit von akustischen Expositionsbedingungen und akustischen Emissionen zwischen Studien von US-vermittelten Bioeffekten bereitzustellen und so hoffentlich ein besseres Verständnis der zugrunde liegenden Mechanismen und die Entwicklung von Behandlungsüberwachungstechniken zur Verbesserung der Sicherheit und Wirksamkeit zu ermöglichen. Die Systeme sind so konzipiert, dass sie mit kommerziell erhältlichen Zellkulturgeräten kompatibel sind, so dass eine breite Palette biologischer Assays entsprechend der anwendung von Interesse durchgeführt werden kann und die Durchführung von Experimenten mit hohem Durchsatz ermöglicht wird, wodurch zeitaufwändige Ausrichtungsverfahren zwischen den Durchläufen entstreichen. Durch die Standardisierung von Protokollen zur Charakterisierung von Expositionsbedingungen und zur Erfassung akustischer Emissionen kann die systemabhängige Variabilität hoffentlich reduziert werden. Die Bandbreite der Parameter, die für ein bestimmtes Experiment untersucht werden sollten, hängt von der Anwendung (gewünschter Bioeffekt, Zelltyp, Tiefe des Zielgewebes, wenn in vivo usw.) und der Art des verwendeten Kavitationsmittels ab. Angesichts der großen Anzahl von Variablen (US-Frequenz, Druckamplitude, Pulslänge, Pulswiederholfrequenz usw.) ist es unwahrscheinlich, dass eine vollständige Untersuchung des gesamten Parameterraums praktikabel ist. Ein Vorteil des vorgeschlagenen Protokolls besteht darin, dass es ermöglicht, einige Grenzen für diesen Parameterraum schnell zu etablieren. Es ermöglicht beispielsweise die Bestimmung des Mindestdrucks, bei dem ein Kavitationssignal erzeugt wird, des maximalen Drucks oder der Pulslänge, die vor dem Auftreten von Zellablösung/-tod verwendet werden kann, und des Drucks, bei dem fraktionierte Oberschwingungen oder Breitbandrauschen erzeugt werden. Es wird empfohlen, eine solche Reihe von Scoping-Messungen als ersten Schritt in jeder Studie durchzuführen.
Wie dargestellt, sind die SATs für die Echtzeitüberwachung akustischer Emissionen konzipiert, wobei biologische Assays außerhalb des Experiments durchgeführt werden. Relativ einfach wäre es jedoch, den SAT so zu modifizieren, dass er eine direkte optische Beobachtung der Probenkammer über ein Mikroskopobjektiv ermöglicht. Dies wiederum könnte an ein Fluoreszenz- und/oder Hochgeschwindigkeitsmikroskopiesystem gekoppelt werden, um beispielsweise die Beobachtung der Medikamentenaufnahme und Blasendynamik zu ermöglichen. Der PCD-Ausgang, wie er derzeit in Bezug auf die Spannung dargestellt wird, zeigt: i) die Arten des Kavitationsverhaltens und ihre relativen Anteile; ii) wie lange diese Kavitationsverhalten persistieren; iii) ob die beobachteten zeitlich-kumulativen Expositionsmerkmale mit einem bestimmten Bioeffekt korrelieren; und iv) ob die relativen Werte und zeitabhängigen Verhaltensweisen mit früheren Experimenten im Expositionssystem übereinstimmen. Während die Empfangsempfindlichkeit der PKD quantifiziert werden kann, sind zusätzliche räumliche Informationen erforderlich, um die akustischen Emissionen in Absolutenergie zuverlässig zu charakterisieren. Dies könnte erreicht werden, indem die PCD durch eine Array-Sonde ersetzt wird, um passives akustisches Mapping (PAM)80zu implementieren. Dies würde jedoch die Komplexität der Signalverarbeitung und die benötigte Rechenzeit und -leistung erhöhen.
Andere Instrumente zur Messung des elektrischen Widerstands der Membran oder zur Anwendung physikalischer Zielmethoden, z. B. Magnetfelder, könnten ebenfalls integriert werden. Es wäre auch möglich, dreidimensionale Gewebestrukturen wie Tumorsphäroide, Organoide oder sogar Ex-vivo-Gewebeproben auf akustisch "weichen" Gelsubstraten anstelle der Zellmonoschichten zu verwenden, um US- und kavitationsvermittelte Effekte in realistischeren Gewebeumgebungen zu untersuchen.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Autoren danken dem Engineering and Physical Sciences Research Council für die Unterstützung dieser Arbeit durch den Zuschuss EP/L024012/1. VB wird auch vom Engineering and Physical Sciences Research Council (EPSRC) und dem Medical Research Council (MRC) unterstützt (Grant EP/L016052/1). VB und AV danken der Clarendon Foundation für Postgraduiertenstipendien. AV dankt auch dem Exeter College für ein Santander-Stipendium. Die Autoren sind James Fisk und David Salisbury für ihre unschätzbare Unterstützung bei der Herstellung des Apparates zu Dank verpflichtet. Sie danken auch den Beiträgen von Dr. Dario Carugo und Joshua Owen bei der Entwicklung früherer Prototyp-SATs.
Materialien
| Name | Company | Catalog Number | Comments |
| Absorber | Precision Acoustics | APTFlex F28 panel | 1.0 cm standard thickness |
| Amplifier (power) | E&I Ltd. | 1040L | 400W power amplifier to drive ultrasound source |
| Amplifier (pre) | Stanford Research Systems | SR445A | Fixed gain multi-stage preamplifier for PCD signals |
| Aquarium heater | Aquael | Ultra 50W | Different models for different tank sizes. |
| Digitizer | TiePie Engineering | HS5-110-XM | Extended memory option: 32M points per channel |
| Hydrophone | Precision Acoustics | FOH | 0.01 mm diameter sensitive area minimises directivity effects |
| Microbubbles | Bracco | SonoVue | FDA approved microbubbles |
| PCD mirror (SAT3) | Olympus NDT | F-102 | 90 degree beam reflection |
| PCD transducer | Olympus NDT | V320-SU | Immersion transducer, 7.5MHz |
| PCD waterproof cable | Olympus NDT | BCU-58-1 W | |
| PDMS (SAT2 compartment lid) | Corning | Sylgard 184 | See Carugo et al. (2015) for preparation guidelines |
| Polymer rod (SAT2 seal) | Zeus | PTFE monofilament | |
| Rubber plug (SAT3 lid/seal) | VWR | 391-2101 | 6mm bottom dia., 8mm top dia., red |
| Signal generator | Agilent | 33250 | Waveform generator for ultrasound source |
| Substrate for cell exposure compartment, SAT2 | Ibidi | µ-Dish 35mm | |
| Substrate for cell exposure compartment, SAT3 | Corning | Transwell 6.5mm | |
| Ultrasound source (SAT3) | Sonic Concepts | H107 with central hole | Use of a HIFU-capable source allows pressures >1MPa to be generated both at the focus and pre-focally for expanded spatial coverage |
Referenzen
- Maier, A., Steidl, S., Christlein, V., Hornegger, J. Medical Imaging Systems - An Introductory Guide. Lecture Notes in Computer Science. , (2018).
- Tachibana, K., Tachibana, S. Albumin microbubble echo-contrast material as an enhancer for ultrasound accelerated thrombolysis. Circulation. 92, 1148-1150 (1995).
- Bao, S., Thrall, B. D., Miller, D. L. Transfection of a reporter plasmid into cultured cells by sonoporation in vitro. Ultrasound in Medicine and Biology. 23 (6), 953-959 (1997).
- Price, R. J., Skyba, D. M., Kaul, S., Skalak, T. C. Delivery of colloidal particles and red blood cells to tissue through microvessel ruptures created by targeted microbubble destruction with ultrasound. Circulation. 98 (13), 1264-1267 (1998).
- Theek, B., et al. Sonoporation enhances liposome accumulation and penetration in tumors with low EPR. Journal of Controlled Release. 231, 77-85 (2016).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- Snipstad, S., et al. Ultrasound Improves the Delivery and Therapeutic Effect of Nanoparticle-Stabilized Microbubbles in Breast Cancer Xenografts. Ultrasound in Medicine and Biology. 43 (11), 2651-2669 (2017).
- Unga, J., Hashida, M. Ultrasound induced cancer immunotherapy. Advanced Drug Delivery Reviews. 72, 144-153 (2014).
- Yang, C., Du, M., Yan, F., Chen, Z. Focused ultrasound improves NK-92MI cells infiltration into tumors. Frontiers in Pharmacology. 10, 326 (2019).
- McDannold, N., Arvanitis, C. D., Vykhodtseva, N., Livingstone, M. S. Temporary disruption of the blood-brain barrier by use of ultrasound and microbubbles: Safety and efficacy evaluation in rhesus macaques. Cancer Research. 72 (14), 3652-3663 (2012).
- O'Reilly, M. A., Hynynen, K. Ultrasound and microbubble-mediated blood-brain barrier disruption for targeted delivery of therapeutics to the brain. Methods in Molecular Biology. 1831, 111-119 (2018).
- Mainprize, T., et al. Blood-Brain Barrier Opening in Primary Brain Tumors with Non-invasive MR-Guided Focused Ultrasound: A Clinical Safety and Feasibility Study. Scientific Reports. 9, 321 (2019).
- Ebben, H. P., Nederhoed, J. H., Lely, R. J., Wisselink, W., Yeung, K. Microbubbles and UltraSound-accelerated Thrombolysis (MUST) for peripheral arterial occlusions: Protocol for a phase II single-arm trial. BMJ Open. 7, 014365 (2017).
- de Saint Victor, M., Barnsley, L. C., Carugo, D., Owen, J., Coussios, C. C., Stride, E. Sonothrombolysis with Magnetically Targeted Microbubbles. Ultrasound in Medicine & Biology. 45 (5), 1151-1163 (2019).
- Dixon, A. J., Li, J., Rickel, J. M. R., Klibanov, A. L., Zuo, Z., Hossack, J. A. Efficacy of Sonothrombolysis Using Microbubbles Produced by a Catheter-Based Microfluidic Device in a Rat Model of Ischemic Stroke. Annals of Biomedical Engineering. , (2019).
- Horsley, H., et al. Ultrasound-activated microbubbles as a novel intracellular drug delivery system for urinary tract infection. Journal of Controlled Release. 301, 166-175 (2019).
- Lattwein, K. R., et al. Sonobactericide: An Emerging Treatment Strategy for Bacterial Infections. Ultrasound in Medicine and Biology. 46 (2), 193-215 (2020).
- Crum, L. A., Fowlkes, J. B. Acoustic cavitation generated by microsecond pulses of ultrasound. Nature. 319, 52-54 (1986).
- Holland, C. K., Apfel, R. E. Thresholds for transient cavitation produced by pulsed ultrasound in a controlled nuclei environment. Journal of the Acoustical Society of America. 88, 2059-2069 (1990).
- Rifai, B., Arvanitis, C. D., Bazan-Peregrino, M., Coussios, C. C. Cavitation-enhanced delivery of macromolecules into an obstructed vessel. The Journal of the Acoustical Society of America. 128, (2010).
- Wu, J., Ross, J. P., Chiu, J. F. Reparable sonoporation generated by microstreaming. The Journal of the Acoustical Society of America. 111 (3), 1460-1464 (2002).
- Doinikov, A. A., Bouakaz, A. Acoustic microstreaming around a gas bubble. The Journal of the Acoustical Society of America. 127 (2), 703-709 (2010).
- De Cock, I., et al. Ultrasound and microbubble mediated drug delivery: acoustic pressure as determinant for uptake via membrane pores or endocytosis. Journal of Controlled Release Official Journal of the Controlled Release Society. 197, 20-28 (2015).
- Pereno, V., Lei, J., Carugo, D., Stride, E. Microstreaming inside Model Cells Induced by Ultrasound and Microbubbles. Langmuir. 36, 6388-6398 (2020).
- Chen, H., Brayman, A. A., Kreider, W., Bailey, M. R., Matula, T. J. Observations of translation and jetting of ultrasound-activated microbubbles in mesenteric microvessels. Ultrasound in Medicine and Biology. 37 (12), 2139-2148 (2011).
- Lentacker, I., De Smedt, S. C., Sanders, N. N. Drug loaded microbubble design for ultrasound triggered delivery. Soft Matter. 5, 2161-2170 (2009).
- Song, J. H., Moldovan, A., Prentice, P. Non-linear Acoustic Emissions from Therapeutically Driven Contrast Agent Microbubbles. Ultrasound in Medicine and Biology. 45 (8), 2188-2204 (2019).
- Ohl, C., Arora, M., Ikink, R., De Jong, N., Versluis, M., Delius, M. Sonoporation from Jetting Cavitation Bubbles. Biophysical Journal. 91 (11), 4285-4295 (2006).
- Li, Z. G., Liu, a. Q., Klaseboer, E., Zhang, J. B., Ohl, C. D. Single cell membrane poration by bubble-induced microjets in a microfluidic chip. Lab on a Chip. 13 (6), 1144-1150 (2013).
- Wang, Q. X., Manmi, K. Three dimensional microbubble dynamics near a wall subject to high intensity ultrasound. Physics of Fluids. 26, 032104 (2014).
- Suslick, K. S. . Ultrasound: Its Chemical, Physical, and Biological Effects. Radiology. , (1988).
- Mitragotri, S. Healing sound: the use of ultrasound in drug delivery and other therapeutic applications. Nature reviews. Drug discovery. 4 (3), 255-260 (2005).
- Mitragotri, S. Sonophoresis: Ultrasound-mediated transdermal drug delivery. Percutaneous Penetration Enhancers Physical Methods in Penetration Enhancement. , 3-14 (2017).
- Park, J., Lee, , et al. Enhanced Transdermal Drug Delivery by Sonophoresis and Simultaneous Application of Sonophoresis and Iontophoresis. AAPS PharmSciTech. 20 (3), 96 (2019).
- Lentacker, I., De Cock, I., Deckers, R., De Smedt, S. C., Moonen, C. T. W. Understanding ultrasound induced sonoporation: Definitions and underlying mechanisms. Advanced Drug Delivery Reviews. 72, 49-64 (2014).
- Wawryka, P., Kiełbik, A., Iwanek, G. Microbubble based sonoporation - the basics into clinical implications. Medical Research Journal. 4 (3), 178-183 (2019).
- Hilgenfeldt, S., Lohse, D., Zomack, M. Sound scattering and localized heat deposition of pulse-driven microbubbles. The Journal of the Acoustical Society of America. 107 (6), 3530-3539 (2000).
- Holt, R. G., Roy, R. A. Measurements of bubble-enhanced heating from focused, MHz-frequency ultrasound in a tissue-mimicking material. Ultrasound Medical Biology. 27 (10), 1399-1412 (2001).
- Tan, J., Li, P., Xue, H., Li, Q. Cyanidin-3-glucoside prevents hydrogen peroxide (H 2 O 2 )-induced oxidative damage in HepG2 cells. Biotechnology Letters. 42 (11), 2453-2466 (2020).
- Costley, D., et al. Treating cancer with sonodynamic therapy: A review. International Journal of Hyperthermia. 31 (2), 107-117 (2015).
- You, D. G., et al. ROS-generating TiO2 nanoparticles for non-invasive sonodynamic therapy of cancer. Scientific Reports. 6, 23200 (2016).
- Canavese, G., et al. Nanoparticle-assisted ultrasound: A special focus on sonodynamic therapy against cancer. Chemical Engineering Journal. 340, 155-172 (2018).
- Beguin, E., et al. Direct Evidence of Multibubble Sonoluminescence Using Therapeutic Ultrasound and Microbubbles. ACS Applied Materials & Interfaces. 11 (22), 19913-19919 (2019).
- Stride, E., et al. Microbubble Agents: New Directions. Ultrasound in Medicine and Biology. 46 (6), 1326-1343 (2020).
- Rapoport, N., Gao, Z., Kennedy, A. Multifunctional nanoparticles for combining ultrasonic tumor imaging and targeted chemotherapy. Journal of the National Cancer Institute. 99 (14), 1095-1106 (2007).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Zhang, L., et al. Mitochondria-Targeted and Ultrasound-Activated Nanodroplets for Enhanced Deep-Penetration Sonodynamic Cancer Therapy. ACS Applied Materials & Interfaces. 11 (9), 9355-9366 (2019).
- Delogu, L. G., et al. Functionalized multiwalled carbon nanotubes as ultrasound contrast agents. Proceedings of the National Academy of Sciences of the United States of America. 109 (41), 16612-16617 (2012).
- Paris, J. L., et al. Ultrasound-mediated cavitation-enhanced extravasation of mesoporous silica nanoparticles for controlled-release drug delivery. Chemical Engineering Journal. 340, 2-8 (2018).
- Mannaris, C., et al. Gas-Stabilizing Gold Nanocones for Acoustically Mediated Drug Delivery. Advanced Healthcare Materials. 7 (12), 1800184 (2018).
- Kwan, J. J., et al. Ultrasound-induced inertial cavitation from gas-stabilizing nanoparticles. Physical Review E - Statistical, Nonlinear, and Soft Matter Physics. 92 (2), (2015).
- Kwan, J. J., et al. Ultrasound-Propelled Nanocups for Drug Delivery. Small. 11 (39), 5305-5314 (2015).
- Mannaris, C., et al. Microbubbles, Nanodroplets and Gas-Stabilizing Solid Particles for Ultrasound-Mediated Extravasation of Unencapsulated Drugs: An Exposure Parameter Optimization Study. Ultrasound in Medicine and Biology. 45, 954-967 (2019).
- Roovers, S., et al. The Role of Ultrasound-Driven Microbubble Dynamics in Drug Delivery: From Microbubble Fundamentals to Clinical Translation. Langmuir. 35, 10173-10191 (2019).
- Lentacker, I., Geers, B., Demeester, J., De Smedt, S. C., Sanders, N. N. Design and Evaluation of Doxorubicin-containing Microbubbles for Ultrasound-triggered Doxorubicin Delivery: Cytotoxicity and Mechanisms Involved. Molecular Therapy. 18 (1), 101-108 (2010).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250 (2019).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Stride, E. P., Coussios, C. C. Cavitation and contrast: The use of bubbles in ultrasound imaging and therapy. Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine. 224 (2), 171-191 (2010).
- Stride, E., Coussios, C. Nucleation, mapping and control of cavitation for drug delivery. Nature Reviews Physics. 1, 495-509 (2019).
- Dong, Y., et al. Antibiofilm effect of ultrasound combined with microbubbles against Staphylococcus epidermidis biofilm. International Journal of Medical Microbiology. 307 (6), 321-328 (2017).
- Van Rooij, T., et al. Vibrational Responses of Bound and Nonbound Targeted Lipid-Coated Single Microbubbles. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (5), 785-797 (2017).
- Duan, X., Yu, A. C. H., Wan, J. M. F. Cellular Bioeffect Investigations on Low-Intensity Pulsed Ultrasound and Sonoporation: Platform Design and Flow Cytometry Protocol. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (9), 1422-1434 (2019).
- Hu, Y., Wan, J. M. F., Yu, A. C. H. Membrane Perforation and Recovery Dynamics in Microbubble-Mediated Sonoporation. Ultrasound in Medicine and Biology. 39 (12), 2393-2405 (2013).
- Carugo, D., Owen, J., Crake, C., Lee, J. Y., Stride, E. Biologicallyand acoustically compatible chamber for studying ultrasound-mediated delivery of therapeutic compounds. Ultrasound in Medicine and Biology. 41 (7), 1927-1937 (2015).
- Pereno, V., et al. Layered acoustofluidic resonators for the simultaneous optical and acoustic characterisation of cavitation dynamics, microstreaming, and biological effects. Biomicrofluidics. 12 (3), 034109 (2018).
- Fan, Z., Liu, H., Mayer, M., Deng, C. X. C. X. Spatiotemporally controlled single cell sonoporation. Proceedings of the National Academy of Sciences of the United States of America. 109 (41), 16486-16491 (2012).
- Helfield, B., Chen, X., Watkins, S. C., Villanueva, F. S. Biophysical insight into mechanisms of sonoporation. Proceedings of the National Academy of Sciences. , (2016).
- Helfield, B. L., Chen, X., Qin, B., Watkins, S. C., Villanueva, F. S. Mechanistic Insight into Sonoporation with Ultrasound-Stimulated Polymer Microbubbles. Ultrasound in Medicine and Biology. 43 (11), 2678-2689 (2017).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the Role of Lipid Transfer in Microbubble-Mediated Drug Delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Kinsler, L. E., Frey, A. R., Coppens, A. B., Sanders, J. V. . Fundamentals of Acoustics, 4th Edition. , (2000).
- Wear, K. A. Considerations for Choosing Sensitive Element Size for Needle and Fiber-Optic Hydrophones-Part I: Spatiotemporal Transfer Function and Graphical Guide. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (2), 318-339 (2019).
- Stoica, P., Moses, R. . Spectral Analysis of Signals. , (2005).
- Lyka, E., Coviello, C., Kozick, R., Coussios, C. C. Sum-of-harmonics method for improved narrowband and broadband signal quantification during passive monitoring of ultrasound therapies. Journal of the Acoustical Society of America. 140 (1), 741-754 (2016).
- Barrack, T., Stride, E. Microbubble Destruction During Intravenous Administration: A Preliminary Study. Ultrasound in Medicine and Biology. 35 (3), 515-522 (2009).
- Apfel, R. E. Acoustic cavitation. Methods in Experimental Physics. 19, 355-411 (1981).
- Mulvana, H., Stride, E., Tang, M. X., Hajnal, J. V., Eckersley, R. J. The Influence of Gas Saturation on Microbubble Stability. Ultrasound in Medicine and Biology. 38 (6), 1097-1100 (2012).
- Mulvana, H., Stride, E., Hajnal, J. V., Eckersley, R. J. Temperature dependent behavior of ultrasound contrast agents. Ultrasound in Medicine and Biology. 36 (6), 925-934 (2010).
- Mulvana, H., Eckersley, R. J., Tang, M. X., Pankhurst, Q., Stride, E. Theoretical and Experimental Characterisation of Magnetic Microbubbles. Ultrasound in Medicine and Biology. 38 (5), 864-875 (2012).
- Coviello, C., et al. Passive acoustic mapping utilizing optimal beamforming in ultrasound therapy monitoring. Journal of the Acoustical Society of America. 137 (5), 2573-2585 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten