Method Article
Ortsgerichtete φC31-vermittelte Integration und Kassettenaustausch in Anopheles-Vektoren der Malaria
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt, wie mit dem φC31-System ortsgerichtete Modifikationen im Genom von Anopheles-Malariamücken erreicht werden können. Zu den beschriebenen Modifikationen gehören sowohl die Integration als auch der Austausch transgener Kassetten im Genom von attP-tragenden Andockleitungen.
Zusammenfassung
Die funktionelle Genomanalyse und verwandte Strategien zur genetischen Kontrolle von Malaria beruhen auf validierten und reproduzierbaren Methoden, um das Genom von Anopheles-Mücken genau zu modifizieren. Unter diesen Methoden ermöglicht das φC31-System eine präzise und stabile ortsgerichtete Integration von Transgenen oder die Substitution integrierter transgener Kassetten durch Rekombinase-vermittelten Kassettenaustausch (RMCE). Diese Methode beruht auf der Wirkung der Streptomyces φC31 Bakteriophagen-Integrase, um die Rekombination zwischen zwei spezifischen Bindungsstellen namens attP (abgeleitet vom Phagen) und attB (abgeleitet vom Wirtbakterium) zu katalysieren. Das System verwendet ein oder zwei attP-Stellen, die zuvor in das Mückengenom integriert wurden, und attB-Stellen in der Spendervorlagen-DNA. Hier veranschaulichen wir, wie das Genom von attP-tragenden Anopheles-Dockinglinien mit zwei Plasmiden stabil modifiziert werden kann: einem attB-markierten Spender, der die Integrations- oder Austauschvorlage trägt, und einem Helferplasmid, das für die φC31-Integrase kodiert. Wir berichten über zwei repräsentative Ergebnisse der φC31-vermittelten ortsgerichteten Modifikation: die einmalige Integration einer transgenen Kassette in An. stephensi und RMCE in An. gambiae-Mücken. φC31-vermittelte Genommanipulation bietet den Vorteil einer reproduzierbaren Transgenexpression aus validierten, fitnessneutralen genomischen Stellen, die vergleichende qualitative und quantitative Analysen von Phänotypen ermöglicht. Die standortorientierte Natur der Integration vereinfacht auch die Validierung der einzelnen Einfügestelle und des Paarungsschemas erheblich, um eine stabile transgene Linie zu erhalten. Diese und weitere Eigenschaften machen das φC31-System zu einem wesentlichen Bestandteil des genetischen Werkzeugkastens für die transgene Manipulation von Malariamücken und anderen Insektenvektoren.
Einleitung
Die Fähigkeit, das Genom von Mückenvektoren von Krankheiten zuverlässig und reproduzierbar zu modifizieren, hat die in vivo funktionelle Validierung von Genen gestärkt und die Türen zu realisierbaren genetischen Vektorkontrollstrategien geöffnet, wie sie auf Anopheles-Mücken abzielen, die Malaria übertragen1.
Die frühe Mücken-Genom-Editierung stützte sich ausschließlich auf die transponierbare Elementtransformation (TE), wobei PiggyBac das am häufigsten verwendete Transposon in Anopheles war2,3,4. Die zufällige Natur der TE-Integration kann jedoch zu unerwünschten Modifikationen wie Gen-Knockouts (Insertionsmutagenese) und signifikanten Positionseffekten auf die Transgenexpression führen5,6,7,8. Mehrfacheinfügungen kommen auch bei der Verwendung von piggyBac5,9 häufig vor, was die Validierung und Isolierung transgener Linien mit einzelnen Einfügungen mühsam macht. Weitere Nachteile sind ihre potenzielle Remobilisierung, wie sie in der Keimbahn von Anopheles stephensi beobachtet wird, wenn eine Quelle für PiggyBac-Transposase10,11,12 bereitgestellt wird, und ihre begrenzte Größe der DNA-Ladung (10-15 kb Länge), wobei die Transformationseffizienz mit zunehmender Größe des Spenderplasmids abnimmt13,14.
Um diese Probleme zu umgehen, wurden standortgesteuerte Integrationsansätze eingeführt. Die häufigste ortsgerichtete Genommodifikation bei Moskitos ist diejenige, die durch das φC31-System vermittelt wird (Abbildung 1a). Dies wird durch eine virale Integrase angetrieben, die die Rekombination zwischen zwei heterospezifischen Bindungsstellen (att) katalysiert, die natürlich im Genom des Bakteriophagen φC31 (attP) und im Streptomyces-Bakterium-Wirt (attB)15 vorkommen. Die Rekombination der beiden Standorte ist unidirektional und führt zur Bildung von Hybridstellen (attL und attR). Die Rekombination solcher Hybridstellen (die zur DNA-Exzision führt) würde nicht nur das Vorhandensein einer aktiven viralen Integrase, sondern auch eines anderen Phagen-kodierten Rekombinationsfaktors erfordern16,17. So wird ein stabiler Integrationsstandort generiert, der das Problem einer möglichen unerwünschten Remobilisierung entlastet15. Darüber hinaus ermöglicht das System die Integration großer Ladungen (z. B. integration von >100 kb-Konstrukten wurde in D. melanogaster18 berichtet), wodurch die Tragfähigkeiten erheblich erhöht werden. Die Integration erfolgt in einem einzigen vordefinierten genomischen Locus, was die Validierung der Insertion und des Paarungsschemas erheblich vereinfacht, um eine stabile transgene Linie zu erhalten. Schließlich ermöglicht die ortsgerichtete Natur der Integration eine Normalisierung der Expression, da sich alternative Transgene am selben Ort befinden und daher im selben benachbarten genomischen Kontext reguliert werden. In der Tat ist eine der Hauptanwendungen der Technik der direkte Vergleich von Phänotypen, die von verschiedenen Transgenen nach der Insertion in einen identischen Locus verliehen werden.
Das Erreichen einer φC31-vermittelten Integration umfasst zwei Phasen: Phase I ist die Schaffung transgener Andocklinien, die attP-Standorte transportieren, und Phase II ist die standortgerichtete Integration einer attB-flankierten Ladung in das Genom der Andocklinie19. Die Erstellung von Phase-I-Dockinglinien stützte sich auf die TE-vermittelte zufällige Integration von attP-markierten Konstrukten und beinhaltete daher einen ersten mühsamen Prozess (einschließlich Southern Blot- und inverser PCR-Analysen an einzelnen weiblichen Nachkommen), um transgene Linien zu isolieren und zu validieren, die ein einziges Integrationsereignis an einzigartigen, transkriptionell aktiven und fitnessneutralen genomischen Orten tragen. Dennoch wurden in An. gambiae1,20,21,22 und in An. stephensi23,24,25 mehrere Andocklinien für die φC31-vermittelte Einzelintegration entwickelt und validiert (Tabelle 1). Jede dieser Linien variiert in Bezug auf die genomische Lage der Andockstelle und den stammspezifischen genetischen Hintergrund und aus ihnen kann eine Vielzahl neuer transgener Linien geschaffen werden. Die komplexe Validierung von TE-vermittelten Integrationen zur Herstellung von Docking-Linien kann nun durch die CRISPR/Cas9-Technologie umgangen werden26; Dies beruht jedoch auf dem A-priori-Wissen über neutrale Loci, die anvisiert werden sollen, und ihre umgebenden Sequenzen.
Die φC31-vermittelte Integration wurde umfassend auf die Genom-Editierung von Insekten aus dem Modellorganismus D. melanogaster27, den Moskitos Aedes aegypti13,28, Ae. albopictus29, An. gambiae19 und An. stephensi24 sowie anderen Insekten wie Ceratitis capitata30 und Bombyx mori31 angewendet.
Eine Einschränkung der φC31-vermittelten Integration, insbesondere im Hinblick auf mögliche Feldfreisetzungen zur Vektorkontrolle, ist die Integration des gesamten attB-tragenden Spenderplasmids in das Mückengenom, einschließlich unerwünschter Sequenzen wie Antibiotikaresistenz-Genmarker und Plasmid-Backbone-Komponenten bakteriellen Ursprungs. Um dies zu adressieren, wurde eine Modifikation des Standardsystems, rekombinase-vermittelter Kassettenaustausch (RMCE), implementiert, die den präzisen Ersatz einer zuvor integrierten transgenen Kassette durch eine neue Donor-DNA ermöglicht (Abbildung 1b). Dies wird durch die Verwendung von zwei invertierten Att-Stellen erreicht, die die Spender- und Empfängerkassetten an jedem Ende flankieren, was dazu führt, dass zwei unabhängige Rekombinationsereignisse gleichzeitig stattfinden, was zu einem Kassettenaustausch ohne Integration des Plasmid-Backbones führt. Dieses verbesserte Design umgeht die Integration unerwünschter Sequenzen und erweitert die Anwendung von φC31-Systemen um beispielsweise die Integration von nicht markierten DNA-Ladungen durch Screening auf den Verlust eines zuvor integrierten Fluoreszenzmarkers32.
RMCE wurde zuerst mit D. melanogaster32 erreicht und später erfolgreich auf Nicht-Modellinsekten wie An. gambiae9,26,33, Ae. aegypti34, Plutella xylostella34 und B. mori35 angewendet. Mehrere Dockinglinien für RMCE wurden in An. gambiae5,9,26 entwickelt und validiert (Tabelle 1). Unseres Wissens muss RMCE noch in anderen Anopheles-Vektorarten erforscht werden.
Bisher wurde das φC31-System in anopheles-Mücken weit verbreitet eingesetzt, um eine Vielzahl von Molekülen einzuführen und zu untersuchen, darunter Malaria-Effektoren19,24,36, Komponenten des GAL4/UAS-Systems zur Überexpression und Knockdown-Gene für Insektizidresistenzstudien9,33, regulatorische Elemente, Reportergene5,21,37 und Gene-Drive-Elemente26 ,38.
Dieses Protokoll beschreibt, wie 1) die standortgerichtete Integration einer attB-flankierten Ladung und 2) rmCE eines von invertierten attB-Stellen flankierten Konstrukts in das Genom der Anopheles-Docking-Linien durchgeführt werden. Dies wird durch die Verwendung von zwei Plasmiden erreicht: einem Donor-attB-markierten Plasmid, das das transgen von Interesse trägt, und einem Helferplasmid, das die φC31-Integrase exprimiert. Die wichtigsten Malaria-Vektoren An. gambiae und An. stephensi werden als spezifische Beispiele verwendet, diese Protokolle sind jedoch auf andere Anopheles-Arten anwendbar.
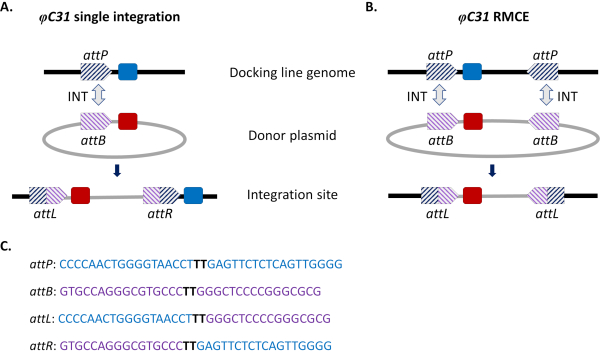
Abbildung 1. Ortsgerichtete Genommodifikationen, Einzelintegration und Rekombinase-vermittelter Kassettenaustausch (RMCE) unter Verwendung des φC31-Systems. Die φC31-Integrase (INT, grauer Doppelpfeil) katalysiert die Rekombination zwischen der attB-Stelle(n) (violett gestreift), die in einem Donorplasmid vorhanden ist, und der attP-Stelle(n) (blau gestreift), die in einer aufnehmenden Andocklinie vorhanden ist, was zur Bildung von Hybridstellen attL und attR führt. A) Die Integration wird erreicht, wenn einzelne attB- und attP-Standorte rekombiniert werden und zu zwei integrierten Markern (blau und rot) führen. B) RMCE tritt auf, wenn zwei attB/P-Stellen gleichzeitig rekombinieren und dazu führen, dass die Kassette zwischen den Att-Stellen der Andocklinie (blauer Marker) durch die vom Donorplasmid (roter Marker) getragene ersetzt wird. C) Partielle Nukleotidsequenzen von attP (blau) und attB (violett) und die Hybridstellen attL/R. Die Rekombination erfolgt zwischen den schwarz hervorgehobenen "TT"-Kernsequenzen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
HINWEIS: Ein schematischer Workflow des abgebildeten Protokolls ist in Abbildung 2 dargestellt.
1. Design von φC31 attB-getaggten Plasmiden (Abbildung 3)
- Erstellen Sie attB-Spenderplasmide , die die folgenden wesentlichen Komponenten tragen
- Dominanter Fluoreszenzmarker
- Wählen Sie einen Promotor, um den Ausdruck des fluoreszierenden Markers zu steuern.
HINWEIS: Für die Anopheles-Transgenese stehen fluoreszierende Marker normalerweise unter der Regulation des 3xP3-Promotors39, der die Expression in den Augen und im Nervenstrang antreibt. Alternativ kann der PUBc-Promotor5 verwendet werden, wenn eine Expression in mehreren Geweben gewünscht ist. Donorplasmide und Docking-Leitungen, die als Beispiele in diesem Protokoll verwendet werden, werden mit dem 3xP3-Promotor markiert. - Wählen Sie ein fluoreszierendes Protein (FP), das mit dem der empfangenden Dockinglinie kompatibel ist, so dass sie leicht unterscheidbar sind.
HINWEIS: Verwenden Sie nicht den gleichen Marker, der bereits in der Dockingline vorhanden ist, und vermeiden Sie die gleichzeitige Verwendung von GFP (grün) / YFP (gelb) und GFP (grün) / CFP (Cyan), da sie sehr schwer zuverlässig zu unterscheiden sind. Donorplasmide, die als Beispiele in diesem Protokoll verwendet werden, sind entweder mit DsRed oder YFP gekennzeichnet, da sie in eine mit CFP markierte Andocklinie integriert werden sollen.
- Wählen Sie einen Promotor, um den Ausdruck des fluoreszierenden Markers zu steuern.
-
attB Rekombinationsstelle(n)
- Verwenden Sie einen einzelnen ATTB-Standort für die Integration einer transgenen Kassette (Single-ATTB-Design ) (Abbildung 3A).
- Verwenden Sie zwei invertierte attB-Stellen für RMCE (Doppel-AttB-Design ), bei denen die Stellen invertiert zueinander liegen und die Spender-DNA-Schablone einschließen (Abbildung 3B).
HINWEIS: Die Ausrichtung der ATTB-Site (s) muss mit der Ausrichtung der ATTP-Site (s) in der Dockingline kompatibel sein.
- Gewünschte Transgenladung
- Verwenden Sie alle anderen gewünschten Merkmale, die basierend auf dem spezifischen Zweck des Experiments in das Mückengenom integriert werden sollen. Hier beschreiben wir die Integration eines Malaria-Effektormoleküls in das Genom von An. stephensi und die Integration der Komponenten des GAL4/UAS-Systems in An. gambiae-Mücken .
- Plasmid-Backbone-Komponenten
- Enthalten sind neben anderen wesentlichen Komponenten für die Plasmidreplikation in Bakterien ein Marker für die Plasmidselektion in vitro (d. H . Ein Antibiotikaresistenzgen).
HINWEIS: Das Plasmid-Rückgrat wird im Single-attB-Design zur Integration in das Mückengenom integriert (Abbildung 3A), während es im Double-attB-Design für RMCE nicht eingefügt wird (Abbildung 3B).
- Enthalten sind neben anderen wesentlichen Komponenten für die Plasmidreplikation in Bakterien ein Marker für die Plasmidselektion in vitro (d. H . Ein Antibiotikaresistenzgen).
- Dominanter Fluoreszenzmarker
2. Herstellung von Plasmiden für die Mikroinjektionsmischung
HINWEIS: Das hier dargestellte Protokoll beinhaltet die Verwendung von zwei Plasmiden: einem attB-markierten Spenderplasmid, das das transgen von Interesse trägt, und einem Helferplasmid, das die φC31-Integrase unter der Regulation des Drosophila Hsp70-Promotors exprimiert40.
- Reinigen Sie Spender- und Helferplasmide mit einem endotoxinfreien Plasmidreinigungskit.
HINWEIS: Sequenzieren Sie das endgültige Plasmidpräparat, das für die Injektion verwendet wird, um die Integrität aller Komponenten zu überprüfen. - Kombinieren Sie geeignete Mengen der beiden Plasmide, um eine Mischung mit einer Endkonzentration von 350 ng/μL des Spenderplasmids und 150 ng/μL des Helferplasmids zu erhalten, wenn sie im Injektionspuffer resuspendiert werden.
HINWEIS: Berücksichtigen Sie bei der Berechnung des erforderlichen Mischungsvolumens, dass 10-15 μL für jeden Tag der geplanten Injektionen ausreichen und DNA im Voraus vorbereitet und bei -20 ° C gelagert werden kann. Integrase-Helfer-Plasmidkonzentrationen von 60-500 ng/μL und Donorplasmidkonzentrationen von 85-200 ng/μL wurden ebenfalls berichtet21,22,26,41. - Die DNA wird durch Zugabe von 0,1 Volumen von 3 M Natriumacetat (pH 5,2) und 2,5 Volumen von eiskaltem 100% EtOH und Wirbel ausgefällt. Ein weißer Niederschlag sollte sofort sichtbar sein. Hochkonzentrierte anfängliche Plasmidpräparationen (d. H. ~ 1 μg / μL) verbessern die Fällungseffizienz.
HINWEIS: Haltepunkt - Der Niederschlag kann über Nacht bei -20 °C gelagert werden. - Zentrifugiere bei 15.000 x g für 20 min bei 4 °C, entsorge den Überstand und wäsche das Pellet mit 1 ml eiskaltem 70% EtOH.
- Das Pellet mit 1 mL eiskaltem 70% EtOH waschen und bei 15.000 x g 5 min bei Raumtemperatur zentrifugieren.
- Entsorgen Sie den Überstand, ohne das Pellet zu stören, und trocknen Sie ihn an der Luft.
- Resuspendieren Sie das Pellet in 1x Injektionspuffer (0,1 mM Na3PO4, 5 mM KCl, pH 7,2, 0,22 μm Filter sterilisiert), um eine Gesamtendkonzentration von 500 ng/μL zu erreichen.
HINWEIS: Gehen Sie davon aus, dass während des Fällungsprozesses etwas DNA verloren geht. Fügen Sie daher zuerst ein kleineres Volumen an Injektionspuffer hinzu, überprüfen Sie die Konzentration auf einem Spektralphotometer (z. B. Nanodrop) und fügen Sie dann ein geeignetes Restvolumen hinzu, um 500 ng / μL zu erreichen. - Stellen Sie sicher, dass die DNA gründlich resuspendiert wird, bereiten Sie Aliquots von je 10-15 μL vor und lagern Sie sie bei -20 °C.
- Am Tag der Injektion einen Aliquot auftauen und bei 15.000 x g für 5 min zentrifugieren, um partikelförmige Rückstände zu entfernen.
HINWEIS: Eine alternative Methode zur Partikelentfernung besteht darin, die Lösung durch einen 0,22 μm-Filter zu filtern. Vermeiden Sie das Vorhandensein von partikelförmigen Rückständen in der Injektionsmischung, da diese während der Mikroinjektion des Embryos zu einer Nadelverstopfung führen.
3. Mikroinjektion von Embryonen aus einer Anopheles-Andocklinie
- Blutfütterung 4-7 Tage alte Moskitos aus der gewünschten Andocklinie 72 h vor der Mikroinjektion (d.h. zur Injektion am Montag und Dienstag füttern Weibchen am vorherigen Freitag; für Injektion am Donnerstag und Freitag füttern Weibchen am Montag der gleichen Woche).
- Blut füttern Wildtyp-Mücken (WT) (dh Moskitos mit dem gleichen genomischen Hintergrund der Docking-Linie) am selben Tag; diese werden für die Auskreuzung benötigt.
HINWEIS: Die Größe und Qualität der Blutmahlzeit beeinflussen die Eiqualität, daher wird empfohlen, immer frisches Blut zu verwenden (d. H . Blut, das innerhalb der letzten 7 Tage entnommen wurde). Die Armfütterung oder die Fütterung von Mäusen kann die Qualität und Quantität der Eier erhöhen, diese Methoden werden jedoch nicht empfohlen. Für den menschlichen und tierischen Gebrauch sind spezifische genehmigte Protokolle erforderlich. - Durchführung von Embryo-Mikroinjektionen
- Führen Sie An. gambiae Embryo-Mikroinjektionen in 25 mM NaCl42 durch, indem Sie den hinteren Pol des Embryos in einem 45-Grad-Winkel anvisieren. Ein detailliertes Protokoll für die Embryonenentnahme, -ausrichtung und -mikroinjektion finden Sie in Pondeville et al.43 und Lobo et al.44.
- Führen Sie An. stephensi Embryo-Mikroinjektionen in Halogenkohlenstofföl 700:27 (2:1) durch, indem sie den hinteren Pol des Embryos in einem Winkel von 30 Grad anvisieren. Ein detailliertes Protokoll für die Embryonenentnahme, -ausrichtung und -mikroinjektion findet sich in Terenius et al.45 und Lobo et al.44.
- Die Eier unmittelbar nach der Injektion in eine mit sterilem destilliertem Wasser (pH 7,2) gefüllte Petrischale geben und insektäre Zustände zurückbringen.
- Nach dem Schlüpfen die G0-Larven täglich in ein Tablett mit gesalzenem destilliertem Wasser (0,1% Tonic Salt) geben und in die Puppen zurücklegen.
- Schlupfrate aufzeichnen (d. h. Anzahl der geschlüpften Larven/Anzahl der injizierten Embryonen).
HINWEIS: Die Bewegung des Embryos unterstützt das Schlüpfen, daher ist ein sanftes Wirbeln wünschenswert. Das Schlüpfen sollte ~ 48 h nach der Injektion beginnen. Da die Injektion eine leichte Entwicklungsverzögerung verursachen kann, ist es ratsam, die Überwachung auf spät schlüpfende Larven für 3-4 Tage fortzusetzen.
4. Kreuzung und Screening von transformierten Individuen
- [OPTIONALER SCHRITT] Screen G0 (injiziert) 1. oder 2. Larven im Stadium (L1-L2) für die vorübergehende Expression des fluoreszierenden Markers.
- Verwenden Sie eine Feinspitzen-Glaspipette, um G0 L1-L2-Larven auf einen Objektträger mit Vertiefungen zu übertragen. Legen Sie eine Larve in jeden Brunnen.
- Verwenden Sie ein Fluoreszenz-Stereoskop mit dem entsprechenden Filter, um nach dem Vorhandensein einer transienten Expression des Fluoreszenzmarkers zu suchen.
HINWEIS: Das Muster des transienten Ausdrucks wird vom verwendeten Promotor diktiert. Bei Verwendung des 3xP3-Promotors ist eine vorübergehende Expression des fluoreszierenden Markers in den Analpapillen sichtbar (siehe Abbildung 6 in Pondeville et al.43). - Hintere G0 positive Individuen separat.
- Sortieren Sie G0-Puppen nach Geschlecht unter einem Stereoskop52.
- Lassen Sie Männchen in separaten Käfigen in Gruppen von 3-5 (Gründerfamilien) auftauchen und fügen Sie einen 10-fachen Überschuss an altersgerechten WT-Weibchen hinzu.
HINWEIS: Da sich Männchen mehrmals paaren, ist es wichtig, einen Überschuss an WT-Weibchen bereitzustellen, um die Paarungschancen jedes Männchens zu maximieren. - Lassen Sie Weibchen in separaten Käfigen in Gruppen von 10-15 (Gründerfamilien) auftauchen und fügen Sie eine gleiche Anzahl von altersgerechten WT-Männchen hinzu.
HINWEIS: Wenn der Platz im Insektarium begrenzt ist, können die Weibchen alle zusammen in einem einzigen Käfig auftauchen. Das Verhältnis von Frauen zu Männern kann so niedrig wie 1 Männlich zu 3 Frauen sein. - Erlauben Sie Erwachsenen, sich für 4-5 Tage zu paaren und versorgen Sie die Weibchen mit einer Blutmahlzeit.
HINWEIS: Blutfütterung und -sammlung von Eiern von G0-Weibchen mehrmals, um die Chancen zu maximieren, Transformanten aus mehreren gonotrophen Zyklen zu erhalten. - Blut füttern WT-Individuen zur gleichen Zeit für die Auskreuzung.
- Sammeln Sie Eier und ziehen Sie aufstrebende G1s der nächsten Generation auf.
- Screen G1 L3-L4 Larven auf geeignete Fluoreszenz zur Identifizierung von Transformationsmitteln.
- Sammeln Sie Larven in einer mit Filterpapier ausgekleideten Petrischale oder auf einem Objektträger und -bildschirm mit einem fluoreszierenden Stereoskop mit geeigneten Filtern für das Vorhandensein des Markers, der mit der attB-markierten Ladung eingeführt wurde.
HINWEIS: Fluoreszenz, die durch den 3xP3-Promotor angetrieben wird, ist in allen postembryonalen Stadien sichtbar und das Screening kann an jüngeren Larven durchgeführt werden, diese sind jedoch zerbrechlicher und müssen relativ vorsichtig gehandhabt werden. Puppen können auch gescreent werden.- Für Single-ATTB-Designs für den Integrationsbildschirm für das Vorhandensein des neuen und bereits vorhandenen Markers; Sie sollten beide vorhanden sein, da die neue Kassette neben der Originalkassette eingelegt wird (Abbildung 3A, Abbildung 4).
HINWEIS: Screening-Ausnahme für einzelne ATTB-Designs: Wenn Sie markierungslose Dockinglinien22 verwenden, überprüfen Sie nur das Vorhandensein der neuen Markierung. Wenn Sie Docking-Linien verwenden, bei denen die Integration zur Inaktivierung des bereits vorhandenen Markers21 führt, suchen Sie nach dem Vorhandensein des neuen Markers und dem Verlust des bereits vorhandenen Markers. - Bei Doppel-ATTB-Designs für RMCE, Bildschirm für das Vorhandensein des neuen Markers und den Verlust des bereits vorhandenen Markers sollte nur der neu eingeführte Marker vorhanden sein, da die neue Kassette den ursprünglichen ersetzt (Abbildung 3B, Abbildung 5).
HINWEIS: Gelegentliche Integrationsereignisse können in RMCE-Experimenten wiederhergestellt werden, bei denen nur ein einziges attP rekombiniert wurde und somit beide Marker vorhanden sind. Das Screening von G1-Personen kann nach dem gleichen Verfahren auch im Puppenstadium durchgeführt werden52.
- Für Single-ATTB-Designs für den Integrationsbildschirm für das Vorhandensein des neuen und bereits vorhandenen Markers; Sie sollten beide vorhanden sein, da die neue Kassette neben der Originalkassette eingelegt wird (Abbildung 3A, Abbildung 4).
- Sammeln Sie Larven in einer mit Filterpapier ausgekleideten Petrischale oder auf einem Objektträger und -bildschirm mit einem fluoreszierenden Stereoskop mit geeigneten Filtern für das Vorhandensein des Markers, der mit der attB-markierten Ladung eingeführt wurde.
- Transfer verwandelte G1-Individuen in eine Larvenschale und hinten zu Puppen. Verwerfen Sie nicht fluoreszierende Individuen und Individuen mit einem unerwarteten Markerexpressionsmuster.
- Sortieren Sie transformierte G1-Puppen nach Geschlecht und kreuzen Sie sie massenhaft mit altersgerechten WT-Individuen des anderen Geschlechts.
- Lassen Sie Erwachsene sich für 4-5 Tage paaren, stellen Sie eine Blutmahlzeit zur Verfügung, sammeln Sie die Eier und züchten Sie die G2-Nachkommen der nächsten Generation.
- Sammeln Sie bei einzelnen Integrationsexperimenten Eier direkt vom Massenkreuz , da die Integrationsstelle bei allen Individuen identisch ist.
- Sammeln Sie für RMCE-Experimente Eier von einzelnen Weibchen und halten Sie die Nachkommen getrennt, bis die molekulare Bewertung aufgrund des potenziellen Vorhandenseins von zwei alternativen Kassettenorientierungen abgeschlossen ist (Abbildung 3B).
- Screenen Sie die G2-Nachkommen (entweder im Larven- oder Puppenstadium) auf das Vorhandensein des fluoreszierenden Markers (50% der Individuen werden voraussichtlich positiv sein), verwerfen Sie nicht-fluoreszierende Nachkommen.
- Legen Sie eine Untergruppe von G2-positiven Individuen für die molekulare Analyse beiseite und ziehen Sie den Rest ins Erwachsenenalter zurück.
HINWEIS: Wenn alle G2-Individuen am Leben erhalten werden müssen, kann eine molekulare Analyse an den Beinen eines einzelnen Erwachsenen46 oder an DNA-Extraktionen im Puppenfall durchgeführt werden (L. Grigoraki persönliche Kommunikation). Alternativ kann eine molekulare Analyse durchgeführt werden, nachdem alle G2-Individuen eipositiert haben und Eier geschlüpft sind. - Erlauben Sie erwachsenen Männchen und Weibchen, sich im selben Käfig zu kreuzen, um die neue transgene Linie zu etablieren.
HINWEIS: Bei RMCE-Experimenten muss eine Interkreuzung von Erwachsenen zwischen Geschwistern auftreten, die von einem einzelnen Weibchen stammen, bis die Orientierung der Insertion durch molekulare Analyse bestimmt wird.
5. Molekulare Validierung der Insertionsstelle durch DNA-Amplifikation (PCR)
- Erstellen Sie nach der Transformation eine Karte der vorhergesagten Einfügestelle im Genom der Andocklinie.
- Einzelne Integration: Stellen Sie sicher, dass die vorhergesagte Insertionsstelle das ursprüngliche Docking-Konstrukt sowie die gesamte Sequenz des Donorplasmids zwischen den beiden Hybridstellen attL und attR trägt (Abbildung 3A).
- RMCE: Stellen Sie sicher, dass die vorhergesagte Einfügestelle mit der der Andocklinie identisch ist, wobei hybride invertierte ATTL-Standorte die ursprünglichen invertierten ATTP-Standorte ersetzen und die Austauschvorlage die ursprünglich zwischen ihnen vorhandene Kassette ersetzt (Abbildung 3B).
- Entwerfen Sie Oligonukleotid-Primer, um den Insertionsübergang auf beiden Seiten des Integrationsortes zu verstärken.
- Einzelne Integration: Entwerfen Sie Oligonukleotid-Primerpaare, die sich über die attR - und/oder attL-Standorte erstrecken. Ein Primer muss an das zuvor integrierte Docking-Konstrukt und der andere an das neu integrierte Transgen binden (Abbildung 3A).
- RMCE: Der Kassettenersatz kann in zwei verschiedenen Orientierungen in Bezug auf das Chromosom (bezeichnet als A und B) auftreten. Entwerfen Sie alternative Kombinationen von 4 Oligonukleotid-Primern, um ein diskretes Produkt in nur einer der Orientierungen zu erhalten, wobei ein Paar für Orientierung A diagnostisch und das andere für Orientierung B diagnostisch ist (Abbildung 3B, Abbildung 6).
- Extrahieren Sie genomische DNA von G2-positiven Individuen und führen Sie die diagnostische PCR und Gelelektrophorese durch, um das Vorhandensein erwarteter diagnostischer Amplikone aus den vorhergesagten Integrations-Sitemaps zu visualisieren.
HINWEIS: DNA kann alternativ aus den Beinen eines einzelnen Erwachsenen46 oder Puppenkoffern extrahiert werden (L. Grigoraki persönliche Kommunikation). - Sequenz-PCR-Produkte zur Bestätigung erwarteter Sequenzen.
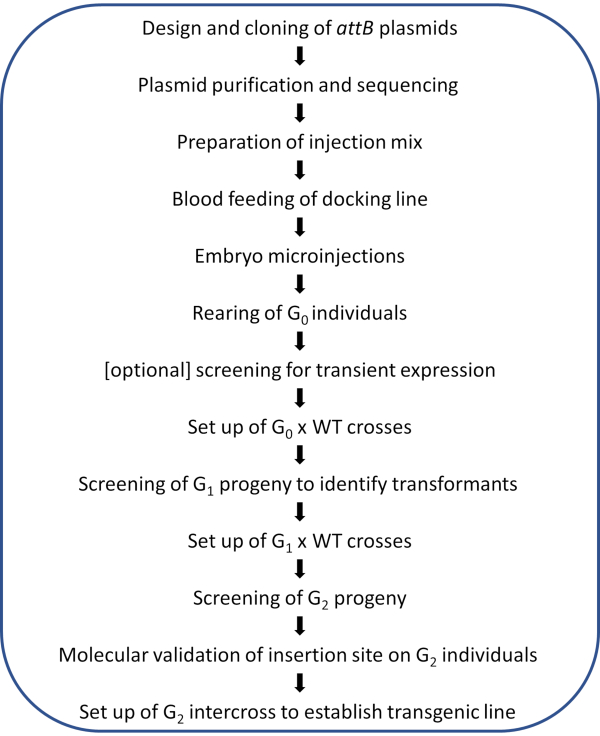
Abbildung 2. Workflow-Diagramm für die ortsgerichtete φC31-Genommodifikation in Anopheles-Mücken . Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
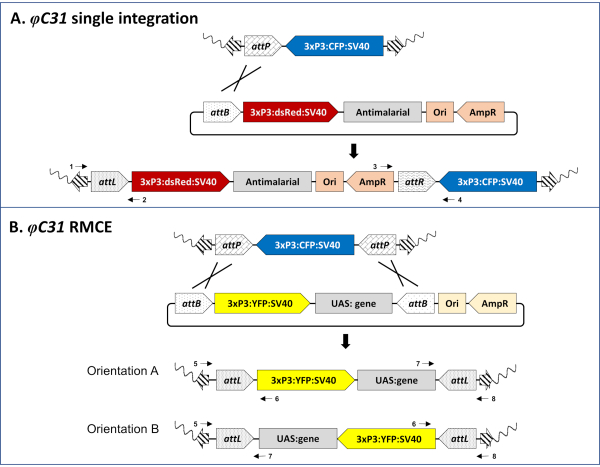
Abbildung 3. Molekulare Grundlagen der φC31-vermittelten Single-Integration (A) und RMCE (B). A) Schematische Karten der genomischen Insertion in eine An. stephensi-Andocklinie (80.9, Tabelle 1), die eine einzelne attP-Stelle trägt und mit CFP (oben), einem mit DsRed markierten Single-attB-Design-Donorplasmid (Mitte) und der erwarteten Insertionsstelle, die sich nach erfolgreicher Integration ergibt (unten). B) Schematische Karten der genomischen Insertion in einer An. gambiae-Andocklinie (A11, Tabelle 1), die zwei invertierte attP-Stellen trägt und mit CFP (oben), einem mit YFP (Mitte) markierten Doppel-attB-Design-Donorplasmid und der erwarteten Insertionsstelle nach erfolgreicher RMCE (unten) gekennzeichnet ist. Wellenlinie: Mückengenom; Gestreifte Pfeile: PiggyBac Transposon Arme; 3xP3: Promotor des fluoreszierenden Markers; SV40: viraler Terminator; Ori: Ursprung der Replikation; AmpR: Ampicillin-Resistenz-Gen. Kreuzungslinien stellen den/die Ort(e) der Rekombination zwischen attP- und attB-Standorten dar. Nummerierte schwarze Pfeile stellen Primer-Bindungsstellen für die molekulare Validierung des Insertionsortes dar (Schritt 5 des Protokolls). Vollständig annotierte einfache und doppelte attB-markierte Plasmide sind auf Anfrage bei den Autoren erhältlich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Das hier dargestellte Protokoll ermöglicht es, eine stabile transgene Anopheles-Linie in ~ 10 Wochen zu erzeugen (unter der Annahme eines 21-tägigen Mückenlebenszyklus).
Es wird erwartet, dass die Larvenbrutraten nach der Injektion in An. gambiae im Allgemeinen niedriger sind als bei An. stephensi, jedoch wurden Schlüpfraten zwischen 10-50% berichtet9,20,24,26,33,43,47. Bei entsprechender Injektionstechnik reichen Schlüpfraten von ≥20% im Allgemeinen aus, um Transformanten zu erhalten. Die DNA-Aufnahme durch die Embryonen kann durch Screening junger Larven auf vorübergehende Expression des fluoreszierenden Markers beurteilt werden. In erfolgreichen RMCE-Experimenten an An. gambiae mit dem 3xP3-Promotor zeigten bis zu 50% der überlebenden G0-Larven eine episomale Expression des Markers in der Analpapille48.
Verallgemeinerte Schätzungen der Transformationseffizienz sind zwischen Labors und sogar zwischen Experimenten schwer zu bewerten, da die Transformation von einem komplexen Zusammenspiel von Variablen abhängt, darunter Reinheit, Konzentration, Größe und potenzielle Toxizität der injizierten DNA, Qualität der Eier, Handhabung von Eiern vor und nach der Injektion, Mückenaufzucht und vor allem die Erfahrung des Bedieners. Transformationsraten von bis zu 7% wurden für RMCE in An. gambiae (berechnet als die Anzahl der unabhängigen Transformationsereignisse in der Gesamtzahl der G0-Individuen)9,26,33 und bis zu 2,2% Transformationsrate für die Integration in An. stephensi erhalten. Wir schlagen vor, mindestens 500 Embryonen zu injizieren, was zum Schlüpfen von mindestens 100 G0-Larven und zu 2-7 G0 erwachsenen Gründern führen sollte, aus denen stabil transformierte Nachkommen gewonnen werden können. Beim Screening auf vorübergehende Expression bei G0-Larven können bis zu 40 positive Larven erwartet werden.
Beispiele für die phänotypische Validierung der Transformation durch das Screening von fluoreszierenden Markern, die durch den 3xP3-Promotor reguliert werden, sind in Abbildung 4 und Abbildung 5 dargestellt. Abbildung 4 zeigt eine neue An. stephensi-Linie, die durch Einsetzen einer DsRed-markierten Kassette in eine mit CFK markierte Andocklinie erhalten wurde (80.9, Tabelle 1), was dazu führt, dass G1-Nachkommen beide Marker exprimieren, wie durch die in den Augen nachgewiesene rote und blaue Fluoreszenz angezeigt.
Es wird stattdessen erwartet, dass RMCE-Designs dazu führen, dass der marker, der ursprünglich in die Docking-Linie eingeführt wurde, durch den des Donorplasmids ersetzt wird. Abbildung 5A und Abbildung B veranschaulichen diesen Markeraustausch in einer mit CFK gekennzeichneten An. gambiae-Andocklinie (A11, Tabelle 1), wo nach erfolgreicher RMCE der CFP-Marker verloren geht und der YFP-Marker erfasst wird, was zu einer gelben (aber nicht blauen) Augen- und Nervenstrangfluoreszenz führt33. Gelegentlich kann RMCE zu einem einzigen Integrationsereignis anstelle des Austauschs der gewünschten transgenen Kassette führen, wie in Abbildung 5C dargestellt, wo eine Larve gezeigt wird, die sowohl mit dem ursprünglichen CFP als auch mit den neuen YFP-Markern markiert ist. Es wird berichtet, dass bis zu 50% der Gesamtzahl der Transformationsereignisse einzelne Integrationen sind9,33.
Beim Screening auf das Vorhandensein eines fluoreszierenden Markers ist es entscheidend, sein Signal von einer möglichen Hintergrundautofluoreszenz zu unterscheiden. Dies ist besonders wichtig bei der Verwendung von CFP, da Anopheles-Larven eine natürliche blaue Autofluoreszenz aufweisen (Abbildung 6A). Die Erhöhung der Vergrößerung und die Konzentration auf die Gewebe und Organe, bei denen die Fluoreszenz voraussichtlich vom Promotor angetrieben wird, ist notwendig, um echte CFP-positive Individuen zu identifizieren, wie in Abbildung 6B unter Verwendung des 3xP3-CFP-Markers dargestellt.
Einzelne Transformanten werden schließlich molekular mittels PCR untersucht, um die erwartete Insertionsstelle zu bestätigen. Abbildung 7 zeigt die PCR-Validierung bei Individuen aus einer Austausch-An. gambiae-Linie , die die beiden möglichen Orientierungen der Insertion im Mückengenom zeigt33.
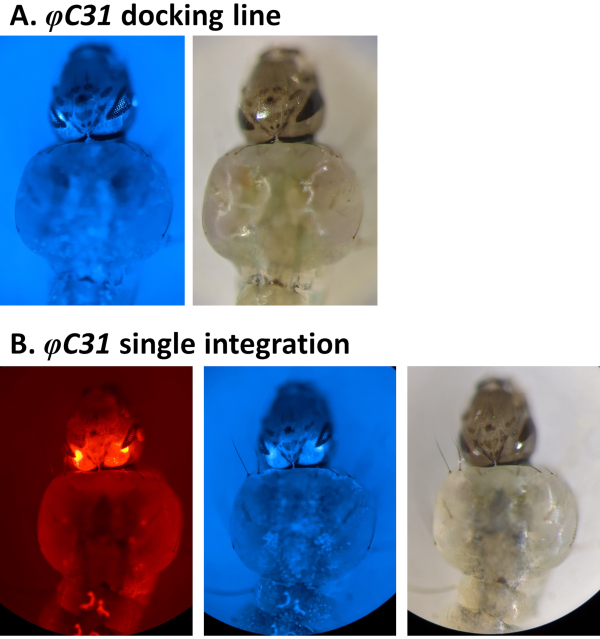
Abbildung 4. Validierung der φC31-Einzelintegration in An. stephensi-Larven (dorsale Ansicht). A) Die Andocklinie (80.9, Tabelle 1) drückt die GFP in den Augen unter der Regulierung des 3xP3-Promotors aus. B) Eine erfolgreiche Integration führt zur Expression des neu erworbenen DsRed sowie des ursprünglichen CFP-Markers in den Augen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
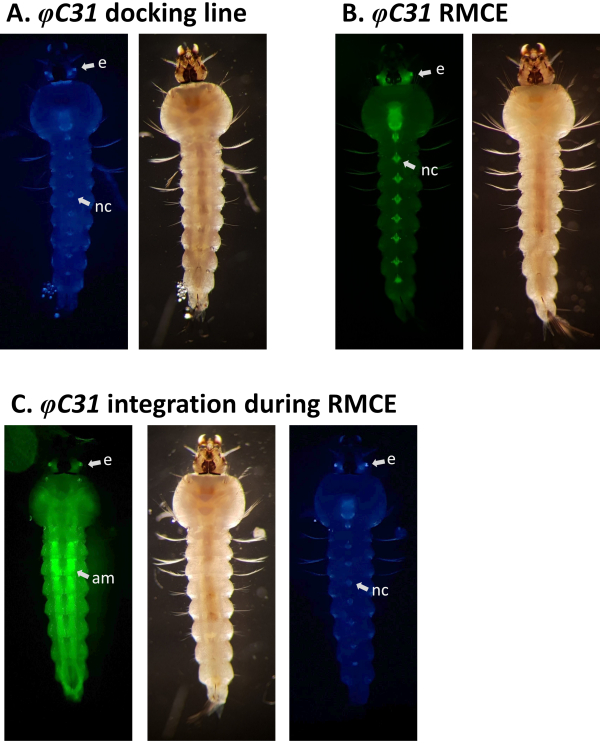
Abbildung 5. Validierung von φC31 RMCE in An. gambiae Larven (ventrale Ansicht). A) Die Andocklinie (A10, Tabelle 1) drückt CFP unter der Regulation des 3xP3-Promotors in den Augen (e) und dem Nervenstrang (nc)5 aus. B) Erfolgreiche RMCE führt zum Wechsel des Fluoreszenzmarkers von CFP zu YFP33. C) Während des RMCE-Experiments trat ein einzelnes Integrationsereignis auf, bei dem die transformierende Larve sowohl die CFP- als auch die YFP-Marker exprimiert. Diese Larve trägt GAL4/UAS-Komponenten, die ein breites Expressionsmuster von YFP verursachen, besonders stark in den Bauchmuskeln (am). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
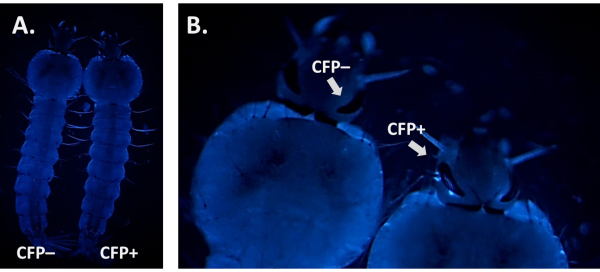
Abbildung 6. CFP-Autofluoreszenz in An. gambiae-Larven (dorsale Ansicht). A) Side-by-Side-Bild einer positiven (CFP+) und einer negativen (CFP-) L4-Larve mit dem CFP-Filter. B) Nahaufnahme der Larvenaugen, die ein CFP+ vs CFP - Individuum zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
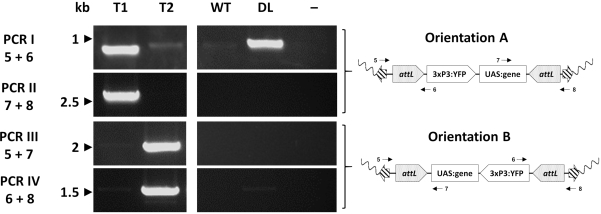
Abbildung 7. Molekulare Validierung der Orientierung der Kassetteneinfügung in repräsentativer transgener An. gambiae erstellt durch φC31 RMCE. Die transgene Kassette kann in einer von zwei alternativen Ausrichtungen (A oder B) in Bezug auf die Einfügestelle eingesetzt werden. Jede PCR-Reaktion (I - IV) verwendet eine Kombination von Primern (5-8)33 , die entwickelt wurden, um ein diagnostisches Amplifikationsfragment für jede Orientierung zu erhalten, wie in den schematischen Plasmidkarten angegeben. T1: repräsentatives transgenes Individuum, das die Orientierung der Insertion A trägt; T2: repräsentatives transgenes Individuum, das die Orientierung der Insertion B trägt; WT: Wildtyp; DL: Docking-Linie; -: Reaktionsnegativkontrolle, bei der Wasser als Vorlage verwendet wurde. Diese Zahl wurde von Adolfi et al. (2019)33 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Spezies | Dehnung | Name | attP(s) | Chromo-some | Promoter-Marker | Herkunftsinstitution | Referenz |
| An. stephensi | Indiana | 26,10 b | Ledig | 2R | 3xP3-eCFP | Univ. von Kalifornien Irvine | 25 |
| An. stephensi | Indiana | 44Cb | Ledig | X | 3xP3-eCFP | Univ. von Kalifornien Irvine | 23, 24 |
| An. stephensi | Indiana | 80,9 Mrd. | Ledig | 2L | 3xP3-eCFP | Univ. von Kalifornien Irvine | Diese Studie |
| An. gambiae | G3 | 113 | Ledig | 2R | 3xP3-eCFP | Univ. von Kalifornien Irvine | Diese Studie |
| An. gambiae | KIL | Ec | Ledig | 3R | 3xP3-eCFP | Keele Univ. | 19, 43 |
| An. gambiae | G3 | X1 | Ledig | 2L | Keine Markierung | Universität Straßburg | 22 |
| An. gambiae | G3 | YAttP | Ledig | Y | 3xP3-Ausschreibung | Imperial Hochschule London | 21 |
| An. gambiae | G3 | A10b | Doppelt | 2R | 3xP3-eCFP | Liverpool Schule Trop. Med. | 5 |
| An. gambiae | G3 | A11b | Doppelt | 2R | 3xP3-eCFP | Liverpool Schule Trop. Med. | 9 |
| ein. Stamm von der Johns Hopkins University (Schenkung von M. Jacobs-Lorena) und in Kultur an der Univ. of California Irvine für >20 Jahre. | |||||||
| b. Diese Zeilen sind auf begründeten Wunsch bei den Autoren erhältlich. | |||||||
| c. Diese Zeile ist im BEI-Repository www.beiresources.org als MRA-1163 verfügbar. | |||||||
Tabelle 1. Anopheles attP Docking-Linien.
Diskussion
Das genaue Design von attB-markierten Plasmiden, die mit der Docking-Linie ihrer Wahl kompatibel sind, ist für den Erfolg des Experiments von größter Bedeutung. Die Wahl des Markers, der für das Screening von Transformationsmitteln verwendet wird, einschließlich der Fluoreszenzfarbe und ihres Expressionsmusters, die dem bereits in der Andocklinie vorhandenen Muster unterliegen, muss sorgfältig geprüft werden. Es ist notwendig, fluoreszierende Marker zu verwenden, die leicht unterscheidbar sind: Gute Markerkombinationen umfassen RFP (rot) / CFP (cyan), RFP (rot) / GFP (grün), RFP (rot) / YFP (gelb) und YFP (gelb) / CFP (cyan), während kombinationen, die vermieden werden sollten, YFP (gelb) / GFP (grün) und CFP (cyan) / GFP (grün) sind. Der 3xP3-Promotor39, spezifisch für die Augen und das Nervenstrang, wird am häufigsten verwendet, um die Expression von fluoreszierenden Markern für die Mückentransgenese zu steuern. Tatsächlich nutzen alle derzeit verfügbaren Anopheles-Dockinglinien diesen Promoter. Alternative regulatorische Regionen sind die des An. gambiae-Polyubiquitin-Gens (PUBc)5 oder des viralen Promotors IE120, die die Expression in mehreren Geweben antreiben. Wenn sie zusammen mit 3xP3 verwendet werden, würden diese Promotoren die möglichen Farbkombinationen und sogar die Verwendung desselben Fluorophors erweitern. Die angegebenen Promotoren sind während des gesamten Lebenszyklus der Mücke aktiv, was ein Screening und eine Fluoreszenzüberwachung in allen Lebensstadien ermöglicht. Eine zusätzliche Überlegung beim Plasmiddesign ist die Größe der zu integrierenden oder auszutauschenden Ladung. Während das φC31-System bemerkenswerte Tragfähigkeiten hat18, sollte berücksichtigt werden, dass die Größe des Donorplasmids im Allgemeinen negativ mit der Transformationseffizienz korreliert22.
Im beschriebenen Protokoll ist die Quelle der Integrase ein Helferplasmid, das das Enzym ubiquitär exprimiert40. Das ubiquitäre Vorhandensein der Integrase kann zur Umwandlung von Körperzellen führen, wenn Mikroinjektionen nicht genau auf den Bereich gerichtet sind, in dem sich die Keimbahn bildet. Während solche Transformationsereignisse verloren gehen, da sie nicht vererbbar sind, können somatische Effekte die Fitness injizierter Individuen verringern. Um dies zu vermeiden und die Umwandlungseffizienz zu erhöhen, kann die Integraseexpression auf die Keimbahn beschränkt werden, beispielsweise durch Verwendung des Vasapromotors22,26. Andere Protokolle beschreiben die Verwendung von in vitro transkribierter Boten-RNA (mRNA) als Quelle der φC31-Integrase19,24,43. Dies beinhaltet jedoch die mühsame Herstellung von mRNA und erfordert einen sorgfältigen Umgang mit der Injektionsmischung und die Verwendung von RNase-freien Reagenzien, um einen Abbau zu vermeiden. Plasmidquellen der Integrase haben sich sowohl in An. gambiae9,21,22,26,33,37 als auch in An. stephensi (A.A. persönliche Kommunikation) als zuverlässig erwiesen und führen zu einer effizienten Transformation und sind daher unsere bevorzugte Option. Eine weitere Option für die Integrase-Abgabe ist die In-vivo-Produktion in selbstdockenden Helferleinen. Solche Linien wurden in An. gambiae erzeugt, die die φC31-Integrase unter der Regulation der keimbahnspezifischen Promotor-Nanos exprimieren und zu einer verbesserten Überlebens- und Transformationseffizienz führen20. Es müssen jedoch mögliche Fitnessbelastungen durch die In-vivo-Produktion des Integrase-Enzyms an der Hilfslinie berücksichtigt werden.
Wie bei anderen transgenen Techniken muss der Aufzucht und Kreuzung von Individuen, die aus injizierten Embryonen stammen, besondere Aufmerksamkeit gewidmet werden, um die Chancen auf die Gewinnung von Transformationsmitteln zu maximieren. Personen, die das Transgen stabil geerbt haben, können zunächst an den G1-Nachkommen gewonnen werden. Frühe Anzeichen einer möglichen Transformation können jedoch durch das Vorhandensein einer vorübergehenden episomalen Expression des fluoreszierenden Markers in den Analpapillen und/oder Nervensträngen der ersten und zweiten Larven von G0 unter Verwendung des 3xP3-Promotors43 bewertet werden. Während das Vorhandensein von vorübergehender Fluoreszenz auf eine erfolgreiche Plasmidabgabe hindeutet, garantiert sie keine vererbbare Keimbahntransformation. Ebenso schließt das Fehlen eines transienten Ausdrucks eine erfolgreiche Transformation nicht aus. Dennoch wurde beobachtet, dass vorübergehend positive Individuen eher transgene Nachkommen hervorbringen als vorübergehend negative43,48. In fachkundigen Händen kann die Aufzucht und Kreuzung von nur positiven Individuen eine Option sein, um die Anzahl der Mücken zu reduzieren. Angesichts der Bedeutung und Zerbrechlichkeit kleiner G0-Larven ist jedoch immer noch die geringste Manipulation ratsam und die Aufzucht aller G0-Individuen wird immer empfohlen.
Das in diesem Protokoll beschriebene Paarungsschema wurde entwickelt, um die Wahrscheinlichkeit der Paarung zu maximieren und unabhängige Transformationsereignisse zu isolieren. Wenn jedoch Insektenraum oder Personalverfügbarkeit ein Problem darstellt, können G0-Erwachsene nach Geschlecht in Einzelkäfigen zusammengefasst werden, wenn genügend gegengeschlechtliche Personen zur Verfügung gestellt werden. Ein solches Setup ermöglicht keine Unterscheidung zwischen mehreren Transformationsereignissen, die bei Individuen aus demselben Käfig auftreten. Je nach Versuchsaufbau wird während des Screening-Prozesses mit dem Vorhandensein eines doppelten (einfache Integration) oder eines einfachen (RMCE) Markers gerechnet. In einzelnen Integrationsexperimenten ist es wichtig, das Vorhandensein des ursprünglichen Markers von der Andocklinie zu überprüfen, während es in RMCE wichtig ist, den Verlust des zuvor integrierten Markers zu überprüfen. In der Tat ist es in RMCE-Designs nicht ungewöhnlich, Transformationsmittel zurückzugewinnen, bei denen aufgrund der Rekombination eines einzelnen attP-Standorts eine einzelne Integration anstelle eines Austauschs stattfand9,33. Bei solchen Individuen sind sowohl fluoreszierende Marker als auch das gesamte Spenderplasmid-Rückgrat vorhanden, was die Bedeutung eines gründlichen Screenings für beide Fluoreszenzmarker unterstreicht.
Während das Vorhandensein von erwarteten Fluoreszenzmustern auf eine erfolgreiche Transformation hinweist, muss eine molekulare Charakterisierung der Insertionsstelle vorgenommen werden. Dazu ist die Erstellung genauer Karten des vorhergesagten Insertionsortes, einschließlich der flankierenden genomischen Regionen der Andocklinie, entscheidend für das Design adäquater diagnostischer Oligonukleotid-Primer für Genamplifikationsanalysen. Einzelne Integrationsereignisse führen zur Bildung von attR - und attL-Hybridstellen an der Verbindung zwischen der neu integrierten DNA und der zuvor eingefügten Kassette. Diese Websites können für die Validierung der Einfügewebsite als Ziel festgelegt werden. In RMCE-Designs kann das Einsetzen der Donorkassette in zwei alternativen Orientierungen in Bezug auf den genomischen Locus erfolgen, so dass vier Primer in alternativen PCR-Kombinationen verwendet werden können, um zu erkennen, welche Orientierung die Linie trägt. Da die Orientierung der Kassetteneinfügung die Transgenexpression beeinflussen kann, ist es bei der vergleichenden Genexpressionsanalyse wichtig, Linien mit der gleichen Ausrichtung der Insertion zu verwenden.
Bei der Arbeit mit einer geringen Anzahl von Transformationsmitteln ist es möglicherweise nicht wünschenswert, ganze Individuen für die molekulare Analyse zu opfern. Eine Option dazu ist die Durchführung einer molekularen Analyse von DNA, die aus den Beinen eines einzelnen Erwachsenen extrahiert wurde46 , da der Beinverlust die Fähigkeit eines erwachsenen Weibchens, sich zu paaren und zu ovipositieren, nicht beeinträchtigt49. Es besteht jedoch die Gefahr, dass die Person bei der Beinentfernung beschädigt wird. Der Erfolg wurde mit verworfenen Puppenfällen (L. Grigoraki persönliche Kommunikation) erzielt, aber der sicherste Ansatz besteht darin, eine molekulare Analyse an G2-Eltern durchzuführen, nachdem sie lebensfähige G3-Nachkommen erhalten haben.
In den letzten Jahren hat CRISPR/Cas9 die Art und Weise der ortsspezifischen Genom-Editierung revolutioniert26,41,50,51. Im Gegensatz zu ortsgerichtetem RMCE sind CRISPR/Cas9-vermittelte Genintegrationen (Knock-Ins) unabhängig vom Vorhandensein von vorinstallierten Rekombinationsstellen, wobei nur ein einstufiges Transformationsereignis erforderlich ist. Dennoch beruht das CRISPR/Cas9-System auf dem Vorhandensein großer bekannter genomischer Sequenzen, die die gewünschte Insertionsstelle für eine erfolgreiche homologiegerichtete Reparatur flankieren, sowie auf der effizienten Standorterkennung, die durch Leit-RNAs vermittelt wird. Diese Bedingungen können nicht immer erfüllt werden oder können mühsam zu beheben sein, und angesichts der Verfügbarkeit mehrerer Andocklinien in An. gambiae und An. stephensi und der von ihnen abgeleiteten Leitungen bleibt das φC31-System ein sehr wertvolles Werkzeug, um direkte phänotypische Vergleiche zwischen Transgenen an denselben genomischen Standorten durchzuführen.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken Kiona Parker (UCI) für die Bereitstellung von Bildern von transgenen An. stephensi-Larven und Fraser Colman (LSTM) und Beth Poulton (LSTM) für die Bereitstellung transgener An. gambiae-Larven . Beth Poulton (LSTM) leistete auch wertvolle Hilfe bei der Bildgebung von An. gambiae-Larven . Diese Arbeit wurde vom Tata Institute for Genetics and Society (TIGS) und dem Director Catalyst Fund des LSTM finanziert, der an A.A. (DCF2014AA) vergeben wurde. A.A.J. ist Donald Bren Professor an der University of California, Irvine.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL eppendorf tubes | |||
| 8-well microslides | VWR | MARI1216690 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Ethanol, Absolute, Molecular Biology Grade | |||
| Filter set CFP for Leica MZ FLIII Excitation 436/20 nm, extinction 480/40 nm | Leica | 10446363 | |
| Filter set dsRED for Leica MZ FLIII Excitation 545/30 nm, extinction 620/60 nm | Leica | 10447079 | |
| Filter set YFP customised for Leica MZ FLIII | Omega Optical | 500QM25, 500QM35 | |
| Halocarbon oil 27 | Sigma | H8773 | |
| Halocarbon oil 700 | Sigma | H8898 | |
| Petri dishes | |||
| Potassium chloride | |||
| Sodium Chloride | |||
| Sodium phosphate dibasic | |||
| Sodium Acetate Solution (3 M), pH 5.2 | Thermo Fisher Scientific (Life Technologies) | R1181 | |
| Stable brush Size 0 |
Referenzen
- Adolfi, A., Lycett, G. J. Opening the toolkit for genetic analysis and control of Anopheles mosquito vectors. Current Opinion in Insect Science. 30, 8-18 (2018).
- Grossman, G. L., Rafferty, C. S., Clayton, J. R., Stevens, T. K., Mukabayire, O., Benedict, M. Q. Germline transformation of the malaria vector, Anopheles gambiae, with the piggyBac transposable element. Insect Molecular Biology. 10 (6), 597-604 (2001).
- Nolan, T., Bower, T. M., Brown, A. E., Crisanti, A., Catteruccia, F. piggyBac-mediated germline transformation of the malaria mosquito Anopheles stephensi using the red fluorescent protein dsRED as a selectable marker. Journal of Biological Chemistry. 277 (11), 8759-8762 (2002).
- Perera, O. P., Harrell, R. A., Handler, A. M. Germ-line transformation of the South American malaria vector, Anopheles albimanus, with a piggyBac/EGFP transposon vector is routine and highly efficient. Insect Molecular Biology. 11 (4), 291-297 (2002).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Carballar-Lejarazú, R., Jasinskiene, N., James, A. Exogenous gypsy insulator sequences modulate transgene expression in the malaria vector mosquito, Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 110 (18), 7176-7181 (2013).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977(2014).
- Nolan, T., Petris, E., Müller, H. M., Cronin, A., Catteruccia, F., Crisanti, A. Analysis of two novel midgut-specific promoters driving transgene expression in Anopheles stephensi mosquitoes. PLoS ONE. 6 (2), 16471(2011).
- Lynd, A., Balabanidou, V., Vontas, J., Lycett, G. J. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: appliction to cuticular hydrocarbon synthesis. BioRxiv. , (2019).
- O'Brochta, D. A., Alford, R. T., Pilitt, K. L., Aluvihare, C. U., Harrell, R. A., Harrell, R. A. piggyBac transposon remobilization and enhancer detection in Anopheles mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16339-16344 (2011).
- O'Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based enhancer-trapping in the malaria mosquito Anopheles stephensi. G3. 2 (11), Bethesda. 1305-1315 (2012).
- Macias, V. M., et al. nanos-Driven expression of piggyBac transposase induces mobilization of a synthetic autonomous transposon in the malaria vector mosquito, Anopheles stephensi. Insect Biochemistry and Molecular Biology. 87, 81-89 (2017).
- Nimmo, D. D., Alphey, L., Meredith, J. M., Eggleston, P. High efficiency site-specific genetic engineering of the mosquito genome. Insect Molecular Biology. 15 (2), 129-136 (2006).
- Kim, A., Pyykko, I. Size matters: Versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354, 301-309 (2011).
- Thorpe, H. M., Smith, M. C. M. In vitro site-specific integration of bacteriophage DNA catalyzed by a recombinase of the resolvase/invertase family. Proceedings of the National Academy of Sciences of the United States of America. 95 (10), 5505-5510 (1998).
- Khaleel, T., Younger, E., Mcewan, A. R., Varghese, A. S., Smith, M. C. M. A phage protein that binds φC31 integrase to switch its directionality. Molecular Microbiology. 80 (6), 1450-1463 (2011).
- Farruggio, A. P., Chavez, C. L., Mikell, C. L., Calos, M. P. Efficient reversal of phiC31 integrase recombination in mammalian cells. Biotechnology Journal. 7 (11), 1332-1336 (2012).
- Venken, K. J. T., He, Y., Hoskins, R. A., Bellen, H. J. P[acman]: A BAC Transgenic Platform for Targeted Insertion of Large DNA Fragments in D. melanogaster. Science. 314 (5806), 1747-1751 (2006).
- Meredith, J. M., et al. Site-specific integration and expression of an anti-malarial gene in transgenic Anopheles gambiae significantly reduces Plasmodium infections. PLoS ONE. 6 (1), 14587(2011).
- Meredith, J. M., Underhill, A., McArthur, C. C., Eggleston, P. Next-Generation Site-Directed Transgenesis in the Malaria Vector Mosquito Anopheles gambiae: Self-Docking Strains Expressing Germline-Specific phiC31 Integrase. PLoS ONE. 8 (3), 59264(2013).
- Bernardini, F., et al. Site-specific genetic engineering of the Anopheles gambiae Y chromosome. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7600-7605 (2014).
- Volohonsky, G., et al. Tools for Anopheles gambiae Transgenesis. G3. 5 (6), Bethesda. 1151-1163 (2015).
- Amenya, D. A., et al. Comparative fitness assessment of Anopheles stephensi transgenic lines receptive to site-specific integration. Insect Molecular Biology. 19 (2), 263-269 (2010).
- Isaacs, A. T., et al. Transgenic Anopheles stephensi coexpressing single-chain antibodies resist Plasmodium falciparum development. Proceedings of the National Academy of Sciences of the United States of America. 109 (28), 1922-1930 (2012).
- Pham, T. B., et al. Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLoS Genetics. 15 (12), 1008440(2019).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2015).
- Groth, A. C., Fish, M., Nusse, R., Calos, M. P. Construction of Transgenic Drosophila by Using the Site-Specific Integrase from Phage phiC31. Genetics. 166 (4), 1775-1782 (2004).
- Franz, A. W. E., et al. Comparison of transgene expression in Aedes aegypti generated by mariner Mos1 transposition and site-directed recombination. Insect Molecular Biology. 20 (5), 587-598 (2011).
- Labbé, G., Nimmo, D., Alphey, L. piggybac-and PhiC31-Mediated Genetic Transformation of the Asian Tiger Mosquito, Aedes albopictus (Skuse). PLoS Neglected Tropical Diseases. 4 (8), 788(2010).
- Schetelig, M. F., Scolaric, F., Handler, A. M., Kittelmann, S., Gasperi, G., Wimmer, E. A. Site-specific recombination for the modification of transgenic strains of the Mediterranean fruit fly Ceratitis capitata. Proceedings of the National Academy of Sciences of the United States of America. 106 (43), 18171-18176 (2009).
- Yonemura, N., et al. phiC31-integrase-mediated, site-specific integration of transgenes in the silkworm, Bombyx mori (Lepidoptera: Bombycidae). Applied Entomology and Zoology. 43 (11), 997-1008 (2013).
- Bateman, J. R., Lee, A. M., Wu, C. T. Site-specific transformation of Drosophila via phiC31 integrase-mediated cassette exchange. Genetics. 173 (2), 769-777 (2006).
- Adolfi, A., Poulton, B., Anthousi, A., Macilwee, S., Ranson, H., Lycett, G. J. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Haghighat-Khah, R. E., et al. Site-specific cassette exchange systems in the aedes aegypti mosquito and the Plutella xylostella moth. PLoS ONE. 10 (4), 0121097(2015).
- Long, D., Lu, W., Zhang, Y., Bi, L., Xiang, Z., Zhao, A. An efficient strategy for producing a stable, replaceable, highly efficient transgene expression system in silkworm, Bombyx mori. Scientific Reports. 5 (1), 8802(2015).
- Volohonsky, G., et al. Transgenic Expression of the Anti-parasitic Factor TEP1 in the Malaria Mosquito Anopheles gambiae. PLoS Pathogens. 13 (1), 1006113(2017).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019(2020).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Berghammer, A. J., Klingler, M., Wimmer, E. A. A universal marker for transgenic insects. Nature. 402 (6760), 370-371 (1999).
- Ringrose, L. Transgenesis in Drosophila melanogaster. Methods in Molecular Biology. 561, 3-19 (2009).
- Dong, Y., Simões, M. L., Marois, E., Dimopoulos, G. CRISPR/Cas9 -mediated gene knockout of Anopheles gambiae FREP1 suppresses malaria parasite infection. PLoS Pathogens. 14 (3), 1006898(2018).
- Lombardo, F., Lycett, G. J., Lanfrancotti, A., Coluzzi, M., Arcà, B. Analysis of apyrase 5' upstream region validates improved Anopheles gambiae transformation technique. BMC research notes. 2, 24(2009).
- Pondeville, E., et al. Efficient ΦC31 integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Lobo, N. F., Clayton, J. R., Fraser, M. J., Kafatos, F. C., Collins, F. H. High efficiency germ-line transformation of mosquitoes. Nature protocols. 1 (3), 1312-1317 (2006).
- Terenius, O., Juhn, J., James, A. A. Injection of An. stephensi embryos to generate malaria-resistant mosquitoes. Journal of Visualized Experiments. 5, 216(2007).
- Lynd, A., et al. Insecticide resistance in Anopheles gambiae from the northern Democratic Republic of Congo, with extreme knockdown resistance (kdr) mutation frequencies revealed by a new diagnostic assay. Malaria Journal. 17 (1), 412(2018).
- Marinotti, O., et al. Development of a population suppression strain of the human malaria vector mosquito, Anopheles stephensi. Malaria Journal. 12 (1), 142(2013).
- Adolfi, A. In vivo functional genetic analysis of insecticide resistance in the malaria mosquito Anopheles gambiae. University of Liverpool. , PhD thesis (2017).
- Isaacs, A. T., Lynd, A., Donnelly, M. J. Insecticide-induced leg loss does not eliminate biting and reproduction in Anopheles gambiae mosquitoes. Scientific Reports. 7, 46674(2017).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), 6736-6743 (2015).
- Li, M., Akbari, O. S., White, B. J. Highly efficient site-specific mutagenesis in malaria mosquitoes using CRISPR. G3: Genes, Genomes, Genetics. 8 (2), 653-658 (2018).
- Poulton, B. C., et al. Using the GAL4-UAS System for Functional Genetics in Anopheles gambiae. J. Vis. Exp. , (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten