Method Article
말라리아의 아노필스 벡터에서 사이트 지향 φC31 중재 통합 및 카세트 교환
요약
이 프로토콜은 φC31 시스템을 사용하여 Anopheles 말라리아 모기의 게놈에서 사이트 지향적 인 수정을 달성하는 방법을 설명합니다. 설명된 수정은 attP 베어링 도킹 라인의 게놈에 있는 형질전환 카세트의 통합 그리고 교환둘 다 포함됩니다.
초록
말라리아의 유전적 통제를 위한 기능적인 게놈 분석 및 관련 전략은 Anopheles 모기의 게놈을 정확하게 수정하기 위하여 검증되고 재현가능한 방법에 의지합니다. 이러한 방법 들 중, φC31 시스템은 유전자의 정확하고 안정적인 현장 지향 통합을 허용, 또는 재조합 매개 카세트 교환을 통해 통합 된 형질화 카세트의 대체 (RMCE). 이 방법은 연쇄상 구균 φC31 박테리오파지 인테그라스의 작용에 의존하여 attP(파지에서 파생) 및 attB(숙주 박테리아로부터 유래)로 지정된 두 개의 특정 부착 부위 간의 재조합을 촉매한다. 이 시스템은 이전에 모기 게놈 및 attB 사이트와 기증자 템플릿 DNA에 통합된 하나 또는 두 개의 attP 사이트를 사용합니다. 여기서는 통합 또는 교환 템플릿을 운반하는 attB 태그기증자와 φC31 integrase를 인코딩하는 도우미 플라스미드와 같은 두 개의 플라스미드를 사용하여 attP 베어링 Anopheles 도킹 라인의 게놈을 안정적으로 수정하는 방법을 설명합니다. 우리는 φC31 중재 사이트 지향 수정의 두 가지 대표적인 결과를보고: An. stephensi와 An. 감비아에 모기에 있는 RMCE에 있는 형질전환 카세트의 단일 통합. φC31 매개 게놈 조작은 검증된 피트니스 중성 게놈 부위로부터 재현 가능한 유전자 발현의 이점을 제공하여 표현형의 비교 질적 및 정량적 분석을 가능하게 합니다. 또한 통합의 사이트 지향 특성은 또한 안정적인 형질 전환선을 얻기 위해 단일 삽입 부위및 결합 방식의 유효성 검사를 실질적으로 단순화합니다. 이들 및 기타 특성은 φC31 시스템을 말라리아 모기 및 기타 곤충 벡터의 형질 전환 조작을 위한 유전 툴킷의 필수 구성 요소로 만듭니다.
서문
질병의 모기 벡터의 게놈을 안정적으로 그리고 재현가능하게 수정하는 능력은 유전자의 생체 내 기능적 검증 을 강화하고 말라리아를 전송하는 아노페Les 모기를 표적으로 하는 것과 같은 실현 가능한 유전 벡터 통제 전략에 문을 열었습니다1.
초기 모기 게놈 편집은 전이 가능한 원소(TE)매개 변환에만 의존했으며, 피기박은 Anopheles2,3,4에서 가장 일반적으로 사용되는 트랜스포슨입니다. 그러나, TE 통합의 무작위 적 특성은 유전자 녹아웃 (삽입 돌연변이 발생)과 같은 바람직하지 않은 변형으로 이어질 수 있으며, 유전자 발현에 대한 중요한 위치 효과5,6,7,8. 여러 삽입은 또한 piggyBac5,9를 사용할 때 일반적인 발생, 이는 단일 삽입과 형질 대사의 유효성 검사 및 격리를 힘들게. 다른 단점은 그들의 잠재적인 재동원을 포함, Anopheles stephensi의 세균에서 관찰 되는 돼지 박 transposase10,11,12의 소스를 제공할 때, DNA화물의 제한된 크기 (10-15 kb 길이) 기증자 플라스미드의 증가 크기와 함께 변환 효율 감소와 함께 13,14.
이러한 문제를 우회하기 위해 사이트 지향 통합 접근 방식이 도입되었습니다. 모기에서 가장 흔한 사이트 지향 게놈 수정은 φC31 시스템에 의해 매개된다(도 1a). 이는 박테리오파지 φC31(attP)의 게놈에서 자연적으로 발생하는 두 개의 이성특이적 부착(att) 부위와 연쇄상 구균 박테리움 숙주(attB)15 사이의 재결합을 촉매하는 바이러스 성 내테그라스에 의해 구동된다. 두 사이트의 재결합은 단방향이며 하이브리드 사이트 (attL 및 attR)의 형성을 초래합니다. 이러한 하이브리드 사이트의 재조합 (DNA 절제로 이어지는) 활성 바이러스 성 정수뿐만 아니라 또 다른 파지 인코딩 재조합 계수의 존재뿐만 아니라 필요합니다16,17. 따라서 잠재적인 원치 않는 재모빌화15의 문제를 완화하는 안정적인 통합 사이트가 생성됩니다. 더욱이, 이 시스템은 대형 화물의 통합(예를 들어, >100kb 구체의 통합이 D. melanogaster18에서 보고됨)의 통합을 허용하고, 운반 능력을 크게 증가시다. 통합은 안정적인 형질전환선을 얻기 위해 삽입 및 결합 방식의 유효성검사를 크게 단순화하는 단일 미리 정의된 게놈 궤적에서 발생합니다. 마지막으로, 통합의 사이트 지향 특성은 대체 전유전자가 동일한 궤적에 위치하므로 동일한 이웃 게놈 컨텍스트 내에서 조절되므로 발현의 정상화를 가능하게 합니다. 실제로, 기술의 주요 응용 프로그램 중 하나는 동일한 궤적에 삽입 다음 다른 트랜스 유전자에 의해 수여 표현형의 직접 비교이다.
φC31 중재 통합 달성은 2단계와 관련이 있습니다: 위상 I는 attP 사이트를 운반하는 형질전환 도킹 라인의 생성이며, 위상 II는 도킹 라인19의 게놈에서 attB 측면화물의 현장 지향 통합이다. 단계 I 도킹 라인의 생성은 attP 태그 구조의 TE 매개 무작위 통합에 의존하고 따라서 고유, 전사 활성, 피트니스 중립 게놈 위치에서 단일 통합 이벤트를 운반하는 형질 대사를 격리하고 검증하기 위해 초기 힘든 과정 (단일 여성 자손에 대한 남부 블롯 및 역 PCR 분석 포함)을 포함했다. 그럼에도 불구하고 φC31 매개 단일 통합을 위한 여러 도킹 라인이 An. gambiae19,20,21,22 및 An. stephensi23,24,25 (표 1)에서 개발 및 검증되었습니다. 이들 각각의 라인은 도킹 부위의 게놈 위치와 변형 특이적 유전적 배경의 측면에서 다양하며, 그들로부터 다양한 새로운 형질전환선이 생성될 수 있다. 이제 CRISPR/Cas9 technology26에 의해 도킹 라인을 생산하기 위한 TE 매개 통합의 복잡한 검증을 우회할 수 있습니다. 그러나 이것은 표적화되는 중립 적 loci의 사전 지식과 주변 시퀀스에 의존합니다.
φC31 매개 통합은 모델 유기체 D. melanogaster27에서 곤충 게놈 편집에 광범위하게 적용되었으며, 모기 Aedes aegypti13,28, Ae. albopictus29, An. gambiae19, 및 An. stephensi24뿐만 아니라 Ceratitist1및 봄피3를 포함한 다른 곤충에 적용되었습니다.
φC31 중재 통합의 제한, 특히 벡터 제어를 위한 잠재적인 필드 방출을 고려하여, 세균 기원의 항생제 저항 유전자 마커 및 플라스미드 백본 성분과 같은 바람직하지 않은 서열을 포함하여 전체 attB 베어링 기증자 플라스미드의 모기 게놈내의 통합이다. 이를 해결하기 위해, 표준 시스템의 변형, 재조합 매개 카세트 교환 (RMCE), 새로운 기증자 DNA와 이전에 통합 된 형질전환 카세트의 정확한 교체를 허용하는 구현되었다 (도 1b). 이는 각 끝에 기증자와 받는 사람 카세트 측면에 있는 두 개의 반전 된 att 사이트를 사용하여 달성되며, 이는 플라스미드 백본의 통합없이 카세트 교환의 결과로 동시에 두 개의 독립적 인 재결합 이벤트를 구동합니다. 이러한 개선된 설계는 원치 않는 서열의 통합을 우회하고, 이전에 통합된 형광마커32의 손실을 선별하여 표시되지 않은 DNA 화물의 통합을 예로 들 수 있도록 φC31 시스템의 적용을 확대한다.
RMCE는 D. 멜라노가스터32와 함께 먼저 달성되었고, 이후 An. gambiae9,26,33, Ae. aegypti34, 플루텔라 xylostella34 및 B. mori35를 포함한 비모델 곤충에 성공적으로 적용되었습니다. RMCE에 대한 여러 도킹 라인은 An. gambiae5,9,26 (표 1)에서 개발 및 검증되었습니다. 우리의 지식에, RMCE는 아직 다른 Anopheles 벡터 종에서 탐구되지 않습니다.
현재까지 φC31 시스템은 항말라리아 이펙터 19,24,36, 살충제 저항 연구를 위한 유전자를 과발 표현 및 녹여기 위해 항말라리아 이펙터 19,24,36, GAL4/UAS 시스템의 성분을 포함한 다양한 분자를 소개하고 연구하기 위해 Anopheles 모기에서 널리 사용되어 왔으며, 규제 요소, 기자 유전자5,21,37 및 유전자 구동 요소 ,38.
이 프로토콜은 Anopheles 도킹 라인의 게놈에 반전 된 attB 사이트에 의해 측면 구조의 attB 측면화물 및 2) RMCE의 1) 현장 지향 통합을 수행하는 방법을 설명합니다. 이것은 두 개의 플라스미드를 사용하여 달성된다: 관심의 변형을 들고 기증자 attB 태그 플라스미드, φC31 integrase를 표현하는 도우미 플라스미드. 주요 말라리아 벡터 An. 감비아와 An. stephensi는 특정 예로 사용되지만 이러한 프로토콜은 다른 Anopheles 종에 적용 할 수 있습니다.
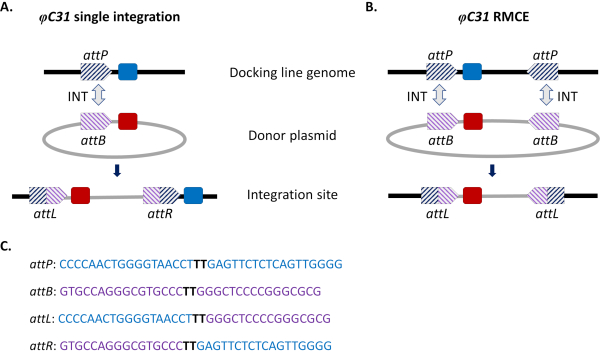
그림 1. φC31 시스템을 이용한 현장 지향 게놈 수정, 단일 통합 및 재조합 카세트 교환(RMCE). φC31 integrase (INT, 회색 이중 화살표)는 기증자 플라스미드와 attP 사이트 (의) (파란색 줄무늬)에 존재하는 attB 사이트 (보라색 줄무늬)의 재결합을 촉매하여 수신 도킹 라인에 존재하며, 이는 하이브리드 사이트 attL 및 attR의 형성을 초래합니다. A) 단일 attB 및 attP 사이트가 재결합하여 두 개의 통합 마커(파란색과 빨간색)가 존재할 때 통합이 이루어집니다. B) RMCE는 두 개의 attB/P 사이트가 동시에 재결합할 때 발생하며 도킹 라인의 애트 사이트(blue marker) 사이에 카세트를 기증자 플라스미드(red marker)에 의해 운반되는 것으로 대체하게 된다. C) attP (파란색) 및 attB (보라색) 및 하이브리드 부위 attL/R의 부분 뉴클레오티드 서열. 재조합은 굵은 검은색으로 강조 표시된 'TT' 코어 시퀀스 간에 발생합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
참고: 그림 2에 그림 프로토콜의 회로도 워크플로우가 표시됩니다.
1. φC31 attB 의 디자인 -태그 플라스미드 (그림 3)
- 다음과 같은 필수 구성 요소를 운반하는 attB 기증자 플라스미드 만들기
- 지배적인 형광 마커
- 형광 마커의 발현을 구동하는 프로모터를 선택합니다.
참고: Anopheles 전염의 경우 형광 마커는 일반적으로 눈과 신경 코드에서 발현을 유도하는 3xP3 프로모터39의 규제 하에 있습니다. 대안적으로, PUBc 프로모터5 는 여러 조직에서 발현이 원할 때 사용될 수 있다. 이 프로토콜의 예로 사용되는 기증자 플라스미드 및 도킹 라인은 3xP3 프로모터를 사용하여 표시됩니다. - 수신도킹 라인의 형광 단백질(FP)을 선택하여 쉽게 구별할 수 있도록 하십시오.
참고: 도킹 라인에 이미 존재하는 동일한 마커를 사용하지 말고 안정적으로 구별하기가 매우 어렵기 때문에 GFP(녹색)/YFP(노란색) 및 GFP(녹색)/CFP(시안)의 동시 사용을 피하십시오. 이 프로토콜의 예로 사용되는 기증자 플라스미드는 CFP로 표시된 도킹 라인에 통합되어야 하기 때문에 DsRed 또는 YFP로 표시됩니다.
- 형광 마커의 발현을 구동하는 프로모터를 선택합니다.
-
attB 재조합 사이트(들)
- 트랜스제닉 카세트(단일 attB 설계)를 통합하기 위해 단일 attB 사이트를 사용합니다(그림 3A).
- 사이트가 서로 에 대하여 반전 누워 기증자 DNA 템플릿을 둘러싸는 RMCE (이중 attB 디자인)에 대한 두 개의 반전 attB 사이트를 사용합니다 (그림 3B).
참고: attB 사이트의 방향은 도킹 라인에 있는 attP 사이트와 호환되어야 합니다.
- 원하는 트랜스진 화물
- 실험의 특정 목적에 기초하여 모기 게놈에 통합되는 다른 원하는 기능을 사용합니다. 여기서는 항말라리아 이펙터 분자를 An. stephensi 의 게놈으로 통합하고 GAL4/UAS 시스템의 성분을 An. 감비아 모기로 통합하는 것을 설명합니다.
- 플라스미드 백본 구성 요소
- 포함, 박테리아에서 플라스미드 복제를 위한 다른 필수 구성 요소 중, 체외에서 플라스미드 선택을 위한 마커 (즉, 항생 저항 유전자).
참고: 플라스미드 백본은 통합을 위한 단일 attB 설계(도 3A)에서 모기 게놈에 통합될 것이며 RMCE를 위한 이중 attB 설계에 삽입되지 않습니다(도 3B).
- 포함, 박테리아에서 플라스미드 복제를 위한 다른 필수 구성 요소 중, 체외에서 플라스미드 선택을 위한 마커 (즉, 항생 저항 유전자).
- 지배적인 형광 마커
2. 미세 주입 믹스를위한 플라스미드 의 준비
참고 : 여기에 설명 된 프로토콜은 두 플라스미드의 사용을 포함한다: 관심의 변형을 들고 attB 태그 기증자 플라스미드, 드로소필라 Hsp70 프로모터40의 규정에 따라 φC31 테그라를 표현하는 도우미 플라스미드.
- 내독소가 없는 플라스미드 정화 키트를 사용하여 기증자와 도우미 플라스미드를 정화합니다.
참고: 모든 구성 요소의 무결성을 확인하기 위해 주입에 사용되는 최종 플라스미드 제제를 순서화합니다. - 두 플라스미드의 적절한 양을 결합하여 기증자 플라스미드의 최종 농도 350 ng/μL과 주입 버퍼에서 재장중단시 도우미 플라스미드의 150 ng/μL의 혼합물을 얻습니다.
참고: 필요한 양의 혼합량을 계산할 때, 계획된 주사의 매일 10-15 μL이 충분하다는 것을 고려하고 DNA는 사전에 준비하고 -20°C에 저장될 수 있다. 인테그라스 도우미 플라스미드 농도60-500 ng/μL 및 기증자 플라스미드 농도 85-200 ng/μL도 보고되었다21,22,26,41. - 3M 아세테이트(pH 5.2)와 2.5부량의 얼음냉이 100% EtOH 및 소용돌이를 추가하여 DNA를 침전시한다. 흰색 침전은 즉시 표시되어야 합니다. 고농축 초기 플라스미드 제제(예: ~1 μg/μL)를 사용하면 강수 효율이 향상됩니다.
참고 : 정지 점 - 침전은 하룻밤 -20 ° C에 저장할 수 있습니다. - 원심분리기는 4°C에서 20분 동안 15,000 x g 에서, 상류제를 버리고, 1mL의 얼음 냉기 70% EtOH로 펠릿을 세척한다.
- 실온에서 5분 동안 1mL의 얼음 차가운 70% EtOH및 원심분리기 1mL 로 펠릿을 세척합니다.
- 펠릿과 공기 건조를 방해하지 않고 상체를 폐기하십시오.
- 펠릿을 1x 사출 버퍼(0.1mM Na3PO4, 5mM KCl, pH 7.2, 0.22 μm 필터 살균)로 재연하여 총 500 ng/μL의 최종 농도에 도달한다.
참고: 강수 과정에서 일부 DNA가 손실될 것이라고 가정합니다. 따라서 먼저 사출 버퍼의 더 작은 부피를 추가하고, 분광계(예: Nanodrop)의 농도를 확인한 다음 적절한 남은 부피를 추가하여 500 ng/μL에 도달합니다. - DNA가 철저히 다시 중단되었는지 확인하고, 각각 10-15 μL의 알리쿼트를 준비하고 -20°C에 보관하십시오.
- 주사 당일, 15,000 x g 에서 1개의 알리쿼트와 원심분리기를 5분 동안 해동하여 미립자 잔류물을 제거합니다.
참고: 미립자 제거를 위한 또 다른 방법은 0.22 μm 필터를 통해 용액을 필터링하는 것입니다. 그들은 배아 미세 주입 중 바늘 막힘으로 이어질 때 사출 믹스에 미립자 잔류물의 존재를 피하십시오.
3. Anopheles 도킹 라인에서 배아의 미세 주입
- 혈액 공급 4-7 일 된 모기는 미세 주입 전에 원하는 도킹 라인 72 시간 전에 (즉, 월요일과 화요일에 주사에 대 한 이전 금요일에 여성을 공급; 목요일과 금요일에 먹이 여성에 대 한 같은 주 월요일).
- 혈액 공급 야생 형 (WT) 모기 (즉, 도킹 라인의 동일한 게놈 배경을 가진 모기) 같은 날에; 이러한 횡단에 필요한 것입니다.
참고: 혈액 식사의 크기와 품질은 계란의 품질에 영향을 미치므로 항상 신선한 혈액 (즉, 이전 7 일 이내에 그려진 혈액)을 사용하는 것이 좋습니다. 쥐에 팔 먹이 또는 먹이 계란의 품질 과 양을 증가 시킬 수 있습니다., 그러나 이러한 방법은 권장 되지 않습니다. 인간 및 동물 사용에 대해 특정 승인 된 프로토콜이 필요합니다. - 배아 미세 주입 수행
- 25mM NaCl42에서 항감비아배아 미세주입을 수행하여 45도 각도로 배아의 후방 극을 표적으로 한다. 배아 수집을 위한 상세한 프로토콜을 위해, 정렬 및 미세 주입은 Pondeville et al.43 및 Lobo et al.44를 참조합니다.
- 할로카본 오일 700:27 (2:1)에서 An. stephensi 배아 미세 주입을 수행하여 30도 각도로 배아의 후방 극을 표적으로 한다. 배아 수집, 정렬 및 미세 주입을 위한 상세한 프로토콜은 Terenius 외 45 및 Lobo et al.44에서 찾아볼 수 있습니다.
- 멸균 증류수(pH 7.2)로 채워진 페트리 접시에 주사 후 계란을 옮기고 곤충 상태로 돌려보도록 한다.
- 부화시 G0 애벌레를 소금에 절인 증류수(0.1%의 토닉 소금)를 넣고 트레이에 옮기고 푸파에 간후.
- 기록 부화 속도 (즉, 유충부화 수 / 주입 된 배아의 수).
참고: 배아 운동은 부화에 도움이 되므로 부드러운 소용돌이가 바람직합니다. 부화는 주입 후 ~ 48h를 시작해야 합니다. 주사는 약간의 발달 지연을 일으킬 수 있기 때문에 3-4 일 동안 늦은 부화 유충에 대한 모니터링을 유지하는 것이 좋습니다.
4. 변형된 개인의 교차 및 선별
- [선택적 단계] 스크린 G0 (주입) 1 또는 2 번째 인스타 애벌레 (L1-L2) 형광 마커의 일시적인 발현을 위한.
- G0 L1-L2 유충을 우물이 있는 현미경 슬라이드로 옮기려면 미세 팁 유리 파이펫을 사용하십시오. 각 우물에 애벌레 1개를 놓습니다.
- 적절한 필터가 있는 형광 스테레오스코프를 사용하여 형광 마커의 일시적인 발현의 존재를 검사합니다.
참고: 과도 식의 패턴은 사용되는 프로모터에 의해 결정됩니다. 3xP3 프로모터를 사용하는 경우, 형광 마커의 일시적인 발현은 항문 유두에서 볼 수 있습니다(Pondeville 외.43의 도 6 참조) - 리어 G0 양성 개인 별도.
- 입체스코프52에서 섹스로 G0 강아지를 정렬합니다.
- 남성이 3-5 (설립자 가족)의 그룹으로 별도의 케이지에 등장하고 연령일치 WT 여성의 10 배 초과를 추가하자.
참고: 수컷이 여러 번 짝짓기 때문에, 각 남성의 짝짓기 기회를 최대화하기 위해 WT 여성의 과잉을 제공하는 것이 중요합니다. - 여성이 10-15 (설립자 가족)의 그룹으로 별도의 케이지에 등장하고 연령일치 WT 남성의 동일한 수를 추가할 수 있습니다.
참고 : 곤충에 공간이 제한된 경우 여성은 하나의 케이지에서 모두 함께 나타날 수 있습니다. 남성 대 여성 비율은 남성 1명에서 여성 3명까지 낮을 수 있다. - 성인이 4-5 일 동안 짝짓기를 하고 여성에게 혈액 식사를 제공 할 수 있습니다.
참고: 혈액 공급 및 여러 gonotrophic 주기에서 변압제를 얻기의 기회를 극대화 하기 위해 G0 여성에서 계란을 여러 번 수집. - 혈액 공급 WT 개인 동시에 횡단에 대 한.
- 계란을 수집하고 차세대 G1을 후면.
- 변형제를 식별하기 위해 적절한 형광을 위한 화면 G1 L3-L4 애벌레.
- 필터 종이가 늘어선 페트리 접시또는 attB 태그화물로 도입된 마커의 존재를 위한 적절한 필터가 있는 형광 스테레오스코프를 사용하여 현미경 슬라이드 및 스크린에 애벌레를 수집합니다.
참고: 3xP3 프로모터에 의해 구동되는 형광은 모든 배아 단계에서 볼 수 있으며 스크리닝은 젊은 애벌레에서 수행 될 수 있지만, 이들은 더 취약하고 상대적으로 신중하게 처리해야합니다. 푸파도 상영할 수 있습니다.- 새 마커와 기존 마커의 존재를 위한 통합 스크린을 위한 단일 attB 설계의 경우; 새 카세트가 원래 카세트 옆에 삽입되기 때문에 둘 다 존재해야 합니다(그림 3A, 그림 4).
참고: 단일 attB 설계에 대한 스크리닝 예외: 마커없는 도킹 라인을 사용하는 경우22, 새 마커의 존재에 대한 화면. 통합이 기존 마커21의 불활성화를 초래하는 도킹 라인을 사용하는 경우, 새 마커의 존재와 기존 마커의 손실을 화면으로 설정한다. - RMCE용 이중 attB 설계의 경우, 새로운 마커의 존재와 기존 마커의 손실을 위한 화면은 새로운 카세트가 원래 마커를 대체하기 때문에 새로 도입된 마커만 존재해야 한다(도 3B, 도 5).
참고: 가끔 통합 이벤트는 RMCE 실험에서 단일 attP만 재결합하여 두 마커가 모두 존재하는 경우 복구할 수 있습니다. G1 개인의 검사는 동일한 절차에 따라 pupa 단계에서도 수행 할 수 있습니다52.
- 새 마커와 기존 마커의 존재를 위한 통합 스크린을 위한 단일 attB 설계의 경우; 새 카세트가 원래 카세트 옆에 삽입되기 때문에 둘 다 존재해야 합니다(그림 3A, 그림 4).
- 필터 종이가 늘어선 페트리 접시또는 attB 태그화물로 도입된 마커의 존재를 위한 적절한 필터가 있는 형광 스테레오스코프를 사용하여 현미경 슬라이드 및 스크린에 애벌레를 수집합니다.
- G1 개인을 애벌레 트레이로 옮기고 후면으로 푸파에 옮깁니다. 예기치 않은 마커 발현 패턴을 가진 비형광 개인 및 개인을 폐기하십시오.
- 정렬 섹스에 의해 G1 pupae를 변환하고 이성 나이 일치 WT 개인과 함께 한꺼번에 교차.
- 성인이 4-5 일 동안 짝짓기를 하고, 혈액 식사를 제공하고, 계란을 수집하고, 차세대 G2 자손을 양육할 수 있습니다.
- 단일 통합 실험의 경우 통합 사이트가 모든 개인에서 동일하므로 한꺼번에 직접 계란을 수집합니다.
- RMCE 실험의 경우, 단일 여성으로부터 계란을 수집하고 두 개의 대체 카세트 방향의 잠재적 존재로 인해 분자 평가가 완료 될 때까지 자손 분리를 유지합니다 (그림 3B).
- 형광 마커의 존재를 위해 G2 자손 (애벌레 또는 푸파 단계에서)를 스크린하십시오 (개인의 50 %는 긍정적 일 것으로 예상됨), 비 형광 자손을 폐기하십시오.
- 분자 분석을 위한 G2 양성 개인의 하위 집합을 따로 놓고 나머지는 성인기에 리어드합니다.
참고: 모든 G2 개인이 살아 있어야 하는 경우, 분자 분석은 단일 성인의 다리에 실시 될 수 46 또는 pupal 케이스 DNA 추출 (L. 그리고라키 개인 통신). 대안적으로, 분자 분석은 모든 G2 개별이 oviposited하고 계란이 부화한 후에 수행될 수 있습니다. - 성인 남성과 여성이 새로운 형질 전환 선을 확립하기 위해 같은 케이지에서 교차 할 수 있습니다.
참고: RMCE 실험의 경우, 성인 간 교차는 분자 분석을 통해 삽입의 방향이 결정될 때까지 단일 여성에서 파생되는 형제 자매 간에 발생해야 합니다.
5. DNA 증폭 (PCR)에 의한 삽입 부위의 분자 검증
- 변환 후 도킹 라인의 게놈에서 예측 삽입 부위의 맵을 준비한다.
- 단일 통합: 예측 된 삽입 부위가 원래 도킹 구조와 두 하이브리드 사이트 attL 및 attR 사이에 기증자 플라스미드의 전체 시퀀스를 전달하도록 합니다(그림 3A).
- RMCE: 예측 삽입 사이트가 하이브리드 반전 attL 사이트가 원래 반전된 attP 사이트를 대체하고 교환 템플릿이 원래 그들 사이에 있는 카세트를 대체하는 도킹 라인의 사이트와 동일한지 확인합니다(그림 3B).
- 통합 궤적의 양쪽에 삽입 접합을 증폭하기 위해 올리고뉴클레오티드 프라이머를 설계한다.
- 단일 통합: attR 및/또는 attL 부위에 걸쳐 있는 올리고뉴클레오티드 프라이머 쌍을 디자인합니다. 하나의 프라이머는 이전에 통합된 도킹 컨던스링에 바인딩해야 하며 다른 프라이머는 새로 통합된 트랜스진에 결합해야 합니다(그림 3A).
- RMCE: 카세트 교체는 염색체(지정된 A 및 B)와 관련하여 두 가지 방향으로 발생할 수 있습니다. 4개의 올리고뉴클레오티드 프라이머의 대체 조합을 설계하여 방향 중 하나에만 이산제품을 제공하고, 한 쌍은 방향 A에 대한 진단이고, 다른 한 쌍은 방향 B(도 3B, 도 6)에 대한 진단이다.
- G2 양성 개인으로부터 게놈 DNA를 추출하고 진단 PCR 및 겔 전기포고를 수행하여 예측된 통합 부위 맵에서 예상되는 진단 앰플리턴의 존재를 시각화한다.
참고: DNA는 단독으로 단일 성인의 다리46 또는 pupal 케이스 (L. Grigoraki 개인 커뮤니케이션)에서 추출될 수 있습니다. - 예상 시퀀스를 확인하기 위해 PCR 제품을 시퀀스합니다.
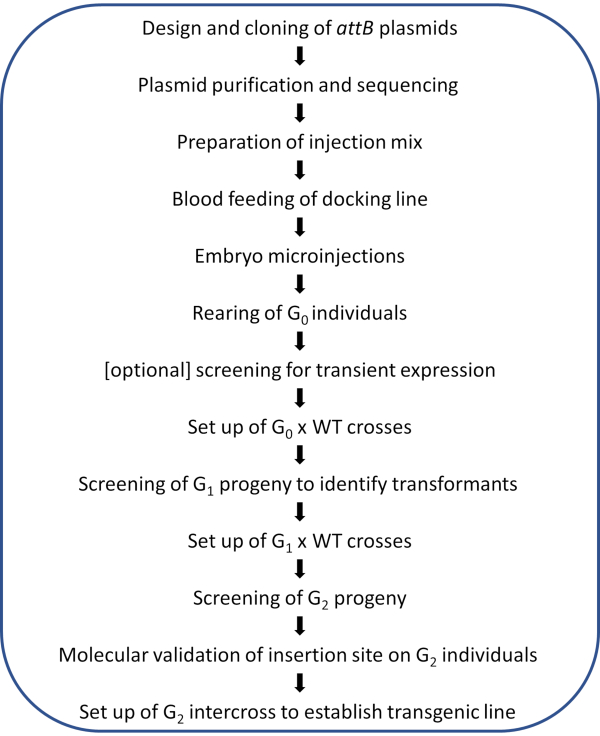
그림 2. Anopheles 모기의 사이트 지향 φC31 게놈 수정을 위한 워크플로도 다이어그램. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
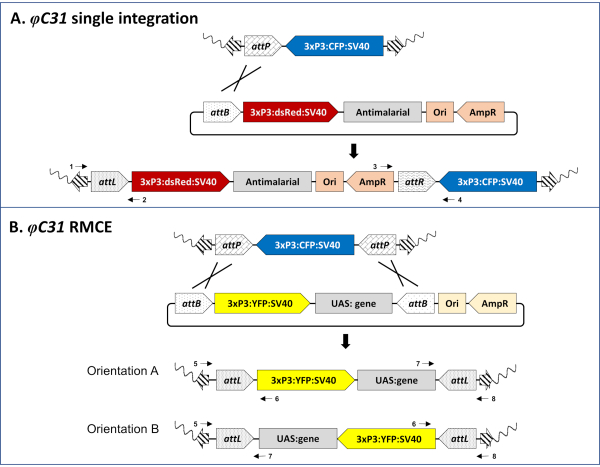
그림 3. φC31 매개 단일 통합(A) 및 RMCE(B)의 분자 기초. A) 단일 attP 사이트를 운반하는 An. stephensi 도킹 라인(80.9, 표 1)에 게놈 삽입의 회로도맵을 수행하고 CFP(상단),DsRed(가운데)로 표시된 단일 attB 설계 기증자 플라스미드, 성공적인 통합(아래)을 초래하는 예상 삽입 부위로 표시하였다. B) 두 개의 반전 된 attP 사이트를 운반하고 CFP (상단), YFP (중간)로 표시된 이중 attB 설계 기증자 플라스미드를 들고, 성공적인 RMCE (아래)후 발생하는 예상 삽입 부위를 들고 있는 An. 감비아도킹 라인(A11, 표 1)에 게놈 삽입의 회로도. 물결 모양선: 모기 게놈; 줄무늬 화살표: 돼지 박 트랜스 포슨 팔; 3xP3: 형광 마커의 프로모터; SV40: 바이러스 성 터미네이터; 오리: 복제의 출처; AmpR: 암피실린 저항 유전자. 교차 선은 attP와 attB 사이트 간의 재조합 의 사이트를 나타냅니다. 번호가 매겨진 검은 화살표는 삽입 궤적(프로토콜의 5단계)의 분자 유효성 검사를 위한 프라이머 결합 부위를 나타낸다. 요청 시 저자로부터 완전히 주석이 달린 단일 및 이중 attB 태그 플라스미드를 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
여기에 설명된 프로토콜은 ~10주 안에 안정적인 Anopheles 형질 전환선을 생성할 수 있습니다(21일 모기 수명 주기를 가정).
An. 감비아의 후사 후 애벌레 부화율은 일반적으로 An. stephensi보다 낮을 것으로 예상되지만, 10~50% 사이의 부화율은 9,20,24,26,33,43,47로 보고되었다. 적절한 주입 기술을 감안할 때, ≥20%의 부화율은 일반적으로 변압제를 산출하기에 충분합니다. 배아에 의한 DNA 섭취량은 형광 마커의 일시적인 발현을 위해 젊은 애벌레를 선별하여 평가될 수 있다. 생존된 G0 애벌레의 최대 50%까지 3xP3 프로모터를 이용한 An. 감비아에서 성공적인 RMCE 실험에서 항문 유두48에서 마커의 상피 발현을 보였다.
변환 효율의 일반화 된 추정은 실험실 사이에서 평가하기 어렵고 심지어 변환은 주입 된 DNA의 순도, 농도, 크기 및 잠재적 독성, 계란의 품질, 계란의 사전 및 후 주입 처리, 모기 사육 및 가장 중요한 운영자의 경험을 포함한 변수의 복잡한 상호 작용에 따라 달라집니다. An. gambiae의 RMCE(총 G0 개인의 독립적인 변환 이벤트 수로 계산)의 변환 률은 최대 7%,An. stephensi의 통합을 위한 최대 2.2%의 변환율을 얻었습니다. 우리는 적어도 100 G0 애벌레의 부화로 이끌어 야 하는 적어도 500개의 태아를 주입하고 안정적으로 변형된 자손이 얻을 수 있는 2-7 G0 성인 창시자에게 주의해야 합니다. G0 애벌레에서 일시적인 발현을 검사하는 경우 최대 40개의 양성 애벌레가 예상될 수 있다.
3xP3 프로모터에 의해 조절된 형광 마커의 스크리닝을 통한 변형의 표형 검증의 예는 도 4 및 도 5에서 보고된다. 도 4는 DSRed 표시 카세트를 CFP(80.9, 표 1)로 표시된 도킹 라인에 삽입하여 얻은 새로운 An. stephensi 라인을 나타내며, G1 자손은 눈에 검출된 빨간색과 파란색 형광에 의해 표시된 바와 같이 두 마커를 모두 표현합니다.
RMCE 설계는 대신 기증자 플라스미드의 마커와 함께 도킹 라인에 원래 삽입 된 마커의 교체를 초래할 것으로 예상된다. 도 5A 및 Figure B는 CFP(A11, 표 1)로 표시된 An. 감비아도킹 라인에서 이러한 마커 교환을 예시하며, 여기서 성공적인 RMCE 후 CFP 마커가 손실되고 YFP 마커가 획득되어 노란색(파란색은 아님) 눈과 신경 코드 형광333이 발생합니다. 경우에 따라 RMCE는 도 5C에 도시된 바와 같이 원하는 트랜스제닉 카세트의 교환 대신 단일 통합 이벤트를 초래할 수 있으며, 여기서 원래 CFP와 새로운 YFP 마커로 표시된 애벌레가 표시됩니다. 전체 변환 이벤트 수의 최대 50%가 단일 통합9,33인 것으로 보고됩니다.
형광 마커의 존재를 검사 할 때 가능한 배경 자동 형광과 신호를 구별하는 것이 중요합니다. 이것은 Anopheles 애벌레로 CFP를 사용할 때 자연 적인 청색 자동 형광을 표시할 때 특히 중요합니다 (그림 6A). 3xP3-CFP 마커를 사용하여 도 6B에 도시된 바와 같이 진정한 CFP 양성 개인을 식별하는 것이 필요한 발기인에 의해 형광이 구동될 것으로 예상되는 조직 및 장기에 대한 배율을 증가시키고 초점을 맞추는 것이 필요하다.
개별 변압제는 마지막으로 예상된 삽입 부위를 확인하기 위하여 PCR를 통해 분자적으로 평가됩니다. 도 7은 모기 게놈33에 삽입의 두 가지 잠재적 방향을 보여주는 교환 An. 감비아라인에서 개인에 있는 PCR 유효성 검사를 보고합니다.
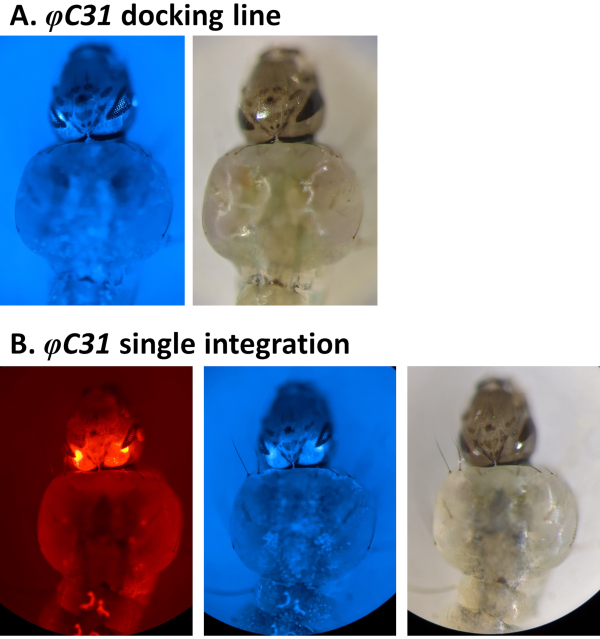
그림 4. 안스네시 애벌레(등쪽 보기)에서 φC31 단일 통합의 유효성을 검사합니다. A) 도킹 라인(80.9, 표 1)은 3xP3 프로모터의 규정에 따라 눈에 CFP를 표현한다. B) 성공적인 통합은 새로 획득한 DsRed의 발현뿐만 아니라 눈의 원래 CFP 마커를 초래한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
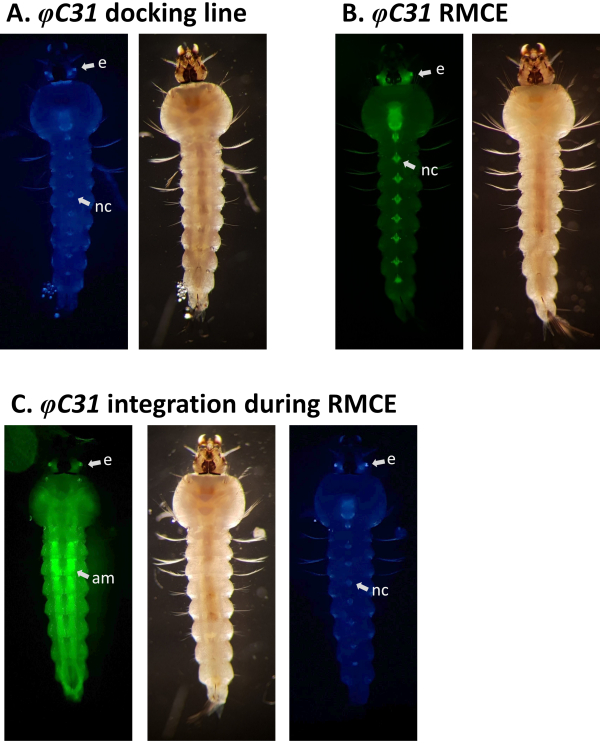
그림 5. An. 감비아유충 (복부 보기)에서 φC31 RMCE의 유효성 검사. A) 도킹 라인(A10, 표 1)은 눈(e) 및 신경코드(nc)5에서 3xP3 프로모터의 규정에 따라 CFP를 표현한다. B) 성공적인 RMCE는 CFP에서 YFP33로 형광 마커를 교환합니다. C) 변형화 애벌레가 CFP와 YFP 마커를 모두 표현하는 RMCE 실험 중에 단일 통합 이벤트가 발생했습니다. 이 애벌레는 YFP의 광범위한 발현 패턴을 일으키는 GAL4/UAS 성분을 운반하며, 특히 복부 근육(am)에서 강합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
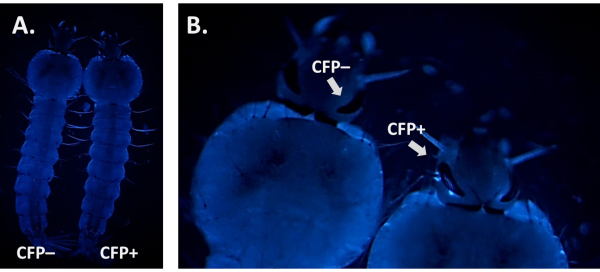
그림 6. An. 감비아 애 애벌레 (등쪽 보기)에서 CFP 자동 불발. A) CFP 필터를 사용하여 양수(CFP+) 및 음수(CFP-) L4 애벌레의 나란히 이미지. B) CFP + 대 CFP- 개인을 드러내는 애벌레 눈의 클로즈업 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
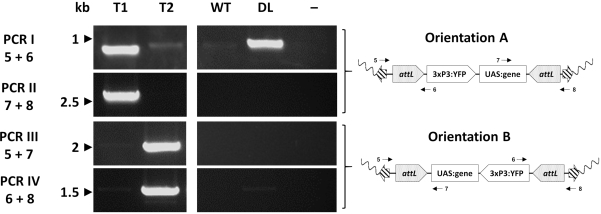
그림 7. φC31 RMCE에 의해 생성된 대표적인 트랜스제닉 An. 감비아에 카세트 삽입의 방향의 분자 검증. 형질 전환 카세트는 삽입 부위와 관련하여 두 가지 대체 방향(A 또는 B) 중 하나에 삽입될 수 있다. 각 PCR 반응(I-IV)은 회로도 도금 맵에 표시된 대로 각 방향에 대한 진단 증폭 단편을 제공하도록 설계된 프라이머(5-8)33의 조합을 사용합니다. T1: 대표적인 형질전환 개인 은 삽입 A의 방향을 운반; T2: 대표적인 형질전환 개인 은 삽입 B의 방향을 운반; WT: 야생 유형; DL: 도킹 라인; -: 물이 템플릿으로 사용된 반응 음성 제어. 이 수치는 아돌피 외(2019)33에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 종 | 거르다 | 이름 | attP(들) | 크로모-일부 | 프로모터 마커 | 원산지 제도 | 참조 |
| 안스데시 | 인디언 | 26.10b | 싱글 | 2R | 3xP3-eCFP | 캘리포니아 어바인 대학교 | 25 |
| 안스데시 | 인디언 | 44Cb | 싱글 | X | 3xP3-eCFP | 캘리포니아 어바인 대학교 | 23, 24 |
| 안스데시 | 인디언 | 80.9b | 싱글 | 2L | 3xP3-eCFP | 캘리포니아 어바인 대학교 | 이 연구 |
| A. 감비아에 | G3 | 113 | 싱글 | 2R | 3xP3-eCFP | 캘리포니아 어바인 대학교 | 이 연구 |
| A. 감비아에 | 킬 | Ec | 싱글 | 3R | 3xP3-eCFP | 킬 대. | 19, 43 |
| A. 감비아에 | G3 | X1 | 싱글 | 2L | 마커 없음 | 스트라스부르 대학교 | 22 |
| A. 감비아에 | G3 | YAttP | 싱글 | Y | 3xP3-RFP | 임페리얼 칼리지 런던 | 21 |
| A. 감비아에 | G3 | A10b | 배 | 2R | 3xP3-eCFP | 리버풀 스쿨 트롭 메드. | 5 |
| A. 감비아에 | G3 | A11b | 배 | 2R | 3xP3-eCFP | 리버풀 스쿨 트롭 메드. | 9 |
| a. 존스 홉킨스 대학에서 변형 (M. 제이콥스 - 로레나의 선물) 및 캘리포니아 어바인 대학에서 문화에서 >20 년. | |||||||
| b. 이러한 줄은 합리적인 요청에 따라 작성자로부터 사용할 수 있습니다. | |||||||
| c. 이 라인은 BEI 리포지토리 www.beiresources.org MRA-1163으로 사용할 수 있습니다. | |||||||
표 1. Anopheles attP 도킹 라인.
토론
선택한 도킹 라인과 호환되는 attB 태그플라스미드의 정확한 설계는 실험의 성공에 가장 중요합니다. 형광 색상과 도킹 라인에 이미 존재하는 패턴의 적용을 받을 표현 패턴을 포함하여 변압제의 선별에 사용되는 마커의 선택에 주의를 기울여야 한다. 쉽게 구별할 수 있는 형광 마커를 사용해야 합니다: 좋은 마커 조합은 RFP(빨강)/CFP(시안), RFP(빨간색)/GFP(녹색), RFP(빨간색)/YFP(노란색), YFP(노란색)/CFP(시안), 피하는 조합은 YFP(노란색)/GFP(녹색) 및 CFP(녹색)입니다. 눈과 신경코드에 특이적인 3xP3 프로모터39는 모기 간 발생을 위한 형광 마커의 발현을 유도하는 데 가장 빈번하게 사용된다. 실제로 현재 사용 가능한 모든 Anopheles 도킹 라인은이 프로모터를 활용합니다. 대체 조절 영역은 여러 조직에서 발현을 유도하는 An. 감비아 에 폴리비퀴틴 유전자(PUBc)5 또는 바이러스 프로모터 IE120의 영역입니다. 3xP3와 함께 사용하면 이러한 프로모터는 가능한 색상 조합과 동일한 플루오로포어의 사용까지 확장합니다. 표시된 프로모터는 모기 수명 주기 전반에 걸쳐 활동적이며 모든 생명 단계에서 스크리닝 및 형광 모니터링을 허용합니다. 플라스미드 설계 시 추가 고려 사항은 통합 또는 교환할 화물의 크기입니다. φC31 시스템은 놀라운 운반 능력을 가지고 있지만18, 그것은 기증자 플라스미드의 크기는 일반적으로 변환 효율과 부정적인 상관 관계가 고려되어야한다222.
기술된 프로토콜에서 인테그라스의 공급원은 효소유비쿼터스40을 발현하는 도우미 플라스미드이다. 자궁 내의 유비쿼터스 존재는 미세 주입이 정확하게 생식선이 형성되는 지역으로 향하지 않는 경우에 체세포의 변환으로 이끌어 낼 수 있습니다. 이러한 변환 이벤트는 헤아질 수 없기 때문에 손실될 것이지만, 체세포 효과는 주입 된 개인의 체력을 감소시킬 수 있습니다. 이를 방지하고 변환 효율을 높이기 위해, 인테그라식은 예를 들어 바사 프로모터22,26을 사용하여 생식선으로 제한될 수 있다. 다른 프로토콜은 φC31 integrase19,24,43의 근원으로 시험관 내 전사 메신저 RNA (mRNA)의 사용을 설명합니다. 그러나, 이것은 mRNA의 힘든 준비를 포함하고 사출 혼합의 주의 깊게 취급하고 저하를 피하기 위하여 RNase 자유 시약의 사용을 요구합니다. Integrase의 플라스미드 소스는 An. gambiae9,21,22,26,33,37 및 An. stephensi (A.A. 개인 커뮤니케이션)에서 모두 신뢰할 수 있고 효율적인 변화로 이어질 것으로 입증되었으며, 따라서 우리의 바람직한 옵션입니다. integrase 배달을위한 추가 옵션은 자체 도킹 도우미 라인의 생체 내 생산입니다. 이러한 라인은 세균계 발 기인 나노의 규정에 따라 φC31 정수로를 발현하고 생존 및 변형 효율을 향상시키는 것으로 나타났다. 그러나, 도우미 라인에 인테그라 효소의 생체 내 생산에 의해 부과 된 잠재적 인 피트 니스 부하를 고려 해야 합니다.
다른 형질 전환 기법과 마찬가지로, 특별한 주의는 변혁제를 복구 할 수있는 기회를 극대화하기 위해 주입 된 배아에서 파생 개인의 양육 및 횡단에 예약해야합니다. 안정적으로 유전자를 상속 한 개인은 먼저 G1 자손에서 회복 될 수있다. 그러나, 잠재적인 변환의 초기 징후는 3xP3 프로모터43을 사용할 때 G0 제1 및 제2 인스타 애벌레의 항문 유두 및/또는 신경 코드에서 형광 마커의 일시적인 에피소피 발현의 존재에 의해 평가될 수 있다. 일시적인 형광의 존재는 성공적인 플라스미드 전달을 시사하지만, 그것은 헤탈이 성 생식선 변환을 보장하지 않습니다. 마찬가지로 일시적인 표현식이 부족해도 성공적인 변환은 제외되지 않습니다. 그럼에도 불구 하 고, 그것은 일시적인 긍정적인 개인 일시적인 부정적인 사람에 비해 형질 전환 자손을 얻을 가능성이 더 높은 관찰 되었습니다43,48. 전문가의 손에서, 양육 및 만 긍정적 인 개인의 횡단모기 수를 줄이기 위해 옵션이 될 수 있습니다. 그러나, 작은 G0 애벌레의 중요성과 취약성을 감안할 때, 조작의 최소 금액은 여전히 권장하고 모든 G0 개인의 양육은 항상 권장됩니다.
이 프로토콜에 보고된 결합 방식은 결합 가능성을 최대화하고 독립적인 변환 이벤트를 격리하도록 설계되었습니다. 그러나 곤충 공간이나 인원 가용성이 문제가 되는 경우, G0 성인은 충분한 이성 개인이 제공되는 경우 단일 케이지에서 성관계를 당기는 것이 가능합니다. 이러한 설정은 동일한 케이지의 개인에서 발생하는 여러 변환 이벤트 간의 차별을 허용하지 않습니다. 실험 용 설정에 따라 스크리닝 과정에서 이중(단일 통합) 또는 단일(RMCE) 마커의 존재가 예상됩니다. 단일 통합 실험에서는 도킹 라인에서 원래 마커의 존재를 확인하는 것이 중요하며 RMCE에서는 이전에 통합된 마커의 손실을 확인하는 것이 중요합니다. 실제로 RMCE 설계에서는 단일 attP site9,33의 재결합으로 인해 교환 대신 단일 통합이 발생한 변환제를 복구하는 것은 드문 일이 아닙니다. 이러한 개인에서 모두 형광 마커뿐만 아니라 전체 기증자 플라스미드 백본이 모두 형광 마커에 대한 철저한 검사를 실시의 중요성을 강조.
예상되는 형광 패턴의 존재는 성공적인 변환을 나타내지만 삽입 부위의 분자 특성화는 수행해야합니다. 이를 위해 도킹 라인의 측면 게놈 영역을 포함한 예측된 삽입 궤적의 정확한 맵을 제조하는 것은 유전자 증폭 분석을 위한 적절한 진단 올리고뉴클레오티드 프라이머의 설계에 매우 중요합니다. 단일 통합 이벤트는 새로 통합된 DNA와 이전에 삽입된 카세트 사이의 접합부에서 attR 및 attL 하이브리드 부위의 형성을 초래합니다. 이러한 사이트는 삽입 사이트 유효성 검사를 대상으로 지정할 수 있습니다. RMCE 설계에서, 기증자 카세트의 삽입은 게놈 궤적과 관련하여 두 가지 대체 방향으로 발생할 수 있으며, 따라서 4개의 프라이머는 라인이 운반하는 방향을 감지하기 위해 대체 PCR 조합에 사용될 수 있다. 카세트 삽입의 방향은 트랜스진 발현에 영향을 미칠 수 있으므로, 비교 유전자 발현 분석에서는 동일한 삽입 방향을 운반하는 라인을 사용하는 것이 중요하다.
변형제의 낮은 숫자로 작업 할 때 분자 분석을 위해 전체 개인을 희생하는 것이 바람직하지 않을 수 있습니다. 이에 대한 옵션은 다리 손실이 짝짓기 및 oviposit49 성인 여성 능력에 영향을 미치지 않기 때문에 단일 성인의 다리에서 추출 된 DNA에 분자 분석을 실시하고 있습니다46. 그러나 다리 제거 과정에서 개인에게 손상을 줄 위험이 있습니다. 성공은 버려진 pupal 케이스 (L. Grigoraki 개인 커뮤니케이션)를 사용하여 얻어졌습니다, 그러나 가장 안전한 접근은 실행 가능한 G3 자손을 얻은 후에 G2 부모에 분자 분석을 능력을 발휘하는 것입니다.
최근 몇 년 동안 CRISPR/Cas9는 사이트별 게놈 편집26,41,50,51을 수행하는 방식에 혁명을 일으켰습니다. 사이트 지향 RMCE와 달리 CRISPR/Cas9 매개 유전자 통합(knock-ins)은 1단계 변환 이벤트만 으로 사전 삽입된 재조합 부위의 존재와 는 무관합니다. 그럼에도 불구하고 CRISPR/Cas9 시스템은 가이드 RNA가 중재하는 효율적인 현장 인식뿐만 아니라 성공적인 편모로지 지향 수리를 위해 원하는 삽입 부위를 측면에 있는 대형 공지된 게놈 서열의 존재에 의존합니다. 이러한 조건은 항상 충족될 수 없거나 문제 해결에 힘들 수 있으며, An. 감비아와 An. stephensi 및 그들로부터 파생된 라인에서 여러 도킹 라인의 가용성을 감안할 때, φC31 시스템은 동일한 게놈 위치에서 트랜스게놈 간의 직접적인 현상 비교를 수행하는 매우 귀중한 도구로 남아 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 트랜스 제닉 An. stephensi 애벌레의 이미지를 제공 키오나 파커 (UCI)에 감사드립니다, 프레이저 콜맨 (LSTM) 및 베스 폴튼 (LSTM) 트랜스 제닉 An. 감비아 애 애벌레를 제공. 베스 폴튼 (LSTM)은 또한 An. 감비아 애 애벌레의 이미징 동안 귀중한 도움을 제공했다. 이 작품은 유전학 및 사회를위한 타타 연구소 (TIGS)와 LSTM의 이사 촉매 기금에 의해 투자되었다 A.A.에 수여 (DCF2014AAA). A.A.J.는 캘리포니아 대학교 어바인의 도널드 브렌 교수입니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL eppendorf tubes | |||
| 8-well microslides | VWR | MARI1216690 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Ethanol, Absolute, Molecular Biology Grade | |||
| Filter set CFP for Leica MZ FLIII Excitation 436/20 nm, extinction 480/40 nm | Leica | 10446363 | |
| Filter set dsRED for Leica MZ FLIII Excitation 545/30 nm, extinction 620/60 nm | Leica | 10447079 | |
| Filter set YFP customised for Leica MZ FLIII | Omega Optical | 500QM25, 500QM35 | |
| Halocarbon oil 27 | Sigma | H8773 | |
| Halocarbon oil 700 | Sigma | H8898 | |
| Petri dishes | |||
| Potassium chloride | |||
| Sodium Chloride | |||
| Sodium phosphate dibasic | |||
| Sodium Acetate Solution (3 M), pH 5.2 | Thermo Fisher Scientific (Life Technologies) | R1181 | |
| Stable brush Size 0 |
참고문헌
- Adolfi, A., Lycett, G. J. Opening the toolkit for genetic analysis and control of Anopheles mosquito vectors. Current Opinion in Insect Science. 30, 8-18 (2018).
- Grossman, G. L., Rafferty, C. S., Clayton, J. R., Stevens, T. K., Mukabayire, O., Benedict, M. Q. Germline transformation of the malaria vector, Anopheles gambiae, with the piggyBac transposable element. Insect Molecular Biology. 10 (6), 597-604 (2001).
- Nolan, T., Bower, T. M., Brown, A. E., Crisanti, A., Catteruccia, F. piggyBac-mediated germline transformation of the malaria mosquito Anopheles stephensi using the red fluorescent protein dsRED as a selectable marker. Journal of Biological Chemistry. 277 (11), 8759-8762 (2002).
- Perera, O. P., Harrell, R. A., Handler, A. M. Germ-line transformation of the South American malaria vector, Anopheles albimanus, with a piggyBac/EGFP transposon vector is routine and highly efficient. Insect Molecular Biology. 11 (4), 291-297 (2002).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Carballar-Lejarazú, R., Jasinskiene, N., James, A. Exogenous gypsy insulator sequences modulate transgene expression in the malaria vector mosquito, Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 110 (18), 7176-7181 (2013).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Nolan, T., Petris, E., Müller, H. M., Cronin, A., Catteruccia, F., Crisanti, A. Analysis of two novel midgut-specific promoters driving transgene expression in Anopheles stephensi mosquitoes. PLoS ONE. 6 (2), 16471 (2011).
- Lynd, A., Balabanidou, V., Vontas, J., Lycett, G. J. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: appliction to cuticular hydrocarbon synthesis. BioRxiv. , (2019).
- O'Brochta, D. A., Alford, R. T., Pilitt, K. L., Aluvihare, C. U., Harrell, R. A., Harrell, R. A. piggyBac transposon remobilization and enhancer detection in Anopheles mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16339-16344 (2011).
- O'Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based enhancer-trapping in the malaria mosquito Anopheles stephensi. G3. 2 (11), 1305-1315 (2012).
- Macias, V. M., et al. nanos-Driven expression of piggyBac transposase induces mobilization of a synthetic autonomous transposon in the malaria vector mosquito, Anopheles stephensi. Insect Biochemistry and Molecular Biology. 87, 81-89 (2017).
- Nimmo, D. D., Alphey, L., Meredith, J. M., Eggleston, P. High efficiency site-specific genetic engineering of the mosquito genome. Insect Molecular Biology. 15 (2), 129-136 (2006).
- Kim, A., Pyykko, I. Size matters: Versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354, 301-309 (2011).
- Thorpe, H. M., Smith, M. C. M. In vitro site-specific integration of bacteriophage DNA catalyzed by a recombinase of the resolvase/invertase family. Proceedings of the National Academy of Sciences of the United States of America. 95 (10), 5505-5510 (1998).
- Khaleel, T., Younger, E., Mcewan, A. R., Varghese, A. S., Smith, M. C. M. A phage protein that binds φC31 integrase to switch its directionality. Molecular Microbiology. 80 (6), 1450-1463 (2011).
- Farruggio, A. P., Chavez, C. L., Mikell, C. L., Calos, M. P. Efficient reversal of phiC31 integrase recombination in mammalian cells. Biotechnology Journal. 7 (11), 1332-1336 (2012).
- Venken, K. J. T., He, Y., Hoskins, R. A., Bellen, H. J. P[acman]: A BAC Transgenic Platform for Targeted Insertion of Large DNA Fragments in D. melanogaster. Science. 314 (5806), 1747-1751 (2006).
- Meredith, J. M., et al. Site-specific integration and expression of an anti-malarial gene in transgenic Anopheles gambiae significantly reduces Plasmodium infections. PLoS ONE. 6 (1), 14587 (2011).
- Meredith, J. M., Underhill, A., McArthur, C. C., Eggleston, P. Next-Generation Site-Directed Transgenesis in the Malaria Vector Mosquito Anopheles gambiae: Self-Docking Strains Expressing Germline-Specific phiC31 Integrase. PLoS ONE. 8 (3), 59264 (2013).
- Bernardini, F., et al. Site-specific genetic engineering of the Anopheles gambiae Y chromosome. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7600-7605 (2014).
- Volohonsky, G., et al. Tools for Anopheles gambiae Transgenesis. G3. 5 (6), 1151-1163 (2015).
- Amenya, D. A., et al. Comparative fitness assessment of Anopheles stephensi transgenic lines receptive to site-specific integration. Insect Molecular Biology. 19 (2), 263-269 (2010).
- Isaacs, A. T., et al. Transgenic Anopheles stephensi coexpressing single-chain antibodies resist Plasmodium falciparum development. Proceedings of the National Academy of Sciences of the United States of America. 109 (28), 1922-1930 (2012).
- Pham, T. B., et al. Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLoS Genetics. 15 (12), 1008440 (2019).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2015).
- Groth, A. C., Fish, M., Nusse, R., Calos, M. P. Construction of Transgenic Drosophila by Using the Site-Specific Integrase from Phage phiC31. Genetics. 166 (4), 1775-1782 (2004).
- Franz, A. W. E., et al. Comparison of transgene expression in Aedes aegypti generated by mariner Mos1 transposition and site-directed recombination. Insect Molecular Biology. 20 (5), 587-598 (2011).
- Labbé, G., Nimmo, D., Alphey, L. piggybac-and PhiC31-Mediated Genetic Transformation of the Asian Tiger Mosquito, Aedes albopictus (Skuse). PLoS Neglected Tropical Diseases. 4 (8), 788 (2010).
- Schetelig, M. F., Scolaric, F., Handler, A. M., Kittelmann, S., Gasperi, G., Wimmer, E. A. Site-specific recombination for the modification of transgenic strains of the Mediterranean fruit fly Ceratitis capitata. Proceedings of the National Academy of Sciences of the United States of America. 106 (43), 18171-18176 (2009).
- Yonemura, N., et al. phiC31-integrase-mediated, site-specific integration of transgenes in the silkworm, Bombyx mori (Lepidoptera: Bombycidae). Applied Entomology and Zoology. 43 (11), 997-1008 (2013).
- Bateman, J. R., Lee, A. M., Wu, C. T. Site-specific transformation of Drosophila via phiC31 integrase-mediated cassette exchange. Genetics. 173 (2), 769-777 (2006).
- Adolfi, A., Poulton, B., Anthousi, A., Macilwee, S., Ranson, H., Lycett, G. J. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Haghighat-Khah, R. E., et al. Site-specific cassette exchange systems in the aedes aegypti mosquito and the Plutella xylostella moth. PLoS ONE. 10 (4), 0121097 (2015).
- Long, D., Lu, W., Zhang, Y., Bi, L., Xiang, Z., Zhao, A. An efficient strategy for producing a stable, replaceable, highly efficient transgene expression system in silkworm, Bombyx mori. Scientific Reports. 5 (1), 8802 (2015).
- Volohonsky, G., et al. Transgenic Expression of the Anti-parasitic Factor TEP1 in the Malaria Mosquito Anopheles gambiae. PLoS Pathogens. 13 (1), 1006113 (2017).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Berghammer, A. J., Klingler, M., Wimmer, E. A. A universal marker for transgenic insects. Nature. 402 (6760), 370-371 (1999).
- Ringrose, L. Transgenesis in Drosophila melanogaster. Methods in Molecular Biology. 561, 3-19 (2009).
- Dong, Y., Simões, M. L., Marois, E., Dimopoulos, G. CRISPR/Cas9 -mediated gene knockout of Anopheles gambiae FREP1 suppresses malaria parasite infection. PLoS Pathogens. 14 (3), 1006898 (2018).
- Lombardo, F., Lycett, G. J., Lanfrancotti, A., Coluzzi, M., Arcà, B. Analysis of apyrase 5' upstream region validates improved Anopheles gambiae transformation technique. BMC research notes. 2, 24 (2009).
- Pondeville, E., et al. Efficient ΦC31 integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Lobo, N. F., Clayton, J. R., Fraser, M. J., Kafatos, F. C., Collins, F. H. High efficiency germ-line transformation of mosquitoes. Nature protocols. 1 (3), 1312-1317 (2006).
- Terenius, O., Juhn, J., James, A. A. Injection of An. stephensi embryos to generate malaria-resistant mosquitoes. Journal of Visualized Experiments. 5, 216 (2007).
- Lynd, A., et al. Insecticide resistance in Anopheles gambiae from the northern Democratic Republic of Congo, with extreme knockdown resistance (kdr) mutation frequencies revealed by a new diagnostic assay. Malaria Journal. 17 (1), 412 (2018).
- Marinotti, O., et al. Development of a population suppression strain of the human malaria vector mosquito, Anopheles stephensi. Malaria Journal. 12 (1), 142 (2013).
- Adolfi, A. In vivo functional genetic analysis of insecticide resistance in the malaria mosquito Anopheles gambiae. University of Liverpool. , (2017).
- Isaacs, A. T., Lynd, A., Donnelly, M. J. Insecticide-induced leg loss does not eliminate biting and reproduction in Anopheles gambiae mosquitoes. Scientific Reports. 7, 46674 (2017).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), 6736-6743 (2015).
- Li, M., Akbari, O. S., White, B. J. Highly efficient site-specific mutagenesis in malaria mosquitoes using CRISPR. G3: Genes, Genomes, Genetics. 8 (2), 653-658 (2018).
- Poulton, B. C., et al. Using the GAL4-UAS System for Functional Genetics in Anopheles gambiae. J. Vis. Exp. , (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유