Method Article
Ein dreidimensionales Sphäroidmodell zur Untersuchung der Tumor-Stroma-Wechselwirkung bei hepatozellulären Karzinomen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Es fehlen umfassende In-vitro-Modelle , die die relevante menschliche Krankheit getreu rekapitulieren. Die aktuelle Studie präsentiert die dreidimensionale (3D) Tumorsphäroidbildung und -kultur, ein zuverlässiges In-vitro-Werkzeug zur Untersuchung der Tumor-Stroma-Interaktion beim menschlichen hepatozellulären Karzinom.
Zusammenfassung
Die Aggressivität und das Fehlen gut verträglicher und breit wirksamer Behandlungen für das fortgeschrittene hepatozelluläre Karzinom (HCC), die vorherrschende Form von Leberkrebs, rationalisieren seinen Rang als zweithäufigste Ursache für krebsbedingte Todesfälle. Präklinische Modelle müssen angepasst werden, um die menschlichen Bedingungen zu rekapitulieren, um die besten therapeutischen Kandidaten für die klinische Entwicklung auszuwählen und die Bereitstellung personalisierter Medizin zu unterstützen. Dreidimensionale (3D) zelluläre Sphäroidmodelle sind vielversprechend als aufstrebende In-vitro-Alternative zu zweidimensionalen (2D) Monoschichtkulturen. Hier beschreiben wir ein 3D-Tumor-Sphäroidmodell, das die Fähigkeit einzelner Zellen zur Aggregation nutzt, wenn sie in hängenden Tröpfchen gehalten werden, und repräsentativer für eine In-vivo-Umgebung ist als Standard-Monoschichten. Darüber hinaus können 3D-Sphäroide durch die Kombination homotypischer oder heterotypischer Zellen hergestellt werden, die die zelluläre Heterogenität in vivo besser widerspiegeln und möglicherweise die Untersuchung von Umweltinteraktionen ermöglichen, die das Fortschreiten und die Behandlungsreaktionen beeinflussen können. Die aktuelle Forschung optimierte die Zelldichte, um homotypische und heterotypische 3D-Tumorsphäroide zu bilden, indem Zellsuspensionen auf den Lidern von Standard-10 cm3-Petrischalen immobilisiert wurden. Die Längsschnittanalyse wurde durchgeführt, um Wachstumskurven für homotypische versus heterotypische Tumor-/Fibroblasten-Sphäroide zu generieren. Schließlich wurde der proliferative Einfluss von Fibroblasten (COS7-Zellen) und Lebermyofibroblasten (LX2) auf homotypische Tumorsphäroide (Hep3B) untersucht. Eine Seeding-Dichte von 3.000 Zellen (in 20 μL-Medien) ergab erfolgreich heterotypische Huh7/COS7-Sphäroide, die bis zum 8. Kulturtag eine stetige Größenzunahme zeigten, gefolgt von einer Wachstumsverzögerung. Dieser Befund wurde unter Verwendung homotypischer Hep3B-Sphäroide bestätigt, die in LX2 (human hepatic stellate cell line) conditioned medium (CM) kultiviert wurden. LX2 CM löste die Proliferation von Hep3B-Sphäroiden im Vergleich zu Kontrolltumorphäroiden aus. Zusammenfassend hat dieses Protokoll gezeigt, dass 3D-Tumorsphäroide als einfaches, wirtschaftliches und vorgescreentes In-vitro-Werkzeug verwendet werden können, um Tumor-Stroma-Interaktionen umfassender zu untersuchen.
Einleitung
Die weltweite Inzidenz und Mortalität durch Leberkrebs hat trotz Fortschritten bei der Behandlung von Lebererkrankungen und den meisten anderen Krebsarten weiter zugenommen. Im Jahr 2018 übertraf Leberkrebs Darm- und Magenkrebs und wurde weltweit zur zweithäufigsten krebsbedingten Todesursache1. Im Jahr 2020 gab es mehr als 9.00.000 neue Diagnosen, was 4,7% der gesamten Krebsfälle weltweit ausmacht1. Dies ist besonders enttäuschend, da die signifikanten Risikofaktoren für die Entwicklung von HCC, der häufigsten Form von Leberkrebs, gut charakterisiert sind2. Zirrhose ist der häufigste Risikofaktor für die Entwicklung von HCC, wobei sich 80% der Fälle vor dem Hintergrund einer etablierten Zirrhose entwickeln2. Zu den chronischen Lebererkrankungen, die zur Zirrhose und damit zum HCC führen, gehören das Hepatitis-B-Virus (HBV), das Hepatitis-C-Virus (HCV), die alkoholbedingte Lebererkrankung (ARLD), die nichtalkoholischen Fettlebererkrankungen (NAFLD) - letztere werden auf Fettleibigkeit und Typ-2-Diabetes mellitus (T2DM) zurückgeführt2,3. Die aktuellen Managementprotokolle für HCC sind stadiumsabhängig und für Patienten mit fortgeschrittenem Krebs, die am häufigsten ein schlechtes Ergebnis haben4, begrenzt. Es gab bedeutende Fortschritte bei der Verwendung von Kinasehemmern und in jüngster Zeit bei immunonkologischen Behandlungen, obwohl realistisch gesehen nur eine Minderheit der Patienten mit fortgeschrittenem Leberkrebs davon profitieren5. Darüber hinaus besteht die Befürchtung, dass HCCs, die bei Patienten mit NAFLD auftreten - der am schnellsten wachsenden zugrunde liegenden Ursache, die mehr als 50% der neu diagnostizierten HCC-Fälle in westlichen Ländern ausmacht - gegen die Checkpoint-Inhibitor-Therapie mit programmiertem Tod 1 (PD1) resistenter sein könnten6.
Es wurde massiv in klinische Studien für Patienten mit HCC investiert, einschließlich signifikanter Verbesserungen bei klinischen Studien und ihren Endpunkten7. Nach einem Jahrzehnt des Scheiterns haben diese Investitionen begonnen, die Möglichkeiten für Patienten zu verändern. Die Realität ist jedoch, dass der Gesamtanteil der Responder nach wie vor relativ gering ist, wobei Patienten, die in Studien rekrutiert werden, oft schlecht die in den Kliniken betreuten Patienten repräsentieren. Die Gefahr besteht darin, dass die Fortschritte kostspielig sind und eher den Wenigen als den Vielen zugute kommen. Da immer mehr Therapiekandidaten für den einmaligen Gebrauch oder eine Kombination entstehen, ist es wichtig, präklinische Modelle zu haben, die die In-vivo-Reaktionen besser vorhersagen. Dabei handelt es sich wahrscheinlich um Modelle, die zusätzliche Faktoren einbeziehen, die zur Variabilität der Patientenreaktionen beitragen, die die menschliche HCC-Heterogenität und pathologische Komplexität besser widerspiegeln8. Systeme, die die pathophysiologischen In-vivo-Bedingungen von HCC nachbilden, werden benötigt, um die Biologie der Tumorevolution, des Wachstums und der Progression zu verstehen. Die bestehenden experimentellen Modelle für chronische Lebererkrankungen und HCC fallen in der Regel in drei Hauptkategorien: in vivo tierbasierte Modelle (überprüft in 9), In-vitro-Kulturen10 und ex vivo11,12-Modelle. Tierbasierte Ansätze werden häufig verwendet, um chronische Lebererkrankungen, einschließlich HCC, zu untersuchen. Die genetische Variabilität, die hohen Betriebskosten und das unterschiedliche Immunsystem zwischen den Arten gehören jedoch zu den Haupteinschränkungen für die Anwendung solcher Modelle9. Während einige Ex-vivo-Modelle im Vergleich zu anderen In-vitro-Zelllinienmodellen ein hervorragendes Werkzeug für die Fokussierung auf menschliches Gewebe bieten, behindern die Gewebeverfügbarkeit und der begrenzte experimentelle Zeitverlauf ihre Nutzung in großem Maßstab.
Auf der anderen Seite bleiben die In-vitro-Zelllinienmodelle eine gute Option für Wissenschaftler, die mit begrenzten Ressourcen arbeiten, mit einem geringeren Bedarf an einer konstanten Versorgung mit frischem menschlichem Gewebe10. Diese Modelle bieten auch ein Werkzeug, das als erster Screen verwendet werden kann, um bei der Zielvalidierung der Arzneimittelauswahl zu helfen, bevor komplexere In-vivo-Modelle verwendet werden. Die jüngste Modifikation der traditionellen 2D-Monoschichtkulturen in 3D-Kulturen hat die Wirksamkeit dieser In-vitro-Modelle verbessert13,14.
3D-In-vitro-Modelle können kritische Merkmale rekapitulieren, die unter normalen und pathologischen Bedingungen beim Menschen beobachtet wurden. Unter physiologischen Bedingungen wird die Signaltransduktion durch zelluläres Übersprechen und Interaktion mit anderen Bindegewebsmolekülen, nämlich den Proteinen der extrazellulären Matrix (ECM), initiiert und bildet ein 3D-Interaktionsnetzwerk15,16. Der Tumor entwickelt sich in einer 3D-kugelförmigen Form während der malignen Transformation, für die Sauerstoff und Nährstoffe in der Nicht-Tumor/Tumor-Interphase leicht reichlich vorhanden sind. Gleichzeitig überwiegen hypoxische Zustände am Tumorkern. Diese Heterogenität in der Nährstoffverfügbarkeit führt zur Aktivierung räumlich unterschiedlicher Signal- und Stoffwechselwege, die die Tumorgenese regulieren. Diese Bedingungen sind in den herkömmlichen 2D-Monolayer-Kulturen14, in denen Zellen auf steifem Kulturplastik in physiologisch irrelevanter Weise wachsen, schlecht rekapituliert. Krebszellen kommunizieren auch mit anderen nicht-parenchymalen Zellen, der primären Quelle von ECM, Wachstum und Invasionssignalen innerhalb der Tumormikroumgebung. Im Gegensatz zu 2D-Kulturen können 3D-In-vitro-Modelle eine geeignetere Plattform bieten, um diese Tumor-Stroma-Interaktion zu untersuchen17.
3D-Modelle sind im HCC-Bereich weit verbreitet und unterscheiden sich in der Art und Weise, wie das Mikrogewebe gebildet wird18,19,20,21,22,23. Die meisten dieser Modelle verwendeten entweder die extrem niedrigen Bindungsplatten18,19,20,21,22 oder Trans-Wells23 im Prozess der Sphäroidbildung. Das beschriebene Protokoll führt die Hängetröpfchentechnik als alternatives, plastikfreies und kostengünstiges in vitro 3D-Tumorsphäroidmodell ein. Dies kann die Beurteilung der parakrinen und autokrinen Rolle von Fibroblasten bei der Proliferation der Tumorzellen im 3D-Format erleichtern.
Protokoll
1. Zellpräparation
- Führen Sie alle Experimente unter sterilen Bedingungen in einer mikrobiologischen Sicherheitswerkbank mit laminarem Durchfluss der Klasse II durch (siehe Materialtabelle).
- Schalten Sie die Haube ein und ermöglichen Sie die Stabilisierung des Luftstroms.
- Besprühen Sie die innere Haubenoberfläche gründlich mit 70% Ethanol, um mögliche Verunreinigungen durch frühere Benutzer zu vermeiden.
- Bereiten Sie 5% einer Desinfektionslösung in einem 500 ml Glasbecher vor. Verwerfen Sie alle Zellüberstände oder Zelltrümmer in der Lösung.
- Reinigen Sie alle Mikropipetten und Kippboxen gründlich mit 70% Ethanol.
- Bereiten Sie frische Zellkulturmedien vor, indem Sie Dulbeccos modifiziertes Eagle's Medium (DMEM) Hochglukosemedium mit 10% hitzedeaktiviertem fetalem Rinderserum (FBS), 1% Penicillin/Streptomycin (100 Einheiten/ml Penicillin und 100 μg/ml Streptomycin) und 2 mM L-Glutamin ergänzen. Reduzieren Sie für die LX2-hepatische Sternzelllinie die Konzentration des FBS-Supplements auf 2%.
- Warme Nährmedien vor Beginn des Experiments.
- Nehmen Sie Huh7 und Hep3B HCC-Tumorzelllinien und COS7- und LX2-Fibroblastenzelllinien aus ihrem Lagergestell in flüssigem Stickstoff. Kryokonservierte Zellen schnell auftauen.
- Aufgetaute Zellen mit 2 ml frischem Kulturmedium verdünnen. Zentrifugieren Sie Zellen bei 200 x g für 4 min bei Raumtemperatur. Verwerfen Sie den Überstand und resuspenieren Sie das Zellpellet in 1 ml frischem Warmkulturmedium.
- Samenzellen im T75-Zellkulturkolben. Inkubieren Sie die Zellen in einem Zellkulturinkubator in 5% CO2 bei 37 °C unter 95% befeuchteten Bedingungen, bis die Zellen 60% -70% Konfluenz erreichen.
2. Zellsammlung
- Nährmedien ansaugen und Zellen dreimal mit Phosphatpuffer-Kochsalzlösung (PBS) waschen.
- Fügen Sie 2 ml vorgewärmtes 1x Trypsin hinzu, um adhärente Zellen vom Boden der T75-Kolben zu lösen. Bei 37 °C in einem Inkubator für 4 min inkubieren.
- Inaktivieren Sie Trypsin, indem Sie 4 ml vollständiges Kulturmedium hinzufügen. Sammeln Sie die Zellsuspension und zentrifugieren Sie die Zellen bei 200 x g für 4 min bei Raumtemperatur. Verwerfen Sie den Überstand und resuspenieren Sie die Zellen in 4 ml frischen Kulturmedien.
3. Zellzählung
- Wirbeln Sie die Zellsuspension vorsichtig, um eine homogene Verteilung der Zellen im Zentrifugenröhrchen zu gewährleisten.
- Mischen Sie mit einer 10 μL Pipette 10 μL Zellsuspension mit 10 μL Trypanblau. Pipettieren Sie die Mischung viermal vorsichtig nach oben und unten, um eine vollständige Färbung der äußeren Zelloberfläche mit dem Farbstoff zu gewährleisten.
- Zählen Sie die Anzahl der Zellen mit einem Hämozytometer.
- Legen Sie zunächst einen Deckglas über den Zählbereich des Hämozytometers, bevor Sie die gefärbte Zellsuspension laden.
- Legen Sie die Pipettenspitze mit der Zellsuspension in die V-Nut des Hämozytometers. Stoßen Sie den Spitzeninhalt vorsichtig in die Zählfolie aus.
- Lassen Sie die Aufschlämmung einige Minuten ruhen, bevor Sie sie für die Zellzählung auf dem Mikroskoptisch fixieren.
HINWEIS: Um Doppelzählungen zu vermeiden, zählen Sie nur die Zellen auf den beiden Seiten des großen Quadrats. - Zählen Sie in Zellen, die die obere oder die rechte Linie überlappen, und vermeiden Sie diejenigen, die sich mit der unteren oder der linken Linie überschneiden.
- Berechnen Sie die Gesamtzahl der Zellen.
HINWEIS: Zellzahl pro ml =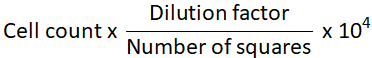
4. Sammlung von fibroblastenkonditionierten Medien (CM)
- Saugen Sie Kulturmedien ab und waschen Sie die LX2-Zellen dreimal mit PBS.
- Fügen Sie 2 ml vorgewärmtes 1x Trypsin hinzu, um adhärente Zellen vom Boden der T75-Kolben zu lösen. Den Kolben bei 37 °C in einem Inkubator für 4 min inkubieren.
- Inaktivieren Sie Trypsin, indem Sie 4 ml vollständiges Kulturmedium hinzufügen. Sammeln Sie die Zellsuspension und zentrifugieren Sie die Zellen bei 200 x g für 4 min bei Raumtemperatur. Zählen Sie die Zellen gemäß Schritt 3.
- Säen Sie 1 x 106 LX2 Zellen in 10 cm3 Schalen für 48 h bei 37 °C.
- Sammeln Sie den Fibroblasten CM nach 48 h. Zentrifugieren Sie bei 200 x g für 4 min bei Raumtemperatur, um schwimmende Zellen zu pelletieren. Steriler Filter des CM mit einem 0,22 μm Filter, der auf dem Boden von 20 ml Spritzen befestigt ist.
- Sammeln Sie den Überstand CM. Aliquotieren Sie den CM in 2 ml Röhrchen und lagern Sie ihn bei -80 °C für weitere Anwendungen.
HINWEIS: Die Lösung kann 6 Monate bei -80 °C gelagert werden.
5. Validierung von Zelldichten für perfekte Sphäroide
- Saugen Sie Kulturmedien ab und waschen Sie die HCC-Zelllinien dreimal mit PBS.
- Fügen Sie 2 ml vorgewärmtes 1x Trypsin hinzu, um adhärente Zellen vom Boden der T75-Kolben zu lösen. Bei 37 °C in einem Inkubator für 4 min inkubieren.
- Inaktivieren Sie Trypsin, indem Sie 4 ml vollständiges Kulturmedium hinzufügen. Sammeln Sie die Zellsuspension und zentrifugieren Sie die Zellen bei 200 x g für 4 min bei Raumtemperatur.
- Zählen Sie die Zellen gemäß Schritt 3.
- Pipettieren Sie verschiedene Dichten aus den Tumorzelllinien (12000, 6000, 3000, 1500, 1000, 750, 500, 250 und 125 Zellen) in 20 μL Medien auf der Innenfläche eines 10 cm3 großen Deckels einer Petrischale.
- Fügen Sie 10 ml steriles PBS auf den Boden der Schale hinzu, um feuchte Bedingungen für den Prozess der Sphäroidbildung zu schaffen.
- Drehen Sie den Deckel der 10 cm3 großen Schüssel um, damit das Medium, einschließlich der Zellsuspension, über einer feuchten Umgebung hängen kann. Lassen Sie die hängenden Tröpfchen für 3 Tage.
- Machen Sie Bilder der Sphäroide mit 50-facher Vergrößerung mit einem inversen Mikroskop 3 Tage nach dem Aufhängen der ursprünglichen Tröpfchen.
6. Heterotypischer Tumor/Stroma-Sphäroide
- Suspendieren Sie 1500 Huh7 HCC-Zellen mit 1500 COS7-Säugetierfibroblastenzellen (Verhältnis 1: 1) in hängenden Tröpfchen, um Kugeln zu bilden. Fügen Sie 10 ml steriles PBS auf den Boden der Schüssel hinzu, um feuchte Bedingungen für die Sphäroide zu schaffen.
- Drehen Sie den Deckel der 10 cm3 großen Schüssel um, damit das Medium, einschließlich der Zellsuspension, über einer feuchten Umgebung hängen kann. Lassen Sie die hängenden Tröpfchen für 3 Tage.
- Machen Sie Bilder der Sphäroide mit einem inversen Mikroskop von Tag 3 bis Tag 10 der Kultur.
- Stellen Sie die 10 cm3 Schale auf das Mikroskoptisch. Stellen Sie die Vergrößerung des Mikroskops für alle Sphäroide auf das 50-fache ein.
- Öffnen Sie die Mikroskopsoftware auf dem angeschlossenen Computer und passen Sie den Fokus an, um ein klares Bild von jedem Sphäroid zu erhalten. Verwenden Sie das Capture Tool in der Mikroskopsoftware, um die aufgenommenen Bilder zu speichern.
7. Homotypische Hep3B-Sphäroide in LX2 CM
- Suspendieren Sie 3000 Hep3B HCC-Zellen in den hängenden Tröpfchen, um Kugeln zu bilden. Fügen Sie 10 ml steriles PBS auf den Boden der Schüssel hinzu, um feuchte Bedingungen für die Sphäroide zu schaffen.
- Drehen Sie den Deckel der 10 cm3 großen Schüssel um, damit das Medium, einschließlich der Zellsuspension, über einer feuchten Umgebung hängen kann. Lassen Sie die hängenden Tröpfchen für 3 Tage.
- Übertragen Sie Hep3B-Sphäroide in 20 μL frisches CM aus LX2-Zellen in hängenden Tröpfchen.
HINWEIS: Verwenden Sie sterile autoklavierte ungefilterte 200 μL-Pipettenspitzen beim Sphäroidtransfer, um störungen oder verletzungen der gebildeten Sphäroide zu vermeiden. Dies dient auch dazu, alle verbleibenden Zellen zu eliminieren, die nicht an das einzelne Hauptsphäroid gebunden bleiben.- Verwenden Sie eine autoklavierte 20-μL-Pipette für den Transferprozess. Stellen Sie das Pipettenvolumen auf 2 μL ein. Befestigen Sie die Pipettenspitze an der Pipette.
- Kehren Sie den Deckel der 10 cm3 großen Schale um, auf der die Sphäroide gebildet wurden. Befestigen Sie den Deckel auf der Bühne eines Lichtmikroskops. Stellen Sie den Feinfokus des Mikroskops ein, um jedes Sphäroid sichtbar zu machen.
- Entleeren Sie die Luft vorsichtig aus der Mikropipette, indem Sie die Kolbentaste drücken. Setzen Sie die Pipettenspitze in das Tröpfchen ein, einschließlich des zu übertragenden Sphäroides. Kommen Sie dem Sphäroid sehr nahe, ohne es mit der Spitze zu berühren.
- Lassen Sie den Druck auf den Kolbenknopf vorsichtig los, um das Absaugen des Sphäroides in die Mikropipettenspitze in 2 μL Medien zu ermöglichen.
- Übertragen Sie das Sphäroid in ein neues Tröpfchen, das an einer neuen 10 cm3 Schale hängt, mit neuen Medien / konditionierten Medien / Behandlung.
HINWEIS: Stellen Sie sicher, dass alle Sphäroide mit dem Lichtmikroskop erfolgreich auf die neue 10 cm3 Schale übertragen werden.
- Nehmen Sie Bilder der Sphäroide mit 50-facher Vergrößerung mit einem inversen Mikroskop vom Tag des Transfers (Tag 3) bis Tag 7 der Kultur in LX2 CM auf.
8. Berechnung des Sphäroidvolumens
- Weisen Sie jedem Sphäroid eine eindeutige numerische Kennung zu, damit Bilder von übereinstimmenden Sphäroiden täglich erfasst werden können.
- Analysieren Sie Bilder der wachsenden Sphäroide mit einem Bildanalyse-Softwarepaket.
- Öffnen Sie jedes Sphäroidbild innerhalb des Softwarepakets. Verwenden Sie das Freihand-Auswahlwerkzeug und umreißen Sie jedes Sphäroid. Wählen Sie in der Dropdown-Schaltfläche Analyse die Option Messung festlegen und dann Bereich aus. Drücken Sie OK.
- Zeichnen Sie manuell einen Kreis um jedes Sphäroid. Sobald die Kugel eingekreist ist, drücken Sie Strg + M , damit das Programm den Sphäroidbereich in Pixel berechnen kann. Wandeln Sie die Fläche des Sphäroids in ein Volumen um.
HINWEIS: Volumen des Sphäroidsmm3 = 0,09403 ×
- Berechnen Sie die Änderung des Sphäroidvolumens relativ zu seinem Volumen am ersten Tag der Bildaufnahme.
HINWEIS: Dies dient dazu, das Sphäroidvolumen auf das Startvolumen zu normalisieren und die Genauigkeit angesichts der natürlichen Variation der Startgröße zu verbessern.
Ergebnisse
Zellen, die in einem mehrschichtigen 3D-Format kultiviert werden, spiegeln die Komplexität der Tumormikroumgebung genauer wider als herkömmliche 2D-Kulturen24,25. Zuvor haben viele Studien die Sphäroid-Kulturmedien mit verschiedenen Mitogenen und Wachstumsfaktoren26 ergänzt, um die Sphäroidbildung einzuleiten. In dieser Studie liefert die Zugabe von Fibroblasten oder deren CM jedoch essentielle Mitogene und Wachstumsfaktoren, um das Sphäroidwachstum zu beschleunigen.
Abbildung 1 zeigt Daten aus einer Pilotstudie, in der Huh7 menschliche HCC-Zellen in einer absteigenden Aussaatdichte von 12.000 bis zu 125 Zellen in 20 μL frischen Medien für 3 Tage ausgesät wurden. Eine Seeding-Dichte von 12.000 Zellen ergab Sphäroide mit einer asymmetrischen Form, die auch nach Halbierung der Zell-Seeding-Dichte nicht korrigiert wurde. Sphäroide, die aus 3000 Zellen hergestellt wurden, erschienen jedoch abgerundeter (Abbildung 1, obere Reihe). Eine weitere Reduktion der Zellkonzentration gelang weder die Bildung einzelner Kugeln (125, 250, 500 Zelldichtekugeln) noch ein regelmäßiges sphärisch ähnliches Aussehen (1000 und 1500 Zelldichte-Sphäroide). Es ist erwähnenswert, dass viele kleine Kugeln mit einer Dichte von 500 Tumorzellen gebildet wurden; Es wurde jedoch nur ein kleines Sphäroid bei 50-facher Vergrößerung eingefangen (Abbildung 1, obere Reihe). Das gleiche optimierte Protokoll wurde auf die COS7-Nierenfibroblasten-Zelllinie des COS7-Primaten angewendet (Abbildung 1, mittlere Reihe). Die Suspendierung von 125, 250 und 500 COS7-Fibroblasten in 20 μL hängenden Tröpfchen führte zu einem abgerundeten Sphäroid mit mehreren kleineren Sphäroide, während höhere Zelldichten (1000, 1500 und 3000) einzelne halbgerundete Sphäroide bildeten. Ähnlich wie bei den Huh7-Tumorsphäroiden führten höhere Zellsuspensionen (6.000 und 12.000 Zellen/Kugel) zur Bildung unregelmäßiger Zellaggregate, wodurch höhere Zellkonzentrationen verworfen wurden (Abbildung 1, mittlere Reihe). Niedrige Dichten von Huh7/COS7-heterotypischen Zellsuspensionen (125, 250 und 500 Zellen/Kugel) erzeugten ein einzelnes Sphäroid mit mehreren schwebenden oder halb angebrachten Sphäroiden (Abbildung 1, untere Reihe). 1000- und 1500-Zell-heterotypische Sphäroide waren halb abgerundet, während eine Seeding-Dichte von 3000 Zellen (1500 pro Zelltyp) ein abgerundetes 3D-Sphäroid ergab. Wie bereits erwähnt, führten höhere Zelldichten zur Bildung von Aggregaten anstelle von klar definierten Sphäroiden (Abbildung 1, untere Reihe). Zusammenfassend wurden 3000 Sphäroide mit Zelldichte gerundet, ähnlich wie menschliche HCC-Tumore, und für weitere Experimente angepasst. Die Kultivierung der Zellsuspensionen als hängende Tröpfchen für 3 Tage reichte aus, um die Sphäroidbildung zu fördern.
Nach der Optimierung der besten Zellkonzentration und des zeitpunkts für die Sphäroidbildung im aktuellen Kontext wurde die proliferative Wirkung von co-kultivierenden Tumor- und Fibroblastenzelllinien longitudinal bewertet. Abbildungen 2 und Abbildung 3 zeigen Huh7/COS7 heterotypische Sphäroide (3000 Gesamtzellzahlen pro Sphäroid), die von Tag 3 bis Tag 10 überwacht werden. Als Kontrollen dienten homotypische Huh7- und COS7-Sphäroide (je 1500 Zellen). Ab Tag 4 wuchsen heterotypische Sphäroide im Vergleich zu homotypischen Sphäroiden in einer idealen runden Form (Abbildung 2). Das Anfangsvolumen des heterotypischen Sphäroids war größer als das jedes homotypischen Sphäroids. Das Wachstum von Sphäroiden wurde als die Änderung ihres Volumens relativ zum Anfangsvolumen am Tag der Sphäroidbildung berechnet, um eine normale Variation des Sphäroidvolumens zu vermeiden (Tag 3, Abbildung 3). Heterotypische Sphäroide zeigten zunächst eine schnelle Wachstumsphase von Tag 4 bis Tag 7, gefolgt von einer langsameren Wachstumsphase an Tag 8 (Abbildungen 2, obere Reihe und Abbildung 3). Das Sphäroidvolumen nahm an den Tagen 9 und 10 ab, was möglicherweise die Erschöpfung der Nährstoffe oder einen hypoxischen Kern und den Zelltod widerspiegelt.
Im Gegensatz dazu wuchsen homotypische Huh7- und COS7-Sphäroide viel langsamer (Abbildung 2, mittlere und untere Reihe; Abbildung 3). Homotypische Sphäroide zeigten bis zum fünften Tag der Kultur (zwei Tage nach der Sphäroidbildung) eine relativ statische Wachstumskurve. Ab Tag 6 zeigten die homotypischen Sphäroide eine allmähliche Zunahme ihrer Wachstumskurve, wenn auch mit einer signifikant niedrigeren Rate als die der heterotypischen Sphäroide (Abbildung 3). Zusammenfassend lässt sich sagen, dass tumor/ fibroblasten heterotypische Sphäroide mit einer höheren Rate wachsen als homotypische Sphäroide, was darauf hindeutet, dass der direkte Kontakt von Tumorzellen und Fibroblasten die Größe der Tumorsphäroide erhöht.
Um die oben genannten Ergebnisse zu validieren und den parakrinen Einfluss von mesenchymalen Zellen auf die Proliferation von HCC-Sphäroiden in einem leberbezogenen Kontext zu untersuchen, wurden 3 Tage alte homotypische Hep3B HCC-Sphäroide für weitere 4 Tage in normalen frischen Medien oder CM aus LX2-leberförmigen Sternzellen gezüchtet (Abbildung 4 und Abbildung 5). Auf den ersten Blick bildeten 3000 Hep3B-Zellen nach 3 Tagen perfekt abgerundete Sphäroide (Abbildung 4). Hep3B-Sphäroide zeigten eine kontinuierliche Proliferation in frischen Medien von Tag 3 bis Tag 7 (Abbildung 4, obere Reihe). Die Wachstumsrate wurde erhöht, wenn Hep3B-Sphäroide in LX2 CM beibehalten wurden (Abbildung 4, untere Reihe). Diese medienabhängige Umwandlung im Hep3B-Sphäroidwachstum zeigte statistische Signifikanz von Tag 4 bis zum Ende des Experiments (Abbildung 5), was auf eine fibroblastengetriebene Proliferation von Tumorsphäroiden hindeutet.
Zusammenfassend lässt sich sagen, dass diese Studie die bestehenden 3D-Sphäroidkulturen erfolgreich modifiziert hat, um das Crosstalk zwischen HCC-Tumorzellen und verschiedenen Fibroblastenzelllinien zu nutzen und die proliferative Bedeutung dieser direkten und indirekten zellulären Interaktion zu untersuchen (Abbildung 6). Eine weitere Charakterisierung der gebildeten Sphäroide ist erforderlich, um die Interaktion von Tumorzellen mit der umgebenden Mikroumgebung zu verbessern.
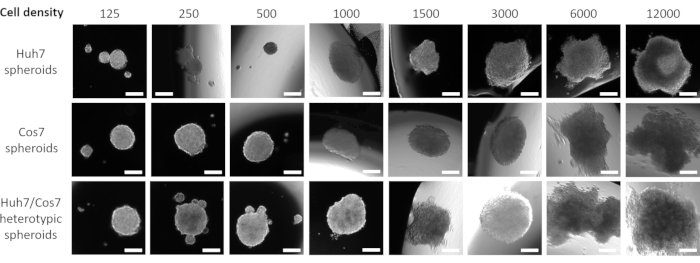
Abbildung 1: Optimierung der optimalen Zelldichte für die Sphäroidbildung. Spalten repräsentieren unterschiedliche Zellaussaatdichten, und Zeilen stellen Sphäroide dar, die aus Huh7-Zellen (obere Reihe), COS7-Zellen (mittlere Reihe) und huh7/COS7-heterotypischen Zellen (untere Zeile) gebildet werden. Die Bilder stellen Sphäroide dar, die nach dem Suspendieren von 125, 250, 500, 1000, 1500, 3000, 6000 und 12000 Zellen (von links nach rechts) in 20 μL-Medien für 3 Tage gebildet wurden. Die Pilotstudie umfasste zwei Sphäroide pro Bedingung, und die Bilder wurden mit 50-facher Vergrößerung aufgenommen, Maßstabsbalken = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
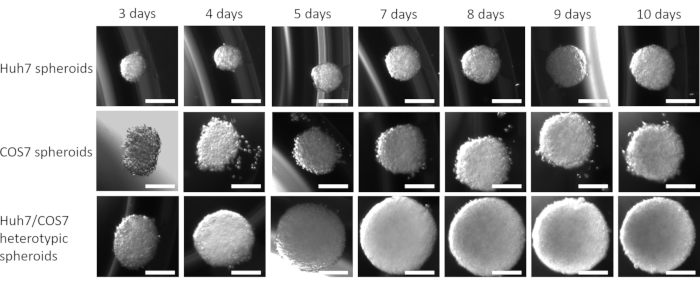
Abbildung 2: Heterotypisches versus homotypisches Sphäroidwachstum. Spalten stellen den Tag dar, an dem Sphäroidbilder aufgenommen wurden, und Zeilen zeigen repräsentative Bilder für Sphäroide, die aus Huh7-Zellen (obere Reihe), COS7-Zellen (mittlere Reihe) und Huh7/COS7-Zellen (untere Reihe) gebildet wurden. Die Bilder stellen die Sphäroide dar, die nach dem Suspendieren von 3000 Zellen aus jeder Bedingung (homotypisches Huh7, COS7 oder die heterotypischen Sphäroide Huh7 / COS7) verschiedener Zeitpunkte von links nach rechts gebildet wurden. Das Experiment umfasste 10 Sphäroide pro Bedingung, und die Bilder wurden mit 50-facher Vergrößerung aufgenommen, Maßstabsbalken = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
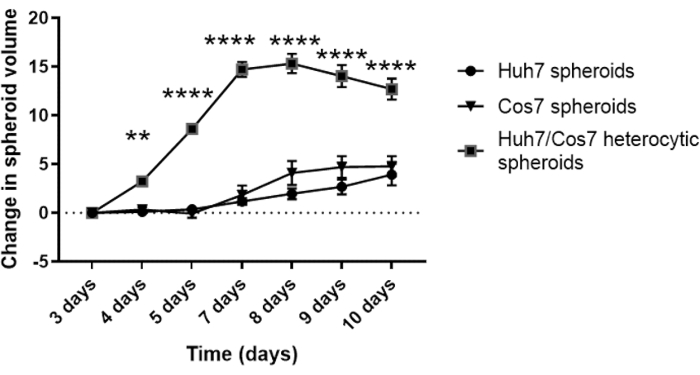
Abbildung 3: Längsschnittanalyse des heterotypischen versus homotypischen Sphäroidwachstums. Die Grafik zeigt die Wachstumskurve von heterotypischen Huh7/COS7-Sphäroiden gegenüber homotypischen Huh7- und COS7-Sphäroiden. Die Daten werden als Mittelwert ± s.e.m dargestellt; n = 10 unabhängige Sphäroide. ** p < 0,01; P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
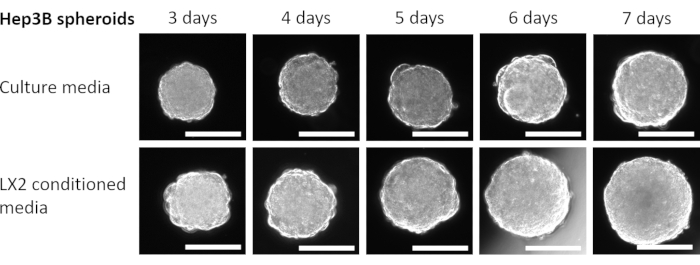
Abbildung 4: Wachstum homotypischer Hep3B-Sphäroide in LX2 CM. Spalten stellen den Tag dar, an dem Sphäroidbilder aufgenommen wurden, und Zeilen zeigen repräsentative Bilder von Hep3B-Sphäroiden, die in frischen DMEM-Kulturmedien (obere Reihe) oder LX2 CM (untere Reihe) kultiviert wurden. Das Experiment umfasste sieben Sphäroide pro Bedingung (frische Medien oder LX2 CM), und die Bilder wurden mit 50-facher Vergrößerung aufgenommen, Maßstabsbalken = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
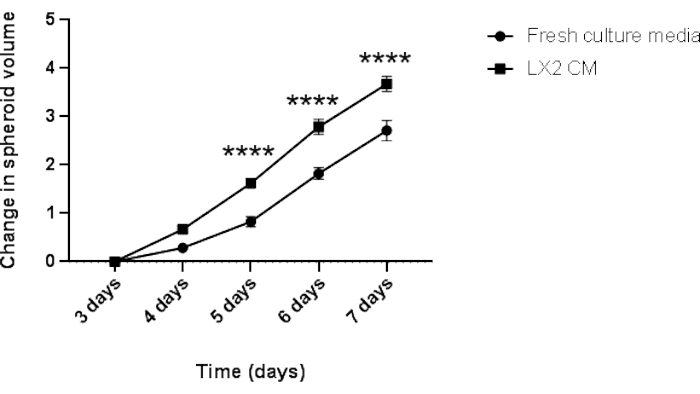
Abbildung 5: Längsschnittanalyse des homotypischen Hep3B-Sphäroidwachstums. Die Grafik zeigt die Wachstumskurve von Hep3B-Sphäroiden in frischen DMEM-Kulturmedien oder LX2 CM. Die Daten werden als Mittelwert ± s.e.m dargestellt; n = 7 unabhängige Sphäroide. P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
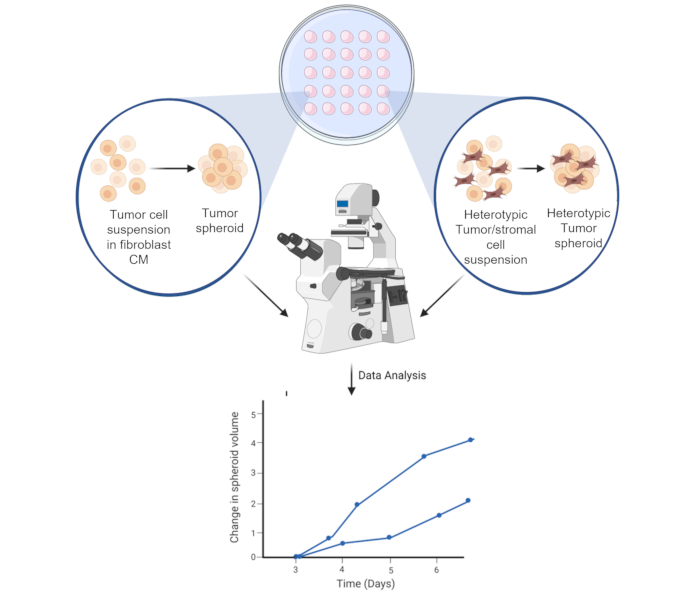
Abbildung 6: Schematische Darstellung des Sphäroidbildungsprozesses. Die Zellsuspension wird auf dem Innendeckel der 10 cm3 Petrischale pipettiert. Der Deckel wird invertiert und 3 Tage lang aufbewahrt, um eine homotypische oder heterotypische Sphäroidbildung zu ermöglichen. Sphäroide Bilder werden mit 50-facher Vergrößerung aufgenommen. Die Abbildung wird mit einem webbasierten wissenschaftlichen Illustrationstool erstellt (siehe Materialverzeichnis). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Der Kontext, in dem die experimentellen Zelllinien wachsen, beeinflusst ihr Genexpressionsprofil, ihre Signalweganalyse und ihre funktionellen Kriterien. In Brustkrebszellen beispielsweise bleibt die Koordination zwischen verschiedenen onkogenen Signalwegen nur erhalten, wenn Krebszellen in 3D-Konformation gezüchtet werden27. Deregulierte Gene in 3D-Melanomen und Brustkrebs-Sphäroiden, aber nicht in den Monolayer-Zellen, sind für den menschlichen In-vivo-Tumor relevanter28,29. Zum Beispiel waren die β1-Integrinspiegel in Brustepithelzellen und Tumorgegenstücken niedriger als die in einem 2D-Format gezüchteten Spiegel29. Darüber hinaus neigen Fibroblasten in 3D-Strukturen dazu, in Bezug auf Morphologie und Geschwindigkeit deutlich zu migrieren, verglichen mit denen, die auf Kunststoff kultiviert werden30. Darüber hinaus aktiviert die mechanische Steifigkeit des Wachstumssubstrats spezifische Signalwege, die die maligne Transformation normaler Epithelzellen durch Deregulation der extrazellulären signalregulierten Kinase (ERK)/Rho in Epithelzellen fördern31. Diese Faktoren begünstigen den Übergang von der konventionellen 2D-Kultur zu 3D-Sphäroidmodellen, da 3D-Kulturen eher mit menschlichen Krankheiten übereinstimmen.
Die aktuelle Studie verwendete herkömmliche Laborwerkzeuge und -zubehör, um ein 3D-Tumor-Sphäroidmodell zu erstellen. Die gebildeten Sphäroide reagierten auf die Proliferationssignale von Fibroblasten, wie ihr signifikant erhöhtes Wachstum zeigt. Dieses Modell gehört zur Kategorie der mehrzelligen Tumorsphäroide. Es gibt drei weitere Kategorien von 3D-Tumorsphäroiden, darunter Tumorosphären32, gewebeabgeleitete Tumorkugeln33,34 und organotypische mehrzellige Sphäroide35. In mehrzelligen Tumorsphäroiden werden Tumorzellen unter Bedingungen mit geringer Adhäsion suspendiert, damit sie sich zu Kugeln zusammenschließen können, ohne den Boden des Kulturgefäßes zu berühren36. Für diese verankerungsunabhängige Technik wurden mehrere Ansätze eingesetzt, die von rotierenden Systemen, Flüssigkeits-Overlay-Techniken bis hin zu unbeschichteten U-förmigen Platten mit extrem niedriger Befestigung reichen37. Bei HCC verwenden die meisten In-vitro-Sphäroidkulturen die 24- oder 96-Well-Platten mit extrem niedriger Bindung, um abgerundete Sphäroide zu bilden18,19,20,21,22. Diese Technik ist jedoch nicht kostengünstig und schließt einen versehentlichen Zell-Kunststoff-Kontakt nicht aus. Andere Systeme verwenden Trans-Wells23 oder Leberschnitte12, um Lebermikrogewebe herzustellen. Die Verwendung von menschlichem Gewebe in translationalen Arbeiten ist der Goldstandard, aber für viele Forschungsgruppen nicht immer verfügbar oder zugänglich. Der aktuelle Ansatz profitierte von der Theorie der hängenden Tröpfchen. Zellsuspension wird hinzugefügt, so dass die Tumorsphäroide in einer zugänglichen Flüssig-Luft-Grenzfläche zu einzelnen abgerundeten Kugeln gebildet werden38. Vorteile der Verwendung dieser Technik sind das Fehlen eines Zell-Kunststoff-Kontakts und die Leichtigkeit, das autokrine und parakrine Übersprechen zwischen Tumor- und Fibroblastenzellen zu untersuchen. Dieses Modell wurde in einer weiteren Studie weiter validiert, in der die Bedeutung des nicht-parenchymalen TREM2 für den Schutz der Leber vor der HCC-Entwicklung entschlüsselt wurde39. Diese Arbeit zeigte, dass das Volumen sowohl von Hep3B- als auch von PLC/PRF5-Sphäroiden in der Kontrolle von LX2 CM höher war als bei TREM2-überexprimierendem LX2 CM in einer Wnt-abhängigen Weise39.
In der aktuellen Studie wurden Fibroblasten vor der Sphäroidbildung mit Tumorzellen gemischt, um die proliferative Wirkung dieser Kokultur zu untersuchen. Andere haben Fibroblasten, Endothelzellen und Immunzellen mit Tumorzellsuspension hinzugefügt, nachdem sie ein Tumorsphäroid gebildet hatten, um die Migration von Stromazellen in den Tumor zu untersuchen40,41. Das aktuelle heterotypische Sphäroidmodell zeigte ein ähnliches Wachstumsmuster wie die zuvor berichteten Modelle und der ursprüngliche In-vivo-Tumor; Sphäroide zeigen ein exponentielles Wachstum, gefolgt von einer verzögerten Wachstumsphase, höchstwahrscheinlich aufgrund der Erschöpfung der Nährstoffe und der Vergrößerung des nekrotischen Kerns42. Anstatt Wachstumsfaktoren und Mitogene hinzuzufügen, um die Sphäroidbildung zu unterstützen, verwendete diese Studie einen physiologischeren Ansatz, indem diese Wachstumsfaktoren aus direktem Kontakt mit Fibroblasten oder ihrem Sekretom im Fibroblasten-CM stammten. Es ist wichtig zu erwähnen, dass LX2-Zellen durch die Behandlung mit TGFβ1 oder PDGF43 weiter aktiviert werden können. LX2-Zellen wurden 48 h lang mit 10 ng/ml TGFβ1 behandelt, bevor das Medium für verschiedene experimentelle Einstellungen entfernt wurde. LX2-Zellen wurden dreimal mit PBS gewaschen (um einen direkten TGFβ1-Effekt auszuschließen), und dann wurden frische Medien für weitere 24 Stunden hinzugefügt, bevor das CM gesammelt wurde. Das aus TGFβ1-stimuliertem LX2 gewonnene CM induzierte das Wachstum der Hep3B-Sphäroide mit einer höheren Rate als das CM aus der Kontrolle LX2 (Daten nicht gezeigt). Dieses flexible System kann sich für Co-Kulturen verschiedener Krebszellen plus/ minus Fibroblasten sowie für von Patienten abgeleitete Linien eignen. Es kann auch einen Screening-Assay mit mittlerem Durchsatz für Medikamente anbieten, der schnell übernommen und in eine translationale Wirkstoffentdeckungspipeline eingefügt werden könnte, um die Dosierung für In-vivo-Studien zu informieren.
Eine Einschränkung der aktuellen Studie ist die Verwendung der immortalisierten Zelllinien bei der Sphäroidbildung anstelle von frisch isolierten HCC-Tumorzellen und krebsassoziierten Fibroblasten. Eine weitere Einschränkung ist der Vergleich des wachstums des homotypischen Hep3B-Sphäroides zwischen CM aus LX2 und in frischen Medien anstelle von CM aus anderen Nicht-Fibroblasten-Zelllinien. Die letztgenannte Einschränkung könnte durch die genetische Veränderung eines Gens von Interesse in den Fibroblasten behoben werden, gefolgt von der Anwendung des CM vom Wildtyp gegenüber dem gentechnisch veränderten Fibroblasten auf homotypische Sphäroide.
Offenlegungen
FO ist Direktor und Aktionär von Fibrofind Limited.
Danksagungen
MYWZ wird vom Secretary of State for Business, Energy and Industrial Strategy und dem Newton Prize 2020 als Teil der offiziellen Entwicklungshilfe "ODA" und des Newton-Fonds des Vereinigten Königreichs finanziert. SS wird durch das Cancer Research UK Advanced Clinician Scientist Fellowship C53575 / A29959 unterstützt. SS, FO und HR erhalten Eine Finanzierung im Rahmen von HUNTER, die durch eine Partnerschaft zwischen Cancer Research UK, der Fondazione AIRC und der Fundacion Cientifica de la Asociacion Espanola Contra el Cancer finanziert wird.
Materialien
| Name | Company | Catalog Number | Comments |
| 1x Trypsin | Sigma Aldrich | 59429C | |
| 2 mL tubes | Eppendorf | ||
| Biorender | Biorender.com | Online | |
| Class II laminar flow BioMAT2 hood | Medair Technologies | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Biosera | M-D1107 | |
| Excel sofware | Microsoft office 365 | ||
| Graphpad prism sofware | GraphPad software | ||
| Heat deactivated fetal bovine serum (FBS) | life tech | 105000064 | |
| Image J software | Fiji | ||
| L-glutamine | Sigma Aldrich | G7513-100ml | |
| Penicillin/streptomycin (100 unit/ml penicillin and 100 μg/ml streptomycin) | Sigma Aldrich | P0781-100ml | |
| Petri dish 90 mm, triple vented | Greiner | 633175 | |
| Trypan blue | Sigma Aldrich | T8154 | |
| Virkon™ Broad Spectrum Disinfectant, 5kg Bucket | Rely+On™ | SCI-129999 | |
| Ziess inverted microscope | Ziess |
Referenzen
- Ferlay, J., et al. Cancer statistics for the year 2020: an overview. International Journal of Cancer. , (2021).
- Llovet, J. M., et al. Hepatocellular carcinoma. Nature Reviews Disease Primers. 7 (1), 6 (2021).
- Reeves, H. L., Zaki, M. Y., Day, C. P. Hepatocellular carcinoma in obesity, Type 2 diabetes, and NAFLD. Digestive Diseases & Sciences. 61 (5), 1234-1245 (2016).
- Forner, A., Reig, M., Bruix, J. Hepatocellular carcinoma. Lancet. 391 (10127), 1301-1314 (2018).
- Reig, M., et al. Diagnosis and treatment of hepatocellular carcinoma. Update of the consensus document of the AEEH, AEC, SEOM, SERAM, SERVEI, and SETH. Medicina Clinica (Barc). 156 (9), 1-30 (2021).
- Pfister, D., et al. NASH limits anti-tumour surveillance in immunotherapy-treated HCC. Nature. 592 (7854), 450-456 (2021).
- Llovet, J. M., et al. Trial design and endpoints in hepatocellular carcinoma: AASLD consensus conference. Hepatology. 73, 158-191 (2021).
- Llovet, J. M., Hernandez-Gea, V. Hepatocellular carcinoma: reasons for phase III failure and novel perspectives on trial design. Clinical Cancer Research. 20 (8), 2072-2079 (2014).
- Brown, Z. J., Heinrich, B., Greten, T. F. Mouse models of hepatocellular carcinoma: an overview and highlights for immunotherapy research. Nature Reviews Gastroenterology and Hepatology. 15 (9), 536-554 (2018).
- Nikolic, M., Sustersic, T., Filipovic, N. In vitro models and on-chip systems: Biomaterial interaction studies with tissues generated using lung epithelial and liver metabolic cell lines. Frontiers in Bioengineering and Biotechnology. 6, 120 (2018).
- Clark, A. M., Ma, B., Taylor, D. L., Griffith, L., Wells, A. Liver metastases: Microenvironments and ex-vivo models. Experimental Biology and Medicine. 241 (15), 1639-1652 (2016).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Brassard-Jollive, N., Monnot, C., Muller, L., Germain, S. In vitro 3D systems to model tumor angiogenesis and interactions with stromal cells. Frontiers in Cell and Developmental Biology. 8, 594903 (2020).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Kleinman, H. K., Philp, D., Hoffman, M. P. Role of the extracellular matrix in morphogenesis. Current Opinion in Biotechnology. 14 (5), 526-532 (2003).
- Bissell, M. J., Radisky, D. C., Rizki, A., Weaver, V. M., Petersen, O. W. The organizing principle: microenvironmental influences in the normal and malignant breast. Differentiation. 70 (9-10), 537-546 (2002).
- Ronnov-Jessen, L., Petersen, O. W., Koteliansky, V. E., Bissell, M. J. The origin of the myofibroblasts in breast cancer. Recapitulation of tumor environment in culture unravels diversity and implicates converted fibroblasts and recruited smooth muscle cells. Journal of Clinical Investigations. 95 (2), 859-873 (1995).
- Shao, H., et al. A novel stromal fibroblast-modulated 3D tumor spheroid model for studying tumor-stroma interaction and drug discovery. Journal of Visualized Experiments: JoVE. (156), e60660 (2020).
- Song, Y., et al. Activated hepatic stellate cells play pivotal roles in hepatocellular carcinoma cell chemoresistance and migration in multicellular tumor spheroids. Scientific Reports. 6, 36750 (2016).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. International Journal of Molecular Sciences. 20 (7), (2019).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Scientific Reports. 8 (1), 14297 (2018).
- Khawar, I. A., et al. Three dimensional mixed-cell spheroids mimic stroma-mediated chemoresistance and invasive migration in hepatocellular carcinoma. Neoplasia. 20 (8), 800-812 (2018).
- Feaver, R. E., et al. Development of an in vitro human liver system for interrogating non-alcoholic steatohepatitis. Journal of Clinical Investigations Insight. 1 (20), 90954 (2016).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) and reactive oxygen species. Federation of American Societies for Experimental Biology Journal. 17 (3), 503-505 (2003).
- Chen, R., et al. Screening candidate metastasis-associated genes in three-dimensional HCC spheroids with different metastasis potential. International Journal of Clinical Experimental Pathology. 7 (5), 2527-2535 (2014).
- Venkataraman, G., et al. Preferential self-association of basic fibroblast growth factor is stabilized by heparin during receptor dimerization and activation. Proceedings of the National Academy of Sciences of the United States of America. 93 (2), 845-850 (1996).
- Bissell, M. J., et al. Tissue structure, nuclear organization, and gene expression in normal and malignant breast. Cancer Research. 59, 1757-1763 (1999).
- Ghosh, S., et al. Three-dimensional culture of melanoma cells profoundly affects gene expression profile: a high density oligonucleotide array study. Journal of Cellular Physiology. 204 (2), 522-531 (2005).
- Delcommenne, M., Streuli, C. H. Control of integrin expression by extracellular matrix. Journal of Biological Chemistry. 270 (45), 26794-26801 (1995).
- Meshel, A. S., Wei, Q., Adelstein, R. S., Sheetz, M. P. Basic mechanism of three-dimensional collagen fibre transport by fibroblasts. Nature Cell Biology. 7 (2), 157-164 (2005).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8 (3), 241-254 (2005).
- Yu, M., et al. Cancer therapy. Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Weiswald, L. B., et al. Newly characterised ex vivo colospheres as a three-dimensional colon cancer cell model of tumour aggressiveness. British Journal of Cancer. 101 (3), 473-482 (2009).
- Kondo, J., et al. Retaining cell-cell contact enables preparation and culture of spheroids composed of pure primary cancer cells from colorectal cancer. Proceedings of the National Academy of Sciences of the United States of America. 108 (15), 6235-6240 (2011).
- Rajcevic, U., et al. Colorectal cancer derived organotypic spheroids maintain essential tissue characteristics but adapt their metabolism in culture. Proteome Sciences. 12, 39 (2014).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4 (3), 309-324 (2009).
- Friedrich, J., Ebner, R., Kunz-Schughart, L. A. Experimental anti-tumor therapy in 3-D: spheroids--old hat or new challenge. International Journal of Radiation Biology. 83 (11-12), 849-871 (2007).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnology & Bioengineering. 83 (2), 173-180 (2003).
- Esparza-Baquer, A., et al. TREM-2 defends the liver against hepatocellular carcinoma through multifactorial protective mechanisms. Gut. 70 (7), 1345-1361 (2021).
- Dangles-Marie, V., et al. A three-dimensional tumor cell defect in activating autologous CTLs is associated with inefficient antigen presentation correlated with heat shock protein-70 down-regulation. Cancer Research. 63 (13), 3682-3687 (2003).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumour angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Mayer, B., et al. Multicellular gastric cancer spheroids recapitulate growth pattern and differentiation phenotype of human gastric carcinomas. Gastroenterology. 121 (4), 839-852 (2001).
- Xu, L., et al. Human hepatic stellate cell lines, LX-1 and LX-2: new tools for analysis of hepatic fibrosis. Gut. 54 (1), 142-151 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten