Method Article
Un modelo esferoide tridimensional para investigar la interacción tumor-estroma en el carcinoma hepatocelular
* Estos autores han contribuido por igual
En este artículo
Resumen
Faltan modelos integrales in vitro que recapitulen fielmente la enfermedad humana relevante. El presente estudio presenta la creación y cultivo de esferoides tumorales tridimensionales (3D), una herramienta in vitro fiable para estudiar la interacción tumor-estroma en el carcinoma hepatocelular humano.
Resumen
La agresividad y la falta de tratamientos bien tolerados y ampliamente efectivos para el carcinoma hepatocelular avanzado (CHC), la forma predominante de cáncer de hígado, racionalizan su rango como la segunda causa más común de muerte relacionada con el cáncer. Los modelos preclínicos deben adaptarse para recapitular las condiciones humanas para seleccionar los mejores candidatos terapéuticos para el desarrollo clínico y ayudar a la entrega de medicina personalizada. Los modelos de esferoides celulares tridimensionales (3D) son prometedores como una alternativa in vitro emergente a los cultivos monocapa bidimensionales (2D). Aquí, describimos un modelo esferoide tumoral 3D que explota la capacidad de las células individuales para agregarse cuando se mantiene en gotas colgantes, y es más representativo de un entorno in vivo que las monocapas estándar. Además, los esferoides 3D se pueden producir mediante la combinación de células homotípicas o heterotípicas, que reflejan más la heterogeneidad celular in vivo, lo que potencialmente permite el estudio de las interacciones ambientales que pueden influir en la progresión y las respuestas al tratamiento. La investigación actual optimizó la densidad celular para formar esferoides tumorales homotípicos y heterotípicos en 3D mediante la inmovilización de suspensiones celulares en las tapas de las placas de Petri estándar de 10 cm3 . Se realizó un análisis longitudinal para generar curvas de crecimiento de esferoides homotípicos versus heterotípicos tumorales/fibroblastos. Finalmente, se investigó el impacto proliferativo de los fibroblastos (células COS7) y los miofibroblastos hepáticos (LX2) sobre los esferoides tumorales homotípicos (Hep3B). Una densidad de siembra de 3.000 células (en medios de 20 μL) produjo con éxito esferoides heterotípicos Huh7 /COS7, que mostraron un aumento constante de tamaño hasta el día 8 del cultivo, seguido de retraso del crecimiento. Este hallazgo fue corroborado utilizando esferoides homotípicos Hep3B cultivados en medio condicionado (CM) LX2 (línea celular estrellada hepática humana). LX2 CM desencadenó la proliferación de esferoides Hep3B en comparación con los esferoides tumorales de control. En conclusión, este protocolo ha demostrado que los esferoides tumorales 3D se pueden utilizar como una herramienta in vitro simple, económica y de preselección para estudiar las interacciones tumor-estroma de manera más integral.
Introducción
La incidencia y la mortalidad mundiales por cáncer de hígado han seguido aumentando, a pesar de los avances en los tratamientos para la enfermedad hepática y la mayoría de los otros tipos de cáncer. En 2018, el cáncer de hígado superó al cáncer colorrectal y de estómago para convertirse en la segunda causa más común de muerte relacionada con el cáncer a nivel mundial1. En 2020, hubo más de 9.000.000 de nuevos diagnósticos, lo que representa el 4,7% del total de casos de cáncer en todo el mundo1. Esto es particularmente decepcionante, dado que los factores de riesgo significativos para el desarrollo de CHC, la forma más común de cáncer de hígado, están bien caracterizados2. La cirrosis es el factor de riesgo más común para el desarrollo de CHC, con un 80% de los casos que se desarrollan en el contexto de la cirrosis establecida2. Las enfermedades hepáticas crónicas, que progresan a cirrosis y, en consecuencia, CHC, incluyen el virus de la hepatitis B (VHB), el virus de la hepatitis C (VHC), la enfermedad hepática relacionada con el alcohol (ARLD), las enfermedades del hígado graso no alcohólico (EHGNA), estas últimas atribuidas a la obesidad y la diabetes mellitus tipo 2 (DM2)2,3. Los protocolos de manejo actuales para el CHC son dependientes del estadio y limitados para las personas con cáncer avanzado, que con mayor frecuencia tienen un resultado deficiente4. Se han producido avances significativos en el uso de inhibidores de la quinasa y, más recientemente, los tratamientos inmuno-oncológicos, aunque de manera realista, benefician solo a una minoría de pacientes con cánceres hepáticos avanzados5. Además, existe la preocupación de que los HCC que surgen en pacientes con EHGNA, la causa subyacente de más rápido crecimiento, que representa más del 50% de los casos de CHC recién diagnosticados en las naciones occidentales, puedan ser más resistentes a la terapia con inhibidores del punto de control de muerte programada 1 (PD1)6.
Ha habido una inversión masiva en ensayos clínicos para pacientes con CHC, incluyendo mejoras significativas en los ensayos clínicos y sus criterios de valoración7. Después de una década de fracasos, estas inversiones han comenzado a cambiar las oportunidades para los pacientes. Sin embargo, la realidad es que la proporción general de respondedores sigue siendo relativamente pobre, y los pacientes reclutados en los ensayos a menudo representan mal a los atendidos en las clínicas. El peligro es que los avances sean costosos y beneficien a unos pocos en lugar de a muchos. A medida que surgen más terapias candidatas para un solo uso o combinación, es esencial tener modelos preclínicos más predictivos de las respuestas in vivo. Es probable que se trate de modelos que incorporen factores adicionales que contribuyan a la variabilidad observada en las respuestas de los pacientes y que reflejen mejor la heterogeneidad del CHC humano y la complejidad patológica8. Se necesitan sistemas que recreen las condiciones fisiopatológicas in vivo del CHC para ayudar a comprender la biología de la evolución, el crecimiento y la progresión del tumor. Los modelos experimentales existentes de enfermedades hepáticas crónicas y CHC generalmente se dividen en tres categorías principales: modelos in vivo de origen animal (revisados en9), cultivos in vitro10 y modelos ex vivo11,12. Los enfoques basados en animales se utilizan ampliamente para estudiar las enfermedades hepáticas crónicas, incluido el CHC; sin embargo, la variabilidad genética, los altos costos de funcionamiento y los diferentes sistemas inmunes entre especies se encuentran entre las principales limitaciones para la aplicación de dichos modelos9. Si bien algunos modelos ex vivo proporcionan una excelente herramienta para centrarse en los tejidos humanos en comparación con otros modelos de líneas celulares in vitro, la disponibilidad de tejidos y el curso de tiempo experimental limitado obstruyen su utilización a gran escala.
Por otro lado, los modelos de línea celular in vitro siguen siendo una buena opción para los científicos que trabajan con recursos limitados, con una menor necesidad de tener un suministro constante de tejidos humanos frescos10. Estos modelos también proporcionan una herramienta que se puede utilizar como una primera pantalla para ayudar con la validación objetivo de la selección de fármacos antes de proceder a modelos in vivo más complejos. La reciente modificación de los cultivos monocapa 2D tradicionales en cultivos 3D ha mejorado la eficacia de estos modelos in vitro13,14.
Los modelos 3D in vitro pueden recapitular características críticas observadas en condiciones humanas normales y patológicas. En condiciones fisiológicas, la transducción de señales se inicia a través de la diafonía celular y la interacción con otras moléculas del tejido conectivo, a saber, las proteínas de la matriz extracelular (ECM), formando una red de interacción 3D15,16. El tumor evoluciona en una forma esférica 3D durante la transformación maligna, para la cual el oxígeno y los nutrientes son fácilmente abundantes en la interfase no tumoral/tumoral. Al mismo tiempo, las condiciones hipóxicas predominan en el núcleo del tumor. Esta heterogeneidad en la disponibilidad de nutrientes resulta en la activación de vías metabólicas y de señalización espacialmente distintas que regulan la tumorigénesis. Estas condiciones están mal recapituladas en los cultivos monocapa 2D convencionales14, en los que las células crecen en plástico de cultivo rígido de una manera fisiológicamente irrelevante. Las células cancerosas también se comunican con otras células no parenquimatosas, la fuente principal de ECM, crecimiento y señalización de invasión dentro del microambiente tumoral. A diferencia de los cultivos 2D, los modelos 3D in vitro pueden proporcionar una plataforma más adecuada para estudiar esta interacción tumor-estroma17.
Los modelos 3D son ampliamente utilizados en el campo del CHC, y varían en la forma en que se forma el microtejido18,19,20,21,22,23. La mayoría de estos modelos utilizaron las placas de unión ultrabaja18,19,20,21,22 o transbuques23 en el proceso de formación de esferoides. El protocolo descrito introduce la técnica de gotas colgantes como un modelo de esferoide tumoral 3D alternativo, libre de plástico y rentable in vitro. Esto puede facilitar la evaluación de las funciones paracrinas y autocrinas de los fibroblastos en la proliferación de las células tumorales en un formato 3D.
Protocolo
1. Preparación celular
- Realizar todos los experimentos en condiciones estériles en el armario de seguridad microbiológica de flujo laminar Clase II (ver Tabla de Materiales).
- Encienda la campana y permita la estabilización del flujo de aire.
- Rocíe a fondo la superficie interior de la campana con etanol al 70% para eliminar cualquier posible contaminación de usuarios anteriores.
- Prepare el 5% de una solución desinfectante en un vaso de precipitados de vidrio de 500 ml. Deseche cualquier sobrenadante celular o residuos celulares dentro de la solución.
- Limpie a fondo todas las micropipetas y cajas de punta con etanol al 70%.
- Prepare medios de cultivo celular frescos complementando el medio de glucosa alta modificado eagle's medium (DMEM) de Dulbecco con suero fetal bovino (FBS) desactivado por calor al 10%, penicilina /estreptomicina al 1% (100 unidades/ml de penicilina y 100 μg/ml de estreptomicina) y 2 mM de L-glutamina. Para la línea celular estrellada hepática LX2, reduzca la concentración del suplemento FBS al 2%.
- Calentar los medios de cultivo antes de iniciar el experimento.
- Tome las líneas celulares tumorales Huh7 y Hep3B HCC y las líneas celulares de fibroblastos COS7 y LX2 de su estante de almacenamiento en nitrógeno líquido. Descongelar rápidamente las células criopreservadas.
- Diluya las células descongeladas con 2 ml de medios de cultivo frescos. Células centrífugas a 200 x g durante 4 min a temperatura ambiente. Deseche el sobrenadante y vuelva a suspender el pellet celular en 1 ml de medio de cultivo caliente fresco.
- Células de semilla en matraz de cultivo celular T75. Incubar las células en una incubadora de cultivo celular en 5% de CO2 a 37 °C en condiciones humidificadas al 95% hasta que las células alcancen una confluencia del 60%-70%.
2. Colección de células
- Aspirar los medios de cultivo y lavar las células tres veces con solución salina tampón de fosfato (PBS).
- Agregue 2 ml de tripsina 1x precalentada para separar las células adherentes de la parte inferior de los matraces T75. Incubar a 37 °C en una incubadora durante 4 min.
- Inactivar la tripsina añadiendo 4 ml de medios de cultivo completos. Recoja la suspensión celular y las células centrífugas a 200 x g durante 4 min a temperatura ambiente. Deseche el sobrenadante y resuspenda las células en medios de cultivo frescos de 4 ml.
3. Conteo de células
- Vórtice suavemente la suspensión celular para asegurar una distribución homogénea de las células en el tubo de la centrífuga.
- Usando una pipeta de 10 μL, mezcle 10 μL de suspensión celular con 10 μL de azul de tripano. Pipete suavemente la mezcla hacia arriba y hacia abajo cuatro veces para garantizar la tinción completa de la superficie externa de la célula con el tinte.
- Cuente el número de células usando un hemocitómetro.
- Primero, coloque una cubierta sobre el área de conteo del hemocitómetro antes de cargar la suspensión de la celda teñida.
- Coloque la punta de la pipeta que contiene la suspensión celular en la ranura en V del hemocitómetro. Expulse suavemente el contenido de la punta en la diapositiva de conteo.
- Deje que la suspensión se asiente durante un par de minutos antes de fijarla en la etapa del microscopio para el recuento de células.
NOTA: Para evitar el doble conteo, solo cuente las celdas en los dos lados del cuadrado grande. - Cuente en celdas que superpongan el dominio superior o el derecho y evite los que se superponen al gobierno inferior o izquierdo.
- Calcule el número total de celdas.
NOTA: Número de células por ml =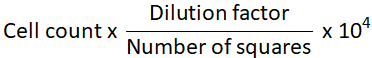
4. Recolección de medios condicionados por fibroblastos (CM)
- Aspire los medios de cultivo y lave las células LX2 tres veces con PBS.
- Agregue 2 ml de tripsina 1x precalentada para separar las células adherentes de la parte inferior de los matraces T75. Incubar el matraz a 37 °C en una incubadora durante 4 min.
- Inactivar la tripsina añadiendo 4 ml de medios de cultivo completos. Recoja la suspensión celular y las células centrífugas a 200 x g durante 4 min a temperatura ambiente. Cuente las celdas según el paso 3.
- Siembra 1 x 106 células LX2 en platos de 10 cm3 durante 48 h a 37 °C.
- Recoger el fibroblasto CM después de 48 h. Centrifugar a 200 x g durante 4 min a temperatura ambiente para granular cualquier celda flotante. Filtro estéril el CM utilizando un filtro de 0,22 μm fijado en la parte inferior de las jeringas de 20 ml.
- Recoger el sobrenadante CM. Alícuota el CM en tubos de 2 ml y guárdelo a -80 °C para aplicaciones posteriores.
NOTA: La solución se puede almacenar durante 6 meses a -80 °C.
5. Validación de densidades celulares para esferoides perfectos
- Aspirar los medios de cultivo y lavar las líneas celulares de HCC tres veces con PBS.
- Agregue 2 ml de tripsina 1x precalentada para separar las células adherentes de la parte inferior de los matraces T75. Incubar a 37 °C en una incubadora durante 4 min.
- Inactivar la tripsina añadiendo 4 ml de medios de cultivo completos. Recoja la suspensión celular y las células centrífugas a 200 x g durante 4 min a temperatura ambiente.
- Cuente las celdas según el paso 3.
- Pipetear diferentes densidades de las líneas celulares tumorales (12000, 6000, 3000, 1500, 1000, 750, 500, 250 y 125 células) en 20 μL de medios en la superficie interior de una tapa de 10 cm3 de una placa de Petri.
- Agregue 10 ml de PBS estéril al fondo del plato para proporcionar condiciones húmedas para el proceso de formación de esferoides.
- Invierta la tapa del plato de 10 cm3 para permitir que el medio, incluida la suspensión celular, cuelgue sobre un ambiente húmedo. Deje las gotas colgantes durante 3 días.
- Tome imágenes de los esferoides a un aumento de 50x usando un microscopio invertido 3 días después de colgar las gotas originales.
6. Tumor heterotípico/esferoides estromales
- Suspenda 1500 células Huh7 HCC con 1500 células fibroblásticas de mamíferos COS7 (proporción 1:1) en gotas colgantes para formar esferas. Agregue 10 ml de PBS estéril al fondo del plato para proporcionar condiciones húmedas para los esferoides.
- Invierta la tapa del plato de 10 cm3 para permitir que el medio, incluida la suspensión celular, cuelgue sobre un ambiente húmedo. Deje las gotas colgantes durante 3 días.
- Tome imágenes de los esferoides usando un microscopio invertido desde el día 3 hasta el día 10 de cultivo.
- Coloque el plato de 10 cm3 en el escenario del microscopio. Ajuste el aumento del microscopio a 50x para todos los esferoides.
- Abra el software del microscopio en la computadora conectada y ajuste su enfoque para tener una imagen clara de cada esferoide. Utilice la herramienta de captura en el software del microscopio para guardar las imágenes adquiridas.
7. Esferoides homotípicos Hep3B en LX2 CM
- Suspenda 3000 células Hep3B HCC en las gotas colgantes para formar esferas. Agregue 10 ml de PBS estéril al fondo del plato para proporcionar condiciones húmedas para los esferoides.
- Invierta la tapa del plato de 10 cm3 para permitir que el medio, incluida la suspensión celular, cuelgue sobre un ambiente húmedo. Deje las gotas colgantes durante 3 días.
- Transfiera los esferoides Hep3B a 20 μL de CM fresco de células LX2 en gotas colgantes.
NOTA: Use puntas de pipeta estériles sin filtrar en autoclave de 200 μL en el proceso de transferencia de esferoides para evitar cualquier interrupción o lesión de los esferoides formados. Esto también es para eliminar cualquier célula residual que permanezca sin adherir al esferoide único principal.- Utilice una pipeta de 20 μL en autoclave para el proceso de transferencia. Ajuste el volumen de la pipeta a 2 μL. Conecte la punta de la pipeta a la pipeta.
- Invierta la tapa del plato de 10 cm3 en el que se formaron los esferoides. Fije la tapa en el escenario de un microscopio de luz. Ajuste el enfoque fino del microscopio para que cada esferoide sea visible.
- Vacíe cuidadosamente el aire de la micropipeta presionando el botón del émbolo. Inserte la punta de la pipeta en la gota, incluido el esferoide, que se va a transferir. Acércate mucho al esferoide sin tocarlo con la punta.
- Suelte suavemente la presión en el botón del émbolo para permitir la succión del esferoide en la punta de la micropipeta en medios de 2 μL.
- Transfiera el esferoide a una nueva gota colgada en un nuevo plato de 10 cm3 , con nuevos medios / medios acondicionados / tratamiento.
NOTA: Asegúrese de que todos los esferoides se transfieran con éxito a la nueva placa de 10 cm3 utilizando el microscopio de luz.
- Tome imágenes de los esferoides a un aumento de 50x utilizando un microscopio invertido desde el día de la transferencia (día 3) hasta el día 7 del cultivo en LX2 CM.
8. Cálculo del volumen esferoide
- Asigne un identificador numérico único para cada esferoide para que las imágenes de los esferoides coincidentes se puedan capturar diariamente.
- Analice imágenes de los esferoides en crecimiento utilizando un paquete de software de análisis de imágenes.
- Abra cada imagen esferoide dentro del paquete de software. Usando la herramienta de selección a mano alzada y delineando cada esferoide. En el botón desplegable Análisis , seleccione Establecer medición y, a continuación, Área. Pulse OK.
- Dibuja manualmente un círculo alrededor de cada esferoide. Una vez que la esfera está rodeada, presione Ctrl + M para permitir que el programa calcule el área esferoide en píxeles. Convierta el área del esferoide en un volumen.
NOTA: Volumen de spheroidmm3 = 0.09403 ×
- Calcule el cambio en el volumen de esferoides en relación con su volumen en el primer día de captura de imagen.
NOTA: Esto es para normalizar el volumen esferoide al volumen inicial y mejorar la precisión dada la variación natural en el tamaño inicial.
Resultados
Las células cultivadas en un formato 3D de múltiples capas reflejan con mayor precisión la complejidad del microambiente tumoral que los cultivos 2D convencionales24,25. Anteriormente, muchos estudios han complementado los medios de cultivo de esferoides con diferentes mitógenos y factores de crecimiento26 para iniciar la formación de esferoides. En este estudio, sin embargo, la adición de fibroblastos, o su CM, proporciona mitógenos esenciales y factores de crecimiento para acelerar el crecimiento de los esferoides.
La Figura 1 muestra los datos de un estudio piloto en el que las células HCC humanas Huh7 se sembraron en una densidad de siembra descendente a partir de 12,000 hasta 125 células en medios frescos de 20 μL durante 3 días. Una densidad de siembra de 12,000 células produjo esferoides con una forma asimétrica, que no se corrigió incluso después de reducir a la mitad la densidad de siembra celular. Sin embargo, los esferoides creados a partir de 3000 células parecían más redondeados (Figura 1, fila superior). Una mayor reducción de la concentración celular no logró formar esferas individuales (125, 250, 500 esferas de densidad celular) ni tuvo una apariencia esférica regular (1000 y 1500 esferoides de densidad celular). Vale la pena mencionar que se formaron muchas esferas pequeñas a una densidad de 500 células tumorales; sin embargo, solo se capturó un pequeño esferoide con un aumento de 50x (Figura 1, fila superior). El mismo protocolo optimizado se aplicó a la línea celular de fibroblastos renales de primates COS7 (Figura 1, fila central). La suspensión de 125, 250 y 500 fibroblastos COS7 en gotas colgantes de 20 μL dio como resultado un esferoide redondeado con múltiples esferoides más pequeños, mientras que las densidades celulares más altas (1000, 1500 y 3000) formaron esferoides semiredondados únicos. Al igual que los esferoides tumorales Huh7, las suspensiones celulares más altas (6.000 y 12.000 células/esfera) dieron lugar a la formación de agregados celulares irregulares y, por lo tanto, se descartaron concentraciones celulares más altas (Figura 1, fila media). Las bajas densidades de suspensiones de células heterotípicas huh7/COS7 (125, 250 y 500 células/esfera) generaron un solo esferoide con múltiples esferoides flotantes o semiadjuntos (Figura 1, fila inferior). Los esferoides heterotípicos de 1000 y 1500 células fueron semiredondeados, mientras que una densidad de siembra de 3000 células (1500 por tipo de célula) dio un esferoide 3D redondeado. Como se señaló anteriormente, las densidades celulares más altas dieron como resultado la formación de agregados en lugar de esferoides bien definidos (Figura 1, fila inferior). En conclusión, 3000 esferoides de densidad celular fueron redondeados, similares a los tumores de CHC humano, y se adaptaron para experimentos posteriores. Cultivar las suspensiones celulares como gotas colgantes durante 3 días fue suficiente para promover la formación de esferoides.
Después de optimizar la mejor concentración celular y el punto de tiempo para la formación de esferoides en el contexto actual, se evaluó longitudinalmente el impacto proliferativo del cocultivo de las líneas celulares tumorales y fibroblásticas. Las Figuras 2 y 3 muestran esferoides heterotípicos Huh7/COS7 (3000 números totales de células por esferoide) monitoreados desde el día 3 hasta el día 10. Los esferoides homotípicos Huh7 y COS7 (1500 células cada uno) sirvieron como controles. A partir del día 4, los esferoides heterotípicos crecieron en una forma redonda ideal en comparación con los esferoides homotípicos (Figura 2). El volumen inicial del esferoide heterotípico era mayor que el de cada esferoide homotípico. El crecimiento de los esferoides se calculó como el cambio en su volumen en relación con el volumen inicial en el día de la formación de esferoides para evitar la variación normal en el volumen de esferoides (día 3, Figura 3). Los esferoides heterotípicos mostraron inicialmente una fase de crecimiento rápido a partir del día 4 hasta el día 7, seguida de una fase más lenta de crecimiento en el día 8 (Figuras 2, fila superior y Figura 3). El volumen esferoide disminuyó en los días 9 y 10, posiblemente reflejando el agotamiento de nutrientes o un núcleo hipóxico y muerte celular.
En contraste, los esferoides homotípicos Huh7 y COS7 crecieron a un ritmo mucho más lento (Figura 2, filas media e inferior; Figura 3). Los esferoides homotípicos exhibieron una curva de crecimiento relativamente estática hasta el quinto día de cultivo (dos días después de la formación de esferoides). A partir del día 6, los esferoides homotípicos comenzaron a mostrar un aumento gradual en su curva de crecimiento, aunque a un ritmo significativamente menor que el de los esferoides heterotípicos (Figura 3). En conclusión, los esferoides heterotípicos tumorales/fibroblastos crecen a un ritmo mayor que los esferoides homotípicos, lo que sugiere que el contacto directo de las células tumorales y los fibroblastos aumenta el tamaño de los esferoides tumorales.
Finalmente, para validar los hallazgos anteriores y estudiar el impacto paracrino de las células mesenquimales en la proliferación de esferoides del CHC en un contexto relacionado con el hígado, los esferoides homotípicos Hep3B HCC de 3 días de antigüedad se cultivaron en medios frescos regulares o CM a partir de células estrelladas hepáticas LX2 (Figura 4 y Figura 5) durante 4 días adicionales. A primera vista, 3000 células Hep3B formaron esferoides perfectamente redondeados después de 3 días (Figura 4). Los esferoides Hep3B mostraron una proliferación continua en medios frescos desde el día 3 hasta el día 7 (Figura 4, fila superior). La tasa de crecimiento mejoró cuando los esferoides Hep3B se mantuvieron en LX2 CM (Figura 4, fila inferior). Esta conversión dependiente de los medios en el crecimiento de los esferoides Hep3B exhibió significación estadística desde el día 4 hasta el final del experimento (Figura 5), lo que sugiere una proliferación de esferoides tumorales impulsada por fibroblastos.
En conclusión, este estudio ha modificado con éxito los cultivos de esferoides 3D existentes para explotar la diafonía entre las células tumorales de HCC y diferentes líneas celulares de fibroblastos e investigar la importancia proliferativa de esta interacción celular directa e indirecta (Figura 6). Se necesita una mayor caracterización de los esferoides formados para mejorar la forma en que las células tumorales interactúan con el microambiente circundante.
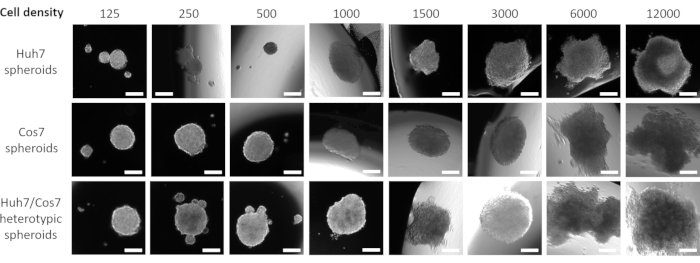
Figura 1: Optimización de la densidad celular óptima para la formación de esferoides. Las columnas representan diferentes densidades de siembra de células, y las filas representan esferoides formados a partir de células Huh7 (fila superior), células COS7 (fila central) y células heterotípicas Huh7/COS7 (fila inferior). Las imágenes representan esferoides formados después de suspender 125, 250, 500, 1000, 1500, 3000, 6000 y 12000 células (de izquierda a derecha) en medios de 20 μL durante 3 días. El estudio piloto incluyó dos esferoides por condición, y las imágenes se tomaron a un aumento de 50x, barra de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
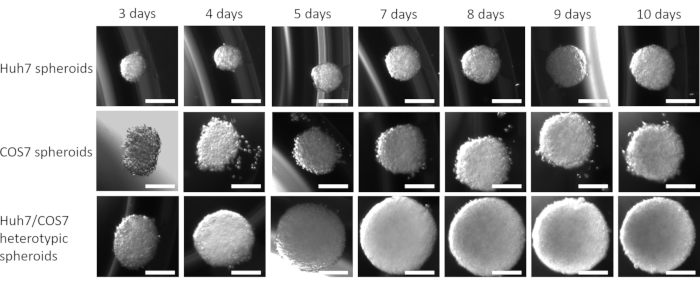
Figura 2: Crecimiento heterotípico versus homotípico de esferoides. Las columnas representan el día en que se tomaron las imágenes esferoides, y las filas muestran imágenes representativas de los esferoides formados a partir de células Huh7 (fila superior), células COS7 (fila central) y células Huh7/COS7 (fila inferior). Las imágenes representan los esferoides formados después de suspender 3000 células de cada condición (Huh7 homotípico, COS7 o los esferoides heterotípicos Huh7 / COS7) de diferentes puntos de tiempo de izquierda a derecha. El experimento incluyó 10 esferoides por condición, y las imágenes se tomaron a un aumento de 50x, barra de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura 3: Análisis longitudinal del crecimiento esferoide heterotípico versus homotípico. El gráfico muestra la curva de crecimiento de los esferoides heterotípicos huh7/COS7 frente a los esferoides homotípicos Huh7 y COS7. Los datos se presentan como media ± s.e.m; n = 10 esferoides independientes. ** p < 0,01; p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
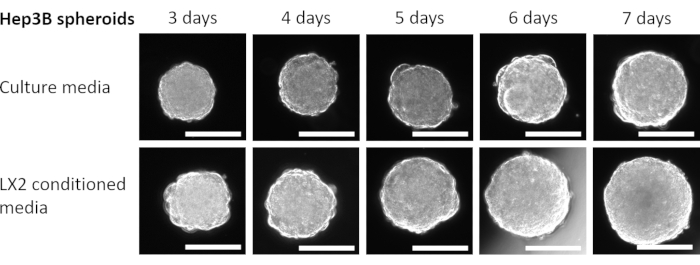
Figura 4: Crecimiento de esferoides homotípicos Hep3B en LX2 CM. Las columnas representan el día en que se capturaron las imágenes esferoides, y las filas muestran imágenes representativas de los esferoides Hep3B cultivados en medios de cultivo DMEM frescos (fila superior) o LX2 CM (fila inferior). El experimento incluyó siete esferoides por condición (medios frescos o LX2 CM), y las imágenes se tomaron a un aumento de 50x, barra de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
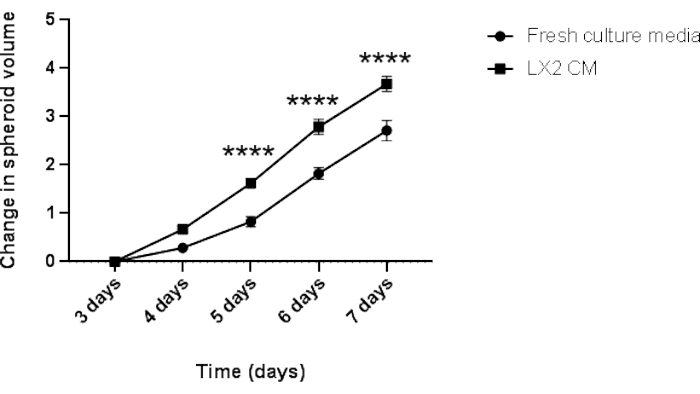
Figura 5: Análisis longitudinal del crecimiento homotípico de los esferoides Hep3B. El gráfico muestra la curva de crecimiento de los esferoides Hep3B en medios de cultivo DMEM frescos o LX2 CM. Los datos se presentan como media ± s.e.m; n = 7 esferoides independientes. p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
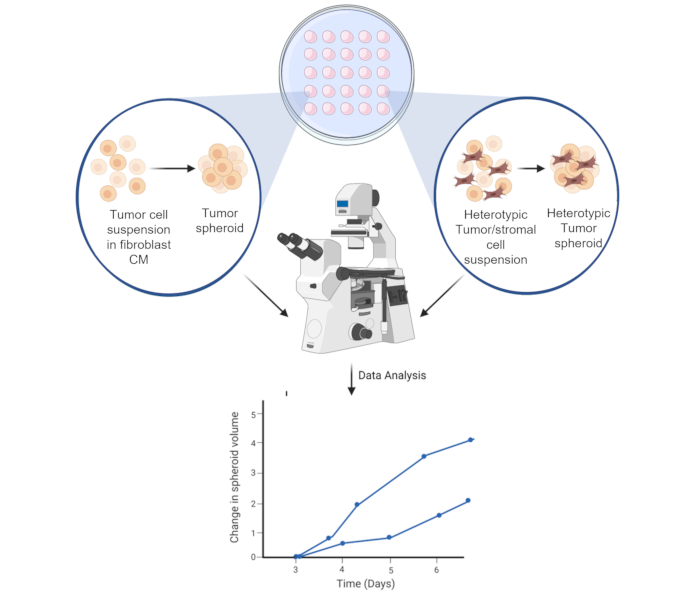
Figura 6: Representación esquemática del proceso de formación de esferoides. La suspensión celular está canalizada en la tapa interior de la placa de Petri de 10 cm3 . La tapa se invierte y se mantiene durante 3 días para permitir la formación de esferoides homotípicos o heterotípicos. Las imágenes esferoides se toman con un aumento de 50x. La figura se crea utilizando una herramienta de ilustración científica basada en la web (ver Tabla de Materiales). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El contexto en el que crecen las líneas celulares experimentales influye en su perfil de expresión génica, análisis de vías y criterios funcionales. Por ejemplo, en las células de cáncer de mama, la coordinación entre las diferentes vías oncogénicas se mantiene solo si las células cancerosas se cultivan en conformación 3D27. Los genes desregulados en el melanoma 3D y los esferoides del cáncer de mama, pero no en las células monocapa, son más relevantes para el tumor humano in vivo28,29. Por ejemplo, los niveles de integrina β1 en células epiteliales mamarias y contrapartes tumorales fueron más bajos que los niveles cultivados en formato 2D29. Además, los fibroblastos en estructuras 3D tienden a migrar claramente en términos de morfología y velocidad en comparación con los cultivados en plástico30. Además, la rigidez mecánica del sustrato de crecimiento activa vías específicas que favorecen la transformación maligna de las células epiteliales normales mediante la desregulación de la quinasa regulada por señal extracelular (ERK)/Rho en las células epiteliales31. Estos factores favorecen la transición del cultivo 2D convencional a los modelos esferoides 3D, ya que los cultivos 3D son más acordes con las enfermedades humanas.
El estudio actual utilizó herramientas y suministros de laboratorio convencionales para producir un modelo de esferoide tumoral 3D. Los esferoides formados respondieron a las señales de proliferación provenientes de los fibroblastos, como lo demuestra su crecimiento significativamente mayor. Este modelo pertenece a la categoría de esferoides tumorales multicelulares. Existen otras tres categorías de esferoides tumorales 3D, incluyendo las tumorosferas32, las esferas tumorales derivadas de tejidos33,34 y los esferoides multicelulares organotípicos35. En los esferoides tumorales multicelulares, las células tumorales se suspenden en condiciones de baja adhesión para permitirles agregarse para formar esferas sin tocar el fondo del vaso de cultivo36. Se han empleado varios enfoques para ofrecer esta técnica independiente del anclaje, que van desde sistemas giratorios, técnicas de superposición líquida y placas en forma de U de fijación ultra baja sin recubrimiento37. En el CHC, la mayoría de los cultivos de esferoides in vitro utilizan las placas ultra bajas de 24 o 96 pocillos para formar esferoides redondeados18,19,20,21,22. Sin embargo, esta técnica no es rentable y no excluye ningún contacto accidental entre células y plásticos. Otros sistemas utilizan trans-wells23 o rodajas de hígado12 para producir micro-tejidos hepáticos. El uso de tejidos humanos en el trabajo traslacional es el estándar de oro, pero no siempre está disponible o accesible para muchos grupos de investigación. El enfoque actual se benefició de la teoría de las gotas colgantes. Se añade suspensión celular para que los esferoides tumorales se formen en una interfaz líquido-aire accesible para formar esferas redondeadas individuales38. Las ventajas de usar esta técnica son la falta de contacto célula-plástico y la facilidad de estudiar la diafonía autocrina y paracrina entre las células tumorales y fibroblásticas. Este modelo fue validado en otro estudio que descifró la importancia del TREM2 no parenquimatoso en la protección del hígado contra el desarrollo del CHC39. Este trabajo mostró que el volumen de los esferoides Hep3B y PLC/PRF5 fue mayor en el control LX2 CM frente a trem2-sobreexpresando LX2 CM de una manera dependiente de Wnt39.
En el estudio actual, los fibroblastos se mezclaron con células tumorales antes de la formación de esferoides para investigar el impacto proliferativo de este cocultivo. Otros han añadido fibroblastos, células endoteliales y células inmunitarias con suspensión de células tumorales después de formar un esferoide tumoral para estudiar la migración de células estromales hacia el tumor40,41. El modelo esferoide heterotípico actual mostró un patrón de crecimiento similar a los modelos reportados previamente y al tumor in vivo original; los esferoides muestran un crecimiento exponencial seguido de una fase de crecimiento retardada, muy probablemente debido al agotamiento de los nutrientes y al agrandamiento del núcleo necrótico42. En lugar de agregar factores de crecimiento y mitógenos para ayudar a la formación de esferoides, este estudio utilizó un enfoque más fisiológico al tener estos factores de crecimiento por contacto directo con fibroblastos o su secretoma en el fibroblasto CM. Es esencial mencionar que las células LX2 se pueden activar aún más mediante el tratamiento con TGFβ1 o PDGF43. Las células LX2 han sido tratadas con 10 ng/mL TGFβ1 durante 48 h antes de retirar los medios para diferentes entornos experimentales. Las células LX2 se lavaron tres veces con PBS (para excluir cualquier efecto directo de TGFβ1), y luego se agregaron medios frescos durante otras 24 horas antes de recolectar el CM. El CM recogido de LX2 estimulado por TGFβ1 indujo el crecimiento de los esferoides Hep3B a una tasa más alta que el CM del control LX2 (datos no mostrados). Este sistema flexible puede prestarse a cocultivos de diferentes células cancerosas más/menos fibroblastos, así como a líneas derivadas del paciente. También puede ofrecer un ensayo de detección de rendimiento medio para medicamentos que podría adoptarse rápidamente e insertarse en una tubería de descubrimiento de fármacos traslacionales para informar la dosificación de estudios in vivo.
Una limitación del estudio actual es el uso de las líneas celulares inmortalizadas en la formación de esferoides en lugar de células tumorales de CHC recién aisladas y fibroblastos asociados al cáncer. Otra limitación es comparar el crecimiento homotípico del esferoide Hep3B entre CM de LX2 y en medios frescos en lugar de CM de otras líneas celulares no fibroblásticas. Esta última limitación podría abordarse mediante la modificación genética de un gen de interés en los fibroblastos seguido de la aplicación de la CM de tipo salvaje frente a fibroblastos genéticamente modificados a esferoides homotípicos.
Divulgaciones
FO es director y accionista de Fibrofind limited.
Agradecimientos
MYWZ está financiado por el Secretario de Estado de Negocios, Energía y Estrategia Industrial y el Premio Newton 2020 como parte de la Asistencia Oficial para el Desarrollo del Reino Unido "ODA" y el fondo Newton. SS cuenta con el apoyo de la beca Cancer Research UK Advanced Clinician Scientist C53575 / A29959. SS, FO y HR reciben fondos como parte de HUNTER, financiado a través de una asociación entre Cancer Research UK, Fondazione AIRC y la Fundación Científica de la Asociación Española Contra el Cáncer.
Materiales
| Name | Company | Catalog Number | Comments |
| 1x Trypsin | Sigma Aldrich | 59429C | |
| 2 mL tubes | Eppendorf | ||
| Biorender | Biorender.com | Online | |
| Class II laminar flow BioMAT2 hood | Medair Technologies | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Biosera | M-D1107 | |
| Excel sofware | Microsoft office 365 | ||
| Graphpad prism sofware | GraphPad software | ||
| Heat deactivated fetal bovine serum (FBS) | life tech | 105000064 | |
| Image J software | Fiji | ||
| L-glutamine | Sigma Aldrich | G7513-100ml | |
| Penicillin/streptomycin (100 unit/ml penicillin and 100 μg/ml streptomycin) | Sigma Aldrich | P0781-100ml | |
| Petri dish 90 mm, triple vented | Greiner | 633175 | |
| Trypan blue | Sigma Aldrich | T8154 | |
| Virkon™ Broad Spectrum Disinfectant, 5kg Bucket | Rely+On™ | SCI-129999 | |
| Ziess inverted microscope | Ziess |
Referencias
- Ferlay, J., et al. Cancer statistics for the year 2020: an overview. International Journal of Cancer. , (2021).
- Llovet, J. M., et al. Hepatocellular carcinoma. Nature Reviews Disease Primers. 7 (1), 6 (2021).
- Reeves, H. L., Zaki, M. Y., Day, C. P. Hepatocellular carcinoma in obesity, Type 2 diabetes, and NAFLD. Digestive Diseases & Sciences. 61 (5), 1234-1245 (2016).
- Forner, A., Reig, M., Bruix, J. Hepatocellular carcinoma. Lancet. 391 (10127), 1301-1314 (2018).
- Reig, M., et al. Diagnosis and treatment of hepatocellular carcinoma. Update of the consensus document of the AEEH, AEC, SEOM, SERAM, SERVEI, and SETH. Medicina Clinica (Barc). 156 (9), 1-30 (2021).
- Pfister, D., et al. NASH limits anti-tumour surveillance in immunotherapy-treated HCC. Nature. 592 (7854), 450-456 (2021).
- Llovet, J. M., et al. Trial design and endpoints in hepatocellular carcinoma: AASLD consensus conference. Hepatology. 73, 158-191 (2021).
- Llovet, J. M., Hernandez-Gea, V. Hepatocellular carcinoma: reasons for phase III failure and novel perspectives on trial design. Clinical Cancer Research. 20 (8), 2072-2079 (2014).
- Brown, Z. J., Heinrich, B., Greten, T. F. Mouse models of hepatocellular carcinoma: an overview and highlights for immunotherapy research. Nature Reviews Gastroenterology and Hepatology. 15 (9), 536-554 (2018).
- Nikolic, M., Sustersic, T., Filipovic, N. In vitro models and on-chip systems: Biomaterial interaction studies with tissues generated using lung epithelial and liver metabolic cell lines. Frontiers in Bioengineering and Biotechnology. 6, 120 (2018).
- Clark, A. M., Ma, B., Taylor, D. L., Griffith, L., Wells, A. Liver metastases: Microenvironments and ex-vivo models. Experimental Biology and Medicine. 241 (15), 1639-1652 (2016).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Brassard-Jollive, N., Monnot, C., Muller, L., Germain, S. In vitro 3D systems to model tumor angiogenesis and interactions with stromal cells. Frontiers in Cell and Developmental Biology. 8, 594903 (2020).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Kleinman, H. K., Philp, D., Hoffman, M. P. Role of the extracellular matrix in morphogenesis. Current Opinion in Biotechnology. 14 (5), 526-532 (2003).
- Bissell, M. J., Radisky, D. C., Rizki, A., Weaver, V. M., Petersen, O. W. The organizing principle: microenvironmental influences in the normal and malignant breast. Differentiation. 70 (9-10), 537-546 (2002).
- Ronnov-Jessen, L., Petersen, O. W., Koteliansky, V. E., Bissell, M. J. The origin of the myofibroblasts in breast cancer. Recapitulation of tumor environment in culture unravels diversity and implicates converted fibroblasts and recruited smooth muscle cells. Journal of Clinical Investigations. 95 (2), 859-873 (1995).
- Shao, H., et al. A novel stromal fibroblast-modulated 3D tumor spheroid model for studying tumor-stroma interaction and drug discovery. Journal of Visualized Experiments: JoVE. (156), e60660 (2020).
- Song, Y., et al. Activated hepatic stellate cells play pivotal roles in hepatocellular carcinoma cell chemoresistance and migration in multicellular tumor spheroids. Scientific Reports. 6, 36750 (2016).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. International Journal of Molecular Sciences. 20 (7), (2019).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Scientific Reports. 8 (1), 14297 (2018).
- Khawar, I. A., et al. Three dimensional mixed-cell spheroids mimic stroma-mediated chemoresistance and invasive migration in hepatocellular carcinoma. Neoplasia. 20 (8), 800-812 (2018).
- Feaver, R. E., et al. Development of an in vitro human liver system for interrogating non-alcoholic steatohepatitis. Journal of Clinical Investigations Insight. 1 (20), 90954 (2016).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) and reactive oxygen species. Federation of American Societies for Experimental Biology Journal. 17 (3), 503-505 (2003).
- Chen, R., et al. Screening candidate metastasis-associated genes in three-dimensional HCC spheroids with different metastasis potential. International Journal of Clinical Experimental Pathology. 7 (5), 2527-2535 (2014).
- Venkataraman, G., et al. Preferential self-association of basic fibroblast growth factor is stabilized by heparin during receptor dimerization and activation. Proceedings of the National Academy of Sciences of the United States of America. 93 (2), 845-850 (1996).
- Bissell, M. J., et al. Tissue structure, nuclear organization, and gene expression in normal and malignant breast. Cancer Research. 59, 1757-1763 (1999).
- Ghosh, S., et al. Three-dimensional culture of melanoma cells profoundly affects gene expression profile: a high density oligonucleotide array study. Journal of Cellular Physiology. 204 (2), 522-531 (2005).
- Delcommenne, M., Streuli, C. H. Control of integrin expression by extracellular matrix. Journal of Biological Chemistry. 270 (45), 26794-26801 (1995).
- Meshel, A. S., Wei, Q., Adelstein, R. S., Sheetz, M. P. Basic mechanism of three-dimensional collagen fibre transport by fibroblasts. Nature Cell Biology. 7 (2), 157-164 (2005).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8 (3), 241-254 (2005).
- Yu, M., et al. Cancer therapy. Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Weiswald, L. B., et al. Newly characterised ex vivo colospheres as a three-dimensional colon cancer cell model of tumour aggressiveness. British Journal of Cancer. 101 (3), 473-482 (2009).
- Kondo, J., et al. Retaining cell-cell contact enables preparation and culture of spheroids composed of pure primary cancer cells from colorectal cancer. Proceedings of the National Academy of Sciences of the United States of America. 108 (15), 6235-6240 (2011).
- Rajcevic, U., et al. Colorectal cancer derived organotypic spheroids maintain essential tissue characteristics but adapt their metabolism in culture. Proteome Sciences. 12, 39 (2014).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4 (3), 309-324 (2009).
- Friedrich, J., Ebner, R., Kunz-Schughart, L. A. Experimental anti-tumor therapy in 3-D: spheroids--old hat or new challenge. International Journal of Radiation Biology. 83 (11-12), 849-871 (2007).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnology & Bioengineering. 83 (2), 173-180 (2003).
- Esparza-Baquer, A., et al. TREM-2 defends the liver against hepatocellular carcinoma through multifactorial protective mechanisms. Gut. 70 (7), 1345-1361 (2021).
- Dangles-Marie, V., et al. A three-dimensional tumor cell defect in activating autologous CTLs is associated with inefficient antigen presentation correlated with heat shock protein-70 down-regulation. Cancer Research. 63 (13), 3682-3687 (2003).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumour angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Mayer, B., et al. Multicellular gastric cancer spheroids recapitulate growth pattern and differentiation phenotype of human gastric carcinomas. Gastroenterology. 121 (4), 839-852 (2001).
- Xu, L., et al. Human hepatic stellate cell lines, LX-1 and LX-2: new tools for analysis of hepatic fibrosis. Gut. 54 (1), 142-151 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados