Method Article
Optisches Einfangen plasmonischer Nanopartikel für In-situ-oberflächenverstärkte Raman-Spektroskopie-Charakterisierungen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt einen bequemen Ansatz zur Integration von optischem Fang und oberflächenverstärkter Raman-Spektroskopie (SERS), um plasmonische Nanopartikel für die empfindliche molekulare Detektion zu manipulieren. Ohne Aggregationsmittel setzt der Fanglaser plasmonische Nanopartikel zusammen, um die SERS-Signale von Zielanalyten für spektroskopische In-situ-Messungen zu verbessern.
Zusammenfassung
Die oberflächenverstärkte Raman-Spektroskopie (SERS) ermöglicht die ultrasensitive Detektion von Analytmolekülen in verschiedenen Anwendungen aufgrund des verbesserten elektrischen Feldes metallischer Nanostrukturen. Die salzinduzierte Silbernanopartikelaggregation ist die beliebteste Methode zur Erzeugung von SERS-aktiven Substraten; Sie ist jedoch durch schlechte Reproduzierbarkeit, Stabilität und Biokompatibilität eingeschränkt. Das vorliegende Protokoll integriert optische Manipulation und SERS-Erkennung, um eine effiziente Analyseplattform zu entwickeln, um dies zu beheben. Ein 1064 nm Trapping-Laser und ein 532 nm Raman-Sondenlaser werden in einem Mikroskop kombiniert, um Silbernanopartikel zusammenzusetzen, die plasmonische Hotspots für in situ SERS-Messungen in wässrigen Umgebungen erzeugen. Ohne Aggregationsmittel ermöglicht diese dynamische plasmonische Silber-Nanopartikel-Anordnung eine etwa 50-fache Verstärkung des Analytmolekülsignals. Darüber hinaus bietet es eine räumliche und zeitliche Kontrolle, um die SERS-aktive Baugruppe in einer mit einem Analyten beschichteten Silbernanopartikellösung von nur 0,05 nM zu bilden, wodurch die potenzielle Störung für die In-vivo-Analyse minimiert wird. Daher birgt diese optische Trapping-integrierte SERS-Plattform ein großes Potenzial für effiziente, reproduzierbare und stabile molekulare Analysen in Flüssigkeiten, insbesondere in wässrigen physiologischen Umgebungen.
Einleitung
Die oberflächenverstärkte Raman-Spektroskopie (SERS) ist eine empfindliche Analysetechnik zum direkten Nachweis der chemischen Struktur von Zielmolekülen bei extrem niedrigen Konzentrationen oder sogar auf Einzelmolekülebene 1,2,3,4. Die Laserbestrahlung induziert eine lokalisierte Oberflächenplasmonenresonanz in metallischen Nanostrukturen, die als SERS-Substrate verwendet werden, um die Raman-Signale von Zielmolekülen zu verstärken. Salzinduzierte Nanopartikelaggregate sind die weit verbreiteten SERS-Substrate, die spontan eine Brownsche Bewegung in kolloidalen Suspensionsflüssigkeiten 5,6 durchlaufen. Eine weitere Trocknung ermöglicht stabile SERS-Messungen; Es kann jedoch zu Verunreinigungskonzentrationen kommen, die Hintergrundgeräusche verursachen und irreversible Schäden an biologischen Proben verursachen7. Daher ist es wichtig, salzfreie Nanopartikelaggregationen zu entwickeln, ihre Bewegung in Lösung zu kontrollieren und die Biokompatibilität unter Beibehaltung der Messeffizienz zu verbessern.
Optisches Trapping wurde eingesetzt, um verschiedene metallische Substrate zu kontrollieren und SERS-Detektionenzu erleichtern 8,9,10,11,12,13,14. Eine optische Falle wird erzeugt, indem ein Laserstrahl eng fokussiert wird, um ein optisches Kraftfeld zu erzeugen, das kleine Objekte in den Bereich mit der höchsten Intensität um den Fokus15,16 zieht. In jüngster Zeit wurden optische Fallen verwendet, um reproduzierbare und empfindliche plasmonische Sensorplattformen für verschiedene Anwendungen zu entwickeln, die ihre einzigartigen Vorteile bei der Lokalisierung und Kontrolle der Position von SERS-aktiven metallischen Nanostrukturen in Lösungen 17,18,19,20,21,22,23,24 . Das vorliegende Protokoll führt einen Ansatz ein, um optische Pinzette und Raman-Spektromikroskopie zu kombinieren, um Silbernanopartikel (AgNPs) dynamisch zusammenzusetzen und sie gegen Brownsche Bewegung in Lösung für effiziente SERS-Messungen zu stabilisieren. Im AgNP-Assemblierungsbereich kann das Signal des 3,3'-Dithiobis[6-nitrobenzoesäure]-bis(succinimid)-esters (DSNB), Analytmoleküle, die auf der Oberfläche von AgNPs beschichtet sind, um etwa das 50-fache verstärkt werden. Dieser Ansatz eignet sich zur Analyse empfindlicher Biomoleküle, die mit den chemischen Verschließmitteln25,26,27 nicht kompatibel sind. Darüber hinaus bietet es räumliche und zeitliche Steuerung zur Erzeugung der SERS-aktiven AgNP-Assembly. Dies ermöglicht die In-situ-Detektion in wässrigen Umgebungen, was den Einsatz von AgNPs verringern und Störungen für die In-vivo-Analyse minimieren könnte28,29,30. Darüber hinaus ist die optische Traping-induzierte AgNP-Anordnung stabil, reproduzierbar und reversibel31,32. Daher ist es eine vielversprechende Plattform für den Nachweis von Analytmolekülen in Lösungen und unter physiologischen Bedingungen, unter denen die salzinduzierte Aggregation nicht anwendbar ist.
In der vorliegenden Studie sind ein 1064-nm-Fanglaser, ein Kraftdetektionsmodul und eine Hellfeld-Beleuchtungsquelle in das optische Pinzettenmikroskopiesystem zur optischen Manipulation und Visualisierung von Partikeln integriert. Ein 532 nm Raman-Sondenlaser wurde ebenfalls in das Mikroskop integriert und mit dem Fanglaser in der Probenkammer ausgerichtet. Für die spektrale Erfassung wurde rückgestreutes Licht gesammelt und in ein Spektrometer umgeleitet (Abbildung 1).
Protokoll
1. Optischer Aufbau
- Richten Sie einen 532 nm Laserstrahl (Raman-Anregungsquelle) in den Flexport des optischen Pinzettenmikroskops (siehe Materialtabelle).
- Richten Sie den 532-nm-Laserstrahl mit einem dichroitischen 750-nm-Langpassspiegel in die Stereo-Doppelschichtbahnen des optischen Pinzettenmikroskops aus, um ihn mit den ursprünglichen Fanglaserstrahlen zu kombinieren, um auf die Probenkammer zu fokussieren.
- Das rückgestreute Licht aus der Probenkammer wird mit einem dichroitischen 750-nm-Langpassspiegel gesammelt und in ein Spektrometer umgeleitet, das eine CCD-Kamera (Flüssigstickstoff-gekühltes ladungsgekoppeltes Gerät) enthält (siehe Materialtabelle). Platzieren Sie vor der spektralen Erfassung einen 532-nm-Kerbfilter vor dem Eingangsschlitz des Spektrometers.
HINWEIS: Augenschutz muss verwendet werden, wenn der Laser eingeschaltet ist, und der Laserstrahl muss sich in einem sicheren Bereich befinden.
2. Herstellung von AgNPs
- 50 mL 1 mM wässrige Lösung von 1 mM AgNO3 werden während des Kochens in einem Rundkolben erhitzt.
- 1,0 ml 0,1 M Trinatriumcitratlösung werden tropfenweise in die gekochte wässrigeAgNO3-Lösung gegeben.
- Lassen Sie die Mischung 16 min unter ständigem Rühren kochen.
- Kühlen Sie die Mischung auf Raumtemperatur ab. Gelbliche Farbe wird beobachtet.
- Die AgNP-Kolloide bei 2000 × g für 5 min bei Raumtemperatur zentrifugieren und dann den Überstand mit einer Pipette entfernen.
- Resuspendieren Sie die AgNP-Kolloide mit 1 mL entionisiertem Wasser (spezifischer Widerstand von 18,2 MΩ cm).
- Wiederholen Sie die Schritte 2.5 und 2.6 dreimal, um das restliche Reduktionsmittel zu entfernen.
- Charakterisierung der Größenverteilung der AgNPs mittels Rasterelektronenmikroskopie (REM) und dynamischer Lichtstreuung (DLS)33 , um die Gleichmäßigkeit der AgNPs zu bestätigen (Abbildung 2). Die AgNP-Konzentration wurde durch UV-Absorption auf 0,1 nM geschätzt34.
ANMERKUNGEN: Aufgrund der geringen Konzentration kann die AgNP-Stammlösung ohne Clusterbildung für 2-3 Wochen aufrechterhalten werden. Es werden keine Stabilisierungsmittel benötigt. Wenn ein Niederschlag in der AgNP-Stammlösung beobachtet wurde, wurde eine neue AgNP-Lösung nach dem obigen Protokoll hergestellt.
3. Wechselwirkung des DSNB-Analytmoleküls und AgNP
- 200 μL 2 mM DSNB (siehe Materialtabelle) zu 1 mL AgNP-Kolloid geben und bei Raumtemperatur für 3 h inkubieren, um eine Schicht DSNB auf der Oberfläche von AgNP durch Bildung der Ag-S-Bindung zwischen AgNP und DSNB35 zu beschichten. Eine schematische Darstellung dieser Interaktion ist in Abbildung 3 dargestellt.
- Zentrifugieren Sie den AgNP bei 2.000 × g für 5 min bei Raumtemperatur und entfernen Sie den Überstand.
- Resuspendieren Sie das AgNP-DSNB mit 1 mL entionisiertem Wasser.
- Wiederholen Sie die Schritte 3.2 und 3.3 dreimal, um überschüssiges DSNB zu entfernen.
- Zeichnen Sie die UV-sichtbaren Spektren des AgNP-Kolloids und der AgNP-DSNB-Lösung auf.
HINWEIS: Diese Spektren zeigen eine Absorptionsspitzenverschiebung von etwa 420 nm auf 450 nm, was auf die erfolgreiche Beschichtung von DSNB auf der Oberfläche von AgNP hinweist (Abbildung 3).
4. Vorbereitung der Probenkammer und Erzeugung der AgNP-Baugruppe für die SERS-Messung
- Glasobjektträger und Deckglas mit Wasser und Ethanol reinigen.
- Befestigen Sie das Rahmenband (0,25 mm Dicke, siehe Materialtabelle) am Objektträger, um eine Kammer (1,0 cm Länge × 1,0 cm Breite × 0,25 mm Höhe) zu schaffen.
- Einige Tropfen der AgNP-DSNB-Lösung (ca. 25 μL) in den Rahmen geben.
- Legen Sie das Deckglas auf das Rahmenband, und verschließen Sie es (Abbildung 4).
- Geben Sie flüssigen Stickstoff in den Behälter der flüssigstickstoffgekühlten CCD-Kamera, bis die Temperatur -120 °C erreicht.
- Blockieren Sie den Strahlweg der Raman-Sonde mit einem magnetischen Laserschutzschirm (siehe Materialtabelle) und schalten Sie dann den 532-nm-Raman-Anregungsquellenlaser ein.
- Befestigen Sie die Probenkammer mit der AgNP-DSNB-Lösung auf dem Kammerhalter. Fügen Sie Wasser in das in Wasser eingetauchte Objektiv hinzu (60-fache Vergrößerung mit einer numerischen Apertur A von 1,2 von 1,2), wie in Abbildung 1 dargestellt. Platzieren Sie dann den Kammerhalter sofort auf der Mikrobühne über dem Objektiv.
- Tropfen Sie Immersionsöl auf das Deckglas und positionieren Sie den in Öl getauchten Kondensator, um Partikel auf der Mikroskopkamera sichtbar zu machen.
- Stellen Sie die Z-Position des Objektivs ein, indem Sie den Knopf des Mikroskops drehen, bis der 532-nm-Raman-Sondenstrahl auf die untere Glasoberfläche der Kammer fokussiert ist und einen weißen Fleck auf der Mikroskopkamera zeigt (Abbildung 5).
- Passen Sie die X- und Y-Positionen der Mikrostufe an, um die Kammer so zu bewegen, dass der zentrale Bereich der Kammer am weißen Punkt platziert wird. Öffnen Sie die optische Pinzettensteuerungssoftware (siehe Materialtabelle), und verwenden Sie die ausgestattete Joystick-Steuerung, um den 1064-nm-Fanglaser (im optischen Pinzettensystem durch einen roten Kreis gekennzeichnet) so zu bewegen, dass er mit dem weißen Punkt überlappt (Abbildung 5).
- Als nächstes stimmen Sie den Knopf des Mikroskops ab, um die Z-Position des Objektivs nach oben zu bewegen.
HINWEIS: Das Verschwinden des weißen Flecks im Bild der Mikroskopkamera zeigt an, dass der 532 nm Raman-Sondenstrahl innerhalb der Kammer fokussiert ist.
- Schalten Sie den 1064-nm-Fanglaser ein, um AgNPs in der Probenkammer anzuziehen und eine plasmonische AgNP-Baugruppe zu erstellen.
HINWEIS: Die Sammlung von AgNPs führt zu einem dunklen Fleck in der Probenkammer (Abbildung 6B).- Drehen Sie den Fanglaserstrahl herunter, um bei Bedarf eine Überhitzung oder Blasenbildung zu vermeiden.
HINWEIS: Erhöhen Sie die Catching-Laserleistung und die Bestrahlungszeit, wenn keine AgNP-Baugruppe erkennbar ist.
- Drehen Sie den Fanglaserstrahl herunter, um bei Bedarf eine Überhitzung oder Blasenbildung zu vermeiden.
- Passen Sie die Position der Probenmikrostufe an, um den dunklen Fleck der plasmonischen AgNP-Baugruppe für spektroskopische Messungen unter den Fokus des 532-nm-Raman-Sondenstrahls zu stellen.
- Platzieren Sie die Neutraldichtefilter (ND) vor dem 532-nm-Raman-Laserauslass, um die Leistung auf 10 mW einzustellen. Geben Sie die Aufnahmezeit (10 s für die vorliegende Studie, Abbildung 6) in das Einstellungsfenster der Spektrumsoftware ein (siehe Materialtabelle) und klicken Sie auf die Schaltfläche Erfassen, um die spektrale Erfassung zu starten.
HINWEIS: Dies erzeugt das SERS-Spektrum der Analytmoleküle (DSNB im repräsentativen Ergebnis und Abbildung 6).
Ergebnisse
Als Proof of Concept wurde DSNB als Analytmolekül ausgewählt und auf die Oberfläche von AgNPs aufgetragen. Die typischen SERS-Spektren von DSNB, verstärkt durch die plasmonische AgNP-Anordnung und dispergierte AgNP, sind in Abbildung 6 dargestellt. Ohne den Fanglaser erzeugten die dispergierten AgNPs in der Probenkammer bei Anregung durch den Raman-Sondenlaser ein schwarzes Spektrum (Abbildung 6A). Ein schwaches und breites SERS-Signal wurde bei etwa 1380-1450 cm-1 beobachtet, dem charakteristischen Peak von DSNB aus seiner symmetrischen NO2-Ausdehnung, die mit Literaturberichten 35,36 übereinstimmt. Da die dispergierten AgNPs unter Brownscher Bewegung standen, waren die Interpartikelübergänge groß und instabil, wie in Abbildung 6C dargestellt. Daher war die SERS-Signalverstärkung von DSNB für die dispergierten AgNPs gering.
AgNPs werden gesammelt, um eine plasmonische AgNP-Anordnung zu bilden, wenn der Fanglaser eingeschaltet ist. Die Erhöhung der Leistung und die Verlängerung der Bestrahlungszeit des Fanglasers könnte mehr AgNPs anziehen und einen dunklen Fleck erzeugen, wie in Abbildung 6B gezeigt. Hier haben wir eine Catching-Laserleistung von 700 mM und eine Bestrahlungszeit von 20 s angewendet, um eine plasmonische AgNP-Baugruppe in einer 0,05 nM DSNB-beschichteten AgNP-Lösung an einem bestimmten Ort und zu einem bestimmten Zeitpunkt zu erzeugen. Das SERS-Spektrum von DSNB wurde im Bereich der plasmonischen AgNP-Anordnung erhalten (Abbildung 6A, rot). Das starke Raman-Band bei 930 cm-1 wird der Nitro-Scherenschwingung zugeordnet, und die großen Bänder bei 1078 cm-1, 1152 cm-1 und 1191 cm-1 entsprechen wahrscheinlich der Succinimidyl-N-C-O-Dehnung, die sich mit den aromatischen Ringmoden von DSNB 35,37 überlappt. Die Merkmalsbänder bei 1385 cm-1 und 1444 cm-1 entstehen aus der symmetrischen Nitrodehnung von DSNB und sind durch die Reaktion mit der Oberfläche von AgNP35,37 deutlich verstärkt und leicht verschoben. Basierend auf den zuvor berichteten SERS-Fingerabdrücken von DSNB35,36,37 wurde die Bande bei 1579 cm-1 dem aromatischen Ringmodus von DSNB zugeordnet. Die Gesamtintensitäten von DSNB in der plasmonischen AgNP-Anordnung waren höher als die des dispergierten AgNP. Unter Berücksichtigung der Intensität des charakteristischen Peaks bei 1444 cm-1 kann die plasmonische AgNP-Anordnung eine etwa 50-fache Verstärkung des SERS-Signals von DSNB im Vergleich zu dem des dispergierten AgNP liefern. Wie in Abbildung 7 gezeigt, wurden die SERS-Spektren von DSNB wiederholt (20 Mal) für die AgNP-Assemblierung im Experiment aufgezeichnet und zeigten identische Schwingungsmerkmale. Die Intensitäten der charakteristischen Peaks von DSNB bei 1152 cm−1, 1444 cm−1 und 1579 cm−1 über diese 20 SERS-Spektren wurden als Histogramme mit relativen Standardabweichungen (RSD) von 6,88%, 6,59% bzw. 5,48% aufgetragen. Dies bestätigte die Reproduzierbarkeit und Stabilität. Daher ist dieser Ansatz zuverlässig für die Manipulation plasmonischer Nanopartikel und die SERS-Detektion von Analytmolekülen in Lösung.
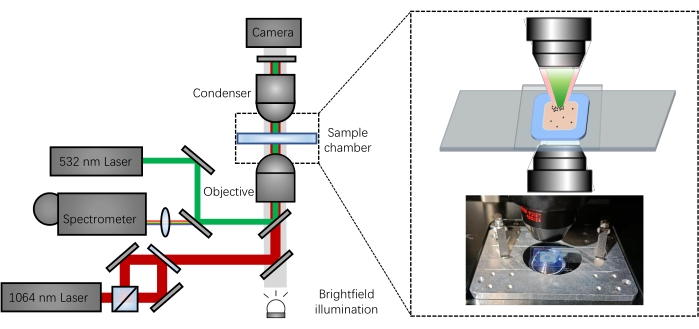
Abbildung 1: Schematische Darstellung der optischen pinzettengekoppelten Raman-spektroskopischen Plattform. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
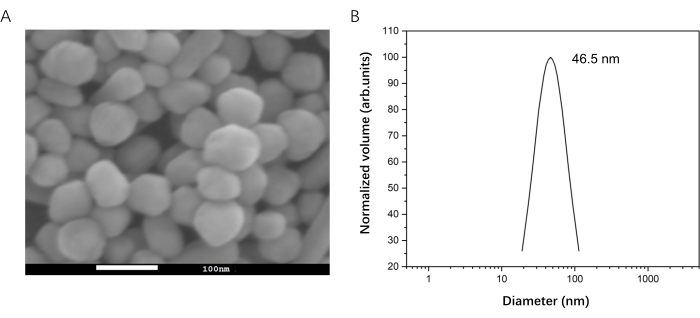
Abbildung 2: Vorbereitung von AgNP für die SERS-Messung. (A) REM-Bild von AgNP. (B) Größenverteilung von AgNP durch DLS. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
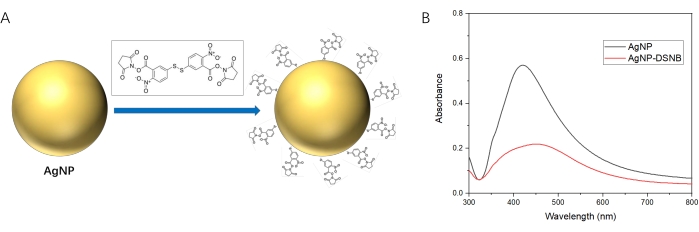
Abbildung 3: Wechselwirkung von AgNP und DSNB. (A) Schematische Darstellung der Beschichtung von DSNB auf der Oberfläche von AgNP. (B) UV-sichtbare Spektren von AgNP und AgNP-DSNB. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
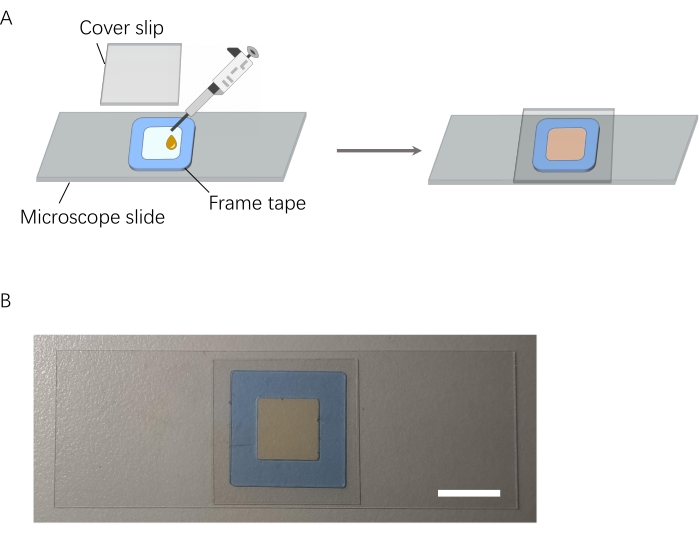
Abbildung 4: Schematische Darstellung der Probenkammervorbereitung. (A) Prozess der Probenkammervorbereitung. (B) Vorbereitete Probenkammer. Maßstabsbalken = 1 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Positionsüberlappung des 532 nm Raman-Lasers und des 1064-nm-Fanglasers. (A) Position des 532-nm-Raman-Lasers durch weißen Fleck angezeigt. (B) Position des 1064-nm-Fanglasers, der durch einen roten Kreis angezeigt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
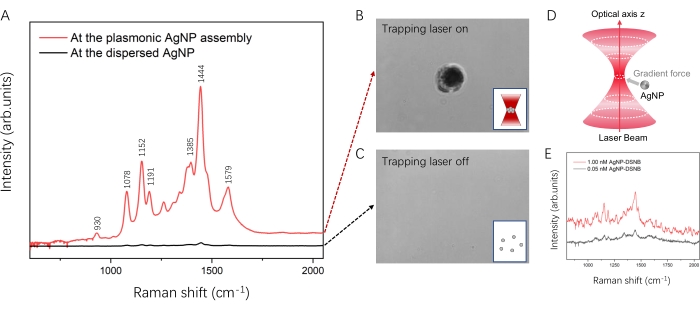
Abbildung 6: Typische SERS-Spektren der Analytmoleküle, verstärkt durch die plasmonische AgNP-Anordnung. (A) SERS-Spektren von DSNB an der plasmonischen AgNP-Anordnung (rot) und dem dispergierten AgNP (schwarz). (B) Die plasmonische AgNP-Anordnung, wenn der Fanglaser eingeschaltet ist, zeigt einen dunklen Fleck unter mikroskopischer Visualisierung. (C) Der dispergierte AgNP, wenn der Fanglaser ausgeschaltet ist. (D) Illustration des Mechanismus der Bildung von AgNP-Anordnungen. (E) Konzentrationsabhängige SERS-Intensität in Abwesenheit des Fanglasers. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
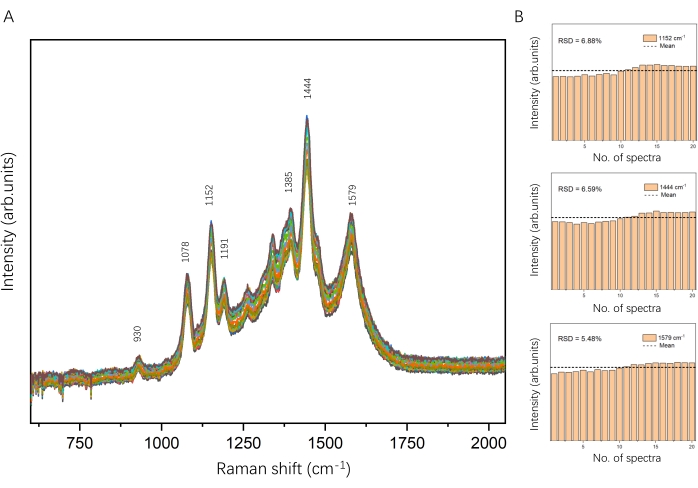
Abbildung 7: Reproduzierbarkeit des SERS-Signals von DSNB. (A) 20 SERS-Spektren von DSNB an der plasmonischen AgNP-Anordnung, die wiederholt im Experiment aufgezeichnet wurden. (B) Histogramme der Intensitäten der charakteristischen DSNB-Spitzenwerte liegen bei 1152 cm-1 (RSD = 6,88%), 1444 cm-1 (RSD = 6,59%) und 1579 cm-1 (RSD = 5,48%). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 8: AgNP-Baugruppe, die unter verschiedenen experimentellen Parametern erzeugt wurde. (A) Unterschiedliche Fanglaserleistung; Bestrahlungszeit 20 s und AgNP-Konzentration 0,05 nM. (B) unterschiedliche Bestrahlungszeit; Fanglaserleistung 700 mW und AgNP-Konzentration 0,05 nM. (C) unterschiedliche AgNP-Konzentration; Bestrahlungszeit 20 s und Einfanglaserleistung 700 mW. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Die Mikroskopkamerabilder der AgNP-Montage in Zeitreihen, wenn der Fanglaser ausgeschaltet wurde. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die vorliegende Studie berichtet über eine analytische Plattform, die optisches Trapping und SERS-Detektion für in situ molekulare Charakterisierungen kombiniert. Ein 532-nm-Raman-Sondenstrahl wurde mit einem 1064-nm-Fanglaserstrahl durch Stereo-Doppelschichtpfade kombiniert, um den Fokus zu kombinieren und für zusätzliche spektroskopische Messungen in Rückstreugeometrie zu sammeln. Der einfangende Laserstrahl setzte AgNPs zu plasmonischen Hotspots zusammen, gefolgt von der Anregung des Raman-Sondenlaserstrahls, um das SERS-Signal der gelösten Analytmoleküle zu erzeugen. Als Proof of Concept wurde der Nachweis von DSNB demonstriert, das auf der Oberfläche von AgNPs beschichtet wurde. In der vom Trapping-Laserstrahl gesteuerten AgNP-Montageregion wurde eine etwa 50-fache Verstärkung des DSNB-Signals im Vergleich zu den umgebenden dispergierten AgNPs erreicht. Eine ähnliche Hochsignalverstärkung von Analytmolekülen in den Lösungsphasen-SERS-Messungen auf der vorgestellten Plattform wurde reproduzierbar erhalten.
Der kritische Schritt, der die SERS-Signalverstärkung beeinflusst, ist die Bildung einer optischen Traping-induzierten AgNP-Assembly. Das SERS-Signal der Analytmoleküle kann durch Feinabstimmung experimenteller Parameter wie der Fanglaserleistung, der Bestrahlungszeit und der AgNP-Konzentration optimiert werden. Wie in Abbildung 8 dargestellt, kann die Verwendung einer höheren Captureing-Laserleistung die Effizienz der AgNP-Baugruppenbildung erhöhen. Reproduzierbare AgNP-Baugruppen wurden erhalten, indem die Leistung des Fanglasers von 450 mW auf 700 mW erhöht wurde. Eine Fanglaserleistung von mehr als 950 mW kann jedoch zu Überhitzung und Blasenbildung führen38. Daher wird eine moderate Fanglaserleistung empfohlen, um eine dynamische AgNP-Baugruppe zu erzeugen. Analog dazu ist eine längere Bestrahlungszeit nützlich, um die Bildung von AgNP-Baugruppen zu fördern. Abbildung 8B zeigt, dass eine klare sphärische AgNP-Anordnung gebildet wurde, wenn sich die Bestrahlungszeit von 5-20 s erhöhte. Die AgNP-Baugruppe war jedoch nach 60 s Bestrahlung verzerrt. Darüber hinaus wurde die Bildung der AgNP-Anordnung bei einer höheren AgNP-Konzentration von 0,01 nM auf 0,05 nM beschleunigt, während sie bei 0,25 nM schnell überhitzt wurde, wie in Abbildung 8C gezeigt. Wenn keine AgNP-Baugruppenbildung erkennbar ist, wird empfohlen, die Fanglaserleistung und die Bestrahlungszeit zu erhöhen. Bei der Erzeugung einer stabilen AgNP-Baugruppe muss der Fanglaser heruntergedreht werden, um mögliche thermische Schäden zu vermeiden.
Die SERS-Aktivität der optischen Traping-induzierten AgNP-Anordnung wurde auf einen Anstieg der lokalen AgNP-Konzentration im Catching-Laser-Bestrahlungsbereich zurückgeführt, der den dunklen Fleck in Abbildung 6B darstellt. In der fluidischen AgNP-Lösung kann die optische Falle kontinuierlich AgNPs anziehen, um sich in einem begrenzten Raum in den interpartikulären Kontakten zu akkumulieren und plasmonische Hotspots zu bilden. Dies führt zu einem verstärkten elektrischen Feld, das den SERS-Effekt verstärkt. Es wurde ferner durch das stärkere SERS-Signal bestätigt, das bei einer höheren AgNP-Konzentration (1,00 nM) im Vergleich zum schwächeren SERS-Signal bei einer niedrigeren AgNP-Konzentration (0,05 nM) ohne den Fanglaser erhalten wurde, wie in Abbildung 6E gezeigt.
Darüber hinaus hat die Positionskontrolle der plasmonischen AgNP-Anordnung in Lösung gegen Brownsche Bewegung durch optisches Trapping die Effizienz und Stabilität von SERS-Messungen signifikant verbessert. Hochdurchsatzmessungen können durchgeführt werden, wenn sie an das mikrofluidische System angeschlossen sind. Im Vergleich zur traditionellen salzinduzierten Aggregation von Nanopartikeln zur Erzeugung von SERS-aktiven Substraten ermöglicht unsere Plattform die dynamische Bildung plasmonischer AgNP-Anordnungen am vorgesehenen Ort und Moment mit hoher Flexibilität26,28. Darüber hinaus arbeitet es effizient bei nanomolaren AgNP-Konzentrationen und ermöglicht die räumlich-zeitliche Manipulation von SERS-aktiven Hotspots für in situ spektroskopische Messungen in Lösungen. Diese dynamische AgNP-Baugruppe zerlegte sich nach und nach in wenigen Minuten, wenn der Trapping-Laser ausgeschaltet wurde. Ohne den Trapping-Laser verschwand die AgNP-Baugruppe fast in 20 min, wie in der ergänzenden Abbildung 1 dargestellt. Dies kann den Einfluss auf das Detektionssystem minimieren und zeigt ein großes Potenzial für verschiedene Bioanwendungen, insbesondere den Nachweis von Biomolekülen (DNA, RNA und Protein) unter physiologischen und in vivo Bedingungen. Diese dynamische AgNP-Anordnung bietet jedoch einen kleineren Verstärkungsfaktor als salzinduzierte AgNP-Aggregate2, so dass weitere Modifikationen und Entwicklungen erforderlich sind.
Zusammenfassend lässt sich sagen, dass die Integration von optischem Trapping und SERS-Detektion eine bequeme Methode zur Kontrolle plasmonischer Nanopartikel bietet und eine reproduzierbare SERS-Signalverstärkung erreicht, um Analytmoleküle in Lösungen mit hoher Effizienz, Stabilität und Biokompatibilität zu detektieren.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir erkennen die finanzielle Unterstützung durch die Kommission für Wissenschaft, Technologie und Innovation der Stadtverwaltung Shenzhen (No. JCYJ20180306174930894), Zhongshan Municipal Bureau of Science and Technology (2020AG003) und Research Grant Council of Hong Kong (Projekt 26303018). Wir danken auch Prof. Chi-Ming Che und seiner finanziellen Unterstützung durch das "Labor für synthetische Chemie und chemische Biologie" im Rahmen des Health@InnoHK-Programms, das von der Innovations- und Technologiekommission der Sonderverwaltungsregion der Regierung von Hongkong der Volksrepublik China ins Leben gerufen wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 1064 nm trapping laser | IPG Photonics, United States | 1064 nm CW Yb fiber laser, 10W | |
| 3,3'-Dithiobis[6-nitrobenzoic acid] bis(succinimide) ester | Biosynth Carbosynth | FD15467 | |
| 532 nm Raman excitation source | CNI, China | MLL-III-532 | |
| Bluelake software | LUMICKS, Netherlands | version 1.6.12 | optical tweezer control software |
| Frame tape | Thermo Fisher Scientific, Inc | AB-0576 | |
| Immersion oil | Cargille Laboratories, Inc | 16482 | |
| Liquid nitrogen-cooled charge-coupled device (CCD) camera | Teledyn Princeton Instrument, United States | 400B eXcelon | |
| Long-pass dichroic mirror | AHF, Germany | F48-801 | |
| Magnetic laser safety screen | ThorLabs | TPSM2 | |
| Optical tweezer microscope | LUMICKS, Netherlands | m-trap | |
| Silver nitrate | Sigma-Aldrich China, Inc. | S8157 | |
| Spectrometer | Teledyn Princeton Instrument, United States | IsoPlane SCT-320 | |
| Trisodium citrate | Sigma-Aldrich China, Inc. | S4641 | |
| WinSpec software | Teledyn Princeton Instrument, United States | version 2.6.24.0 | spectrum software |
Referenzen
- Stiles, P. L., Dieringer, J. A., Shah, N. C., Van Duyne, R. P. Surface-enhanced Raman spectroscopy. Annual Review of Analytical Chemistry. 1 (1), 601-626 (2008).
- Xu, L. J., et al. Label-free detection of native proteins by surface-enhanced Raman spectroscopy using iodide-modified nanoparticles. Analytical Chemistry. 86 (4), 2238-2245 (2014).
- Le Ru, E. C., Etchegoin, P. G. Single-molecule surface-enhanced raman spectroscopy. Annual Review of Physical Chemistry. 63, 65-87 (2012).
- Huang, J. A., et al. SERS discrimination of single DNA bases in single oligonucleotides by electro-plasmonic trapping. Nature Communications. 10 (1), 1-10 (2019).
- Chan, M. Y., Leng, W., Vikesland, P. J. Surface-enhanced Raman spectroscopy characterization of salt-induced aggregation of gold nanoparticles. ChemPhysChem. 19 (1), 24-28 (2018).
- Le Ru, E. C., Meyer, M., Etchegoin, P. G. Proof of single-molecule sensitivity in Surface Enhanced Raman Scattering (SERS) by means of a two-analyte technique. Journal of Physical Chemistry B. 110 (4), 1944-1948 (2006).
- Schultz, Z. Not too hot: the importance of optimizing laser power for surface-enhanced Raman spectroscopy (SERS) measurements. Spectroscopy. 36 (8), 18-20 (2021).
- Svedberg, F., Käll, M. On the importance of optical forces in surface-enhanced Raman scattering (SERS). Faraday Discussions. 132, 35-44 (2006).
- Svedberg, F., Li, Z., Xu, H., Käll, M. Creating hot nanoparticle pairs for surface-enhanced Raman spectroscopy through optical manipulation. Nano Letters. 6 (12), 2639-2641 (2006).
- Liu, Z., Hung, W. H., Aykol, M., Valley, D., Cronin, S. B. Optical manipulation of plasmonic nanoparticles, bubble formation and patterning of SERS aggregates. Nanotechnology. 21 (10), 105304 (2010).
- Spadaro, D., et al. Optical trapping of plasmonic mesocapsules: Enhanced optical forces and SERS. Journal of Physical Chemistry C. 121 (1), 691-700 (2017).
- Ottevaere, H., et al. Optical trapping of particles combined with confocal Raman spectroscopy in an optofluidic chip. Optical Design and Fabrication 2017. , (2017).
- Koya, A. N., et al. Novel plasmonic nanocavities for optical trapping-assisted biosensing applications. Advanced Optical Materials. 8 (7), 1901481 (2020).
- Yuan, Y., et al. Optical trapping-assisted SERS platform for chemical and biosensing applications: Design perspectives. Coordination Chemistry Reviews. 339, 138-152 (2017).
- Ashkin, A., Dziedzic, J. M., Yamane, T. Optical trapping and manipulation of single cells using infrared laser beams. Nature. 330 (6150), 769-771 (1987).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proceedings of the National Academy of Sciences. 94 (10), 4853-4860 (1997).
- Dang, H., et al. Reproducible and sensitive plasmonic sensing platforms based on Au-nanoparticle-internalized nanodimpled substrates. Advanced Functional Materials. 31 (49), 1-10 (2021).
- Lafuente, M., et al. Plasmonic MOF thin films with Raman internal standard for fast and ultrasensitive SERS detection of chemical warfare agents in ambient air. ACS Sensors. 6 (6), 2241-2251 (2021).
- Chen, H., et al. SERS imaging-based aptasensor for ultrasensitive and reproducible detection of influenza virus A. Biosensors and Bioelectronics. 167, 112496 (2020).
- Chen, L., et al. Label-free plasmonic assisted optical trapping of single DNA molecules. Optics Letters. 46 (6), 1482 (2021).
- Farid, S., et al. Rainbows at the end of subwavelength discontinuities: plasmonic light trapping for sensing applications. Advanced Optical Materials. 9 (24), 1-18 (2021).
- Lin, S., et al. Tetragonal superlattice of elongated rhombic dodecahedra for sensitive SERS determination of pesticide residues in fruit. ACS Applied Materials and Interfaces. 12 (50), 56350-56360 (2020).
- Tiwari, S., Khandelwal, U., Sharma, V., Kumar, G. V. P. Single molecule surface enhanced Raman scattering in a single gold nanoparticle-driven thermoplasmonic tweezer. Journal of Physical Chemistry Letters. 12 (49), 11910-11918 (2021).
- Fukushima, T., et al. Visualization of molecular trapping at plasmonic metal nanostructure by surface-enhanced Raman scattering imaging. Journal of Nanophotonics. 14 (2), 1 (2020).
- Yuan, Y., et al. Optical trapping-assisted SERS platform for chemical and biosensing applications: Design perspectives. Coordination Chemistry Reviews. 339, 138-152 (2017).
- Foti, A., et al. Optical aggregation of gold nanoparticles for SERS detection of proteins and toxins in liquid environment: towards ultrasensitive and selective detection. Materials. 11 (3), 440 (2018).
- Dinish, U. S., et al. Single molecule with dual function on nanogold: Biofunctionalized construct for in vivo photoacoustic imaging and SERS biosensing. Advanced Functional Materials. 25 (15), 2316-2325 (2015).
- Tong, L., Righini, M., Gonzalez, M. U., Quidant, R., Käll, M. Optical aggregation of metal nanoparticles in a microfluidic channel for surface-enhanced Raman scattering analysis. Lab on a Chip. 9 (2), 193-195 (2009).
- Messina, E., et al. Plasmon-enhanced optical trapping of gold nanoaggregates with selected optical properties. ACS Nano. 5 (2), 905-913 (2011).
- Hwang, H., et al. In situ dynamic measurements of the enhanced SERS signal using an optoelectrofluidic SERS platform. Lab on a Chip. 11 (15), 2518-2525 (2011).
- Fazio, B., et al. SERS detection of biomolecules at physiological pH via aggregation of gold nanorods mediated by optical forces and plasmonic heating. Scientific Reports. 6 (1), 26952 (2016).
- Schlücker, S. Surface-enhanced raman spectroscopy: Concepts and chemical applications. Angewandte Chemie - International Edition. 53 (19), 4756-4795 (2014).
- Verma, P., Maheshwari, S. K. Preparation of sliver and selenium nanoparticles and its characterization by dynamic light scattering and scanning electron microscopy. Journal of microscopy and ultrastructure. 6 (4), 182-187 (2018).
- Paramelle, D., et al. A rapid method to estimate the concentration of citrate capped silver nanoparticles from UV-visible light spectra. Analyst. 139 (19), 4855-4861 (2014).
- Zhang, Y., et al. Facile SERS-active chip (PS@Ag/SiO2/Ag) for the determination of HCC biomarker. Sensors and Actuators B: Chemical. 272, 34-42 (2018).
- Cheng, M., et al. SERS immunosensor of array units surrounded by particles: A platform for auxiliary diagnosis of hepatocellular carcinoma. Nanomaterials. 10 (10), 1-11 (2020).
- Grubisha, D. S., Lipert, R. J., Park, H. -. Y., Driskell, J., Porter, M. D. Femtomolar detection of prostate-specific antigen: an immunoassay based on surface-enhanced raman scattering and immunogold labels. Analytical Chemistry. 75 (21), 5936-5943 (2003).
- Wang, S., Fu, L., Zhang, Y., Wang, J., Zhang, Z. Quantitative evaluation and optimization of photothermal bubble generation around overheated nanoparticles excited by pulsed lasers. Journal of Physical Chemistry C. 122 (42), 24421-24435 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten