Method Article
Intrappolamento ottico di nanoparticelle plasmoniche per la caratterizzazione della spettroscopia Raman potenziata dalla superficie in situ
In questo articolo
Riepilogo
Il presente protocollo descrive un approccio conveniente per integrare l'intrappolamento ottico e la spettroscopia Raman potenziata dalla superficie (SERS) per manipolare nanoparticelle plasmoniche per il rilevamento molecolare sensibile. Senza agenti aggreganti, il laser trappola assembla nanoparticelle plasmoniche per migliorare i segnali SERS degli analiti target per misurazioni spettroscopiche in situ .
Abstract
La spettroscopia Raman potenziata dalla superficie (SERS) consente il rilevamento ultrasensibile di molecole di analita in varie applicazioni grazie al campo elettrico potenziato delle nanostrutture metalliche. L'aggregazione di nanoparticelle d'argento indotta dal sale è il metodo più popolare per generare substrati attivi SERS; tuttavia, è limitato da scarsa riproducibilità, stabilità e biocompatibilità. Il presente protocollo integra la manipolazione ottica e il rilevamento SERS per sviluppare una piattaforma analitica efficiente per affrontare questo problema. Un laser trappola da 1064 nm e un laser a sonda Raman da 532 nm sono combinati al microscopio per assemblare nanoparticelle d'argento, che generano hotspot plasmonici per misurazioni SERS in situ in ambienti acquosi. Senza agenti aggreganti, questo assemblaggio dinamico di nanoparticelle plasmoniche d'argento consente un miglioramento di circa 50 volte del segnale della molecola dell'analita. Inoltre, fornisce il controllo spaziale e temporale per formare l'assemblaggio attivo SERS in una soluzione di nanoparticelle d'argento rivestita di analita di 0,05 nM, che riduce al minimo la potenziale perturbazione per l'analisi in vivo . Pertanto, questa piattaforma SERS integrata nel trappolaggio ottico ha un grande potenziale per analisi molecolari efficienti, riproducibili e stabili nei liquidi, specialmente in ambienti fisiologici acquosi.
Introduzione
La spettroscopia Raman potenziata dalla superficie (SERS) è una tecnica analitica sensibile per rilevare direttamente la struttura chimica delle molecole bersaglio a concentrazioni ultrabasse o anche a livello di singola molecola 1,2,3,4. L'irradiazione laser induce la risonanza plasmonica superficiale localizzata in nanostrutture metalliche, utilizzate come substrati SERS per amplificare i segnali Raman delle molecole bersaglio. Gli aggregati di nanoparticelle indotti dal sale sono i substrati SERS ampiamente utilizzati, che subiscono spontaneamente il moto browniano nei liquidi di sospensione colloidale 5,6. Un'ulteriore essiccazione consente misurazioni SERS stabili; Tuttavia, può verificarsi una concentrazione di impurità, che introduce rumore di fondo e provoca danni irreversibili ai campioni biologici7. Quindi, è pertinente sviluppare aggregazioni di nanoparticelle prive di sale, controllare il loro movimento in soluzione e migliorare la biocompatibilità mantenendo l'efficienza di misura.
L'intrappolamento ottico è stato adottato per controllare vari substrati metallici e facilitare i rilevamenti SERS 8,9,10,11,12,13,14. Una trappola ottica viene generata focalizzando strettamente un raggio laser per generare un campo di forza ottico, che attira piccoli oggetti nella regione di massima intensità intorno al fuoco15,16. Recentemente, trappole ottiche sono state utilizzate per sviluppare piattaforme di rilevamento plasmonico riproducibili e sensibili per varie applicazioni, mostrando i loro vantaggi unici nella localizzazione e nel controllo della posizione di nanostrutture metalliche attive SERS nelle soluzioni 17,18,19,20,21,22,23,24 . Il presente protocollo introduce un approccio per combinare pinzette ottiche e spettromicroscopia Raman per assemblare dinamicamente nanoparticelle d'argento (AgNP) e stabilizzarle contro il moto browniano in soluzione per misurazioni SERS efficienti. Nella regione di assemblaggio dell'AgNP, il segnale dell'estere bis(succinimide) bis(succinimide) dell'acido 3,3'-ditiobis[6-nitrobenzoico] (DSNB), molecole analite rivestite sulla superficie degli AgNP, può essere potenziato di circa 50 volte. Questo approccio è adatto per analizzare biomolecole sensibili incompatibili con agenti chimici di tappatura25,26,27. Inoltre, fornisce il controllo spaziale e temporale per generare l'assemblaggio AgNP attivo SERS. Ciò consente il rilevamento in situ in ambienti acquosi, che potrebbe ridurre l'uso di AgNP e minimizzare le perturbazioni per l'analisi in vivo 28,29,30. Inoltre, l'assemblaggio AgNP indotto da trappole ottiche è stabile, riproducibile e reversibile31,32. Quindi, è una piattaforma promettente per rilevare molecole di analita in soluzioni e in condizioni fisiologiche in cui l'aggregazione indotta dal sale non è applicabile.
Nel presente studio, un laser di intrappolamento a 1064 nm, un modulo di rilevamento della forza e una sorgente di illuminazione in campo chiaro sono integrati nel sistema di microscopia ottica a pinzetta per la manipolazione ottica e la visualizzazione delle particelle. Un laser a sonda Raman da 532 nm è stato anche incorporato nel microscopio e allineato con il laser di intrappolamento nella camera del campione. Per l'acquisizione spettrale, la luce retrodiffusa è stata raccolta e reindirizzata in uno spettrometro (Figura 1).
Protocollo
1. Configurazione ottica
- Dirigere un raggio laser da 532 nm (sorgente di eccitazione Raman) nella porta flessibile del microscopio ottico a pinzetta (vedi Tabella dei materiali).
- Allineare il raggio laser da 532 nm nei percorsi stereo a doppio strato del microscopio ottico a pinzetta con uno specchio dicroico a passo lungo da 750 nm da combinare con i raggi laser di intrappolamento originali per concentrarsi sulla camera del campione.
- Raccogliere la luce retrodiffusa dalla camera del campione utilizzando uno specchio dicroico a passo lungo 750 nm e reindirizzarla in uno spettrometro contenente una telecamera CCD (Charge-Coupled Device) raffreddata ad azoto liquido (vedere la tabella dei materiali). Posizionare un filtro notch da 532 nm davanti alla fessura di ingresso dello spettrometro prima dell'acquisizione spettrale.
NOTA: la protezione degli occhi deve essere utilizzata quando il laser è acceso e il raggio laser deve essere contenuto all'interno di un'area sicura.
2. Fabbricazione di AgNP
- Riscaldare 50 mL di soluzione acquosa AgNO3 1 mM in un matraccio a fondo tondo durante l'ebollizione.
- Aggiungere 1,0 mL di soluzione di citrato trisodico 0,1 M goccia a goccia nella soluzione acquosa di AgNO3 bollita.
- Mantenere la miscela in ebollizione per 16 minuti mescolando costantemente.
- Raffreddare la miscela a temperatura ambiente. Si osserva il colore giallastro.
- Centrifugare i colloidi AgNP a 2000 × g per 5 minuti a temperatura ambiente, quindi rimuovere il surnatante con una pipetta.
- Risospendere i colloidi AgNP con 1 mL di acqua deionizzata (resistività di 18,2 MΩ cm).
- Ripetere tre volte i passaggi 2,5 e 2,6 per rimuovere l'agente riducente residuo.
- Caratterizzare la distribuzione dimensionale degli AgNP utilizzando la microscopia elettronica a scansione (SEM) e la diffusione dinamica della luce (DLS)33 per confermare l'uniformità degli AgNP (Figura 2). La concentrazione di AgNP è stata stimata in 0,1 nM mediante assorbanza UV34.
NOTE: A causa della bassa concentrazione, la soluzione madre di AgNP può essere mantenuta senza raggruppamento per 2-3 settimane. Non sono necessari agenti stabilizzanti. Se è stato osservato un precipitato nella soluzione madre di AgNP, è stata preparata una nuova soluzione di AgNP seguendo il protocollo di cui sopra.
3. Interazione della molecola dell'analita DSNB e AgNP
- Aggiungere 200 μL di 2 mM DSNB (vedi Tabella dei materiali) a 1 mL di colloide AgNP e incubare a temperatura ambiente per 3 ore per rivestire uno strato di DSNB sulla superficie di AgNP mediante la formazione del legame Ag-S tra AgNP e DSNB35. Una rappresentazione schematica di questa interazione è illustrata nella Figura 3.
- Centrifugare l'AgNP a 2.000 × g per 5 minuti a temperatura ambiente e rimuovere il surnatante.
- Risospendere l'AgNP-DSNB con 1 mL di acqua deionizzata.
- Ripetere tre volte i passaggi 3.2 e 3.3 per rimuovere il DSNB in eccesso.
- Registrare gli spettri UV-visibili del colloide AgNP e della soluzione AgNP-DSNB.
NOTA: Questi spettri mostrano uno spostamento del picco di assorbimento da circa 420 nm a 450 nm, indicando il successo del rivestimento di DSNB sulla superficie di AgNP (Figura 3).
4. Preparazione della camera di campionamento e generazione dell'assemblaggio AgNP per la misura SERS
- Pulire il vetrino e il coprivetrino con acqua ed etanolo.
- Fissare il nastro del telaio (spessore 0,25 mm, vedere Tabella dei materiali) al vetrino per creare una camera (1,0 cm di lunghezza × 1,0 cm di larghezza × 0,25 mm di altezza).
- Aggiungere alcune gocce della soluzione AgNP-DSNB (circa 25 μL) nel telaio.
- Applicare il coprislip sul nastro adesivo del telaio e sigillarlo (Figura 4).
- Aggiungere azoto liquido al contenitore della telecamera CCD raffreddata ad azoto liquido fino a raggiungere la temperatura di -120 °C.
- Bloccare il percorso del fascio della sonda Raman utilizzando uno schermo di sicurezza laser magnetico (vedere la tabella dei materiali), quindi accendere il laser con sorgente di eccitazione Raman a 532 nm.
- Fissare la camera di campionamento con la soluzione AgNP-DSNB sul supporto della camera. Aggiungere acqua all'obiettivo immerso in acqua (ingrandimento 60x con un'apertura numerica A di 1,2) come mostrato nella Figura 1. Quindi posizionare immediatamente il supporto della camera sul microstadio sopra l'obiettivo.
- Far cadere l'olio ad immersione sulla parte superiore del coprivetrino e posizionare il condensatore immerso in olio per visualizzare le particelle sulla fotocamera del microscopio.
- Regolare la posizione Z dell'obiettivo ruotando la manopola del microscopio fino a quando il fascio della sonda Raman a 532 nm non viene focalizzato sulla superficie inferiore del vetro della camera, mostrando una macchia bianca sulla fotocamera del microscopio (Figura 5).
- Regolare le posizioni X e Y del microstadio per spostare la camera per posizionare la regione centrale della camera nel punto bianco. Aprire il software di controllo delle pinzette ottiche (vedere la tabella dei materiali) e utilizzare il comando a joystick dotato per spostare il laser di intrappolamento a 1064 nm (indicato da un cerchio rosso nel sistema di pinzette ottiche) in sovrapposizione con il punto bianco (Figura 5).
- Quindi, sintonizzare la manopola del microscopio per spostare la posizione Z dell'obiettivo verso l'alto.
NOTA: La scomparsa della macchia bianca nell'immagine della fotocamera del microscopio indica che il fascio della sonda Raman a 532 nm è focalizzato all'interno della camera.
- Accendere il laser di trappola a 1064 nm per attirare AgNP nella camera del campione e creare un assemblaggio AgNP plasmonico.
NOTA: La raccolta di AgNP provoca una macchia scura nella camera campione (Figura 6B).- Abbassare il raggio laser di intrappolamento per evitare il surriscaldamento o la formazione di bolle quando necessario.
NOTA: Aumentare la potenza del laser di cattura e il tempo di irradiazione se non vi è alcuna formazione apparente del gruppo AgNP.
- Abbassare il raggio laser di intrappolamento per evitare il surriscaldamento o la formazione di bolle quando necessario.
- Regolare la posizione del microstadio del campione per posizionare la macchia scura del gruppo plasmonico AgNP sotto il fuoco del fascio della sonda Raman a 532 nm per misure spettroscopiche.
- Posizionare i filtri a densità neutra (ND) davanti all'uscita laser Raman da 532 nm per regolare la potenza a 10 mW. Inserire il tempo di acquisizione (10 s per il presente studio, Figura 6) nel pannello di impostazione del software dello spettro (vedere Tabella dei materiali) e fare clic sul pulsante Acquisisci per avviare l'acquisizione spettrale.
NOTA: Questo genera lo spettro SERS delle molecole dell'analita (DSNB nel risultato rappresentativo e nella Figura 6).
Risultati
Come prova di concetto, DSNB è stato scelto come molecola dell'analita e rivestito sulla superficie degli AgNP. Gli spettri tipici di DSNB potenziati dall'assemblaggio plasmonico AgNP e dall'AgNP disperso sono mostrati nella Figura 6. Senza il laser trapping, gli AgNP dispersi nella camera del campione hanno generato uno spettro nero (Figura 6A) dopo l'eccitazione da parte del laser sonda Raman. Un segnale SERS debole e ampio è stato osservato a circa 1380-1450 cm-1, il picco caratteristico del DSNB dal suo tratto simmetrico NO2, che è coerente con i rapporti di letteratura35,36. Poiché gli AgNP dispersi erano sotto moto browniano, le giunzioni interparticellari erano grandi e instabili, come illustrato nella Figura 6C. Pertanto, l'amplificazione del segnale SERS di DSNB era bassa per gli AgNP dispersi.
Gli AgNP vengono raccolti per formare un assemblaggio plasmonico AgNP quando il laser di cattura è acceso. Aumentando la potenza e prolungando il tempo di irradiazione del laser di cattura potrebbe attirare più AgNP e generare una macchia scura, come mostrato nella Figura 6B. Qui, abbiamo applicato una potenza laser di intrappolamento di 700 mM e un tempo di irradiazione di 20 s per creare un assemblaggio plasmonico AgNP in una soluzione AgNP rivestita DSNB da 0,05 nM in un luogo e in un momento designati. Lo spettro SERS di DSNB è stato ottenuto nella regione dell'assemblaggio plasmonico AgNP (Figura 6A, rosso). La forte banda Raman a 930 cm-1 è assegnata alla vibrazione nitro scissoring, e le grandi bande a 1078 cm-1, 1152 cm-1 e 1191 cm-1 corrispondono probabilmente al tratto succinimidyl N-C-O sovrapposto ai modi dell'anello aromatico di DSNB 35,37. Le bande caratteristiche a 1385 cm-1 e 1444 cm-1 derivano dal tratto nitro simmetrico di DSNB e sono significativamente migliorate e leggermente spostate a causa della reazione con la superficie di AgNP35,37. Sulla base delle impronte digitali SERS precedentemente riportate di DSNB35,36,37, la banda a 1579 cm-1 è stata assegnata alla modalità dell'anello aromatico di DSNB. Le intensità complessive di DSNB nell'assemblaggio plasmonico di AgNP erano superiori a quelle dell'AgNP disperso. Considerando l'intensità del picco caratteristico a 1444 cm-1, l'assemblaggio plasmonico AgNP può fornire un miglioramento di circa 50 volte del segnale SERS di DSNB rispetto a quello dell'AgNP disperso. Come mostrato in Figura 7, gli spettri SERS di DSNB sono stati registrati ripetutamente (20 volte) per l'assemblaggio AgNP nell'esperimento, dimostrando caratteristiche vibrazionali identiche. Le intensità dei picchi caratteristici del DSNB a 1152 cm−1, 1444 cm−1 e 1579 cm−1 in questi 20 spettri SERS sono state tracciate come istogrammi con deviazioni standard relative (RSD) rispettivamente del 6,88%, 6,59% e 5,48%. Ciò ha ulteriormente verificato la riproducibilità e la stabilità. Pertanto, questo approccio è affidabile per la manipolazione di nanoparticelle plasmoniche e il rilevamento SERS di molecole di analita in soluzione.
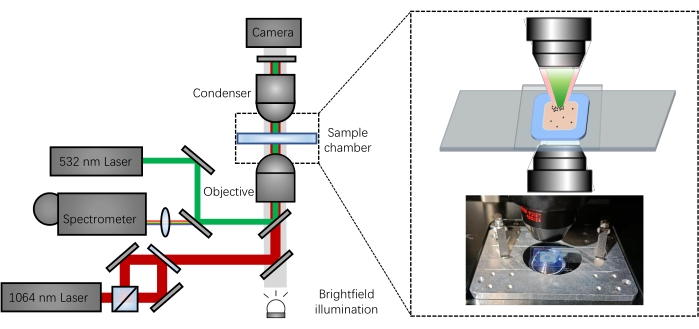
Figura 1: Rappresentazione schematica della piattaforma spettroscopica Raman accoppiata a pinzette ottiche. Fare clic qui per visualizzare una versione ingrandita di questa figura.
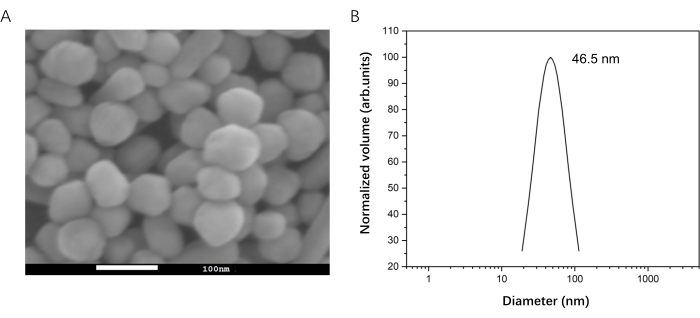
Figura 2: Preparazione di AgNP per la misura SERS. (A) Immagine SEM di AgNP. (B) Distribuzione dimensionale di AgNP mediante DLS. Fare clic qui per visualizzare una versione ingrandita di questa figura.
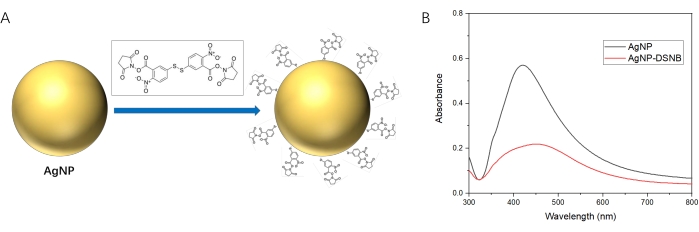
Figura 3: Interazione tra AgNP e DSNB. (A) Schema del rivestimento di DSNB sulla superficie di AgNP. (B) Spettri UV-visibili di AgNP e AgNP-DSNB. Fare clic qui per visualizzare una versione ingrandita di questa figura.
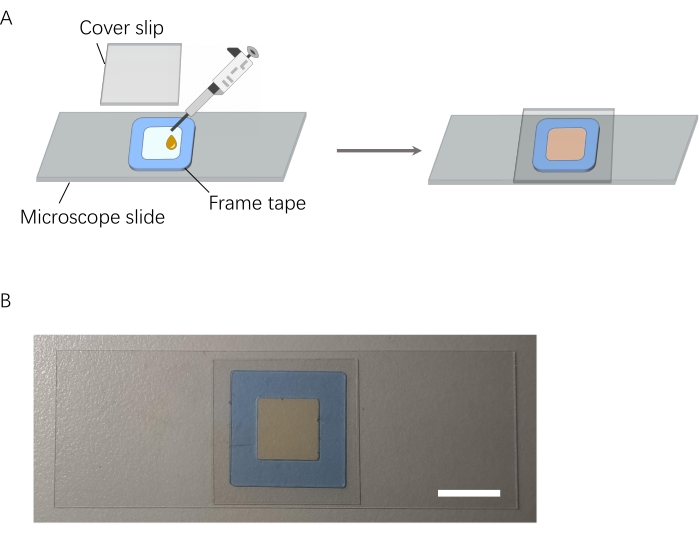
Figura 4: Schema della preparazione della camera di campionamento. (A) Processo di preparazione della camera di campionamento. (B) Camera di campionamento preparata. Barra della scala = 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Sovrapposizione di posizione del laser Raman a 532 nm e del laser trapping a 1064 nm. (A) Posizione del laser Raman a 532 nm indicata da una macchia bianca. (B) Posizione del laser di cattura a 1064 nm indicata da un cerchio rosso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
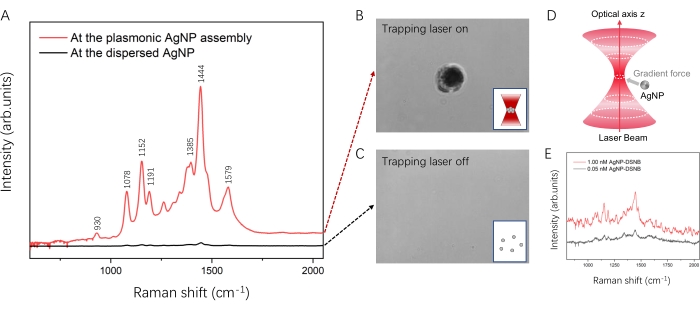
Figura 6: Spettri SERS tipici delle molecole analite potenziate dall'assemblaggio plasmonico AgNP. (A) Spettri SERS di DSNB all'assemblaggio plasmonico AgNP (rosso) e all'AgNP disperso (nero). (B) L'assemblaggio plasmonico AgNP quando il laser di cattura è acceso mostra una macchia scura sotto visualizzazione microscopica. (C) L'AgNP disperso quando il laser di cattura è spento. (D) Illustrazione del meccanismo di formazione dell'assemblaggio AgNP. (E) Intensità SERS dipendente dalla concentrazione in assenza del laser di cattura. Fare clic qui per visualizzare una versione ingrandita di questa figura.
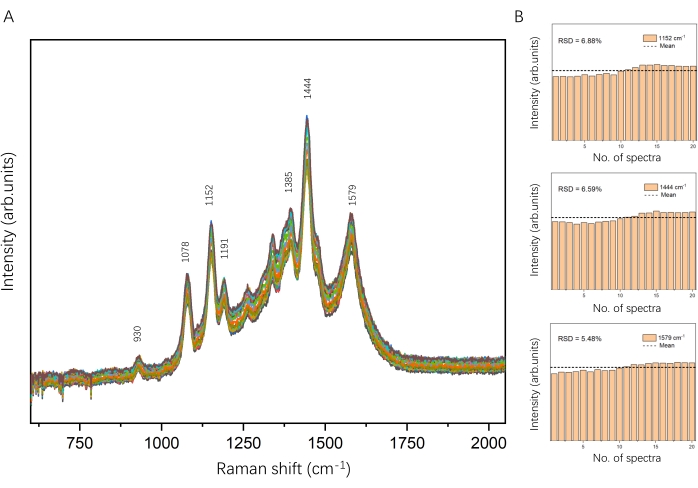
Figura 7: Riproducibilità del segnale SERS di DSNB. (A) 20 spettri SERS di DSNB all'assemblaggio plasmonico AgNP registrati ripetutamente nell'esperimento. (B) Istogrammi delle intensità dei picchi caratteristici DSNB a 1152 cm-1 (RSD = 6,88%), 1444 cm-1 (RSD = 6,59%) e 1579 cm-1 (RSD = 5,48%). Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 8: Assemblaggio AgNP generato secondo diversi parametri sperimentali. (A) Diversa potenza del laser di trappola; tempo di irradiazione 20 s e concentrazione di AgNP 0,05 nM. b) tempo di irradiazione diverso; potenza laser di cattura 700 mW e concentrazione AgNP 0,05 nM. (C) diversa concentrazione di AgNP; tempo di irradiazione 20 s e potenza laser di cattura 700 mW. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Le immagini della telecamera al microscopio dell'assemblaggio di AgNP in serie temporali quando il laser di trappola è stato spento. Clicca qui per scaricare questo file.
Discussione
Il presente studio riporta una piattaforma analitica che combina l'intrappolamento ottico e il rilevamento SERS per caratterizzazioni molecolari in situ . Un fascio di sonda Raman da 532 nm è stato combinato con un raggio laser di intrappolamento a 1064 nm attraverso percorsi stereo a doppio strato per combinare la messa a fuoco e la raccolta per ulteriori misurazioni spettroscopiche nella geometria di retrodiffusione. Il raggio laser di intrappolamento ha assemblato AgNP per formare punti caldi plasmonici, seguito dall'eccitazione del raggio laser della sonda Raman per generare il segnale SERS delle molecole analite in soluzione. Come prova di concetto, è stata dimostrata la rilevazione di DSNB, che è stata rivestita sulla superficie degli AgNP. Nella regione di assemblaggio AgNP controllata dal raggio laser di trappola, è stato ottenuto un miglioramento di circa 50 volte nel segnale di DSNB rispetto agli AgNP dispersi circostanti. Una simile amplificazione ad alto segnale delle molecole di analita nelle misure SERS in fase di soluzione sulla piattaforma presentata è stata ottenuta in modo riproducibile.
Il passaggio critico che interessa l'amplificazione del segnale SERS è la formazione di un assemblaggio AgNP indotto da trappole ottiche. Il segnale SERS delle molecole dell'analita può essere ottimizzato regolando parametri sperimentali come la potenza del laser di trappolaggio, il tempo di irradiazione e la concentrazione di AgNP. Come mostrato nella Figura 8, l'utilizzo di una maggiore potenza laser di intrappolamento può aumentare l'efficienza della formazione dell'assemblaggio AgNP. I gruppi AgNP riproducibili sono stati ottenuti aumentando la potenza del laser di trappola da 450 mW a 700 mW. Tuttavia, una potenza laser di intrappolamento superiore a 950 mW può indurre surriscaldamento e generazione di bolle38. Pertanto, si consiglia una potenza laser di detrazione moderata per creare un assieme AgNP dinamico. Analogamente, un tempo di irradiazione più lungo è utile per promuovere la formazione di gruppi AgNP. La figura 8B mostra che un gruppo AgNP sferico chiaro si è formato quando il tempo di irradiazione è aumentato da 5 a 20 s. Tuttavia, l'assemblaggio AgNP è stato distorto dopo 60 s di irradiazione. Inoltre, la formazione dell'assemblaggio AgNP è stata accelerata a una concentrazione AgNP più elevata, da 0,01 nM a 0,05 nM, mentre è stata rapidamente surriscaldata a 0,25 nM, come mostrato nella Figura 8C. Se non vi è alcuna formazione apparente di assemblaggio AgNP, si raccomanda di aumentare la potenza del laser di intrappolamento e il tempo di irradiazione. Dopo la generazione di un assemblaggio AgNP stabile, il laser di intrappolamento deve essere abbassato per evitare potenziali danni termici.
L'attività SERS dell'assemblaggio AgNP indotto da trappole ottiche è stata attribuita ad un aumento della concentrazione locale di AgNP nella regione di irradiazione laser di trappolaggio, che è la macchia scura nella Figura 6B. Nella soluzione fluidica di AgNP, la trappola ottica può attrarre continuamente AgNP per accumulare e formare hotspot plasmonici in uno spazio ristretto nelle giunzioni interparticellari. Ciò produce un campo elettrico potenziato che migliora l'effetto SERS. È stato ulteriormente verificato dal segnale SERS più forte ottenuto a una concentrazione di AgNP più elevata (1,00 nM) rispetto al segnale SERS più debole acquisito a una concentrazione AgNP inferiore (0,05 nM) senza il laser di trapping, come mostrato nella Figura 6E.
Inoltre, il controllo della posizione dell'assemblaggio plasmonico AgNP in soluzione, contro il moto browniano, mediante intrappolamento ottico ha migliorato significativamente l'efficienza e la stabilità delle misure SERS. Il rilevamento ad alta produttività può essere condotto quando è collegato al sistema microfluidico. Rispetto alla tradizionale aggregazione indotta dal sale di nanoparticelle per generare substrati attivi SERS, la nostra piattaforma consente la formazione dinamica di assemblaggi plasmonici AgNP, nel luogo e nel momento progettati, con elevata flessibilità26,28. Inoltre, funziona in modo efficiente a concentrazioni di AgNP nanomolari e consente la manipolazione spazio-temporale di hotspot attivi SERS per misure spettroscopiche in situ in soluzioni. Questo assemblaggio dinamico AgNP si è gradualmente smontato in pochi minuti quando il laser di trappola è stato spento. Senza il laser di trappola, l'assemblaggio AgNP è quasi scomparso in 20 minuti, come mostrato nella figura supplementare 1. Ciò può ridurre al minimo l'influenza sul sistema di rilevamento e presenta un grande potenziale per varie bio-applicazioni, in particolare la rilevazione di biomolecole (DNA, RNA e proteine) in condizioni fisiologiche e in vivo. Tuttavia, questo assemblaggio dinamico di AgNP fornisce un fattore di miglioramento minorerispetto agli aggregati AgNP 2 indotti dal sale e, quindi, sono necessarie ulteriori modifiche e sviluppi.
In conclusione, l'integrazione dell'intrappolamento ottico e del rilevamento SERS fornisce un metodo conveniente per controllare le nanoparticelle plasmoniche e ottenere un miglioramento del segnale SERS riproducibile per rilevare le molecole dell'analita in soluzioni ad alta efficienza, stabilità e biocompatibilità.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Riconosciamo il sostegno finanziario della Commissione per la scienza, la tecnologia e l'innovazione del comune di Shenzhen (No. JCYJ20180306174930894), Zhongshan Municipal Bureau of Science and Technology (2020AG003) e Research Grant Council of Hong Kong (Project 26303018). Riconosciamo anche il Prof. Chi-Ming Che e il suo sostegno finanziario dal "Laboratorio di Chimica Sintetica e Biologia Chimica" nell'ambito del Programma Health@InnoHK lanciato dalla Commissione per l'Innovazione e la Tecnologia, la Regione Amministrativa Speciale del Governo di Hong Kong della Repubblica Popolare Cinese.
Materiali
| Name | Company | Catalog Number | Comments |
| 1064 nm trapping laser | IPG Photonics, United States | 1064 nm CW Yb fiber laser, 10W | |
| 3,3'-Dithiobis[6-nitrobenzoic acid] bis(succinimide) ester | Biosynth Carbosynth | FD15467 | |
| 532 nm Raman excitation source | CNI, China | MLL-III-532 | |
| Bluelake software | LUMICKS, Netherlands | version 1.6.12 | optical tweezer control software |
| Frame tape | Thermo Fisher Scientific, Inc | AB-0576 | |
| Immersion oil | Cargille Laboratories, Inc | 16482 | |
| Liquid nitrogen-cooled charge-coupled device (CCD) camera | Teledyn Princeton Instrument, United States | 400B eXcelon | |
| Long-pass dichroic mirror | AHF, Germany | F48-801 | |
| Magnetic laser safety screen | ThorLabs | TPSM2 | |
| Optical tweezer microscope | LUMICKS, Netherlands | m-trap | |
| Silver nitrate | Sigma-Aldrich China, Inc. | S8157 | |
| Spectrometer | Teledyn Princeton Instrument, United States | IsoPlane SCT-320 | |
| Trisodium citrate | Sigma-Aldrich China, Inc. | S4641 | |
| WinSpec software | Teledyn Princeton Instrument, United States | version 2.6.24.0 | spectrum software |
Riferimenti
- Stiles, P. L., Dieringer, J. A., Shah, N. C., Van Duyne, R. P. Surface-enhanced Raman spectroscopy. Annual Review of Analytical Chemistry. 1 (1), 601-626 (2008).
- Xu, L. J., et al. Label-free detection of native proteins by surface-enhanced Raman spectroscopy using iodide-modified nanoparticles. Analytical Chemistry. 86 (4), 2238-2245 (2014).
- Le Ru, E. C., Etchegoin, P. G. Single-molecule surface-enhanced raman spectroscopy. Annual Review of Physical Chemistry. 63, 65-87 (2012).
- Huang, J. A., et al. SERS discrimination of single DNA bases in single oligonucleotides by electro-plasmonic trapping. Nature Communications. 10 (1), 1-10 (2019).
- Chan, M. Y., Leng, W., Vikesland, P. J. Surface-enhanced Raman spectroscopy characterization of salt-induced aggregation of gold nanoparticles. ChemPhysChem. 19 (1), 24-28 (2018).
- Le Ru, E. C., Meyer, M., Etchegoin, P. G. Proof of single-molecule sensitivity in Surface Enhanced Raman Scattering (SERS) by means of a two-analyte technique. Journal of Physical Chemistry B. 110 (4), 1944-1948 (2006).
- Schultz, Z. Not too hot: the importance of optimizing laser power for surface-enhanced Raman spectroscopy (SERS) measurements. Spectroscopy. 36 (8), 18-20 (2021).
- Svedberg, F., Käll, M. On the importance of optical forces in surface-enhanced Raman scattering (SERS). Faraday Discussions. 132, 35-44 (2006).
- Svedberg, F., Li, Z., Xu, H., Käll, M. Creating hot nanoparticle pairs for surface-enhanced Raman spectroscopy through optical manipulation. Nano Letters. 6 (12), 2639-2641 (2006).
- Liu, Z., Hung, W. H., Aykol, M., Valley, D., Cronin, S. B. Optical manipulation of plasmonic nanoparticles, bubble formation and patterning of SERS aggregates. Nanotechnology. 21 (10), 105304 (2010).
- Spadaro, D., et al. Optical trapping of plasmonic mesocapsules: Enhanced optical forces and SERS. Journal of Physical Chemistry C. 121 (1), 691-700 (2017).
- Ottevaere, H., et al. Optical trapping of particles combined with confocal Raman spectroscopy in an optofluidic chip. Optical Design and Fabrication 2017. , (2017).
- Koya, A. N., et al. Novel plasmonic nanocavities for optical trapping-assisted biosensing applications. Advanced Optical Materials. 8 (7), 1901481 (2020).
- Yuan, Y., et al. Optical trapping-assisted SERS platform for chemical and biosensing applications: Design perspectives. Coordination Chemistry Reviews. 339, 138-152 (2017).
- Ashkin, A., Dziedzic, J. M., Yamane, T. Optical trapping and manipulation of single cells using infrared laser beams. Nature. 330 (6150), 769-771 (1987).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proceedings of the National Academy of Sciences. 94 (10), 4853-4860 (1997).
- Dang, H., et al. Reproducible and sensitive plasmonic sensing platforms based on Au-nanoparticle-internalized nanodimpled substrates. Advanced Functional Materials. 31 (49), 1-10 (2021).
- Lafuente, M., et al. Plasmonic MOF thin films with Raman internal standard for fast and ultrasensitive SERS detection of chemical warfare agents in ambient air. ACS Sensors. 6 (6), 2241-2251 (2021).
- Chen, H., et al. SERS imaging-based aptasensor for ultrasensitive and reproducible detection of influenza virus A. Biosensors and Bioelectronics. 167, 112496 (2020).
- Chen, L., et al. Label-free plasmonic assisted optical trapping of single DNA molecules. Optics Letters. 46 (6), 1482 (2021).
- Farid, S., et al. Rainbows at the end of subwavelength discontinuities: plasmonic light trapping for sensing applications. Advanced Optical Materials. 9 (24), 1-18 (2021).
- Lin, S., et al. Tetragonal superlattice of elongated rhombic dodecahedra for sensitive SERS determination of pesticide residues in fruit. ACS Applied Materials and Interfaces. 12 (50), 56350-56360 (2020).
- Tiwari, S., Khandelwal, U., Sharma, V., Kumar, G. V. P. Single molecule surface enhanced Raman scattering in a single gold nanoparticle-driven thermoplasmonic tweezer. Journal of Physical Chemistry Letters. 12 (49), 11910-11918 (2021).
- Fukushima, T., et al. Visualization of molecular trapping at plasmonic metal nanostructure by surface-enhanced Raman scattering imaging. Journal of Nanophotonics. 14 (2), 1 (2020).
- Yuan, Y., et al. Optical trapping-assisted SERS platform for chemical and biosensing applications: Design perspectives. Coordination Chemistry Reviews. 339, 138-152 (2017).
- Foti, A., et al. Optical aggregation of gold nanoparticles for SERS detection of proteins and toxins in liquid environment: towards ultrasensitive and selective detection. Materials. 11 (3), 440 (2018).
- Dinish, U. S., et al. Single molecule with dual function on nanogold: Biofunctionalized construct for in vivo photoacoustic imaging and SERS biosensing. Advanced Functional Materials. 25 (15), 2316-2325 (2015).
- Tong, L., Righini, M., Gonzalez, M. U., Quidant, R., Käll, M. Optical aggregation of metal nanoparticles in a microfluidic channel for surface-enhanced Raman scattering analysis. Lab on a Chip. 9 (2), 193-195 (2009).
- Messina, E., et al. Plasmon-enhanced optical trapping of gold nanoaggregates with selected optical properties. ACS Nano. 5 (2), 905-913 (2011).
- Hwang, H., et al. In situ dynamic measurements of the enhanced SERS signal using an optoelectrofluidic SERS platform. Lab on a Chip. 11 (15), 2518-2525 (2011).
- Fazio, B., et al. SERS detection of biomolecules at physiological pH via aggregation of gold nanorods mediated by optical forces and plasmonic heating. Scientific Reports. 6 (1), 26952 (2016).
- Schlücker, S. Surface-enhanced raman spectroscopy: Concepts and chemical applications. Angewandte Chemie - International Edition. 53 (19), 4756-4795 (2014).
- Verma, P., Maheshwari, S. K. Preparation of sliver and selenium nanoparticles and its characterization by dynamic light scattering and scanning electron microscopy. Journal of microscopy and ultrastructure. 6 (4), 182-187 (2018).
- Paramelle, D., et al. A rapid method to estimate the concentration of citrate capped silver nanoparticles from UV-visible light spectra. Analyst. 139 (19), 4855-4861 (2014).
- Zhang, Y., et al. Facile SERS-active chip (PS@Ag/SiO2/Ag) for the determination of HCC biomarker. Sensors and Actuators B: Chemical. 272, 34-42 (2018).
- Cheng, M., et al. SERS immunosensor of array units surrounded by particles: A platform for auxiliary diagnosis of hepatocellular carcinoma. Nanomaterials. 10 (10), 1-11 (2020).
- Grubisha, D. S., Lipert, R. J., Park, H. -. Y., Driskell, J., Porter, M. D. Femtomolar detection of prostate-specific antigen: an immunoassay based on surface-enhanced raman scattering and immunogold labels. Analytical Chemistry. 75 (21), 5936-5943 (2003).
- Wang, S., Fu, L., Zhang, Y., Wang, J., Zhang, Z. Quantitative evaluation and optimization of photothermal bubble generation around overheated nanoparticles excited by pulsed lasers. Journal of Physical Chemistry C. 122 (42), 24421-24435 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon