Method Article
Mikrofluidische Synthese von Mikrogelbausteinen für mikroporös geglühte Partikelgerüste
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Reihe von Methoden zur Synthese der Mikrogelbausteine für mikroporös geglühte Partikelgerüste, die für eine Vielzahl von Anwendungen der regenerativen Medizin verwendet werden können.
Zusammenfassung
Die MAP-Gerüstplattform (Microporous Annealed Particle Scared) ist eine Unterklasse von granularen Hydrogelen. Es besteht aus einer injizierbaren Aufschlämmung von Mikrogelen, die nach einem sekundärlichtbasierten chemischen Vernetzungsschritt (d. H. Glühen) ein strukturstabiles Gerüst mit Porosität im Zellmaßstab in situ bilden können. MAP-Gerüst hat sich in einer Vielzahl von Anwendungen der regenerativen Medizin bewährt, einschließlich dermaler Wundheilung, Stimmlippenvergrößerung und Stammzellabgabe. Dieser Artikel beschreibt die Methoden zur Synthese und Charakterisierung von Polyethylenglykol (PEG)-Mikrogelen als Bausteine zur Bildung eines MAP-Gerüsts. Diese Methoden umfassen die Synthese eines kundenspezifischen Glühmakromers (MethMAL), die Bestimmung der Mikrogelvorläufergelationskinetik, die Herstellung mikrofluidischer Bauelemente, die mikrofluidische Erzeugung von Mikrogelen, die Mikrogelreinigung und die grundlegende Charakterisierung von Gerüsten, einschließlich Mikrogeldimensionierung und Gerüstglühen. Insbesondere können die hierin beschriebenen mikrofluidischen Hochdurchsatzmethoden große Mengen an Mikrogelen herstellen, die zur Erzeugung von MAP-Gerüsten für jede gewünschte Anwendung, insbesondere im Bereich der regenerativen Medizin, verwendet werden können.
Einleitung
Die MAP-Gerüstplattform ist ein injizierbares Biomaterial, das vollständig aus Hydrogel-Mikropartikeln (Mikrogelen) besteht, die Mikroporosität im Zellmaßstab liefern, wenn sie miteinander vernetzt sind, was eine abbauunabhängige Zellmigration und Massengewebeintegration ermöglicht1. Aufgrund ihrer Fähigkeit, sich schnell in das Wirtsgewebe zu integrieren, und ihrer inhärent geringen Immunogenität hat die MAP-Gerüstplattform ihre präklinische Anwendbarkeit für eine Vielzahl von Therapien der regenerativen Medizin gezeigt 2,3,4,5,6,7,8,9,10, einschließlich der Beschleunigung der dermalen Wundheilung 1,3 ,11, Revaskularisierung der Hirnschlaghöhle7, Abgabe mesenchymaler Stammzellen2 und Bereitstellung von Gewebefüllstoffen zur Behandlung von glottischer Insuffizienz6. Es wurde auch gezeigt, dass MAP durch die Rekrutierung von M2-Makrophagen entzündungshemmende Wirkungen auf das Wirtsgewebe vermittelt 3 und sogar so eingestellt werden kann, dass es eine Th2-Immunantwort "Gewebereparatur" fördert8. Diese günstigen Eigenschaften der MAP-Gerüstplattform ermöglichen es, sie auf ein breites Spektrum klinischer Anwendungen auszuweiten.
Bisher veröffentlichte Methoden zur Erzeugung von Mikrogelen für die MAP-Gerüstbildung umfassen die strömungsfokussierende Tröpfchenmikrofluidik 1,4,7,9, Elektrospritzen 5,12 und Überkopfspinnen mit Batchemulsion 6,10. Die tropfenmikrofluidische Methode kann Partikel mit hoher Monodispersität erzeugen, verwendet jedoch sehr langsame Flussraten, die geringe Partikelausbeuten (μL / h) erzeugen. Alternativ können die Elektrospritz- und Batch-Emulsionsverfahren ein hohes Partikelvolumen mit hoher Partikelpolydispersität erzeugen. Dieses Protokoll verwendet eine mikrofluidische Hochdurchsatzmethode zur Herstellung von Mikrogelen mit einer monodispersen Population, basierend auf Arbeiten von de Rutte et al13. Diese Methode verwendet weiche Lithographietechniken, um aus einer Fotomaske ein mikrofluidisches Gerät für Polydimethylsiloxan (PDMS) herzustellen, das dann mit einem Objektträger verbunden wird. Das Gerätedesign beruht auf einer Schrittemulgierung, um ein hohes Volumen an Mikrogelpartikeln (ml/h) zu erzeugen. Die Monodispersität, die mit dieser Methode erreicht werden kann, bietet eine bessere Kontrolle der Porosität im Vergleich zu anderen Techniken, da monodisperse Mikrogele Gerüste mit gleichmäßigeren Porengrößen bilden können2.
Die Methoden zur Synthese und Charakterisierung der einzelnen Mikrogele, die als Bausteine für MAP-Gerüste dienen können, werden in diesem Manuskript beschrieben, insbesondere im Hinblick auf die Herstellung von Mikrogelen, die aus einem PEG-Rückgrat mit einer Maleimidgruppe (MAL) bestehen, die leicht an einer effizienten Michael-Typ-Addition mit thiolfunktionalisierten Vernetzern für die Mikrogelgelierung beteiligt ist. Um die Mikrogelgelierung vom MAP-Gerüstglühen zu entkoppeln, beschreibt dieses Manuskript auch, wie ein veröffentlichtes14 kundenspezifisches Glühmakromer, MethMAL, synthetisiert wird, bei dem es sich um ein heterofunktionelles Methacrylamid / Maleimid-4-armiges PEG-Makromer handelt. Die funktionellen Methacrylamidgruppen nehmen leicht an der radikalischen Photopolymerisation (für das Mikrogelglühen) teil, bleiben aber relativ inert gegenüber den Bedingungen, die die Michael-Typ-Addition für die funktionellen MAL-Gruppen fördern.
Darüber hinaus beschreibt dieses Manuskript die Protokolle zur Herstellung mikrofluidischer PDMS-Geräte, zur Bestimmung der Mikrogel-Gelierungskinetik und zur Charakterisierung der Mikrogelgröße. Der letzte Teil des Manuskripts beschreibt das MAP-Gerüstglühen, bei dem die Mikrogele in situ durch einen sekundären, photoinitiierten Vernetzungsschritt, der die Oberflächen der Mikrogele kovalent miteinander verbindet, in ein Massengerüst überführt werden. Es ist wichtig zu beachten, dass es andere Glühmethoden gibt, die in MAP-Gerüstsystemen implementiert werden können, die nicht auf lichtbasierte Chemikalien angewiesen sind, wie z. B. enzymvermitteltes Glühen, wie zuvor beschrieben1. Insgesamt können diese Methoden direkt oder mit verschiedenen Hydrogel-Formulierungschemikalien (z. B. Hyaluronsäure-basiert) verwendet werden, um MAP-Gerüste für jede Anwendung zu erzeugen.
Protokoll
1. MethMAL-Makromersynthese
HINWEIS: Dieses Protokoll ist speziell für die Modifizierung von 1 g PEG-Maleimid, kann aber skaliert werden, um größere Chargen herzustellen.
- 1 g 4-armiges 20 kDa PEG-Maleimid zu 10 mL 1x phosphatgepufferter Kochsalzlösung (PBS, pH 7,4) in ein kleines Glasbecherglas mit Rührstab geben. Rühren Sie die Lösung bei 300 U/min, bis sich das PEG vollständig aufgelöst hat (~30 min).
- 14,65 mg 2-Aminoethanthiol (0,67:1 Thiol [SH] zu Maleimid [MAL] Molverhältnis) unter Rühren bei 300 U/min in die Reaktion geben.
HINWEIS: Die Thiolgruppen auf 2-Aminoethanthiol werden über Michael-Typ-Addition zu etwa drei Armen des PEG-MAL hinzugefügt, wobei Aminendgruppen übrig bleiben.- Beachten Sie die folgende Beispielrechnung für die Menge an 2-Aminoethanthiol, die hinzugefügt werden soll:
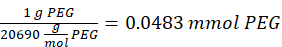
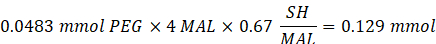
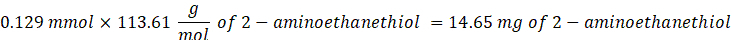
HINWEIS: Um zu vermeiden, dass eine sehr kleine Menge gemessen wird, lösen Sie 100 mg 2-Aminoethanthiol in 1 ml 1x PBS (pH 7,4) und fügen Sie 146,5 μL dieser Lösung zur Reaktion hinzu.
- Beachten Sie die folgende Beispielrechnung für die Menge an 2-Aminoethanthiol, die hinzugefügt werden soll:
- Nach Schritt 1.2 1 h und 10 min abwarten, dann 160,1 mg 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholiniumchlorid (DMTMM, 12:1 molares Verhältnis zu PEG) und 32,77 μL Methacrylsäure (8:1 molares Verhältnis zu PEG) in 5 mL 1x PBS (pH 7,4) in einem neuen Glasbecherglas mischen und 50 min unter Rühren bei 300 U/min reagieren.
HINWEIS: In diesem Schritt reagiert die Methacrylsäure mit DMTMM zu einem hochreaktiven Ester, der dann an die verfügbaren Amingruppen auf dem PEG gekoppelt werden kann.- Beachten Sie die folgende Beispielberechnung zur Berechnung der hinzuzufügenden DMTMM-Menge:
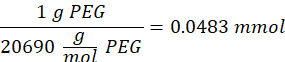
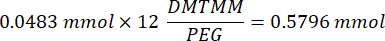
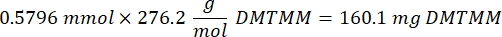
- Beachten Sie die folgende Beispielrechnung zur Berechnung der hinzuzufügenden Methacrylsäuremenge:
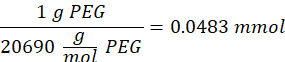
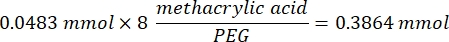
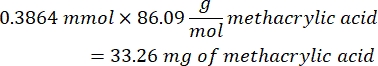
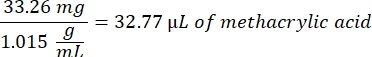
- Beachten Sie die folgende Beispielberechnung zur Berechnung der hinzuzufügenden DMTMM-Menge:
- Die Methacrylsäure/DMTMM-Lösung mit der 20 kDa PEG-MAL/2-Aminoethanthiollösung in das Becherglas geben.
- 53,56 μL Triethylamin (1:1 Molverhältnis zu Methacrylsäure) in das Becherglas geben und über Nacht unter Rühren bei 300 U/min reagieren lassen. Decken Sie das Becherglas mit Folie ab, um zu verhindern, dass Staub und andere Verunreinigungen in das Becherglas gelangen.
- Beachten Sie die folgende Beispielberechnung für die hinzuzufügende Triethylaminmenge:
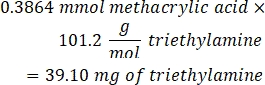
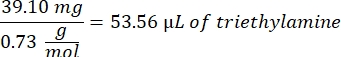
- Beachten Sie die folgende Beispielberechnung für die hinzuzufügende Triethylaminmenge:
- Übertragen Sie die Reaktion auf Schlangenhaut-Dialyseschläuche (Molekulargewichtsgrenze: 3.500 Da).
- Legen Sie den Dialyseschlauch 3 Tage lang unter Rühren bei 300 U/min in ein großes Becherglas mit 1 M NaCl in entionisiertem (DI) Wasser (Volumen sollte den Schlauch vollständig bedecken). Wechseln Sie die 1 M NaCl-Lösung 2x täglich für insgesamt sechs Wäschen.
- Dialysieren Sie für 6 h in DI-Wasser. Wechseln Sie das DI-Wasser stündlich für insgesamt sechs Wäschen.
- Die Reaktion wird in ein 50-ml-konisches Röhrchen übertragen und bei −80 °C eingefroren.
- Lyophilisieren Sie das Rohr für mindestens 72 h bei einer Starttemperatur von −70 °C und einer Temperaturrampe von 0,01 °C/min bis 0 °C.
- Die Probe wird für 1H-NMR vorbereitet, indem 25 mg MethMAL in 700 μl Chloroform-d gelöst und in ein NMR-Röhrchen überführt werden.
- Erfassen Sie die 1H-NMR-Spektren.
HINWEIS: Die Spektren in diesem Protokoll wurden mit einem 500-MHz-Spektrometer mit den folgenden Parametern erfasst: Sweep-Breite = 6.467,3 Hz, Zeitverzögerung = 13,1 s, Erfassungszeit = 5,1 s, Pulszeit = 5,1 μs und Anzahl der Scans = 8. - Für die Analyse integrieren Sie den Maleimid-Peak als Referenz (~6,76 ppm) und dann die beiden Methacrylamid-Peaks (~5,35 ppm und 5,6 ppm). Teilen Sie das Verhältnis der Methacrylamid-Peakflächen durch die Gesamtfläche aller drei Peaks, um den Prozentsatz der mit Methacrylamid modifizierten Arme zu erhalten.
HINWEIS: Eine akzeptable Modifikation ist die Substitution von 67% -75% funktioneller Methacrylamidgruppe. Ein Beispiel für das H-NMR-Spektrum 1 fürMethMAL ist in Abbildung 1 dargestellt.- Verwenden Sie Gleichung (1) als Grad der Substitutionsgleichung:
 (1)
(1)
- Verwenden Sie Gleichung (1) als Grad der Substitutionsgleichung:
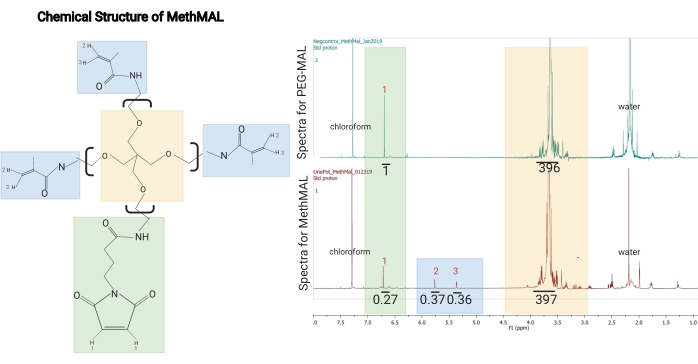
Abbildung 1: Chemische Struktur und 1H-NMR-Spektrum von MethMAL. (A) Chemische Struktur: Das MethMAL-Glühmakromer besteht aus 20 kDa 4-armigem Polyethylenglykol, das mit drei Methacrylamidarmen modifiziert ist. (B) Diese Struktur erzeugt Peaks bei 5,36 ppm (3) und 5,76 ppm (2), die in PEG-MAL-Spektren nicht vorhanden sind, und einen Maleimidarm, der einen Peak bei 6,71 ppm erzeugt (1). Das Lösungsmittel Chloroform erzeugte einen Peak bei 7,26 ppm, und Restwasser in dieser Probe erzeugte einen Peak bei 2,2 ppm (markiert auf Spektren). In den MethMAL-Spektren hatte der Maleimid-Peak eine integrierte Fläche von 0,27 und die Summe der Methacrylamid-Peakflächen betrug 0,73 (0,37 + 0,36). Die prozentuale Modifikation von Methacrylamid betrug 73% (0,73/(0,27 + 0,73)). Diese Zahl stammt von Pfaff et al.14. Copyright (2021) American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Mikrogel-Vorläufer-Gelierungskinetik
HINWEIS: Die Gelierungszeit kann durch Einstellen des pH-Wertes des Puffers geändert werden, der zum Auflösen der Gelvorläuferkomponenten verwendet wird. Bei PEG-Maleimid-Hydrogelen entspricht ein saurerer pH-Wert typischerweise einer langsameren Gelierzeit, da die Thiolatkonzentration bei niedrigerempH-Wert 15 erniedrigt ist.
- Bestimmen Sie die gewünschten Konzentrationen von Polymer-, Vernetzer- und anderen Gelvorläuferkomponenten (d. H. Peptide, Glykosaminoglykane). PEG-MAL, RGD und MethMAL (PEG-Backbone) werden in 10x PBS (pH 1,5) und der MMP-2-Vernetzer in 1x PBS (pH 7,4) gelöst.
HINWEIS: In diesem Protokoll ist die Gelvorläuferlösung eine veröffentlichte Formulierung3, die aus 45,88 mg/ml 4-armigem PEG-MAL (10 kDa), 0,82 mg/ml RGD, 8,06 mg/ml MethMAL und 4,62 mg/ml MMP-2-Vernetzer (enzymatisch abbaubarer Vernetzer) besteht. - Bereiten Sie ein Viskosimeter oder ein gleichwertiges Gerät zur Überwachung von Speicher- und Verlustmodulen mit einer Spaltgröße von 0,4 mm, einer Schubdehnung von 1,0, einer Frequenz von 1,0 Hz und einer Dauer von 10.800 s vor.
- Befestigen Sie eine 35-mm-Plattenrotorgeometrie (P35/Ti). Verwenden Sie eine befeuchtete Kammer oder einen feuchten Schwamm um die Geometrie, um eine befeuchtete Umgebung zu erhalten.
- Mischen Sie den PEG-Backbone und den MMP-Vernetzer im Volumenverhältnis 1:1.
- 400 μL der Gelvorläuferlösung werden auf die Mitte des Viskosimetertisches pipettiert.
- Senken Sie die Geometrie langsam auf den Tisch, bis sie die vorgegebene Spaltgröße von 0,4 mm erreicht hat, und beginnen Sie sofort mit der Überwachung der Speicher- (G') und Verlustmodule (G'') für bis zu 6 h bei Raumtemperatur.
HINWEIS: Es wird davon ausgegangen, dass die Gelierung beginnt, wenn der Speichermodul größer als der Verlustmodul wird, und die Gelierung gilt als abgeschlossen, wenn der Speichermodul ein Plateau erreicht. Eine repräsentative Gelierungskinetikkurve ist in Abbildung 2 dargestellt.
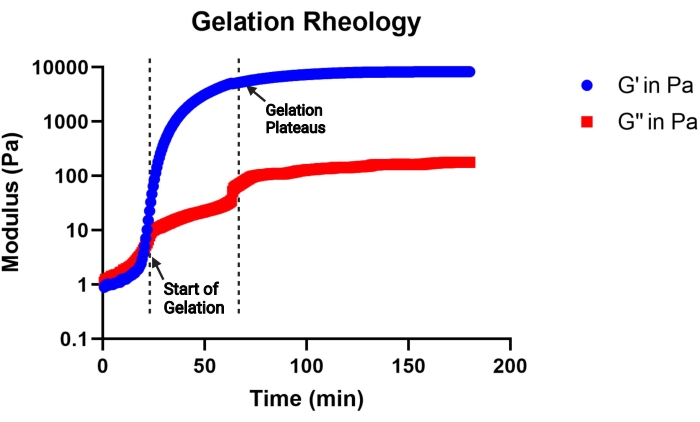
Abbildung 2: Repräsentative Kurve der Gelierungskinetik einer MAP-Gelvorläuferlösung (pH 4,5), bestimmt mit einem Viskosimeter. Die Gelierung beginnt mit dem schnellen Anstieg des Speichermoduls (G'), und die Gelierung ist abgeschlossen, wenn die G'-Kurve Plateaus erreicht. G'' gibt den Verlustmodul an. Diese Zahl stammt von Pruett et al.3. Copyright (2021) Wiley-VCH GmBH. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Herstellung mikrofluidischer Bauelemente
ANMERKUNG: Dieses Protokoll beschreibt die Herstellung eines mikrofluidischen Stufenemulgierungsgerätedesigns nach de Rutte et al.13, das in Abbildung 3A zu sehen ist. Dieses Protokoll kann jedoch mit jedem Gerätedesign verwendet werden, das in einen SU-8-Wafer geätzt ist. Es wird empfohlen, die SU-8-Siliziumwafer-Masterfertigung auszulagern, es sei denn, die entsprechenden Reinraumeinrichtungen stehen für die Fertigung zur Verfügung.
- Erstellen Sie das erste mikrofluidische Gerät für Polydimethylsiloxan (PDMS) aus einer SU-8-Wafer-Fotomaske.
- Bereiten Sie ~200 g PDMS vor, indem Sie Base und Härter im Verhältnis 10:1 w/w mischen (siehe Materialtabelle).
- Platzieren Sie den SU-8-Wafer in einer Kulturschale (Klebeband der Ränder des Wafers an der Schale), wobei das mikrofluidische Design nach oben zeigt.
- Gießen Sie PDMS in die Schale, um eine 1-1,5 cm dicke Schicht über dem Wafer zu erzeugen. Stellen Sie die Schale unter Vakuum, um Blasen zu entfernen.
- Lassen Sie das PDMS aushärten, bis es erstarrt ist (24 h bei Raumtemperatur oder ~2 h bei 60 °C).
- Sobald das PDMS ausgehärtet ist, schneiden Sie vorsichtig mit einer Rasierklinge oder einem Skalpell ein Rechteck durch das PDMS, so dass ein Rand von 0,5-1 cm um das Design auf dem Wafer liegt.
HINWEIS: Verwenden Sie nicht zu viel Druck und seien Sie sehr vorsichtig, um eine Beschädigung (z. B. Risse, Kratzer) des Wafers zu vermeiden. - Verkeilen Sie einen Spatel in einen der Schnitte und schieben Sie ihn entlang der Schnitte, um das PDMS vom Wafer zu trennen.
HINWEIS: Wenn sich das PDMS vom Wafer trennt, beginnt sich unter dem PDMS eine Luftblase zu bilden (siehe Abbildung 3B). - Verwenden Sie den Spatel, um das Rechteck des PDMS vorsichtig aus der Schale zu heben.
HINWEIS: Die resultierende Lücke im PDMS über dem Wafer ist die Form für die mikrofluidischen Geräte.
- Erstellen Sie nachfolgende PDMS-Mikrofluidik-Geräte aus der SU-8 Wafer-Fotomaske.
- Bereiten Sie ~ 15-20 g PDMS pro Form vor, indem Sie die Basis und den Härter im Verhältnis 10: 1 mischen.
- Gießen Sie PDMS in den rechteckigen Spalt in der Form, um eine 5 mm dicke PDMS-Schicht über dem Wafer zu erzeugen. Stellen Sie die Form unter Vakuum, um Blasen zu entfernen.
- Das PDMS aushärten lassen, bis es vollständig erstarrt ist (24 h bei Raumtemperatur oder 2 h bei 60 °C).
- Sobald das PDMS ausgehärtet ist, schneiden Sie das PDMS mit einer Rasierklinge oder einem Skalpell um die Kanten des Rechtecks.
HINWEIS: Verwenden Sie nicht zu viel Druck und seien Sie sehr vorsichtig, um eine Beschädigung (d. H. Rissbildung) des Wafers zu vermeiden. - Verkeilen Sie einen Spatel in einen der Schnitte und schieben Sie ihn entlang der Schnitte, um das PDMS vom Wafer zu trennen.
HINWEIS: Wenn sich das PDMS vom Wafer trennt, beginnt sich unter dem PDMS eine Luftblase zu bilden. - Verwenden Sie einen 1,5-mm-Biopsiestempel, um Löcher durch das PDMS-Rechteck an den beiden Einlässen und am Auslass zu erzeugen (siehe Abbildung 3B).
- Wenn sich mehrere Geräte auf einem einzelnen Wafer befinden, verwenden Sie einen Spatel oder eine Rasierklinge, um das PDMS leicht zwischen den einzelnen Geräten zu ritzen, und falten Sie dann das PDMS vorsichtig entlang der geritzten Linien, so dass sich das PDMS von selbst sehr sauber trennt.
- Lagern Sie die PDMS-Geräte in einem staubfreien Behälter.
- Verkleben Sie die PDMS-Mikrofluidikgeräte auf Glasobjektträgern.
- Bereiten Sie einen Objektträger pro mikrofluidischem PDMS-Gerät vor. Verwenden Sie Klebeband, gefilterte Luft oder Isopropylalkohol (IPA)-Waschungen, um Staub vom Objektträger zu entfernen. Stellen Sie sicher, dass die Objektträger vollständig trocken sind, bevor Sie mit dem nächsten Schritt fortfahren.
- Legen Sie einen Objektträger und ein PDMS-Gerät mit der Designseite nach oben nebeneinander auf eine kleine Kunststoffschale (ein 96-Well-Plattendeckel eignet sich gut dafür) und legen Sie sie in einen Plasmareiniger. Schließen Sie die Tür und das Luftstromventil und schalten Sie die Vakuumpumpe ein. Lassen Sie es mindestens 30 s laufen und schalten Sie es dann aus.
- Verbinden Sie den Sauerstofftankgasschlauch mit dem Luftstromventil. Lassen Sie die Plasmakammer 30 s lang mit Sauerstoff füllen, schalten Sie dann den Sauerstoff aus und schließen Sie das Luftstromventil.
- Schalten Sie die Vakuumpumpe ein und stellen Sie den Hochfrequenzpegel (RF) auf Hoch ein. Warten Sie, bis die Kammer violett-rosa färbt (siehe Abbildung 3B). Lassen Sie 30 s verstreichen.
- Wenn der Timer ausgeht, schalten Sie das Plasma aus und saugen Sie. Öffnen Sie dann langsam das Luftstromventil, um das Vakuum freizugeben. Nehmen Sie das Fach aus dem Plasmareiniger.
- Drehen Sie das PDMS-Gerät vorsichtig auf den Glasobjektträger, um sie zu verkleben. Beachten Sie während der Verklebung den leichten Unterschied in der Transparenz des PDMS.
HINWEIS: Um optimale Ergebnisse zu erzielen, lagern Sie die geklebten Geräte bis unmittelbar vor Gebrauch bei 60 °C.
- Oberflächenbehandlung der PDMS-Mikrofluidik-Geräte
- Bereiten Sie die Oberflächenbehandlung vor, indem Sie PFOCTS (Trichlor(1H,1H,2H,2H-perfluoroctyl)silan) in Novec-Öl (1:50) verdünnen. Verwenden Sie 1 ml für 3-4 Geräte. Übertragen Sie das Volumen in eine 1-ml-Spritze und befestigen Sie eine 25-G-Nadel.
HINWEIS: Die in diesem Protokoll verwendeten Nadeln sind abgeschrägt, also seien Sie vorsichtig beim Umgang mit scharfen und spitzen Punkten. Auf Wunsch können auch stumpfe Nadeln verwendet werden. - Schneiden Sie ein 10-12 cm großes Stück Tygon-Schläuch pro zu behandelndem Gerät ab.
- Schneiden Sie ein Stück PEEK-Schlauch, ~7 cm lang. Führen Sie einige Millimeter des PEEK-Schlauchs in das Ende des Tygon-Schlauchs ein, wie in Abbildung 4A dargestellt, um zu verhindern, dass die Nadel die Tygon-Schlaucheinlässe durchsticht.
- Nehmen Sie das/die Gerät(e) aus der beheizten Kammer und führen Sie das Nicht-PEEK-Ende des Tygon-Schlauchs in das wässrige Einlassloch ein.
- Führen Sie die Nadel der Oberflächenbehandlungsspritze in den PEEK-Schlauch ein und decken Sie die Ölkammerauslassöffnung ab (siehe Abbildung 3B).
- Injizieren Sie die Behandlung langsam in das Gerät und stellen Sie sicher, dass es das Gerät ohne Blasen füllt. Warten Sie, bis sich zuerst die wässrigen Kammern gefüllt haben, gefolgt von den kleineren Kanälen und dann der Ölkammer. Entfernen Sie den Tygon-Schlauch vom Gerät. Sobald das Gerät gefüllt ist, lassen Sie es 10 min bei Raumtemperatur ruhen.
- Füllen Sie eine 5-ml-Spritze nur mit Öl (kein Silan) und befestigen Sie eine 25-G-Nadel.
- Saugen Sie die Oberflächenbehandlung durch die Ein- und Auslässe aus dem Gerät ab. Führen Sie den Tygon-Schlauch in den wässrigen Einlass ein, führen Sie die Spritze mit Öl in den PEEK-Schlauch ein und spülen Sie jedes Gerät mit Öl. Saugen Sie das Öl aus dem Gerät ab.
- Wiederholen Sie die Ölspülung noch 2x. Entfernen Sie den Tygon-Schlauch.
HINWEIS: Das Gerät ist einsatzbereit.
- Bereiten Sie die Oberflächenbehandlung vor, indem Sie PFOCTS (Trichlor(1H,1H,2H,2H-perfluoroctyl)silan) in Novec-Öl (1:50) verdünnen. Verwenden Sie 1 ml für 3-4 Geräte. Übertragen Sie das Volumen in eine 1-ml-Spritze und befestigen Sie eine 25-G-Nadel.
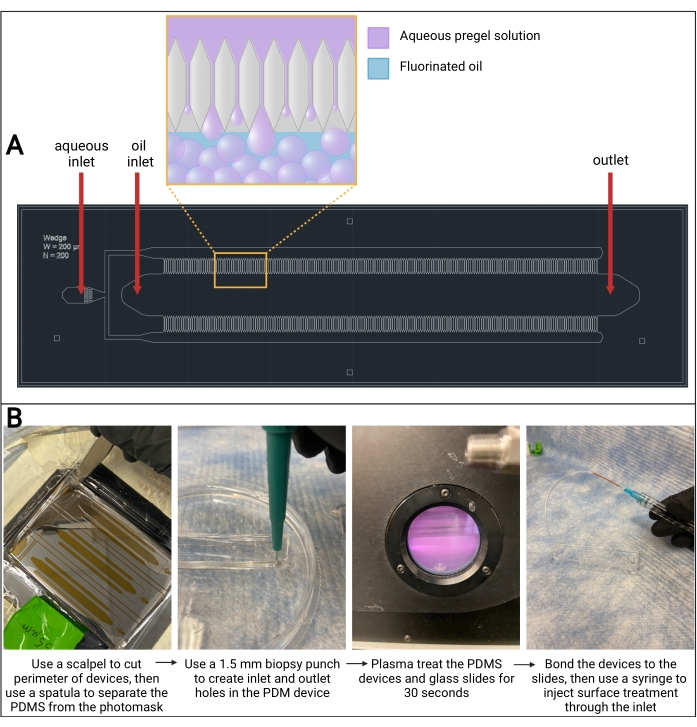
Abbildung 3: Mikrofluidisches PDMS-Gerät . (A) AutoCAD-Zeichnung (Computergestütztes Design) des mikrofluidischen Gerätedesigns. Die Bildung von Mikrogeltröpfchen tritt in den Kanälen auf beiden Seiten des Ölkanals auf, wie im vergrößerten Aufschluss zu sehen ist. (B) Überblick über die Herstellung von PDMS-Geräten. Abkürzung: PDMS = Polydimethylsiloxan. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Mikrofluidische Erzeugung von Mikrogelen
- Bestimmen Sie die gewünschten Konzentrationen von Polymer-, Vernetzer- und anderen Gelvorläuferkomponenten (d. H. Peptide, Glykosaminoglykane). Lösen Sie PEG-MAL, RGD und MethMAL (PEG-Backbone) in 10x PBS (pH 1,5) und den MMP-2-Vernetzer zusammen mit 5 μM Biotin-Maleimid in 1x PBS (pH 7,4).
HINWEIS: In diesem Protokoll ist die Gelvorläuferlösung eine veröffentlichte Formulierung3 , bestehend aus 45,88 mg/ml 4-armigem PEG-MAL (10 kDa), 0,82 mg/ml RGD, 8,06 mg/ml MethMAL und 4,62 mg/ml MMP-2-Vernetzer (enzymatisch abbaubarer Vernetzer). Die unten beschriebenen Methoden ergeben ~ 3 ml Mikrogele. - Bereiten Sie 6 ml Tensidlösung vor, indem Sie die Brühe 5% Fluortensid auf mindestens 1% in Novec-Öl verdünnen. Fügen Sie diese Lösung zu einer 10-ml-Spritze hinzu.
HINWEIS: Fluoriertes Tensid ist nicht mit Wasser mischbar, wodurch es während des Gelübergangs in die wässrige Phase während der PBS-Waschungen im Reinigungsschritt leicht entfernt werden kann. - Schneiden Sie drei Stück Tygon-Schläuche ab, die eine für die Höhe der Spritzenpumpe geeignete Länge haben.
- Schneiden Sie zwei Stück PEEK-Schlauch, ~ 1 Zoll lang. Führen Sie einige Millimeter des PEEK-Schlauchs in das Ende von zwei Tygon-Schläuchen ein, wie in Abbildung 4A dargestellt, um zu verhindern, dass die Nadel die Tygon-Schlaucheinlässe durchsticht.
- Führen Sie das Nicht-PEEK-Ende des Tygon-Schlauchs in die Einlässe der mikrofluidischen Geräte ein. Führen Sie den verbleibenden Tygon-Schlauch (ohne PEEK-Schlauch am Ende) in den Ausgang des mikrofluidischen Geräts ein, wie in Abbildung 4C dargestellt.
- Geben Sie mindestens 3 ml Öl in eine 5 ml Kunststoffspritze und befestigen Sie sie an einer 25 G Nadel. Führen Sie die Nadel vorsichtig in den PEEK-Schlauch an einem der Tygon-Einlässe ein. Spülen Sie den Schlauch und das Gerät vorsichtig mit Öl. Sammeln Sie das Öl aus dem Auslass in einem konischen Rohr. Wiederholen Sie die Ölspülung am anderen Tygon-Einlass.
- Stellen Sie die Spritzenpumpen auf die gewünschten Durchflussraten ein.
HINWEIS: Dieses Protokoll verwendet 3 ml/h für den wässrigen Durchfluss und 6 ml/h für den Öldurchfluss. Es kann erforderlich sein, zwei separate Spritzenpumpen zu verwenden. - Verbinden Sie die Spritze mit dem Tensid über eine 25-G-Nadel mit dem Öleinlass (siehe Abbildung 4A) und geben Sie vorsichtig genug Öl ab, um den Schlauch und den Ölkanal des mikrofluidischen Geräts anzusaugen.
- Sobald das Gerät und die Öleinlässe eingerichtet sind, fügen Sie 0,5 ml Öl zu einer neuen 5-ml-Spritze hinzu, die den Gelvorläufer enthält. Der Zweck dieser kleinen Ölmenge besteht darin, die Vorläuferlösung gegen Ende des Laufs durch die mikrofuilidische Vorrichtung zu spülen.
- In einem konischen Röhrchen werden 1,5 mL der PEG-Backbone-Lösung und 1,5 mL der Vernetzerlösung vermischt. Vortex für 30 s und schnell die kombinierte Gelvorläuferlösung in die 5 ml Spritze übertragen.
- Verbinden Sie die Spritze mit der Gelvorläuferlösung über eine 25 G Nadel mit dem wässrigen Einlass. Dosieren Sie vorsichtig genug Lösung, um den Schlauch und den wässrigen Kanal zu grundieren.
- Klemmen Sie die Spritzen auf die jeweiligen Spritzenpumpen und drücken Sie sie ( siehe Abbildung 4B). Stellen Sie sicher, dass Flüssigkeit sowohl durch den wässrigen als auch durch den Ölkanal fließt.
HINWEIS: Es wird empfohlen, ein Mikroskop zu verwenden, um die Mikrogelbildung innerhalb des PDMS-Geräts zu visualisieren. - Suchen Sie nach Partikeln einheitlicher Größe aus den Kanälen (siehe Abbildung 4D). Sammeln Sie die Mikrogele aus dem Auslass in einem konischen Röhrchen.
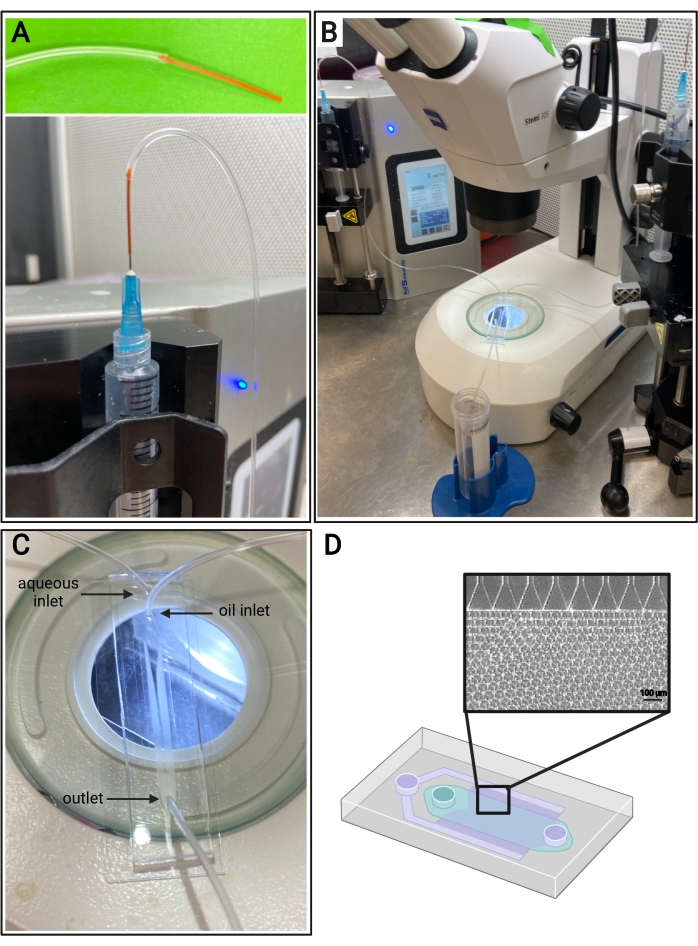
Abbildung 4: Mikrofluidischer Aufbau. (A) Darstellung des Verfahrens zum Verbinden von PEEK-Schläuchen (oben) und Tygon-Schläuchen mit einer 25-G-Nadel auf einer Spritze (unten). (B) Mikrofluidischer Aufbau mit Spritzenpumpen, Schläuchen, Gerät und Mikroskop. (C) Bild des mikrofluidischen Geräteaufbaus mit zwei Einlässen (wässrig und Öl) und einem Auslass. (D) Schematische Darstellung der mikrofluidischen Vorrichtung und repräsentatives Hellfeldbild der erwarteten Mikrogelbildung aus den Kanälen in einer Stufenemulgierungsvorrichtung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. Reinigung und Sterilisation von Mikrogelen
- Sobald die Gelierung abgeschlossen ist (bestimmt als Zeit-bis-Speicher-Modulplateau bei der Charakterisierung der Gelierungskinetik), entfernen Sie die Ölphase vorsichtig mit einer Pipette vom Boden des Röhrchens (siehe Abbildung 5). Legen Sie diese in einen geeigneten Abfallbehälter für fluorierte Abfälle.
HINWEIS: Die Gelierzeit kann durch Zugabe einer organisch löslichen Base zum Sammelrohr (z. B. Triethylamin) beschleunigt werden, aber es ist wichtig zu beachten, dass die Zugabe einer starken Base alle nicht umgesetzten Maleimide hydrolysieren kann. Wenn es gewünscht wird, Mikrogele durch überschüssige Maleimide nach der Gelierung zu funktionalisieren, überspringen Sie die Zugabe von Triethylamin. - Fügen Sie mehr Öl im Verhältnis 1:1 in das Mikrogel-Sammelröhrchen hinzu. Mischen Sie, indem Sie das Sammelrohr vorsichtig umdrehen. Nicht wirbeln.
- Lassen Sie das Sammelrohr ~5 min ruhen, damit sich die Phasen trennen können. Suchen Sie unten nach der Ölphase und oben nach der wässrigen Phase (den Mikrogelen) (siehe Abbildung 5).
- Wiederholen Sie die Ölwäschen mindestens 2x mehr.
- Fügen Sie mehr Öl im Verhältnis 1:1 mit dem Gel hinzu und fügen Sie 1x PBS in einem Verhältnis von 4:1 PBS zu Gel hinzu. Mehrmals umkehren, um zu mischen. Um die Schichten zu trennen, zentrifugieren Sie das Röhrchen bei ~ 2.000 x g für ~ 30 s. Suchen Sie nach der Ölphase am Boden des Röhrchens, dem Gel in der Mitte und PBS oben (siehe Abbildung 5).
- Entfernen Sie die Ölphase mit einer Pipette und entsorgen Sie sie in einem Abfallbehälter.
HINWEIS: Entfernen Sie den PBS nicht. Verwenden Sie ein größeres konisches Röhrchen, um das Waschen fortzusetzen, wenn das ursprüngliche Sammelröhrchen 15 ml betrug. - Wiederholen Sie Öl und PBS wäscht 2x mehr. Achten Sie darauf, dass das Gel durch die letzte Wäsche von undurchsichtig zu klar übergeht, wie in Abbildung 5 gezeigt, was darauf hinweist, dass das Tensid entfernt wurde und sich das Gel in der PBS-Phase befindet.
- Entfernen Sie das gesamte Öl. Entfernen Sie PBS nicht aus dem konischen Rohr.
- Verwenden Sie in einem chemischen Abzug eine Glaspipette, um dem Rohr Hexane in einem gleichen Volumen wie das PBS hinzuzufügen. Wirbeln Sie das konische Rohr für 30 s oder bis es gründlich gemischt ist. Zentrifugieren bei 4.696 x g für 5 min.
- Suchen Sie nach der Trennung nach Hexanen in der oberen Schicht, PBS in der Mitte und Gel unten (siehe Abbildung 5). Entfernen Sie die Hexanschicht und entsorgen Sie sie in einem Behälter für organische Abfälle. Saugen Sie die PBS ab.
- Wiederholen Sie Hexan und PBS mindestens 2x mehr oder bis das Gel nahezu durchscheinend erscheint (siehe Abbildung 5). Waschen Sie das Gel mit PBS 1x mehr, damit alle verbleibenden Hexane entfernt werden. Zentrifugieren bei 4.696 x g für 5 min. Saugen Sie die PBS-Schicht ab. Achten Sie darauf, das Gelpellet nicht zu stören.
- Um nicht umgesetzte Maleimide in den Mikrogelen zu verschließen oder zu löschen, wird eine 100 mM Lösung von N-Acetyl-L-Cystein in 1x PBS hergestellt und diese Lösung dem Gel hinzugefügt. Über Nacht auf einen Tubenrotator bei 37 °C geben, gefolgt von vielen Wäschen mit PBS, um nicht umgesetztes N-Acetyl-L-Cystein zu entfernen.
- Für eine Langzeitlagerung (bis zu 1 Jahr) resuspendieren Sie die Mikrogele in 70% IPA und lagern Sie sie bei 4 ° C, um das Wachstum von Bakterien auf den Mikrogelen zu verhindern.
- Um die Mikrogele zu sterilisieren, fügen Sie dem Gel 70% IPA im Verhältnis 4:1 v/v in einer Biosicherheitshaube hinzu. Das Röhrchen 30 s durchwirbeln, dann bei 4.696 × g für 5 min zentrifugieren. Saugen Sie den IPA-Überstand aus dem Gelpellet in einer Biosicherheitshaube ab. Führen Sie 2x weitere IPA-Wäschen durch, gefolgt von 3x Wäschen mit sterilem 1x PBS.
HINWEIS: Alle IPA sollten entfernt werden, bevor das Gel mit Zellen oder Tieren verwendet wird.
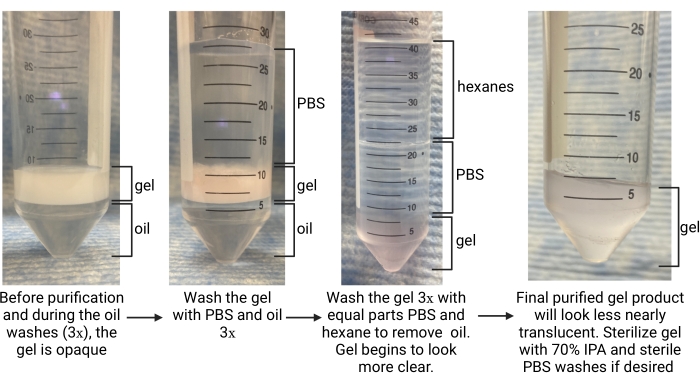
Abbildung 5: Überblick über das Mikrogel-Reinigungsverfahren. Abkürzungen: PBS = phosphatgepufferte Kochsalzlösung; IPA = Isopropylalkohol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Charakterisierung der Mikrogelgröße
HINWEIS: Es wird empfohlen, Mikrogelpartikel über Nacht bei 37 °C in 1x PBS ausgleichen zu lassen, um vor der Größenbestimmung auf ihren endgültigen Durchmesser aufzuquellen.
- Bild Gelpartikel.
- Drehen Sie das MAP-Gel bei 4.696 × g für 5 min herunter und saugen Sie den Überstand ab.
- Entfernen Sie mit einer Verdrängerpipette 5 μL Mikrogele aus dem Gelpellet und verdünnen Sie 1 ml PBS in einem Mikrozentrifugenröhrchen (1:200 Verdünnung). Passen Sie diese Verdünnung nach Bedarf an.
HINWEIS: Während der Formulierung der Gelvorläuferlösung können 5 μM Biotin-Maleimid zugegeben und als Alternative zur Markierung von Mikrogelen mit einem Fluorophor verwendet werden. In diesem Fall kann ein Streptavidin-Fluorophor in einer Verdünnung von 1:300 (aus 1 mg / ml Vorrat) hinzugefügt werden. Lassen Sie die Inkubation mit Streptavidin für mindestens 15 Minuten vor der Bildgebung. - Mit einer Verdrängungspipette werden 100 μL der verdünnten Mikrogele in die Vertiefungen einer klaren 96-Well-Platte überführt.
- Verwenden Sie ein Weitfeld- oder Konfokalmikroskop, um die Mikrogele mit einem 10x-Objektiv sichtbar zu machen. Nehmen Sie Bilder der Mikrogele für die Analyse auf.
- Siehe Abbildung 6 für repräsentative konfokale Bilder von Mikrogelen.
- Dimensionierung von Partikeln mit ImageJ
- Öffnen Sie die Bilddateien aus dem Mikroskop in ImageJ.
- Wählen Sie | analysieren aus. Stellen Sie die Skalierung ein und stellen Sie die Bildskala entsprechend dem Mikroskopobjektiv ein.
- Bild auswählen | Typ | 8-Bit.
- Bild auswählen | Anpassen | Schwellenwert und wählen Sie dann die automatische Schwellenwertoption "Otsu" aus dem Dropdown-Feld.
- Klicken Sie auf Analyze | Legen Sie Messungen fest und wählen Sie Ferets Durchmesser und begrenzen Sie den Schwellenwert.
- Klicken Sie auf Analyze | Analysieren Sie Partikel und geben Sie den Flächengrößenbereich (in Pixel ^ 2) ein, der für die Mikrogele erwartet wird (um kleine Trümmer von der Analyse auszuschließen). Ändern Sie die Zirkularität auf 0,75-1,00 und wählen Sie Show | Gliederungen. Aktivieren Sie Ergebnisse anzeigen und an Kanten ausschließen.
HINWEIS: Der Zirkularitätsformfilter schließt Mikrogele am Bildrand aus, die zu einer ungenauen Durchmessermessung führen können. - Führen Sie das Modul Partikel analysieren aus.
- Warten Sie auf die Ausgabe, die dem Feret-Durchmesser jedes Partikels entspricht, und exportieren Sie diese Ergebnisse in eine Tabelle.
- Berechnen Sie in diesem Protokoll den Polydispersitätsindex (PDI), um die Heterogenität der Mikrogelgröße zu bestimmen. Analysieren Sie mindestens 100 Mikrogele, um eine Population zu definieren: Ein PDI-Bereich von 1,00-1,05 definiert eine monodisperse Population und ein PDI größer als 1,05 definiert eine polydisperse Population. Verwenden Sie Gleichung (2), Gleichung (3) und Gleichung (4), um den PDI zu berechnen, wie unten beschrieben.
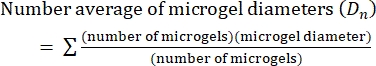 (2)
(2) (3)
(3)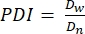 (4)
(4)

Abbildung 6: Repräsentative Bilder von Mikrogelen. (A) Fluoreszierendes konfokales Bild der Mikrogelpopulation A, (B) Bild von Schwellenwert-Mikrogelen und (C) Partikelumrisse nach ImageJ-Analyse. (D) Fluoreszierendes konfokales Bild der Mikrogelpopulation B und (E) Durchlichtbild von Mikrogelen (Mikrogele sind nahezu durchscheinend). (F) Darstellung repräsentativer Ergebnisse der in diesem Protokoll beschriebenen ImageJ-Analyse. Beide Mikrogelpopulationen haben relativ monodisperse PDIs. Beide Populationen von Mikrogelen wurden mit einer wässrigen Durchflussrate von 3 ml / h und einer Ölflussrate von 6 ml / h synthetisiert. Der Unterschied in der Mikrogelgröße ist jedoch auf Unterschiede in der Schrittweite des mikrofluidischen Geräts zurückzuführen. Zum Beispiel wurde die Mikrogelpopulation A mit einer mikrofluidischen Vorrichtung mit einer Kanalschrittweite von 11 μm synthetisiert, und die Mikrogelpopulation B wurde in einer Vorrichtung mit einer Schrittweite von 40 μm synthetisiert. Maßstabsbalken = 100 μm. Abkürzung: PDI = Polydispersity Index. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
7. Gerüstglühen mit mikroporösen geglühten Partikeln (MAP)
- Man kann eine Stammlösung von 2 mM Lithiumphenyl-2,4,6-trimethylbenzoylphosphinat (LAP) in 1x PBS (pH 7,4) herstellen.
- Die LAP-Stammlösung wird auf 0,2 mM in einem Volumen von 1x PBS verdünnt, das dem Gelvolumen entspricht. Wenn Sie den LAP-Photoinitiator für Zellstudien oder Tierversuche verwenden, achten Sie darauf, die Lösung vor der Verwendung zu sterilisieren.
- Drehen Sie das MAP-Gel bei 4.696 × g für 5 min herunter und saugen Sie den Überstand ab.
- Übertragen Sie mit einer Verdrängerpipette das gewünschte Gelvolumen in ein Mikrozentrifugenröhrchen.
- Fügen Sie dem Gel 0,2 mM LAP in einem volumetrischen Verhältnis von 1:1 hinzu (die endgültige LAP-Konzentration beträgt 0,1 mM).
- Wirbeln Sie die Mischung vor und inkubieren Sie sie mindestens 15 Minuten im Dunkeln.
- Zentrifugieren Sie die Mischung bei 18.000 × g für 5 min, um das Gel zu pelletieren.
- Entfernen Sie vorsichtig den Überstand aus dem Gelpellet.
- Übertragen Sie das MAP-Gel mit einer Verdrängungspipette an die Zielstelle.
- Tragen Sie fokussiertes Licht (365 nm, 8,66 mW/cm2) 113 s lang auf die Probe auf, um das Gerüst zu glühen.
HINWEIS: Die Glühzeit von 113 s wurde wie zuvor veröffentlicht für eine LAP-Konzentration von 0,1 mM14 optimiert, aber möglicherweise ist eine zusätzliche Optimierung für verschiedene Photoinitiatorkonzentrationen erforderlich.
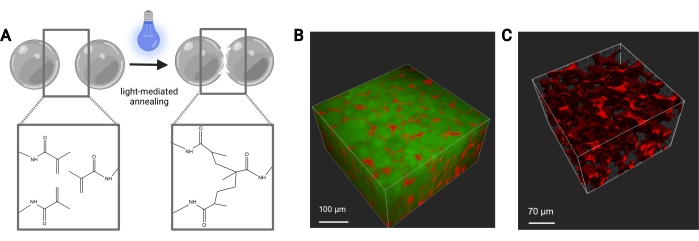
Abbildung 7: MAP-Gerüstglühen. (A) Schematische Darstellung des MAP-Gerüstglühens. Bei Bestrahlung mit einem Photoinitiator und Licht durchlaufen die funktionellen Methacrylamidgruppen auf dem MethMAL-Makromer eine Klick-Photopolymerisationsreaktion, die die Oberflächen der Mikrogele miteinander verbindet. (B) Darstellung eines 3D-Renderings (Imaris) eines Zwei-Photonen-Mikroskopbildes von MAP-Mikrogelen (grün), die in einer 3D-Puckform mit Dextran (rot) in den Poren geglüht wurden. (C) Darstellung eines 3D-Renderings (Imaris) eines Zwei-Photonen-Mikroskopbildes, das die Porosität eines MAP-Gerüsts zeigt, das mit fluoreszierendem 70 kDa Dextran (rot) durchblutet wurde. Maßstabsbalken = (B) 100 μm, (C) 70 μm. Abkürzungen: MAP = microporous annealed particle; MethMAL = kundenspezifisches Glühmakromer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Das Ziel dieses Protokolls ist es, alle Schritte zu skizzieren, die für die Synthese von Mikrogelbausteinen erforderlich sind, die in einem MAP-Gerüst verwendet werden. Das MethMAL-Glühmakromer ist hochselektiv und effizient und mit mehreren Polymer-Backbones kompatibel14. Wichtig ist, dass mindestens 67%-75% des 20 kDa PEG-Maleimids mit funktionellen Methacrylamidgruppen modifiziert werden, um eine hohe Glüheffizienz zu gewährleisten. Die prozentuale Modifikation kann am einfachsten durch die Analyse von 1 H-NMR-Spektrenpeaks bestimmt werden, wie in Abbildung 1 dargestellt. Die Gelierungskinetik, die durch ein Viskosimeter bestimmt wird, ist eine wichtige Metrik, die für jede Gelformulierung zu berücksichtigen ist. Dieses Protokoll verwendet eine Gelvorläuferlösung, die aus einem PEG-Rückgrat mit einer MAL-Gruppe besteht, die effizient mit thiolfunktionalisierten Vernetzern für die Mikrogelgelierung reagiert. Viele Hydrogel-Chemikalien können jedoch verwendet werden, um Mikrogele über das hierin beschriebene mikrofluidische Hochdurchsatzverfahren herzustellen. Die Zeit bis zum Beginn der Gelierung gibt Aufschluss über die Dauer der mikrofluidischen Mikrogelbildung. Es wird empfohlen, einen pH-Wert der Gelvorstufe zu wählen, der die Gelierung zwischen 30 min (Abbildung 2) und 2 h initiieren kann.
Wenn die Gelierungszeit zu schnell ist, beginnt die Gelvorläuferlösung innerhalb der mikrofluidischen Vorrichtung zu polymerisieren und die Kanäle zu verstopfen. Darüber hinaus ist es wichtig zu beachten, dass sich ändernde thiolierte Ligandenkonzentrationen (z. B. RGD) Auswirkungen auf die Netzwerkbildung während der Gelierung haben können und möglicherweise durch Anpassung der Formulierung berücksichtigt werden müssen. Die Schritte zur Herstellung mikrofluidischer Bauelemente können mühsam sein, aber repräsentative Ergebnisse eines erfolgreich verklebten Geräts sind in Abbildung 3 dargestellt. Dieses Protokoll verwendet ein parallelisiertes Mikrofluidisierungsgerät mit hohem Durchsatz, das nach einem Design von de Rutte et al.13 adaptiert wurde, und die Herstellung von Siliziumwafern wurde an ein mikrofluidisches Technologieunternehmen ausgelagert. Die in diesem Protokoll beschriebenen Schritte können jedoch mit jedem Gerätedesign verwendet werden, das auf einer SU-8-Siliziumwafer-Fotomaske geätzt ist. Es ist wichtig zu beachten, dass die Schrittweite der Kanäle auf der Fotomaske während der Geräteherstellung optimiert werden muss, da dies die Größe der Mikrogelpartikel beeinflusst.
Die Durchflussraten für die mikrofluidische Erzeugung von Mikrogelen sollten für jede Gelformulierung basierend auf Faktoren wie Gelierzeit, gewünschter Partikelgröße und mikrofluidischem Gerätedesign optimiert werden. Bei Verwendung des Hochdurchsatzgeräts können die Durchflussraten für die wässrige Phase bis zu 5 ml / h betragen. Abbildung 4B zeigt den Aufbau für Geräte mit hohem Durchsatz, die in diesem Protokoll verwendet werden. Wenn das Gerät korrekt läuft, sollte die Mikrogelbildung ähnlich wie in Abbildung 4D aussehen. Vor der Reinigung sind die Mikrogele undurchsichtig. Nach Abschluss der verschiedenen Öl-, PBS- und Hexanwäschen sollte das Gel wie das repräsentative Bild in Abbildung 5 klar aussehen. Wenn ein Fluorophor in die Mikrogele eingebaut wird, kann das gereinigte Produkt eine leichte Färbung haben, sollte aber immer noch nahezu durchscheinend sein. Nach der Reinigung und Quellung sollten die Mikrogele eine sehr gleichmäßige Größe haben und einen PDI zwischen 1,00 und 1,05 aufweisen, wie in Abbildung 6 dargestellt. Verschiedene Photoinitiatoren können zum Photoglühen von MAP-Gerüsten verwendet werden. Wenn eine Alternative zu LAP verwendet wird, die hierin beschrieben wird, muss man die Glühkinetik wie zuvor beschriebenbestimmen 14. Zusätzlich können verschiedene Lichtquellen zum Photoglühen verwendet werden, sofern die Lichtquelle mit dem Photoinitiator übereinstimmt. Man muss darauf achten, die Lichtquelle zu kalibrieren und zu fokussieren. Die Glühzeit und Lichtintensität müssen möglicherweise basierend auf der Gelformulierung und der Photoinitiatorkonzentration optimiert werden. Das in diesem Protokoll beschriebene Glühverfahren kann für In-vitro- und In-vivo-Studien verwendet werden. Nach dem Glühen bilden die Mikrogele ein poröses Gerüst, das mit Zwei-Photonen-Mikroskopie sichtbar gemacht werden kann (Abbildung 7B-C).
Diskussion
Dieses Protokoll beschreibt Methoden zur Synthese und Charakterisierung von Mikrogelen, die als Bausteine für mikroporöse geglühte Partikel (MAP)-Gerüste dienen. Dieses Protokoll verwendet einen mikrofluidischen Hochdurchsatzansatz, um große Mengen einheitlicher Mikrogele zu erzeugen, was mit anderen Methoden wie der strömungsfokussierenden Mikrofluidik 1,4,7,9 (hohe Monodisperistie, geringe Ausbeute), Batchemulsion 6,10 und Elektrospritzen 5,12 nicht erreicht werden kann. (geringe Monodispersität, hohe Ausbeute). Mit den hierin beschriebenen Verfahren können monodisperse Mikrogele zur Verwendung in MAP-Gerüsten hergestellt werden, die für eine Vielzahl von Anwendungen der regenerativen Medizin (z. B. Zellabgabe, Wundheilung) verwendet werden können.
Ein kritischer Schritt dieses Protokolls ist die Entwicklung der PDMS-Mikrofluidik-Geräte. Wenn die Geräte nicht korrekt hergestellt werden, könnte dies negative nachgeschaltete Auswirkungen auf die Mikrogelbildung und Monodispersität haben. Es ist wichtig, das Einbringen von Artefakten (z. B. Blasen, Staub) in das PDMS zu verhindern, bevor es aushärtet, da dies die Kanäle verstopfen und die Mikrogelbildung erheblich beeinträchtigen könnte. Um dies so weit wie möglich zu mildern, sollte man Klebeband verwenden, um Staub zu entfernen, die Geräte in einem staubfreien Behälter zu lagern und wenn möglich in einer staubfreien Haube zu arbeiten. Es wird auch empfohlen, die Geräte bei 60 °C zu lagern, um die besten Ergebnisse mit der Oberflächenbehandlung zu erzielen.
Beim Gießen der PDMS-Geräte ist es wichtig, eine gleichmäßige Dicke beizubehalten, die etwa gleich oder kleiner als die Länge des Biopsiestempels ist. Wenn das Gerät zu dick ist, kann der Biopsiestempel nicht vollständig durchdringen. Es ist auch wichtig, dass die Einlässe / Auslässe des PDMS-Geräts beim Stanzen mit dem Biopsiestempel und / oder beim Einführen des Schlauchs nicht gerissen werden. Ein Riss im PDMS-Gerät führt zu einem Auslaufen aus den Einlässen / Ausgängen, was zum Verlust der Gelvorläuferlösung führen kann. Wenn ein PDMS-Gerät undicht ist, ist die beste Lösung, es so schnell wie möglich durch ein neues Gerät zu ersetzen.
Bei der Plasmabehandlung des Gerätes hat die Verwendung von reinem Sauerstoff und die Plasmabehandlung für 30 s die besten Ergebnisse für die Verklebung von PDMS auf dem Objektträger erzielt. Wenn das Gerät nicht richtig haftet (d. h. das PDMS kann nach der Plasmabehandlung immer noch vom Glasobjektträger abgehoben werden), sollte überprüft werden, ob das Plasmabehandlungsgerät ordnungsgemäß funktioniert und ob das Gerät und die Objektträger gründlich gereinigt wurden. Es ist auch wichtig, die richtige Silanoberflächenbehandlung zu verwenden, und für beste Ergebnisse sollten die PDMS-Geräte direkt vor der Verwendung oberflächenbehandelt werden. Andere Methoden der Oberflächenbehandlung, wie die chemische Gasphasenabscheidung, könnten ebenfalls verwendet werden.
Ein weiterer entscheidender Schritt ist der korrekte Einsatz der PDMS-Mikrofluidik-Geräte zur Mikrogelbildung. Es wird empfohlen, ein Durchflussverhältnis von mindestens 2: 1 zu verwenden (dieses Protokoll verwendet eine Öldurchflussrate von 6 ml / h und eine wässrige Durchflussrate von 3 ml / h), aber dies kann abgestimmt werden, um die gewünschte Mikrogelgröße zu erreichen. Der pH-Wert der Mikrogel-Vorläuferlösung ist ebenfalls eine wichtige Metrik, die optimiert werden muss, um ein Verstopfen des Geräts zu vermeiden. Phosphatgepufferte Kochsalzlösung (PBS) beschleunigt die Thiolatbildung in der Michael-Typ-Additionschemie, und die in diesem Protokoll verwendeten PBS-Konzentrationen liefern die besten Ergebnisse für die Mikrogelgelierung in den mikrofluidischen Geräten. Sobald die Spritzenpumpen gestartet sind, kann es einige Blasen in den mikrofluidischen Kanälen geben, aber dies sollte sich nach einigen Minuten ausgleichen. Es wird empfohlen, die Mikrogelbildung mit einem Mikroskop zu überwachen. Wenn die Strömung nicht ähnlich aussieht wie in diesem Video und/oder es einige Kanäle gibt, die große Partikel produzieren, ist dies wahrscheinlich auf Probleme mit dem Oberflächenbehandlungsschritt zurückzuführen. Die beste Lösung ist, das Gerät durch ein frisch oberflächenbehandeltes Gerät zu ersetzen.
Wenn die Mikrogele zu koaleszieren scheinen, kann dies auf eine unzureichende Konzentration von Fluortensid zurückzuführen sein. Die empfohlene Lösung besteht darin, den Gew.-% des Tensids in der Ölphase zu erhöhen. Eine Einschränkung bei der Verwendung hoher Tensidkonzentrationen besteht jedoch darin, dass es schwieriger sein kann, es während des Reinigungsschritts zu entfernen. Es wird empfohlen, mikrofluidische Geräte nur einmal zu verwenden, aber die Geräte können wiederverwendet werden, wenn sie sofort nach Gebrauch mit Novec-Öl gespült werden, um wässrige Lösung zu entfernen, die im Gerät gelieren und die Kanäle verstopfen könnte. Während ein mikrofluidisches Gerät ein Hochdurchsatzvolumen von Mikrogelen (ml / h) produzieren kann, kann diese Produktionsrate skaliert werden, indem mehrere mikrofluidische Geräte parallel verwendet werden.
Der Glühschritt der MAP-Gerüstmontage beruht auf der Verwendung eines lichtaktivierten Photoinitiators der radikalischen Polymerisation, und der Photoinitiator kann basierend auf der gewünschten Anwendung ausgewählt werden. Zum Beispiel hat der LAP-Photoinitiator schnelle Glühzeiten (<30 s), wenn langwelliges UV-Licht verwendet wird, was einen minimalen Einfluss auf die Zelllebensfähigkeit in vitrohat 14. Diese Wellenlänge wird jedoch stark vom Gewebe16 absorbiert und hat möglicherweise in vivo keine so hohe Glühwirkung wie in vitro.
Eosin Y ist ein weiterer Photoinitiator, der durch sichtbare Wellenlängen (505 nm) aktiviert wird und tiefer in das Gewebe eindringt, was die Fähigkeit des MAP-Gerüsts verbessert, unter dem Gewebe geglüht zu werden. Die langen Lichtexpositionszeiten, die für das Eosin-Y-Glühen erforderlich sind, können jedoch die Zellexposition gegenüber freien Radikalen verlängern und die Lebensfähigkeit der Zellen in vitro beeinträchtigen 14. Die Verwendung dieser Methoden zur Hochdurchsatzerzeugung von hochgleichmäßigen Mikrogel-Bausteinen wird die auf MAP-Gerüste ausgerichtete Forschung beschleunigen und das Wissen auf dem Gebiet der injizierbaren porösen Materialien für die regenerative Medizin erweitern.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren möchten Joe de Rutte und dem Di Carlo Lab an der University of California, Los Angeles, für ihre Unterstützung beim ursprünglichen mikrofluidischen Gerätedesign, aus dem das berichtete Gerät entwickelt wurde, sowie für ihre frühzeitige Anleitung bei der Herstellung und Fehlerbehebung von PDMS-Geräten danken. Mit Biorender.com wurden Figurenschemata erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-aminoethanethiol hydrochloride | Acros Organics | AC153770250 | For MethMal Synthesis MW: 113.61 Da |
| 35 mm plate rotor | HAAKE | P35/Ti | Geometry for HAAKE viscometer |
| 4-arm PEG-Maleimide (10 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-100MA | For microgel precursor solution |
| 4-arm PEG-Maleimide (20 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-200MA | For MethMal Synthesis Molecular weight specific to each batch |
| BD Syringe with Luer-Lok Tips | Becton Dickinson | Disposable plastic syringes | |
| Biopsy punch | Mitex | MLTX33-31A-P/25 | 1.5 mm diameter |
| Chloroform-d | Acros Organics | AC209561000 | For MethMal Synthesis |
| Collimated LED Light Source | ThorLabs | M365LP1-C1 | 365 nm |
| Culture dish (15 cm) | Corning | CLS430599 | 150 mm x 25 mm |
| DMTMM(4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride) | Oakwood Chemical | 151882 | For MethMal Synthesis MW: 276.72 Da |
| Fluorosurfactant | Ran Technologies | 008-Flurosurfactant-5wtH-200G | 5 weight percent of 008-Flurosurfactant in HFE7500 |
| FreeZone Triad Freeze Dry System | Labconco | 7400000 Series | For MethMal Synthesis Lyophilizer |
| Glass slides | Fisher Scientific | 12-550-A3 | Plain glass slides, uncoated |
| HAAKE Rheowin viscometer | HAAKE | ||
| ImageJ | version 1.8.0_172 | ||
| KDS Legato 210 Dual Prong Syringe Pump | Kd Scientific | ||
| LED Driver | ThorLabs | DC2200 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | Photoinitiator |
| Methacrylic Acid | Sigma Aldrich | 155721 | For MethMal Synthesis MW: 86.09 Da Density: 1.015g/mL |
| Microfluidic device SU8-Si master wafer | FlowJem | N/A | Custom-made, with silanization |
| MMP-2 degradable crosslinker | FlowJem | Sequence: Ac-GCGPQGIAGQDGCG-NH2 | |
| Needles (25 G, beveled) | BD | 305122 | Length: 15.88 mm Gauge: 0.5 mm |
| Novec 7500 | 3M | 7100025016 | Fluorinated oil |
| Oxygen | Praxair | UN1072 | Compressed |
| Peek tubing | Trajan Scientific | 03-350-523 | 1/32" Outer Diameter; 0.02" Inner Diameter; 10' Length |
| PFOCTS (trichloro(1H,1H,2H,2H-perfluorooctyl)silane) | Sigma-Aldrich | 448931 | For surface treatment |
| Phosphate Buffered Saline | Fisher BioReagants | BP3994 | Diluted to 1x in ultrapure water, pH = 7.4 |
| Plasma cleaner | Harrick Plasma | PDC-001-HP | |
| Razor blade | Fisher Scientific | 12-640 | |
| RGD cell adhesive peptide | WatsonBio Sciences | Sequence: Ac-RGDSPGGC-NH2 | |
| Rheowin software | HAAKE | Software compatible with HAAKE viscometer | |
| Scalpel blade | Bard-Parker | 371210 | Size: #10 |
| Scalpel handle | Bard-Parker | 371030 | Size: #3 |
| Sodium Chloride | Fisher BioReagents | BP358-1 | For MethMal Synthesis MW: 58.44 Da |
| Sylgard 184 silicone elastomer kit | DOW Chemical | 2065622 | Base and curing agent |
| Triethylamine | Fisher Scientific | O4884-100 | For MethMal Synthesis MW: 101.19 Da Density: 0.73g/mL |
| Tygon tubing | Saint Gobain Performance Plastics | AAD04103 | ID: 0.51 mm OD: 1.52 mm |
| Varian Inova 500 Spectrometer | Varian | NMR Located in the UVA Biomolecular Magnetic Resonance Facility |
Referenzen
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147(2019).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Advanced Functional Materials. 31 (35), 2104337(2021).
- Darling, N. J., Sideris, E., Hamada, N., Carmichael, S. T., Segura, T. Injectable and spatially patterned microporous annealed particle (MAP) hydrogels for tissue repair applications. Advanced Science. 5 (11), 1801046(2018).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science and Engineering. 5 (12), 6395-6404 (2019).
- Pruett, L., et al. Development of a microporous annealed particle hydrogel for long-term vocal fold augmentation. Laryngoscope. 130 (10), 2432-2441 (2020).
- Nih, L. R., Sideris, E., Carmichael, S. T., Segura, T. Injection of microporous annealing particle (MAP) hydrogels in the stroke cavity reduces gliosis and inflammation and promotes NPC migration to the lesion. Advanced Materials. 29 (32), (2017).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Schaeffer, C., et al. Injectable microannealed porous scaffold for articular cartilage regeneration. Annals of Plastic Surgery. 84, 6S Suppl 5 446-450 (2020).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Jivan, F., Alge, D. L. Bio-orthogonal, site-selective conjugation of recombinant proteins to microporous annealed particle hydrogels for tissue engineering. Advanced Therapeutics. 3 (1), 1900148(2020).
- de Rutte, J. M., Koh, J., di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomaterials Science and Engineering. 7 (2), 422-427 (2021).
- Darling, N. J., Hung, Y. S., Sharma, S., Segura, T. Controlling the kinetics of thiol-maleimide Michael-type addition gelation kinetics for the generation of homogenous poly(ethylene glycol) hydrogels. Biomaterials. 101, 199-206 (2016).
- Sandell, J. L., Zhu, T. C. A review of in-vivo optical properties of human tissues and its impact on PDT. Journal of Biophotonics. 4 (11-12), 773-787 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten