Method Article
Síntesis microfluídica de bloques de construcción de microgel para andamios de partículas recocidas microporosas
En este artículo
Resumen
Este protocolo describe un conjunto de métodos para sintetizar los bloques de construcción de microgel para andamios de partículas recocidas microporosas, que se pueden usar para una variedad de aplicaciones de medicina regenerativa.
Resumen
La plataforma de andamio de partículas recocidas microporosas (MAP) es una subclase de hidrogeles granulares. Se compone de una suspensión inyectable de microgeles que puede formar un andamio estructuralmente estable con porosidad a escala celular in situ después de un paso secundario de reticulación química basada en la luz (es decir, recocido). El andamio MAP ha demostrado éxito en una variedad de aplicaciones de medicina regenerativa, incluida la cicatrización de heridas dérmicas, el aumento de las cuerdas vocales y la administración de células madre. Este artículo describe los métodos para la síntesis y caracterización de microgeles de poli(etilenglicol) (PEG) como los bloques de construcción para formar un andamio MAP. Estos métodos incluyen la síntesis de un macrómero de recocido personalizado (MethMAL), la determinación de la cinética de gelificación del precursor de microgeles, la fabricación de dispositivos microfluídicos, la generación microfluídica de microgeles, la purificación de microgel y la caracterización básica de andamios, incluido el dimensionamiento de microgel y el recocido de andamios. Específicamente, los métodos microfluídicos de alto rendimiento descritos en este documento pueden producir grandes volúmenes de microgeles que se pueden usar para generar andamios MAP para cualquier aplicación deseada, especialmente en el campo de la medicina regenerativa.
Introducción
La plataforma de andamio MAP es un biomaterial inyectable compuesto completamente de micropartículas de hidrogel (microgeles) que proporcionan microporosidad a escala celular cuando se entrecruzan, lo que permite la migración celular independiente de la degradación y la integración de tejidos a granel1. Debido a su capacidad para integrarse rápidamente con el tejido huésped y su inmunogenicidad inherentemente baja, la plataforma de andamio MAP ha demostrado aplicabilidad preclínica para una amplia variedad de terapias de medicina regenerativa 2,3,4,5,6,7,8,9,10, incluida la aceleración de la cicatrización de heridas dérmicas 1,3 ,11, revascularizar la cavidad 7 del accidente cerebrovascularcerebral, administrar células madre mesenquimales2 y proporcionar aumento de volumen tisular para tratar la insuficiencia glótica6. También se ha demostrado que MAP transmite efectos antiinflamatorios al tejido huésped a través del reclutamiento de macrófagos M23 e incluso puede ajustarse para promover una respuesta inmune Th2 de "reparación tisular"8. Estas propiedades favorables de la plataforma de andamio MAP permiten expandirla a una amplia gama de aplicaciones clínicas.
Los métodos publicados anteriormente para generar microgeles para la formación de andamios MAP han incluido microfluídica de gotas de enfoque de flujo 1,4,7,9, electropulverización 5,12 y centrifugado aéreo con emulsión por lotes 6,10. El método microfluídico de gotas puede producir partículas con alta monodispersidad pero utiliza caudales muy lentos que producen bajos rendimientos de partículas (μL / h). Alternativamente, los métodos de electropulverización y emulsión por lotes pueden producir un alto volumen de partículas, pero con alta polidispersidad de partículas. Este protocolo utiliza un método microfluídico de alto rendimiento para producir microgeles con una población monodispersa, basado en el trabajo de Rutte et al13. Este método utiliza técnicas de litografía blanda para hacer un dispositivo microfluídico de polidimetilsiloxano (PDMS) a partir de una fotomáscara, que luego se une a un portaobjetos de vidrio. El diseño del dispositivo se basa en la emulsificación escalonada para generar un alto volumen de partículas de microgel (ml / h). La monodispersidad que se puede lograr con este método proporciona un control superior de la porosidad en comparación con otras técnicas, ya que los microgeles monodispersos pueden formar andamios con tamaños de poro más uniformes2.
Los métodos para sintetizar y caracterizar los microgeles individuales que pueden actuar como bloques de construcción para andamios MAP se describen dentro de este manuscrito, específicamente en términos de creación de microgeles que consisten en una columna vertebral PEG con un grupo de maleimida (MAL), que participa fácilmente en la adición eficiente de tipo Michael con reticulantes funcionalizados con tiol para la gelificación de microgel. Para desacoplar la gelificación de microgel del recocido de andamios MAP, este manuscrito también describe cómo sintetizar un macrómero de recocido personalizadopublicado de 14 , MethMAL, que es un macrómero PEG heterofuncional de metacrilamida / maleimida de 4 brazos. Los grupos funcionales de metacrilamida participan fácilmente en la fotopolimerización de radicales libres (para el recocido de microgel), mientras que permanecen relativamente inertes a las condiciones que promueven la adición de tipo Michael para los grupos funcionales MAL.
Además, este manuscrito describe los protocolos para crear dispositivos microfluídicos PDMS, determinar la cinética de gelificación de microgel y caracterizar el tamaño del microgel. La parte final del manuscrito detalla el recocido del andamio MAP, que es cuando los microgeles se transfieren in situ a un andamio a granel a través de un paso de reticulación secundario iniciado por la foto que une covalentemente las superficies de los microgeles. Es importante tener en cuenta que existen otros métodos de recocido que pueden implementarse en sistemas de andamios MAP que no dependen de productos químicos basados en la luz, como el recocido mediado por enzimas, como se describió anteriormente1. En general, estos métodos se pueden usar directamente o con diferentes productos químicos de formulación de hidrogel (por ejemplo, a base de ácido hialurónico) para generar andamios MAP para cualquier aplicación.
Protocolo
1. Síntesis de macrómeros recocidos de MethMAL
NOTA: Este protocolo es específicamente para modificar 1 g de PEG-maleimida, pero se puede ampliar para hacer lotes más grandes.
- Añadir 1 g de PEG-maleimida de 20 kDa de 4 brazos a 10 ml de solución salina tamponada con fosfato (PBS, pH 7,4) en un vaso de precipitados de vidrio pequeño con una barra de agitación. Revuelva la solución a 300 rpm hasta que el PEG esté completamente disuelto (~30 min).
- Añadir 14,65 mg de 2-aminoetanotiol (0,67:1 tiol [SH] a maleimida [MAL] relación molar) a la reacción con agitación a 300 rpm.
NOTA: Los grupos tiol en 2-aminoetanotiol se agregarán a aproximadamente tres brazos del PEG-MAL a través de la adición de tipo Michael, dejando grupos extremos de amina.- Observe el siguiente ejemplo de cálculo para la cantidad de 2-aminoetanotiol a agregar:
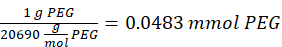
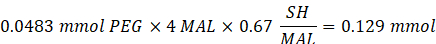
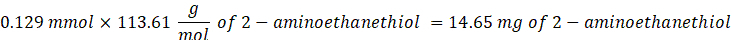
NOTA: Para evitar medir una cantidad muy pequeña, disuelva 100 mg de 2-aminoetanotiol en 1 ml de 1x PBS (pH 7.4) y agregue 146.5 μL de esa solución a la reacción.
- Observe el siguiente ejemplo de cálculo para la cantidad de 2-aminoetanotiol a agregar:
- Espere 1 h y 10 min después del paso 1.2., luego mezcle 160,1 mg de cloruro de 4-(4,6-Dimetoxi-1,3,5-triazin-2-il)-4-metilmorfolinio (DMTMM, relación molar 12:1 a PEG) y 32,77 μL de ácido metacrílico (relación molar 8:1 a PEG) en 5 ml de 1x PBS (pH 7,4) en un vaso de precipitados de vidrio nuevo y reaccione durante 50 min con agitación a 300 rpm.
NOTA: En este paso, el ácido metacrílico reacciona con DMTMM para formar un éster altamente reactivo que luego se puede acoplar a los grupos amina disponibles en el PEG.- Observe el siguiente ejemplo de cálculo para calcular la cantidad de DMTMM que se va a agregar:
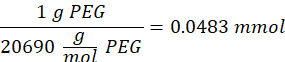
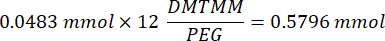
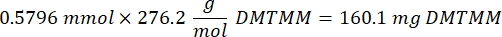
- Observe el siguiente ejemplo de cálculo para calcular la cantidad de ácido metacrílico a añadir:
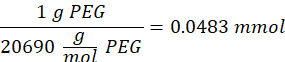
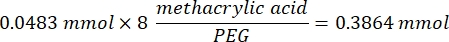
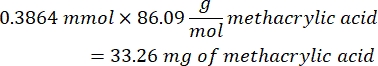
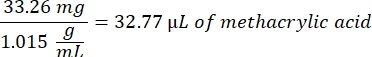
- Observe el siguiente ejemplo de cálculo para calcular la cantidad de DMTMM que se va a agregar:
- Añadir la solución de ácido metacrílico/DMTMM al vaso de precipitados con la solución de 20 kDa PEG-MAL/2-aminoetanotiol.
- Añadir 53,56 μL de trietilamina (relación molar 1:1 a ácido metacrílico) al vaso de precipitados y dejar reaccionar durante la noche con agitación a 300 rpm. Cubra el vaso de precipitados con papel de aluminio para evitar que el polvo y otros contaminantes entren en el vaso de precipitados.
- Observe el siguiente ejemplo de cálculo para la cantidad de trietilamina a agregar:
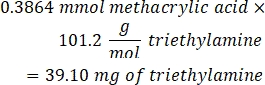
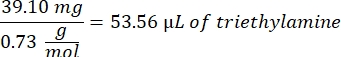
- Observe el siguiente ejemplo de cálculo para la cantidad de trietilamina a agregar:
- Transfiera la reacción al tubo de diálisis de piel de serpiente (límite de peso molecular: 3,500 Da).
- Coloque el tubo de diálisis en un vaso grande con NaCl 1 M en agua desionizada (DI) (el volumen debe cubrir el tubo por completo) durante 3 días con agitación a 300 rpm. Cambie la solución de NaCl 1 M 2 veces al día para un total de seis lavados.
- Dializar durante 6 h en agua DI. Cambie el agua DI cada hora para un total de seis lavados.
- Transfiera la reacción a un tubo cónico de 50 ml y congele a -80 °C.
- Liofilizar el tubo durante al menos 72 h a una temperatura inicial de −70 °C y una rampa de temperatura de 0,01 °C/min hasta 0 °C.
- Preparar la muestra para 1RMN-H disolviendo 25 mg de MethMAL en 700 μL de cloroformo-d y transfiérala a un tubo de RMN.
- Adquiera los espectros 1H-RMN.
NOTA: Los espectros en este protocolo se adquirieron utilizando un espectrómetro de 500 MHz con los siguientes parámetros: ancho de barrido = 6,467.3 Hz, retardo de tiempo = 13.1 s, tiempo de adquisición = 5.1 s, tiempo de pulso = 5.1 μs y número de escaneos = 8. - Para el análisis, integre el pico de maleimida como referencia (~6.76 ppm) y luego integre los dos picos de metacrilamida (~5.35 ppm y 5.6 ppm). Divida la proporción de las áreas pico de metacrilamida por el área total de los tres picos para obtener el porcentaje de brazos modificados con metacrilamida.
NOTA: Una modificación aceptable es la sustitución del grupo funcional metacrilamida del 67%-75%. En la Figura 1 se muestra un ejemplo deespectro H-RMN para MethMAL.- Utilice la ecuación (1) como la ecuación de grado de sustitución:
 (1)
(1)
- Utilice la ecuación (1) como la ecuación de grado de sustitución:
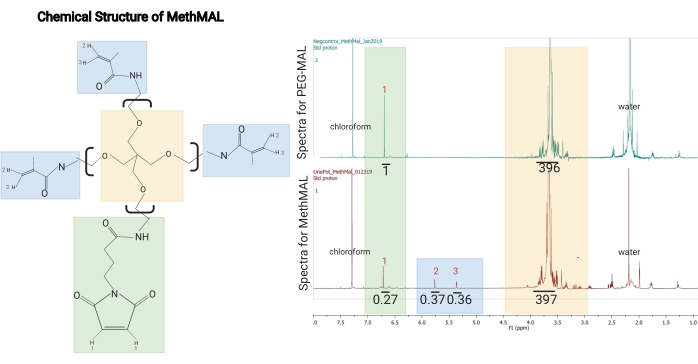
Figura 1: Estructura química y espectro de 1H-RMN de MethMAL. (A) Estructura química: el macrómero recocido MethMAL está compuesto por poli(etilenglicol) de 20 kDa y 4 brazos modificado con tres brazos de metacrilamida. (B) Esta estructura genera picos a 5,36 ppm (3) y 5,76 ppm (2) no presentes en los espectros PEG-MAL, y un brazo de maleimida, que genera un pico a 6,71 ppm (1). El solvente, cloroformo, generó un pico a 7.26 ppm, y el agua residual en esta muestra generó un pico a 2.2 ppm (etiquetado en espectros). En los espectros de MethMAL, el pico de maleimida tenía un área integrada de 0,27, y la suma de las áreas de picos de metacrilamida era 0,73 (0,37 + 0,36). La modificación porcentual de metacrilamida fue del 73% (0,73/(0,27 + 0,73)). Esta figura es de Pfaff et al.14. Derechos de autor (2021) American Chemical Society. Haga clic aquí para ver una versión más grande de esta figura.
2. Cinética de gelificación del precursor del microgel
NOTA: El tiempo de gelificación se puede modificar ajustando el pH del tampón utilizado para disolver los componentes precursores del gel. Para los hidrogeles de PEG-maleimida, un pH más ácido generalmente corresponde a un tiempo de gelificación más lento ya que la concentración de tiolato disminuye a un pH más bajo15.
- Predetermine las concentraciones deseadas de polímero, reticulante y otros componentes precursores del gel (es decir, péptidos, glicosaminoglicanos). Disuelva el PEG-MAL, RGD y MethMAL (PEG-backbone) en 10x PBS (pH 1.5) y el reticulante MMP-2 en 1x PBS (pH 7.4).
NOTA: En este protocolo, la solución precursora de gel es una formulación publicada3, que consta de 45,88 mg/ml de 4 brazos PEG-MAL (10 kDa), 0,82 mg/ml RGD, 8,06 mg/ml de MethMAL y 4,62 mg/ml de reticulación MMP-2 (reticulante enzimáticamente degradable). - Prepare un viscosímetro, o un instrumento equivalente, para monitorear los módulos de almacenamiento y pérdida utilizando un tamaño de espacio de 0.4 mm, una deformación de corte de 1.0, una frecuencia de 1.0 Hz y una duración de 10,800 s.
- Acople una geometría de rotor de placa de 35 mm (P35/Ti). Use una cámara humidificada o una esponja húmeda alrededor de la geometría para mantener un ambiente humidificado.
- Mezcle la red troncal PEG y la reticulación MMP en una relación volumétrica de 1:1.
- Pipetear 400 μL de la solución precursora del gel en el centro de la etapa del viscosímetro.
- Baje lentamente la geometría sobre el escenario hasta que alcance el tamaño de espacio predeterminado de 0,4 mm e inmediatamente comience a monitorear los módulos de almacenamiento (G') y pérdida (G'') durante un máximo de 6 h a temperatura ambiente.
NOTA: Se considera que la gelificación comienza cuando el módulo de almacenamiento se vuelve mayor que el módulo de pérdida, y la gelificación se considera completa cuando el módulo de almacenamiento se estabiliza. En la Figura 2 se muestra una curva cinética de gelificación representativa.
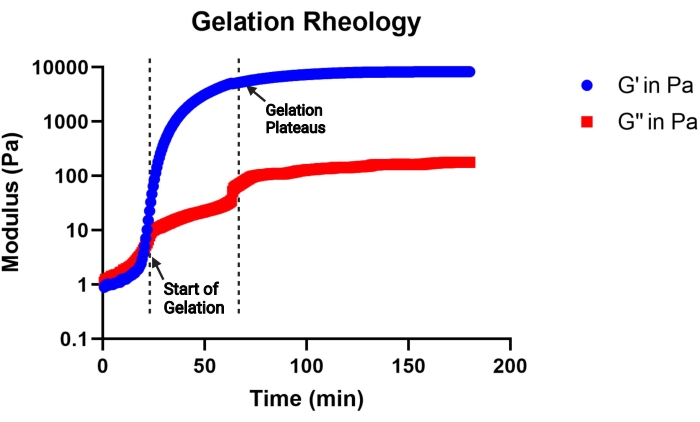
Figura 2: Curva representativa de la cinética de gelificación de una solución precursora de gel MAP (pH 4,5) determinada por un viscosímetro. La gelificación comienza con el rápido aumento del módulo de almacenamiento (G'), y la gelificación se completa cuando la curva G' se estabiliza. G'' indica el módulo de pérdida. Esta cifra es de Pruett et al.3. Derechos de autor (2021) Wiley-VCH GmBH. Haga clic aquí para ver una versión más grande de esta figura.
3. Fabricación de dispositivos microfluídicos
NOTA: Este protocolo describe la fabricación del dispositivo de un diseño de dispositivo de emulsificación por pasos microfluídicos adaptado de Rutte et al.13, que se puede ver en la Figura 3A. Sin embargo, este protocolo se puede utilizar con cualquier diseño de dispositivo que esté grabado en una oblea SU-8. Se recomienda subcontratar la fabricación maestra de obleas de silicio SU-8, a menos que las instalaciones de sala limpia apropiadas estén disponibles para la fabricación.
- Cree el primer dispositivo microfluídico de polidimetilsiloxano (PDMS) a partir de una fotomáscara de oblea SU-8.
- Prepare ~200 g de PDMS mezclando la base y el agente de curado en una proporción de 10:1 p/p (consulte la Tabla de materiales).
- Coloque la oblea SU-8 en una placa de cultivo (pegue los bordes de la oblea a la placa), con el diseño microfluídico hacia arriba.
- Vierta PDMS en el plato para crear una capa de 1-1.5 cm de espesor sobre la oblea. Coloque el plato al vacío para eliminar cualquier burbuja.
- Deje que el PDMS se cure hasta que se solidifique (24 h a temperatura ambiente o ~ 2 h a 60 ° C).
- Una vez que el PDMS se haya curado, use cuidadosamente una cuchilla de afeitar o un bisturí para cortar un rectángulo a través del PDMS, de modo que haya un margen de 0.5-1 cm alrededor del diseño en la oblea.
NOTA: No use demasiada presión y sea muy cuidadoso para evitar dañar (por ejemplo, agrietarse, rayar) la oblea. - Encaje una espátula en uno de los cortes y deslícela a lo largo de los cortes para separar el PDMS de la oblea.
NOTA: A medida que el PDMS se separa de la oblea, comenzará a formarse una burbuja de aire debajo del PDMS (consulte la Figura 3B). - Use la espátula para levantar suavemente el rectángulo de PDMS fuera del plato.
NOTA: El espacio resultante en el PDMS sobre la oblea será el molde para los dispositivos microfluídicos.
- Cree dispositivos microfluídicos PDMS posteriores a partir de la fotomáscara de oblea SU-8.
- Prepare ~ 15-20 g de PDMS por molde mezclando la base y el agente de curado en una proporción de 10: 1.
- Vierta PDMS en el espacio rectangular en el molde para crear una capa de 5 mm de PDMS sobre la oblea. Ponga el molde al vacío para eliminar cualquier burbuja.
- Deje que el PDMS se cure hasta que esté completamente solidificado (24 h a temperatura ambiente o 2 h a 60 °C).
- Una vez que el PDMS se haya curado, use una cuchilla de afeitar o un bisturí para cortar el PDMS alrededor de los bordes del rectángulo.
NOTA: No use demasiada presión y sea muy cuidadoso para evitar dañar (es decir, agrietar) la oblea. - Encaje una espátula en uno de los cortes y deslícela a lo largo de los cortes para separar el PDMS de la oblea.
NOTA: A medida que el PDMS se separa de la oblea, comenzará a formarse una burbuja de aire debajo del PDMS. - Utilice un punzón de biopsia de 1,5 mm para crear orificios a través del rectángulo PDMS en las dos entradas y salidas (consulte la figura 3B).
- Si hay varios dispositivos en una sola oblea, use una espátula o una cuchilla de afeitar para marcar ligeramente el PDMS entre cada dispositivo, luego doble suavemente el PDMS a lo largo de las líneas marcadas para que el PDMS se separe muy limpiamente por sí solo.
- Guarde los dispositivos PDMS en un recipiente libre de polvo.
- Vincule los dispositivos microfluídicos PDMS a portaobjetos de vidrio.
- Prepare un portaobjetos de vidrio por dispositivo microfluídico PDMS. Use cinta adhesiva, aire filtrado o lavados de alcohol isopropílico (IPA) para eliminar cualquier polvo del portaobjetos. Asegúrese de que las diapositivas estén completamente secas antes de pasar al siguiente paso.
- Coloque un portaobjetos de vidrio y un dispositivo PDMS, con el lado del diseño hacia arriba, uno al lado del otro en una pequeña bandeja de plástico (una tapa de placa de 96 pocillos funciona bien para esto) y colóquelo en un limpiador de plasma. Cierre la puerta y la válvula de flujo de aire y encienda la bomba de vacío. Déjelo funcionar durante al menos 30 s y, a continuación, apáguelo.
- Conecte el tubo de gas del tanque de oxígeno a la válvula de flujo de aire. Deje que la cámara de plasma se llene de oxígeno durante 30 s, luego apague el oxígeno y cierre la válvula de flujo de aire.
- Encienda la bomba de vacío y ajuste el nivel de radiofrecuencia (RF) a alto. Espere hasta que la cámara se vuelva de color violeta-rosa (consulte la Figura 3B). Deje pasar 30 s.
- Cuando el temporizador se apague, apague el plasma y el vacío. Luego, abra lentamente la válvula de flujo de aire para liberar el vacío. Retire la bandeja del limpiador de plasma.
- Voltee suavemente el dispositivo PDMS sobre la diapositiva de vidrio para unirlos. A medida que ocurre la unión, observe la ligera diferencia en la transparencia del PDMS.
NOTA: Para obtener los mejores resultados, guarde los dispositivos adheridos a 60 °C hasta inmediatamente antes de su uso.
- Tratamiento de superficies de los dispositivos microfluídicos PDMS
- Preparar el tratamiento superficial diluyendo PFOCTS (tricloro(1H,1H,2H,2H-perfluorooctil)silano) en aceite Novec (1:50). Use 1 ml para 3-4 dispositivos. Transfiera el volumen a una jeringa de 1 ml y coloque una aguja de 25 G.
NOTA: Las agujas utilizadas en este protocolo están biseladas, así que tenga cuidado al manipular objetos punzantes. También se pueden usar agujas romas si se desea. - Corte una pieza de 10-12 cm de tubo Tygon por dispositivo que será tratado.
- Corte un trozo de tubo PEEK, ~7 cm de longitud. Inserte un par de milímetros del tubo PEEK en el extremo del tubo Tygon, como se muestra en la Figura 4A, para ayudar a evitar que la aguja perfore las entradas del tubo Tygon.
- Saque el(los) dispositivo(s) de la cámara calentada e inserte el extremo no PEEK del tubo Tygon en el orificio de entrada acuoso.
- Inserte la aguja de la jeringa de tratamiento de superficie en el tubo PEEK y cubra el orificio de salida de la cámara de aceite (consulte la figura 3B).
- Inyecte el tratamiento en el dispositivo lentamente y asegúrese de que llene el dispositivo, sin burbujas. Espere a que las cámaras acuosas se llenen primero, seguidas de los canales más pequeños y luego la cámara de aceite. Retire el tubo Tygon del dispositivo. Una vez que el dispositivo se haya llenado, déjelo reposar durante 10 minutos a temperatura ambiente.
- Llene una jeringa de 5 ml solo con aceite (sin silano) y coloque una aguja de 25 G.
- Aspire el tratamiento de la superficie fuera del dispositivo a través de las entradas y salidas. Inserte el tubo Tygon en la entrada acuosa, inserte la jeringa con aceite en el tubo PEEK y enjuague cada dispositivo con aceite. Aspire el aceite del dispositivo.
- Repita el lavado de aceite 2 veces más. Retire el tubo Tygon.
NOTA: El dispositivo está listo para ser utilizado.
- Preparar el tratamiento superficial diluyendo PFOCTS (tricloro(1H,1H,2H,2H-perfluorooctil)silano) en aceite Novec (1:50). Use 1 ml para 3-4 dispositivos. Transfiera el volumen a una jeringa de 1 ml y coloque una aguja de 25 G.
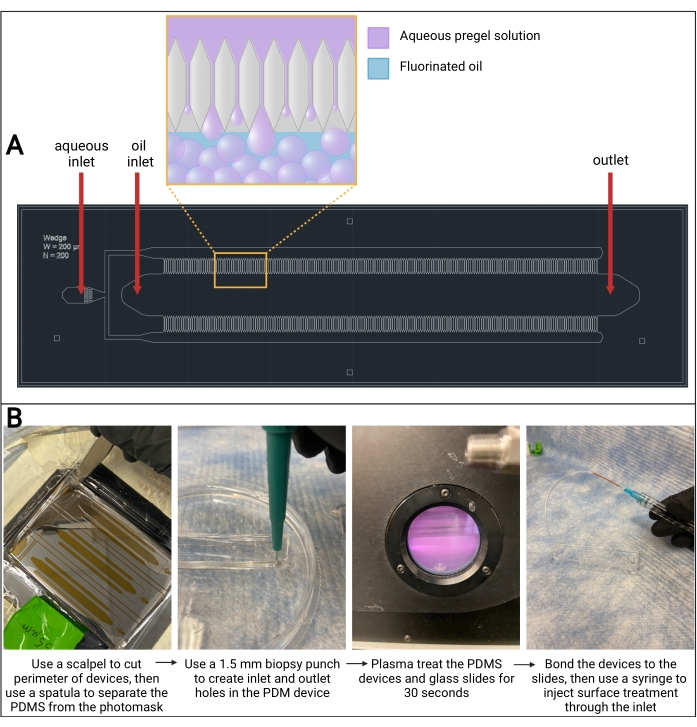
Figura 3: Dispositivo PDMS microfluídico. (A) Diseño asistido por computadora (AutoCAD) dibujo del diseño del dispositivo microfluídico. La formación de gotas de microgel ocurre en los canales a ambos lados del canal de aceite, como se ve en el afloramiento magnificado. (B) Descripción general de la fabricación de dispositivos PDMS. Abreviatura: PDMS = polidimetilsiloxano. Haga clic aquí para ver una versión más grande de esta figura.
4. Generación microfluídica de microgeles
- Predetermine las concentraciones deseadas de polímero, reticulante y otros componentes precursores del gel (es decir, péptidos, glicosaminoglicanos). Disuelva el PEG-MAL, RGD y MethMAL (PEG-backbone) en 10x PBS (pH 1.5) y el reticulante MMP-2 junto con 5 μM de biotina-maleimida en 1x PBS (pH 7.4).
NOTA: En este protocolo, la solución precursora de gel es una formulación publicada3 que consta de 45,88 mg/ml de PEG-MAL de 4 brazos (10 kDa), 0,82 mg/ml de RGD, 8,06 mg/ml de MethLMAL y 4,62 mg/ml de reticulación MMP-2 (reticulante enzimáticamente degradable). Los métodos descritos a continuación producirán ~ 3 ml de microgeles. - Prepare 6 ml de solución de surfactante diluyendo el stock de FluoroSurfactant al 5% a al menos 1% en aceite Novec. Agregue esta solución a una jeringa de 10 ml.
NOTA: El surfactante fluorado es inmiscible con agua, lo que permite que se elimine fácilmente durante la transición del gel a la fase acuosa durante los lavados PBS en la etapa de purificación. - Corte tres piezas de tubo Tygon que tengan una longitud adecuada para la altura de la bomba de la jeringa.
- Corte dos piezas de tubo PEEK, ~ 1 pulgada de largo. Inserte un par de milímetros del tubo PEEK en el extremo de dos piezas del tubo Tygon, como se muestra en la Figura 4A, para ayudar a evitar que la aguja perfore las entradas del tubo Tygon.
- Inserte el extremo no PEEK del tubo Tygon en las entradas de los dispositivos microfluídicos. Inserte la pieza restante del tubo Tygon (sin tubo PEEK en el extremo) en la salida del dispositivo microfluídico, como se muestra en la Figura 4C.
- Agregue al menos 3 ml de aceite a una jeringa de plástico de 5 ml y conéctela a una aguja de 25 g. Inserte cuidadosamente la aguja en el tubo PEEK de una de las entradas Tygon. Enjuague suavemente el tubo y el dispositivo con aceite. Recoja el aceite de la salida en un tubo cónico. Repita el lavado de aceite en la otra entrada Tygon.
- Ajuste las bombas de jeringa a los caudales deseados.
NOTA: Este protocolo utiliza 3 mL/h para el caudal acuoso y 6 mL/h para el caudal de aceite. Es posible que sea necesario utilizar dos bombas de jeringa separadas. - Conecte la jeringa que contiene el surfactante a la entrada de aceite a través de una aguja de 25 G (consulte la figura 4A) y dispense suavemente suficiente aceite para cebar el tubo y el canal de aceite del dispositivo microfluídico.
- Una vez que se hayan configurado el dispositivo y las entradas de aceite, agregue 0,5 ml de aceite a una nueva jeringa de 5 ml, que contendrá el precursor del gel. El propósito de esta pequeña cantidad de aceite es ayudar a eliminar la solución precursora a través del dispositivo microfuilidico hacia el final de la carrera.
- En un tubo cónico, combine 1,5 ml de la solución troncal PEG y 1,5 ml de la solución reticulante. Vortex durante 30 s y transfiera rápidamente la solución combinada de precursor de gel a la jeringa de 5 ml.
- Conecte la jeringa con la solución precursora del gel a la entrada acuosa a través de una aguja de 25 G. Dispense suavemente suficiente solución para cebar el tubo y el canal acuoso.
- Sujete las jeringas a las bombas de jeringa respectivas y presione la función ( consulte la figura 4B). Asegúrese de que haya líquido fluyendo a través de los canales acuoso y de aceite.
NOTA: Se recomienda utilizar un microscopio para visualizar la formación de microgel dentro del dispositivo PDMS. - Busque partículas de tamaño uniforme de los canales (consulte la Figura 4D). Recoja los microgeles de la salida en un tubo cónico.
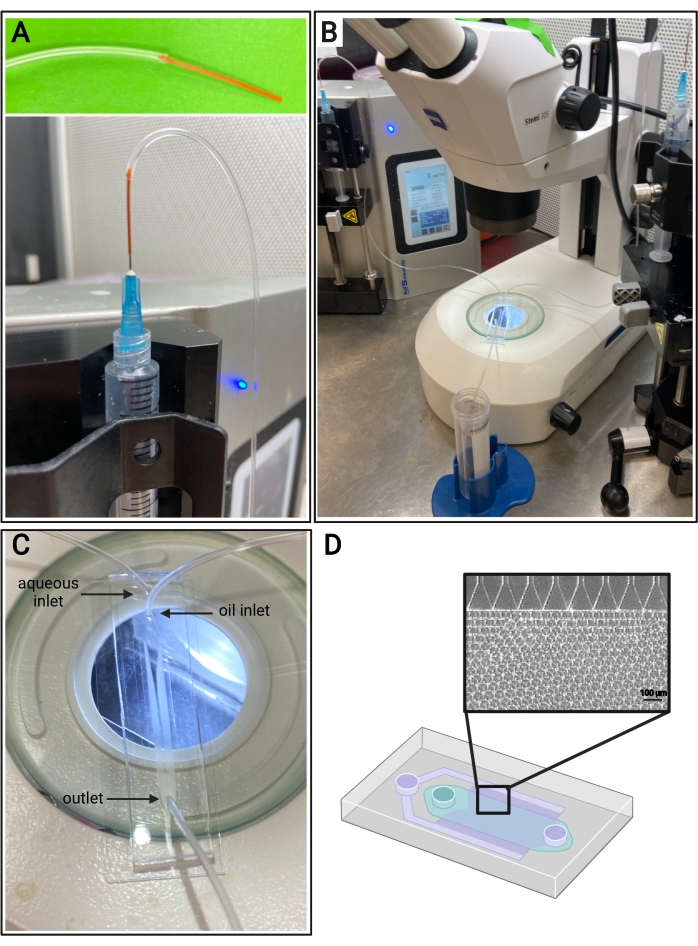
Figura 4: Configuración microfluídica. (A) Representación del método para conectar el tubo PEEK (arriba) y el tubo Tygon a una aguja de 25 G en una jeringa (abajo). (B) Configuración microfluídica con bombas de jeringa, tubos, dispositivos y microscopio. (C) Imagen de la configuración del dispositivo microfluídico, con dos entradas (acuosa y de aceite) y una salida. (D) Esquema del dispositivo microfluídico e imagen representativa de campo claro de la formación esperada de microgel a partir de los canales en un dispositivo de emulsificación escalonada. Haga clic aquí para ver una versión más grande de esta figura.
5. Purificación y esterilización de microgeles
- Una vez completada la gelificación (determinada como el tiempo hasta la meseta del módulo de almacenamiento en la caracterización cinética de gelificación), utilice una pipeta para eliminar cuidadosamente la fase oleosa del fondo del tubo (consulte la figura 5). Deposite esto en un contenedor de residuos apropiado para residuos fluorados.
NOTA: El tiempo de gelificación puede acelerarse agregando una base soluble orgánica al tubo de recolección (por ejemplo, trietilamina), pero es importante tener en cuenta que la adición de una base fuerte puede hidrolizar cualquier maleimida no reaccionada. Si se desea funcionalizar microgeles a través del exceso de maleimidas después de la gelificación, omita la adición de trietilamina. - Agregue más aceite en el tubo de recolección de microgel en una proporción de 1: 1. Mezclar invirtiendo suavemente el tubo de recolección. No vorágice.
- Deje que el tubo de recolección se asiente durante ~ 5 minutos para permitir que las fases se separen. Busque la fase oleosa en la parte inferior y la fase acuosa (los microgeles) en la parte superior (consulte la figura 5).
- Repita los lavados con aceite al menos 2 veces más.
- Agregue más aceite en una proporción de 1: 1 con el gel y agregue 1x PBS en una proporción de PBS a gel de 4: 1. Invertir para mezclar varias veces. Para separar las capas, centrifugar el tubo a ~2,000 x g durante ~30 s. Busque la fase oleosa en la parte inferior del tubo, el gel en el medio y PBS en la parte superior (consulte la figura 5).
- Retire la fase oleosa con una pipeta y deséchela en un contenedor de residuos.
NOTA: No quite el PBS. Use un tubo cónico más grande para continuar los lavados si el tubo de recolección original era de 15 ml. - Repita el aceite y PBS lava 2 veces más. Busque que el gel pase de opaco a claro por el lavado final, como se muestra en la Figura 5, lo que indica que el surfactante se eliminó y el gel está en la fase PBS.
- Retire todo el aceite. No retire PBS del tubo cónico.
- En una campana extractora de humos químicos, use una pipeta de vidrio para agregar hexanos al tubo a un volumen igual al PBS. Vortex el tubo cónico durante 30 s o hasta que se mezcle bien. Centrifugadora a 4.696 x g durante 5 min.
- Después de la separación, busque hexanos en la capa superior, PBS en el medio y gel en la parte inferior (consulte la Figura 5). Retire la capa de hexano y deséchela en un recipiente para residuos orgánicos. Aspirar el PBS.
- Repita los lavados de hexano y PBS al menos 2 veces más o hasta que el gel parezca casi translúcido (consulte la Figura 5). Lave el gel con PBS 1 vez más para que se eliminen los hexanos restantes. Centrifugadora a 4.696 x g durante 5 min. Aspirar la capa PBS. Tenga cuidado de no alterar el gránulo de gel.
- Para tapar o apagar cualquier maleimida sin reaccionar en los microgeles, prepare una solución de 100 mM de N-acetil-L-cisteína en 1x PBS y agregue esta solución al gel. Colocar en un rotador de tubo a 37 °C durante la noche, seguido de muchos lavados con PBS para eliminar la N-acetil-L-cisteína sin reaccionar.
- Para el almacenamiento a largo plazo (hasta 1 año), resuspender los microgeles en 70% IPA y almacenar a 4 °C para ayudar a prevenir el crecimiento de bacterias en los microgeles.
- Para esterilizar los microgeles, agregue 70% de IPA al gel en una proporción de 4: 1 v / v en una campana de bioseguridad. Vortex el tubo durante 30 s, luego centrifugar a 4.696 × g durante 5 min. Aspire el sobrenadante IPA del gránulo de gel en una campana de bioseguridad. Realice 2 veces más lavados IPA seguidos de 3 lavados con 1x PBS estéril.
NOTA: Toda la IPA debe eliminarse antes de usar el gel con células o animales.
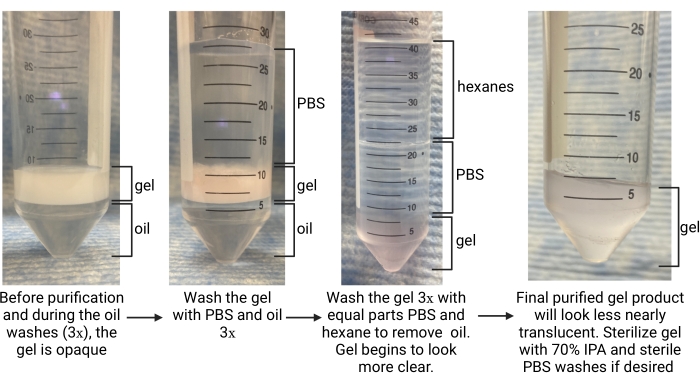
Figura 5: Descripción general del procedimiento de purificación de microgeles. Abreviaturas: PBS = solución salina tamponada con fosfato; IPA = alcohol isopropílico. Haga clic aquí para ver una versión más grande de esta figura.
6. Caracterización del tamaño del microgel
NOTA: Se recomienda permitir que las partículas de microgel se equilibren en 1x PBS durante la noche a 37 °C para hincharse hasta su diámetro final antes del dimensionamiento.
- Partículas de gel de imagen.
- Girar el gel MAP a 4.696 × g durante 5 min y aspirar el sobrenadante.
- Con una pipeta de desplazamiento positivo, extraer 5 μL de microgeles del gránulo de gel y diluir en 1 ml de PBS en un tubo de microcentrífuga (dilución 1:200). Ajuste esta dilución según sea necesario.
NOTA: Durante la formulación de la solución precursora de gel, se pueden agregar 5 μM de biotina-maleimida y usarlos como alternativa al etiquetado de microgeles con un fluoróforo. En este caso, se puede agregar un fluoróforo de estreptavidina a una dilución de 1:300 (a partir de 1 mg/ml). Permita la incubación con estreptavidina durante al menos 15 minutos antes de la obtención de imágenes. - Con una pipeta de desplazamiento positivo, transfiera 100 μL de los microgeles diluidos a los pocillos de una placa transparente de 96 pocillos.
- Utilice un microscopio de campo amplio o confocal para visualizar los microgeles con un objetivo de 10x. Adquirir imágenes de los microgeles para su análisis.
- Consulte la Figura 6 para obtener imágenes confocales representativas de microgeles.
- Dimensionamiento de partículas con ImageJ
- Abra los archivos de imagen desde el microscopio en ImageJ.
- Seleccione Analizar | Establezca Escala y establezca la escala de la imagen de acuerdo con el objetivo del microscopio.
- Seleccione | de imagen Tipo | 8 bits.
- Seleccione | de imagen Ajustar | Umbral y luego seleccione la opción de umbral automático "Otsu" en el cuadro desplegable.
- Haga clic en Analizar | Establezca Medidas y seleccione Diámetro de Feret y límite al umbral.
- Haga clic en Analizar | Analice las partículas e introduzca el rango de tamaño de área (en píxeles ^ 2) esperado para los microgeles (para excluir pequeños residuos de ser analizados). Cambie la circularidad a 0,75-1,00 y seleccione Mostrar | Contornos. Compruebe los resultados de visualización y excluya en los bordes.
NOTA: El filtro de forma de circularidad excluye los microgeles en el borde de la imagen que pueden producir una medición de diámetro inexacta. - Ejecute el módulo Analizar partículas .
- Espere la salida, que es el diámetro de Feret de cada partícula, y exporte estos resultados a una hoja de cálculo.
- En este protocolo, calcule el índice de polidispersidad (PDI) para determinar la heterogeneidad en el tamaño del microgel. Analizar al menos 100 microgeles para definir una población: un rango PDI de 1.00-1.05 define una población monodispersa, y un PDI mayor que 1.05 define una población polidispersa. Utilice la ecuación (2), la ecuación (3) y la ecuación (4) para calcular el PDI, como se describe a continuación.
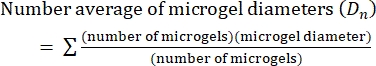 (2)
(2) (3)
(3)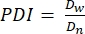 (4)
(4)

Figura 6: Imágenes representativas de microgeles. (A) Imagen confocal fluorescente de la población de microgel A, (B) imagen de microgeles umbrales y (C) contornos de partículas después del análisis de ImageJ. (D) Imagen confocal fluorescente de la población B de microgel y (E) imagen de luz transmitida de microgeles (los microgeles son casi translúcidos). (F) Representación de resultados representativos del análisis de ImageJ descrito en este protocolo. Ambas poblaciones de microgel tienen PDI relativamente monodispersas. Ambas poblaciones de microgeles se sintetizaron con un caudal acuoso de 3 mL/h y un caudal de aceite de 6 mL/h. Sin embargo, la diferencia en el tamaño del microgel se debe a las diferencias en el tamaño del paso del dispositivo microfluídico. Por ejemplo, la población de microgel A se sintetizó con un dispositivo microfluídico con un tamaño de paso de canal de 11 μm, y la población de microgel B se sintetizó en un dispositivo con un tamaño de paso de 40 μm. Barras de escala = 100 μm. Abreviatura: PDI = índice de polidispersidad. Haga clic aquí para ver una versión más grande de esta figura.
7. Recocido de andamios de partículas recocidas microporosas (MAP)
- Crear una solución madre de 2 mM de fenil-2,4,6-trimetilbenzoilofinato de litio (LAP) en 1x PBS (pH 7.4).
- Diluir la solución madre de LAP a 0,2 mM en un volumen de 1x PBS equivalente al volumen de gel. Si utiliza el fotoiniciador LAP para estudios celulares o estudios en animales, asegúrese de esterilizar la solución antes de usarla.
- Girar el gel MAP a 4.696 × g durante 5 min y aspirar el sobrenadante.
- Con una pipeta de desplazamiento positivo, transfiera el volumen deseado de gel a un tubo de microcentrífuga.
- Agregue 0.2 mM LAP al gel en una relación volumétrica de 1: 1 (la concentración final de LAP es de 0.1 mM).
- Vortex la mezcla e incubar durante al menos 15 minutos en la oscuridad.
- Centrifugar la mezcla a 18.000 × g durante 5 min para granular el gel.
- Retire con cuidado el sobrenadante del gránulo de gel.
- Transfiera el gel MAP a la ubicación objetivo con una pipeta de desplazamiento positivo.
- Aplique luz enfocada (365 nm, 8.66mW/cm2) a la muestra durante 113 s para recocir el andamio.
NOTA: El tiempo de recocido de 113 s se ha optimizado como se publicó anteriormente para una concentración de LAP de 0,1 mM14, pero puede ser necesaria una optimización adicional para diferentes concentraciones de fotoiniciadores.
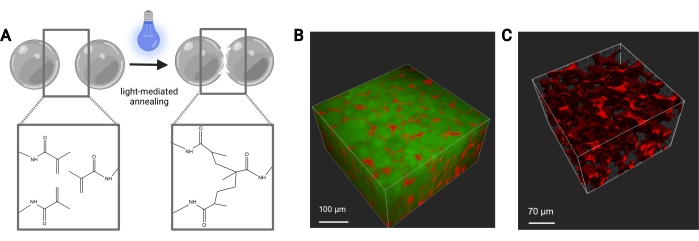
Figura 7: Recocido de andamios MAP. a) Esquema del recocido de andamios MAP. Cuando se exponen a un fotoiniciador y a la luz, los grupos funcionales de metacrilamida en el macrómero MethMAL se someten a una reacción de fotopolimerización por clic, que une las superficies de los microgeles. (B) Representación de una representación 3D (Imaris) de una imagen de microscopio de dos fotones de microgeles MAP (verde) recocidos juntos en forma de disco 3D, con dextrano (rojo) en los poros. (C) Representación de una representación 3D (Imaris) de una imagen de microscopio de dos fotones que muestra la porosidad de un andamio MAP que ha sido perfundido con dextrano fluorescente de 70 kDa (rojo). Barras de escala = (B) 100 μm, (C) 70 μm. Abreviaturas: MAP = partícula recocida microporosa; MethMAL = macrómero de recocido personalizado. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El objetivo de este protocolo es describir todos los pasos necesarios para sintetizar bloques de construcción de microgel que se utilizarán en un andamio MAP. El macrómero recocido MethMAL es altamente selectivo y eficiente y es compatible con múltiples redes troncales de polímeros14. Es importante que al menos el 67%-75% de la PEG-maleimida de 20 kDa se modifique con grupos funcionales de metacrilamida para garantizar una alta eficiencia de recocido. La modificación porcentual se puede determinar más fácilmente analizando los picos de espectros de 1H-RMN, como se muestra en la Figura 1. La cinética de gelificación, determinada por un viscosímetro, es una métrica importante a considerar para cada formulación de gel. Este protocolo utiliza una solución precursora de gel que consiste en una columna vertebral PEG con un grupo MAL, que reacciona eficientemente con reticulantes funcionalizados con tiol para la gelificación de microgel. Sin embargo, muchas químicas de hidrogel se pueden utilizar para fabricar microgeles a través del método microfluídico de alto rendimiento descrito en este documento. El tiempo hasta el inicio de la gelificación proporcionará información sobre la duración de la generación de microgel microfluídico. Se recomienda elegir un pH precursor del gel que pueda iniciar la gelificación entre 30 min (Figura 2) y 2 h.
Si el tiempo de gelificación es demasiado rápido, la solución precursora de gel comenzará a polimerizarse dentro del dispositivo microfluídico y obstruirá los canales. Además, es importante tener en cuenta que el cambio de las concentraciones de ligando tiolado (por ejemplo, RGD) puede tener impactos en la formación de la red durante la gelificación y puede ser necesario tener en cuenta ajustando la formulación. Los pasos de fabricación del dispositivo microfluídico pueden ser tediosos, pero los resultados representativos de un dispositivo unido con éxito se muestran en la Figura 3. Este protocolo utiliza un dispositivo microfluídico de emulsificación escalonada, paralelizado y de alto rendimiento que fue adaptado de un diseño de Rutte et al.13, y la fabricación de obleas de silicio se subcontrató a una empresa de tecnología microfluídica. Sin embargo, los pasos descritos en este protocolo se pueden usar con cualquier diseño de dispositivo grabado en una fotomáscara de oblea de silicio SU-8. Es importante tener en cuenta que el tamaño de paso de los canales en la fotomáscara debe optimizarse durante la fabricación del dispositivo, ya que afectará el tamaño de las partículas de microgel.
Los caudales para la generación microfluídica de microgeles deben optimizarse para cada formulación de gel en función de factores como el tiempo de gelificación, el tamaño de partícula deseado y el diseño del dispositivo microfluídico. Si se utiliza el dispositivo de alto rendimiento, los caudales para la fase acuosa pueden llegar hasta 5 ml / h. La figura 4B muestra la configuración de los dispositivos de alto rendimiento utilizados en este protocolo. Si el dispositivo funciona correctamente, la formación de microgel debe ser similar a la que se muestra en la Figura 4D. Antes de la purificación, los microgeles serán opacos. Después de completar los diversos lavados de aceite, PBS y hexano, el gel debe verse claro como la imagen representativa en la Figura 5. Si se incorpora un fluoróforo en los microgeles, el producto purificado puede tener un ligero tinte de color, pero aún debe estar cerca de translúcido. Después de la purificación y la hinchazón, los microgeles deben ser de tamaño muy uniforme y tener un PDI entre 1.00 y 1.05, como se muestra en la Figura 6. Se pueden utilizar varios fotoiniciadores para el fotorecocido de andamios MAP. Si se utiliza una alternativa a la LAP, descrita en este documento, se debe determinar la cinética de recocido como se describió anteriormente14. Además, se pueden usar varias fuentes de luz para el fotorecocido, siempre que la fuente de luz se corresponda con el fotoiniciador. Uno debe asegurarse de calibrar y enfocar la fuente de luz. El tiempo de recocido y la intensidad de la luz pueden necesitar ser optimizados en función de la formulación del gel y la concentración del fotoiniciador. El método de recocido descrito en este protocolo se puede utilizar para estudios in vitro e in vivo. Después del recocido, los microgeles formarán un andamio poroso que se puede visualizar con microscopía de dos fotones (Figura 7B-C).
Discusión
Este protocolo describe métodos para sintetizar y caracterizar microgeles, que sirven como bloques de construcción para andamios de partículas recocidas microporosas (MAP). Este protocolo utiliza un enfoque microfluídico de alto rendimiento para generar grandes volúmenes de microgeles uniformes, lo que no se puede lograr con otros métodos como la microfluídica de enfoque de flujo 1,4,7,9 (alta monodisperisidad, bajo rendimiento), emulsión por lotes 6,10 y electropulverización 5,12 (baja monodispersidad, alto rendimiento). Con los métodos descritos en la presente invención, se pueden fabricar microgeles monodispersos para su uso en andamios MAP que se pueden usar para una variedad de aplicaciones de medicina regenerativa (por ejemplo, administración celular, cicatrización de heridas).
Un paso crítico de este protocolo es la creación de los dispositivos microfluídicos PDMS. Si los dispositivos no se fabrican correctamente, esto podría tener efectos negativos posteriores en la formación de microgel y la monodispersión. Es importante evitar la introducción de artefactos (es decir, burbujas, polvo) en el PDMS antes de que se cure, ya que esto podría obstruir los canales y afectar significativamente la formación de microgel. Para mitigar esto tanto como sea posible, uno debe usar cinta adhesiva para eliminar el polvo, almacenar los dispositivos en un recipiente libre de polvo y trabajar en una capucha libre de polvo, si es posible. También se recomienda almacenar los dispositivos a 60 °C para obtener los mejores resultados con el tratamiento de la superficie.
Al verter los dispositivos PDMS, es importante mantener un grosor uniforme que sea aproximadamente igual o menor que la longitud del punzón de biopsia. Si el dispositivo es demasiado grueso, el punzón de biopsia no podrá penetrar hasta el final. También es crucial no romper las entradas/salidas del dispositivo PDMS mientras se perfora con el punzón de biopsia y/o se inserta un tubo. Un desgarro en el dispositivo PDMS causará fugas de las entradas / salidas, lo que puede causar la pérdida de la solución precursora de gel. Si hay fugas en un dispositivo PDMS, la mejor solución es reemplazarlo con un nuevo dispositivo lo más rápido posible.
Al tratar con plasma el dispositivo, el uso de oxígeno puro y el tratamiento con plasma durante 30 s ha producido los mejores resultados para adherir PDMS al portaobjetos de vidrio. Si el dispositivo no se adhiere correctamente (es decir, el PDMS aún se puede levantar del portaobjetos de vidrio después del tratamiento con plasma), se debe verificar que el tratador de plasma funcione correctamente y que el dispositivo y los portaobjetos se hayan limpiado a fondo. También es importante utilizar el tratamiento superficial de silano correcto y, para obtener los mejores resultados, los dispositivos PDMS deben tratarse directamente antes de su uso. También podrían utilizarse otros métodos de tratamiento de superficies, como la deposición química de vapor.
Otro paso crucial es utilizar correctamente los dispositivos microfluídicos PDMS para la formación de microgeles. Se recomienda utilizar una relación de caudal de al menos 2:1 (este protocolo utiliza un caudal de aceite de 6 ml/h y un caudal acuoso de 3 mL/h), pero esto se puede ajustar para lograr el tamaño de microgel deseado. El pH de la solución precursora de microgel también es una métrica importante a optimizar para evitar la obstrucción del dispositivo. La solución salina tamponada con fosfato (PBS) acelera la formación de tiolatos en la química de adición de tipo Michael, y las concentraciones de PBS utilizadas en este protocolo producen los mejores resultados para la gelificación de microgel en los dispositivos microfluídicos. Una vez que se inician las bombas de jeringa, puede haber algunas burbujas en los canales microfluídicos, pero esto debería equilibrarse después de unos minutos. Se recomienda controlar la formación de microgel con un microscopio. Si el flujo no se ve similar al de este video y / o hay algunos canales que producen partículas grandes, es probable que esto se deba a problemas con el paso de tratamiento de la superficie. La mejor solución es reemplazar el dispositivo por uno que haya sido recién tratado en la superficie.
Si los microgeles parecen estar fusionándose, esto puede deberse a una concentración insuficiente de fluorosurfactante. La solución recomendada es aumentar el % en peso del surfactante en la fase oleosa. Sin embargo, una limitación para usar altas concentraciones de surfactante es que puede ser más difícil de eliminar durante la etapa de purificación. Se recomienda usar dispositivos microfluídicos una sola vez, pero los dispositivos se pueden reutilizar si se lavan con aceite Novec inmediatamente después de su uso para eliminar cualquier solución acuosa que pueda gelificar el dispositivo y obstruir los canales. Mientras que un dispositivo microfluídico puede producir un volumen de alto rendimiento de microgeles (ml / h), esta tasa de producción se puede escalar mediante el uso de múltiples dispositivos microfluídicos en paralelo.
El paso de recocido del conjunto de andamio MAP se basa en el uso de un fotoiniciador activado por luz de polimerización radical, y el fotoiniciador se puede seleccionar en función de la aplicación deseada. Por ejemplo, el fotoiniciador LAP tiene tiempos de recocido rápidos (<30 s) cuando se utiliza luz UV de onda larga, lo que tiene un impacto mínimo en la viabilidad celular in vitro14. Sin embargo, esta longitud de onda es altamente absorbida por el tejido16 y puede no tener una eficacia de recocido tan alta in vivo como in vitro.
La eosina Y es otro fotoiniciador activado por longitudes de onda visibles (505 nm) y tiene una penetración más profunda en el tejido, lo que mejora la capacidad del andamio MAP para ser recocido debajo del tejido. Sin embargo, los largos tiempos de exposición a la luz necesarios para el recocido de eosina Y pueden prolongar la exposición celular a los radicales libres e impactar la viabilidad celular in vitro14. El uso de estos métodos para la generación de alto rendimiento de bloques de construcción de microgel altamente uniformes acelerará la investigación centrada en andamios MAP y avanzará en el conocimiento en el campo de los materiales porosos inyectables para la medicina regenerativa.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores desean agradecer a Joe de Rutte y al Laboratorio Di Carlo de la Universidad de California, Los Ángeles, por su ayuda con el diseño original del dispositivo microfluídico a partir del cual se desarrolló el dispositivo informado, así como su orientación temprana en la fabricación y solución de problemas del dispositivo PDMS. Los esquemas de las figuras se crearon con Biorender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-aminoethanethiol hydrochloride | Acros Organics | AC153770250 | For MethMal Synthesis MW: 113.61 Da |
| 35 mm plate rotor | HAAKE | P35/Ti | Geometry for HAAKE viscometer |
| 4-arm PEG-Maleimide (10 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-100MA | For microgel precursor solution |
| 4-arm PEG-Maleimide (20 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-200MA | For MethMal Synthesis Molecular weight specific to each batch |
| BD Syringe with Luer-Lok Tips | Becton Dickinson | Disposable plastic syringes | |
| Biopsy punch | Mitex | MLTX33-31A-P/25 | 1.5 mm diameter |
| Chloroform-d | Acros Organics | AC209561000 | For MethMal Synthesis |
| Collimated LED Light Source | ThorLabs | M365LP1-C1 | 365 nm |
| Culture dish (15 cm) | Corning | CLS430599 | 150 mm x 25 mm |
| DMTMM(4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride) | Oakwood Chemical | 151882 | For MethMal Synthesis MW: 276.72 Da |
| Fluorosurfactant | Ran Technologies | 008-Flurosurfactant-5wtH-200G | 5 weight percent of 008-Flurosurfactant in HFE7500 |
| FreeZone Triad Freeze Dry System | Labconco | 7400000 Series | For MethMal Synthesis Lyophilizer |
| Glass slides | Fisher Scientific | 12-550-A3 | Plain glass slides, uncoated |
| HAAKE Rheowin viscometer | HAAKE | ||
| ImageJ | version 1.8.0_172 | ||
| KDS Legato 210 Dual Prong Syringe Pump | Kd Scientific | ||
| LED Driver | ThorLabs | DC2200 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | Photoinitiator |
| Methacrylic Acid | Sigma Aldrich | 155721 | For MethMal Synthesis MW: 86.09 Da Density: 1.015g/mL |
| Microfluidic device SU8-Si master wafer | FlowJem | N/A | Custom-made, with silanization |
| MMP-2 degradable crosslinker | FlowJem | Sequence: Ac-GCGPQGIAGQDGCG-NH2 | |
| Needles (25 G, beveled) | BD | 305122 | Length: 15.88 mm Gauge: 0.5 mm |
| Novec 7500 | 3M | 7100025016 | Fluorinated oil |
| Oxygen | Praxair | UN1072 | Compressed |
| Peek tubing | Trajan Scientific | 03-350-523 | 1/32" Outer Diameter; 0.02" Inner Diameter; 10' Length |
| PFOCTS (trichloro(1H,1H,2H,2H-perfluorooctyl)silane) | Sigma-Aldrich | 448931 | For surface treatment |
| Phosphate Buffered Saline | Fisher BioReagants | BP3994 | Diluted to 1x in ultrapure water, pH = 7.4 |
| Plasma cleaner | Harrick Plasma | PDC-001-HP | |
| Razor blade | Fisher Scientific | 12-640 | |
| RGD cell adhesive peptide | WatsonBio Sciences | Sequence: Ac-RGDSPGGC-NH2 | |
| Rheowin software | HAAKE | Software compatible with HAAKE viscometer | |
| Scalpel blade | Bard-Parker | 371210 | Size: #10 |
| Scalpel handle | Bard-Parker | 371030 | Size: #3 |
| Sodium Chloride | Fisher BioReagents | BP358-1 | For MethMal Synthesis MW: 58.44 Da |
| Sylgard 184 silicone elastomer kit | DOW Chemical | 2065622 | Base and curing agent |
| Triethylamine | Fisher Scientific | O4884-100 | For MethMal Synthesis MW: 101.19 Da Density: 0.73g/mL |
| Tygon tubing | Saint Gobain Performance Plastics | AAD04103 | ID: 0.51 mm OD: 1.52 mm |
| Varian Inova 500 Spectrometer | Varian | NMR Located in the UVA Biomolecular Magnetic Resonance Facility |
Referencias
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147(2019).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Advanced Functional Materials. 31 (35), 2104337(2021).
- Darling, N. J., Sideris, E., Hamada, N., Carmichael, S. T., Segura, T. Injectable and spatially patterned microporous annealed particle (MAP) hydrogels for tissue repair applications. Advanced Science. 5 (11), 1801046(2018).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science and Engineering. 5 (12), 6395-6404 (2019).
- Pruett, L., et al. Development of a microporous annealed particle hydrogel for long-term vocal fold augmentation. Laryngoscope. 130 (10), 2432-2441 (2020).
- Nih, L. R., Sideris, E., Carmichael, S. T., Segura, T. Injection of microporous annealing particle (MAP) hydrogels in the stroke cavity reduces gliosis and inflammation and promotes NPC migration to the lesion. Advanced Materials. 29 (32), (2017).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Schaeffer, C., et al. Injectable microannealed porous scaffold for articular cartilage regeneration. Annals of Plastic Surgery. 84, 6S Suppl 5 446-450 (2020).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Jivan, F., Alge, D. L. Bio-orthogonal, site-selective conjugation of recombinant proteins to microporous annealed particle hydrogels for tissue engineering. Advanced Therapeutics. 3 (1), 1900148(2020).
- de Rutte, J. M., Koh, J., di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomaterials Science and Engineering. 7 (2), 422-427 (2021).
- Darling, N. J., Hung, Y. S., Sharma, S., Segura, T. Controlling the kinetics of thiol-maleimide Michael-type addition gelation kinetics for the generation of homogenous poly(ethylene glycol) hydrogels. Biomaterials. 101, 199-206 (2016).
- Sandell, J. L., Zhu, T. C. A review of in-vivo optical properties of human tissues and its impact on PDT. Journal of Biophotonics. 4 (11-12), 773-787 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados