Method Article
Synthèse microfluidique de blocs de construction de microgel pour échafaudage de particules microporeuses recuites
Dans cet article
Résumé
Ce protocole décrit un ensemble de méthodes de synthèse des blocs de construction de microgel pour les échafaudages de particules microporeuses recuites, qui peuvent être utilisés pour une variété d’applications de médecine régénérative.
Résumé
La plate-forme d’échafaudage à particules microporeuses recuites (MAP) est une sous-classe d’hydrogels granulaires. Il est composé d’une boue injectable de microgels qui peut former un échafaudage structurellement stable avec une porosité à l’échelle cellulaire in situ après une étape secondaire de réticulation chimique à base de lumière (c.-à-d. recuit). L’échafaudage MAP a montré du succès dans une variété d’applications de médecine régénérative, y compris la cicatrisation des plaies cutanées, l’augmentation des cordes vocales et l’administration de cellules souches. Cet article décrit les méthodes de synthèse et de caractérisation des microgels de poly(éthylène glycol) (PEG) comme éléments constitutifs pour former un échafaudage MAP. Ces méthodes comprennent la synthèse d’un macromère de recuit personnalisé (MethMAL), la détermination de la cinétique de gélification des précurseurs de microgel, la fabrication de dispositifs microfluidiques, la génération microfluidique de microgels, la purification de microgel et la caractérisation de base des échafaudages, y compris le dimensionnement des microgels et le recuit d’échafaudage. Plus précisément, les méthodes microfluidiques à haut débit décrites ici peuvent produire de grands volumes de microgels qui peuvent être utilisés pour générer des échafaudages MAP pour toute application souhaitée, en particulier dans le domaine de la médecine régénérative.
Introduction
La plateforme d’échafaudage MAP est un biomatériau injectable composé entièrement de microparticules d’hydrogel (microgels) qui fournissent une microporosité à l’échelle cellulaire lorsqu’elles sont réticulées, ce qui permet une migration cellulaire indépendante de la dégradation et une intégration tissulaire en vrac1. En raison de sa capacité à s’intégrer rapidement au tissu hôte et de son immunogénicité intrinsèquement faible, la plateforme d’échafaudage MAP a démontré son applicabilité préclinique à une grande variété de thérapies de médecine régénérative 2,3,4,5,6,7,8,9,10, y compris l’accélération de la cicatrisation des plaies cutanées 1,3 ,11, revascularisation de la cavité cérébrale7, administration de cellules souches mésenchymateuses2 et gonflement des tissus pour traiter l’insuffisance glottique6. Il a également été démontré que la MAP transmet des effets anti-inflammatoires au tissu hôte par le recrutement de macrophages M23 et peut même être réglée pour favoriser une réponse immunitaire Th2 « réparation tissulaire »8. Ces propriétés favorables de la plateforme d’échafaudage MAP lui permettent d’être étendue à un large éventail d’applications cliniques.
Les méthodes précédemment publiées pour générer des microgels pour la formation d’échafaudages MAP comprenaient la microfluidique à gouttelettesfocalisant l’écoulement 1,4,7,9, l’électropulvérisation 5,12 et la filature aérienne avec émulsion discontinue 6,10. La méthode microfluidique par gouttelettes peut produire des particules à forte monodispersité, mais utilise des débits très lents qui produisent de faibles rendements de particules (μL/h). Alternativement, les méthodes d’électropulvérisation et d’émulsion discontinue peuvent produire un volume élevé de particules, mais avec une polydispersité élevée des particules. Ce protocole utilise une méthode microfluidique à haut débit pour produire des microgels avec une population monodispersée, basée sur les travaux de de Rutte et al13. Cette méthode utilise des techniques de lithographie douce pour fabriquer un dispositif microfluidique polydiméthylsiloxane (PDMS) à partir d’un photomasque, qui est ensuite collé à une lame de verre. La conception du dispositif repose sur une émulsification par étapes pour générer un volume élevé de particules de microgel (mL/h). La monodispersité qui peut être obtenue avec cette méthode offre un contrôle supérieur de la porosité par rapport à d’autres techniques, car les microgels monodispersés peuvent former des échafaudages avec des tailles de pores plus uniformes2.
Les méthodes de synthèse et de caractérisation des microgels individuels qui peuvent servir de blocs de construction pour les échafaudages MAP sont décrites dans ce manuscrit, en particulier en termes de création de microgels constitués d’un squelette PEG avec un groupe maléimide (MAL), qui participe facilement à l’addition efficace de type Michael avec des réticulateurs fonctionnalisés au thiol pour la gélification de microgel. Pour découpler la gélification microgel du recuit d’échafaudage MAP, ce manuscrit décrit également comment synthétiser un macromère de recuit personnalisé publié à14 reprises, MethMAL, qui est un macromère PEG hétérofonctionnel méthacrylamide / maléimide à 4 bras. Les groupes fonctionnels méthacrylamide participent facilement à la photopolymérisation radicalaire (pour le recuit sur microgel), tout en restant relativement inertes aux conditions qui favorisent l’addition de type Michael pour les groupes fonctionnels MAL.
De plus, ce manuscrit décrit les protocoles de création de dispositifs microfluidiques PDMS, de détermination de la cinétique de gélification des microgels et de caractérisation de la taille du microgel. La dernière partie du manuscrit détaille le recuit d’échafaudage MAP, c’est-à-dire lorsque les microgels sont transférés in situ dans un échafaudage en vrac par une étape de réticulation secondaire, photo-initiée, qui lie de manière covalente les surfaces des microgels ensemble. Il est important de noter qu’il existe d’autres méthodes de recuit qui peuvent être mises en œuvre dans les systèmes d’échafaudage MAP qui ne reposent pas sur des produits chimiques à base de lumière, telles que le recuit à médiation enzymatique, comme décrit précédemment1. Dans l’ensemble, ces méthodes peuvent être utilisées directement ou avec différentes chimies de formulation d’hydrogel (par exemple, à base d’acide hyaluronique) pour générer des échafaudages MAP pour n’importe quelle application.
Protocole
1. Synthèse des macromères de recuit MethMAL
REMARQUE: Ce protocole est spécifiquement destiné à modifier 1 g de PEG-maléimide, mais peut être mis à l’échelle pour faire des lots plus importants.
- Ajouter 1 g de 4 bras 20 kDa PEG-maléimide à 10 mL de 1x solution saline tamponnée au phosphate (PBS, pH 7,4) dans un petit bécher en verre muni d’une barre d’agitation. Remuer la solution à 300 tr/min jusqu’à ce que le PEG soit complètement dissous (~30 min).
- Ajouter 14,65 mg de 2-aminoéthanéthiol (rapport molaire thiol [SH] 0,67:1 à maléimide [MAL]) à la réaction sous agitation à 300 rpm.
REMARQUE: Les groupes thiol sur le 2-aminoéthanéthiol seront ajoutés à environ trois bras du PEG-MAM par addition de type Michael, laissant des groupes d’extrémité amine.- Observez l’exemple de calcul suivant pour la quantité de 2-aminoéthanéthiol à ajouter:
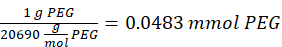
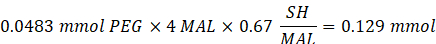
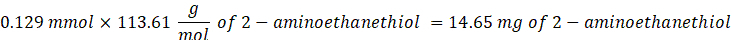
REMARQUE: Pour éviter de mesurer une très petite quantité, dissoudre 100 mg de 2-aminoéthanéthiol dans 1 mL de 1x PBS (pH 7,4) et ajouter 146,5 μL de cette solution à la réaction.
- Observez l’exemple de calcul suivant pour la quantité de 2-aminoéthanéthiol à ajouter:
- Attendre 1 h et 10 minutes après l’étape 1.2., puis mélanger 160,1 mg de chlorure de 4-(4,6-Diméthoxy-1,3,5-triazin-2-yl)-4-méthylmorpholinium (DMTMM, rapport molaire 12:1 au PEG) et 32,77 μL d’acide méthacrylique (rapport molaire 8:1 au PEG) dans 5 mL de 1x PBS (pH 7,4) dans un nouveau bécher en verre et réagir pendant 50 min sous agitation à 300 tr/min.
REMARQUE: À cette étape, l’acide méthacrylique réagit avec DMTMM pour former un ester hautement réactif qui peut ensuite être couplé aux groupes amines disponibles sur le PEG.- Observez l’exemple de calcul suivant pour calculer la quantité de DMTMM à ajouter :
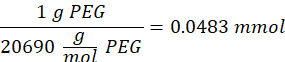
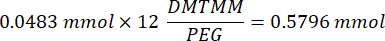
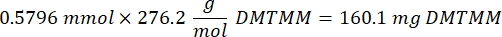
- Observez l’exemple de calcul suivant pour calculer la quantité d’acide méthacrylique à ajouter :
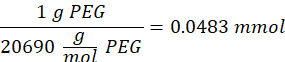
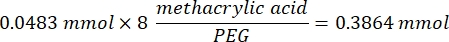
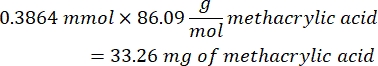
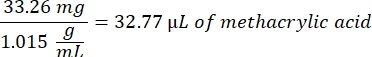
- Observez l’exemple de calcul suivant pour calculer la quantité de DMTMM à ajouter :
- Ajouter la solution d’acide méthacrylique/DMTMM dans le bécher avec la solution de 20 kDa PEG-MAL/2-aminoéthanéthiol.
- Ajouter 53,56 μL de triéthylamine (rapport molaire 1:1 à l’acide méthacrylique) dans le bécher et laisser réagir pendant la nuit en agitant à 300 tr/min. Couvrir le bécher avec du papier d’aluminium pour empêcher la poussière et les autres contaminants de pénétrer dans le bécher.
- Observez l’exemple de calcul suivant pour la quantité de triéthylamine à ajouter :
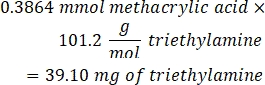
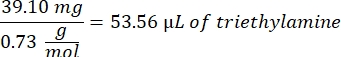
- Observez l’exemple de calcul suivant pour la quantité de triéthylamine à ajouter :
- Transférer la réaction dans un tube de dialyse en peau de serpent (seuil de poids moléculaire : 3 500 Da).
- Placer le tube de dialyse dans un grand bécher avec 1 M NaCl dans de l’eau désionisée (DI) (le volume doit couvrir entièrement le tube) pendant 3 jours sous agitation à 300 tr / min. Changez la solution de NaCl 1 M 2x par jour pour un total de six lavages.
- Dialyser pendant 6 h dans de l’eau DI. Changez l’eau DI toutes les heures pour un total de six lavages.
- Transférer la réaction dans un tube conique de 50 mL et congeler à −80 °C.
- Lyophiliser le tube pendant au moins 72 h à une température de départ de −70 °C et à une rampe de température de 0,01 °C/min jusqu’à 0 °C.
- Préparer l’échantillon pour 1H-RMN en dissolvant 25 mg de MethMAL dans 700 μL de chloroforme-d et transférer dans un tube RMN.
- Acquérir les spectres RMN 1H.
NOTE: Les spectres de ce protocole ont été acquis à l’aide d’un spectromètre de 500 MHz avec les paramètres suivants: largeur de balayage = 6 467,3 Hz, délai = 13,1 s, temps d’acquisition = 5,1 s, temps d’impulsion = 5,1 μs et nombre de balayages = 8. - Pour l’analyse, intégrer le pic de maléimide comme référence (~6,76 ppm), puis intégrer les deux pics de méthacrylamide (~5,35 ppm et 5,6 ppm). Diviser le rapport des aires des pics de méthacrylamide par la superficie totale des trois pics pour obtenir le pourcentage de bras modifiés avec du méthacrylamide.
REMARQUE : Une modification acceptable est la substitution fonctionnelle de 67 % à 75 % du groupe méthacrylamide. Un exemple de spectre 1H-RMN pour MethMAL est illustré à la figure 1.- Utilisez l’équation (1) comme équation du degré de substitution :
 (1)
(1)
- Utilisez l’équation (1) comme équation du degré de substitution :
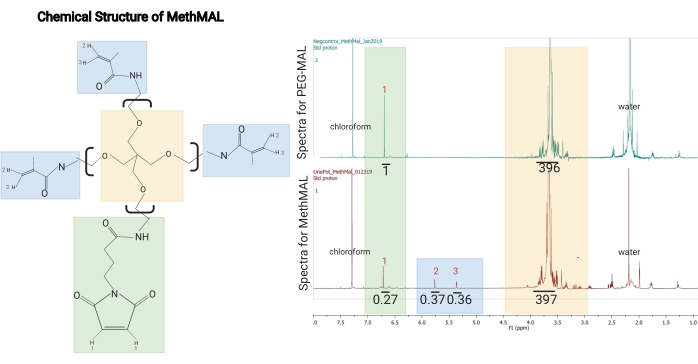
Figure 1 : Structure chimique et spectre 1H-RMN de MethMAL. (A) Structure chimique : le macromère de recuit MethMAL est composé de 20 kDa de poly(éthylèneglycol) à 4 bras modifié avec trois bras méthacrylamide. (B) Cette structure génère des pics à 5,36 ppm (3) et 5,76 ppm (2) non présents dans les spectres PEG-MAL, et un bras maléimide, qui génère un pic à 6,71 ppm (1). Le solvant, le chloroforme, a généré un pic à 7,26 ppm, et l’eau résiduelle dans cet échantillon a généré un pic à 2,2 ppm (marqué sur les spectres). Dans les spectres MethMAL, le pic de maléimide avait une aire intégrée de 0,27, et la somme des aires des pics de méthacrylamide était de 0,73 (0,37 + 0,36). La modification en pourcentage de méthacrylamide était de 73 % (0,73/(0,27 + 0,73)). Ce chiffre est tiré de Pfaff et al.14. Droits d’auteur (2021) American Chemical Society. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Cinétique de gélification des précurseurs de microgel
NOTE: Le temps de gélification peut être modifié en ajustant le pH du tampon utilisé pour dissoudre les composants précurseurs du gel. Pour les hydrogels de PEG-maléimide, un pH plus acide correspond généralement à un temps de gélification plus lent puisque la concentration de thiolate est diminuée à un pH inférieurde 15.
- Prédéterminer les concentrations souhaitées de polymère, de réticulant et d’autres composants précurseurs de gel (peptides , glycosaminoglycanes). Dissoudre le PEG-MAL, RGD et MethMAL (épine dorsale PEG) dans 10x PBS (pH 1,5) et le réticulateur MMP-2 dans 1x PBS (pH 7,4).
REMARQUE : Dans ce protocole, la solution de précurseur du gel est une formulation publiée3, qui comprend 45,88 mg/mL de PEG-MAL à 4 bras (10 kDa), 0,82 mg/mL de RGD, 8,06 mg/mL de MethMAL et 4,62 mg/mL de réticulant MMP-2 (agent de réticulation enzymatiquement dégradable). - Préparer un viscosimètre, ou un instrument équivalent, pour surveiller les modules de stockage et de perte en utilisant un espace de 0,4 mm, une déformation de cisaillement de 1,0, une fréquence de 1,0 Hz et une durée de 10 800 s.
- Fixez une géométrie de rotor à plaques de 35 mm (P35/Ti). Utilisez une chambre humidifiée ou une éponge humide autour de la géométrie pour maintenir un environnement humidifié.
- Mélangez le squelette PEG et le réticulant MMP dans un rapport volumétrique de 1:1.
- Pipeter 400 μL de la solution de précurseur du gel au centre de l’étage viscosimétrique.
- Abaissez lentement la géométrie sur la scène jusqu’à ce qu’elle atteigne la taille d’espace prédéterminée de 0,4 mm et commencez immédiatement à surveiller les modules de stockage (G') et de perte (G'') jusqu’à 6 heures à température ambiante.
REMARQUE : La gélification est considérée comme commençant lorsque le module de stockage devient supérieur au module de perte, et la gélification est considérée comme terminée lorsque le module de stockage plafonne. Une courbe représentative de la cinétique de gélification est représentée à la figure 2.
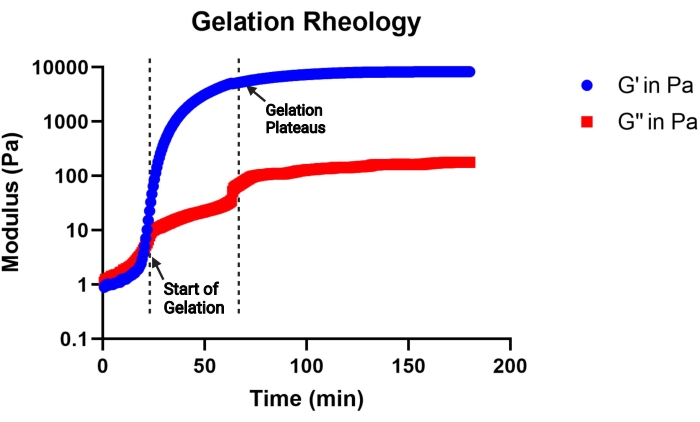
Figure 2 : Courbe représentative de la cinétique de gélification d’une solution de précurseur de gel MAP (pH 4,5) déterminée par un viscosimètre. La gélification commence à l’augmentation rapide du module de stockage (G'), et la gélification se termine lorsque la courbe G' plafonne. G'' indique le module de perte. Ce chiffre est tiré de Pruett et al.3. Droits d’auteur (2021) Wiley-VCH GmBH. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Fabrication de dispositifs microfluidiques
REMARQUE : Ce protocole décrit la fabrication d’un dispositif d’émulsification microfluidique adaptée de de Rutte et al.13, qui peut être vu à la figure 3A. Cependant, ce protocole peut être utilisé avec n’importe quelle conception de périphérique gravée dans une plaquette SU-8. Il est recommandé d’externaliser la fabrication principale de plaquettes de silicium SU-8, à moins que les installations de salle blanche appropriées ne soient disponibles pour la fabrication.
- Créez le premier dispositif microfluidique polydiméthylsiloxane (PDMS) à partir d’un photomasque à plaquette SU-8.
- Préparer ~200 g de PDMS en mélangeant la base et l’agent de durcissement dans un rapport de 10:1 p/p (voir le tableau des matériaux).
- Placez la plaquette SU-8 dans un plat de culture (collez les bords de la plaquette à la boîte), avec la conception microfluidique tournée vers le haut.
- Versez PDMS dans le plat pour créer une couche de 1 à 1,5 cm d’épaisseur sur la plaquette. Placez le plat sous vide pour éliminer les bulles.
- Laisser durcir le PDMS jusqu’à solidification (24 h à température ambiante ou ~2 h à 60 °C).
- Une fois que le PDMS a durci, utilisez soigneusement une lame de rasoir ou un scalpel pour couper un rectangle à travers le PDMS, de sorte qu’il y ait une marge de 0,5 à 1 cm autour du dessin sur la plaquette.
REMARQUE: N’utilisez pas trop de pression et soyez très doux pour éviter d’endommager (par exemple, craquer, gratter) la plaquette. - Coincez une spatule dans l’une des coupes et faites-la glisser le long des coupes pour séparer le PDMS de la plaquette.
REMARQUE : Lorsque le PDMS se sépare de la plaquette, une bulle d’air commence à se former sous le PDMS (voir la figure 3B). - Utilisez la spatule pour soulever doucement le rectangle de PDMS hors de la boîte.
REMARQUE: L’espace résultant dans le PDMS au-dessus de la plaquette sera le moule pour les dispositifs microfluidiques.
- Créez ensuite des dispositifs microfluidiques PDMS à partir du photomasque de plaquette SU-8.
- Préparer ~15-20 g de PDMS par moule en mélangeant la base et l’agent de durcissement dans un rapport de 10:1.
- Versez PDMS dans l’espace rectangulaire du moule pour créer une couche de 5 mm de PDMS au-dessus de la plaquette. Mettez le moule sous vide pour éliminer les bulles.
- Laisser durcir le PDMS jusqu’à solidification complète (24 h à température ambiante ou 2 h à 60 °C).
- Une fois que le PDMS a durci, utilisez une lame de rasoir ou un scalpel pour couper le PDMS autour des bords du rectangle.
REMARQUE: N’utilisez pas trop de pression et soyez très doux pour éviter d’endommager (c’est-à-dire de craquer) la plaquette. - Coincez une spatule dans l’une des coupes et faites-la glisser le long des coupes pour séparer le PDMS de la plaquette.
REMARQUE: Lorsque le PDMS se sépare de la plaquette, une bulle d’air commence à se former sous le PDMS. - Utilisez un poinçon de biopsie de 1,5 mm pour créer des trous à travers le rectangle PDMS aux deux entrées et à la sortie (voir la figure 3B).
- S’il y a plusieurs appareils sur une seule tranche, utilisez une spatule ou une lame de rasoir pour marquer légèrement le PDMS entre chaque appareil, puis pliez doucement le PDMS le long des lignes marquées afin que le PDMS se sépare très proprement.
- Rangez les appareils PDMS dans un récipient sans poussière.
- Collez les dispositifs microfluidiques PDMS à des lames de verre.
- Préparez une lame de verre par dispositif microfluidique PDMS. Utilisez du ruban adhésif, de l’air filtré ou des lavages à l’alcool isopropylique (IPA) pour enlever toute poussière de la lame. Assurez-vous que les lames sont complètement sèches avant de passer à l’étape suivante.
- Placez une lame de verre et un dispositif PDMS, côté conception vers le haut, l’un à côté de l’autre sur un petit plateau en plastique (un couvercle à plaque de 96 puits fonctionne bien pour cela) et placez-le dans un nettoyant plasma. Fermez la porte et la vanne de débit d’air et allumez la pompe à vide. Laissez-le fonctionner pendant au moins 30 s, puis éteignez-le.
- Connectez le tube de gaz du réservoir d’oxygène à la vanne de débit d’air. Laissez la chambre à plasma se remplir d’oxygène pendant 30 s, puis éteignez l’oxygène et fermez la vanne de débit d’air.
- Allumez la pompe à vide et réglez le niveau de radiofréquence (RF) sur élevé. Attendez que la chambre prenne une couleur violet-rose (voir la figure 3B). Laisser passer 30 s.
- Lorsque la minuterie se déclenche, éteignez le plasma et passez l’aspirateur. Ensuite, ouvrez lentement la vanne de débit d’air pour libérer le vide. Retirez le plateau du nettoyeur plasma.
- Retournez doucement le périphérique PDMS sur la lame de verre pour les coller. Au fur et à mesure que la liaison se produit, observez la légère différence dans la transparence du PDMS.
REMARQUE: Pour de meilleurs résultats, conservez les appareils collés à 60 ° C jusqu’à ce qu’ils soient immédiatement avant utilisation.
- Traitement de surface des dispositifs microfluidiques PDMS
- Préparer le traitement de surface en diluant les PFOCTS (trichloro(1H,1H,2H,2H-perfluorooctyl)silane) dans de l’huile Novec (1:50). Utilisez 1 mL pour 3-4 appareils. Transférer le volume dans une seringue de 1 mL et fixer une aiguille de 25 G.
REMARQUE: Les aiguilles utilisées dans ce protocole sont biseautées, alors faites attention lorsque vous manipulez des objets tranchants. Des aiguilles contondantes peuvent également être utilisées si vous le souhaitez. - Coupez un morceau de tube Tygon de 10 à 12 cm par appareil qui sera traité.
- Couper un morceau de tube en PEEK, ~7 cm de longueur. Insérez quelques millimètres du tube en PEEK à l’extrémité du tube Tygon, comme illustré à la figure 4A, pour empêcher l’aiguille de percer les entrées du tube Tygon.
- Retirez le(s) appareil(s) de la chambre chauffée et insérez l’extrémité non PEEK du tube Tygon dans le trou d’entrée aqueux.
- Insérez l’aiguille de la seringue de traitement de surface dans le tube en PEEK et recouvrez le trou de sortie de la chambre d’huile (voir Figure 3B).
- Injectez le traitement dans l’appareil lentement et assurez-vous qu’il remplit l’appareil, sans bulles. Attendez que les chambres aqueuses se remplissent en premier, suivies des canaux plus petits, puis de la chambre à huile. Retirez le tube Tygon de l’appareil. Une fois l’appareil rempli, laissez-le reposer pendant 10 min à température ambiante.
- Remplissez une seringue de 5 ml avec de l’huile seulement (pas de silane) et fixez une aiguille de 25 g.
- Aspirez le traitement de surface hors de l’appareil par les entrées et les sorties. Insérez le tube Tygon dans l’entrée aqueuse, insérez la seringue avec de l’huile dans le tube en PEEK et rincez chaque dispositif avec de l’huile. Aspirez l’huile hors de l’appareil.
- Répétez le rinçage de l’huile 2x plus. Retirez le tube Tygon.
REMARQUE: L’appareil est prêt à être utilisé.
- Préparer le traitement de surface en diluant les PFOCTS (trichloro(1H,1H,2H,2H-perfluorooctyl)silane) dans de l’huile Novec (1:50). Utilisez 1 mL pour 3-4 appareils. Transférer le volume dans une seringue de 1 mL et fixer une aiguille de 25 G.
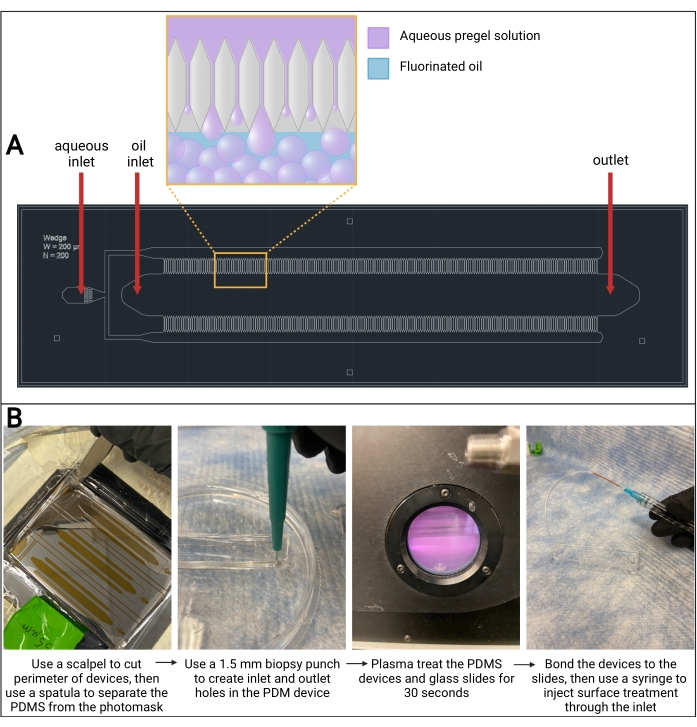
Figure 3 : Dispositif PDMS microfluidique. (A) Dessin de conception assistée par ordinateur (AutoCAD) de la conception de dispositifs microfluidiques. La formation de gouttelettes de microgel se produit dans les canaux de chaque côté du canal pétrolier, comme on le voit dans l’affleurement amplifié. (B) Vue d’ensemble de la fabrication des dispositifs PDMS. Abréviation : PDMS = polydiméthylsiloxane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Génération microfluidique de microgels
- Prédéterminer les concentrations souhaitées de polymère, de réticulant et d’autres composants précurseurs de gel (peptides , glycosaminoglycanes). Dissoudre le PEG-MAL, RGD et MethMAL (PEG-squelette) dans 10x PBS (pH 1,5) et le réticulant MMP-2 avec 5 μM de biotine-maléimide dans 1x PBS (pH 7,4).
REMARQUE : Dans ce protocole, la solution de précurseur du gel est une formulation publiée3 composée de 45,88 mg/mL de PEG-MAL à 4 bras (10 kDa), de 0,82 mg/mL de RGD, de 8,06 mg/mL de MethMAL et de 4,62 mg/mL de réticulant MMP-2 (agent de réticulation enzymatiquement dégradable). Les méthodes décrites ci-dessous donneront ~3 mL de microgels. - Préparer 6 mL de solution de surfactant en diluant le stock de FluoroSurfactant à 5% à au moins 1% dans l’huile Novec. Ajouter cette solution à une seringue de 10 mL.
REMARQUE: Le tensioactif fluoré est non miscible avec l’eau, ce qui lui permet d’être facilement éliminé pendant la transition du gel à la phase aqueuse pendant les lavages PBS dans l’étape de purification. - Coupez trois morceaux de tube Tygon d’une longueur appropriée pour la hauteur de la pompe de la seringue.
- Coupez deux morceaux de tube en PEEK, ~ 1 pouce de longueur. Insérez quelques millimètres du tube en PEEK dans l’extrémité de deux morceaux de tube Tygon, comme illustré à la figure 4A, pour empêcher l’aiguille de percer les entrées du tube Tygon.
- Insérez l’extrémité non PEEK du tube Tygon dans les entrées des dispositifs microfluidiques. Insérez le morceau restant de tube Tygon (sans tube en PEEK à l’extrémité) dans la sortie du dispositif microfluidique, comme illustré à la figure 4C.
- Ajouter au moins 3 mL d’huile à une seringue en plastique de 5 mL et la fixer à une aiguille de 25 G. Insérez délicatement l’aiguille dans le tube en PEEK de l’une des entrées Tygon. Rincez doucement le tube et l’appareil avec de l’huile. Recueillir l’huile de la sortie dans un tube conique. Répétez le rinçage de l’huile sur l’autre entrée Tygon.
- Réglez les pompes à seringue sur les débits souhaités.
REMARQUE : Ce protocole utilise 3 mL/h pour le débit aqueux et 6 mL/h pour le débit d’huile. Il peut être nécessaire d’utiliser deux pompes à seringue distinctes. - Connectez la seringue contenant le surfactant à l’entrée d’huile à l’aide d’une aiguille de 25 G (voir Figure 4A) et distribuez doucement suffisamment d’huile pour amorcer le tube et le canal d’huile du dispositif microfluidique.
- Une fois l’appareil et les entrées d’huile installés, ajoutez 0,5 mL d’huile à une nouvelle seringue de 5 mL, qui contiendra le précurseur du gel. Le but de cette petite quantité d’huile est d’aider à rincer la solution précurseur à travers le dispositif microfuilidique vers la fin de la course.
- Dans un tube conique, combiner 1,5 mL de la solution de squelette PEG et 1,5 mL de la solution de réticulation. Vortex pendant 30 s et transférer rapidement la solution de précurseur de gel combiné dans la seringue de 5 mL.
- Connectez la seringue avec la solution précurseur du gel à l’entrée aqueuse via une aiguille de 25 G. Distribuer doucement suffisamment de solution pour amorcer le tube et le canal aqueux.
- Fixez les seringues sur les pompes de seringue respectives et appuyez sur la seringues (voir Figure 4B). Assurez-vous qu’il y a du liquide qui s’écoule à travers les canaux aqueux et huileux.
REMARQUE: Il est recommandé d’utiliser un microscope pour visualiser la formation de microgel dans le dispositif PDMS. - Recherchez les particules de taille uniforme dans les canaux (voir la figure 4D). Recueillir les microgels de la sortie dans un tube conique.
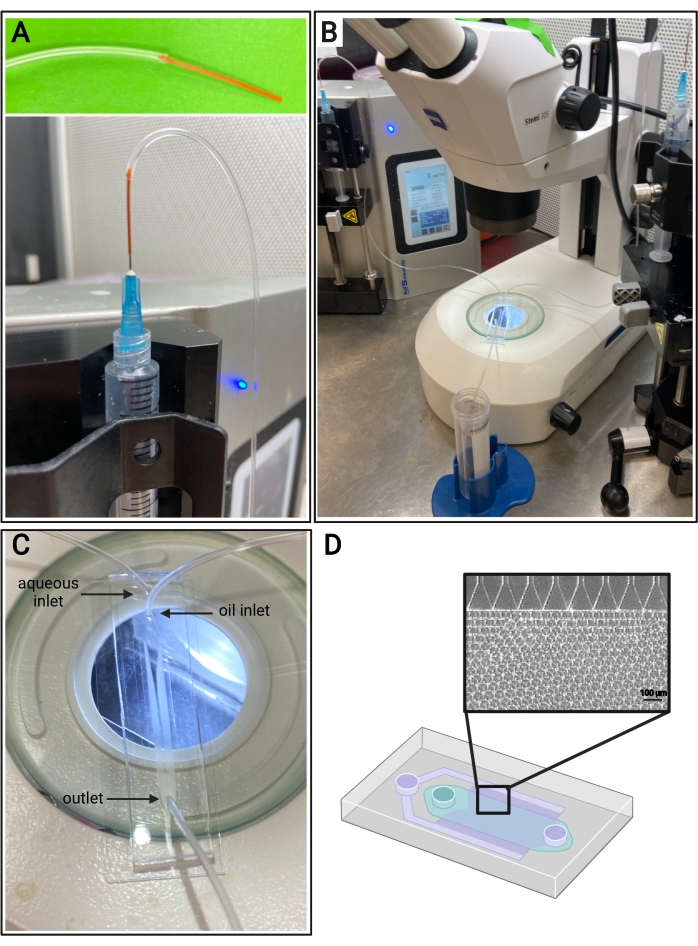
Figure 4 : Configuration microfluidique. (A) Représentation de la méthode de connexion d’un tube en PEEK (en haut) et d’un tube Tygon à une aiguille de 25 G sur une seringue (en bas). (B) Installation microfluidique avec pompes à seringue, tubes, dispositif et microscope. (C) Image de la configuration du dispositif microfluidique, avec deux entrées (aqueuses et huileuses) et une sortie. (D) Schéma du dispositif microfluidique et image représentative en fond clair de la formation attendue de microgel à partir des canaux dans un dispositif d’émulsification par étapes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Purification et stérilisation des microgels
- Une fois la gélification terminée (déterminée comme le plateau du temps jusqu’au module de stockage dans la caractérisation de la cinétique de gélification), utilisez une pipette pour retirer soigneusement la phase huileuse du fond du tube (voir la figure 5). Déposez-le dans un conteneur à déchets approprié pour les déchets fluorés.
REMARQUE : Le temps de gélification peut être accéléré en ajoutant une base organique soluble au tube de collecte (p. ex. triéthylamine), mais il est important de noter que l’ajout d’une base forte peut hydrolyser tout maléimide n’ayant pas réagi. Si l’on souhaite fonctionnaliser les microgels par un excès de maléimides après la gélification, sauter l’ajout de triéthylamine. - Ajouter plus d’huile dans le tube de collecte de microgel dans un rapport de 1: 1. Mélanger en retournant doucement le tube de collecte. Ne pas vortex.
- Laissez le tube de collecte reposer pendant ~5 min pour permettre aux phases de se séparer. Recherchez la phase huileuse en bas et la phase aqueuse (les microgels) en haut (voir Figure 5).
- Répétez les lavages à l’huile au moins 2x plus.
- Ajoutez plus d’huile dans un rapport 1: 1 avec le gel et ajoutez 1x PBS dans un rapport PBS / gel de 4: 1. Retourner pour mélanger plusieurs fois. Pour séparer les couches, centrifuger le tube à ~2 000 x g pendant ~30 s. Recherchez la phase huileuse au fond du tube, le gel au milieu et le PBS sur le dessus (voir Figure 5).
- Retirer la phase huileuse à l’aide d’une pipette et jeter dans un conteneur à déchets.
REMARQUE: Ne retirez pas le PBS. Utilisez un tube conique plus grand pour continuer les lavages si le tube de prélèvement original était de 15 mL. - Répétez l’huile et le PBS lavage 2x plus. Recherchez le gel pour passer d’opaque à clair lors du lavage final, comme le montre la figure 5, indiquant que le surfactant a été éliminé et que le gel est en phase PBS.
- Retirez toute l’huile. Ne retirez pas le PBS du tube conique.
- Dans une hotte chimique, utilisez une pipette en verre pour ajouter des hexanes au tube à un volume égal à celui du PBS. Vortex du tube conique pendant 30 s ou jusqu’à ce qu’il soit bien mélangé. Centrifuger à 4 696 x g pendant 5 min.
- Après la séparation, recherchez les hexanes dans la couche supérieure, le PBS au milieu et le gel en bas (voir la figure 5). Retirez la couche d’hexane et jetez-la dans un récipient pour déchets organiques. Aspirez le PBS.
- Répéter les lavages à l’hexane et au PBS au moins 2 fois de plus ou jusqu’à ce que le gel apparaisse presque translucide (voir la figure 5). Lavez le gel avec du PBS 1x de plus afin que les hexanes restants soient éliminés. Centrifuger à 4 696 x g pendant 5 min. Aspirez la couche PBS. Veillez à ne pas déranger la pastille de gel.
- Pour coiffer ou éteindre tout maléimide n’ayant pas réagi dans les microgels, préparer une solution de 100 mM de N-acétyl-L-cystéine dans 1x PBS et ajouter cette solution au gel. Placer sur un rotateur tubulaire à 37 °C pendant la nuit, suivi de nombreux lavages avec PBS pour éliminer la N-acétyl-L-cystéine qui n’a pas réagi.
- Pour un stockage à long terme (jusqu’à 1 an), remettre les microgels en suspension dans de l’IPA à 70% et conserver à 4 °C pour aider à prévenir la croissance des bactéries sur les microgels.
- Pour stériliser les microgels, ajoutez 70% d’IPA au gel dans un rapport 4:1 v/v dans une hotte de biosécurité. Tourbillonner le tube pendant 30 s, puis centrifuger à 4 696 × g pendant 5 min. Aspirer le surnageant IPA de la pastille de gel dans une hotte de biosécurité. Effectuez 2x plus de lavages IPA suivis de 3x lavages avec 1x PBS stérile.
REMARQUE: Toute IPA doit être retirée avant d’utiliser le gel avec des cellules ou des animaux.
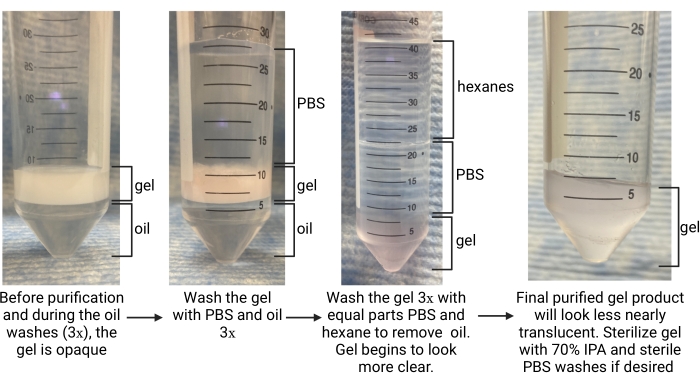
Figure 5 : Vue d’ensemble de la procédure de purification du microgel. Abréviations : PBS = solution saline tamponnée au phosphate; IPA = alcool isopropylique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Caractérisation de la taille des microgels
REMARQUE: Il est recommandé de laisser les particules de microgel s’équilibrer dans 1x PBS pendant une nuit à 37 ° C pour gonfler à leur diamètre final avant le calibrage.
- Particules de gel image.
- Faire tourner le gel MAP à 4 696 × g pendant 5 min et aspirer le surnageant.
- À l’aide d’une pipette volumétrique, retirer 5 μL de microgels de la pastille de gel et diluer dans 1 mL de PBS dans un tube microcentrifuge (dilution 1:200). Ajustez cette dilution au besoin.
NOTE: Lors de la formulation de la solution de précurseur du gel, 5 μM de biotine-maléimide peuvent être ajoutés et utilisés comme alternative au marquage des microgels avec un fluorophore. Dans ce cas, un streptavidine-fluorophore peut être ajouté à une dilution de 1:300 (à partir de 1 mg/mL de stock). Laisser incuber la streptavidine pendant au moins 15 minutes avant l’imagerie. - À l’aide d’une pipette volumétrique, transférer 100 μL des microgels dilués dans les puits d’une plaque transparente de 96 puits.
- Utilisez un microscope à grand champ ou confocale pour visualiser les microgels avec un objectif 10x. Acquérir des images des microgels pour analyse.
- Voir la figure 6 pour des images confocales représentatives des microgels.
- Dimensionnement des particules avec ImageJ
- Ouvrez les fichiers image du microscope dans ImageJ.
- Sélectionnez Analyser | Réglez l’échelle et réglez l’échelle de l’image en fonction de l’objectif du microscope.
- Sélectionnez Image | Type | 8 bits.
- Sélectionnez Image | Ajuster | Seuil , puis sélectionnez l’option de seuil automatique « Otsu » dans la liste déroulante.
- Cliquez sur Analyser | Définissez les mesures et sélectionnez le diamètre de Feret et limitez-vous au seuil.
- Cliquez sur Analyser | Analysez les particules et entrez la plage de taille de zone (en pixel ^ 2) attendue pour les microgels (pour exclure les petits débris de l’analyse). Réglez la circularité sur 0,75-1,00 et sélectionnez Afficher | Grandes lignes. Cochez les résultats d’affichage et excluez sur les bords.
REMARQUE: Le filtre de forme de circularité exclut les microgels sur la bordure de l’image qui peuvent donner une mesure de diamètre inexacte. - Exécutez le module Analyser les particules .
- Attendez la sortie, qui est le diamètre de Feret de chaque particule, et exportez ces résultats dans une feuille de calcul.
- Dans ce protocole, calculez l’indice de polydispersité (PDI) pour déterminer l’hétérogénéité de la taille du microgel. Analyser au moins 100 microgels pour définir une population : une plage PDI de 1,00 à 1,05 définit une population monodispersée, et une PDI supérieure à 1,05 définit une population polydispersée. Utilisez l’équation (2), l’équation (3) et l’équation (4) pour calculer le PDI, comme décrit ci-dessous.
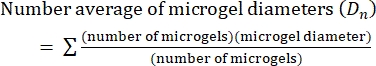 (2)
(2) (3)
(3)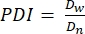 (4)
(4)

Figure 6 : Images représentatives de microgels. (A) Image confocale fluorescente de la population de microgels A, (B) image de microgels seuillés, et (C) contours de particules après analyse ImageJ. (D) Image confocale fluorescente de la population de microgels B et (E) image lumineuse transmise des microgels (les microgels sont presque translucides). (F) Représentation des résultats représentatifs de l’analyse ImageJ décrite dans le présent protocole. Les deux populations de microgel ont des PDI relativement monodispersées. Les deux populations de microgels ont été synthétisées avec un débit aqueux de 3 mL/h et un débit d’huile de 6 mL/h. Cependant, la différence de taille de microgel est due à des différences dans la taille des pas du dispositif microfluidique. Par exemple, la population de microgel A a été synthétisée avec un dispositif microfluidique avec une taille de pas de canal de 11 μm, et la population de microgel B a été synthétisée dans un dispositif avec une taille de pas de 40 μm. Barres d’échelle = 100 μm. Abréviation : PDI = indice de polydispersité. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Recuit d’échafaudage de particules microporeuses recuites (MAP)
- Créer une solution mère de 2 mM de phényl-2,4,6-triméthylbenzoylphosphinate de lithium (LAP) dans 1x PBS (pH 7,4).
- Diluer la solution mère LAP à 0,2 mM dans un volume de 1x PBS équivalent au volume de gel. Si vous utilisez le photoinitiateur LAP pour des études cellulaires ou animales, assurez-vous de stériliser la solution avant utilisation.
- Faire tourner le gel MAP à 4 696 × g pendant 5 min et aspirer le surnageant.
- À l’aide d’une pipette volumétrique, transférer le volume de gel souhaité dans un tube microcentrifugeux.
- Ajouter 0,2 mM LAP au gel dans un rapport volumétrique de 1:1 (la concentration finale de LAP est de 0,1 mM).
- Tourbillonner le mélange et incuber pendant au moins 15 minutes dans l’obscurité.
- Centrifuger le mélange à 18 000 × g pendant 5 min pour granuler le gel.
- Retirez délicatement le surnageant de la pastille de gel.
- Transférer le gel MAP à l’emplacement cible à l’aide d’une pipette à déplacement positif.
- Appliquer une lumière focalisée (365 nm, 8,66 mW/cm2) sur l’échantillon pendant 113 s pour recuire l’échafaudage.
NOTE: Le temps de recuit de 113 s a été optimisé comme publié précédemment pour une concentration LAP de 0,1 mM14, mais une optimisation supplémentaire pour différentes concentrations de photoinitiateurs peut être nécessaire.
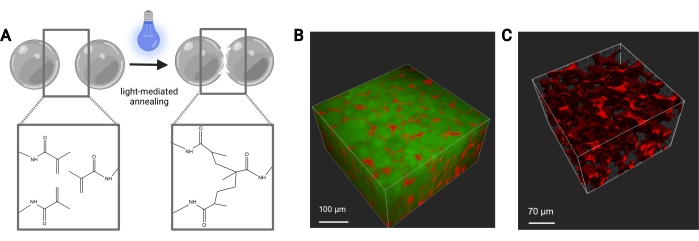
Figure 7 : Recuit d’échafaudage MAP. (A) Schéma du recuit d’échafaudage MAP. Lorsqu’ils sont exposés à un photoinitiateur et à la lumière, les groupes fonctionnels méthacrylamide sur le macromère MethMAL subissent une réaction de photopolymérisation par clic, qui lie les surfaces des microgels ensemble. (B) Représentation d’un rendu 3D (Imaris) d’une image au microscope à deux photons de microgels MAP (vert) recuits ensemble en forme de rondelle 3D, avec du dextrane (rouge) dans les pores. (C) Représentation d’un rendu 3D (Imaris) d’une image de microscope à deux photons montrant la porosité d’un échafaudage MAP perfusé avec du dextrane fluorescent de 70 kDa (rouge). Barres d’échelle = (B) 100 μm, (C) 70 μm. Abréviations : MAP = particule microporeuse recuite; MethMAL = macromère de recuit personnalisé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Le but de ce protocole est de décrire toutes les étapes nécessaires à la synthèse des blocs de construction de microgel à utiliser dans un échafaudage MAP. Le macromère de recuit MethMAL est très sélectif et efficace et est compatible avec plusieurs squelettes polymères14. Il est important qu’au moins 67 % à 75 % du maléimide PEG de 20 kDa soit modifié avec des groupes fonctionnels méthacrylamide pour assurer une efficacité de recuit élevée. Le pourcentage de modification peut être déterminé plus facilement en analysant les pics de spectres 1 H-RMN, comme le montre la figure 1. La cinétique de gélification, déterminée par un viscosimètre, est une mesure importante à prendre en compte pour chaque formulation de gel. Ce protocole utilise une solution de précurseur de gel constituée d’un squelette PEG avec un groupe MAL, qui réagit efficacement avec des agents de réticulation fonctionnalisés au thiol pour la gélification de microgel. Cependant, de nombreuses chimies d’hydrogel peuvent être utilisées pour fabriquer des microgels via la méthode microfluidique à haut débit décrite ici. Le délai d’apparition de la gélification donnera un aperçu de la durée de la génération de microgel microfluidique. Il est recommandé de choisir un gel précurseur pH qui peut initier la gélification entre 30 min (Figure 2) et 2 h.
Si le temps de gélification est trop rapide, la solution de précurseur du gel commencera à polymériser dans le dispositif microfluidique et obstruera les canaux. De plus, il est important de noter que la modification des concentrations de ligands thiolés (p. ex. RGD) peut avoir des répercussions sur la formation du réseau pendant la gélification et peut devoir être prise en compte en ajustant la formulation. Les étapes de fabrication du dispositif microfluidique peuvent être fastidieuses, mais les résultats représentatifs d’un dispositif collé avec succès sont présentés à la figure 3. Ce protocole utilise un dispositif microfluidique à émulsification par étapes parallélisé à haut débit qui a été adapté d’une conception de de Rutte et al.13, et la fabrication de plaquettes de silicium a été sous-traitée à une société de technologie microfluidique. Cependant, les étapes décrites dans ce protocole peuvent être utilisées avec n’importe quelle conception de dispositif gravée sur un photomasque de plaquette de silicium SU-8. Il est important de noter que la taille des pas des canaux sur le photomasque doit être optimisée lors de la fabrication du dispositif, car elle aura un impact sur la taille des particules de microgel.
Les débits pour la génération microfluidique de microgels doivent être optimisés pour chaque formulation de gel en fonction de facteurs tels que le temps de gélification, la taille de particules souhaitée et la conception du dispositif microfluidique. Si vous utilisez le dispositif à haut débit, les débits de la phase aqueuse peuvent atteindre 5 mL/h. La figure 4B montre la configuration des dispositifs à haut débit utilisés dans ce protocole. Si le dispositif fonctionne correctement, la formation de microgel doit ressembler à celle illustrée à la figure 4D. Avant purification, les microgels seront opaques. Après avoir terminé les différents lavages à l’huile, au PBS et à l’hexane, le gel doit ressembler à l’image représentative de la figure 5. En cas d’incorporation d’un fluorophore dans les microgels, le produit purifié peut avoir une légère teinte colorée mais doit toujours être proche de la translucidité. Après purification et gonflement, les microgels doivent être de taille très uniforme et avoir une DJP comprise entre 1,00 et 1,05, comme le montre la figure 6. Divers photoinitiateurs peuvent être utilisés pour le photorecuit des échafaudages MAP. Si l’on utilise une alternative à LAP, décrite ici, il faut déterminer la cinétique de recuit comme décrit précédemment14. En outre, diverses sources lumineuses peuvent être utilisées pour le photorecuit, à condition que la source lumineuse corresponde au photoinitiateur. Il faut s’assurer de calibrer et de focaliser la source lumineuse. Le temps de recuit et l’intensité lumineuse peuvent devoir être optimisés en fonction de la formulation du gel et de la concentration du photoinitiateur. La méthode de recuit décrite dans ce protocole peut être utilisée pour des études in vitro et in vivo. Après recuit, les microgels formeront un échafaudage poreux qui pourra être visualisé par microscopie à deux photons (Figure 7B-C).
Discussion
Ce protocole décrit les méthodes de synthèse et de caractérisation des microgels, qui servent de blocs de construction pour les échafaudages de particules microporeuses recuites (MAP). Ce protocole utilise une approche microfluidique à haut débit pour générer de grands volumes de microgels uniformes, ce qui ne peut être réalisé avec d’autres méthodes telles que la microfluidiquefocalisant l’écoulement 1,4,7,9 (monodispéristie élevée, faible rendement), l’émulsion discontinue 6,10 et l’électropulvérisation 5,12 (faible monodispersité, rendement élevé). Avec les méthodes décrites ici, les microgels monodispersés peuvent être fabriqués pour être utilisés dans les échafaudages MAP qui peuvent être utilisés pour une variété d’applications de médecine régénérative (par exemple, l’administration de cellules, la cicatrisation des plaies).
Une étape critique de ce protocole est la création des dispositifs microfluidiques PDMS. Si les dispositifs ne sont pas fabriqués correctement, cela pourrait avoir des effets négatifs en aval sur la formation de microgel et la monodispersité. Il est important de prévenir l’introduction d’artefacts (c.-à-d. bulles, poussière) dans le PDMS avant qu’il ne durcisse, car cela pourrait obstruer les canaux et avoir un impact significatif sur la formation de microgel. Pour atténuer cela autant que possible, il faut utiliser du ruban adhésif pour enlever la poussière, stocker les appareils dans un récipient sans poussière et travailler dans une hotte sans poussière, si possible. Il est également recommandé de stocker les appareils à 60 °C pour obtenir les meilleurs résultats avec le traitement de surface.
Lors du versement des dispositifs PDMS, il est important de maintenir une épaisseur uniforme qui est à peu près égale ou inférieure à la longueur du poinçon de biopsie. Si l’appareil est trop épais, le poinçon de biopsie ne pourra pas pénétrer complètement. Il est également crucial de ne pas déchirer les entrées/sorties de l’appareil PDMS lors du poinçonnage avec le poinçon de biopsie et/ou de l’insertion de la tubulure. Une déchirure dans le dispositif PDMS provoquera une fuite des entrées / sorties, ce qui peut entraîner la perte de la solution précurseur du gel. S’il y a une fuite dans un périphérique PDMS, la meilleure solution est de le remplacer par un nouveau périphérique le plus rapidement possible.
Lors du traitement plasmatique de l’appareil, l’utilisation d’oxygène pur et de traitement au plasma pendant 30 s a produit les meilleurs résultats pour l’adhérence du PDMS à la lame de verre. Si l’appareil ne se lie pas correctement (c.-à-d. que le PDMS peut toujours être soulevé de la lame de verre après le traitement plasma), il faut vérifier que le traitement du plasma fonctionne correctement et que l’appareil et les lames ont été soigneusement nettoyés. Il est également important d’utiliser le traitement de surface silane approprié et, pour de meilleurs résultats, les dispositifs PDMS doivent être traités en surface directement avant utilisation. D’autres méthodes de traitement de surface, telles que le dépôt chimique en phase vapeur, pourraient également être utilisées.
Une autre étape cruciale consiste à utiliser correctement les dispositifs microfluidiques PDMS pour la formation de microgel. Il est recommandé d’utiliser un rapport de débit d’au moins 2:1 (ce protocole utilise un débit d’huile de 6 mL/h et un débit aqueux de 3 mL/h), mais cela peut être réglé pour atteindre la taille de microgel souhaitée. Le pH de la solution précurseur de microgel est également une mesure importante à optimiser pour éviter le colmatage de l’appareil. La solution saline tamponnée au phosphate (PBS) accélère la formation de thiolate dans la chimie d’addition de type Michael, et les concentrations de PBS utilisées dans ce protocole donnent les meilleurs résultats pour la gélification de microgel dans les dispositifs microfluidiques. Une fois les pompes à seringue démarrées, il peut y avoir des bulles dans les canaux microfluidiques, mais cela devrait s’équilibrer après quelques minutes. Il est recommandé de surveiller la formation de microgel avec un microscope. Si le flux ne ressemble pas à celui de cette vidéo et/ou s’il y a quelques canaux produisant de grosses particules, cela est probablement dû à des problèmes avec l’étape de traitement de surface. La meilleure solution est de remplacer l’appareil par un appareil fraîchement traité en surface.
Si les microgels semblent fusionner, cela peut être dû à une concentration insuffisante de fluorosurfactant. La solution recommandée est d’augmenter le % en poids du tensioactif dans la phase huileuse. Cependant, une limite à l’utilisation de concentrations élevées de tensioactif est qu’il peut être plus difficile à éliminer pendant l’étape de purification. Il est recommandé d’utiliser des appareils microfluidiques une seule fois, mais les dispositifs peuvent être réutilisés s’ils sont rincés avec de l’huile Novec immédiatement après utilisation pour éliminer toute solution aqueuse qui pourrait se geler dans le dispositif et obstruer les canaux. Alors qu’un dispositif microfluidique peut produire un volume de microgels à haut débit (mL/h), ce taux de production peut être mis à l’échelle en utilisant plusieurs dispositifs microfluidiques en parallèle.
L’étape de recuit de l’assemblage de l’échafaudage MAP repose sur l’utilisation d’un photoinitiateur activé par la lumière de polymérisation radicalaire, et le photoinitiateur peut être sélectionné en fonction de l’application souhaitée. Par exemple, le photoinitiateur LAP a des temps de recuit rapides (<30 s) lors de l’utilisation de la lumière UV à ondes longues, ce qui a un impact minimal sur la viabilité cellulaire in vitro14. Cependant, cette longueur d’onde est fortement absorbée par le tissu16 et peut ne pas avoir une efficacité de recuit aussi élevée in vivo qu’in vitro.
L’éosine Y est un autre photoinitiateur activé par les longueurs d’onde visibles (505 nm) et a une pénétration plus profonde dans les tissus, ce qui améliore la capacité de l’échafaudage MAP à être recuit sous les tissus. Cependant, les longs temps d’exposition à la lumière nécessaires au recuit Eosin Y peuvent prolonger l’exposition cellulaire aux radicaux libres et avoir un impact sur la viabilité cellulaire in vitro14. L’utilisation de ces méthodes pour la génération à haut débit de blocs de construction de microgel hautement uniformes accélérera la recherche axée sur les échafaudages MAP et fera progresser les connaissances dans le domaine des matériaux poreux injectables pour la médecine régénérative.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs tiennent à remercier Joe de Rutte et le laboratoire Di Carlo de l’Université de Californie à Los Angeles pour leur aide dans la conception originale du dispositif microfluidique à partir duquel le dispositif signalé a été développé, ainsi que pour leurs premiers conseils dans la fabrication et le dépannage des dispositifs PDMS. Les schémas de figures ont été créés avec Biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 2-aminoethanethiol hydrochloride | Acros Organics | AC153770250 | For MethMal Synthesis MW: 113.61 Da |
| 35 mm plate rotor | HAAKE | P35/Ti | Geometry for HAAKE viscometer |
| 4-arm PEG-Maleimide (10 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-100MA | For microgel precursor solution |
| 4-arm PEG-Maleimide (20 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-200MA | For MethMal Synthesis Molecular weight specific to each batch |
| BD Syringe with Luer-Lok Tips | Becton Dickinson | Disposable plastic syringes | |
| Biopsy punch | Mitex | MLTX33-31A-P/25 | 1.5 mm diameter |
| Chloroform-d | Acros Organics | AC209561000 | For MethMal Synthesis |
| Collimated LED Light Source | ThorLabs | M365LP1-C1 | 365 nm |
| Culture dish (15 cm) | Corning | CLS430599 | 150 mm x 25 mm |
| DMTMM(4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride) | Oakwood Chemical | 151882 | For MethMal Synthesis MW: 276.72 Da |
| Fluorosurfactant | Ran Technologies | 008-Flurosurfactant-5wtH-200G | 5 weight percent of 008-Flurosurfactant in HFE7500 |
| FreeZone Triad Freeze Dry System | Labconco | 7400000 Series | For MethMal Synthesis Lyophilizer |
| Glass slides | Fisher Scientific | 12-550-A3 | Plain glass slides, uncoated |
| HAAKE Rheowin viscometer | HAAKE | ||
| ImageJ | version 1.8.0_172 | ||
| KDS Legato 210 Dual Prong Syringe Pump | Kd Scientific | ||
| LED Driver | ThorLabs | DC2200 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | Photoinitiator |
| Methacrylic Acid | Sigma Aldrich | 155721 | For MethMal Synthesis MW: 86.09 Da Density: 1.015g/mL |
| Microfluidic device SU8-Si master wafer | FlowJem | N/A | Custom-made, with silanization |
| MMP-2 degradable crosslinker | FlowJem | Sequence: Ac-GCGPQGIAGQDGCG-NH2 | |
| Needles (25 G, beveled) | BD | 305122 | Length: 15.88 mm Gauge: 0.5 mm |
| Novec 7500 | 3M | 7100025016 | Fluorinated oil |
| Oxygen | Praxair | UN1072 | Compressed |
| Peek tubing | Trajan Scientific | 03-350-523 | 1/32" Outer Diameter; 0.02" Inner Diameter; 10' Length |
| PFOCTS (trichloro(1H,1H,2H,2H-perfluorooctyl)silane) | Sigma-Aldrich | 448931 | For surface treatment |
| Phosphate Buffered Saline | Fisher BioReagants | BP3994 | Diluted to 1x in ultrapure water, pH = 7.4 |
| Plasma cleaner | Harrick Plasma | PDC-001-HP | |
| Razor blade | Fisher Scientific | 12-640 | |
| RGD cell adhesive peptide | WatsonBio Sciences | Sequence: Ac-RGDSPGGC-NH2 | |
| Rheowin software | HAAKE | Software compatible with HAAKE viscometer | |
| Scalpel blade | Bard-Parker | 371210 | Size: #10 |
| Scalpel handle | Bard-Parker | 371030 | Size: #3 |
| Sodium Chloride | Fisher BioReagents | BP358-1 | For MethMal Synthesis MW: 58.44 Da |
| Sylgard 184 silicone elastomer kit | DOW Chemical | 2065622 | Base and curing agent |
| Triethylamine | Fisher Scientific | O4884-100 | For MethMal Synthesis MW: 101.19 Da Density: 0.73g/mL |
| Tygon tubing | Saint Gobain Performance Plastics | AAD04103 | ID: 0.51 mm OD: 1.52 mm |
| Varian Inova 500 Spectrometer | Varian | NMR Located in the UVA Biomolecular Magnetic Resonance Facility |
Références
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147(2019).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Advanced Functional Materials. 31 (35), 2104337(2021).
- Darling, N. J., Sideris, E., Hamada, N., Carmichael, S. T., Segura, T. Injectable and spatially patterned microporous annealed particle (MAP) hydrogels for tissue repair applications. Advanced Science. 5 (11), 1801046(2018).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science and Engineering. 5 (12), 6395-6404 (2019).
- Pruett, L., et al. Development of a microporous annealed particle hydrogel for long-term vocal fold augmentation. Laryngoscope. 130 (10), 2432-2441 (2020).
- Nih, L. R., Sideris, E., Carmichael, S. T., Segura, T. Injection of microporous annealing particle (MAP) hydrogels in the stroke cavity reduces gliosis and inflammation and promotes NPC migration to the lesion. Advanced Materials. 29 (32), (2017).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Schaeffer, C., et al. Injectable microannealed porous scaffold for articular cartilage regeneration. Annals of Plastic Surgery. 84, 6S Suppl 5 446-450 (2020).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Jivan, F., Alge, D. L. Bio-orthogonal, site-selective conjugation of recombinant proteins to microporous annealed particle hydrogels for tissue engineering. Advanced Therapeutics. 3 (1), 1900148(2020).
- de Rutte, J. M., Koh, J., di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomaterials Science and Engineering. 7 (2), 422-427 (2021).
- Darling, N. J., Hung, Y. S., Sharma, S., Segura, T. Controlling the kinetics of thiol-maleimide Michael-type addition gelation kinetics for the generation of homogenous poly(ethylene glycol) hydrogels. Biomaterials. 101, 199-206 (2016).
- Sandell, J. L., Zhu, T. C. A review of in-vivo optical properties of human tissues and its impact on PDT. Journal of Biophotonics. 4 (11-12), 773-787 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon