Method Article
Echtzeitanalyse der Bioenergetik in primären humanen retinalen Pigmentepithelzellen mittels hochauflösender Respirometrie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Der Stoffwechselstatus menschlicher retinaler Pigmentepithelzellen (H-RPE) spiegelt deren Gesundheit und Funktion wider. Hier wird ein optimiertes Protokoll zur Untersuchung des Echtzeit-Stoffwechselflusses von H-RPE mittels hochauflösender Respirometrie vorgestellt.
Zusammenfassung
Die metabolische Dysfunktion der retinalen Pigmentepithelzellen (RPE) ist eine der Hauptursachen für Netzhauterkrankungen wie die altersbedingte Makuladegeneration (AMD) und die proliferative Vitreoretinopathie (PVR). Da es sich bei RPE um hochmetabolisch aktive Zellen handelt, spiegeln Veränderungen in ihrem Stoffwechselstatus Veränderungen in ihrer Gesundheit und Funktion wider. Die hochauflösende Respirometrie ermöglicht die kinetische Analyse der beiden wichtigsten bioenergetischen Signalwege, der Glykolyse und der mitochondrialen oxidativen Phosphorylierung (OXPHOS), in Echtzeit durch Quantifizierung der extrazellulären Ansäuerungsrate (ECAR) bzw. der Sauerstoffverbrauchsrate (OCR). Im Folgenden finden Sie ein optimiertes Protokoll für die Durchführung hochauflösender Respirometrie an primären humanen retinalen Pigmentepithelzellen (H-RPE). Dieses Protokoll bietet eine detaillierte Beschreibung der Schritte, die bei der Erstellung bioenergetischer Profile von RPE erforderlich sind, um ihre basale und maximale OXPHOS- und glykolytische Kapazität zu definieren. Die Exposition von H-RPE bei verschiedenen Wirkstoffinjektionen, die auf die mitochondriale und glykolytische Maschinerie abzielen, führt zu definierten bioenergetischen Profilen, aus denen wichtige Stoffwechselparameter berechnet werden können. Dieses Protokoll unterstreicht die verbesserte Reaktion von BAM15 als Entkopplungsmittel im Vergleich zu Carbonylcyanid p-Trifluormethoxyphenylhydrazon (FCCP), um die maximale Atmungskapazität in RPE zu induzieren. Dieses Protokoll kann verwendet werden, um den bioenergetischen Status von RPE unter verschiedenen Krankheitsbedingungen zu untersuchen und die Wirksamkeit neuartiger Medikamente bei der Wiederherstellung des Grundumsatzstatus von RPE zu testen.
Einleitung
Retinale Pigmentepithelzellen (RPE) existieren als Monoschicht pigmentierter Epithelzellen, die strategisch zwischen den Photorezeptoren und dem fenestrierten Endothel der Choriocapillaris positioniert sind. RPE sind hochmetabolisch aktiv und haben zahlreiche Funktionen, darunter (1) Phagozytose von abgestoßenen Photorezeptorscheiben, (2) Recycling von Sehpigmenten zur Aufrechterhaltung des Sehzyklus, (3) Transport von Nährstoffen, Metaboliten, Ionen und Wasser, (4) Absorption von Licht, (5) Schutz vor Photooxidation, (6) Sekretion essentieller Faktoren zur Unterstützung der Netzhautintegrität und (7) Bildung der äußeren Blut-Netzhaut-Barriere1 . Die Degeneration von RPE ist mit Stoffwechselstörungen und mitochondrialen Defekten verbunden, die zu erblindenden Augenerkrankungen wie der altersbedingten Makuladegeneration (AMD) und der proliferativen Vitreoretinopathie (PVR) führen2.
Zwei wichtige bioenergetische Signalwege sind die Glykolyse, die im Zytoplasma stattfindet, und die oxidative Phosphorylierung (OXPHOS), die in den Mitochondrien stattfindet. Bei der Glykolyse wird ein Molekül Glukose in zwei Moleküle Pyruvat umgewandelt und es entsteht eine Nettoproduktion von zwei Molekülen Adenosintriphosphat (ATP). Im Gegensatz zur Glykolyse produziert OXPHOS weitaus höhere ATP-Konzentrationen (~32-38 ATP-Moleküle pro Glukosemolekül). Bemerkenswert ist, dass OXPHOS Sauerstoff verbraucht und funktionelle Mitochondrien benötigt, während die Glykolyse im Zytoplasma stattfindet und keinen Sauerstoff benötigt.
Vor der Einführung fluoreszenz- oder phosphoreszenzbasierter Techniken zur Untersuchung der mitochondrialen Atmung wurde der Sauerstoffgehalt in permeabilisierten Zellsuspensionen in Kammern gemessen, die mit einer Sauerstoffelektrode vom Clark-Typ3 ausgestattet waren. Die Clark-Elektrode ist zwar viel billiger als die fluoreszenzbasierte Respirometrie und funktioniert in nicht adhärenten Zellen, hat aber einen relativ geringen Durchsatz, da jeder Atemlauf etwa 15-20 Minuten dauert und weitaus höhere Zellmengen für jede Probe benötigtwerden 3. Damit hat die fluoreszenzbasierte Respirometrie-Technik die Clark-Elektrode weitgehend ersetzt und ist zu einer beliebten Technik in der Stoffwechsel- und Mitochondrienforschung geworden.
Dieses Protokoll beschreibt eine hochauflösende, fluoreszenzbasierte Respirometrietechnik mit hohem Durchsatz, bei der die OXPHOS- und glykolytischen bioenergetischen Profile lebender Zellen kinetisch gemessen werden. Da der Prozess von OXPHOS Sauerstoff verbraucht, wird das bioenergetische Profil für OXPHOS erstellt, indem Änderungen der Sauerstoffverbrauchsrate (OCR) im Laufe der Zeit abgebildetwerden 4. Bei dieser Technik sind zwei Fluorophore in die Sensorpatronenhülse eingebettet, die mit faseroptischen Bündeln verbunden ist, die Licht emittieren und die Fluorophore anregen. Änderungen der Fluorophoremission werden von hochempfindlichen Fluoreszenzsensoren gemessen und durch das Glasfaserbündel übertragen, das in eine OCR-Anzeige5 umgewandelt werden soll. Der Fluorophor wird durch Sauerstoff abgeschreckt und ermöglicht so die Bestimmung des extrazellulären Sauerstoffgehalts im Assay-Medium, der als Sauerstofffluss oder OCR bezeichnet wird. Der andere Fluorophor ist eine pH-Sensorsonde, die empfindlich auf Änderungen des Protonenausflusses reagiert und in ein Maß für die extrazelluläre Ansäuerungsrate (ECAR) umgewandelt wird. Während der Messungen werden die faseroptischen Bündel mit eingebetteten Fluorophoren auf 200 μm über der Zellmonoschicht abgesenkt, wodurch eine transiente Mikrokammer entsteht, die schnelle Messwerte in Echtzeit ermöglicht. Sobald eine Änderung des Sauerstoff- oder Protonengehalts um 10 % festgestellt wird, werden die Sensoren nach oben gehoben, sodass sich ein größeres Medienvolumen mit den transienten Mikrokammermedien vermischen kann, wodurch die OCR- und ECAR-Werte wieder auf den Ausgangswert zurückgesetzt werden. Jede Sensorkartusche ist mit vier Anschlüssen ausgestattet, um die sequenzielle Verabreichung von bis zu vier Verbindungen pro Well während des Assays zu ermöglichen. Vor und nach der Injektion der Verbindungen in jeden Port können Messungen durchgeführt werden, die wichtige Informationen über den Stoffwechselstatus der Zellen liefern.
Die Untersuchung dieser beiden unterschiedlichen Stoffwechselwege kann wichtige Erkenntnisse über den Stoffwechselstatus von RPE nach Exposition gegenüber verschiedenen pathogenen Reizen liefern und kann daher verwendet werden, um die Wirksamkeit von Medikamenten bei der Wiederherstellung der metabolischen Integrität von RPE zu testen 6,7,8. Das Aufkommen der Hochdurchsatz-Respirometrie und die Verfügbarkeit spezifischer mitochondrialer Inhibitoren haben mehr Forschung angeregt, um die bioenergetischen Profile von RPE zu definieren und Defekte im Stoffwechsel und in den Mitochondrien während der Krankheitszuständezu identifizieren 6,7,8,9,10,11,12,13 . Die hochauflösende Respirometrie hat die Schlüsselrolle der metabolischen Reprogrammierung von RPE bei Netzhautpathologien wie AMD und PVR hervorgehoben. Zwei Schlüsselzytokine, die an der Pathogenese von AMD und PVR beteiligt sind, sind der transformierende Wachstumsfaktor-beta 2 (TGFβ2) und der Tumornekrosefaktor-alpha (TNFα). Die Induktion der epithelial-mesenchymalen Transition (EMT) durch TGFβ2 geht mit einer mitochondrialen Dysfunktion, einer OXPHOS-Suppression und einer kompensatorischen Erhöhung der glykolytischen Kapazität in RPE6 einher. In jüngerer Zeit wurde gezeigt, dass das proinflammatorische Zytokin TNFα eine signifikante Hochregulation von basalem OXPHOS und eine reduzierte Glykolyse in H-RPE7 induziert. Die Verabreichung von Dimethylfumarat unterdrückte signifikant die TNFα-induzierte Entzündung in H-RPE und stellte die mitochondriale Morphologie und die basalen bioenergetischen Profile wieder her7. Die divergierenden Stoffwechselprofile, die durch diese beiden Wachstumsfaktoren induziert werden, regen zu faszinierenden mechanistischen Fragen hinsichtlich der Beteiligung der metabolischen Reprogrammierung an Netzhauterkrankungen an. Das folgende Protokoll beschreibt die Schritte zur Beurteilung von OXPHOS und glykolytischen bioenergetischen Profilen in H-RPE mittels hochauflösender Respirometrie.
Protokoll
1. Plattieren von H-RPE in der Zellkulturplatte
- H-RPE wird in einem T25-Kolben in humanem RPE-Medium aufgetaut, das mit RPE-Wachstumsmedium (4 mM L-Glutamin, 25 ng/ml FGF-2, 2 % FBS, 30 mg/ml Gentamicin und 15 μg/ml Amphotericin) ergänzt wird.
- Inkubieren Sie die Zellen bei 37 °C und 5 % CO2 in einem befeuchteten Inkubator. Aktualisieren Sie das Medium am nächsten Tag und warten Sie, bis die Zellen eine Konfluenz von mindestens 80 % erreicht haben, bevor Sie sie im Verhältnis 1:3 in einen T75-Kolben geben.
- Sobald die Zellen konfluiert sind, passieren Sie die Zellen mit dem Subkultur-Reagenzien-Kit, das aus einer 0,025%igen Trypsin/EDTA-Lösung, einer Trypsin-Neutralisationslösung und HEPES-gepufferter Kochsalzlösung (pH 7,0-7,6) besteht.
- Spülen Sie H-RPE vorsichtig mit 3 ml HEPES-gepufferter Kochsalzlösung. Dann werden 3 ml Trypsin/EDTA hinzugefügt und 5 Minuten lang inkubiert (37 °C und 5 % CO2) (oder bis sich die Zellen vom Boden des Kolbens abgehoben haben, wie unter dem Mikroskop beobachtet). Neutralisieren Sie das Trypsin/EDTA mit 3 ml Trypsin-Neutralisationslösung.
- Zentrifugieren Sie die Zellen bei 200 x g für 3,5 Minuten, um das Zellpellet zu bilden. Saugen Sie den Überstand vorsichtig ab und entsorgen Sie ihn.
- Resuspendieren Sie die Zellen in humanem RPE-Medium auf eine Endkonzentration von 20.000 Zellen pro 100 μl pro Well.
- Pipettieren Sie mehrmals auf und ab, um sicherzustellen, dass die Zellsuspension homogen ist, und verwenden Sie eine Mehrkanalpipette, um das Pipettieren in die 96-Well-Zellkultur-Mikrotiterplatte zu erleichtern und konsistent zu halten. Legen Sie die Pipettenspitze direkt unter den kreisförmigen Rand oben in der Vertiefung, um eine gleichmäßige, homogene Zellschicht zu erhalten.
HINWEIS: Es ist keine Beschichtung erforderlich, da die Zellen gut auf der Mikrotiterplatte haften. - Achten Sie darauf, die vier Eckvertiefungen leer von Zellen zu lassen (nur 100 μl Medium), um als Hintergrundkorrekturvertiefungen zu dienen (Abbildung 1A).
HINWEIS: Die Mikrotiterplatte ist in einem typischen 96-Well-Plattendesign formatiert. Die Oberfläche jedes Wells beträgt jedoch 0,106cm2, was 40 % kleiner ist als bei einer Standardplatte mit 96 Wells. Bei dieser Zelldichte sollten die Zellen am nächsten Tag zu 100% konfluent sein. Es wird empfohlen, vor dem Testen der Behandlungen zunächst ein Experiment zur Optimierung der Zelldichte durchzuführen, um sicherzustellen, dass die basalen OCR- und ECAR-Werte bei etwa 50-100 pmol/min bzw. 10-20 mpH/min liegen.
- Pipettieren Sie mehrmals auf und ab, um sicherzustellen, dass die Zellsuspension homogen ist, und verwenden Sie eine Mehrkanalpipette, um das Pipettieren in die 96-Well-Zellkultur-Mikrotiterplatte zu erleichtern und konsistent zu halten. Legen Sie die Pipettenspitze direkt unter den kreisförmigen Rand oben in der Vertiefung, um eine gleichmäßige, homogene Zellschicht zu erhalten.
- Lassen Sie die Zellkulturplatte 1 Stunde bei Raumtemperatur (RT) stehen, bevor Sie sie wieder in den Inkubator (5% CO2, 37 °C, befeuchtet) stellen, um Kanteneffekte zu minimieren. Randeffekte sind Änderungen des Medienvolumens in den Wells der peripheren Ränder der 96-Well-Platte aufgrund von Verdunstung14.
HINWEIS: Die Zellen haften über Nacht und bilden am nächsten Tag eine konfluierende Monoschicht. H-RPE reifen mindestens 1 Monat in der Platte, indem alle 2-3 Tage die Hälfte des Nährmediums aufgefrischt wird. - Untersuchen Sie die Zellen unter dem Mikroskop, bevor Sie das Medium wechseln, um ihre Morphologie und ihren Pigmentierungsgrad zu überprüfen. Stellen Sie sicher, dass die Zellen mit einer charakteristischen kopfsteinpflasterartigen Morphologie zusammenfließen und im Laufe der Zeit Pigmentierung annehmen, wie in den Morphologiebildern von Shu et al.7 zu sehen ist.
2. Am Tag vor der Durchführung des Assays
- Stellen Sie sicher, dass die Sensorkartusche am Tag vor dem Assay hydratisiert ist, indem Sie jede Vertiefung der Versorgungsplatte mit 200 μl deionisiertem Wasser füllen.
HINWEIS: Der Deckel der Utility-Platte enthält fluoreszierende Biosensoren zur Messung des Sauerstoff- und pH-Werts für jede Well. Die Sensoren sind mit faseroptischen Wellenleitern gekoppelt, die Licht mit unterschiedlichen Anregungswellenlängen abgeben und ein Fluoreszenzsignal durch optische Filter an Photodetektoren weiterleiten. - Legen Sie die in Wasser getauchte Sensorkartusche zusammen mit ~20 ml des Kalibers (zum Aufwärmen für den nächsten Tag) über Nacht in einen bei 37 °C befeuchteten Ofen (ohne CO2) in die Versorgungsplatte.
Anmerkungen: Das Kaliber ist eine proprietäre Lösung, die für die Kalibrierung von Sensorkartuschen entwickelt wurde und in seiner Zusammensetzung wahrscheinlich der phosphatgepufferten Kochsalzlösung (PBS) ähnelt. Die Mindestzeit für die Hydratation der Kartusche beträgt 4 Stunden, aber die besten Ergebnisse werden mit einer Hydratation über Nacht erzielt. - Stellen Sie sicher, dass das Gerät eingeschaltet ist, und starten Sie die Software, damit sich das Gerät über Nacht auf 37 °C stabilisieren kann (Abbildung 2). Im Allgemeinen kann das Instrument auch bei Nichtgebrauch eingeschaltet bleiben.
3. Echtzeit-Mido-Stresstest mit dem extrazellulären Flussanalysator
- Ersetzen Sie am Tag des Assays mindestens 45 Minuten vor dem Ausführen des Assays das Wasser in der Utility-Platte durch ein gleiches Volumen des erwärmten Kalibers.
- Stellen Sie die Mito-Stresstest-Testmedien unter Verwendung des Basismediums ohne Phenolrot durch Zugabe von Nahrungsergänzungsmitteln her, wie in Tabelle 1 gezeigt. Erwärmen Sie das Medium auf 37 °C, stellen Sie den pH-Wert auf 7,4 ein und vakuumfiltrieren Sie das Medium mit einer Röhrenaufsatzfiltereinheit. Um eine volle Platte zu betreiben, stellen Sie ~25 ml Assay-Medium her.
- Entfernen Sie das humane RPE-Medium und ersetzen Sie es durch 180 μl frisch vorbereitetes Assay-Medium (Schritt 3.2). Legen Sie die Zellkulturplatte für 1 h in einen befeuchteten 37 °C heißen Ofen (ohne CO2), bevor Sie mit dem Assay beginnen.
HINWEIS: Dies ist wichtig für die Entgasung der Zellplatte, um eine CO2 - Diffusion zu ermöglichen. Da sich die Zellen nicht mehr in ihren Wachstumsmedien und nicht mehr in einem Inkubator mit CO2 befinden, verschlechtert sich ihre Lebensfähigkeit mit der Zeit, daher sollte darauf geachtet werden, den Assay so effizient wie möglich durchzuführen. Es sollte auch darauf geachtet werden, dass sich keine Blasen in der Zellkulturplatte befinden. Wenn welche vorhanden sind, drücken Sie sie mit einer Pipette oder Nadel ein. - Jede Sensorkartusche verfügt über vier Reagenzien-Abgabeöffnungen pro Well für die Injektion von Testverbindungen in die Wells der Zellkulturplatte während des Assays (Abbildung 1C, D). Bereiten Sie ~3 ml der 10-fachen Arzneimittellösungen vor, indem Sie die Arzneimittelvorräte in den jeweiligen Assaymedien gemäß Tabelle 2 verdünnen. Beladen Sie z. B. Port A mit 25 μM Oligomycin, das in den Mito Stress Test-Assaymedien gelöst ist, so dass bei der Injektion des Wirkstoffvolumens in die Vertiefung durch das Gerät die Endkonzentration, der jede Zelle ausgesetzt ist, 2,5 μM beträgt. Pipettieren Sie 20 μl des 10-fachen Wirkstoffvorrats in Anschluss A, 22 μl in Anschluss B, und 25 μl in Port C, um die spezifizierte Endkonzentration des Wirkstoffs in jeder Vertiefung zu erreichen. Bei Protokollen, die alle vier Arzneimittelanschlüsse erfordern, pipettieren Sie 28 μl in Anschluss D.
Anmerkungen: Beachten Sie Abbildung 1B , wenn Sie die Arzneimittel in die Arzneimittelanschlüsse pipettieren, um die richtige Ausrichtung der Anschlüsse A/B/C/D zu erfahren. Die Kerbe am Rand der Kartusche sollte sich beim Laden der Medikamentenöffnungen in der unteren linken Ecke befinden. Durch das Pipettieren in einem Winkel in jeden Medikamentenanschluss können Blasen minimiert werden. Wenn Blasen vorhanden sind, sollte darauf geachtet werden, diese mit einer Pipette oder Nadel zu öffnen. - Öffnen Sie die Registerkarte Vorlagen in der Analysesoftware, wählen Sie Mito-Stresstest aus und füllen Sie die Gruppendefinitionen aus.
- Geben Sie Details zur Injektionsstrategie ein (in diesem Fall ist sie als Mito-Stresstest-Medikament voreingestellt). Eingabedetails zu den verschiedenen Versuchsgruppen im Assay (z. B. Kontrolle oder Behandlung). Geben Sie Details zu den Assay-Medien ein (Zugabe verschiedener Ergänzungen und ihrer spezifischen Konzentrationen zu den Basis-Assay-Medien ) und fügen Sie schließlich den Zelltyp hinzu.
- Klicken Sie auf die nächste Registerkarte, Plattenkarte, wo die verschiedenen untersuchten Gruppen ihrer spezifischen Position auf der 96-Well-Plattenkarte zugewiesen werden. Sobald dies erledigt ist, klicken Sie auf die Registerkarte Protokoll , um das Geräteprotokoll für das Standardprotokoll des Mito Stress Test zu überprüfen.
HINWEIS: Die standardmäßige Mito-Stresstest-Vorlage ist gebrauchsfertig, kann aber beliebig an das Versuchsdesign angepasst werden. Die Standardmesszeit beträgt beispielsweise 3 Minuten, kann aber bei Bedarf auf 5 Minuten geändert werden.
- Klicken Sie auf Assay ausführen und setzen Sie die Sensorkartusche, die in die Kaliberlösung eingetaucht ist, in die Versorgungsplatte ein. Dieser Vorgang dauert ca. 25 Minuten. In diesem Schritt wird jeder Biosensor unabhängig auf der Grundlage des in der Kaliberlösung gemessenen Sensorausgangs mit bekanntem pH- und Sauerstoffgehalt kalibriert.
- Sobald dies kalibriert ist, entfernen Sie die Nutzplatte und setzen Sie die Zellkulturplatte ein.
HINWEIS: Die Zellkulturplatte wird zuerst äquilibriert, woraufhin das Gerät mit dem Mischen des Assay-Mediums und der Messung der OCR- und ECAR-Werte beginnt. Dieser Schritt dauert ca. 1,5 Stunden und wird im Inneren des Geräts durchgeführt, ohne dass der Benutzer eingreifen muss. Ein Ausgangswert von OCR und ECAR wird zunächst durch Mischen der Assay-Medien für 3 Minuten und anschließendes Messen von OCR und ECAR für 3 Minuten festgelegt. Das Instrument führt drei Misch- und Messschleifen durch. - Nach der Basismessung injiziert das Gerät automatisch die Port A-Arzneimittellösung in jede Vertiefung. Es folgen drei Misch- und Messschleifen (je 3 min). Das gleiche Muster tritt nach jeder nachfolgenden Medikamenteninjektion auf (Ports B und C).
- Sobald dies kalibriert ist, entfernen Sie die Nutzplatte und setzen Sie die Zellkulturplatte ein.
- Entfernen Sie nach Abschluss des Laufs die Zellkulturplatte und die Sensorkartusche. Stellen Sie zur Qualitätskontrolle sicher, dass alle Arzneimittelanschlüsse in der Sensorkartusche injiziert wurden, indem Sie die Anschlüsse untersuchen, um sicherzustellen, dass keine Arzneimittelrückstände zurückbleiben. Entsorgen Sie die Sensorkartusche und die Utility-Platte, da es sich um Einwegartikel handelt.
- Untersuchen Sie die Zellen in der Zellkultur-Mikrotiterplatte unter dem Mikroskop, um sicherzustellen, dass noch eine konfluente Monoschicht von Zellen vorhanden ist. Verwerfen Sie das Assay-Medium und ersetzen Sie es durch 60 μl 1x Lysepuffer in jeder Vertiefung.
Anmerkungen: Der Lysepuffer besteht aus 10x Lysepuffer, der in deionisiertem Wasser unter Zusatz von 1 mM Phenylmethylsulfonylfluorid (PMSF) zu 1x verdünnt wird. - Wickeln Sie die Ränder der Platte in Parafilm ein, um eine Verdunstung zu verhindern, und legen Sie sie in einen -80 °C-Gefrierschrank, um die Zelllyse über Nacht zu unterstützen, bevor Sie den Proteingehalt mit dem BCA-Assay quantifizieren.
- Normalisieren Sie für die Datenanalyse alle Daten, indem Sie die OCR- und ECAR-Werte durch das Mikrogramm Protein in jeder Vertiefung dividieren. Exportieren Sie den Mito Stress Test Report Generator, der Excel-Makros verwendet, um die Mito Stress Test-Parameter mithilfe der Datenanalysesoftware automatisch zu berechnen.
HINWEIS: Dies kann verwendet werden, um die Basalatmung, die maximale Atmung, die freie Atemkapazität, den Protonenaustritt, die ATP-Produktion und die nicht-mitochondriale Atmung zu bestimmen. Definitionen dieser Berechnungen sind in Tabelle 3 aufgeführt.
4. Glykolytischer Belastungstest in Echtzeit mit dem extrazellulären Flussanalysator
- Führen Sie den glykolytischen Stresstest durch, indem Sie die gleichen Schritte wie beim Mito-Stresstest ausführen, mit Ausnahme der verschiedenen Assay-Medienpräparate und Arzneimittelinjektionen, die in Tabelle 1 und Tabelle 2 aufgeführt sind.
- Exportieren Sie für die Datenanalyse den Berichtsgenerator für den glykolytischen Stresstest, der Excel-Makros verwendet, um die Parameter des glykolytischen Stresstests automatisch aus der Datenanalysesoftware zu berechnen.
HINWEIS: Dies kann verwendet werden, um die nicht-glykolytische Ansäuerung, Glykolyse, die glykolytische Kapazität und die glykolytische Reserve zu bestimmen. Definitionen dieser Berechnungen sind in Tabelle 3 aufgeführt.
5. BCA-Protein-Quantifizierungs-Assay
HINWEIS: Der Bicinchonsäure (BCA) Protein-Quantifizierungs-Assay (auch bekannt als Smith-Assay15) ist ein kolorimetrischer Assay auf Kupferbasis, der zur Bestimmung des Gesamtproteingehalts in einer Probe verwendet wird. Durch die Normalisierung von OCR- und ECAR-Daten auf das Mikrogramm Protein in jeder Vertiefung wird sichergestellt, dass unterschiedliche Mengen an Zellen/Proteinen in jeder Vertiefung die Messwerte nicht verzerren. Der Mechanismus des BCA-Assays basiert auf zwei chemischen Reaktionen. Zum einen reduzieren die Peptidbindungen in Proteinen Kupferionen (Cu2+) zu Kupferionen (Cu+), was eine temperaturabhängige Reaktion ist, die durch höhere Temperaturen (37 bis 60 °C) unterstützt wird. Wenn mehr Peptidbindungen vorhanden sind, wird die Menge anCu2+ proportional zum Proteingehalt in der Lösung16. Diese Reaktion führt zu einem Farbwechsel von grün zu einer intensiven violetten Lösung mit einer maximalen Absorption bei 562 nm16. Je höher der Proteingehalt in der Probe ist, desto höher ist die Absorption bei dieser Wellenlänge. Der Arbeitsbereich dieses Kits liegt bei 20-2.000 μg/ml.
- Das BCA-Assay-Kit enthält 1 ml Aliquots Rinderserumalbumin (BSA) mit 2 mg/ml, das als Referenzstandard für die Proteinkonzentration dient. Bereiten Sie eine serielle Verdünnung in einer klaren, flachen 96-Well-Platte vor, indem Sie mit dem unverdünnten 2 mg/ml BSA beginnen und anschließend die Konzentration durch Verdünnung in deionisiertem Wasser (z. B. 2, 1, 0,5, 0,25, 0,125 mg/ml usw.) halbieren. Die Verwendung einer bekannten Proteinkonzentration ermöglicht die Berechnung einer Standardkurve, mit der der Proteingehalt der experimentellen Proben berechnet wird. Um die Genauigkeit der berechneten Proteingehaltsmessungen zu verbessern, messen Sie die Absorptionswerte der Proteinkonzentrationsreferenzstandards zusammen mit den experimentellen Proben für jeden Assay.
- Pipettieren Sie 25 μl jeder BSA-Reihenverdünnung in zweifacher Ausführung in die 96-Well-Platte.
- Pipettieren Sie 25 μL des 1x Lysepuffers in zweifacher Ausführung in die 96-Well-Platte, die als Rohling dient.
- Tauen Sie die Zellkulturplatte auf Raumtemperatur auf und pipettieren Sie 25 μl jedes Zelllysats in zweifacher Ausführung in die 96-Well-Platte.
- Bereiten Sie das Arbeitsreagenz in einem Verhältnis von 50:1 der BCA-Kit-Reagenzien A:B vor. Mischen Sie es gründlich durch Vortexen, um jegliche Trübung im Arbeitsreagenz zu entfernen, so dass es sich um eine homogene grüne Lösung handelt. Geben Sie 200 μl des Arbeitsreagenzes in jede Vertiefung.
- Schützen Sie die Platte vor Licht, indem Sie die Platte mit Folie abdecken und 20 Minuten lang in einem 37 °C heißen Ofen inkubieren.
- Messen Sie die Absorption bei 562 nm in einem 96-Well-Plattenlesegerät.
- Ermitteln Sie für die Datenanalyse den Mittelwert aller doppelten Werte. Subtrahieren Sie die Blindabsorptionswerte, die aus den 1x-Lysepuffervertiefungen bestimmt wurden, von den Messungen aller Proben. Bestimmen Sie die Standardkurve, indem Sie die Absorption jedes BSA-Standards auf seine bekannte Konzentration in μg/ml auftragen. Verwenden Sie die lineare Gleichung, die aus der Standardkurve abgeleitet ist, um die Proteinkonzentration der experimentellen Proben zu bestimmen.
Ergebnisse
Das Gerät misst gleichzeitig OCR und ECAR für jeden Durchlauf. Für den Mito-Stresstest basieren die Parameterberechnungen auf OCR-Messwerten (Abbildung 3A), während die Parameterberechnungen für den glykolytischen Stresstest auf ECAR-Messwerten basieren (Abbildung 3B). Abbildung 3 zeigt repräsentative Diagramme für die OCR-Kurve des Mito-Stresstests über die Zeit (Abbildung 3C) und Parameterberechnungen in Form von Balkendiagrammen für H-RPE (Abbildung 3D). Der glykolytische Stresstest wird als ECAR-Kurve über die Zeit dargestellt (Abbildung 3E), und Parameterberechnungen werden in Balkendiagrammen für H-RPE angezeigt (Abbildung 3F).
Die Basalatmung vermittelt ein Verständnis für den Energiebedarf der Zellen unter basalen Bedingungen17. Die erste Wirkstoffinjektion, Oligomycin (Oligo), ist ein ATP-Synthase-Hemmer, und daher ist jede Verringerung der OCR nach der ersten Medikamenteninjektion ein Maß für die ATP-verknüpfte Atmung18. Jede verbleibende Basalatmung nach nachfolgenden Medikamenteninjektionen wird als Protonenleck angesehen, da sie nicht an die ATP-Synthese gekoppelt ist. Ein erhöhtes Protonenleck kann auf eine verstärkte mitochondriale Entkopplung hinweisen, die durch physiologisch vorhandene Entkopplungsproteine reguliert wird, aber auch mit Pathologien wie Fettleibigkeit, Krebs, Typ-2-Diabetes und Herz-Kreislauf-Erkrankungen in Verbindung gebracht wurde19. Die zweite Injektion erfolgt mit einem Entkopplungsmittel, wie z.B. BAM15 oder FCCP, um das maximale Atmungspotenzial der Mitochondrien zu bestimmen. Entkopplungsmittel lassen den Protonengradienten kollabieren und verringern die Protonenantriebskraft über die mitochondriale Innenmembran. Das Ergebnis ist ein ungehinderter Elektronenfluss durch die Elektronentransportkette (ETC), der den Sauerstoffverbrauch erhöht und dazu führt, dass die mitochondriale Atmung ihre maximale Kapazität erreicht20. Die freie Atemkapazität (SRC) ist die Differenz zwischen maximaler und basaler Atmung und gibt die Fähigkeit der Zellen an, auf Änderungen des Energiebedarfs zu reagieren, wenn sie herausgefordert werden, was auf die Zellfitness hinweist. Wichtig ist, dass BAM15 für den Mito-Stresstest in H-RPE FCCP bei der Verbesserung der mitochondrialen Atmungskapazität überlegen ist (Abbildung 4A,B), da die maximale Atmung und die Ersatzatmungskapazität mit 10 μM BAM15 signifikant höher sind als mit 500 nM oder 1 μM FCCP. Es wurden keine signifikanten Unterschiede zwischen den beiden FCCP-Dosen beobachtet. Die dritte und letzte Injektion von Rotenon und Antimycin A (Rot/AA) hemmt die mitochondrialen Komplexe I bzw. III des ETC, wodurch die mitochondriale Atmung heruntergefahren wird. jede verbleibende OCR ist auf nicht-mitochondriale Quellenzurückzuführen 21.
Bei der Glykolyse wird ein Molekül Glukose unter Ausschluss von Sauerstoff in zwei Moleküle Laktat umgewandelt. Die Extrusion von Laktat aus der Zelle geht mit dem Ausfluss von einem Proton pro Laktatmolekül einher, was zu einer Übersäuerung des extrazellulären Raums führt. Der Fluss der Protonenproduktion im Medium wird durch Änderungen der ECAR gemessen. Zuerst werden die basalen Glykolysespiegel bestimmt, danach wird die Glukose in das glukosefreie Assaymedium injiziert, um die Glykolyse zu induzieren und so die ECAR-Spiegelzu erhöhen 22. Oligomycin wird injiziert, um die "höchste" ECAR zu induzieren, da es die mitochondriale ATP-Produktion stoppt und so die Zelle zwingt, ihr ATP durch Glykolyse abzuleiten. Schließlich wird die Glykolyse durch Zugabe von 2DG gestoppt, das die Hexokinase, das erste Enzym der Glykolyse23, hemmt. Jede verbleibende ECAR ist wahrscheinlich auf andere Versauerungsquellen zurückzuführen, wie z. B. die CO2 -Produktion durch den TCA-Zyklus während OXPHOS, und wird als nicht-glykolytische ECAR bezeichnet. Die glykolytische Reserve wird als Differenz zwischen dem "höchsten" ECAR und dem ECAR in Gegenwart von Glukose berechnet. Die glykolytische Kapazität ist die Summe aus Glykolyse und glykolytischer Reserve.
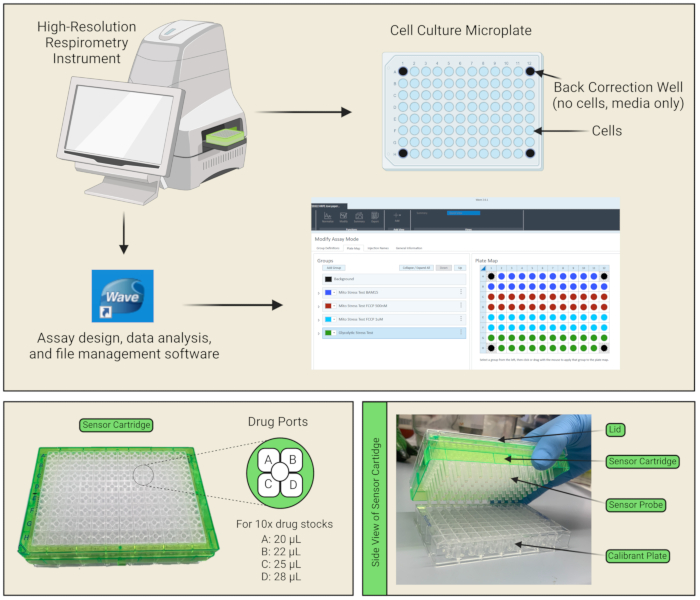
Abbildung 1: Komponenten der Platte und der Sensorkassette . (A) Das Gerät, die Datenanalysesoftware und die Protokoll-Setup-Schnittstelle werden gezeigt. Im 96-Well-Kulturplatten-Layout sind die Zellen in den blau gefärbten Wells plattiert und die vier Eckwells sind schwarz markiert, da sie als Back-Correction-Wells dienen, die nur Medien (und keine Zellen) enthalten. (B) Für jede Vertiefung der Sensorkartusche befinden sich vier Medikamentenanschlüsse, in die die Arzneimittel A, B, C und D geladen werden können. Die Volumina, die in jeden Port pipettiert werden müssen, sind auf der Grundlage der Berechnungen für 10x Arzneimittelvorratspräparate aufgeführt. (C) Die Sensorkartusche besteht aus Sensorsonden, die direkt in die mit dem Bremssattel gefüllte Versorgungsplatte eingesetzt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
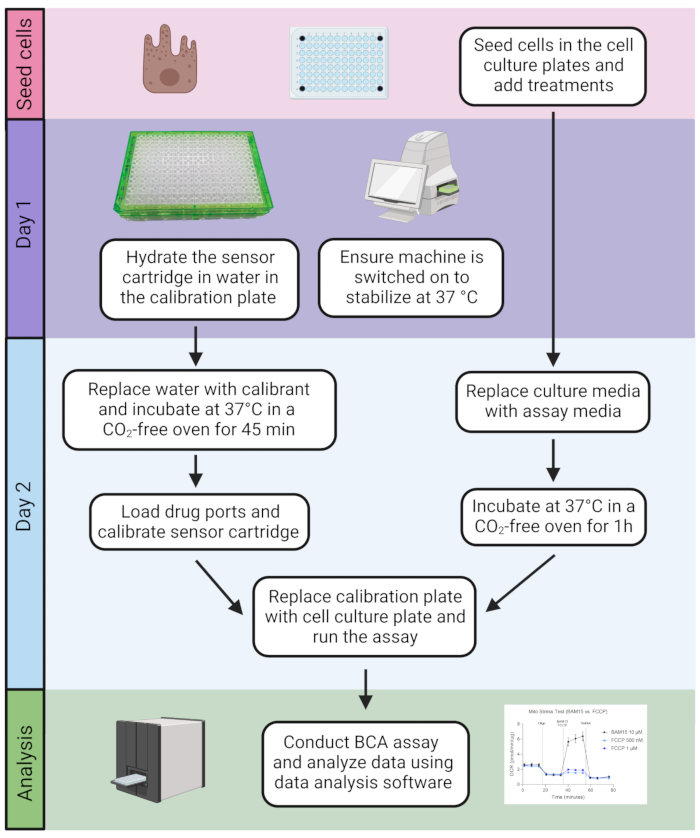
Abbildung 2: Zeitlicher Ablauf des Assays. Die Zellen werden in die Zellkulturplatte eingesät. Sobald der Assay fertig ist, umfasst er ein 2-tägiges Verfahren, gefolgt von der Quantifizierung des Proteingehalts mit dem BCA-Assay und der anschließenden Datenanalyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
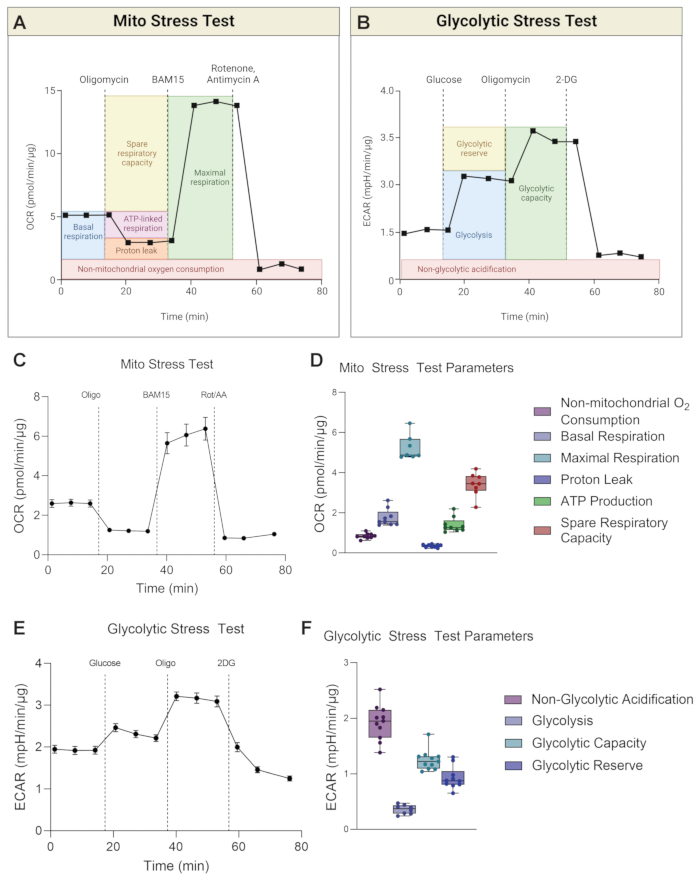
Abbildung 3: Repräsentative Grafiken des Mito-Stresstests und des glykolytischen Stresstests. Die Berechnungen der Parameter (A) des Mito-Stresstests und (B) des glykolytischen Stresstests sind im Schaltplan dargestellt. (C) Repräsentative Sauerstoffverbrauchskurve (OCR) und (D) Mito-Stresstest-Parameter für H-RPE werden gezeigt. (E) Repräsentative extrazelluläre Ansäuerungsrate (ECAR)-Kurve und (F) Glykolytische Stresstestparameter für H-RPE werden gezeigt. Fehlerbalken sind Mittelwerte ± SEM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
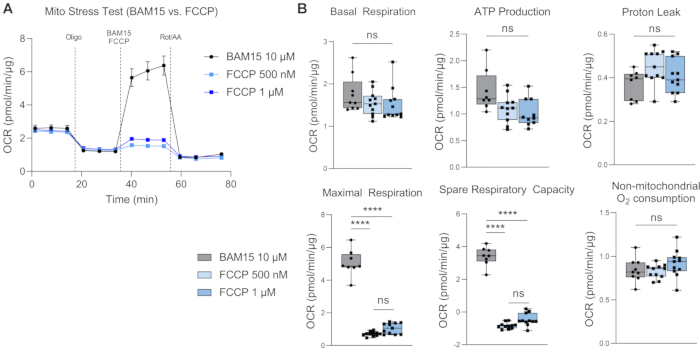
Abbildung 4: Vergleich von BAM15 mit FCCP als Entkopplungsmittel. Mito-Stresstest auf H-RPE, bei dem die Wirksamkeit der Induktion der maximalen Atmung mit 10 μM BAM15, 500 nM FCCP oder 1 μM FCCP verglichen wird, wobei die (A) OCR-Kurve (Sauerstoffverbrauchsrate) und (B) die Parameter des Mito-Stresstests gezeigt werden. Fehlerbalken sind Mittelwerte ± SEM. **** p ≤ 0,0001; ns, nicht signifikant. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Test | Glukose (mM) | GlutaMax (mM) | Natriumpyruvat (mM) | HEPES (mM) |
| Mito Stresstest | 25 | 2 | 1 | 1 |
| Glykolytischer Belastungstest | Nichts | 0.5 | Nichts | 1 |
Tabelle 1: Konzentration der Nahrungsergänzungsmittel, die den Testmedien für den Mito- und den Glykolytischen Belastungstest zugesetzt wurden.
| Test | Anschluss A | Anschluss B | Anschluss C |
| Mito Stresstest | Oligomycin 2,5 μM | FCCP 500 nM ODER BAM15 10 μM | Rotenon 2 μM UND Antimycin A 2 μM |
| Glykolytischer Belastungstest | Glukose 10 mM | Oligomycin 2 μM | 2-Desoxyglucose 50 mM |
Tabelle 2: Konzentrationen von Drug-Port-Injektionen für den Mito- und den Glykolytischen Belastungstest. Es ist wichtig zu beachten, dass dies die endgültigen Konzentrationen sind, denen die Zellen nach der Injektion der Medikamente in jede Vertiefung ausgesetzt sind. Die Medikamente sollten beim Beladen der Medikamentenports 10x stärker vorbereitet werden.
| Ausdruck | Definition | |||
| Kaliber | Der Kaliber ist eine Lösung, die zur Kalibrierung der Sensorkartusche verwendet wird. Seine Formulierung ist proprietär und hat eine ähnliche Zusammensetzung wie PBS. | |||
| Sensor-Kartusche | Die Sensorkartusche enthält zwei in die Sensorpatronenhülse eingebettete Fluorophore, die mit Glasfaserbündeln verbunden sind, die Licht emittieren und die Fluorophore anregen. Ein Fluorophor misst den Sauerstofffluss und der andere den Protonenfluss. Jede Sensorkartusche ist außerdem mit 4 Anschlüssen ausgestattet, um die sequenzielle Verabreichung von bis zu 4 Verbindungen pro Well während des Assays zu ermöglichen. | |||
| Utility-Platte | Die Utility-Platte (auch Kaliberplatte genannt) dient zur Kalibrierung der Sensoren. Die Calibrant-Lösung wird in die Utility Plate eingelegt. | |||
| Mito Stresstest | Der Mito-Stresstest ist der Name für den Assay, der das bioenergetische Profil der mitochondrialen Atmung liefert, indem Änderungen der OCR im Laufe der Zeit aufgezeichnet werden. | |||
| Glykolytischer Belastungstest | Der glykolytische Stresstest ist der Name des Assays, der das glykolytische bioenergetische Profil liefert, indem Änderungen der ECAR im Laufe der Zeit aufgezeichnet werden. | |||
| Sauerstoffverbrauchsrate (OCR) | Die Sauerstoffverbrauchsrate ist ein Maß für den Sauerstofffluss (pmol/min) und gibt den mitochondrialen Stoffwechselstatus an. | |||
| Extrazelluläre Versauerungsrate (ECAR) | Die extrazelluläre Ansäuerungsrate ist ein Maß für den Protonenausfluss (mpH/min) und gibt den glykolytischen Stoffwechselstatus an. | |||
| Wave-Software | Die Wave-Software wird für die Programmierung des Assays und die anschließende Datenanalyse verwendet | |||
| Nicht-mitochondrialer Sauerstoffverbrauch | Messung der Mindestrate nach Rotenon/Antimycin A-Injektion | |||
| Basale Atmung | (Messung der letzten Frequenz vor der ersten Injektion) – (Nicht-mitochondriale Atmungsrate) | |||
| Maximale Atmung | (Messung der maximalen Rate nach FCCP-Injektion) – (Nicht-mitochondriale Atmung) | |||
| H+ (Proton) Leck | (Messung der Mindestrate nach Oligomycin-Injektion) – (Nicht-mitochondriale Atmung) | |||
| ATP-Produktion | (Letzte Ratenmessung vor der Oligomycin-Injektion) – (Minimale Ratenmessung nach Oligomycin-Injektion) | |||
| Freie Atemkapazität | (Maximale Atmung) – (Basale Atmung) | |||
| Reserve-Atmungskapazität in % | (Maximale Atmung) / (Basalatmung) × 100 | |||
| Effizienz der Kopplung | ATP-Produktionsrate) / (Basalatmungsrate) × 100 | |||
| Glykolyse | (Messung der maximalen Rate vor der Injektion von Oligomycin) – (Messung der letzten Rate vor der Injektion von Glukose) | |||
| Glykolytische Kapazität | (Messung der maximalen Rate nach der Injektion von Oligomycin) – (Messung der letzten Rate vor der Injektion von Glukose) | |||
| Glykolytische Reserve | (Glykolytische Kapazität) – (Glykolyse) | |||
| Glykolytische Reserve in % | (Glykolytische Kapazitätsrate) /(Glykolyse) × 100 | |||
| Nicht-glykolytische Ansäuerung | Letzte Geschwindigkeitsmessung vor der Glukoseinjektion | |||
Tabelle 3: Liste der Definitionen der wichtigsten Komponenten des Assays.
Diskussion
Dieses optimierte Protokoll für die hochauflösende Respirometrie von H-RPE beinhaltet die Verwendung von BAM15 als Entkoppler anstelle des üblicherweise verwendeten FCCP. Während frühere Studien zur hochauflösenden Respirometrie von RPE FCCP 9,24 verwendeten, scheint BAM15 im Vergleich zu FCCP eine robustere Induktion der maximalen Atmung in H-RPE zu induzieren. Während sowohl FCCP als auch BAM15 sicher in Zellen angewendet werden können, wird berichtet, dass BAM15 im Vergleich zu FCCP oder Carbonylcyanid-3-chlorphenylhydrazon (CCCP) weniger Nebenwirkungen in normalen Zellen hat25. Kenwood et al. zeigten, dass BAM15 die Mitochondrien depolarisiert, ohne das Plasmamembranpotential zu beeinträchtigen, und so eine anhaltende maximale mitochondriale Atmungsrate bei niedriger Zytotoxizität induziert26. FCCP hingegen depolarisiert sowohl die Mitochondrien als auch die Plasmamembran und weist eine höhere Zytotoxizitätauf 26.
Das Protokoll besteht aus mehreren kritischen Schritten, einschließlich der Sicherstellung, dass die Zellen in allen experimentellen Vertiefungen der Mikrotiterplatte ordnungsgemäß in einer konfluenten, gleichmäßigen und homogenen Monoschicht aus RPE plattiert sind. Reife RPE sind für die Energiegewinnung in hohem Maße von OXPHOS abhängig, daher sollten die Zellen mindestens 1 Monat lang reifen gelassen werden, um sicherzustellen, dass die RPE während des Assays korrekte basale und maximale OCR-Werte erzeugen. Die Entgasung der Zellkulturplatte für 1 h bei 37 °C in einem befeuchteten Ofen (ohne CO 2) vor dem Einlegen in das Gerät ist entscheidend für genaue ECAR-Messwerte, da CO2 den pH-Wert des Assay-Mediums beeinflussen kann. Es ist wichtig, daran zu denken, die Sensorkartusche am Tag vor dem Assay zu hydratisieren, um sicherzustellen, dass sie am Tag des Assays zuverlässige OCR- und ECAR-Messwerte liefert. Es sollte darauf geachtet werden, die zu injizierenden Arzneimittel ordnungsgemäß zu rekonstituieren und die rekonstituierten Arzneimittelvorräte für die Langzeitlagerung in kleinere Mengen zu aliquotieren, um Gefrier-/Auftauzyklen zu minimieren. Es ist wichtig, 10-fache Arzneimittellösungen herzustellen, die in den jeweiligen Testmedien verdünnt werden (z. B. verdünnt in Mito-Stresstest-Assaymedien für den Mito-Stresstest), um die Verdünnung von der Injektion des Arzneimittels in jede mit Assaymedien gefüllte Vertiefung zu berücksichtigen. Mit jeder nachfolgenden Medikamenteninjektion befindet sich mehr Medium in jeder Vertiefung, und daher nehmen die Volumen des geladenen Arzneimittels mit jeder Injektion zu, und es sollte darauf geachtet werden, die im Protokoll angegebenen Volumina einzuhalten. Es ist wichtig, nach Abschluss des Experiments Qualitätskontrollen durchzuführen, indem die Sensorkartusche untersucht wird, um sicherzustellen, dass keine Wirkstoffrückstände erkennbar sind, und die Zellkulturplatte unter dem Mikroskop betrachtet wird, um sicherzustellen, dass die konfluente und homogene Zellmonoschicht erhalten bleibt.
Zu den Modifikationen dieses Protokolls gehören die Injektion verschiedener Medikamente in die Häfen und die Bestimmung, wie sich diese Medikamente auf die OCR- und ECAR-Messwerte auswirken. Eine beliebte Modifikation besteht darin, ein experimentelles Medikament der Wahl als Port A zu injizieren, bevor die üblichen Mito- oder Glykolytischen Stresstestmedikamente injiziert werden. Diese Art von Protokoll gibt Aufschluss darüber, wie sich eine akute Injektion des Medikaments der Wahl auf die nachfolgenden OXPHOS- und glykolytischen Parameter auswirkt. Zu den weiteren Modifikationen gehört die Untersuchung verschiedener Zelltypen; Dies erfordert eine anfängliche Fehlersuche bei der optimalen Dichte der Seeding-Zellen und eine Optimierung des Assay-Mediums, indem sichergestellt wird, dass die Basalwerte zwischen 50-100 pmol/min für OCR und 10-20 mpH/min für ECAN liegen. Die optimalen Konzentrationen der injizierten Wirkstoffe müssen für jeden neu untersuchten Zelltyp bestimmt werden, indem die OCR- und ECAR-Reaktionen auf eine serielle Verdünnung der Wirkstoffe beobachtet werden.
Eine wesentliche Einschränkung des Protokolls besteht darin, dass die Lebensfähigkeit der Zellen mit der Zeit abnimmt, da sich die Zellen nicht in einem CO2 -Inkubator in ihren normalen Wachstumsmedien befinden und der Test daher innerhalb von 3-4 Stunden abgeschlossen sein sollte, um eine maximale Zelllebensfähigkeit zu gewährleisten. Darüber hinaus kann die Exposition gegenüber mitochondrialen Toxinen, die in jede Vertiefung injiziert werden, die Lebensfähigkeit der Zellen im Laufe der Zeit weiter verringern. Sobald der Assay abgeschlossen ist, müssen die Zellen zur Bewertung des Proteingehalts lysiert werden, um die OCR- und ECAR-Messwerte zu normalisieren, und daher können dieselben Zellen nicht für nachfolgende molekularbiologische Assays geerntet werden.
Alternativen zum Seepferdchen für die bioenergetische Profilerstellung sind der Oroboros Oxygraph 2k (O2k)27, BaroFuse28,29 und Resipher (Lucid Scientific)7. Das Oroboros O2k ist ein geschlossenes Zweikammer-Respirometer, das polarographische Sauerstoffelektroden vom Typ S1 Clark verwendet. Während der Oroboros O2k hochempfindliche Messungen des metabolischen Flusses in Echtzeit liefert, ist die Vorrichtung arbeitsintensiv, da der Bediener jedes Medikament manuell injizieren muss30. Das BaroFuse ist ein neuartiges mehrkanaliges mikrofluidisches Perfusionssystem, das Gasdruck verwendet, um mehrere parallele Perfusionsexperimente zu ermöglichen, und mit einem Sauerstoffdetektionssystem zur Messung der OCR verbunden ist. Der Vorteil dieses Flusskultursystems besteht darin, dass die Funktion und Lebensfähigkeit des Gewebes erhalten bleibt, im Gegensatz zum Seepferdchen, bei dem die Lebensfähigkeit der Zellen über längere Assays abnimmt. Der Resipher verwendet hochempfindliche optische Sauerstoffsensoren, um OCR zu messen, während sich die Zellen in einer 96-Well-Platte im Inkubator befinden, und ermöglicht so kontinuierliche OCR-Messungen über mehrere Wochen bis Monate. Bemerkenswert ist, dass diese Instrumente ECAR nicht messen, und daher hat das Seepferdchen den Vorteil, dass sowohl OXPHOS als auch Glykolyse gleichzeitig erforscht werden können.
Die Untersuchung von bioenergetischen Echtzeitprofilen von OXPHOS und der Glykolyse entwickelt sich zu einem Schlüsselfaktor bei der Charakterisierung der Gesundheit und Funktion von RPE. Die hochauflösende Respirometrie ermöglicht einen effizienten Vergleich des Stoffwechselstatus von normalem und erkranktem RPE und eröffnet damit neue Wege für das Screening der Wirksamkeit von Medikamenten bei Netzhauterkrankungen wie AMD und PVR. Zu den zukünftigen Richtungen der hochauflösenden Respirometrie auf RPE gehört die Optimierung eines Protokolls zur Untersuchung bioenergetischer Profile für hochpolarisierte RPE-Monolagen, die auf Transwell-Filtern gezüchtet wurden. Calton et al. (2016) erreichten dies erfolgreich, indem sie einen dreieckigen Abschnitt der polarisierten RPE-Monolage schnitten, die auf Transwell-Filtern31 gewachsen war. Eine weitere Erweiterung der Methodik umfasst die Untersuchung der bioenergetischen Profile von induzierten pluripotenten Stammzell-abgeleiteten RPE (iPSC-RPE), die von Patienten mit verschiedenen retinalen degenerativen Erkrankungen isoliert wurden32. Die Untersuchung, wie pathogene Zytokine, die an AMD und PVR beteiligt sind, die dynamische Natur des RPE-Stoffwechsels beeinflussen, kann metabolische Schwachstellen aufdecken, die die Identifizierung neuer medikamentöser Ziele unterstützen können.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Studie wurde zum Teil unterstützt durch Zuschüsse von: dem Fight for Sight Leonard &; Robert Weintraub Postdoctoral Fellowship (D.Y.S.); Postdoktoranden-Stipendienprogramm der BrightFocus Foundation in der Erforschung der Makuladegeneration (M2021010F, D.Y.S.); Verteidigungsministerium, Spinal Vision Research Program unter der Auszeichnungsnummer VR180132 (M.S.-G. und L.A.K.); National Eye Institute der National Institutes of Health unter der Auszeichnungsnummer R01EY027739 (L.A.K.). Wir danken den Spendern der Makuladegeneration Research M2021010F, einem Programm der BrightFocus Foundation, für die Unterstützung dieser Forschung. Schaltpläne wurden mit Biorender.com erstellt
Materialien
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose | Sigma | D8375-5G | Reconstituted in the Glycolytic Assay Media from its powder form and used in the Glycolytic Stress Test (Port C injection) |
| 96 Well Non-Treated Plate, 5/Pack, Sterile | VWR | 229597 | BCA Assay 96-well plate |
| Antimycin A from Streptomyces sp. | Sigma | A8674-25MG | Inhibitor of Complex III of the electron transport chain (part of the Port C drug injection together with rotenone) |
| BAM15 | Sigma | SML1760-5MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| BCA Assay | ThermoFisher | 23225 | To determine total protein content in each well |
| Calibrant Solution | Seahorse Bioscience | 100840-000 | Solution used to calibrate the probes of the sensor cartridge |
| Cell Lysis buffer 10x | Cell Signaling Technologies | 9803S | Dilute 10x Cell Lysis Buffer to a 1x solution using deionized water and add 1 mM PMSF before use |
| D-(+)-Glucose solution | Sigma | G8644-100ML | Supplement to be added to the Mito Stress Test assay media and also used in the Glycolytic Stress Test (Port A injection) |
| DMSO, Cell culture grade | Sigma-aldrich | D4540-100ML | For reconstituting all mitochondrial drugs except for 2DG |
| FCCP | Sigma | C2920-10MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| GlutaMAX | Gibco | 35050061 | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| HEPES solution | Sigma | H0887-100ML | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| H-RPE – Human Retinal Pigment Epithelial Cells | Lonza | 194987 | Primary human fetal RPE cells |
| Oligomycin - CAS 1404-19-9 - Calbiochem | Sigma | 495455-10MG | ATP synthase inhibitor used for the Mito Stress Test (Port A injection) and Glycolytic Stress Test (Port B injection) |
| Parafilm | Bemis | PM996 | To seal the plate once the cells are lysed to prevent evaporation in the freezer |
| Phenylmethylsulfonyl fluoride (PMSF) Protease Inhibitor | Gold Biotechnology Inc | 50-153-2823 | Used at 1 mM for the 1x Cell Lysis Buffer solution |
| ReagentPack Subculture Reagents, 100 mL | Lonza | CC-5034 | Passaging reagents for primary human fetal RPE cells. Each kit contains 100 mL Trypsin/EDTA, Trypsin Neutralizing Solution, HEPES Buffered Saline |
| Rotenone | Sigma | R8875-1G | Inhibitor of Complex I of the electron transport chain (part of the Port C drug injection together with antimycin A) |
| RtEGM Retinal Pigment Epithelial Cell Growth Medium BulletKit - RtEBMTM Basal Medium (00195406) and RtEGMTM SingleQuots Supplements (00195407) | Lonza | 195409 | Media for primary human fetal RPE cells |
| Seahorse XFe96 Analyzer | Agilent | High-Resolution Respirometry Instrument | |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | This contains the 96-well Seahorse Cell Culture Microplate, the sensor cartridge and the calibrant solution |
| Sodium pyruvate solution | Sigma | S8636-100ML | Supplement to be added to the Mito Stress Test assay media |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 50 mL process volume, 0.22 µm pore size | Millipore-Sigma | SCGP00525 | Tube top filter unit for sterile filtration of the assay media |
| Synergy H1 Plate Reader | BioTek | Plate Reader for measuring absorbance at 562 nm for the BCA assay | |
| XF base medium without phenol red | Agilent | 103335-100 | Base media for running the Seahorse assay |
Referenzen
- He, Y., et al. Mitochondria impairment correlates with increased sensitivity of aging RPE cells to oxidative stress. Journal of Ocular Biology Diseases and Informatics. 3 (3), 92-108 (2010).
- Shu, D. Y., Butcher, E., Saint-Geniez, M. EMT and EndMT: Emerging roles in age-related macular degeneration. International Journal of Molecular Sciences. 21 (12), 4271 (2020).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the Seahorse XF analyzer or a Clark-type oxygen electrode. Current Protocols in Toxicology. 60, 2-16 (2014).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio Protocol. 8 (10), 2850 (2018).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Shu, D. Y., Butcher, E. R., Saint-Geniez, M. Suppression of PGC-1α drives metabolic dysfunction in TGFbeta2-induced EMT of retinal pigment epithelial cells. International Journal of Molecular Sciences. 22 (9), 4701 (2021).
- Shu, D. Y., et al. Dimethyl fumarate blocks tumor necrosis factor-alpha-driven inflammation and metabolic rewiring in the retinal pigment epithelium. Frontiers in Molecular Neuroscience. 15, 896786 (2022).
- Satish, S., Philipose, H., Rosales, M. A. B., Saint-Geniez, M. Pharmaceutical induction of PGC-1α promotes retinal pigment epithelial cell metabolism and protects against oxidative damage. Oxidative Medicine and Cellular Longevity. 2018, 9248640 (2018).
- Ferrington, D. A., et al. Altered bioenergetics and enhanced resistance to oxidative stress in human retinal pigment epithelial cells from donors with age-related macular degeneration. Redox Biology. 13, 255-265 (2017).
- Cai, H., et al. High-throughput screening identifies compounds that protect RPE cells from physiological stressors present in AMD. Experimental Eye Research. 185, 107641 (2019).
- Kurihara, T., et al. Hypoxia-induced metabolic stress in retinal pigment epithelial cells is sufficient to induce photoreceptor degeneration. Elife. 5, 14319 (2016).
- Ishii, M., Beeson, G., Beeson, C., Rohrer, B. Mitochondrial C3a receptor activation in oxidatively stressed epithelial cells reduces mitochondrial respiration and metabolism. Frontiers in Immunology. 12, 628062 (2021).
- Rosales, M. A. B., Shu, D. Y., Iacovelli, J., Saint-Geniez, M. Loss of PGC-1α in RPE induces mesenchymal transition and promotes retinal degeneration. Life Science Alliance. 2 (3), 201800212 (2019).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Huang, T., Long, M., Huo, B. Competitive binding to cuprous ions of protein and BCA in the bicinchoninic acid protein assay. Open Biomedical Engineering Journal. 4, 271-278 (2010).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245 (2021).
- Symersky, J., Osowski, D., Walters, D. E., Mueller, D. M. Oligomycin frames a common drug-binding site in the ATP synthase. Proceedings of the National Academy of Sciences. 109 (35), 13961-13965 (2012).
- Divakaruni, A. S., Brand, M. D. The regulation and physiology of mitochondrial proton leak. Physiology. 26 (3), 192-205 (2011).
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: A key controller of biological processes in physiology and diseases. Cells. 8 (8), 795 (2019).
- Herst, P. M., Tan, A. S., Scarlett, D. J., Berridge, M. V. Cell surface oxygen consumption by mitochondrial gene knockout cells. Biochimica Biophysica Acta. 1656 (2-3), 79-87 (2004).
- Pike Winer, L. S., Wu, M. Rapid analysis of glycolytic and oxidative substrate flux of cancer cells in a microplate. PLoS One. 9 (10), 109916 (2014).
- Laussel, C., Leon, S. Cellular toxicity of the metabolic inhibitor 2-deoxyglucose and associated resistance mechanisms. Biochemical Pharmacology. 182, 114213 (2020).
- Miyagishima, K. J., et al. AMPK modulation ameliorates dominant disease phenotypes of CTRP5 variant in retinal degeneration. Communications Biology. 4 (1), 1360 (2021).
- Gao, Z. X., et al. The new mitochondrial uncoupler BAM15 induces ROS production for treatment of acute myeloid leukemia. Biochemical Pharmacology. 198, 114948 (2022).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Rountree, A., et al. Barofuse a novel pressure-driven, adjustable-throughput perfusion system for tissue maintenance and assessment. Heliyon. 2 (12), 00210 (2016).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, 66716 (2021).
- Mas-Bargues, C., Garcia-Dominguez, E., Borras, C. Recent approaches to determine static and dynamic redox state-related parameters. Antioxidants. 11 (5), 864 (2022).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Chichagova, V., et al. Human iPSC disease modelling reveals functional and structural defects in retinal pigment epithelial cells harbouring the m.3243A > G mitochondrial DNA mutation. Scientific Reports. 7 (1), 12320 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten