Method Article
고분해능 호흡 측정법을 이용한 일차 인간 망막 색소 상피 세포의 생체 에너지 실시간 분석
요약
인간 망막 색소 상피 세포(H-RPE)의 대사 상태는 건강과 기능을 반영합니다. 여기에 제시된 것은 고해상도 호흡 측정을 사용하여 H-RPE의 실시간 대사 플럭스를 검사하기 위한 최적화된 프로토콜입니다.
초록
망막 색소 상피 세포(RPE)의 대사 기능 장애는 노화 관련 황반변성(AMD) 및 증식성 유리체 망막병증(PVR)과 같은 망막 질환의 주요 병원성 동인입니다. RPE는 대사 활동이 활발한 세포이기 때문에 대사 상태의 변화는 건강과 기능의 변화를 반영합니다. 고분해능 호흡 측정법은 각각 세포외 산성화율(ECAR) 및 산소 소비율(OCR)의 정량화를 통해 두 가지 주요 생체 에너지 경로인 해당과정과 미토콘드리아 산화 인산화(OXPHOS)의 실시간 동역학 분석을 가능하게 합니다. 다음은 원발성 인간 망막 색소 상피 세포(H-RPE)에서 고해상도 호흡 측정을 수행하기 위해 최적화된 프로토콜입니다. 이 프로토콜은 기본 및 최대 OXPHOS 및 당분해 능력을 정의하기 위해 RPE의 생체 에너지 프로파일을 생성하는 데 관련된 단계에 대한 자세한 설명을 제공합니다. H-RPE를 미토콘드리아 및 당분해 기계를 표적으로 하는 다양한 약물 주사에 노출시키면 주요 대사 매개변수를 계산할 수 있는 정의된 생체 에너지 프로파일이 생성됩니다. 이 프로토콜은 RPE에서 최대 호흡 용량을 유도하기 위해 카르보닐 시안화물 p-트리플루오로메톡시페닐히드라존(FCCP)에 비해 분리제로서 BAM15의 향상된 반응을 강조합니다. 이 프로토콜은 다양한 질병 조건에서 RPE의 생체 에너지 상태를 연구하고 RPE의 기초 대사 상태를 복원하는 신약의 효능을 테스트하는 데 사용할 수 있습니다.
서문
망막 색소 상피 세포(RPE)는 융모막 모세혈관의 광수용체와 천공 내피 사이에 전략적으로 위치한 색소 상피 세포의 단층으로 존재합니다. RPE는 (1) 흘린 광수용체 디스크의 식균 작용, (2) 시각 주기를 유지하기 위한 시각 색소의 재활용, (3) 영양소, 대사 산물, 이온 및 물의 수송, (4) 빛의 흡수, (5) 광산화에 대한 보호, (6) 망막 무결성을 지원하는 필수 인자의 분비, (7) 외부 혈액-망막 장벽형성 1 . RPE의 변성은 대사 기능 장애 및 미토콘드리아 결함과 관련이 있어 연령 관련 황반변성(AMD) 및 증식성 유리체 망막병증(PVR)과 같은 실명성 안구 질환을 유발합니다.2.
두 가지 주요 생체 에너지 경로에는 세포질에서 발생하는 해당과정과 미토콘드리아에서 발생하는 산화적 인산화(OXPHOS)가 있습니다. 해당 과정 동안 포도당 한 분자는 피루브산 분자 2 분자로 전환되고 아데노신 삼인산 (ATP) 분자 2 분자의 순 생산이 이루어집니다. 해당과정과 달리 OXPHOS는 훨씬 더 높은 수준의 ATP(포도당 분자당 ~32-38개의 ATP 분자)를 생성합니다. 특히, OXPHOS는 산소를 소비하고 기능적 미토콘드리아가 일어나야 하는 반면, 해당과정은 세포질에서 발생하며 산소가 필요하지 않습니다.
미토콘드리아 호흡을 검사하기 위한 형광 또는 인광 기반 기술이 도입되기 전에 Clark형 산소 전극3이 장착된 챔버의 투과된 세포 현탁액에서 산소 수준을 측정했습니다. Clark 전극은 형광 기반 호흡 측정법보다 훨씬 저렴하고 비부착성 세포에서 작동하지만, 각 호흡 시간이 약 15-20분 동안 지속되고 각 샘플에 대해 훨씬 더 많은 양의 세포가 필요하기 때문에 상대적으로 처리량이 낮습니다3. 따라서 형광 기반 호흡 측정 기술은 Clark 전극을 크게 대체했으며 대사 및 미토콘드리아 연구 분야에서 널리 사용되는 기술이 되었습니다.
이 프로토콜은 살아있는 세포의 OXPHOS 및 당분해 생물 에너지 프로파일을 동역학적으로 측정하는 고처리량, 고분해능, 형광 기반 호흡 측정 기술을 설명합니다. OXPHOS의 공정은 산소를 소비하기 때문에, OXPHOS에 대한 생체 에너지 프로파일은 시간 경과에 따른 산소 소비율(OCR)의 변화를 매핑하여 생성된다4. 이 기술에서는 빛을 방출하는 광섬유 번들에 연결된 센서 카트리지 슬리브에 두 개의 형광단이 내장되어 형광단을 여기시킵니다. 형광단 방출의 변화는 고감도 형광 센서에 의해 측정되고 광섬유 다발을 통해 전송되어 OCR 판독값으로 변환됩니다(5). 형광단은 산소에 의해 소멸되어 산소 플럭스 또는 OCR로 알려진 분석 배지에서 세포외 산소 수준을 측정할 수 있습니다. 다른 형광단은 양성자 유출의 변화에 민감한 pH 센서 프로브로, 세포외 산성화율(ECAR) 측정으로 변환됩니다. 측정하는 동안 형광단이 내장된 광섬유 다발은 세포 단층 위 200μm로 낮아져 빠른 실시간 판독을 가능하게 하는 일시적인 마이크로 챔버를 생성합니다. 산소 또는 양성자 수준의 10% 변화가 감지되면 센서가 위로 들어 올려져 더 많은 양의 매체가 일시적인 마이크로 챔버 매체와 혼합되어 OCR 및 ECAR 값을 기준선으로 복원합니다. 각 센서 카트리지에는 분석 중에 웰당 최대 4개의 화합물을 순차적으로 투여할 수 있도록 4개의 포트가 장착되어 있습니다. 각 포트에 화합물을 주입하기 전과 후에 측정값을 수집하여 세포의 대사 상태에 대한 주요 정보를 확인할 수 있습니다.
이 두 가지 뚜렷한 대사 경로를 조사하면 서로 다른 병원성 자극에 노출된 후 RPE의 대사 상태에 관한 중요한 발견을 얻을 수 있으므로 RPE 6,7,8의 대사 무결성을 회복하는 약물의 효능을 테스트하는 데 사용할 수 있습니다. 고처리량 호흡 측정법의 출현과 특정 미토콘드리아 억제제의 가용성은 RPE의 생체 에너지 프로파일을 정의하고 질병 상태동안 대사 및 미토콘드리아의 결함을 식별하는 데 더 많은 연구를 자극했습니다 6,7,8,9,10,11,12,13 . 고해상도 호흡 측정법은 AMD 및 PVR과 같은 망막 병리에서 RPE의 대사 재프로그래밍의 핵심 역할을 강조했습니다. AMD 및 PVR의 발병기전에 관여하는 두 가지 주요 사이토카인은 형질전환 성장 인자-베타 2(TGFβ2) 및 종양 괴사 인자-알파(TNFα)입니다. TGFβ2에 의한 상피-중간엽 전이(EMT)의 유도는 미토콘드리아 기능 장애, OXPHOS 억제 및 RPE6에서 당분해 능력의 보상적 증가를 동반합니다. 보다 최근에, 전염증성 사이토카인인 TNFα는 H-RPE7에서 기저 OXPHOS의 상당한 상향 조절 및 감소된 해당과정을 유도하는 것으로 나타났습니다. 디메틸 푸마레이트의 투여는 H-RPE에서 TNFα 유발 염증을 유의하게 억제하고 미토콘드리아 형태 및 기초 생체 에너지 프로파일을 회복시켰다7. 이 두 가지 성장 인자에 의해 유도된 다양한 대사 프로필은 망막 질환에서 대사 재프로그래밍의 관여에 관한 흥미로운 기계론적 질문을 자극합니다. 다음 프로토콜은 고해상도 호흡 측정을 사용하여 H-RPE에서 OXPHOS 및 해당 생물 에너지 프로파일을 평가하는 단계를 설명합니다.
프로토콜
1. 세포배양 플레이트에 H-RPE 도금
- RPE 성장 배지 보충제(4mM L-글루타민, 25ng/mL FGF-2, 2% FBS, 30mg/mL 겐타마이신 및 15μg/mL 암포테리신)가 보충된 인간 RPE 배지의 T25 플라스크에서 H-RPE를 해동합니다.
- 세포를 가습 인큐베이터에서 37°C 및 5%CO2 에서 인큐베이션한다. 다음날 배지를 새로 고치고 세포가 최소 80% 합류에 도달할 때까지 기다렸다가 T75 플라스크에 1:3의 비율로 통과시킵니다.
- 일단 합류하면 트립신/EDTA 0.025% 용액, 트립신 중화 용액 및 HEPES 완충 식염수(pH 7.0-7.6)로 구성된 계대배양 시약 키트를 사용하여 세포를 계대시킵니다.
- H-RPE를 HEPES 완충 식염수 3mL로 부드럽게 헹굽니다. 그런 다음 3mL의 트립신/EDTA를 넣고 5분 동안(또는 현미경으로 관찰한 바와 같이 세포가 플라스크 바닥에서 들어 올려질 때까지) 배양(37°C 및 5% CO2). 트립신 중화 용액 3mL로 트립신/EDTA를 중화합니다.
- 세포를 200 x g 에서 3.5분 동안 원심분리하여 세포 펠릿을 형성합니다. 상청액을 조심스럽게 흡인하고 버립니다.
- 인간 RPE 배지에서 세포를 웰당 100μL당 20,000개 세포의 최종 농도로 재현탁합니다.
- 세포 현탁액이 균질한지 확인하기 위해 여러 번 위아래로 피펫팅하고, 96웰 세포 배양 마이크로플레이트에 피펫팅을 용이하고 일관성 있게 하기 위해 멀티채널 피펫을 사용합니다. 균일하고 균질한 세포층을 위해 웰 상단의 원형 테두리 바로 아래에 피펫 팁을 놓습니다.
참고: 셀이 마이크로플레이트에 잘 부착되므로 코팅이 필요하지 않습니다. - 배경 보정 웰 역할을 하기 위해 네 모서리 웰에 셀(배지 100μL만 해당)을 비워 두어야 합니다(그림 1A).
참고: 마이크로플레이트는 일반적인 96웰 플레이트 디자인으로 포맷됩니다. 그러나, 각 웰의 표면적은 0.106cm2이며, 이는 표준 96-웰 플레이트보다 40% 더 작다. 이 세포 밀도에서 세포는 다음날 100% 합류해야 합니다. 기본 OCR 및 ECAR 판독값이 각각 약 50-100pmol/min 및 10-20mpH/min인지 확인하기 위해 처리를 테스트하기 전에 먼저 세포 밀도 최적화 실험을 수행하는 것이 좋습니다.
- 세포 현탁액이 균질한지 확인하기 위해 여러 번 위아래로 피펫팅하고, 96웰 세포 배양 마이크로플레이트에 피펫팅을 용이하고 일관성 있게 하기 위해 멀티채널 피펫을 사용합니다. 균일하고 균질한 세포층을 위해 웰 상단의 원형 테두리 바로 아래에 피펫 팁을 놓습니다.
- 세포 배양 접시를 실온(RT)에서 1시간 동안 방치한 후 다시 인큐베이터(5%CO2, 37°C, 가습)에 넣어 가장자리 효과를 최소화합니다. 에지 효과(Edge effect)는 증발로 인한 96-웰 플레이트의 주변 경계의 웰 내의 배지 부피의 변화이다14.
참고: 세포는 밤새 부착되어 다음날 합류 단층을 형성합니다. H-RPE는 2-3일마다 성장 배지의 절반을 새로 고쳐 최소 1개월 동안 플레이트에서 숙성됩니다. - 세포의 형태와 색소 침착 수준을 확인하기 위해 배지를 교체하기 전에 현미경으로 세포를 검사하십시오. 세포가 특징적인 조약돌과 같은 형태와 합류하고 Shu et al.7의 형태 이미지에서 볼 수 있듯이 시간이 지남에 따라 색소 침착을 획득하는지 확인하십시오.
2. 분석 실행 전날
- 유틸리티 플레이트의 각 웰에 200μL의 탈이온수를 채워 분석 전날 센서 카트리지가 수화되었는지 확인합니다.
알림: 다용도판의 뚜껑에는 각 웰의 산소 및 pH 수준을 측정하기 위한 형광 바이오센서가 포함되어 있습니다. 센서는 다양한 여기 파장에서 빛을 전달하고 형광 신호를 광 필터를 통해 광 검출기로 전송하는 광섬유 도파관에 연결됩니다. - 센서 카트리지를 ~20mL의 보정제(다음날 사용을 위해 예열하기 위해)와 함께 유틸리티 플레이트의 물에 담근 37°C 가습 오븐(CO2 없음)에 밤새 넣습니다.
알림: 보정제는 센서 카트리지 보정을 위해 설계된 독점 솔루션이며 구성이 인산염 완충 식염수(PBS)와 유사할 수 있습니다. 카트리지 하이드레이션의 최소 시간은 4시간이지만 밤새 하이드레이션하면 최상의 결과를 얻을 수 있습니다. - 기기가 켜져 있는지 확인하고 소프트웨어를 시작하여 하룻밤 동안 37°C로 안정화되도록 합니다(그림 2). 일반적으로 악기는 사용하지 않을 때에도 그대로 둘 수 있습니다.
3. 세포외 플럭스 분석기를 이용한 실시간 Mito 스트레스 테스트
- 분석 당일, 분석을 실행하기 최소 45분 전에 유틸리티 플레이트의 물을 동일한 양의 따뜻한 교정제로 교체하십시오.
- 표 1과 같이 보충제를 첨가하여 페놀 레드가 없는 기본 배지를 사용하여 Mito Stress Test 분석 배지를 만듭니다. 매체를 37°C로 예열하고, pH를 7.4로 조정하고, 튜브 탑 필터 장치를 사용하여 매체를 진공 여과합니다. 전체 플레이트를 실행하려면 ~25mL의 분석 배지를 만드십시오.
- 인간 RPE 배지를 제거하고 새로 준비된 분석 배지 180μL로 교체합니다(단계 3.2). 분석을 시작하기 전에 세포 배양 플레이트를 가습된 37°C 오븐(CO2 없이)에 1시간 동안 두십시오.
알림: 이것은 CO2 확산을 허용하여 셀 플레이트의 가스를 제거하는 데 중요합니다. 세포는 더 이상 성장 배지에 있지 않고 더 이상 CO2 가 있는 인큐베이터에 있지 않기 때문에 시간이 지남에 따라 생존력이 저하되므로 가능한 한 효율적으로 분석을 수행하기 위해 주의를 기울여야 합니다. 세포 배양 접시에 기포가 없는지 확인하기 위해서도 주의를 기울여야 합니다. 있는 경우 피펫이나 바늘로 터뜨립니다. - 각 센서 카트리지에는 분석 중에 세포 배양 플레이트의 웰에 테스트 화합물을 주입하기 위한 웰당 4개의 시약 전달 포트가 있습니다(그림 1C, D). 표 2에 따라 각 분석 배지에서 약물 스톡을 희석하여 ~3mL의 10x 약물 용액을 준비합니다. 예를 들어, 포트 A에 25μM의 올리고마이신이 용해되어 있는 Mito Stress Test 분석 배지를 로드하여 약물 부피가 기기에 의해 웰에 주입될 때 각 세포가 노출되는 최종 농도가 2.5μM이 되도록 합니다. 10x 약물 스톡의 20μL를 포트 A에, 22μL를 포트 B에 피펫팅하고, 및 25 μL를 포트 C에 주입하여 각 웰에서 지정된 최종 약물 농도를 달성합니다. 4개의 약물 포트가 모두 필요한 프로토콜의 경우 28μL를 포트 D에 피펫팅합니다.
알림: 포트 A/B/C/D의 올바른 방향을 위해 약물을 약물 포트에 피펫팅할 때 그림 1B 를 참조하십시오. 카트리지 가장자리의 노치는 약물 포트를 로드할 때 왼쪽 하단 모서리에 위치해야 합니다. 각 약물 포트에 비스듬히 피펫팅하여 기포를 최소화할 수 있습니다. 거품이 있으면 피펫이나 바늘로 터뜨리도록 주의해야 합니다. - 분석 소프트웨어에서 템플릿 탭을 열고 Mito 스트레스 테스트를 선택한 다음 그룹 정의를 입력합니다.
- 주입 전략에 대한 세부 정보를 입력합니다(이 경우 Mito 스트레스 테스트 약물로 미리 입력됨). 분석의 다양한 실험 그룹(예: 대조군 또는 치료)에 대한 세부 정보를 입력합니다. 분석 배지에 대한 세부 정보(기본 분석 배지에 다양한 보충제 및 특정 농도 추가)를 입력하고 마지막으로 세포 유형을 추가합니다.
- 다음 탭인 플레이트 맵(Plate Map)을 클릭하면 검사 중인 여러 그룹이 96웰 플레이트 맵의 특정 위치에 할당됩니다. 이 작업이 완료되면 프로토콜 탭을 클릭하여 기본 Mito 스트레스 테스트 프로토콜에 대한 기기 프로토콜을 검토합니다.
참고: 기본 Mito 스트레스 테스트 템플릿은 바로 사용할 수 있지만 실험 설계에 맞게 어떤 식으로든 수정할 수 있습니다. 예를 들어ample, 기본 측정 시간은 3분이지만 원하는 경우 5분으로 수정할 수 있습니다.
- Run the Assay(분석 실행)를 클릭하고 교정 용액에 잠긴 센서 카트리지를 유틸리티 플레이트에 삽입합니다. 이 과정은 약 25분이 소요됩니다. 이 단계에서, 각각의 바이오센서는 알려진 pH 및 산소 농도의 교정 용액에서 측정된 센서 출력에 기초하여 독립적으로 교정된다.
- 보정이 완료되면 유틸리티 플레이트를 제거하고 세포 배양 플레이트를 삽입합니다.
참고: 세포 배양 플레이트가 먼저 평형을 이루고 그 후 기기가 분석 배지를 혼합하고 OCR 및 ECAR 값을 측정하기 시작합니다. 이 단계는 약 1.5시간이 소요되며 사용자의 개입 없이 기기 내부에서 수행됩니다. OCR 및 ECAR의 기본 판독값은 먼저 분석 배지를 3분 동안 혼합한 다음 OCR과 ECAR을 3분 동안 측정하여 설정합니다. 이 기기는 혼합 및 측정의 세 가지 루프를 수행합니다. - 기준선 측정 후 기기는 자동으로 포트 A 약물 용액을 각 웰에 주입합니다. 그 다음에는 혼합 및 측정의 세 가지 루프(각각 3분)가 이어집니다. 각각의 후속 약물 주입 후에 동일한 패턴이 발생합니다(포트 B 및 C).
- 보정이 완료되면 유틸리티 플레이트를 제거하고 세포 배양 플레이트를 삽입합니다.
- 실행이 완료되면 세포 배양 플레이트와 센서 카트리지를 제거합니다. 품질 관리를 위해 포트를 검사하여 잔류 약물이 남아 있지 않은지 확인하여 센서 카트리지의 모든 약물 포트가 주입되었는지 확인하십시오. 센서 카트리지와 다용도판은 일회용이므로 폐기하십시오.
- 현미경으로 세포 배양 마이크로플레이트의 세포를 검사하여 세포의 합류 단층이 여전히 존재하는지 확인합니다. 분석 배지를 폐기하고 각 웰에서 60μL의 1x 용해 완충액으로 교체합니다.
참고: 용해 완충액은 10mM 페닐메틸설포닐 플루오라이드(PMSF)를 첨가하여 탈이온수에 1x로 희석된 1x 용해 완충액으로 만들어집니다. - 증발을 방지하기 위해 플레이트의 가장자리를 Parafilm으로 감싸고 BCA 분석을 사용하여 단백질 함량을 정량하기 전에 밤새 세포 용해를 돕기 위해 -80°C 냉동고에 넣습니다.
- 데이터 분석을 위해 OCR 및 ECAR 값을 각 웰의 단백질 마이크로그램으로 나누어 모든 데이터를 정규화합니다. Excel 매크로를 사용하여 데이터 분석 소프트웨어를 사용하여 Mito 스트레스 테스트 매개 변수를 자동으로 계산하는 Mito 스트레스 테스트 보고서 생성기를 내 보냅니다.
참고: 이것은 기초 호흡, 최대 호흡, 예비 호흡 용량, 양성자 누출, ATP 생성 및 비미토콘드리아 호흡을 결정하는 데 사용할 수 있습니다. 이러한 계산의 정의는 표 3에 나와 있습니다.
4. 세포외 플럭스 분석기를 이용한 실시간 당분해 스트레스 테스트
- 표 1 및 표 2에 표시된 다른 분석 배지 보충제 및 약물 주사를 사용하는 것을 제외하고 Mito 스트레스 테스트와 동일한 단계에 따라 Glycolytic Stress Test를 수행합니다.
- 데이터 분석을 위해 Excel 매크로를 사용하여 데이터 분석 소프트웨어에서 해당 스트레스 테스트 매개 변수를 자동으로 계산하는 해당 작용 스트레스 테스트 보고서 생성기를 내 보냅니다.
참고: 이것은 비당분해 산성화, 해당과정, 당분해 능력 및 당분해 예비를 결정하는 데 사용할 수 있습니다. 이러한 계산의 정의는 표 3에 나와 있습니다.
5. BCA 단백질 정량 분석
참고: 비신콘산(BCA) 단백질 정량 분석(Smith 분석15라고도 함)은 샘플의 총 단백질 함량을 측정하는 데 사용되는 구리 기반 비색 분석입니다. OCR 및 ECAR 데이터를 각 웰의 단백질 마이크로그램으로 정규화하면 각 웰의 세포/단백질 양이 다르기 때문에 판독값이 왜곡되지 않습니다. BCA 분석의 메커니즘은 두 가지 화학 반응을 기반으로합니다. 첫째, 단백질의 펩타이드 결합은 구리 이온 (Cu2+)을 구리 이온 (Cu +)으로 환원 시키며, 이는 더 높은 온도 (37-60 ° C)에 의해 보조 된 온도 의존적 반응입니다. 펩티드 결합이 더 많으면,Cu2+의 양은 용액 중의 단백질 함량에 비례한다(16). 이 반응은 녹색에서 강렬한 보라색 용액으로 색이 변하고 562nm에서 최대 흡광도를 나타냅니다16. 샘플의 단백질 함량이 높을수록 이 파장에서 흡광도가 높아집니다. 이 키트의 작동 범위는 20-2,000μg/mL입니다.
- BCA 분석 키트에는 단백질 농도 기준 표준으로 사용되는 2mg/mL의 소 혈청 알부민(BSA) 분취량 1mL가 포함되어 있습니다. 희석되지 않은 96mg/mL BSA에서 시작하여 투명하고 평평한 바닥의 2웰 플레이트에서 연속 희석을 준비한 다음 탈이온수(예: 2, 1, 0.5, 0.25, 0.125mg/mL 등)로 희석하여 농도를 절반으로 줄입니다. 공지된 농도의 단백질을 사용하면 실험 샘플의 단백질 함량을 계산하는 데 사용되는 표준 곡선을 계산할 수 있습니다. 계산된 단백질 함량 측정의 정확도를 높이려면 각 분석에 대한 실험 샘플과 함께 단백질 농도 참조 표준물질의 흡광도 판독값을 측정합니다.
- 각 BSA 연속 희석액 25 μL를 96-웰 플레이트에 이중으로 피펫팅한다.
- 25 μL의 1x 용해 완충액을 96-웰 플레이트에 복제하여 블랭크로 기능하도록 한다.
- 세포 배양 플레이트를 실온으로 해동하고 각 세포 용해물 25μL를 96-웰 플레이트에 복제하여 피펫팅합니다.
- BCA 키트 시약 A:B의 50:1 비율로 작업 시약을 준비합니다. 작업 시약의 탁도를 제거하기 위해 소용돌이에 의해 철저히 혼합하여 균질한 녹색 용액이 되도록 합니다. 200 μL의 작업 시약을 각 웰에 추가합니다.
- 플레이트를 호일로 덮어 플레이트를 빛으로부터 보호하고 37°C 오븐에서 20분 동안 배양합니다.
- 96웰 플레이트 판독기에서 562nm에서 흡광도를 측정합니다.
- 데이터 분석을 위해 모든 중복 값의 평균을 구합니다. 모든 샘플의 측정에서 1x 용해 완충액 웰에서 측정된 블랭크 흡광도 수준을 뺍니다. 각 BSA 표준물질의 흡광도를 μg/mL 단위의 알려진 농도로 표시하여 표준 곡선을 결정합니다. 표준 곡선에서 파생된 선형 방정식을 사용하여 실험 샘플의 단백질 농도를 결정합니다.
결과
이 기기는 각 실행에 대해 OCR과 ECAR을 동시에 측정합니다. Mito 스트레스 테스트의 경우 파라미터 계산은 OCR 판독값을 기반으로 하는 반면(그림 3A), 당분해 스트레스 테스트의 경우 파라미터 계산은 ECAR 판독값을 기반으로 합니다(그림 3B). 그림 3은 시간 경과에 따른 Mito 스트레스 테스트 OCR 곡선의 대표 그래프(그림 3C)와 H-RPE에 대한 막대 그래프 형태의 매개변수 계산(그림 3D)을 보여줍니다. 당분해 스트레스 테스트는 시간 경과에 따른 ECAR 곡선으로 표시되며(그림 3E), 매개변수 계산은 H-RPE에 대한 막대 그래프로 표시됩니다(그림 3F).
기초 호흡은 기초 조건17 하에서 세포의 에너지 요구에 대한 이해를 제공합니다. 첫 번째 약물 주입인 올리고마이신(Oligo)은 ATP 합성효소 억제제이며, 따라서 첫 번째 약물 주입 후 OCR의 감소는 ATP 연관 호흡의 척도이다18. 후속 약물 주입 후 남아 있는 기저 호흡은 ATP 합성과 결합되지 않기 때문에 양성자 누출로 간주됩니다. 양성자 누출 증가는 미토콘드리아 분리가 증가했음을 나타낼 수 있으며, 이는 생리학적으로 존재하지만 비만, 암, 제2형 당뇨병 및 심혈관 질환과 같은 병리와도 관련이 있는 분리 단백질에 의해 조절됩니다19. 두 번째 주사는 미토콘드리아의 최대 호흡 가능성을 결정하기 위해 BAM15 또는 FCCP와 같은 분리제를 사용하는 것입니다. 분리제는 양성자 구배를 붕괴시키고 미토콘드리아 내막을 가로지르는 양성자 원동력을 감소시킵니다. 그 결과 전자 수송 사슬(ETC)을 통한 전자의 흐름이 억제되지 않아 산소 소비율이 높아지고 미토콘드리아 호흡이 최대 용량(20)에 도달하게 됩니다. 예비 호흡 용량(SRC)은 최대 호흡과 기초 호흡의 차이로, 도전을 받았을 때 에너지 요구량의 변화에 반응하는 세포의 능력을 나타내며 세포 적합성을 나타냅니다. 중요한 것은 H-RPE의 미토 스트레스 테스트에서 BAM15가 미토콘드리아 호흡 능력을 향상시키는 데 있어 FCCP보다 우수하다는 것입니다(그림 4A, B), 최대 호흡 및 예비 호흡 용량은 500nM 또는 1μM FCCP에 비해 10μM BAM15에서 훨씬 더 높습니다. FCCP 용량 간에 유의미한 차이는 관찰되지 않았습니다. 로테논과 안티마이신 A(Rot/AA)의 세 번째이자 마지막 주사는 각각 ETC의 미토콘드리아 복합체 I 및 III을 억제하여 미토콘드리아 호흡을 차단합니다. 임의의 잔류 OCR은 비-미토콘드리아 공급원에 기인한다21.
해당과정(glycolysis) 동안, 한 분자의 포도당은 산소가 없는 상태에서 두 분자의 젖산으로 전환됩니다. 세포로부터의 젖산의 압출은 젖산 분자 당 하나의 양성자의 유출을 동반하여 세포 외 공간의 산성화를 일으킨다. 매체에서 양성자 생성의 흐름은 ECAR의 변화로 측정됩니다. 기초 해당과정(Basal glycolysis) 수치가 먼저 확립된 후, 포도당이 없는 분석 배지에 포도당을 주입하여 해당과정을 유도하여 ECAR 수치를 향상시킨다22. 올리고마이신은 미토콘드리아 ATP 생산을 중단시키면서 "가장 높은" ECAR을 유도하기 위해 주입되어 세포가 해당과정을 통해 ATP를 유도하도록 합니다. 마지막으로, 해당과정의 첫 번째 효소인 헥소키나아제를 억제하는2DG를 첨가하여 해당과정을 차단한다 23. 임의의 잔류 ECAR은 산성화의 다른 공급원, 예컨대 OXPHOS 동안 TCA 사이클에 의한CO2 생성에 기인할 가능성이 높으며, 비당분해 ECAR로 표기된다. 당분해 예비력은 포도당이 있는 상태에서 "최고" ECAR과 ECAR의 차이로 계산됩니다. 당분해 능력은 해당과정과 당분해 예비력의 합입니다.
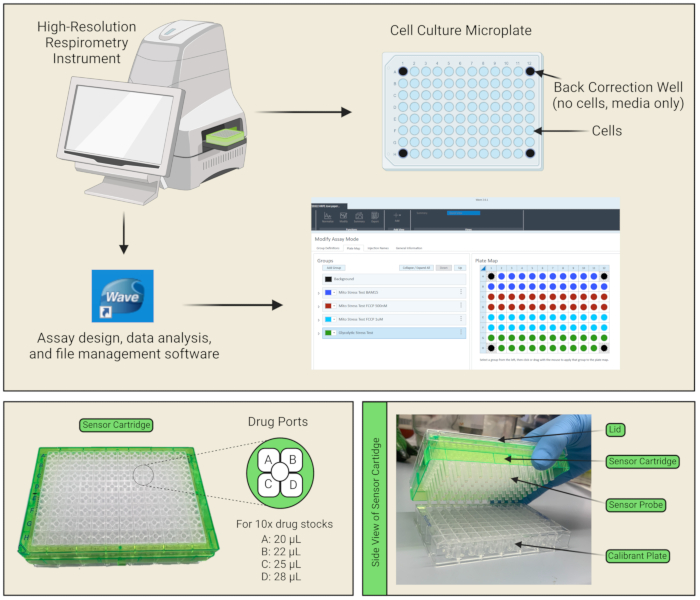
그림 1: 플레이트 및 센서 카트리지의 구성 요소 . (A) 기기, 데이터 분석 소프트웨어 및 프로토콜 설정 인터페이스가 표시됩니다. 96-웰 배양 플레이트 레이아웃에서 세포는 청색 웰에 도말되고 네 모서리 웰은 배지만 포함하는(그리고 세포는 없는) 백 보정 웰 역할을 하기 때문에 검은색으로 표시됩니다. (B) 약물 A, B, C 및 D를 로드할 수 있는 센서 카트리지의 각 웰에 대해 4개의 약물 포트가 있습니다. 각 포트에 피펫팅할 부피는 10x 약품 스톡 준비에 대한 계산을 기반으로 나열됩니다. (C) 센서 카트리지는 교정제로 채워진 유틸리티 플레이트에 직접 배치되는 센서 프로브로 구성됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
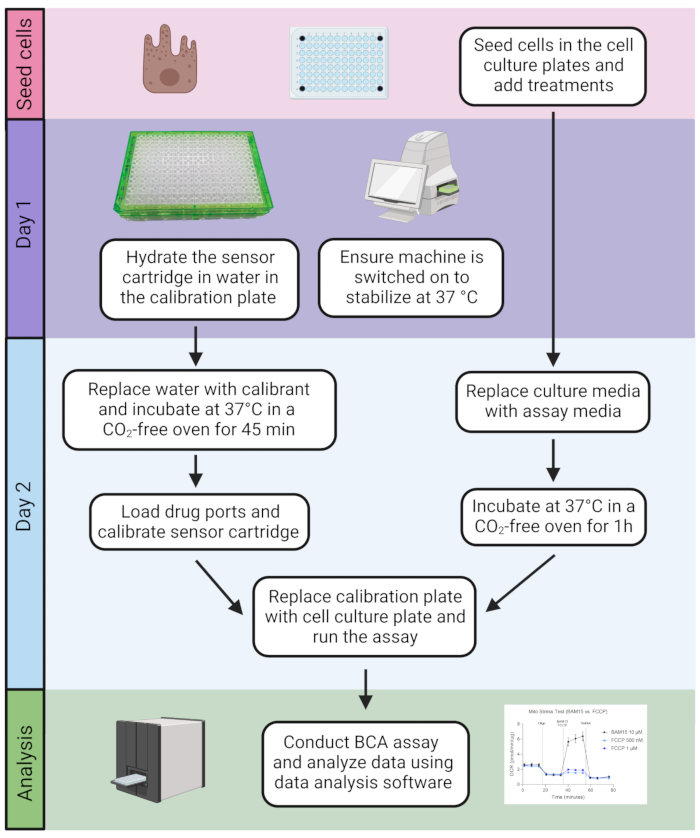
그림 2: 분석 타임라인. 세포는 세포 배양 접시에 시딩됩니다. 일단 준비되면, 분석은 BCA 분석 및 후속 데이터 분석을 사용하여 단백질 함량의 정량화가 뒤 따르는 2 일 절차를 포함합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
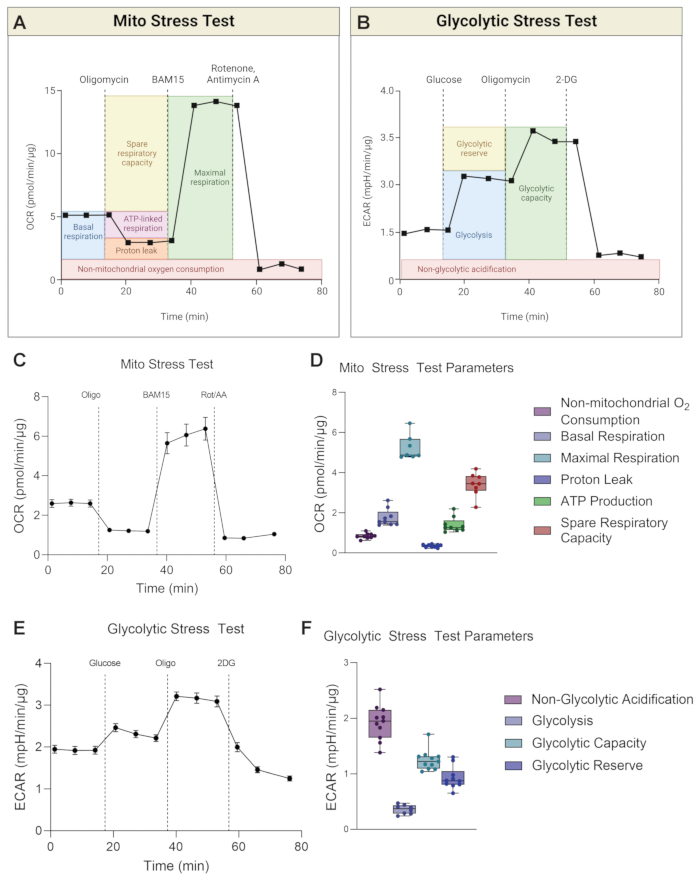
그림 3: Mito 스트레스 테스트와 당분해 스트레스 테스트의 대표 그래프. (A) Mito Stress Test 및 (B) Glycolytic Stress Test 매개변수의 계산은 회로도에 나와 있습니다. (C) H-RPE에 대한 대표적인 산소 소비량(OCR) 곡선과 (D) Mito 스트레스 테스트 매개변수가 표시됩니다. (E) H-RPE에 대한 대표적인 세포외 산성화율(ECAR) 곡선 및 (F) 당분해 스트레스 테스트 매개변수가 표시됩니다. 오차 막대는 SEM± 의미합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
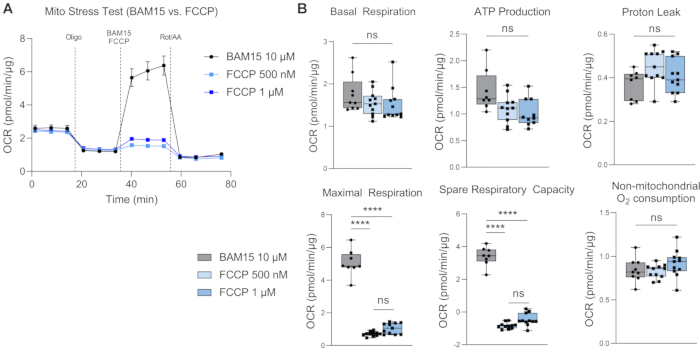
그림 4: 분리제로서의 BAM15와 FCCP의 비교. 10μM BAM15, 500nM FCCP 또는 1μM FCCP를 사용하여 최대 호흡 유도의 효능을 비교한 H-RPE에 대한 Mito 스트레스 테스트, (A) 산소 소비율(OCR) 곡선 및 (B) Mito 스트레스 테스트 매개변수. 오차 막대는 SEM± 평균이다. **** p ≤ 0.0001; ns, 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 테스트 | 포도당 (mM) | 글루타맥스(mM) | 피루브산 나트륨 (mM) | 헤페스 (mM) |
| 미토 스트레스 테스트 | 25 | 2 | 1 | 1 |
| 당분해 스트레스 테스트 | 없음 | 0.5 | 없음 | 1 |
표 1: Mito 및 Glycolytic Stress Test를 위해 분석 배지에 첨가된 보충제의 농도.
| 테스트 | 포트 A | 포트 B | 포트 C |
| 미토 스트레스 테스트 | 올리고마이신 2.5μM | FCCP 500nM 또는 BAM15 10μM | 로테논 2μM 및 안티마이신 A 2μM |
| 당분해 스트레스 테스트 | 포도당 10 mM | 올리고마이신 2μM | 2-데옥시글루코스 50 mM |
표 2: Mito 및 Glycolytic Stress Test를 위한 약물 포트 주사의 농도. 이것은 각 웰에 약물을 주입한 후 세포가 노출되는 최종 농도라는 점에 유의하는 것이 중요합니다. 약물 포트를 적재할 때 약물을 10배 더 강하게 준비해야 합니다.
| 학기 | 정의 | |||
| 교정제 | 교정제는 센서 카트리지를 교정하는 데 사용되는 솔루션입니다. 그 제형은 독점적이며 PBS와 유사한 구성을 가지고 있습니다. | |||
| 센서 카트리지 | 센서 카트리지에는 센서 카트리지 슬리브에 내장된 두 개의 형광단이 포함되어 있으며, 이 형광단은 빛을 방출하는 광섬유 번들에 연결되어 형광단을 자극합니다. 하나의 형광단은 산소 플럭스를 측정하고 다른 형광단은 양성자 플럭스를 측정합니다. 또한 각 센서 카트리지에는 4개의 포트가 장착되어 있어 분석 중에 웰당 최대 4개의 화합물을 순차적으로 투여할 수 있습니다. | |||
| 유틸리티 플레이트 | 유틸리티 플레이트(보정 플레이트라고도 함)는 센서를 보정하는 데 사용됩니다. Calibrant 용액은 Utility Plate에 배치됩니다. | |||
| 미토 스트레스 테스트 | Mito 스트레스 테스트는 시간 경과에 따른 OCR의 변화를 표시하여 미토콘드리아 호흡 생체 에너지 프로필을 제공하는 분석의 이름입니다. | |||
| 당분해 스트레스 테스트 | Glycolytic Stress Test는 시간 경과에 따른 ECAR의 변화를 표시하여 해당 작용 생체 에너지 프로파일을 제공하는 분석의 이름입니다. | |||
| 산소 소비율 (OCR) | 산소 소비율은 산소 플럭스(pmol/min)의 척도이며 미토콘드리아 대사 상태를 나타냅니다. | |||
| 세포외 산성화율(ECAR) | 세포외 산성화율은 양성자 유출(mpH/min)의 척도이며 당분해 대사 상태를 나타냅니다. | |||
| 웨이브 소프트웨어 | Wave 소프트웨어는 분석 및 후속 데이터 분석을 프로그래밍하는 데 사용됩니다 | |||
| 비미토콘드리아 산소 소비량 | 로테논/안티마이신 A 주사 후 최소 속도 측정 | |||
| 기초 호흡 | (첫 번째 주입 전 마지막 속도 측정) – (비미토콘드리아 호흡수) | |||
| 최대 호흡 | (FCCP 주사 후 최대 속도 측정) – (비미토콘드리아 호흡) | |||
| H+ (양성자) 누출 | (올리고마이신 주사 후 최소 속도 측정) – (비미토콘드리아 호흡 | |||
| ATP 생산 | (올리고마이신 주입 전 마지막 속도 측정) – (올리고마이신 주입 후 최소 속도 측정) | |||
| 예비 호흡 용량 | (최대 호흡) – (기초 호흡) | |||
| 예비 호흡 용량(%) | (최대 호흡) / (기초 호흡) × 100 | |||
| 커플링 효율 | ATP 생산율) / (기초호흡수) × 100 | |||
| 해당 | (올리고마이신 주입 전 최대 속도 측정) – (포도당 주입 전 마지막 속도 측정) | |||
| 당분해 능력 | (올리고마이신 주사 후 최대 속도 측정) – (포도당 주입 전 마지막 속도 측정) | |||
| 당분해 보호구역 | (당분해 능력) – (해당과정) | |||
| 당분해 예비력(%)을 % | (당분해능률)/(해당과정) × 100 | |||
| 비당분해 산성화 | 포도당 주입 전 마지막 속도 측정 | |||
표 3: 분석의 주요 구성 요소에 대한 정의 목록.
토론
H-RPE의 고분해능 호흡 측정에 최적화된 이 프로토콜은 일반적으로 사용되는 FCCP 대신 BAM15를 언커플러로 사용하는 것을 포함합니다. RPE의 고해상도 호흡 측정에 대한 이전 연구에서는 FCCP 9,24를 활용했지만 BAM15는 FCCP에 비해 H-RPE에서 최대 호흡 수준의 보다 강력한 유도를 유도하는 것으로 보입니다. FCCP와 BAM15는 모두 세포에서 사용하기에 안전하지만 BAM15는 FCCP 또는 CCCP(carbonylcyanide-3-chlorophenylhydrazone)25에 비해 정상 세포에서 부작용이 적은 것으로 보고되었습니다. Kenwood et al. BAM15는 원형질막 전위에 영향을 주지 않고 미토콘드리아를 탈분극하여 낮은 세포독성에서 지속적인 최대 미토콘드리아 호흡률을 유도한다는것을 보여주었습니다 26. 반면에 FCCP는 미토콘드리아와 원형질막을 모두 탈분극시키고 더 높은 세포 독성을 나타냅니다26.
프로토콜에는 마이크로플레이트의 모든 실험 웰에서 RPE의 합류하고 균일하며 균질한 단층에 세포가 적절하게 도금되도록 하는 것을 포함하여 몇 가지 중요한 단계가 있습니다. 성숙한 RPE는 에너지 생성을 위해 OXPHOS에 크게 의존하므로 RPE가 분석 중에 적절한 기저 및 최대 OCR 판독값을 생성하도록 세포가 최소 1개월 동안 성숙되도록 해야 합니다. CO2가 분석 배지의 pH에 영향을 줄 수 있으므로 기기에 넣기 전에 가습 오븐(CO2 없음)에서 37°C에서 1시간 동안 세포 배양 플레이트를 탈기하는 것은 정확한 ECAR 판독을 위해 매우 중요합니다. 분석 당일 신뢰할 수 있는 OCR 및 ECAR 판독값을 제공하기 위해 분석 전날 센서 카트리지에 수분을 공급하는 것을 기억하는 것이 중요합니다. 동결/해동 주기를 최소화하기 위해 주입할 약물을 적절하게 재구성하고 재구성된 약물 재고를 장기 보관을 위해 더 작은 부피로 분취하도록 주의해야 합니다. 분석 배지로 채워진 각 웰에 약물을 주입하여 희석을 고려하기 위해 각 분석 배지(예: Mito 스트레스 테스트용 Mito 스트레스 테스트 분석 배지에서 희석)에 희석된 10x 약물 용액을 준비하는 것이 중요합니다. 각각의 후속 약물 주입에는 각 웰에 더 많은 배지가 있으므로 로딩되는 약물의 양은 각 주사마다 증가하며 프로토콜에 지정된 부피를 따르도록 주의해야 합니다. 실험 완료 시 센서 카트리지를 검사하여 잔류 약물이 없는지 확인하고 현미경으로 세포 배양 플레이트를 관찰하여 융합성 및 균질한 세포 단층이 남아 있는지 확인하여 품질 검사를 수행하는 것이 중요합니다.
이 프로토콜의 수정에는 포트에 다른 약물을 주입하고 이러한 약물이 OCR 및 ECAR 판독값에 미치는 영향을 결정하는 것이 포함됩니다. 한 가지 인기 있는 수정 방법은 일반적인 Mito 또는 Glycolytic Stress Test 약물을 주입하기 전에 Port A로 선택한 실험 약물을 주입하는 것입니다. 이러한 유형의 프로토콜은 선택한 약물의 급성 주사가 후속 OXPHOS 및 당분해 매개변수에 어떤 영향을 미치는지에 대한 통찰력을 제공합니다. 다른 변형에는 다른 세포 유형을 검사하는 것이 포함됩니다. 이를 위해서는 OCR의 경우 50-100pmol/min, ECAR의 경우 10-20mpH/min 범위의 기본 판독값을 보장하여 최적의 파종 세포 밀도에 대한 초기 문제 해결과 분석 배지의 최적화가 필요합니다. 주입된 약물의 최적 농도는 약물의 연속 희석에 대한 OCR 및 ECAR 반응을 관찰하여 검사된 각각의 새로운 세포 유형에 대해 결정되어야 합니다.
프로토콜의 주요 한계는 세포가 정상적인 성장 배지에서CO2 인큐베이터에 있지 않기 때문에 시간이 지남에 따라 세포 생존율이 감소하므로 최대 세포 생존율을 보장하기 위해 3-4시간 이내에 분석을 완료해야 한다는 것입니다. 또한, 각 웰에 주입된 미토콘드리아 독소에 노출되면 시간이 지남에 따라 세포 생존력이 더욱 감소할 수 있습니다. 분석이 완료되면 OCR 및 ECAR 판독값을 정규화하기 위해 단백질 함량 평가를 위해 세포를 용해해야 하므로 후속 분자 생물학 분석을 위해 동일한 세포를 수확할 수 없습니다.
생물 에너지 프로파일링을 위한 Seahorse의 대안으로는 Oroboros Oxygraph 2k(O2k)27, BaroFuse28,29 및 Resipher(Lucid Scientific)7가 있습니다. Oroboros O2k는 S1 Clark 유형 폴라로그래픽 산소 전극을 사용하는 폐쇄형 2챔버 호흡계입니다. 오로보로스 O2k는 실시간 대사 플럭스의 매우 민감한 측정을 생성하지만, 이 장치는 작업자가 각 약물(30)을 수동으로 주입해야 하기 때문에 노동 집약적이다. BaroFuse는 가스 압력을 사용하여 다중 병렬 관류 실험을 가능하게 하고 산소 검출 시스템과 연결되어 OCR을 측정하는 새로운 다중 채널 미세 유체 관류 시스템입니다. 이 유동 배양 시스템의 장점은 더 긴 분석에서 세포 생존력이 감소하는 Seahorse와 달리 조직 기능과 생존력이 유지된다는 것입니다. Resipher는 세포가 인큐베이터의 96웰 플레이트에 있는 동안 고감도 광학 산소 센서를 사용하여 OCR을 측정하므로 몇 주에서 몇 달에 걸쳐 지속적인 OCR 측정이 가능합니다. 특히, 이러한 기기는 ECAR을 측정하지 않으므로 Seahorse는 OXPHOS와 해당 과정을 동시에 탐사할 수 있는 이점이 있습니다.
OXPHOS 및 해당 과정의 실시간 생체 에너지 프로파일을 조사하는 것은 RPE 건강 및 기능을 특성화하는 핵심 요소로 부상하고 있습니다. 고분해능 호흡 측정법은 정상 및 질병 RPE의 대사 상태를 비교하는 효율적인 수단을 가능하게 하여 AMD 및 PVR과 같은 망막 질환에 대한 약물 효능을 스크리닝하는 새로운 길을 열어줍니다. RPE에 대한 고분해능 호흡 측정법의 향후 방향에는 트랜스웰 필터에서 성장한 고도로 편광된 RPE 단층에 대한 생체 에너지 프로파일을 검사하기 위한 프로토콜 최적화가 포함됩니다. Calton et al. (2016)은 트랜스웰 필터31에서 성장한 편광 RPE 단층의 삼각형 단면을 절단하여 이를 성공적으로 달성했습니다. 방법론의 추가 확장에는 다양한 망막 퇴행성 질환을 가진 환자로부터 분리된 유도만능줄기세포 유래 RPE(iPSC-RPE)의 생체에너지 프로파일을 조사하는 것이 포함된다 32. AMD 및 PVR에 관여하는 병원성 사이토카인이 RPE 대사의 동적 특성에 어떻게 영향을 미치는지에 대한 탐구는 새로운 약물 투여 가능한 표적의 식별을 알릴 수 있는 대사 취약성을 밝힐 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 부분적으로 보조금으로 지원되었습니다 : Fight for Sight Leonard & Robert Weintraub Postdoctoral Fellowship (D.Y.S.); 황반변성 연구의 BrightFocus Foundation 박사후 연구원 프로그램(M2021010F, DYS); 국방부, 수상 번호 VR180132(MSG 및 L.A.K.)에 따른 척추 시력 연구 프로그램; 국립 보건원 국립 안과 연구소 수상 번호 R01EY027739(LAK). 이 연구를 지원하기 위해 BrightFocus Foundation의 프로그램인 황반변성 연구 M2021010F의 기증자에게 감사의 말을 전합니다. 회로도는 Biorender.com
자료
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose | Sigma | D8375-5G | Reconstituted in the Glycolytic Assay Media from its powder form and used in the Glycolytic Stress Test (Port C injection) |
| 96 Well Non-Treated Plate, 5/Pack, Sterile | VWR | 229597 | BCA Assay 96-well plate |
| Antimycin A from Streptomyces sp. | Sigma | A8674-25MG | Inhibitor of Complex III of the electron transport chain (part of the Port C drug injection together with rotenone) |
| BAM15 | Sigma | SML1760-5MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| BCA Assay | ThermoFisher | 23225 | To determine total protein content in each well |
| Calibrant Solution | Seahorse Bioscience | 100840-000 | Solution used to calibrate the probes of the sensor cartridge |
| Cell Lysis buffer 10x | Cell Signaling Technologies | 9803S | Dilute 10x Cell Lysis Buffer to a 1x solution using deionized water and add 1 mM PMSF before use |
| D-(+)-Glucose solution | Sigma | G8644-100ML | Supplement to be added to the Mito Stress Test assay media and also used in the Glycolytic Stress Test (Port A injection) |
| DMSO, Cell culture grade | Sigma-aldrich | D4540-100ML | For reconstituting all mitochondrial drugs except for 2DG |
| FCCP | Sigma | C2920-10MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| GlutaMAX | Gibco | 35050061 | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| HEPES solution | Sigma | H0887-100ML | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| H-RPE – Human Retinal Pigment Epithelial Cells | Lonza | 194987 | Primary human fetal RPE cells |
| Oligomycin - CAS 1404-19-9 - Calbiochem | Sigma | 495455-10MG | ATP synthase inhibitor used for the Mito Stress Test (Port A injection) and Glycolytic Stress Test (Port B injection) |
| Parafilm | Bemis | PM996 | To seal the plate once the cells are lysed to prevent evaporation in the freezer |
| Phenylmethylsulfonyl fluoride (PMSF) Protease Inhibitor | Gold Biotechnology Inc | 50-153-2823 | Used at 1 mM for the 1x Cell Lysis Buffer solution |
| ReagentPack Subculture Reagents, 100 mL | Lonza | CC-5034 | Passaging reagents for primary human fetal RPE cells. Each kit contains 100 mL Trypsin/EDTA, Trypsin Neutralizing Solution, HEPES Buffered Saline |
| Rotenone | Sigma | R8875-1G | Inhibitor of Complex I of the electron transport chain (part of the Port C drug injection together with antimycin A) |
| RtEGM Retinal Pigment Epithelial Cell Growth Medium BulletKit - RtEBMTM Basal Medium (00195406) and RtEGMTM SingleQuots Supplements (00195407) | Lonza | 195409 | Media for primary human fetal RPE cells |
| Seahorse XFe96 Analyzer | Agilent | High-Resolution Respirometry Instrument | |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | This contains the 96-well Seahorse Cell Culture Microplate, the sensor cartridge and the calibrant solution |
| Sodium pyruvate solution | Sigma | S8636-100ML | Supplement to be added to the Mito Stress Test assay media |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 50 mL process volume, 0.22 µm pore size | Millipore-Sigma | SCGP00525 | Tube top filter unit for sterile filtration of the assay media |
| Synergy H1 Plate Reader | BioTek | Plate Reader for measuring absorbance at 562 nm for the BCA assay | |
| XF base medium without phenol red | Agilent | 103335-100 | Base media for running the Seahorse assay |
참고문헌
- He, Y., et al. Mitochondria impairment correlates with increased sensitivity of aging RPE cells to oxidative stress. Journal of Ocular Biology Diseases and Informatics. 3 (3), 92-108 (2010).
- Shu, D. Y., Butcher, E., Saint-Geniez, M. EMT and EndMT: Emerging roles in age-related macular degeneration. International Journal of Molecular Sciences. 21 (12), 4271 (2020).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the Seahorse XF analyzer or a Clark-type oxygen electrode. Current Protocols in Toxicology. 60, 2-16 (2014).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio Protocol. 8 (10), 2850 (2018).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Shu, D. Y., Butcher, E. R., Saint-Geniez, M. Suppression of PGC-1α drives metabolic dysfunction in TGFbeta2-induced EMT of retinal pigment epithelial cells. International Journal of Molecular Sciences. 22 (9), 4701 (2021).
- Shu, D. Y., et al. Dimethyl fumarate blocks tumor necrosis factor-alpha-driven inflammation and metabolic rewiring in the retinal pigment epithelium. Frontiers in Molecular Neuroscience. 15, 896786 (2022).
- Satish, S., Philipose, H., Rosales, M. A. B., Saint-Geniez, M. Pharmaceutical induction of PGC-1α promotes retinal pigment epithelial cell metabolism and protects against oxidative damage. Oxidative Medicine and Cellular Longevity. 2018, 9248640 (2018).
- Ferrington, D. A., et al. Altered bioenergetics and enhanced resistance to oxidative stress in human retinal pigment epithelial cells from donors with age-related macular degeneration. Redox Biology. 13, 255-265 (2017).
- Cai, H., et al. High-throughput screening identifies compounds that protect RPE cells from physiological stressors present in AMD. Experimental Eye Research. 185, 107641 (2019).
- Kurihara, T., et al. Hypoxia-induced metabolic stress in retinal pigment epithelial cells is sufficient to induce photoreceptor degeneration. Elife. 5, 14319 (2016).
- Ishii, M., Beeson, G., Beeson, C., Rohrer, B. Mitochondrial C3a receptor activation in oxidatively stressed epithelial cells reduces mitochondrial respiration and metabolism. Frontiers in Immunology. 12, 628062 (2021).
- Rosales, M. A. B., Shu, D. Y., Iacovelli, J., Saint-Geniez, M. Loss of PGC-1α in RPE induces mesenchymal transition and promotes retinal degeneration. Life Science Alliance. 2 (3), 201800212 (2019).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Huang, T., Long, M., Huo, B. Competitive binding to cuprous ions of protein and BCA in the bicinchoninic acid protein assay. Open Biomedical Engineering Journal. 4, 271-278 (2010).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245 (2021).
- Symersky, J., Osowski, D., Walters, D. E., Mueller, D. M. Oligomycin frames a common drug-binding site in the ATP synthase. Proceedings of the National Academy of Sciences. 109 (35), 13961-13965 (2012).
- Divakaruni, A. S., Brand, M. D. The regulation and physiology of mitochondrial proton leak. Physiology. 26 (3), 192-205 (2011).
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: A key controller of biological processes in physiology and diseases. Cells. 8 (8), 795 (2019).
- Herst, P. M., Tan, A. S., Scarlett, D. J., Berridge, M. V. Cell surface oxygen consumption by mitochondrial gene knockout cells. Biochimica Biophysica Acta. 1656 (2-3), 79-87 (2004).
- Pike Winer, L. S., Wu, M. Rapid analysis of glycolytic and oxidative substrate flux of cancer cells in a microplate. PLoS One. 9 (10), 109916 (2014).
- Laussel, C., Leon, S. Cellular toxicity of the metabolic inhibitor 2-deoxyglucose and associated resistance mechanisms. Biochemical Pharmacology. 182, 114213 (2020).
- Miyagishima, K. J., et al. AMPK modulation ameliorates dominant disease phenotypes of CTRP5 variant in retinal degeneration. Communications Biology. 4 (1), 1360 (2021).
- Gao, Z. X., et al. The new mitochondrial uncoupler BAM15 induces ROS production for treatment of acute myeloid leukemia. Biochemical Pharmacology. 198, 114948 (2022).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Rountree, A., et al. Barofuse a novel pressure-driven, adjustable-throughput perfusion system for tissue maintenance and assessment. Heliyon. 2 (12), 00210 (2016).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, 66716 (2021).
- Mas-Bargues, C., Garcia-Dominguez, E., Borras, C. Recent approaches to determine static and dynamic redox state-related parameters. Antioxidants. 11 (5), 864 (2022).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Chichagova, V., et al. Human iPSC disease modelling reveals functional and structural defects in retinal pigment epithelial cells harbouring the m.3243A > G mitochondrial DNA mutation. Scientific Reports. 7 (1), 12320 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유