Method Article
Анализ биоэнергетики в первичных пигментных эпителиальных клетках сетчатки человека в режиме реального времени с использованием респирометрии высокого разрешения
В этой статье
Резюме
Метаболический статус пигментных эпителиальных клеток сетчатки человека (H-RPE) отражает их здоровье и функцию. Здесь представлен оптимизированный протокол для изучения метаболического потока H-RPE в режиме реального времени с использованием респирометрии высокого разрешения.
Аннотация
Метаболическая дисфункция пигментных эпителиальных клеток сетчатки (РПЭ) является ключевым патогенетическим фактором заболеваний сетчатки, таких как возрастная макулярная дегенерация (ВМД) и пролиферативная витреоретинопатия (ПВР). Поскольку RPE являются высокометаболически активными клетками, изменения в их метаболическом статусе отражают изменения в их здоровье и функциях. Респирометрия высокого разрешения позволяет в режиме реального времени проводить кинетический анализ двух основных биоэнергетических путей, гликолиза и митохондриального окислительного фосфорилирования (OXPHOS), путем количественной оценки скорости внеклеточного подкисления (ECAR) и скорости потребления кислорода (OCR) соответственно. Ниже приведен оптимизированный протокол для проведения респирометрии высокого разрешения на первичных пигментных эпителиальных клетках сетчатки человека (H-RPE). Этот протокол содержит подробное описание этапов создания биоэнергетических профилей РПЭ для определения их базальной и максимальной ОКСФОС и гликолитических способностей. Воздействие H-RPE на различные инъекции лекарств, нацеленных на митохондриальный и гликолитический механизм, приводит к определенным биоэнергетическим профилям, на основе которых можно рассчитать ключевые метаболические параметры. В этом протоколе подчеркивается повышенная реакция BAM15 в качестве разъединяющего агента по сравнению с карбонильным цианидом-трифторметоксифенилгидразоном (FCCP) для индуцирования максимальной дыхательной способности в RPE. Этот протокол может быть использован для изучения биоэнергетического статуса РПЭ при различных состояниях заболевания и проверки эффективности новых препаратов в восстановлении базального метаболического статуса РПЭ.
Введение
Пигментные эпителиальные клетки сетчатки (RPE) существуют в виде монослоя пигментированных эпителиальных клеток, стратегически расположенных между фоторецепторами и фенестрированным эндотелием хориокапилляра. RPE обладают высокой метаболической активностью и выполняют множество функций, включая (1) фагоцитоз пролитых фоторецепторных дисков, (2) рециркуляцию зрительного пигмента для поддержания зрительного цикла, (3) транспорт питательных веществ, метаболитов, ионов и воды, (4) поглощение света, (5) защиту от фотоокисления, (6) секрецию основных факторов для поддержания целостности сетчатки и (7) формирование наружного гемато-ретинального барьера1 . Дегенерация РПЭ связана с метаболической дисфункцией и митохондриальными дефектами, что приводит к слепоте глазных заболеваний, таких как возрастная макулярная дегенерация (ВМД) и пролиферативная витреоретинопатия (ПВР)2.
Два ключевых биоэнергетических пути включают гликолиз, который происходит в цитоплазме, и окислительное фосфорилирование (OXPHOS), которое происходит в митохондриях. Во время гликолиза одна молекула глюкозы превращается в две молекулы пирувата и чистое производство двух молекул аденозинтрифосфата (АТФ). В отличие от гликолиза, OXPHOS производит гораздо более высокие уровни АТФ (~ 32-38 молекул АТФ на молекулу глюкозы). Примечательно, что OXPHOS потребляет кислород и требует функциональных митохондрий, тогда как гликолиз происходит в цитоплазме и не требует кислорода.
До внедрения методов на основе флуоресценции или фосфоресценции для изучения митохондриального дыхания уровни кислорода измеряли в пермеабилизированных клеточных суспензиях в камерах, оснащенных кислородным электродомтипа Кларка 3. Хотя электрод Кларка намного дешевле, чем респирометрия на основе флуоресценции, и работает в неадгезивных клетках, он имеет относительно низкую пропускную способность, при этом каждый дыхательный ход длится около 15-20 минут и требует гораздо большего количества клеток для каждого образца3. Таким образом, метод респирометрии на основе флуоресценции в значительной степени заменил электрод Кларка и стал популярным методом в области метаболизма и митохондриальных исследований.
Этот протокол описывает высокопроизводительный метод респирометрии на основе флуоресценции с высоким разрешением, который кинетически измеряет OXPHOS и гликолитические биоэнергетические профили живых клеток. Поскольку процесс OXPHOS потребляет кислород, биоэнергетический профиль для OXPHOS создается путем картирования изменений скорости потребления кислорода (OCR) с течением времени4. В этом методе два флуорофора встроены в гильзу картриджа датчика, которая соединена с волоконно-оптическими пучками, которые излучают свет, возбуждая флуорофоры. Изменения в флуорофорном излучении измеряются высокочувствительными флуоресцентными датчиками и передаются через волоконно-оптический пучок для преобразования в показанияOCR 5. Флуорофор гасится кислородом, что позволяет определять уровень внеклеточного кислорода в анализируемой среде, известный как поток кислорода или OCR. Другой флуорофор представляет собой датчик pH, чувствительный к изменениям оттока протонов, который преобразуется в меру скорости внеклеточного подкисления (ECAR). Во время измерений волоконно-оптические пучки со встроенными флуорофорами опускаются на 200 мкм над монослоем ячейки, создавая переходную микрокамеру, которая обеспечивает быстрые показания в режиме реального времени. Как только обнаруживается 10-процентное изменение уровня кислорода или протонов, датчики поднимаются вверх, позволяя большему объему среды смешиваться с переходной микрокамерной средой, восстанавливая значения OCR и ECAR до исходного уровня. Каждый сенсорный картридж оснащен четырьмя портами, позволяющими последовательно вводить до четырех соединений в лунку во время анализа. Измерения могут быть собраны до и после инъекции соединений в каждый порт, раскрывая ключевую информацию о метаболическом статусе клеток.
Изучение этих двух различных метаболических путей может привести к важным открытиям относительно метаболического статуса RPE после воздействия различных патогенных стимулов и, таким образом, может быть использовано для проверки эффективности лекарств в восстановлении метаболической целостности RPE 6,7,8. Появление высокопроизводительной респирометрии и наличие специфических митохондриальных ингибиторов стимулировали больше исследований в определении биоэнергетических профилей RPE и выявлении дефектов метаболизма и митохондрий во время болезненных состояний 6,7,8,9,10,11,12,13 . Респирометрия высокого разрешения выявила ключевую роль метаболического перепрограммирования RPE при патологиях сетчатки, таких как AMD и PVR. Двумя ключевыми цитокинами, участвующими в патогенезе ВМД и ПВР, являются трансформирующий фактор роста-бета-2 (TGFβ2) и фактор некроза опухоли-альфа (TNFα). Индукция эпителиально-мезенхимального перехода (ЕМТ) TGFβ2 сопровождается митохондриальной дисфункцией, подавлением OXPHOS и компенсаторным увеличением гликолитической емкости в RPE6. Совсем недавно было показано, что провоспалительный цитокин, TNFα, индуцирует значительное повышение регуляции базального OXPHOS и снижение гликолиза в H-RPE7. Введение диметилфумарата значительно подавляло TNFα-индуцированное воспаление в H-RPE и восстанавливало морфологию митохондрий и базальные биоэнергетические профили7. Расходящиеся метаболические профили, индуцированные этими двумя факторами роста, стимулируют интригующие механистические вопросы относительно участия метаболического перепрограммирования в заболеваниях сетчатки. В следующем протоколе описаны этапы оценки OXPHOS и гликолитических биоэнергетических профилей в H-RPE с использованием респирометрии высокого разрешения.
протокол
1. Нанесение H-RPE на пластину для клеточных культур
- Размораживание H-RPE в колбе T25 в среде RPE человека с добавлением добавок среды для роста RPE (4 мМ L-глютамина, 25 нг/мл FGF-2, 2% FBS, 30 мг/мл гентамицина и 15 мкг/мл амфотерицина).
- Инкубируйте клетки при 37 ° C и 5% CO2 в увлажненном инкубаторе. Обновите носитель на следующий день и подождите, пока ячейки достигнут слияния не менее 80%, прежде чем помещать их в соотношении 1:3 в колбу T75.
- После слияния пройдите через клетки, используя набор субкультурных реагентов, состоящий из 0,025% раствора трипсина / ЭДТА, нейтрализующего трипсина раствора и буферного физиологического раствора HEPES (pH 7,0-7,6).
- Осторожно промойте H-RPE 3 мл буферизованного физиологического раствора HEPES. Затем добавьте 3 мл трипсина/ЭДТА и инкубируйте (37 ° C и 5% CO2) в течение 5 минут (или до тех пор, пока клетки не оторвутся от основания колбы, как это наблюдалось под микроскопом). Нейтрализуйте трипсин/ЭДТА 3 мл раствора, нейтрализующего трипсин.
- Центрифугируйте клетки при 200 x g в течение 3,5 мин, чтобы сформировать клеточную гранулу. Тщательно аспирируйте и выбросьте надосадочную жидкость.
- Ресуспендировать клетки в среде RPE человека до конечной концентрации 20 000 клеток на 100 мкл на лунку.
- Пипетка вверх и вниз несколько раз, чтобы убедиться, что клеточная суспензия однородна, используя многоканальную пипетку для легкости и последовательности пипетирования в 96-луночную микропланшет для клеточной культуры. Положите наконечник пипетки чуть ниже круглого края в верхней части лунки, чтобы получился ровный однородный слой клеток.
ПРИМЕЧАНИЕ: Покрытие не требуется, так как клетки хорошо прилипают к микропланшету. - Обязательно оставьте четыре угловых отверстия пустыми от ячеек (только 100 мкл среды), чтобы они служили лунками для коррекции фона (рис. 1A).
ПРИМЕЧАНИЕ: Микропланшет отформатирован в типичной конструкции пластины с 96 лунками; Однако площадь поверхности каждой скважины составляет 0,106см2, что на 40% меньше, чем у стандартной 96-луночной пластины. При такой плотности клеток клетки должны быть на 100% сливающимися на следующий день. Рекомендуется провести эксперимент по оптимизации плотности клеток перед тестированием лечения, чтобы убедиться, что базальные показания OCR и ECAR составляют около 50-100 пмоль/мин и 10-20 миль в час / мин соответственно.
- Пипетка вверх и вниз несколько раз, чтобы убедиться, что клеточная суспензия однородна, используя многоканальную пипетку для легкости и последовательности пипетирования в 96-луночную микропланшет для клеточной культуры. Положите наконечник пипетки чуть ниже круглого края в верхней части лунки, чтобы получился ровный однородный слой клеток.
- Оставьте планшет для культивирования клеток при комнатной температуре (RT) на 1 час, прежде чем поместить его обратно в инкубатор (5% CO2, 37 ° C, увлажненный), чтобы свести к минимуму побочные эффекты. Краевые эффекты представляют собой изменение объема среды в лунках периферийных границ 96-луночной пластины за счет испарения14.
ПРИМЕЧАНИЕ: Клетки будут прилипать в течение ночи и образуют сливающийся монослой на следующий день. H-RPE созревают в пластине не менее 1 месяца, обновляя половину питательной среды каждые 2-3 дня. - Исследуйте клетки под микроскопом перед сменой среды, чтобы проверить их морфологию и уровень пигментации. Убедитесь, что клетки сливаются с характерной морфологией, похожей на булыжник, и со временем приобретают пигментацию, как видно на морфологических изображениях в Shu et al.7.
2. За день до проведения анализа
- Убедитесь, что картридж датчика гидратирован за день до анализа, заполнив каждую лунку служебной пластины 200 мкл деионизированной воды.
ПРИМЕЧАНИЕ: Крышка служебной пластины содержит флуоресцентные биосенсоры для измерения уровня кислорода и pH для каждой лунки. Датчики соединены с волоконно-оптическими волноводами, которые доставляют свет на различных длинах волн возбуждения и передают флуоресцентный сигнал через оптические фильтры на фотоприемники. - Поместите картридж датчика, погруженный в воду, в пластину вместе с ~ 20 мл калибра (для разогрева для использования на следующий день) в увлажненную духовку с температурой 37 °C (без CO2) на ночь.
ПРИМЕЧАНИЕ: Калибр представляет собой запатентованное решение, предназначенное для калибровки картриджей датчиков, и, вероятно, по составу аналогичен фосфатно-буферному физиологическому раствору (PBS). Минимальное время гидратации картриджа составляет 4 часа, но наилучшие результаты получаются при ночной гидратации. - Убедитесь, что прибор включен, и запустите программное обеспечение, чтобы прибор стабилизировался до 37 °C в течение ночи (рис. 2). Как правило, прибор можно оставить включенным, даже если он не используется.
3. Стресс-тест Мито в реальном времени с использованием анализатора внеклеточного потока
- В день проведения анализа замените воду в служебной пластине равным объемом нагретого калибранта не менее чем за 45 минут до проведения анализа.
- Сделайте среду для анализа стресс-теста Мито, используя базовую среду без фенолового красного, добавив добавки, как показано в таблице 1. Нагрейте фильтрующий материал до 37 °C, отрегулируйте рН до 7,4 и отфильтруйте фильтрующий материал вакуумом с помощью фильтрующего блока с трубчатой крышкой. Для запуска полной пластины сделайте ~ 25 мл анализирующей среды.
- Удалите человеческий СИЗЭ и замените его 180 мкл свежеприготовленной пробирной среды (этап 3.2). Перед началом анализа поместите планшет для клеточных культур в увлажненную печь с температурой 37 °C (без CO2) на 1 час.
ПРИМЕЧАНИЕ: Это важно для дегазации клеточной пластины, обеспечивая диффузию CO2 . Поскольку клетки больше не находятся в питательных средах и больше не находятся в инкубаторе с CO2, их жизнеспособность со временем будет ухудшаться, поэтому следует позаботиться о том, чтобы провести анализ максимально эффективно. Также следует следить за тем, чтобы в пластине для клеточной культуры не было пузырьков; Если таковые имеются, вставьте их пипеткой или иглой. - Каждый сенсорный картридж имеет четыре порта подачи реагентов на лунку для впрыска испытуемых соединений в лунки планшета для клеточных культур во время анализа (рис. 1C, D). Приготовьте ~ 3 мл 10-кратных растворов лекарств, разбавив запасы лекарств в соответствующих анализируемых средах в соответствии с таблицей 2. Например, загрузите в порт А 25 мкМ олигомицина, растворенного в среде для анализа стресс-теста Мито, таким образом, чтобы при введении объема лекарственного средства в лунку с помощью прибора конечная концентрация, воздействию которой подвергается каждая клетка, составляла 2,5 мкМ. Пипетка 20 мкл из 10-кратного запаса лекарства в порт А, 22 мкл в порт В, и 25 мкл в порт С для достижения указанной конечной концентрации лекарственного средства в каждой лунке. Для протоколов, требующих всех четырех портов для лекарств, введите пипетку 28 мкл в порт D.
ПРИМЕЧАНИЕ: См. Рисунок 1B при пипетировании лекарств в порты для лекарств для правильной ориентации портов A/B/C/D. Насечка на краю картриджа должна располагаться в левом нижнем углу при загрузке портов для лекарств. Пипетируя под углом в каждый порт лекарства, пузырьки могут быть сведены к минимуму. Если есть какие-либо пузырьки, следует позаботиться о том, чтобы лопнуть их пипеткой или иглой. - Откройте вкладку «Шаблоны» в аналитическом программном обеспечении, выберите «Стресс-тест Mito» и заполните поля «Определения групп».
- Введите сведения о стратегии инъекций (в этом случае она предварительно вводится в качестве препаратов стресс-теста Мито). Введите сведения о различных экспериментальных группах в анализе (например, контроль или лечение). Введите подробную информацию об анализирующей среде (добавление различных добавок и их конкретных концентраций к базовой анализирующей среде ) и, наконец, добавьте тип клетки.
- Перейдите на следующую вкладку «Карта плит», где различные исследуемые группы будут привязаны к их конкретному местоположению на карте плит с 96 лунками. Как только это будет сделано, перейдите на вкладку « Протокол », чтобы просмотреть протокол прибора для протокола стресс-теста Mito по умолчанию.
ПРИМЕЧАНИЕ: Шаблон стресс-теста Mito по умолчанию готов к использованию, но может быть изменен любым способом в соответствии с экспериментальным дизайном. Например, время измерения по умолчанию составляет 3 минуты, но при желании его можно изменить на 5 минут.
- Нажмите « Запустить анализ» и вставьте картридж датчика, погруженный в раствор калибра, в полезную пластину. Этот процесс занимает около 25 минут. На этом этапе каждый биосенсор калибруется независимо на выходе датчика, измеренном в растворе калибранта с известной концентрацией pH и кислорода.
- После калибровки снимите пластину и вставьте пластину для культивирования клеток.
ПРИМЕЧАНИЕ: Сначала уравновешивается пластина для клеточной культуры, после чего прибор начинает смешивать анализируемую среду и измерять значения OCR и ECAR. Этот шаг занимает около 1,5 часов и проводится внутри прибора без какого-либо вмешательства со стороны пользователя. Базовые показания OCR и ECAR сначала устанавливают путем смешивания анализируемых сред в течение 3 минут, а затем измерения OCR и ECAR в течение 3 минут. Инструмент выполняет три цикла микширования и измерения. - После измерения исходного уровня прибор автоматически вводит раствор лекарственного средства порта А в каждую лунку. Затем следуют три цикла смешивания и измерения (по 3 минуты каждый). Такая же картина наблюдается после каждой последующей инъекции препарата (порты B и C).
- После калибровки снимите пластину и вставьте пластину для культивирования клеток.
- После завершения прогона извлеките пластину для культивирования клеток и картридж датчика. В целях контроля качества убедитесь, что все порты лекарства в картридже датчика были введены, проверив порты, чтобы убедиться, что не осталось остаточного лекарства. Выбросьте картридж датчика и служебную пластину, так как они являются одноразовыми предметами.
- Исследуйте клетки в микропланшете клеточной культуры под микроскопом, чтобы убедиться, что все еще есть сливающийся монослой клеток. Откажитесь от анализирующей среды и замените ее 60 мкл 1x лизирующего буфера в каждой лунке.
ПРИМЕЧАНИЕ: Буфер для лизиса изготавливается из 10-кратного буфера для лизиса, разбавленного до 1-кратного в деионизированной воде с добавлением 1 мМ фенилметилсульфонилфторида (PMSF). - Оберните края пластины в парапленку, чтобы предотвратить испарение, и поместите ее в морозильную камеру с температурой -80 °C, чтобы облегчить лизис клеток на ночь, прежде чем количественно определить содержание белка с помощью анализа BCA.
- Для анализа данных нормализуйте все данные, разделив значения OCR и ECAR на микрограмм белка в каждой лунке. Экспортируйте генератор отчетов Mito Stress Test, который использует макросы Excel для автоматического расчета параметров Mito Stress Test с помощью программного обеспечения для анализа данных.
ПРИМЕЧАНИЕ: Это может быть использовано для определения базального дыхания, максимального дыхания, запасной дыхательной способности, утечки протонов, продукции АТФ и немитохондриального дыхания. Определения этих расчетов приведены в таблице 3.
4. Гликолитический стресс-тест в реальном времени с использованием анализатора внеклеточного потока.
- Выполните гликолитический стресс-тест, выполнив те же шаги, что и стресс-тест Мито, за исключением использования различных добавок для анализа и инъекций лекарств, показанных в Таблице 1 и Таблице 2.
- Для анализа данных экспортируйте генератор отчетов о гликолитическом стресс-тесте, который использует макросы Excel для автоматического расчета параметров гликолитического стресс-теста из программного обеспечения для анализа данных.
ПРИМЕЧАНИЕ: Это можно использовать для определения негликолитического подкисления, гликолиза, гликолитической емкости и гликолитического резерва. Определения этих расчетов приведены в таблице 3.
5. Количественный анализ белка BCA
ПРИМЕЧАНИЕ: Анализ количественного определения белка бицинхоновой кислоты (BCA) (также известный как анализ Смита15) представляет собой колориметрический анализ на основе меди, используемый для определения общего содержания белка в образце. Нормализация данных OCR и ECAR к микрограмму белка в каждой лунке гарантирует, что разное количество клеток/белка в каждой лунке не исказит показания. Механизм анализа BCA основан на двух химических реакциях. Во-первых, пептидные связи в белках восстанавливают ионы меди (Cu2+) до ионов меди (Cu+), что является температурно-зависимой реакцией, поддерживаемой более высокими температурами (от 37 до 60 ° C). Если пептидных связей больше, то количество Cu2+ пропорционально содержанию белка в растворе16. Эта реакция приводит к изменению цвета с зеленого на интенсивный фиолетовый раствор с пиковым поглощением при 562 нм16. Чем выше содержание белка в образце, тем выше поглощение на этой длине волны. Рабочий диапазон этого набора составляет 20-2,000 мкг / мл.
- Набор для анализа BCA содержит 1 мл аликвот бычьего сывороточного альбумина (BSA) в дозе 2 мг / мл, который служит эталонным стандартом концентрации белка. Приготовьте серийное разведение в прозрачной пластине с плоским дном на 96 лунок, начиная с неразбавленной 2 мг/мл BSA, а затем вдвое уменьшая концентрацию путем разбавления в деионизированной воде (например, 2, 1, 0,5, 0,25, 0,125 мг/мл и т.д.). Использование известной концентрации белка позволяет рассчитать стандартную кривую, которая используется для расчета содержания белка в экспериментальных образцах. Для повышения точности расчетных измерений содержания белка измеряйте показания абсорбции эталонных эталонов концентрации белка вместе с экспериментальными образцами для каждого анализа.
- Пипетка 25 мкл каждого последовательного разведения BSA в двух экземплярах в 96-луночную пластину.
- Пипетка 25 мкл 1x буфера для лизиса в двух экземплярах в 96-луночную пластину, чтобы она служила заготовкой.
- Разморозьте планшет для культивирования клеток до комнатной температуры и введите 25 мкл каждого клеточного лизата в 96-луночную пластину.
- Приготовьте рабочий реагент в соотношении 50:1 реагентов набора BCA A:B. Тщательно перемешайте вихревом, чтобы удалить любую мутность в рабочем реагенте, чтобы он стал однородным зеленым раствором. В каждую лунку добавляют по 200 мкл рабочего реагента.
- Защитите тарелку от света, накрыв ее фольгой, и выдержите в духовке при температуре 37 °C в течение 20 минут.
- Измерьте коэффициент поглощения на длине волны 562 нм в 96-луночном считывателе пластин.
- Для анализа данных усредните все повторяющиеся значения. Вычтите холостые уровни поглощения, определенные из буферных лунок 1x лизиса, из измерений всех образцов. Определите стандартную кривую, построив график поглощения каждого стандарта BSA до его известной концентрации в мкг/мл. Используйте линейное уравнение, полученное из стандартной кривой, для определения концентрации белка в экспериментальных образцах.
Результаты
Прибор одновременно измеряет как OCR, так и ECAR для каждого пробега. Для стресс-теста Mito расчеты параметров основаны на показаниях OCR (рис. 3A), тогда как для теста на гликолитическую нагрузку расчеты параметров основаны на показаниях ECAR (рис. 3B). На рисунке 3 показаны репрезентативные графики для кривой OCR стресс-теста Mito с течением времени (рис. 3C) и расчеты параметров в виде гистограмм для H-RPE (рис. 3D). Тест на гликолитическую нагрузку представлен в виде кривой ECAR с течением времени (рис. 3E), а расчеты параметров отображаются в виде гистограмм для H-RPE (рис. 3F).
Базальное дыхание дает представление об энергетических потребностях клеток в базальных условиях17. Первая инъекция лекарственного средства, олигомицин (олиго), является ингибитором АТФ-синтазы, и, таким образом, любое снижение OCR после первой инъекции лекарственного средства является мерой дыхания, связанного с АТФ18. Любое оставшееся базальное дыхание после последующих инъекций лекарств рассматривается как утечка протонов, поскольку оно не связано с синтезом АТФ. Повышенная утечка протонов может указывать на повышенное разъединение митохондрий, которое регулируется разъединяющими белками, которые физиологически присутствуют, но также связаны с такими патологиями, как ожирение, рак, диабет 2 типа и сердечно-сосудистые заболевания19. Вторая инъекция - разъединяющий агент, такой как BAM15 или FCCP, для определения максимального дыхательного потенциала митохондрий. Разъединяющие агенты разрушают градиент протонов и уменьшают движущую силу протонов через внутреннюю мембрану митохондрий. Результатом является беспрепятственный поток электронов через цепь переноса электронов (ETC), что повышает скорость потребления кислорода и заставляет митохондриальное дыхание достигать максимальной мощности20. Резервная дыхательная способность (SRC) - это разница между максимальным и базальным дыханием, указывающая на способность клеток реагировать на изменения энергетических потребностей при вызове, что указывает на пригодность клеток. Важно отметить, что для стресс-теста Мито в H-RPE BAM15 превосходит FCCP в повышении дыхательной способности митохондрий (рис. 4A, B), поскольку максимальное дыхание и резервная дыхательная способность значительно выше при 10 мкМ BAM15 по сравнению с 500 нМ или 1 мкМ FCCP. Существенных различий между дозами FCCP не наблюдалось. Третья и последняя инъекция ротенона и антимицина А (Rot / AA) ингибирует митохондриальные комплексы I и III, соответственно, ETC, что отключает митохондриальное дыхание; любое остаточное OCR обусловлено немитохондриальными источниками21.
Во время гликолиза одна молекула глюкозы превращается в две молекулы лактата в отсутствие кислорода. Выдавливание лактата из клетки сопровождается оттоком одного протона на молекулу лактата, что вызывает подкисление внеклеточного пространства. Поток продукции протонов в среде измеряется изменениями в ECAR. Сначала устанавливаются уровни базального гликолиза, после чего глюкоза вводится в анализную среду, лишенную глюкозы, чтобы вызвать гликолиз и, таким образом, повысить уровни ECAR22. Олигомицин вводят, чтобы вызвать «самый высокий» ECAR, поскольку он останавливает выработку митохондриального АТФ, тем самым заставляя клетку получать АТФ посредством гликолиза. Наконец, гликолиз прекращается добавлением 2DG, который ингибирует гексокиназу, первый фермент гликолиза23. Любой оставшийся ECAR, вероятно, связан с другими источниками подкисления, такими как производство CO2 циклом TCA во время OXPHOS, и обозначается как негликолитический ECAR. Гликолитический резерв рассчитывается как разница между «самым высоким» ECAR и ECAR в присутствии глюкозы. Гликолитическая емкость представляет собой сумму гликолиза и гликолитического резерва.
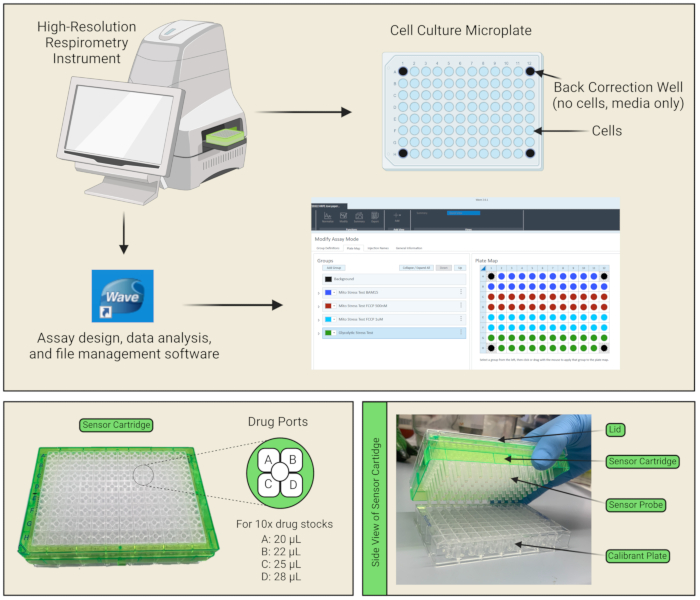
Рисунок 1: Компоненты пластины и картриджа датчика . (A) Показан прибор, программное обеспечение для анализа данных и интерфейс настройки протокола. В макете культуральной пластины с 96 лунками ячейки покрыты лунками синего цвета, а четыре угловые лунки отмечены черным цветом, поскольку они служат обратными корректирующими лунками, которые содержат только среду (и не клетки). (B) Для каждого отверстия картриджа датчика имеется четыре порта для лекарств, в которые можно загружать лекарства A, B, C и D. Объемы для пипетки в каждом порту указаны на основе расчетов для 10-кратных препаратов лекарственного средства. (C) Картридж датчика состоит из датчиков, которые помещаются непосредственно в заполненную калибром полезную пластину. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
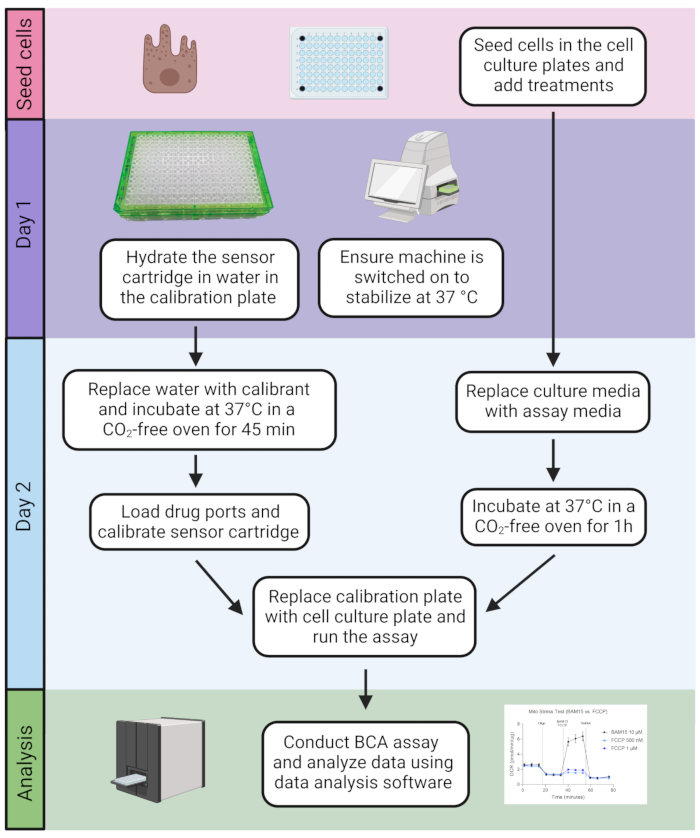
Рисунок 2: Хронология анализа. Клетки высевают в клеточную культуральную пластину. После готовности анализ включает в себя 2-дневную процедуру с последующим количественным определением содержания белка с использованием анализа BCA и последующего анализа данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
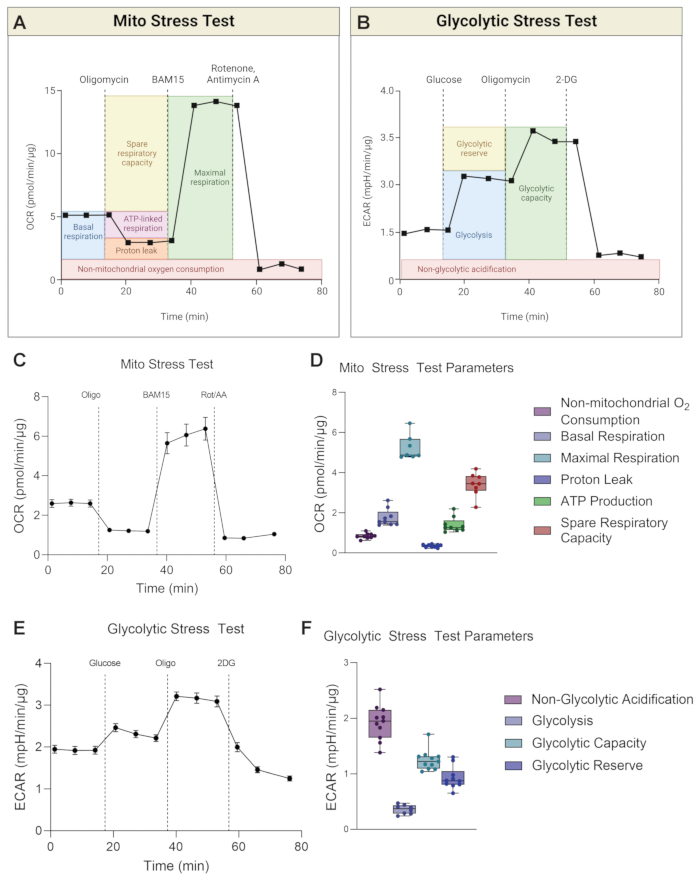
Рисунок 3: Репрезентативные графики стресс-теста Мито и гликолитического стресс-теста. Расчеты параметров (A) Mito Stress Test и (B) Glycolytic Stress Test изображены на схеме. (C) Показана репрезентативная кривая потребления кислорода (OCR) и (D) параметры стресс-теста Mito для H-RPE. (E) Показана репрезентативная кривая скорости внеклеточного подкисления (ECAR) и (F) параметры теста на гликолитический стресс для H-RPE. Полосы погрешностей - это средства ± SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
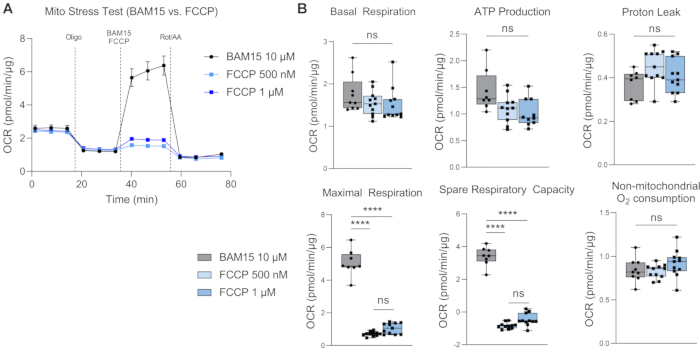
Рисунок 4: Сравнение BAM15 и FCCP в качестве разъединяющего агента. Стресс-тест Мито на H-RPE, сравнивающий эффективность индуцирования максимального дыхания с использованием 10 мкМ BAM15, 500 нМ FCCP или 1 мкМ FCCP, показывающий кривую (A) скорости потребления кислорода (OCR) и (B) параметры стресс-теста Mito. Полосы погрешности являются средними значениями ± SEM. **** p ≤ 0,0001; нс, не существенно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Тест | Глюкоза (мМ) | GlutaMax (мМ) | Пируват натрия (мМ) | HEPES (мМ) |
| Стресс-тест Mito | 25 | 2 | 1 | 1 |
| Гликолитический стресс-тест | Никакой | 0.5 | Никакой | 1 |
Таблица 1: Концентрация добавок, добавляемых в анализные среды для мито- и гликолитических стресс-тестов.
| Тест | Порт А | Порт Б | Порт C |
| Стресс-тест Mito | Олигомицин 2,5 мкМ | FCCP 500 нМ ИЛИ BAM15 10 мкМ | Ротенон 2 мкМ И Антимицин А 2 мкМ |
| Гликолитический стресс-тест | Глюкоза 10 мМ | Олигомицин 2 мкМ | 2-дезоксиглюкоза 50 мМ |
Таблица 2: Концентрации инъекций лекарственных средств для мито- и гликолитических стресс-тестов. Важно отметить, что это конечные концентрации, которым подвергаются клетки после инъекции лекарств в каждую лунку. Лекарства должны быть приготовлены в 10 раз сильнее при загрузке портов для лекарств.
| Срок | Определение | |||
| Калибрант | Калибр представляет собой раствор, который используется для калибровки сенсорного картриджа. Его рецептура является запатентованной и имеет состав, аналогичный PBS. | |||
| Картридж датчика | Картридж датчика содержит два флуорофора, встроенных в гильзу картриджа датчика, которые соединены с волоконно-оптическими пучками, которые излучают свет, возбуждая флуорофоры. Один флуорофор измеряет поток кислорода, а другой - поток протонов. Каждый картридж датчика также оснащен 4 портами, позволяющими последовательно вводить до 4 соединений в лунку во время анализа. | |||
| Утилитарная плита | Утилитарная пластина (также известная как пластина калибра) используется для калибровки датчиков. Раствор Calibrant помещается в служебную пластину. | |||
| Стресс-тест Mito | Стресс-тест Мито — это название анализа, который обеспечивает биоэнергетический профиль митохондриального дыхания путем построения графиков изменений в OCR с течением времени. | |||
| Гликолитический стресс-тест | Гликолитический стресс-тест — это название анализа, который обеспечивает гликолитический биоэнергетический профиль путем построения графика изменений в ECAR с течением времени. | |||
| Норма потребления кислорода (OCR) | Скорость потребления кислорода является мерой потока кислорода (пмоль/мин) и указывает на метаболический статус митохондрий. | |||
| Скорость внеклеточного подкисления (ECAR) | Скорость внеклеточного подкисления является мерой оттока протонов (миль в час / мин) и указывает на гликолитический метаболический статус. | |||
| Программное обеспечение Wave | Программное обеспечение Wave используется для программирования анализа и последующего анализа данных | |||
| Немитохондриальное потребление кислорода | Измерение минимальной скорости после инъекции ротенона/антимицина А | |||
| Базальное дыхание | (Последнее измерение скорости перед первой инъекцией) - (Частота немитохондриального дыхания) | |||
| Максимальное дыхание | (Измерение максимальной скорости после инъекции FCCP) - (Немитохондриальное дыхание) | |||
| Утечка H+ (протона) | (Минимальное измерение скорости после инъекции олигомицина) - (Немитохондриальное дыхание | |||
| Производство СПС | (Последнее измерение скорости перед инъекцией олигомицина) - (Минимальное измерение скорости после инъекции олигомицина) | |||
| Запасная дыхательная способность | (Максимальное дыхание) – (Базальное дыхание) | |||
| Запасная дыхательная способность в % | (Максимальное дыхание) / (Базальное дыхание) × 100 | |||
| Эффективность сцепления | Скорость производства АТФ) / (частота базального дыхания) × 100 | |||
| Гликолиз | (Максимальное измерение скорости перед инъекцией олигомицина) - (Последнее измерение скорости перед инъекцией глюкозы) | |||
| Гликолитическая емкость | (Измерение максимальной скорости после инъекции олигомицина) - (Последнее измерение скорости перед инъекцией глюкозы) | |||
| Гликолитический резерв | (Гликолитическая емкость) – (Гликолиз) | |||
| Гликолитический резерв в % | (Скорость гликолитической емкости) /(Гликолиз) × 100 | |||
| Негликолитическое подкисление | Последнее измерение скорости перед инъекцией глюкозы | |||
Таблица 3: Перечень определений ключевых компонентов анализа.
Обсуждение
Этот оптимизированный протокол для респирометрии высокого разрешения H-RPE включает использование BAM15 в качестве разъединителя вместо обычно используемого FCCP. В то время как в предыдущих исследованиях по респирометрии РПЭ с высоким разрешением использовался FCCP 9,24, BAM15, по-видимому, индуцирует более надежную индукцию максимальных уровней дыхания в H-RPE по сравнению с FCCP. В то время как FCCP и BAM15 безопасны для использования в клетках, BAM15, как сообщается, имеет меньше побочных эффектов в нормальных клетках по сравнению с FCCP или карбонилцианид-3-хлорфенилгидразоном (CCCP)25. Kenwood et al. показали, что BAM15 деполяризует митохондрии, не влияя на потенциал плазматической мембраны, тем самым индуцируя устойчивую максимальную частоту дыхания митохондрий при низкой цитотоксичности26. FCCP, с другой стороны, деполяризует как митохондрии, так и плазматическую мембрану и проявляет более высокую цитотоксичность26.
В протоколе есть несколько важных шагов, в том числе обеспечение того, чтобы ячейки были должным образом покрыты сливающимся, ровным и однородным монослоем RPE во всех экспериментальных лунках микропланшета. Зрелые RPE сильно зависят от OXPHOS для выработки энергии, и, таким образом, клеткам следует дать созреть в течение не менее 1 месяца, чтобы гарантировать, что RPE генерирует правильные базальные и максимальные показания OCR во время анализа. Дегазация планшета для клеточных культур в течение 1 ч при 37 °C в увлажненной печи (без CO 2) перед помещением его в прибор имеет решающее значение для точных показаний ECAR, поскольку CO2 может влиять на pH анализируемой среды. Важно не забывать увлажнять картридж датчика за день до анализа, чтобы убедиться, что он обеспечивает надежные показания OCR и ECAR в день анализа. Следует позаботиться о том, чтобы надлежащим образом восстановить наркотики, подлежащие инъекционному введению, и аликвотировать восстановленные запасы наркотиков в меньшие объемы для длительного хранения, чтобы свести к минимуму циклы замораживания/оттаивания. Крайне важно приготовить 10-кратные растворы лекарственных средств, которые разбавляются в соответствующих анализирующих средах (например, разбавляются в анализирующих средах стресс-теста Мито для стресс-теста Мито), чтобы учесть разбавление от инъекции лекарственного средства в каждую лунку, заполненную анализирующей средой. С каждой последующей инъекцией лекарственного средства в каждой лунке появляется больше среды, и, таким образом, объемы загружаемого лекарственного средства увеличиваются с каждой инъекцией, и следует следить за объемами, указанными в протоколе. Важно выполнить проверку качества по завершении эксперимента, исследуя сенсорный картридж, чтобы убедиться, что остаточное лекарство не видно, и наблюдая за пластиной для клеточной культуры под микроскопом, чтобы убедиться, что сливающийся и однородный клеточный монослой остается.
Изменения в этом протоколе включают введение различных наркотиков в порты и определение того, как эти наркотики влияют на показания OCR и ECAR. Одной из популярных модификаций является инъекция экспериментального препарата по выбору в качестве порта А перед инъекцией обычных препаратов Mito или гликолитического стресс-теста. Этот тип протокола дает представление о том, как острая инъекция выбранного препарата влияет на последующие параметры OXPHOS и гликолитики. Другие модификации включают изучение различных типов клеток; это требует первоначального устранения неполадок оптимальной плотности посевных ячеек и оптимизации анализируемой среды путем обеспечения того, чтобы базальные показания варьировались от 50-100 пмоль/мин для OCR и 10-20 миль в час / мин для ECAR. Оптимальные концентрации вводимых препаратов необходимо определять для каждого нового исследуемого типа клеток, наблюдая за реакциями OCR и ECAR на серийное разведение лекарств.
Ключевым ограничением протокола является то, что жизнеспособность клеток со временем уменьшается, поскольку клетки не находятся в инкубаторе CO2 в их нормальной питательной среде, и, таким образом, анализ должен быть завершен в течение 3-4 часов, чтобы обеспечить максимальную жизнеспособность клеток. Кроме того, воздействие митохондриальных токсинов, вводимых в каждую лунку, может со временем еще больше снизить жизнеспособность клеток. После завершения анализа клетки должны быть лизированы для оценки содержания белка для нормализации показаний OCR и ECAR, и, таким образом, те же клетки не могут быть собраны для последующих анализов молекулярной биологии.
Альтернативы Seahorse для биоэнергетического профилирования включают Oroboros Oxygraph 2k (O2k)27, BaroFuse28,29 и Resipher (Lucid Scientific)7. Oroboros O2k представляет собой закрытый двухкамерный респирометр, в котором используются полярографические кислородные электроды типа S1 Clark. В то время как Oroboros O2k производит высокочувствительные измерения метаболического потока в режиме реального времени, устройство является трудоемким, поскольку оператор должен вручную вводить каждый препарат30. BaroFuse - это новая многоканальная микрофлюидная перфузионная система, которая использует давление газа для проведения нескольких параллельных экспериментов по перфузии и связана с системой обнаружения кислорода для измерения OCR. Преимущество этой системы потокового культивирования заключается в том, что функция и жизнеспособность тканей сохраняются, в отличие от Seahorse, где жизнеспособность клеток уменьшается при более длительных анализах. Resipher использует высокочувствительные оптические датчики кислорода для измерения OCR, когда клетки находятся в 96-луночной пластине в инкубаторе, что позволяет проводить непрерывные измерения OCR в течение нескольких недель или месяцев. Примечательно, что эти приборы не измеряют ECAR, и, таким образом, Seahorse имеет преимущество одновременного исследования как OXPHOS, так и гликолиза.
Изучение биоэнергетических профилей OXPHOS и гликолиза в режиме реального времени становится ключевым фактором в характеристике здоровья и функции RPE. Респирометрия высокого разрешения позволяет эффективно сравнивать метаболический статус нормального и больного РПЭ, тем самым открывая новые возможности скрининга эффективности лекарств при заболеваниях сетчатки, таких как ВМД и ПВР. Будущие направления респирометрии высокого разрешения на РПЭ включают оптимизацию протокола для изучения биоэнергетических профилей высокополяризованных монослоев РПЭ, выращенных на поперечных фильтрах. Calton et al. (2016) успешно достигли этого, разрезав треугольный участок поляризованного монослоя RPE, выращенного на поперечных фильтрах31. Дальнейшее расширение методики включает изучение биоэнергетических профилей индуцированного плюрипотентного РПЭ, полученного из стволовых клеток (iPSC-RPE), выделенного у пациентов с различными дегенеративными заболеваниями сетчатки32. Изучение того, как патогенные цитокины, участвующие в ВМД и PVR, влияют на динамический характер метаболизма RPE, может выявить метаболические уязвимости, которые могут помочь в идентификации новых лекарственных мишеней.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Это исследование было частично поддержано грантами: Fight for Sight Leonard & Robert Weintraub Postdoctoral Fellowship (D.Y.S.); Программа постдокторских стипендий BrightFocus Foundation в области исследований дегенерации желтого пятна (M2021010F, D.Y.S.); Министерство обороны, Программа исследований спинального зрения под номером VR180132 (M.S.-G. и L.A.K.); Национальный глазной институт Национальных институтов здравоохранения под номером R01EY027739 (L.A.K.). Выражаем благодарность донорам программы BrightFocus Foundation «Исследование макулярной дегенерации M2021010F» за поддержку этого исследования. Схемы были созданы с помощью Biorender.com
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose | Sigma | D8375-5G | Reconstituted in the Glycolytic Assay Media from its powder form and used in the Glycolytic Stress Test (Port C injection) |
| 96 Well Non-Treated Plate, 5/Pack, Sterile | VWR | 229597 | BCA Assay 96-well plate |
| Antimycin A from Streptomyces sp. | Sigma | A8674-25MG | Inhibitor of Complex III of the electron transport chain (part of the Port C drug injection together with rotenone) |
| BAM15 | Sigma | SML1760-5MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| BCA Assay | ThermoFisher | 23225 | To determine total protein content in each well |
| Calibrant Solution | Seahorse Bioscience | 100840-000 | Solution used to calibrate the probes of the sensor cartridge |
| Cell Lysis buffer 10x | Cell Signaling Technologies | 9803S | Dilute 10x Cell Lysis Buffer to a 1x solution using deionized water and add 1 mM PMSF before use |
| D-(+)-Glucose solution | Sigma | G8644-100ML | Supplement to be added to the Mito Stress Test assay media and also used in the Glycolytic Stress Test (Port A injection) |
| DMSO, Cell culture grade | Sigma-aldrich | D4540-100ML | For reconstituting all mitochondrial drugs except for 2DG |
| FCCP | Sigma | C2920-10MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| GlutaMAX | Gibco | 35050061 | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| HEPES solution | Sigma | H0887-100ML | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| H-RPE – Human Retinal Pigment Epithelial Cells | Lonza | 194987 | Primary human fetal RPE cells |
| Oligomycin - CAS 1404-19-9 - Calbiochem | Sigma | 495455-10MG | ATP synthase inhibitor used for the Mito Stress Test (Port A injection) and Glycolytic Stress Test (Port B injection) |
| Parafilm | Bemis | PM996 | To seal the plate once the cells are lysed to prevent evaporation in the freezer |
| Phenylmethylsulfonyl fluoride (PMSF) Protease Inhibitor | Gold Biotechnology Inc | 50-153-2823 | Used at 1 mM for the 1x Cell Lysis Buffer solution |
| ReagentPack Subculture Reagents, 100 mL | Lonza | CC-5034 | Passaging reagents for primary human fetal RPE cells. Each kit contains 100 mL Trypsin/EDTA, Trypsin Neutralizing Solution, HEPES Buffered Saline |
| Rotenone | Sigma | R8875-1G | Inhibitor of Complex I of the electron transport chain (part of the Port C drug injection together with antimycin A) |
| RtEGM Retinal Pigment Epithelial Cell Growth Medium BulletKit - RtEBMTM Basal Medium (00195406) and RtEGMTM SingleQuots Supplements (00195407) | Lonza | 195409 | Media for primary human fetal RPE cells |
| Seahorse XFe96 Analyzer | Agilent | High-Resolution Respirometry Instrument | |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | This contains the 96-well Seahorse Cell Culture Microplate, the sensor cartridge and the calibrant solution |
| Sodium pyruvate solution | Sigma | S8636-100ML | Supplement to be added to the Mito Stress Test assay media |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 50 mL process volume, 0.22 µm pore size | Millipore-Sigma | SCGP00525 | Tube top filter unit for sterile filtration of the assay media |
| Synergy H1 Plate Reader | BioTek | Plate Reader for measuring absorbance at 562 nm for the BCA assay | |
| XF base medium without phenol red | Agilent | 103335-100 | Base media for running the Seahorse assay |
Ссылки
- He, Y., et al. Mitochondria impairment correlates with increased sensitivity of aging RPE cells to oxidative stress. Journal of Ocular Biology Diseases and Informatics. 3 (3), 92-108 (2010).
- Shu, D. Y., Butcher, E., Saint-Geniez, M. EMT and EndMT: Emerging roles in age-related macular degeneration. International Journal of Molecular Sciences. 21 (12), 4271 (2020).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the Seahorse XF analyzer or a Clark-type oxygen electrode. Current Protocols in Toxicology. 60, 2-16 (2014).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio Protocol. 8 (10), 2850 (2018).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Shu, D. Y., Butcher, E. R., Saint-Geniez, M. Suppression of PGC-1α drives metabolic dysfunction in TGFbeta2-induced EMT of retinal pigment epithelial cells. International Journal of Molecular Sciences. 22 (9), 4701 (2021).
- Shu, D. Y., et al. Dimethyl fumarate blocks tumor necrosis factor-alpha-driven inflammation and metabolic rewiring in the retinal pigment epithelium. Frontiers in Molecular Neuroscience. 15, 896786 (2022).
- Satish, S., Philipose, H., Rosales, M. A. B., Saint-Geniez, M. Pharmaceutical induction of PGC-1α promotes retinal pigment epithelial cell metabolism and protects against oxidative damage. Oxidative Medicine and Cellular Longevity. 2018, 9248640 (2018).
- Ferrington, D. A., et al. Altered bioenergetics and enhanced resistance to oxidative stress in human retinal pigment epithelial cells from donors with age-related macular degeneration. Redox Biology. 13, 255-265 (2017).
- Cai, H., et al. High-throughput screening identifies compounds that protect RPE cells from physiological stressors present in AMD. Experimental Eye Research. 185, 107641 (2019).
- Kurihara, T., et al. Hypoxia-induced metabolic stress in retinal pigment epithelial cells is sufficient to induce photoreceptor degeneration. Elife. 5, 14319 (2016).
- Ishii, M., Beeson, G., Beeson, C., Rohrer, B. Mitochondrial C3a receptor activation in oxidatively stressed epithelial cells reduces mitochondrial respiration and metabolism. Frontiers in Immunology. 12, 628062 (2021).
- Rosales, M. A. B., Shu, D. Y., Iacovelli, J., Saint-Geniez, M. Loss of PGC-1α in RPE induces mesenchymal transition and promotes retinal degeneration. Life Science Alliance. 2 (3), 201800212 (2019).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Huang, T., Long, M., Huo, B. Competitive binding to cuprous ions of protein and BCA in the bicinchoninic acid protein assay. Open Biomedical Engineering Journal. 4, 271-278 (2010).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245 (2021).
- Symersky, J., Osowski, D., Walters, D. E., Mueller, D. M. Oligomycin frames a common drug-binding site in the ATP synthase. Proceedings of the National Academy of Sciences. 109 (35), 13961-13965 (2012).
- Divakaruni, A. S., Brand, M. D. The regulation and physiology of mitochondrial proton leak. Physiology. 26 (3), 192-205 (2011).
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: A key controller of biological processes in physiology and diseases. Cells. 8 (8), 795 (2019).
- Herst, P. M., Tan, A. S., Scarlett, D. J., Berridge, M. V. Cell surface oxygen consumption by mitochondrial gene knockout cells. Biochimica Biophysica Acta. 1656 (2-3), 79-87 (2004).
- Pike Winer, L. S., Wu, M. Rapid analysis of glycolytic and oxidative substrate flux of cancer cells in a microplate. PLoS One. 9 (10), 109916 (2014).
- Laussel, C., Leon, S. Cellular toxicity of the metabolic inhibitor 2-deoxyglucose and associated resistance mechanisms. Biochemical Pharmacology. 182, 114213 (2020).
- Miyagishima, K. J., et al. AMPK modulation ameliorates dominant disease phenotypes of CTRP5 variant in retinal degeneration. Communications Biology. 4 (1), 1360 (2021).
- Gao, Z. X., et al. The new mitochondrial uncoupler BAM15 induces ROS production for treatment of acute myeloid leukemia. Biochemical Pharmacology. 198, 114948 (2022).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Rountree, A., et al. Barofuse a novel pressure-driven, adjustable-throughput perfusion system for tissue maintenance and assessment. Heliyon. 2 (12), 00210 (2016).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, 66716 (2021).
- Mas-Bargues, C., Garcia-Dominguez, E., Borras, C. Recent approaches to determine static and dynamic redox state-related parameters. Antioxidants. 11 (5), 864 (2022).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Chichagova, V., et al. Human iPSC disease modelling reveals functional and structural defects in retinal pigment epithelial cells harbouring the m.3243A > G mitochondrial DNA mutation. Scientific Reports. 7 (1), 12320 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены