Method Article
Analisi in tempo reale della bioenergetica in cellule epiteliali pigmentate primarie della retina umana mediante respirometria ad alta risoluzione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Lo stato metabolico delle cellule epiteliali pigmentate retiniche umane (H-RPE) riflette la loro salute e funzione. Qui viene presentato un protocollo ottimizzato per esaminare il flusso metabolico in tempo reale di H-RPE utilizzando respirometria ad alta risoluzione.
Abstract
La disfunzione metabolica delle cellule epiteliali pigmentate retiniche (RPE) è un fattore patogeno chiave delle malattie retiniche come la degenerazione maculare legata all'età (AMD) e la vitreoretinopatia proliferativa (PVR). Poiché le RPE sono cellule altamente metabolicamente attive, le alterazioni del loro stato metabolico riflettono cambiamenti nella loro salute e funzione. La respirometria ad alta risoluzione consente l'analisi cinetica in tempo reale delle due principali vie bioenergetiche, la glicolisi e la fosforilazione ossidativa mitocondriale (OXPHOS), attraverso la quantificazione rispettivamente del tasso di acidificazione extracellulare (ECAR) e del tasso di consumo di ossigeno (OCR). Di seguito è riportato un protocollo ottimizzato per condurre respirometria ad alta risoluzione su cellule epiteliali pigmentate retiniche umane primarie (H-RPE). Questo protocollo fornisce una descrizione dettagliata delle fasi coinvolte nella produzione di profili bioenergetici di RPE per definire le loro capacità basali e massime di OXPHOS e glicolitiche. L'esposizione di H-RPE a diverse iniezioni di farmaci mirati al macchinario mitocondriale e glicolitico si traduce in profili bioenergetici definiti, da cui è possibile calcolare i parametri metabolici chiave. Questo protocollo evidenzia la maggiore risposta di BAM15 come agente disaccoppiante rispetto al cianuro di carbonile p-trifluorometossifenilidrazone (FCCP) per indurre la massima capacità respiratoria in RPE. Questo protocollo può essere utilizzato per studiare lo stato bioenergetico di RPE in diverse condizioni di malattia e testare l'efficacia di nuovi farmaci nel ripristinare lo stato metabolico basale di RPE.
Introduzione
Le cellule epiteliali pigmentate retiniche (RPE) esistono come un monostrato di cellule epiteliali pigmentate strategicamente localizzate tra i fotorecettori e l'endotelio fenestrato del coriocapillare. Gli RPE sono altamente metabolicamente attivi con numerose funzioni, tra cui (1) fagocitosi dei dischi fotorecettoriali, (2) riciclaggio del pigmento visivo per mantenere il ciclo visivo, (3) trasporto di nutrienti, metaboliti, ioni e acqua, (4) assorbimento della luce, (5) protezione contro la fotoossidazione, (6) secrezione di fattori essenziali per supportare l'integrità retinica e (7) formazione della barriera emato-retinica esterna1 . La degenerazione della RPE è associata a disfunzione metabolica e difetti mitocondriali, che portano a malattie oculari accecanti come la degenerazione maculare legata all'età (AMD) e la vitreoretinopatia proliferativa (PVR)2.
Due percorsi bioenergetici chiave includono la glicolisi, che si verifica nel citoplasma, e la fosforilazione ossidativa (OXPHOS), che si verifica nei mitocondri. Durante la glicolisi, una molecola di glucosio viene convertita in due molecole di piruvato e una produzione netta di due molecole di adenosina trifosfato (ATP). In contrasto con la glicolisi, OXPHOS produce livelli molto più elevati di ATP (~ 32-38 molecole di ATP per molecola di glucosio). In particolare, OXPHOS consuma ossigeno e richiede mitocondri funzionali, mentre la glicolisi si verifica nel citoplasma e non richiede ossigeno.
Prima dell'introduzione di tecniche basate sulla fluorescenza o sulla fosforescenza per esaminare la respirazione mitocondriale, i livelli di ossigeno venivano misurati in sospensioni cellulari permeabilizzate in camere dotate di un elettrodo di ossigeno di tipo Clark3. Mentre l'elettrodo di Clark è molto più economico della respirometria basata sulla fluorescenza e funziona in cellule non aderenti, è relativamente a basso rendimento, con ogni corsa respiratoria che dura circa 15-20 minuti e richiede quantità molto più elevate di cellule per ogni campione3. Pertanto, la tecnica respirometrica basata sulla fluorescenza ha in gran parte sostituito l'elettrodo di Clark ed è diventata una tecnica popolare nei campi del metabolismo e della ricerca mitocondriale.
Questo protocollo descrive una tecnica respirometrica ad alto rendimento, ad alta risoluzione, basata sulla fluorescenza che misura cineticamente i profili bioenergetici OXPHOS e glicolitici delle cellule viventi. Poiché il processo di OXPHOS consuma ossigeno, il profilo bioenergetico per OXPHOS viene prodotto mappando i cambiamenti nel tasso di consumo di ossigeno (OCR) nel tempo4. In questa tecnica, due fluorofori sono incorporati nel manicotto della cartuccia del sensore che è collegato a fasci di fibre ottiche che emettono luce, eccitando i fluorofori. Le variazioni nell'emissione di fluorofori sono misurate da sensori di fluorescenza altamente sensibili e trasmesse attraverso il fascio di fibre ottiche per essere convertite in una lettura OCR5. Il fluoroforo viene spento dall'ossigeno, consentendo così la determinazione dei livelli di ossigeno extracellulare nel mezzo di analisi, noto come flusso di ossigeno o OCR. L'altro fluoroforo è una sonda sensore di pH sensibile ai cambiamenti nell'efflusso protonico, che viene convertita in una misura del tasso di acidificazione extracellulare (ECAR). Durante le misurazioni, i fasci di fibre ottiche con fluorofori incorporati vengono abbassati a 200 μm sopra il monostrato cellulare, creando una microcamera transitoria che consente letture rapide e in tempo reale. Una volta rilevata una variazione del 10% nei livelli di ossigeno o protoni, i sensori vengono sollevati verso l'alto, consentendo a un volume maggiore di fluidi di mescolarsi con i mezzi transitori della microcamera, ripristinando i valori OCR ed ECAR al basale. Ogni cartuccia sensore è dotata di quattro porte per consentire la somministrazione sequenziale di un massimo di quattro composti per pozzetto durante il test. Le misurazioni possono essere raccolte prima e dopo l'iniezione dei composti in ciascuna porta, rivelando informazioni chiave sullo stato metabolico delle cellule.
L'interrogazione di queste due distinte vie metaboliche può produrre importanti scoperte riguardanti lo stato metabolico di RPE dopo l'esposizione a diversi stimoli patogeni, e quindi può essere utilizzata per testare l'efficacia dei farmaci nel ripristinare l'integrità metabolica di RPE 6,7,8. L'avvento della respirometria ad alto rendimento e la disponibilità di inibitori mitocondriali specifici hanno stimolato ulteriori ricerche nella definizione dei profili bioenergetici dell'RPE e nell'identificazione dei difetti nel metabolismo e nei mitocondri durante gli stati patologici 6,7,8,9,10,11,12,13 . La respirometria ad alta risoluzione ha evidenziato il ruolo chiave della riprogrammazione metabolica dell'RPE nelle patologie retiniche come AMD e PVR. Due citochine chiave coinvolte nella patogenesi di AMD e PVR sono il fattore di crescita trasformante beta 2 (TGFβ2) e il fattore di necrosi tumorale alfa (TNFα). L'induzione della transizione epiteliale-mesenchimale (EMT) da parte del TGFβ2 è accompagnata da disfunzione mitocondriale, soppressione di OXPHOS e aumento compensatorio della capacità glicolitica in RPE6. Più recentemente, la citochina pro-infiammatoria, TNFα, ha dimostrato di indurre una significativa sovraregolazione dell'OXPHOS basale e una ridotta glicolisi in H-RPE7. La somministrazione di dimetilfumarato ha soppresso significativamente l'infiammazione indotta da TNFα nell'H-RPE e ha ripristinato la morfologia mitocondriale e i profili bioenergetici basali7. I profili metabolici divergenti indotti da questi due fattori di crescita stimolano intriganti questioni meccanicistiche riguardanti il coinvolgimento della riprogrammazione metabolica nelle malattie retiniche. Il seguente protocollo descrive i passaggi per valutare OXPHOS e i profili bioenergetici glicolitici in H-RPE utilizzando la respirometria ad alta risoluzione.
Protocollo
1. Placcatura H-RPE nella piastra di coltura cellulare
- Scongelare H-RPE in un matraccio T25 in terreno RPE umano integrato con integratori di terreno di crescita RPE (4 mM L-glutammina, 25 ng/mL FGF-2, 2% FBS, 30 mg/mL di gentamicina e 15 μg/mL di amfotericina).
- Incubare le cellule a 37 °C e 5% di CO2 in un incubatore umidificato. Aggiornare il supporto il giorno successivo e attendere che le celle raggiungano almeno l'80% di confluenza prima di passare in un rapporto di 1:3 in un pallone T75.
- Una volta confluenti, far passare le cellule utilizzando il kit di reagenti di sottocoltura costituito da soluzione di tripsina/EDTA allo 0,025%, soluzione neutralizzante di tripsina e soluzione salina tamponata HEPES (pH 7,0-7,6).
- Risciacquare delicatamente H-RPE con 3 ml di soluzione salina tamponata HEPES. Quindi aggiungere 3 ml di tripsina/EDTA e incubare (37 °C e 5% CO2) per 5 minuti (o fino a quando le cellule non si sono sollevate dalla base del pallone, come osservato al microscopio). Neutralizzare la tripsina/EDTA con 3 mL di soluzione neutralizzante di tripsina.
- Centrifugare le celle a 200 x g per 3,5 minuti per formare il pellet cellulare. Aspirare con cautela e scartare il surnatante.
- Risospendere le cellule nel mezzo RPE umano ad una concentrazione finale di 20.000 cellule per 100 μL per pozzetto.
- Pipettare su e giù più volte per garantire che la sospensione cellulare sia omogenea, utilizzando una pipetta multicanale per facilitare e uniformare il pipettaggio nella micropiastra di coltura cellulare a 96 pozzetti. Appoggiare la punta della pipetta appena sotto il bordo circolare nella parte superiore del pozzetto per uno strato cellulare uniforme e omogeneo.
NOTA: Non è necessario alcun rivestimento poiché le celle aderiscono bene alla micropiastra. - Assicurarsi di lasciare i quattro pozzetti angolari vuoti di celle (solo 100 μL di supporto) per fungere da pozzetti di correzione di fondo (Figura 1A).
NOTA: La micropiastra è formattata in un tipico design a piastra a 96 pozzetti; Tuttavia, la superficie di ciascun pozzetto è di 0,106 cm2, che è il 40% più piccola di una piastra standard da 96 pozzetti. A questa densità cellulare, le cellule dovrebbero essere confluenti al 100% il giorno successivo. Si raccomanda di eseguire un esperimento di ottimizzazione della densità cellulare prima di testare i trattamenti per garantire che le letture OCR basali e ECAR siano rispettivamente di circa 50-100 pmol / min e 10-20 mpH / min.
- Pipettare su e giù più volte per garantire che la sospensione cellulare sia omogenea, utilizzando una pipetta multicanale per facilitare e uniformare il pipettaggio nella micropiastra di coltura cellulare a 96 pozzetti. Appoggiare la punta della pipetta appena sotto il bordo circolare nella parte superiore del pozzetto per uno strato cellulare uniforme e omogeneo.
- Lasciare la piastra di coltura cellulare a temperatura ambiente (RT) per 1 ora prima di reinserirla nell'incubatore (5% CO2, 37 °C, umidificata) per ridurre al minimo gli effetti sui bordi. Gli effetti di bordo sono cambiamenti nel volume del supporto nei pozzetti dei bordi periferici della piastra a 96 pozzetti dovuti all'evaporazione14.
NOTA: Le cellule aderiranno durante la notte e formeranno un monostrato confluente il giorno successivo. Gli H-RPE maturano nella piastra per almeno 1 mese rinfrescando metà dei substrati di crescita ogni 2-3 giorni. - Esaminare le cellule al microscopio prima di cambiare il supporto per verificare la loro morfologia e il livello di pigmentazione. Assicurarsi che le cellule siano confluenti con una caratteristica morfologia simile al ciottolo e acquisiscano pigmentazione nel tempo, come si vede nelle immagini morfologiche in Shu et al.7.
2. Il giorno prima di eseguire il test
- Assicurarsi che la cartuccia del sensore sia idratata il giorno prima del test riempiendo ciascun pozzetto della piastra di servizio con 200 μL di acqua deionizzata.
NOTA: Il coperchio della piastra contiene biosensori fluorescenti per misurare i livelli di ossigeno e pH per ciascun pozzetto. I sensori sono accoppiati a guide d'onda in fibra ottica che forniscono luce a varie lunghezze d'onda di eccitazione e trasmettono un segnale fluorescente attraverso filtri ottici ai fotorivelatori. - Posizionare la cartuccia del sensore immersa in acqua nella piastra di servizio insieme a ~20 mL del calibrante (per riscaldarsi per l'uso il giorno successivo) in un forno umidificato a 37 °C (senza CO2) durante la notte.
NOTA: Il calibrante è una soluzione proprietaria progettata per la calibrazione della cartuccia del sensore ed è probabilmente simile nella composizione alla soluzione salina tamponata con fosfato (PBS). Il tempo minimo per l'idratazione della cartuccia è di 4 ore, ma i migliori risultati si ottengono con l'idratazione notturna. - Assicurarsi che lo strumento sia acceso e avviare il software per consentire allo strumento di stabilizzarsi a 37 °C durante la notte (Figura 2). Generalmente, lo strumento può essere lasciato acceso anche quando non in uso.
3. Stress Test Mito in tempo reale utilizzando l'analizzatore di flusso extracellulare
- Il giorno del test, sostituire l'acqua nella piastra di servizio con un volume uguale di calibrante riscaldato almeno 45 minuti prima di eseguire il test.
- Effettuare il test Mito Stress Test utilizzando il mezzo di base senza rosso fenolo aggiungendo integratori, come mostrato nella Tabella 1. Riscaldare il fluido a 37 °C, regolare il pH a 7,4 e filtrare il fluido sotto vuoto utilizzando un'unità filtrante superiore del tubo. Per eseguire una piastra completa, creare ~ 25 ml di mezzi di analisi.
- Rimuovere il supporto RPE umano e sostituirlo con 180 μL di terreno di analisi appena preparato (fase 3.2). Porre la piastra di coltura cellulare in un forno umidificato a 37 °C (senza CO2) per 1 ora prima di iniziare il test.
NOTA: Questo è importante per il degassamento della piastra cellulare, consentendo la diffusione di CO2 . Poiché le cellule non sono più nei loro terreni di crescita e non sono più in un incubatore con CO2, la loro vitalità si deteriorerà nel tempo, pertanto è necessario prestare attenzione a condurre il test nel modo più efficiente possibile. Bisogna anche fare attenzione per assicurarsi che non ci siano bolle nella piastra di coltura cellulare; Se sono presenti, inserirli con una pipetta o un ago. - Ogni cartuccia del sensore ha quattro porte di erogazione del reagente per pozzetto per l'iniezione dei composti in esame nei pozzetti della piastra di coltura cellulare durante il test (Figura 1C,D). Preparare ~ 3 ml delle soluzioni di farmaco 10x diluendo le scorte di farmaci nei rispettivi mezzi di analisi secondo la Tabella 2. Ad esempio, caricare la porta A con 25 μM di oligomicina disciolta nel mezzo di analisi Mito Stress Test, in modo tale che quando il volume del farmaco viene iniettato nel pozzetto dallo strumento, la concentrazione finale a cui ogni cellula è esposta sia di 2,5 μM. Pipettare 20 μL dello stock di farmaco 10x nella porta A, 22 μL nella porta B, e 25 μL nella porta C, per raggiungere la concentrazione finale specificata del farmaco in ciascun pozzetto. Per i protocolli che richiedono tutte e quattro le porte del farmaco, pipettare 28 μL nella porta D.
NOTA: Fare riferimento alla Figura 1B quando si inseriscono i farmaci nelle porte dei farmaci per il corretto orientamento delle porte A/B/C/D. La tacca sul bordo della cartuccia deve essere posizionata nell'angolo in basso a sinistra durante il caricamento delle porte dei farmaci. Pipettando ad angolo in ciascuna porta del farmaco, le bolle possono essere ridotte al minimo. Se sono presenti bolle, bisogna fare attenzione a farle scoppiare con una pipetta o un ago. - Aprire la scheda Modelli nel software di analisi, selezionare Mito Stress Test e compilare le definizioni di gruppo.
- Dettagli di input sulla strategia di iniezione (in questo caso, è pre-inserito come farmaci Mito Stress Test). Dettagli di input relativi ai diversi gruppi sperimentali nel test (ad esempio, Controllo o Trattamento). Immettere i dettagli sui mezzi di analisi (aggiunta di diversi integratori e le loro concentrazioni specifiche ai mezzi di analisi di base) e infine aggiungere il tipo di cellula.
- Fare clic sulla scheda successiva, Mappa delle piastre, in cui i diversi gruppi esaminati verranno assegnati alla loro posizione specifica sulla mappa delle lastre a 96 pozzi. Una volta fatto ciò, fare clic sulla scheda Protocollo per rivedere il protocollo dello strumento per il protocollo Mito Stress Test predefinito .
NOTA: il modello predefinito Mito Stress Test è pronto per l'uso ma può essere modificato in qualsiasi modo per adattarsi al progetto sperimentale. Ad esempio, il tempo di misurazione predefinito è 3 minuti, ma può essere modificato in 5 minuti se lo si desidera.
- Fare clic su Esegui il test e inserire la cartuccia del sensore immersa nella soluzione di calibrazione nella piastra di servizio. Questo processo richiede circa 25 minuti. In questa fase, ogni biosensore viene calibrato in modo indipendente in base all'uscita del sensore misurata nella soluzione calibrante con pH e concentrazione di ossigeno noti.
- Una volta calibrato, rimuovere la piastra di utilità e inserire la piastra di coltura cellulare.
NOTA: La piastra di coltura cellulare viene prima equilibrata, dopodiché lo strumento inizia a miscelare i mezzi di analisi e a misurare i valori OCR ed ECAR. Questo passaggio dura circa 1,5 ore e viene condotto all'interno dello strumento senza alcun intervento da parte dell'utente. Una lettura basale di OCR ed ECAR viene prima stabilita mescolando i mezzi di analisi per 3 minuti e quindi misurando OCR ed ECAR per 3 minuti. Lo strumento esegue tre cicli di miscelazione e misurazione. - Dopo la misurazione di base, lo strumento inietta automaticamente la soluzione farmacologica Port A in ciascun pozzetto. Questo è seguito da tre cicli di miscelazione e misurazione (3 minuti ciascuno). Lo stesso schema si verifica dopo ogni successiva iniezione di farmaco (porte B e C).
- Una volta calibrato, rimuovere la piastra di utilità e inserire la piastra di coltura cellulare.
- Una volta completata l'esecuzione, rimuovere la piastra di coltura cellulare e la cartuccia del sensore. Ai fini del controllo qualità, assicurarsi che tutte le porte del farmaco nella cartuccia del sensore siano state iniettate esaminando le porte per verificare che non rimanga alcun residuo di farmaco. Eliminare la cartuccia del sensore e la piastra di servizio in quanto sono articoli monouso.
- Esaminare le cellule nella micropiastra di coltura cellulare al microscopio per assicurarsi che ci sia ancora un monostrato confluente di cellule. Eliminare il mezzo di analisi e sostituirlo con 60 μL di tampone di lisi 1x in ciascun pozzetto.
NOTA: Il tampone di lisi è costituito da 10x tampone di lisi diluito a 1x in acqua deionizzata con l'aggiunta di 1 mM di fenilmetilsulfonil fluoruro (PMSF). - Avvolgere i bordi della piastra in Parafilm per evitare l'evaporazione e metterla in un congelatore a -80 °C per favorire la lisi cellulare durante la notte, prima di quantificare il contenuto proteico utilizzando il saggio BCA.
- Per l'analisi dei dati, normalizzare tutti i dati dividendo i valori OCR ed ECAR per il microgrammo di proteina in ciascun pozzetto. Esportare il generatore di report Mito Stress Test, che utilizza macro Excel per calcolare automaticamente i parametri Mito Stress Test utilizzando il software di analisi dei dati.
NOTA: Questo può essere utilizzato per determinare la respirazione basale, la respirazione massima, la capacità respiratoria di riserva, la perdita di protoni, la produzione di ATP e la respirazione non mitocondriale. Le definizioni di questi calcoli sono elencate nella tabella 3.
4. Test di stress glicolitico in tempo reale utilizzando l'analizzatore di flusso extracellulare
- Eseguire lo Stress Test glicolitico seguendo gli stessi passaggi dello Stress Test Mito, ad eccezione dell'utilizzo dei diversi integratori di saggi e iniezioni di farmaci mostrati nella Tabella 1 e nella Tabella 2.
- Per l'analisi dei dati, esportare il generatore di report Glycolytic Stress Test, che utilizza macro Excel per calcolare automaticamente i parametri del Glycolytic Stress Test dal software di analisi dei dati.
NOTA: Questo può essere utilizzato per determinare l'acidificazione non glicolitica, la glicolisi, la capacità glicolitica e la riserva glicolitica. Le definizioni di questi calcoli sono elencate nella tabella 3.
5. Saggio di quantificazione della proteina BCA
NOTA: Il saggio di quantificazione delle proteine dell'acido bicinconico (BCA) (noto anche come saggio di Smith15) è un test colorimetrico a base di rame utilizzato per determinare il contenuto proteico totale in un campione. La normalizzazione dei dati OCR ed ECAR al microgrammo di proteina in ciascun pozzetto assicura che diverse quantità di cellule / proteine in ciascun pozzetto non distorcano le letture. Il meccanismo del saggio BCA si basa su due reazioni chimiche. In primo luogo, i legami peptidici nelle proteine riducono gli ioni rameici (Cu2+) a ioni rameosi (Cu+), che è una reazione dipendente dalla temperatura assistita da temperature più elevate (da 37 a 60 °C). Se ci sono più legami peptidici, rendendo la quantità di Cu2+ proporzionale al contenuto proteico nella soluzione16. Questa reazione provoca un cambiamento di colore dal verde a una soluzione viola intenso, con un picco di assorbanza a 562 nm16. Maggiore è il contenuto proteico nel campione, maggiore è l'assorbanza a questa lunghezza d'onda. Il campo di lavoro di questo kit è di 20-2.000 μg/ml.
- Il kit di analisi BCA contiene 1 mL di aliquote di albumina sierica bovina (BSA) a 2 mg/ml, che funge da standard di riferimento per la concentrazione proteica. Preparare una diluizione seriale in una piastra trasparente a fondo piatto a 96 pozzetti partendo dal BSA non diluito di 2 mg/mL e successivamente dimezzando la concentrazione diluendo in acqua deionizzata (ad esempio, 2, 1, 0,5, 0,25, 0,125 mg/ml, ecc.). L'utilizzo di una concentrazione nota di proteine consente il calcolo di una curva standard, che viene utilizzata per calcolare il contenuto proteico dei campioni sperimentali. Per migliorare l'accuratezza delle misurazioni del contenuto proteico calcolate, misurare le letture di assorbanza degli standard di riferimento della concentrazione proteica insieme ai campioni sperimentali per ciascun test.
- Pipettare 25 μL di ciascuna diluizione seriale BSA in duplice copia nella piastra a 96 pozzetti.
- Pipettare 25 μL del tampone di lisi 1x in duplicato nella piastra da 96 pozzetti per fungere da bianco.
- Scongelare la piastra di coltura cellulare a temperatura ambiente e pipettare 25 μL di ciascun lisato cellulare in duplicato nella piastra a 96 pozzetti.
- Preparare il reagente di lavoro in un rapporto 50:1 di reagenti del kit BCA A:B. Mescolare accuratamente a vortice per rimuovere qualsiasi torbidità nel reagente di lavoro, in modo che sia una soluzione verde omogenea. Aggiungere 200 μL del reagente di lavoro a ciascun pozzetto.
- Proteggere la piastra dalla luce coprendo la piastra con un foglio di alluminio e incubare in forno a 37 °C per 20 minuti.
- Misurare l'assorbanza a 562 nm in un lettore di piastre a 96 pozzetti.
- Per l'analisi dei dati, calcolare la media di tutti i valori duplicati. Sottrarre i livelli di assorbanza del bianco determinati dai pozzetti tampone di lisi 1x dalle misurazioni di tutti i campioni. Determinare la curva standard tracciando l'assorbanza di ogni standard BSA alla sua concentrazione nota in μg/mL. Utilizzare l'equazione lineare derivata dalla curva standard per determinare la concentrazione proteica dei campioni sperimentali.
Risultati
Lo strumento misura simultaneamente sia l'OCR che l'ECAR per ogni corsa. Per lo stress test Mito, i calcoli dei parametri si basano sulle letture OCR (Figura 3A), mentre per lo stress test glicolitico, i calcoli dei parametri si basano sulle letture ECAR (Figura 3B). La Figura 3 mostra grafici rappresentativi per la curva OCR del Mito Stress Test nel tempo (Figura 3C) e calcoli dei parametri sotto forma di grafici a barre per H-RPE (Figura 3D). Lo stress test glicolitico è rappresentato come una curva ECAR nel tempo (Figura 3E) e i calcoli dei parametri sono visualizzati in grafici a barre per H-RPE (Figura 3F).
La respirazione basale fornisce una comprensione delle esigenze energetiche delle cellule in condizioni basali17. La prima iniezione di farmaco, oligomicina (Oligo), è un inibitore dell'ATP sintasi e, pertanto, qualsiasi riduzione dell'OCR dopo la prima iniezione di farmaco è una misura della respirazione legata all'ATP18. Qualsiasi respirazione basale residua dopo successive iniezioni di farmaci è considerata una perdita di protoni poiché non è accoppiata alla sintesi di ATP. L'aumento della perdita di protoni può indicare un aumento del disaccoppiamento mitocondriale, che è regolato da proteine disaccoppianti che sono fisiologicamente presenti ma sono state anche collegate a patologie come obesità, cancro, diabete di tipo 2 e malattie cardiovascolari19. La seconda iniezione è di un agente disaccoppiante, come BAM15 o FCCP, per determinare il potenziale respiratorio massimo dei mitocondri. Gli agenti disaccoppianti comprimono il gradiente protonico e riducono la forza motrice protonica attraverso la membrana interna mitocondriale. Il risultato è un flusso disinibito di elettroni attraverso la catena di trasporto degli elettroni (ETC), che eleva il tasso di consumo di ossigeno e fa sì che la respirazione mitocondriale raggiunga la sua capacità massima20. La capacità respiratoria di riserva (SRC) è la differenza tra respirazione massima e basale, indicando la capacità delle cellule di rispondere ai cambiamenti nelle richieste energetiche quando sfidate, indicando l'idoneità cellulare. È importante sottolineare che, per lo stress test Mito in H-RPE, BAM15 è superiore a FCCP nel migliorare la capacità respiratoria mitocondriale (Figura 4A,B), poiché la respirazione massima e la capacità respiratoria di riserva sono significativamente più elevate con 10 μM BAM15 rispetto a 500 nM o 1 μM FCCP. Non sono state osservate differenze significative tra le due dosi di FCCP. La terza e ultima iniezione di rotenone e antimicina A (Rot / AA) inibiscono i complessi mitocondriali I e III, rispettivamente, dell'ETC, che interrompe la respirazione mitocondriale; qualsiasi OCR residuo è dovuto a fonti non mitocondriali21.
Durante la glicolisi, una molecola di glucosio viene convertita in due molecole di lattato in assenza di ossigeno. L'estrusione di lattato dalla cellula è accompagnata dall'efflusso di un protone per molecola di lattato, causando quindi l'acidificazione dello spazio extracellulare. Il flusso di produzione di protoni nei mezzi è misurato dai cambiamenti nell'ECAR. I livelli di glicolisi basale vengono stabiliti per primi, dopo di che il glucosio viene iniettato nel mezzo di analisi, che è privo di glucosio, per indurre la glicolisi e quindi aumentare i livelli di ECAR22. L'oligomicina viene iniettata per indurre l'ECAR "più alto" in quanto arresta la produzione di ATP mitocondriale, costringendo così la cellula a derivare il suo ATP attraverso la glicolisi. Infine, la glicolisi viene interrotta aggiungendo 2DG, che inibisce l'esochinasi, il primo enzima della glicolisi23. Qualsiasi ECAR residuo è probabilmente dovuto ad altre fonti di acidificazione, come la produzione di CO2 da parte del ciclo TCA durante OXPHOS, ed è indicato come ECAR non glicolitico. La riserva glicolitica è calcolata come la differenza tra l'ECAR "più alto" e l'ECAR in presenza di glucosio. La capacità glicolitica è la somma della glicolisi e della riserva glicolitica.
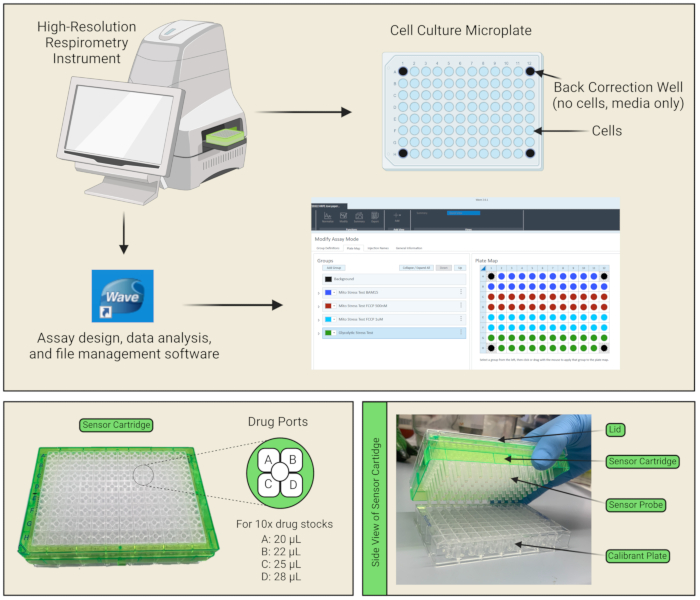
Figura 1: Componenti della piastra e della cartuccia del sensore . (A) Vengono visualizzati lo strumento, il software di analisi dei dati e l'interfaccia di configurazione del protocollo. Nel layout della piastra di coltura a 96 pozzetti, le celle sono placcate nei pozzetti di colore blu e i quattro pozzetti angolari sono contrassegnati in nero, poiché fungono da pozzetti di correzione posteriore che contengono solo supporti (e nessuna cella). (B) Ci sono quattro porte per ogni pozzetto della cartuccia del sensore in cui i farmaci A, B, C e D possono essere caricati. I volumi da pipettare in ciascuna porta sono elencati in base ai calcoli per 10 preparazioni di stock di farmaci. (C) La cartuccia del sensore è costituita da sonde sensore che vengono posizionate direttamente nella piastra di utilità riempita di calibrante. Fare clic qui per visualizzare una versione ingrandita di questa figura.
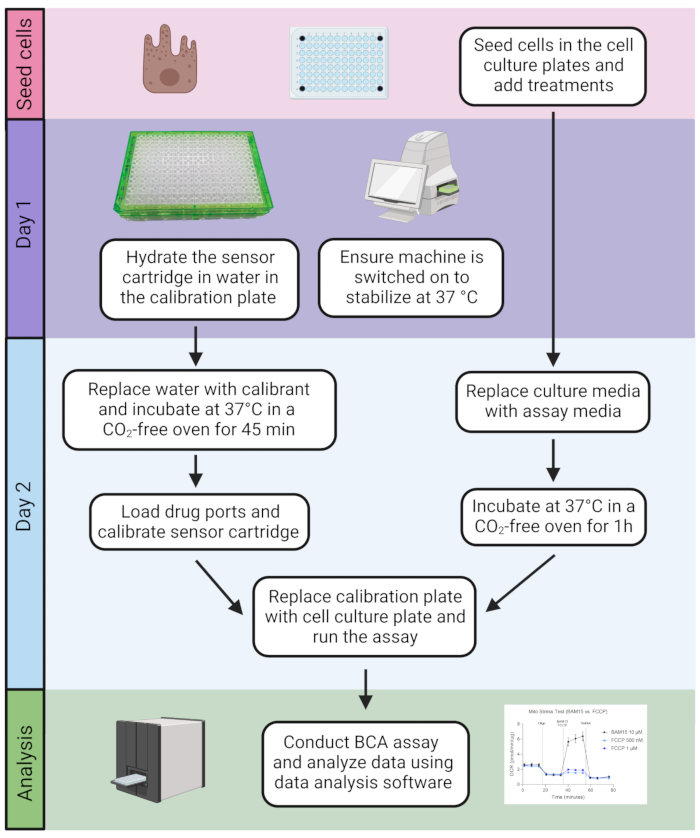
Figura 2: Cronologia del test. Le cellule sono seminate nella piastra di coltura cellulare. Una volta pronto, il test prevede una procedura di 2 giorni seguita dalla quantificazione del contenuto proteico utilizzando il test BCA e successiva analisi dei dati. Fare clic qui per visualizzare una versione ingrandita di questa figura.
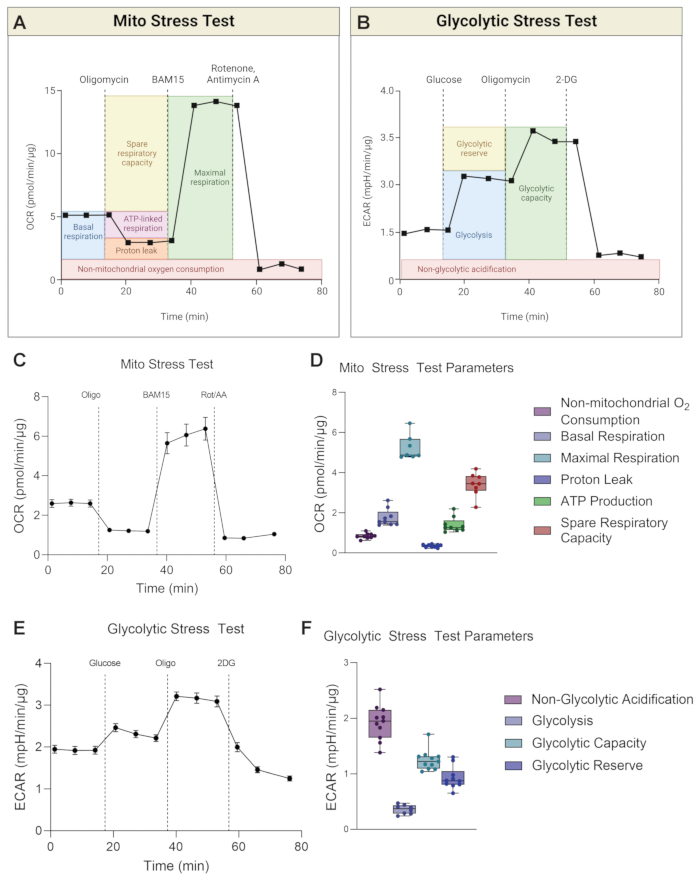
Figura 3: Grafici rappresentativi dello Stress Test Mito e dello Stress Test glicolitico. I calcoli dei parametri (A) Mito Stress Test e (B) Glycolytic Stress Test sono illustrati nello schema. (C) Vengono mostrati la curva rappresentativa del consumo di ossigeno (OCR) e (D) i parametri della prova di stress Mito per H-RPE. (E) Sono mostrati la curva rappresentativa del tasso di acidificazione extracellulare (ECAR) e (F) i parametri della prova da sforzo glicolitica per H-RPE. Le barre di errore sono mezzi ± SEM. Fare clic qui per visualizzare una versione ingrandita di questa figura.
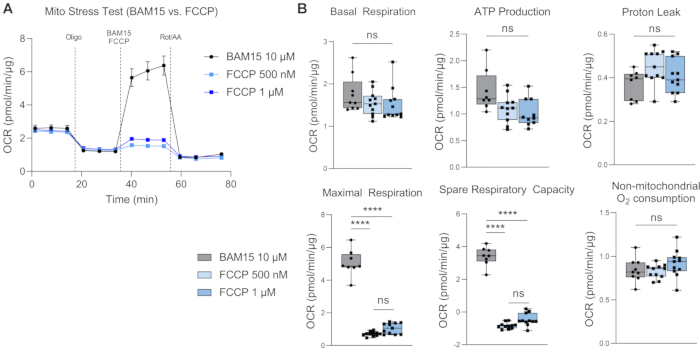
Figura 4: Confronto tra BAM15 e FCCP come agente disaccoppiante. Mito Stress Test su H-RPE confrontando l'efficacia di indurre la respirazione massima utilizzando 10 μM BAM15, 500 nM FCCP o 1 μM FCCP, mostrando la curva (A) del tasso di consumo di ossigeno (OCR) e (B) i parametri dello Stress Test Mito. Le barre di errore sono mezzi ± SEM. **** p ≤ 0,0001; ns, non significativo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Test | Glucosio (mM) | GlutaMax (mM) | Sodio piruvato (mM) | HEPES (mM) |
| Test di Mito | 25 | 2 | 1 | 1 |
| Test da sforzo glicolitico | Nessuno | 0.5 | Nessuno | 1 |
Tabella 1: Concentrazione di integratori aggiunti ai mezzi di analisi per le prove di Mito e Glicolitico da Sforzo.
| Test | Porta A | Porta B | Porta C |
| Test di Mito | Oligomicina 2,5 μM | FCCP 500 nM O BAM15 10 μM | Rotenone 2 μM E Antimicina A 2 μM |
| Test da sforzo glicolitico | Glucosio 10 mM | Oligomicina 2 μM | 2-Deossiglucosio 50 mM |
Tabella 2: Concentrazioni di iniezioni di farmaci per le prove Mito e glicolitiche. È importante notare che queste sono le concentrazioni finali a cui le cellule sono esposte dopo l'iniezione dei farmaci in ciascun pozzetto. I farmaci devono essere preparati 10 volte più forti quando si caricano le porte del farmaco.
| Termine | Definizione | |||
| Calibrante | Il calibrante è una soluzione utilizzata per calibrare la cartuccia del sensore. La sua formulazione è proprietaria e ha una composizione simile a PBS. | |||
| Cartuccia sensore | La cartuccia del sensore contiene due fluorofori incorporati nel manicotto della cartuccia del sensore che sono collegati a fasci di fibre ottiche che emettono luce, eccitando i fluorofori. Un fluoroforo misura il flusso di ossigeno e l'altro misura il flusso di protoni. Ogni cartuccia sensore è inoltre dotata di 4 porte per consentire la somministrazione sequenziale di un massimo di 4 composti per pozzetto durante il test. | |||
| Piastra di utilità | La piastra di utilità (nota anche come piastra di calibrazione) viene utilizzata per calibrare i sensori. La soluzione Calibrant viene inserita nella piastra di utilità. | |||
| Test di Mito | Lo Stress Test Mito è il nome del test che fornisce il profilo bioenergetico della respirazione mitocondriale tracciando i cambiamenti nell'OCR nel tempo. | |||
| Test da sforzo glicolitico | Lo Stress Test glicolitico è il nome del saggio che fornisce il profilo bioenergetico glicolitico tracciando i cambiamenti nell'ECAR nel tempo. | |||
| Tasso di consumo di ossigeno (OCR) | Il tasso di consumo di ossigeno è una misura del flusso di ossigeno (pmol / min) e indica lo stato metabolico mitocondriale. | |||
| Tasso di acidificazione extracellulare (ECAR) | Il tasso di acidificazione extracellulare è una misura dell'efflusso di protoni (mpH/min) e indica lo stato metabolico glicolitico. | |||
| Wave Software | Il software Wave viene utilizzato per la programmazione del test e la successiva analisi dei dati | |||
| Consumo di ossigeno non mitocondriale | Misurazione della velocità minima dopo iniezione di Rotenone/antimicina A | |||
| Respirazione basale | (Ultima misurazione della velocità prima della prima iniezione) – (Frequenza respiratoria non mitocondriale) | |||
| Respirazione massima | (Misurazione della velocità massima dopo iniezione FCCP) – (Respirazione non mitocondriale) | |||
| Perdita H + (protone) | (Misurazione della velocità minima dopo iniezione di oligomicina) – (Respirazione non mitocondriale | |||
| Produzione ATP | (Ultima misurazione della velocità prima dell'iniezione di oligomicina) – (Misurazione della velocità minima dopo l'iniezione di oligomicina) | |||
| Capacità respiratoria di riserva | (Respirazione massima) – (Respirazione basale) | |||
| Capacità respiratoria di riserva in % | (Respirazione massima) / (Respirazione basale) × 100 | |||
| Efficienza di accoppiamento | Tasso di produzione di ATP) / (Frequenza respiratoria basale) × 100 | |||
| Glicolisi | (Misurazione della velocità massima prima dell'iniezione di oligomicina) – (Ultima misurazione della velocità prima dell'iniezione di glucosio) | |||
| Capacità glicolitica | (Misurazione della velocità massima dopo l'iniezione di oligomicina) – (Ultima misurazione della velocità prima dell'iniezione di glucosio) | |||
| Riserva glicolitica | (Capacità glicolitica) – (glicolisi) | |||
| Riserva glicolitica in % | (tasso di capacità glicolitica) /(glicolisi) × 100 | |||
| Acidificazione non glicolitica | Ultima misurazione della velocità prima dell'iniezione di glucosio | |||
Tabella 3: Elenco delle definizioni dei componenti chiave del saggio.
Discussione
Questo protocollo ottimizzato per la respirometria ad alta risoluzione di H-RPE prevede l'uso di BAM15 come disaccoppiatore al posto del FCCP comunemente usato. Mentre studi precedenti sulla respirometria ad alta risoluzione di RPE utilizzavano FCCP 9,24, BAM15 sembra indurre un'induzione più robusta dei livelli respiratori massimi in H-RPE rispetto a FCCP. Mentre sia FCCP che BAM15 sono sicuri da usare nelle cellule, BAM15 è segnalato per avere meno effetti collaterali nelle cellule normali rispetto a FCCP o carbonilcianuro-3-clorofenilidrazone (CCCP) 25. Kenwood et al. hanno dimostrato che BAM15 depolarizza i mitocondri senza influire sul potenziale della membrana plasmatica, inducendo così un tasso di respirazione mitocondriale massimo sostenuto a bassa citotossicità26. FCCP, d'altra parte, depolarizza sia i mitocondri che la membrana plasmatica e mostra una maggiore citotossicità26.
Ci sono diversi passaggi critici nel protocollo, tra cui garantire che le cellule siano correttamente placcate in un monostrato confluente, uniforme e omogeneo di RPE in tutti i pozzetti sperimentali della micropiastra. Gli RPE maturi dipendono fortemente da OXPHOS per la generazione di energia e quindi le cellule dovrebbero essere lasciate maturare per almeno 1 mese per garantire che l'RPE generi letture OCR basali e massime corrette durante il test. Il degasaggio della piastra di coltura cellulare per 1 ora a 37 °C in un forno umidificato (senza CO 2) prima di immetterlo nello strumento è fondamentale per letture ECAR accurate, poiché la CO2 può influire sul pH del mezzo di analisi. È importante ricordarsi di idratare la cartuccia del sensore il giorno prima del test per assicurarsi che fornisca letture OCR ed ECAR affidabili il giorno del test. Si deve prestare attenzione a ricostituire correttamente i farmaci da iniettare e ad aliquotare le scorte di farmaco ricostituite in volumi più piccoli per la conservazione a lungo termine per ridurre al minimo i cicli di congelamento/disgelo. È fondamentale preparare 10 soluzioni farmacologiche diluite nei rispettivi mezzi di analisi (ad esempio, diluite nei mezzi di analisi Mito Stress Test per lo stress test Mito) per tenere conto della diluizione dall'iniezione del farmaco in ciascun pozzetto riempito con mezzi di analisi. Con ogni successiva iniezione di farmaco c'è più terreno in ogni pozzetto, e quindi i volumi di farmaco caricati aumentano con ogni iniezione, e si deve fare attenzione a seguire i volumi specificati nel protocollo. È importante eseguire controlli di qualità al termine dell'esperimento esaminando la cartuccia del sensore per assicurarsi che nessun residuo di farmaco sia evidente e osservando la piastra di coltura cellulare al microscopio per garantire che il monostrato cellulare confluente e omogeneo rimanga.
Le modifiche a questo protocollo includono l'iniezione di diversi farmaci nelle porte e la determinazione di come questi farmaci influiscono sulle letture OCR ed ECAR. Una modifica popolare è quella di iniettare un farmaco sperimentale di scelta come Port A prima di iniettare i soliti farmaci Mito o Glycolytic Stress Test. Questo tipo di protocollo fornisce informazioni su come un'iniezione acuta del farmaco di scelta influisce sui successivi parametri OXPHOS e glicolitici. Altre modifiche includono l'esame di diversi tipi di cellule; ciò richiede la risoluzione iniziale della densità ottimale delle cellule di semina e l'ottimizzazione del mezzo di analisi assicurando che le letture basali vadano da 50-100 pmol/min per OCR e 10-20 mpH/min per ECAR. Le concentrazioni ottimali dei farmaci iniettati devono essere determinate per ogni nuovo tipo di cellula esaminata osservando le risposte OCR ed ECAR a una diluizione seriale dei farmaci.
Una limitazione chiave del protocollo è che la vitalità cellulare diminuisce nel tempo, poiché le cellule non sono in un incubatore di CO2 nei loro normali mezzi di crescita, e quindi il test dovrebbe essere completato entro 3-4 ore per garantire la massima vitalità cellulare. Inoltre, l'esposizione alle tossine mitocondriali iniettate in ciascun pozzetto può ridurre ulteriormente la vitalità cellulare nel tempo. Una volta completato il test, le cellule devono essere lisate per la valutazione del contenuto proteico per normalizzare le letture OCR ed ECAR, e quindi le stesse cellule non possono essere raccolte per i successivi saggi di biologia molecolare.
Alternative al cavalluccio marino per la profilazione bioenergetica includono l'Oroboros Oxygraph 2k (O2k)27, BaroFuse28,29 e Resipher (Lucid Scientific)7. L'Oroboros O2k è un respirometro chiuso a due camere che utilizza elettrodi polarografici di ossigeno di tipo S1 Clark. Mentre Oroboros O2k produce misurazioni altamente sensibili del flusso metabolico in tempo reale, il dispositivo è laborioso in quanto l'operatore è tenuto a iniettare manualmente ogni farmaco30. BaroFuse è un nuovo sistema di perfusione microfluidica multicanale che utilizza la pressione del gas per consentire più esperimenti di perfusione parallela ed è collegato a un sistema di rilevamento dell'ossigeno per misurare l'OCR. Il vantaggio di questo sistema di coltura a flusso è che la funzione e la vitalità dei tessuti vengono mantenute, al contrario del cavalluccio marino in cui la vitalità cellulare diminuisce su saggi più lunghi. Il Resipher utilizza sensori ottici di ossigeno altamente sensibili per misurare l'OCR mentre le celle si trovano in una piastra da 96 pozzetti nell'incubatore, consentendo così misurazioni OCR continue per diverse settimane o mesi. In particolare, questi strumenti non misurano l'ECAR, e quindi il cavalluccio marino ha il vantaggio di esplorare simultaneamente sia OXPHOS che di glicolisi.
L'interrogazione in tempo reale dei profili bioenergetici di OXPHOS e glicolisi sta emergendo come un fattore chiave nella caratterizzazione della salute e della funzione dell'RPE. La respirometria ad alta risoluzione consente un mezzo efficiente per confrontare lo stato metabolico dell'RPE normale e malato, aprendo così nuove strade per l'efficacia dei farmaci di screening per le malattie retiniche come AMD e PVR. Le direzioni future per la respirometria ad alta risoluzione su RPE includono l'ottimizzazione di un protocollo per esaminare i profili bioenergetici per monostrati RPE altamente polarizzati coltivati su filtri transwell. Calton et al. (2016) hanno raggiunto con successo questo obiettivo tagliando una sezione triangolare del monostrato RPE polarizzato coltivato su filtri transwell31. Un'ulteriore espansione della metodologia include l'esame dei profili bioenergetici di RPE derivata da cellule staminali pluripotenti indotte (iPSC-RPE), isolate da pazienti con diverse condizioni degenerative retiniche32. L'esplorazione di come le citochine patogene coinvolte nell'AMD e nel PVR influenzano la natura dinamica del metabolismo RPE può rivelare vulnerabilità metaboliche che possono informare l'identificazione di nuovi bersagli farmacologici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato sostenuto in parte da sovvenzioni da: la Fight for Sight Leonard & Robert Weintraub Postdoctoral Fellowship (D.Y.S.); Programma di borse di studio post-dottorato della Fondazione BrightFocus nella ricerca sulla degenerazione maculare (M2021010F, D.Y.S.); Dipartimento della Difesa, Spinal Vision Research Program con il premio n. VR180132 (M.S.-G. e L.A.K.); National Eye Institute of the National Institutes of Health con il premio n. R01EY027739 (L.A.K.). Un riconoscimento viene fatto ai donatori del Macular Degeneration Research M2021010F, un programma della BrightFocus Foundation, per il sostegno di questa ricerca. Gli schemi sono stati creati con Biorender.com
Materiali
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose | Sigma | D8375-5G | Reconstituted in the Glycolytic Assay Media from its powder form and used in the Glycolytic Stress Test (Port C injection) |
| 96 Well Non-Treated Plate, 5/Pack, Sterile | VWR | 229597 | BCA Assay 96-well plate |
| Antimycin A from Streptomyces sp. | Sigma | A8674-25MG | Inhibitor of Complex III of the electron transport chain (part of the Port C drug injection together with rotenone) |
| BAM15 | Sigma | SML1760-5MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| BCA Assay | ThermoFisher | 23225 | To determine total protein content in each well |
| Calibrant Solution | Seahorse Bioscience | 100840-000 | Solution used to calibrate the probes of the sensor cartridge |
| Cell Lysis buffer 10x | Cell Signaling Technologies | 9803S | Dilute 10x Cell Lysis Buffer to a 1x solution using deionized water and add 1 mM PMSF before use |
| D-(+)-Glucose solution | Sigma | G8644-100ML | Supplement to be added to the Mito Stress Test assay media and also used in the Glycolytic Stress Test (Port A injection) |
| DMSO, Cell culture grade | Sigma-aldrich | D4540-100ML | For reconstituting all mitochondrial drugs except for 2DG |
| FCCP | Sigma | C2920-10MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| GlutaMAX | Gibco | 35050061 | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| HEPES solution | Sigma | H0887-100ML | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| H-RPE – Human Retinal Pigment Epithelial Cells | Lonza | 194987 | Primary human fetal RPE cells |
| Oligomycin - CAS 1404-19-9 - Calbiochem | Sigma | 495455-10MG | ATP synthase inhibitor used for the Mito Stress Test (Port A injection) and Glycolytic Stress Test (Port B injection) |
| Parafilm | Bemis | PM996 | To seal the plate once the cells are lysed to prevent evaporation in the freezer |
| Phenylmethylsulfonyl fluoride (PMSF) Protease Inhibitor | Gold Biotechnology Inc | 50-153-2823 | Used at 1 mM for the 1x Cell Lysis Buffer solution |
| ReagentPack Subculture Reagents, 100 mL | Lonza | CC-5034 | Passaging reagents for primary human fetal RPE cells. Each kit contains 100 mL Trypsin/EDTA, Trypsin Neutralizing Solution, HEPES Buffered Saline |
| Rotenone | Sigma | R8875-1G | Inhibitor of Complex I of the electron transport chain (part of the Port C drug injection together with antimycin A) |
| RtEGM Retinal Pigment Epithelial Cell Growth Medium BulletKit - RtEBMTM Basal Medium (00195406) and RtEGMTM SingleQuots Supplements (00195407) | Lonza | 195409 | Media for primary human fetal RPE cells |
| Seahorse XFe96 Analyzer | Agilent | High-Resolution Respirometry Instrument | |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | This contains the 96-well Seahorse Cell Culture Microplate, the sensor cartridge and the calibrant solution |
| Sodium pyruvate solution | Sigma | S8636-100ML | Supplement to be added to the Mito Stress Test assay media |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 50 mL process volume, 0.22 µm pore size | Millipore-Sigma | SCGP00525 | Tube top filter unit for sterile filtration of the assay media |
| Synergy H1 Plate Reader | BioTek | Plate Reader for measuring absorbance at 562 nm for the BCA assay | |
| XF base medium without phenol red | Agilent | 103335-100 | Base media for running the Seahorse assay |
Riferimenti
- He, Y., et al. Mitochondria impairment correlates with increased sensitivity of aging RPE cells to oxidative stress. Journal of Ocular Biology Diseases and Informatics. 3 (3), 92-108 (2010).
- Shu, D. Y., Butcher, E., Saint-Geniez, M. EMT and EndMT: Emerging roles in age-related macular degeneration. International Journal of Molecular Sciences. 21 (12), 4271(2020).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the Seahorse XF analyzer or a Clark-type oxygen electrode. Current Protocols in Toxicology. 60, 2-16 (2014).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio Protocol. 8 (10), 2850(2018).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Shu, D. Y., Butcher, E. R., Saint-Geniez, M. Suppression of PGC-1α drives metabolic dysfunction in TGFbeta2-induced EMT of retinal pigment epithelial cells. International Journal of Molecular Sciences. 22 (9), 4701(2021).
- Shu, D. Y., et al. Dimethyl fumarate blocks tumor necrosis factor-alpha-driven inflammation and metabolic rewiring in the retinal pigment epithelium. Frontiers in Molecular Neuroscience. 15, 896786(2022).
- Satish, S., Philipose, H., Rosales, M. A. B., Saint-Geniez, M. Pharmaceutical induction of PGC-1α promotes retinal pigment epithelial cell metabolism and protects against oxidative damage. Oxidative Medicine and Cellular Longevity. 2018, 9248640(2018).
- Ferrington, D. A., et al. Altered bioenergetics and enhanced resistance to oxidative stress in human retinal pigment epithelial cells from donors with age-related macular degeneration. Redox Biology. 13, 255-265 (2017).
- Cai, H., et al. High-throughput screening identifies compounds that protect RPE cells from physiological stressors present in AMD. Experimental Eye Research. 185, 107641(2019).
- Kurihara, T., et al. Hypoxia-induced metabolic stress in retinal pigment epithelial cells is sufficient to induce photoreceptor degeneration. Elife. 5, 14319(2016).
- Ishii, M., Beeson, G., Beeson, C., Rohrer, B. Mitochondrial C3a receptor activation in oxidatively stressed epithelial cells reduces mitochondrial respiration and metabolism. Frontiers in Immunology. 12, 628062(2021).
- Rosales, M. A. B., Shu, D. Y., Iacovelli, J., Saint-Geniez, M. Loss of PGC-1α in RPE induces mesenchymal transition and promotes retinal degeneration. Life Science Alliance. 2 (3), 201800212(2019).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Huang, T., Long, M., Huo, B. Competitive binding to cuprous ions of protein and BCA in the bicinchoninic acid protein assay. Open Biomedical Engineering Journal. 4, 271-278 (2010).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245(2021).
- Symersky, J., Osowski, D., Walters, D. E., Mueller, D. M. Oligomycin frames a common drug-binding site in the ATP synthase. Proceedings of the National Academy of Sciences. 109 (35), 13961-13965 (2012).
- Divakaruni, A. S., Brand, M. D. The regulation and physiology of mitochondrial proton leak. Physiology. 26 (3), 192-205 (2011).
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: A key controller of biological processes in physiology and diseases. Cells. 8 (8), 795(2019).
- Herst, P. M., Tan, A. S., Scarlett, D. J., Berridge, M. V. Cell surface oxygen consumption by mitochondrial gene knockout cells. Biochimica Biophysica Acta. 1656 (2-3), 79-87 (2004).
- Pike Winer, L. S., Wu, M. Rapid analysis of glycolytic and oxidative substrate flux of cancer cells in a microplate. PLoS One. 9 (10), 109916(2014).
- Laussel, C., Leon, S. Cellular toxicity of the metabolic inhibitor 2-deoxyglucose and associated resistance mechanisms. Biochemical Pharmacology. 182, 114213(2020).
- Miyagishima, K. J., et al. AMPK modulation ameliorates dominant disease phenotypes of CTRP5 variant in retinal degeneration. Communications Biology. 4 (1), 1360(2021).
- Gao, Z. X., et al. The new mitochondrial uncoupler BAM15 induces ROS production for treatment of acute myeloid leukemia. Biochemical Pharmacology. 198, 114948(2022).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Rountree, A., et al. Barofuse a novel pressure-driven, adjustable-throughput perfusion system for tissue maintenance and assessment. Heliyon. 2 (12), 00210(2016).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, 66716(2021).
- Mas-Bargues, C., Garcia-Dominguez, E., Borras, C. Recent approaches to determine static and dynamic redox state-related parameters. Antioxidants. 11 (5), 864(2022).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Chichagova, V., et al. Human iPSC disease modelling reveals functional and structural defects in retinal pigment epithelial cells harbouring the m.3243A > G mitochondrial DNA mutation. Scientific Reports. 7 (1), 12320(2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon