Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein technischer Leitfaden für die Durchführung spektroskopischer Messungen an metallorganischen Gerüstverbindungen
In diesem Artikel
Zusammenfassung
Hier verwenden wir einen Polymerstabilisator, um metallorganische Gerüstsuspensionen (MOF) herzustellen, die eine deutlich verringerte Streuung in ihren Grundzustands- und transienten Absorptionsspektren aufweisen. Mit diesen MOF-Suspensionen bietet das Protokoll verschiedene Richtlinien zur spektroskopischen Charakterisierung der MOFs, um interpretierbare Daten zu erhalten.
Zusammenfassung
Metallorganische Gerüstverbindungen (MOFs) bieten aufgrund ihrer hohen strukturellen Einstellbarkeit eine einzigartige Plattform, um lichtgetriebene Prozesse in Festkörpermaterialien zu verstehen. Die Weiterentwicklung der MOF-basierten Photochemie wurde jedoch durch die Schwierigkeit der spektralen Charakterisierung dieser Materialien behindert. Da MOFs in der Regel größer als 100 nm sind, sind sie anfällig für übermäßige Lichtstreuung, wodurch Daten aus wertvollen Analysewerkzeugen wie transienter Absorptions- und Emissionsspektroskopie nahezu uninterpretierbar sind. Um aussagekräftige Einblicke in MOF-basierte photochemische und physikalische Prozesse zu erhalten, muss die ordnungsgemäße Vorbereitung von MOFs für spektroskopische Messungen sowie die Versuchsaufbauten, die qualitativ hochwertigere Daten liefern, besonders berücksichtigt werden. Unter Berücksichtigung dieser Überlegungen bietet der vorliegende Leitfaden einen allgemeinen Ansatz und eine Reihe von Richtlinien für die spektroskopische Untersuchung von MOFs. Der Leitfaden befasst sich mit den folgenden Schlüsselthemen: (1) Probenvorbereitungsmethoden, (2) spektroskopische Techniken/Messungen mit MOFs, (3) Versuchsaufbauten, (3) Kontrollexperimente und (4) Charakterisierung der Stabilität nach dem Lauf. Mit geeigneter Probenvorbereitung und experimentellen Ansätzen sind bahnbrechende Fortschritte in Richtung eines grundlegenden Verständnisses der Licht-MOF-Wechselwirkungen deutlich besser erreichbar.
Einleitung
Metallorganische Gerüstverbindungen (MOFs) bestehen aus Metalloxidknoten, die durch organische Moleküle miteinander verbunden sind und hierarchische poröse Strukturen bilden, wenn ihre Bestandteile unter solvothermalen Bedingungen miteinander reagieren1. Dauerhaft poröse MOFs wurden erstmals in den frühen 2000er Jahren gemeldet, und seitdem hat sich das aufkeimende Feld auf ein breites Anwendungsspektrum ausgeweitet, da ihre Strukturkomponenten einzigartig einstellbar sind 2,3,4,5,6,7. Während des Wachstums des Bereichs der MOFs gab es eine Handvoll Forscher, die photoaktive Materialien in die Knoten, Liganden und Poren von MOFs eingebaut haben, um ihr Potenzial in lichtgetriebenen Prozessen wie der Photokatalyse 8,9,10,11, der Aufwärtskonversion12,13,14,15,16 und der Photoelektrochemie 17 zu nutzen ,18. Eine Handvoll der lichtgetriebenen Prozesse von MOFs dreht sich um den Energie- und Elektronentransfer zwischen Donoren und Akzeptoren 17,19,20,21,22,23,24,25. Die beiden gebräuchlichsten Techniken zur Untersuchung des Energie- und Elektronentransfers in molekularen Systemen sind die Emissions- und transiente Absorptionsspektroskopie26,27.
Ein großer Teil der Forschung zu MOFs hat sich auf die Emissionscharakterisierung konzentriert, da die Vorbereitung von Proben, die Durchführung von Messungen und die (relativ) einfache Analyse relativ einfach sind 19,22,23,24,28. Die Energieübertragung manifestiert sich typischerweise als Verlust der Emissionsintensität und -lebensdauer des Donors und als Zunahme der Emissionsintensität des Akzeptors, der in den MOF-Rückgrat geladenwird 19, 23, 28. Der Nachweis eines Ladungstransfers in einem MOF manifestiert sich in einer Abnahme der Emissionsquantenausbeute und der Lebensdauer des Chromophors im MOF29,30. Während die Emissionsspektroskopie ein leistungsfähiges Werkzeug bei der Analyse von MOFs ist, behandelt sie nur einen Teil der notwendigen Informationen, um ein vollständiges mechanistisches Verständnis der MOF-Photochemie zu vermitteln. Die transiente Absorptionsspektroskopie kann nicht nur die Existenz von Energie- und Ladungstransfer unterstützen, sondern auch spektrale Signaturen erkennen, die mit dem Verhalten des nicht-emittierenden Singulett- und Triplett-angeregten Zustands verbunden sind, was sie zu einem der vielseitigsten Werkzeuge zur Charakterisierung macht31,32,33.
Der Hauptgrund, warum robustere Charakterisierungstechniken wie die transiente Absorptionsspektroskopie selten auf MOFs angewendet werden, liegt in der Schwierigkeit, Proben mit minimaler Streuung zu präparieren, insbesondere mit Suspensionen34. In den wenigen Studien, in denen die transiente Absorption an MOFs erfolgreich durchgeführt wurde, sind die MOFs mit einigen Ausnahmen <500 nm groß, was die Bedeutung der Reduzierung der Partikelgröße zur Minimierung der Streuungunterstreicht 15,21,25,35,36,37. Andere Studien verwenden MOF-Dünnschichten17 oder SURMOFs38,39,40, um das Streuproblem zu umgehen; Unter dem Gesichtspunkt der Anwendbarkeit ist ihre Verwendung jedoch recht begrenzt. Darüber hinaus haben sich einige Forschungsgruppen mit der Herstellung von Polymerfilmen von MOFs mit Nafion oder Polystyrol34 beschäftigt, wobei erstere angesichts der stark sauren Sulfonatgruppen auf Nafion einige Bedenken hinsichtlich der Stabilität aufwerfen. Inspiriert von der Herstellung kolloidaler Halbleitersuspensionen 41,42 haben wir große Erfolge bei der Verwendung von Polymeren zur Unterstützung der Suspendierung und Stabilisierung von MOF-Partikeln für spektroskopische Messungenerzielt 11. In dieser Arbeit etablieren wir allgemein anwendbare Richtlinien, die bei der Herstellung von MOF-Suspensionen und deren Charakterisierung mit Emissions-, Nanosekunden- (ns) und ultraschnellen (uf) transienten Absorptionsspektroskopietechniken (TA) zu befolgen sind.
Protokoll
1. Herstellung von MOF-Suspensionen mit einem Polymerstabilisator
- 50 mg Bis-Amino-terminiertes Polyethylenglykol (PNH2, Mn ~1.500) werden abgewogen (siehe Materialtabelle) und in eine Durchstechflasche mit einem Dram (Materialtabelle) überführt. Wiegen Sie 1-5 mg PCN-222(fb) ab (siehe synthetisches Protokoll11) und geben Sie es in dieselbe Durchstechflasche mit PNH2.
HINWEIS: Um die bestmöglichen MOF-Suspensionen zu erhalten, müssen die synthetischen Bedingungen, die zur Herstellung der MOF-Partikelgrößen erforderlich sind, bei oder unter 1 μm liegen. - Suchen Sie ein geeignetes Lösungsmittel (wenn nicht Wasser, verwenden Sie ein wasserfreies Lösungsmittel wie Dimethylformamid [DMF] oder Acetonitril [ACN]; siehe Materialtabelle), um das MOF zu suspendieren, und stellen Sie sicher, dass das Lösungsmittelfenster breit genug ist, damit das Lösungsmittel selbst nicht mit der Wellenlänge der Wahl angeregt wird. Übertragen Sie 1-3 ml Lösungsmittel mit einer Autopipette mit einer geeigneten Pipettenspitze in die Durchstechflasche.
HINWEIS: Die oben genannten häufig verwendeten Lösungsmittel haben ein breites Lösungsmittelfenster - CH3CN: 200 nm Hochenergie-Cut-off; und DMF: 270 nm Cut-off. Lösungsmittel mit höheren Brechungsindizes (1,4-1,5), wie DMF, DMSO und Toluol, können verwendet werden, um die Lichtstreuung zu minimieren, indem sie näher am Brechungsindex von Quarzglas (ca. 1,46-1,55) ausgerichtet sind, wodurch die Beugung des Lichts in unerwünschte Richtungen beim Durchgang durch die Küvette minimiert wird. - Beschallen Sie den Inhalt der Durchstechflasche mit einem Ultraschallgerät (siehe Materialtabelle) 2-5 Minuten lang bei einer Amplitude von 20 % bis 30 % (d. h. dem Abstand, in dem sich die Ultraschallspitze in Längsrichtung bewegt, typischerweise ~60 μm für eine Sonde mit 3 mm Durchmesser bei 30 % Amplitude) mit Intervallen von 2 s ein und 2 s aus. Dieses Verfahren dient dazu, MOF-Aggregate aufzubrechen und MOF-Partikel mit Polymer zu beschichten. Stellen Sie sicher, dass die MOF-Suspension am Ende des Beschallungsprozesses gut dispergiert und homogen ist.
HINWEIS: Die Beschallungszeiten variieren je nachdem, wie gut sich das MOF von Natur aus dispergiert. - Öffnen Sie eine frische 10-ml-Kunststoffspritze (Materialtabelle) und ziehen Sie die Suspension in die Spritze ein. Entfernen Sie die Spritzennadel und ersetzen Sie sie durch einen Polytetrafluorethylen (PTFE)-Gewebe 200 nm Spritzenvorsatzfilter (Materialtabelle). Führen Sie die Suspension durch den Spritzenvorsatzfilter in eine neue, saubere Durchstechflasche. Die resultierende Suspension ist bereit für transiente absorptionsspektroskopische Messungen.
HINWEIS: Angesichts der Tatsache, dass die durchschnittlichen Partikelgrößen einiger MOFs 200 nm überschreiten, liegt die Wahl der geeigneten Größe im Ermessen des Benutzers.
2. Herstellung von filtrierten MOF-Suspensionen für transiente Absorptionsmessungen im Nanosekundenbereich (nsTA)
- Mit der in Abschnitt 1 erhaltenen filtrierten MOF-Suspension muss das Absorptionsspektrum der Suspension ermittelt werden (Materialtabelle). Waschen Sie eine Küvette (1 cm Schichtdicke), die versiegeln und spülen kann (Materialtabelle), drei- bis fünfmal mit Lösungsmittel und füllen Sie sie dann mit 3 ml DMF.
- Wählen Sie mit einem Absorptionsspektralphotometer einen Wellenlängenbereich aus, um das Lösungsmittel und die Suspension zu messen. Messen Sie das leere ultraviolett-sichtbare (UV-Vis) Spektrum des Lösungsmittels in der Küvette und stellen Sie es als Hintergrundscan ein, der von den Probenscans subtrahiert werden soll. Entleeren Sie den Lösungsmittelinhalt der Küvette und übertragen Sie die MOF-Suspension in die Küvette.
HINWEIS: Das elektronische Absorptionsspektrum des PNH 2-Stabilisators (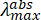 ~250 nm) hat einen schwachen Absorptionsschwanz, der bis 450 nm anhält, mit einer Absorption von ~0,01 bei 450 nm bei der Anfangskonzentration.
~250 nm) hat einen schwachen Absorptionsschwanz, der bis 450 nm anhält, mit einer Absorption von ~0,01 bei 450 nm bei der Anfangskonzentration. - Messen Sie das Absorptionsspektrum der anfänglichen MOF-Suspension unter Berücksichtigung der gewünschten Wellenlänge, die zur Anregung der MOF-Probe erforderlich ist. Wenn die MOF-Suspension bei der gewünschten Anregungswellenlänge eine Absorption oder optische Dichte (OD) >1 aufweist, wird sie mit Lösungsmittel verdünnt und das Absorptionsspektrum gemessen, bis das OD bei der Anregungswellenlänge ≤1 beträgt.
Anmerkungen: Wiederholen Sie bei transienten Absorptionsmessungen mit engem Winkel die Absorptionsmessungen, um einen geeigneten Außendurchmesser bei der Anregungswellenlänge mit einer 2-mm-Zelle zu erreichen (Materialtabelle). Für transiente Absorptionsmessungen von MOFs im Nanosekundenbereich ist eine Absorption oder OD von 0,1-1 bei der Anregungswellenlänge erforderlich, um dem Beerschen Gesetz zu folgen. Der erforderliche OD ist ein großer Bereich, da einige Proben in verschiedenen Regionen stark absorbieren. Ein perfektes Beispiel dafür sind Porphyrine. Porphyrine haben einen starken schmalen Soretbandenübergang zwischen 400-450 nm, während ihre Q-Band-Übergänge zwischen 500-800 nm recht schwach sind. Wenn man an einem ihrer Q-Banden anregen wollte, würde die Herstellung einer Lösung mit einem OD ~0,5 an einem der Q-Banden folglich eine Soretbandenabsorption >3 aufweisen, und der transiente Absorptionsdetektor wäre nicht in der Lage, die Änderungen in diesem Bereich quantitativ zu verarbeiten. Letztendlich liegt es im Ermessen des Anwenders, die geeignete Anregungswellenlänge und Absorptionsamplitude zu bestimmen, die quantitative Messungen im gewünschten Spektralfenster ermöglicht.
3. Spülen der MOF-Aufhängung
- Wenn die MOF-Suspension auf das gewünschte Absorptionsspektrum für TA-Messungen eingestellt ist, setzen Sie einen 2 mm x 8 mm großen Rührstab (Materialtabelle) in die Küvette ein und dichten Sie die Einlassküvettenfuge mit einem Gummiseptum ab.
- Nehmen Sie eine 1-ml-Kunststoffspritze (Materialtabelle), schneiden Sie die Hälfte davon mit einer Schere ab und bewahren Sie die Hälfte der Spritze auf, an der Nadeln befestigt werden können.
- Führen Sie mit einem Ende eines flexiblen Schlauchs, der an einem Ar- oder N2-Tank befestigt ist (Materialtabelle), die Spritzenhälfte mit dem Nadelende außen in das andere Ende des Schlauchs ein.
- Wickeln Sie den Stiel der freiliegenden Spritzenhälfte mit Parafilm (Table of Materials) ein, um eine Versiegelung mit dem Schlauch und der Spritze herzustellen. Wenn eine Schlauchschelle vorhanden ist, kann diese anstelle von Parafilm verwendet werden, um eine Abdichtung mit Spritze und Spülschlauch herzustellen.
- Befestigen Sie eine lange Spülnadel (3 Zoll, 25 G) (Materialtabelle) am Spritzenende und führen Sie die Nadel in die versiegelte Küvette in die Suspension ein. Nehmen Sie die Nadel aus der 1-ml-Spritze (Schritt 3.2) und führen Sie sie in die Küvette ein. Schalten Sie den Ar- oderN2-Durchfluss ein und spülen Sie die Suspension für 45 min-1 h.
HINWEIS: Eine Technik, die als "Doppelspülung" bekannt ist, wird häufig für Lösungsmittel mit einem Siedepunkt <100 °C verwendet. Um diese Technik anzuwenden, wird ein verschlossener Kolben mit Lösungsmittel mit der Einlassnadel gespült, wobei ein Ende einer Kanüle in den Kolbenkopfraum eingeführt und das andere Ende der Kanüle in die Küvettensuspension eingeführt wird. Die Auslassnadel wird in den Kopfraum der Küvette eingeführt. Durch diese Spülung wird der Lösungsmittelverlust durch Verdunstung im Laufe der Zeit minimiert. - Entfernen Sie nach Abschluss der Reinigung die Nadeln und wickeln Sie das Küvettenseptum mit vier bis fünf 2 in Parafilmscheiben ein (Materialtabelle). Messen Sie das Absorptionsspektrum der Probe, um sicherzustellen, dass es den in Abschnitt 2 festgelegten Standards entspricht. Die Probe ist nun bereit für transiente Absorptionsmessungen.
4. Senkrechter Pump-Probe-Nanosekunden-Aufbau für transiente Absorption (nsTA)
- Schalten Sie die Laser- und nsTA-Spektrometersysteme ein (Tabelle der Materialien; Abbildung 1). Stellen Sie die Ausgangsleistung des Lasers so niedrig ein, dass das Platzieren einer weißen Visitenkarte im Strahlengang eine klare Sichtbarkeit des Laserpunkts ermöglicht, aber nicht so hell, dass er blendet.
- Öffnen Sie sowohl den mechanischen Laserverschluss als auch den Sondenstrahlverschluss so, dass sie sich beide im Pfad des Probenhalters befinden.
- Stellen Sie die vertikale und horizontale Position des Laserstrahls (Abbildung 1, P3) so ein, dass er auf die Mitte des Probenzellenhalters (Abbildung 1, SC1) trifft, wo die Probe platziert wird. Verwenden Sie eine Visitenkarte, um die Position zu bestätigen. Platzieren Sie einen Neutraldichtefilter (ND) (OD 2; Tabelle der Materialien) im Pfad des Sondenstrahls.
HINWEIS: Alle Spiegel und Prismen, die in dem hier beschriebenen nsTA-System vorhanden sind, sind auf kinematischen Halterungen (Materialtabelle) montiert, und die Strahlpositionen werden durch manuelles Drehen der vertikalen und horizontalen Knöpfe an den Halterungen eingestellt. Eine längere, 1 cm breite weiße Karte kann über die Innenseite einer leeren Küvette in SC1 gelegt werden, um eine einfachere Ausrichtung zu ermöglichen. - Legen Sie eine geschnittene Visitenkarte (~1,5 cm Breite) in den Probenhalter (oder halten Sie sie in den Probenhalter) und winkeln Sie sie so über den Probenhalter ab, dass sowohl der Laserstrahl als auch der Probestrahl auf dieselbe Seite der Visitenkarte treffen. Passen Sie die vertikale Position des Laserstrahls (P3) an, um die beste Überlappung mit dem intensivsten Teil des Sondenstrahls zu erzielen.
- Schließen Sie die Verschlüsse, entfernen Sie den ND-Filter und legen Sie die Probe zusammen mit einem Magnetrührer in die Probenkammer (Materialtabelle). TA-Messungen können nun durchgeführt werden.
- Das System und die Software, die in dieser Arbeit verwendet werden, sind im Materialverzeichnis angegeben. In der Software-Suite gibt es Auswahlboxen mit den Titeln Spectral Absorption und Kinetic Absorption zur Messung von TA-Spektren bzw. Absorptionskinetik. Wählen Sie die Schaltfläche Spektrale Absorption und wählen Sie den Setup-Modus.
- Stellen Sie den Zeitnullpunkt des Laserpulses im Software-Setup-Fenster ein, indem Sie die Eingabezeit in Schritten von +0,010 μs einstellen (z. B. -0,020 μs, -0,010 μs, 0,000 μs, 0,010 μs usw.), bis der Laserpuls nicht mehr im Sondenstrahlspektrum beobachtet wird.
- Optimieren Sie bei eingestellter Zeit Null die Lichtmenge, die im Setup-Fenster auf den CCD-Detektor (Charge-Coupled Device) trifft, indem Sie die Bandbreite, die Verstärkung und die Gate-Breite so anpassen, dass eine ausreichend hohe Anzahl erreicht wird, um ein angemessenes Signal zu erhalten, ohne den Detektor zu sättigen.
HINWEIS: Wir überlassen diesen Prozess dem Benutzer, da die Detektoren von System zu System unterschiedlich sind. - Um ein TA-Spektrum zu erfassen, klicken Sie auf die Schaltfläche Mehrere auf der Registerkarte Spektrale Absorption . Stellen Sie sicher, dass die Einstellungen aus dem Setup-Fenster in diesem Fenster vorhanden sind. Wenn die Probe Licht emittiert, klicken Sie auf die Registerkarte Hintergründe und dann auf die Schaltfläche Fluoreszenzhintergrund subtrahieren . Legen Sie für einen oberflächlichen Scan die Durchschnittswerte auf 4 fest, um sicherzustellen, dass ein qualitativ hochwertiges anfängliches TA-Spektrum erhalten wird. Wenn ein zufriedenstellendes TA-Spektrum erhalten wird, erhalten Sie ein anderes mit mehr Mittelwerten.
- Um ein TA-Spektrum mit unterschiedlichen Zeitverzögerungen nach der Zeit Null abzubilden, wählen Sie die Schaltfläche Map auf der Registerkarte Spektrale Absorption . Stellen Sie sicher, dass sich die Setup-Parameter auf dieser Registerkarte nicht geändert haben. Geben Sie die gewünschten Zeitintervalle für das Mapping ein, klicken Sie auf Anwenden und dann auf Start , um die Spektren abzubilden.
- Um die Absorptionskinetik bei den gewünschten Wellenlängen zu erhalten, klicken Sie in der Software auf die Schaltfläche Kinetische Absorption und dann im Dropdown-Menü auf die Schaltfläche Setup . Geben Sie die gewünschte Wellenlänge auf der Registerkarte Controller im Setup-Fenster ein und stellen Sie die Bandbreite auf ein geeignetes Niveau ein. In der Regel ist eine Bandbreite von 1 nm ein guter Ausgangspunkt.
- Stellen Sie auf der Registerkarte Oszilloskop das Zeitfenster des Photomultiplier-Röhrendetektors (PMT) so ein, dass es lang genug ist, um die gesamte kinetische Kurve zu sehen, von der Zeit vor der Laseranregung bis zum vollständigen Abklingen des Signals bis zur Basislinie. Ein üblicher Ausgangspunkt ist ein 4.000-ns-Fenster. Stellen Sie den PMT-Spannungsbereich auf ein geeignetes Niveau ein, bei dem der gesamte TA-Verlauf auf der Signalachse beobachtbar ist. Ein Spannungsbereich von 160 mV ist sinnvoll, um mit den Messungen zu beginnen. Klicken Sie auf Anwenden und dann auf Start. Wenn das Signal zu niedrig oder das Zeitfenster zu kurz oder zu lang ist, klicken Sie auf Stopp und stellen Sie die Bandbreite und das Zeitfenster auf geeignete Werte ein, wobei Sie darauf achten, die Bandbreite nicht zu hoch einzustellen, um den Detektor zu sättigen/zu beschädigen.
- Wenn die kinetische Kurve richtig eingerichtet ist, schließen Sie das Setup-Fenster und öffnen Sie das Fenster Multiple aus dem Dropdown-Menü, nachdem Sie auf die Schaltfläche Kinetische Absorption geklickt haben. Stellen Sie sicher, dass die Parameter im Fenster "Setup" im Fenster "Mehrfach" identisch sind. Stellen Sie die gewünschte Anzahl von Messungen (Laseraufnahmen) ein. In der Regel sind 20 Messungen für Hochsignalbereiche des TA-Spektrums ausreichend. Wenn die Probe bei der Sondenwellenlänge emittiert, überprüfen Sie unbedingt die Schaltfläche Fluoreszenzhintergrund subtrahieren auf der Registerkarte Hintergründe. Klicken Sie auf Anwenden und dann auf Start, um die TA-Kinetik zu erfassen.
HINWEIS: Manchmal verschiebt eine höhere Anzahl von Aufnahmen (>40) die Grundlinie des Abklingens, positiv oder negativ, durch Sonden-/Laserstreuinterferenzen. Wenn dies ein Problem ist, führen Sie eine geringere Anzahl von Aufnahmen (~10-20) durch und wiederholen Sie die Messung mehrmals, um mehrere Datensätze zu sammeln, die dann zusammen gemittelt werden können. - Sobald die TA-Messungen abgeschlossen sind, messen Sie anschließend das Absorptionsspektrum des MOF, um eine minimale Degradation zu gewährleisten.
5. Engwinkel-nsTA-Setup
- Bei den senkrechten Pump-Probe-Aufbauten ist das von der MOF-Suspension erhaltene Signal manchmal recht schwach (<10 ΔmOD) und schwankt aufgrund des großen Probenvolumens, das angeregt wird, immer noch durch Streuung. Um die Signalschwankungen zu minimieren und das Signal zu verbessern, können ultraschnelle transiente Absorptionsaufbauten auf nsTA-Aufbauten mit einer engen Pump-Probe-Strahlausrichtung und kleineren Weglängen angewendet werden (Abbildung 2).
- Je nach Aufbau der Probenkammer kann man den Anregungsstrahl so fokussieren und ausrichten, dass sich die Pump- und Sondenstrahlen in einem Winkel von <45° kreuzen und somit mehr Überlappung bieten. Tun Sie dies mit Fokussieroptiken (Abbildung 2, konkave Linse [CCL] und konvexe Linse [CVL]) und kinematischen Spiegeln (Abbildung 2, MM1-3). Schalten Sie das Laser-/Spektrometersystem ein und wiederholen Sie die Schritte 4.2 und 4.3.
Anmerkungen: Während die Verwendung von konkaven/konvexen Linsen ideal für die Fokussierung von Optiken ist, kann anstelle dieser Komponenten eine optische Blende verwendet werden, um den Strahl zu verengen. Die Verengung des Strahls auf diese Weise kann durch eine Erhöhung der Leistung kompensiert werden; Bei der Arbeit mit Wellenlängen unter 400 nm kommt es jedoch häufig zu einer Verschlechterung und Ausbleichen der Iris. Einige TA-Spektrometer verfügen nicht über Steckplatinen, die eine Montage der Optik in der Probenkammer ermöglichen. Da das hier verwendete Spektrometer keine Steckplatinen hat, wurden in der Probenkammer Löcher gebohrt und mit Gewindebohrungen versehen, um die Optik einzurichten (Abbildung 2, MM1-3). Wenn das Spektrometer noch unter Garantie steht, wenden Sie sich an das Support-Team des Unternehmens, um zu erfahren, ob eine solche Einrichtung möglich ist. - Um die Größe des Strahlflecks zu verringern, der auf die 2-mm-Küvette trifft (Materialtabelle), stellen Sie ein Galilei-Teleskop mit einer konkaven Linse (Table of Materials, CCL1) auf, die zuerst auf den Laser trifft, und einer konvexen Linse (Table of Materials, CVL1), die dann auf den Laser trifft. Achten Sie darauf, dass der Abstand zwischen den beiden Objektiven ungefähr der Differenz zwischen den beiden Brennweiten der Objektive entspricht.
HINWEIS: Die bei diesen Messungen verwendeten Spectra-Physics Quantenstrahllaser haben eine Spotgröße von 1 cm. Die Spotgröße wurde mit dem Galileischen Teleskopaufbau halbiert. Für Laser, die Megawatt Leistung abgeben, müssen ausschließlich Galilei-Teleskope verwendet werden. Ein Kepler-Teleskop (zwei konvexe Linsen) bildet Plasma zwischen den beiden Linsen bei selbst bescheidenen Leistungen (~10 mW). - Öffnen Sie sowohl den Laser- als auch den Sondenverschluss. Ersetzen Sie den ersten Verschlussspiegel (SM1) durch SM2 und legen Sie eine Notizkarte so in die SM2-Klemmhalterung, dass sie vollständig zum Sondenstrahl ausgerichtet ist. Richten Sie dann eine Reihe von Mini-Spiegeln (MM1-3) ein, die ungefähr wie in Abbildung 2 dargestellt sind. Richten Sie den einfallenden Laserstrahl durch Einstellen der Drehknöpfe an der kinematischen P3-Halterung ungefähr auf die Mitte von MM1. Um die Ausdehnung des Laserstrahls von Spiegel zu Spiegel zu minimieren, platzieren Sie MM2 vor MM1, um den Reflexionswinkel zwischen den beiden Spiegeln zu verringern (Abbildung 2).
HINWEIS: Bei Laserausrichtungen ist es üblich, einen Spiegel/ein Prisma einen Spiegel von der beabsichtigten Punktposition entfernt einzustellen (z. B. P2 so einzustellen, dass MM1 genau getroffen wird). P2 in den hier diskutierten Experimenten ist jedoch eine stationäre strahlleitende Optik und sollte nicht justiert werden. Wenn die Flexibilität gegeben ist, sollte die Ausrichtung mit einer optischen Komponente erfolgen, die einen Spiegel von der Zieloptik entfernt ist. - Wenn der Strahl ungefähr in der Mitte von MM1 auftrifft, drehen Sie MM1 so, dass der reflektierte Laserstrahl in der Mitte auf MM2 trifft. Wenn der Strahl ungefähr in der Mitte von MM2 auftrifft, drehen Sie MM2 so, dass der reflektierte Laserstrahl in der Mitte auf MM3 trifft. Wenn der Strahl ungefähr in der Mitte von MM3 auftrifft, drehen Sie MM3 so, dass der reflektierte Laserstrahl an der gleichen Stelle wie der Sondenstrahl auf die Ausrichtungskarte trifft.
- Passen Sie die Positionen des Laserstrahls an jedem der Spiegel und der Notizkarte mit den vertikalen und horizontalen Knöpfen an den Spiegeln an. Stellen Sie sicher, dass der Strahl auf seinem gesamten Pfad wenig bis gar kein Clipping aufweist.
- Wiederholen Sie die Schritte 5.5 und 5.6 mit einer 2 mm Küvette mit 14/20 Innengelenk (SC2) und 14/20 Gummiseptum (Materialtabelle). Setzen Sie die Probe in eine Klemmprobenhalterung (SM2) ein, die vollständig dem Strahlengang der Sonde zugewandt ist. Passen Sie die Positionen des Laserstrahls an jedem Spiegel und SM2 mit den vertikalen und horizontalen Knöpfen an den Spiegeln an.
HINWEIS: Um den Wechsel zwischen senkrechten und engwinkligen TA-Setups zu erleichtern, kann anstelle einer normalen kinematischen Halterung eine umklappbare oder magnetische kinematische Spiegelhalterung für MM1 verwendet werden, um eine Neuausrichtung der Optik zu vermeiden. Die Platzierung von MM2 und MM3 sollte die einfallenden Pumpen- oder Sondenstrahlen im senkrechten Aufbau nicht beeinträchtigen. - Rühren Sie die Probe mit einem Rührer mit niedrigem Profil (Materialtabelle) mäßig um und führen Sie TA-Messungen durch. Wiederholen Sie die Schritte 4.6-4.14.
HINWEIS: Bei Lasern mit 1-20 Hz kann oft eine geringere Leistung verwendet werden (~1 mJ/Impuls).
6. Ultraschnelle transiente Absorptionsmessungen (ufTA)
- Ausrichtung von Pumpen- und Sondenstrahlen für maximale Überlappung
- Das MOF-Aussetzungsverfahren in Abschnitt 1 ändert sich nicht. Die Absorptionsmessungen vor der TA (Abschnitt 2) ändern sich nicht, außer bei Verwendung von SC2 anstelle von SC1 (Tabelle der Materialien). Bei Bedarf ändert sich auch der Spülvorgang nicht.
- Um die Pump- und Sondenstrahlen für ufTA-Messungen auszurichten, wird zunächst eine Lösung eines bekannten Chromophors [z. B. Ru(bpy)32+] in einer Küvette mit einer Schichtdicke von 2 mm mit einem OD von 0,5-1 bei der Anregungswellenlänge hergestellt. Es ist nicht erforderlich, die Probe zu spülen.
HINWEIS: Wählen Sie eine Standardprobe, die ein TA-Spektrum im gleichen Wellenlängenbereich wie die MOF-Probe aufweist. Oft kann der MOF-Linker als Standard verwendet werden. - Schalten Sie die Ultrakurzpulslaser-Pumpquelle und das Spektrometer ein (Abbildung 3). Öffnen Sie die Software des optisch-parametrischen Verstärkers (falls vorhanden) und stellen Sie sie auf die gewünschte Anregungswellenlänge ein. Öffnen Sie die ufTA-Spektrometer-Software und wählen Sie ein Sondenfenster (UV-sichtbar, sichtbar oder Nahinfrarot).
HINWEIS: Stellen Sie sicher, dass die optische Verzögerungsstufe auf kurze und lange Zeitverzögerungen ausgerichtet ist. Je nach System geschieht dies manuell oder über die Spektrometer-Software. Die meisten kommerziellen Systeme verfügen über eine "Align Delay Stage"-Option in der Software, die angeklickt werden kann, um sie auszurichten.
Anmerkungen: Schalten Sie nach Möglichkeit das Licht aus oder minimieren Sie Lichtstörungen, wenn Sie die Pumpen- und Sondenstrahlen beobachten. - Legen Sie die Standardküvette in einer Linie mit dem Sondenstrahl in den Probenhalter. Stellen Sie die Leistung der Pumpenquelle mit einem ND-Filterrad ein (Abbildung 3, ufND), um den Pumpenstrahl bei Bedarf zu sehen. Legen Sie eine weiße Notizkarte auf die Küvettenseite, die dem Pumpen- und Sondenstrahl zugewandt ist.
- Stellen Sie den Pumpenpunkt auf der Notizkarte mit den Drehknöpfen an der kinematischen Halterung so ein, dass er sich auf der gleichen vertikalen Höhe wie der Sondenstrahl befindet, und stellen Sie die Pumpe horizontal so ein, dass sie sich innerhalb von 1 mm oder 2 mm neben dem Sondenstrahl befindet. Passen Sie ohne Notizkarte die vertikale und horizontale Position des Pumpstrahls an, um das höchste TA-Spektralsignal zu erhalten.
- Stellen Sie den Fokus (Abbildung 3, TS) des Pumpstrahls so ein, dass er beim Auftreffen auf eine Standard-Probenküvette die kleinste Punktgröße hat. Der Fokus liegt auf dem kleinsten Punkt, an dem das maximale Signal erhalten wird. Sobald das höchste spektrale Signal erreicht ist, werden die Pump- und Sondenstrahlen optimal ausgerichtet.
HINWEIS: Kommerzielle ufTA-Systeme (Table of Materials) verfügen in der Regel über eine Live-View-Option , die es dem Benutzer ermöglicht, die Zeit Null einzustellen und das gesamte TA-Spektrum zu sehen, bevor die Probe offiziell gemessen wird.
- Bestimmung der Spotgröße und Energiedichte des Pumpstrahls
- Wenn die Pump- und Sondenstrahlen ausgerichtet sind, ersetzen Sie den Probenzellenhalter durch ein montiertes Lochrad (2.000-25 μm Löcher; Tabelle der Materialien) im Brennpunkt des Laserstrahls (ergänzende Abbildung 1, PHW). Achten Sie darauf, dass das Lochrad fast (wenn nicht sogar genau) senkrecht zum Weg des Laserstrahls steht.
- Stellen Sie das Lochrad so ein, dass der Laserstrahl durch die 2.000 μm große Lochblende geht. Stellen Sie einen Detektor auf, der an einem Leistungsmesser (ergänzende Abbildung 1, PWR) dicht auf der anderen Seite des Lochrads angebracht ist, so dass der gesamte Laserstrahl auf den Detektor trifft.
- Stellen Sie die Leistung der Pumpenquelle mit einem ND-Filterrad so ein, dass der Detektor genügend Leistung misst. Beachten Sie die durchschnittliche Leistung bei dieser Lochblendengröße.
- Drehen Sie das Lochblendenrad auf eine kleinere Lochblendengröße und passen Sie die vertikale und horizontale Position des Laserstrahls an, um die maximale Leistung an dieser Lochblende zu erreichen. Beachten Sie die Leistung für die Lochblendengröße. Wiederholen Sie diesen Schritt mit immer kleineren Lochblenden, bis die kleinste Lochblende erreicht ist.
HINWEIS: Während die Lochblendenmessungen eher eine ungefähre Methode sind, reichen sie für Messungen aus, wenn sie mit der alternativen Methode der Verwendung einer CCD-Kamera verglichen werden, die Tausende von Dollar kosten kann. - Zeichnen Sie in einer Datenanalysesoftware die Daten auf, um die Hälfte einer pseudo-gaußschen Kurve zu erzeugen (sie wird nicht perfekt sein, da der Strahl von Natur aus nicht vollständig gaußförmig ist). Um eine symmetrische Kurve zu erhalten, nehmen Sie dieselben Daten und fügen Sie sie in aufsteigender Reihenfolge der Punktgrößen ein.
- Multiplizieren Sie die Daten mit -1, sodass das Minimum jetzt das Maximum ist. Zeichnen Sie die Daten und passen Sie sie an eine Gaußkurve an. Teilen Sie den Maximalwert der angepassten Krümmung durch e2. Die Breite der Kurve bei 1/e2 ist der ungefähre Spotgrößendurchmesser.
- Lineare Prüfung des Leistungsverhaltens
- Um sicherzustellen, dass bei einem gewünschten Leistungspegel keine nichtlinearen Effekte auftreten (z. B. Multiphotonen-Anregungsprozesse, Vielteilchenzerfälle), muss das Signal an mehreren Punkten des MOF-TA-Spektrums direkt nach der Chirp-Antwort mit unterschiedlichen Leistungen aufgezeichnet werden. Bestimmen Sie fünf Leistungsstufen, um eine Kurve zu erstellen.
- Ersetzen Sie das Lochrad durch den Probenhalter und legen Sie die Standardprobe wieder in den Halter. Wiederholen Sie Schritt 6.1 (die Neuausrichtung sollte viel einfacher sein, da der Pumpbalken in Schritt 6.2 nur geringfügig angepasst wurde).
- Sobald die Pump- und Sondenstrahlen ausgerichtet sind und sich die MOF-Probe im Probenhalter bewegt, messen und zeichnen Sie die durchschnittliche Pumpenleistung mit einem Leistungsmesser auf, das an einem Detektor im Strahlengang der Pumpe angebracht ist.
- Entfernen Sie den Detektor aus dem Strahlengang und zeichnen Sie im Live-View-TA-Modus das ΔOD-Signal der MOF-Probe an verschiedenen Punkten des TA-Spektrums direkt nach der Chirp-Antwort (~2-3 ps) auf. Wiederholen Sie die Schritte 6.3.3 und 6.3.4 bei den anderen vier Leistungsstufen.
HINWEIS: Manchmal ist das Signal bei niedrigeren Leistungspegeln ziemlich schwach, wenn also die Option verfügbar ist, erhöhen Sie die Mittelungszeit im "Live-View"-Modus auf 5-10 s, um ein besseres Signal-Rausch-Verhältnis zu erhalten und die Signalschwankungen des Sondenstrahls zu verringern. Wir stellen die Mittelungszeit in der Regel bei allen Leistungsmessungen auf 2-5 s ein und zeichnen den OD bei einer Wellenlänge mit jeder nachfolgenden Mittelungsperiode einige Male auf, um eine Standardabweichung bei jeder Leistung zu erhalten. - Zeichnen Sie die aufgezeichneten Datenpunkte als ΔOD im Vergleich zur einfallenden Leistung in einer Datenanalysesoftware auf. Wenn es eine lineare Leistungsantwort gibt, bildet das resultierende Diagramm eine gerade Linie, wobei der y-Achsenabschnitt bei Null liegt. Wenn es erwartungsgemäß zu einer nichtlinearen Leistungsantwort kommt, werden in der Regel signifikante Abweichungen von einer linearen Kurve beobachtet.
- Bestimmung der Energiedichte, die auf die Suspensionsprobe trifft
- Wenn die Spotgröße des Pumpstrahls und die einfallende Leistung, die auf die MOF-Aufhängung trifft, bekannt sind, kann die ungefähre Energiedichte bestimmt werden.
HINWEIS: Ein ungefährer Spotdurchmesser von 250 μm ergibt beispielsweise einen Radius von ~125 μm. Nach der Umrechnung des Radius in cm kann die Oberfläche des Spots berechnet werden: A = πr 2 = π(0,0125cm)2 ≈ 0,0005 cm 2. Dividiert man die einfallende Leistung (z.B. 30 μW) durch die Laserwiederholrate (500 Hz), so ergibt sich eine durchschnittliche Energie pro Puls von 0,06 μJ. Dividiert man schließlich die mittlere Energie pro Puls durch die Spotoberfläche, erhält man eine mittlere Energiedichte pro Puls von 120 μJ·cm-2. Die ideale Energiedichte ist eine, die ein adäquates TA-Signal liefert, während sie in einem linearen Bereich der Pumpenleistung fällt. Wenn jedoch eine geringere Leistung verwendet werden kann, ohne zu viel Signal zu opfern, sollte sie verwendet werden. Ein ΔmOD von ~1 bei <10 ps ist ein guter Kompromiss zwischen Signal- und Pumpleistung.
- Wenn die Spotgröße des Pumpstrahls und die einfallende Leistung, die auf die MOF-Aufhängung trifft, bekannt sind, kann die ungefähre Energiedichte bestimmt werden.
- Durchführung von ultraschnellen TA-Messungen
- Wenn sich die MOF-Probe im Halter befindet, sich die Pump- und Sondenstrahlen überlappen und eine ideale Anregungsleistung für die Probe gewählt wird, können ufTA-Messungen durchgeführt werden.
- Überprüfen Sie das Live-View-Fenster und stellen Sie sicher, dass die Zeit Null korrekt auf den Beginn des Melders eingestellt ist.
HINWEIS: Beim Umschalten zwischen der Standardprobe und der MOF-Probe kann die Zeit Null leicht verschoben werden, daher ist eine erneute Überprüfung erforderlich. - Verlassen Sie das Live-View-Fenster zur Hauptspektrometer-Software. Stellen Sie sicher, dass die MOF-Aufhängung während des gesamten gescannten Zeitfensters ein optimales TA-Spektrum bietet, indem Sie Parameter für einen schnellen Scan einstellen und auf die Schaltfläche Start klicken. Typische Quick-Scan-Parameter sind ein Zeitfenster von -5 ps bis 8.000 ps, ein Scan, 100 Datenpunkte, eine exponentielle Punktkarte (d. h. die 100 Datenpunkte, die in Schritten aufgezeichnet werden, die zu einer exponentiellen Kurve passen) und eine Integrationszeit von 0,1 s.
- Sobald das ufTA-Spektrum für den Schnellscan fertig ist und insgesamt gut aussieht, ändern Sie die Scanparameter für eine qualitativ hochwertigere Messung und klicken Sie auf die Schaltfläche Start . Typische Parameter sind ein Zeitfenster von -5 ps bis 8.000 ps, drei Scans, 200-300 Datenpunkte, eine exponentielle Punktkarte und eine Integrationszeit von 2-3 s.
HINWEIS: Es wird allgemein empfohlen, dass die Messzeit 1 h nicht überschreiten sollte, um eine längere Verschlechterung zu vermeiden, insbesondere bei höheren Pumpenleistungen. - Sobald das hochwertige ufTA-Spektrum fertig ist, nehmen Sie die Probe aus dem Probenhalter und messen Sie das Absorptionsspektrum der Probe, um eine geringe Degradation zu gewährleisten. Bestätigen Sie die minimale Degradation weiter, indem Sie die Suspension durch einen 20-nm-Spritzenvorsatzfilter leiten (Materialtabelle) und das Absorptionsspektrum erneut messen.
7. Erstellung von MOFs für Emissionsmessungen
- Abhängig von der Anregungswellenlänge emittiert PNH2 Fluoreszenz und wird daher bei diesem Verfahren weggelassen, um die wahren Emissionsspektren und die Kinetik der MOF-Suspension zu erhalten. Zusätzlich entfällt der Spritzenfiltrationsprozess in den Schritten 1.7 und 1.8.
HINWEIS: Diese Auslassungen wirken sich nicht merklich auf die Emissionsmessungen aus. - Wiegen Sie 1 mg MOF ab und geben Sie es in eine saubere Durchstechflasche. Übertragen Sie 3-4 ml DMF in die Durchstechflasche mit MOF. Wiederholen Sie Schritt 1.3.
- Messen Sie das Absorptionsspektrum der MOF-Suspension und verdünnen Sie die Suspension, bis bei der Anregungswellenlänge ein OD von 0,1-0,2 erreicht ist (Abschnitt 2).
- Führen Sie den oben genannten Spülvorgang (Abschnitt 3) durch. Die MOF-Suspension ist nun bereit für Fluoreszenzmessungen.
8. MOF-Emissionsmessungen
- Schalten Sie das Fluorimeter und die Bogenlampe ein (Materialtabelle, ergänzende Abbildung 2). Öffnen Sie die Fluorimeter-Software und wählen Sie den Emissionsmodus aus. Geben Sie die gespülte MOF-Suspension in den Probenhalter und rühren Sie mäßig um.
- Stellen Sie mit der in Schritt 7.3 festgelegten Anregungswellenlänge die Anregungs- und Emissionsmonochromatorschlitze auf 5 nm als Ausgangspunkt ein und führen Sie einen kursorischen Emissionsscan mit einer Integrationszeit von 0,1 s durch.
- Sobald die Emissionsbandbreiten optimiert wurden, um ein gutes Signal zu liefern (>10.000 Counts), messen Sie das MOF-Emissionsspektrum mit einer Integrationszeit von 1 s (oder länger). Messen Sie dann das Anregungsspektrum des MOF bei einer ausgewählten Emissionswellenlänge. Stellen Sie sicher, dass das Anregungsspektrum nahezu identisch mit dem MOF-Absorptionsspektrum aussieht.
- Schließen Sie den Bogenlampenspalt und schalten Sie den Gerätemodus in der Software auf TCSPC (zeitkorrelierte Einzelphotonenzählung) um.
- Wählen Sie eine der für TCSPC verwendeten LEDs mit der gewünschten Anregungswellenlänge aus und befestigen Sie sie an einem Probenkammerfenster senkrecht zum Detektorfenster. Schließen Sie die erforderlichen Drähte an die LED an, um sie in das Fluorimeter zu integrieren.
- Stellen Sie das Gerät auf die gewünschte Emissionswellenlänge, die Bandbreite auf 5 nm (ggf. anpassen) und das Zeitfenster auf 150 ns als Ausgangspunkt ein (je nach Probenlebensdauer kann es verkürzt werden). Übernehmen Sie diese Einstellungen und starten Sie die TCSPC-Messungen über das Softwarefenster.
HINWEIS: Ein allgemeiner Stopppunkt für die meisten TCSPC-Messungen ist, wenn die maximale Anzahl einen Wert von 10.000 erreicht hat. Darüber hinaus beträgt die optimale Zählrate des Detektors 1 % bis 5 % der LED-Wiederholrate, um der Poisson-Statistik zu folgen. Wenden Sie sich an den TCSPC-LED-Hersteller, um die Gerätespezifikationen zu erhalten, falls diese noch nicht vorhanden sind.
- Stellen Sie das Gerät auf die gewünschte Emissionswellenlänge, die Bandbreite auf 5 nm (ggf. anpassen) und das Zeitfenster auf 150 ns als Ausgangspunkt ein (je nach Probenlebensdauer kann es verkürzt werden). Übernehmen Sie diese Einstellungen und starten Sie die TCSPC-Messungen über das Softwarefenster.
Ergebnisse
Die elektronischen Absorptionsspektren von PCN-222(fb) mit und ohne PNH2 und Filterung sind in Abbildung 4 dargestellt. Das MOF ohne PNH2 wurde nur mit der Spitze beschallt und verdünnt. Beim Vergleich der beiden Spektren ist der größte Unterschied die Minimierung der Basislinienstreuung, die sich in einer breiten Aufwärtsabsorption mit abnehmenden Wellenlängen zeigt und auch die elektronischen Übergänge deutlich verbreitert. Zum weiteren Vergleich ist der PCN-22...
Diskussion
Während die oben genannten Ergebnisse und das Protokoll allgemeine Richtlinien für die Minimierung der Streuung von MOFs bei der spektroskopischen Charakterisierung beschreiben, gibt es eine große Variabilität in der MOF-Partikelgröße und -struktur, die sich auf die spektroskopischen Ergebnisse auswirkt und daher die Interpretationsmethoden verwischt. Um die Interpretation zu klären und die Belastung zu verringern, die mit der Analyse von MOF-spektroskopischen Daten einhergeht, ist es wichtig, ein Verfahren zu fin...
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde vom Department of Energy im Rahmen des Grants DE-SC0012446 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 cm cuvette sample mount (SM1) | Edinburgh Instruments | n/a | Contact company |
| 1 mL disposable syringes | EXELINT | 26044 | |
| 10 mL disposable syringes | EXELINT | 26252 | |
| 1-dram vials | FisherSci | CG490001 | |
| 20 nm syringe filters | VWR | 28138-005 | The filters are made by Whatman/Cytiva, and their catalog number is 6809-1002 |
| 200 nm syringe filters | Cytiva, Whatman | 6784-1302 | |
| Absorption spectrophotometer | Agilent | Cary 5000 Spectrophotometer | Contact company |
| Acetronitrile (ACN) | FisherSci | AA36423 | |
| Ar gas tank | Linde/PraxAir | P-4563 | |
| bis amino-terminated polyethylene glycol (PNH2) | Sigma-Aldrich | 452572 | MOF suspending agent |
| Clamping sample mount for nsTA (SM2) | Ultrafast Systems | n/a | Contact company |
| Concave lens for telescope(CCL1) | Thorlabs | LD1613-A-ML | |
| Convex lens for telescope (CVL1) | Thorlabs | LA1708-A-ML | |
| Custom 1 cm optical cell with 24/40 outer joint | QuarkGlass | QSE-1Q10-2440 (Spectrosil Cat #1-Q-10 | We requested the 1 cm cell to have a joint |
| Custom 2mm optical cell with 14/20 outer joint | QuarkGlass | QSE-1Q2-1420 (Spectrosil Cat # 1-Q-2) | We requested the 2 mm cell to have a joint |
| Dimethylformamide (DMF) | FisherSci | D119 | |
| Dye laser (Nd:YAG pumped) for 415 nm output | Sirah | CobraStretch | |
| Dye laser dye, Exalite 417 | Luxottica | 4170 | |
| Femtosecond laser | Coherent | Astrella | |
| Fluorimeter | Photon Technology Inc. (Horiba) | QuantaMaster QM-200-4E | |
| Fluorimeter arc lamp, 75 W | Newport | 6251NS | |
| Fluorimeter PMT | Hamamatsu | 1527 | |
| Fluorimeter Software | PTI/Horiba | FelixGX | |
| Fluorimeter TCSPC Module | Becker & Hickl GmbH | PMH-100 | |
| lens mounts for telescope | Thorlabs | LMR1 | |
| Long purging needles | STERiJECT | PRE-22100 | |
| Magnetic stirrer | Ultrafast Systems | n/a | Contact company |
| mirror 1 (MM1) 350-700 nm | Newport | 10Q20BB.1 | |
| MM1 mount | Thorlabs | KM100 | |
| MM1 post | Thorlabs | TR2 | |
| MM1 post holder | Thorlabs | PH1.5 | |
| MM2 mount | Thorlabs | MFM05 | |
| MM2,3 mirrors | thorlabs | BB03-E02 | |
| MM2,3 post | Thorlabs | MS3R | |
| MM2,3 post bases | Thorlabs | MBA1 | |
| MM2,3 post holders | Thorlabs | MPH50 | |
| MM3 mount | Thorlabs | MK05 | |
| mounting posts for telescope optics | Thorlabs | TR4 | |
| Nanosecond TA Nd:YAG lasers | Spectra-Physics | QuantaRay INDI Nd:YAG | |
| Nanosecond TA spectrometer | Edinburgh Instruments | LP980 | |
| nsTA ICCD camera | Oxford Instruments | Andor iStar ICCD camera | Contact company |
| nsTA PMT | Hamamatsu | R928 | |
| Optical parametric amplifier | Ultrafast Systems | Apollo | |
| Parafilm | FisherSci | S37440 | |
| Pinhole wheel | Thorlabs | PHW16 | |
| Pinhole wheel post base | Thorlabs | CF125C | |
| Pinhole wheel post holder | Thorlabs | PH1.5 | |
| Pinhole wheel post/mount assembly | Thorlabs | NDC-PM | |
| post bases for telescope optics | Thorlabs | CF125C | |
| post holders for telescope optics | Thorlabs | PH4 | |
| Power detector for ns TA | Thorlabs | S310C | |
| Prism assembly (P2,3) | Edinburgh Instruments | n/a | Contact company |
| Prism mount (P1) | OWIS | K50-FGS | |
| Prism post (P1) | Thorlabs | TR4 | |
| Prism post base (P1) | Thorlabs | CF125C | |
| Prism post holder (P1) | Thorlabs | PH4 | |
| Quartz prisms (P1-P3) | Newport | 10SR20 | |
| Rubber outer joint septa (14/20) | VWR | 89097-540 | |
| Rubber outer joint septa (24/40) | ChemGlass | CG-3022-24 | |
| Sonication tip | Branson | product discontinued | Closest alternative is 1/8" diam. tip from iUltrasonic |
| Square ND filters | Thorlabs | NEK01S | |
| Stir bars | StarnaCells/FisherSci | NC9126395 | |
| Thorlabs power detector for ufTA | Thorlabs | S401C | |
| Thorlabs power meter | Thorlabs | PM100D | |
| Tip sonicator | Branson | Digital Sonifer 450, product discontinued | Closest alternative is SFX550 from iUltrasonic |
| Tygon tubing | Grainger | 8Y589 | |
| ufTA ND filter wheel | Thorlabs | NDC-25C-2-A | |
| ufTA ND filter wheel mount | Thorlabs | NDC-PM | |
| ufTA ND filter wheel post | Thorlabs | PH2 | |
| ufTA ND filter wheel post base | Thorlabs | CF125C | |
| ufTA pump alignment mirror | Thorlabs | PF10-03-F01 | |
| Ultrafast TA telescope assembly | Ultrafast Systems | n/a | Contact company |
| Ultrafast transient absorption spectrometer | Ultrafast Systems | HeliosFire | |
| Xe arc probe lamp | OSRAM | 4050300508788 |
Referenzen
- Zhou, H. -. C., Long, J. R., Yaghi, O. M. Introduction to metal-organic frameworks. Chemical Reviews. 112 (2), 673-674 (2012).
- Li, H., et al. Recent advances in gas storage and separation using metal-organic frameworks. Materials Today. 21 (2), 108-121 (2018).
- Xie, L. S., Skorupskii, G., Dincă, M. Electrically conductive metal-organic frameworks. Chemical Reviews. 120 (16), 8536-8580 (2020).
- Ye, Y., Zhao, Y., Sun, Y., Cao, J. Recent progress of metal-organic framework-based photodynamic therapy for cancer treatment. International Journal of Nanomedicine. 17, 2367-2395 (2022).
- Gibbons, B., Cai, M., Morris, A. J. A potential roadmap to integrated metal organic framework artificial photosynthetic arrays. Journal of the American Chemical Society. 144 (39), 17723-17736 (2022).
- Wang, Q., Gao, Q., Al-Enizi, A. M., Nafady, A., Ma, S. Recent advances in MOF-based photocatalysis: environmental remediation under visible light. Inorganic Chemistry Frontiers. 7 (2), 300-339 (2020).
- Bavykina, A., et al. Metal-organic frameworks in heterogeneous catalysis: recent progress, new trends, and future perspectives. Chemical Reviews. 120 (16), 8468-8535 (2020).
- Wang, C., Xie, Z., deKrafft, K. E., Lin, W. Doping metal-organic frameworks for water oxidation, carbon dioxide reduction, and organic photocatalysis. Journal of the American Chemical Society. 133 (34), 13445-13454 (2011).
- Wang, Q., Astruc, D. State of the art and prospects in metal-organic framework (MOF)-based and MOF-derived nanocatalysis. Chemical Reviews. 120 (2), 1438-1511 (2020).
- Lan, G., et al. Electron injection from photoexcited metal-organic framework ligands to ru2 secondary building units for visible-light-driven hydrogen evolution. Journal of the American Chemical Society. 140 (16), 5326-5329 (2018).
- Benseghir, Y., et al. Unveiling the mechanism of the photocatalytic reduction of CO2 to formate promoted by porphyrinic Zr-based metal-organic frameworks. Journal of Materials Chemistry A, Materials for Energy and Sustainability. 10 (35), 18103-18115 (2022).
- Rowe, J. M., et al. Sensitized photon upconversion in anthracene-based zirconium metal-organic frameworks. Chemical Communications. 54 (56), 7798-7801 (2018).
- Gharaati, S., et al. Triplet-triplet annihilation upconversion in a MOF with acceptor-filled channels. Chemistry. 26 (5), 1003-1007 (2020).
- Wang, F., et al. Transformable upconversion metal-organic frameworks for near-infrared light-programmed chemotherapy. Chemical Communications. 57 (63), 7826-7829 (2021).
- Roy, I., et al. Photon upconversion in a glowing metal-organic framework. Journal of the American Chemical Society. 143 (13), 5053-5059 (2021).
- Park, J., Xu, M., Li, F., Zhou, H. -. C. 3D long-range triplet migration in a water-stable metal-organic framework for upconversion-based ultralow-power in vivo imaging. Journal of the American Chemical Society. 140 (16), 5493-5499 (2018).
- Lin, S., et al. Photoelectrochemical alcohol oxidation by mixed-linker metal-organic frameworks. Faraday Discussions. 225, 371-383 (2020).
- Jiang, Z. W., Zhao, T. T., Li, C. M., Li, Y. F., Huang, C. Z. 2D MOF-based photoelectrochemical aptasensor for SARS-CoV-2 spike glycoprotein detection. ACS Applied Materials & Interfaces. 13 (42), 49754-49761 (2021).
- Shaikh, S. M., et al. Role of a 3D structure in energy transfer in mixed-ligand metal-organic frameworks. The Journal of Physical Chemistry C. 125 (42), 22998-23010 (2021).
- Shaikh, S. M., et al. Light harvesting and energy transfer in a porphyrin-based metal organic framework. Faraday Discussions. 216, 174-190 (2019).
- Logan, M. W., et al. Systematic variation of the optical bandgap in titanium-based isoreticular metal-organic frameworks for photocatalytic reduction of CO2 under blue light. Journal of Materials Chemistry A, Materials for Energy and Sustainability. 5 (23), 11854-11863 (2017).
- Zhang, Q., et al. Förster energy transport in metal-organic frameworks is beyond step-by-step hopping. Journal of the American Chemical Society. 138 (16), 5308-5315 (2016).
- Kent, C. A., et al. Energy transfer dynamics in metal-organic frameworks. Journal of the American Chemical Society. 132 (37), 12767-12769 (2010).
- Lin, J., et al. Triplet excitation energy dynamics in metal-organic frameworks. The Journal of Physical Chemistry C. 117 (43), 22250-22259 (2013).
- Li, X., Yu, J., Gosztola, D. J., Fry, H. C., Deria, P. Wavelength-dependent energy and charge transfer in MOF: a step toward artificial porous light-harvesting system. Journal of the American Chemical Society. 141 (42), 16849-16857 (2019).
- White, T. A., Arachchige, S. M., Sedai, B., Brewer, K. J. Emission spectroscopy as a probe into photoinduced intramolecular electron transfer in polyazine bridged Ru(II),Rh(III) supramolecular complexes. Materials. 3 (8), 4328-4354 (2010).
- Miller, J. N. Fluorescence energy transfer methods in bioanalysis. Analyst. 130 (3), 265-270 (2005).
- Cao, W., Tang, Y., Cui, Y., Qian, G. Energy transfer in metal-organic frameworks and its applications. Small Structures. 1 (3), 2000019 (2020).
- Lan, G., et al. Titanium-based nanoscale metal-organic framework for type i photodynamic therapy. Journal of the American Chemical Society. 141 (10), 4204-4208 (2019).
- Chen, D., Jin, Z., Xing, H. Titanium-porphyrin metal-organic frameworks as visible-light-driven catalysts for highly efficient sonophotocatalytic reduction of Cr(VI). Langmuir. 38 (40), 12292-12299 (2022).
- Berera, R., van Grondelle, R., Kennis, J. T. M. Ultrafast transient absorption spectroscopy: principles and application to photosynthetic systems. Photosynthesis Research. 101 (2-3), 105-118 (2009).
- Brown, A. M., McCusker, C. E., McCusker, J. K. Spectroelectrochemical identification of charge-transfer excited states in transition metal-based polypyridyl complexes. Dalton Transactions. 43 (47), 17635-17646 (2014).
- Farr, E. P., et al. Introduction to time-resolved spectroscopy: nanosecond transient absorption and time-resolved fluorescence of eosin B. Journal of Chemical Education. 95 (5), 864-871 (2018).
- Pattengale, B., Ostresh, S., Schmuttenmaer, C. A., Neu, J. Interrogating light-initiated dynamics in metal-organic frameworks with time-resolved spectroscopy. Chemical Reviews. 122 (1), 132-166 (2022).
- Santaclara, J. G., et al. Organic linker defines the excited-state decay of photocatalytic MIL-125(Ti)-type materials. ChemSusChem. 9 (4), 388-395 (2016).
- Hanna, L., Long, C. L., Zhang, X., Lockard, J. V. Heterometal incorporation in NH2-MIL-125(Ti) and its participation in the photoinduced charge-separated excited state. Chemical Communications. 56 (78), 11597-11600 (2020).
- Gutierrez, M., Cohen, B., Sánchez, F., Douhal, A. Photochemistry of Zr-based MOFs: ligand-to-cluster charge transfer, energy transfer and excimer formation, what else is there. Physical Chemistry Chemical Physics. 18 (40), 27761-27774 (2016).
- Adams, M., et al. Highly efficient one-dimensional triplet exciton transport in a palladium-porphyrin-based surface-anchored metal-organic framework. ACS Applied Materials & Interfaces. 11 (17), 15688-15697 (2019).
- Hassan, Z. M., et al. Spectroscopic investigation of bianthryl-based metal-organic framework thin films and their photoinduced topotactic transformation. Advanced Materials Interfaces. 9 (13), 2102441 (2022).
- Li, X., et al. Ultrafast relaxation dynamics in zinc tetraphenylporphyrin surface-mounted metal organic framework. The Journal of Physical Chemistry C. 122 (1), 50-61 (2018).
- Triggiani, L., et al. Excitation-dependent ultrafast carrier dynamics of colloidal tio2 nanorods in organic solvent. The Journal of Physical Chemistry C. 118 (43), 25215-25222 (2014).
- Pu, Y., Cai, F., Wang, D., Wang, J. -. X., Chen, J. -. F. Colloidal synthesis of semiconductor quantum dots toward large-scale production: a review. Industrial & Engineering Chemistry Research. 57 (6), 1790-1802 (2018).
- Zhou, L. -. L., et al. One-pot synthetic approach toward porphyrinatozinc and heavy-atom involved Zr-NMOF and its application in photodynamic therapy. Inorganic Chemistry. 57 (6), 3169-3176 (2018).
- Zhao, Y., et al. Metal-organic frameworks with enhanced photodynamic therapy: synthesis, erythrocyte membrane camouflage, and aptamer-targeted aggregation. ACS Applied Materials & Interfaces. 12 (21), 23697-23706 (2020).
- Zeng, J. -. Y., et al. π-extended benzoporphyrin-based metal-organic framework for inhibition of tumor metastasis. ACS Nano. 12 (5), 4630-4640 (2018).
- Cheng, Q., Debnath, S., Gregan, E., Byrne, H. J. Ultrasound-assisted SWNTs dispersion: effects of sonication parameters and solvent properties. The Journal of Physical Chemistry C. 114 (19), 8821-8827 (2010).
- Baig, Z., et al. Investigation of tip sonication effects on structural quality of graphene nanoplatelets (GNPs) for superior solvent dispersion. Ultrasonics Sonochemistry. 45, 133-149 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten