È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una guida tecnica per l'esecuzione di misure spettroscopiche su strutture metallo-organiche
In questo articolo
Riepilogo
Qui, utilizziamo uno stabilizzatore polimerico per preparare sospensioni metallo-organica (MOF) che mostrano una dispersione marcatamente ridotta nei loro spettri di assorbimento transitorio e dello stato fondamentale. Con queste sospensioni MOF, il protocollo fornisce varie linee guida per caratterizzare spettroscopicamente i MOF per produrre dati interpretabili.
Abstract
Le strutture metallo-organiche (MOF) offrono una piattaforma unica per comprendere i processi guidati dalla luce nei materiali allo stato solido, data la loro elevata sintonizzazione strutturale. Tuttavia, la progressione della fotochimica basata su MOF è stata ostacolata dalla difficoltà di caratterizzare spettralmente questi materiali. Dato che i MOF sono tipicamente più grandi di 100 nm di dimensione, sono inclini a un'eccessiva dispersione della luce, rendendo così quasi non interpretabili i dati provenienti da preziosi strumenti analitici come l'assorbimento transitorio e la spettroscopia di emissione. Per ottenere informazioni significative sui processi fotochimici e fisici basati su MOF, è necessario prestare particolare attenzione alla corretta preparazione dei MOF per le misurazioni spettroscopiche, nonché alle configurazioni sperimentali che raccolgono dati di qualità superiore. Con queste considerazioni in mente, la presente guida fornisce un approccio generale e una serie di linee guida per l'indagine spettroscopica dei MOF. La guida affronta i seguenti argomenti chiave: (1) metodi di preparazione dei campioni, (2) tecniche/misure spettroscopiche con MOF, (3) configurazioni sperimentali, (3) esperimenti di controllo e (4) caratterizzazione della stabilità post-corsa. Con un'appropriata preparazione dei campioni e approcci sperimentali, i progressi pionieristici verso la comprensione fondamentale delle interazioni luce-MOF sono significativamente più raggiungibili.
Introduzione
Le strutture metallo-organiche (MOF) sono composte da nodi di ossido metallico legati da molecole organiche, che formano strutture porose gerarchiche quando le loro parti costitutive reagiscono insieme in condizioni solvotermiche1. I MOF permanentemente porosi sono stati segnalati per la prima volta nei primi anni 2000 e da allora il fiorente campo si è ampliato fino a comprendere una vasta gamma di applicazioni, data la sintonizzazione unica dei loro componenti strutturali 2,3,4,5,6,7. Durante la crescita del campo dei MOF, ci sono stati una manciata di ricercatori che hanno incorporato materiali fotoattivi nei nodi, nei ligandi e nei pori dei MOF per sfruttare il loro potenziale in processi guidati dalla luce, come la fotocatalisi 8,9,10,11, upconversion 12,13,14,15,16 e la fotoelettrochimica 17,18. Una manciata dei processi guidati dalla luce dei MOF ruotano attorno all'energia e al trasferimento di elettroni tra donatori e accettori 17,19,20,21,22,23,24,25. Le due tecniche più comuni utilizzate per studiare l'energia e il trasferimento di elettroni nei sistemi molecolari sono la spettroscopia di emissione e assorbimento transitorio26,27.
Una grande quantità di ricerche sui MOF si è concentrata sulla caratterizzazione delle emissioni, data la relativa facilità nella preparazione dei campioni, nell'esecuzione di misurazioni e nell'analisi (relativamente) semplice 19,22,23,24,28. Il trasferimento di energia si manifesta tipicamente come una perdita dell'intensità e della durata dell'emissione del donatore e un aumento dell'intensità di emissione dell'accettore caricato nella dorsale MOF 19,23,28. L'evidenza del trasferimento di carica in un MOF si manifesta come una diminuzione della resa quantica di emissione e della durata del cromoforo nel MOF29,30. Mentre la spettroscopia di emissione è un potente strumento nell'analisi dei MOF, affronta solo una parte delle informazioni necessarie per presentare una comprensione meccanicistica completa della fotochimica MOF. La spettroscopia di assorbimento transitorio può non solo fornire supporto per l'esistenza di energia e trasferimento di carica, ma il metodo può anche rilevare firme spettrali associate ai comportamenti di stato eccitato non emissivi di singoletto e tripletta, rendendolo uno degli strumenti più versatili per la caratterizzazione31,32,33.
Il motivo principale per cui tecniche di caratterizzazione più robuste come la spettroscopia di assorbimento transitorio sono raramente applicate ai MOF è dovuto alla difficoltà di preparare campioni con dispersione minima, specialmente con sospensioni34. Nei pochi studi che hanno eseguito con successo l'assorbimento transitorio sui MOF, i MOF hanno una dimensione di <500 nm, con alcune eccezioni, sottolineando l'importanza di ridurre la dimensione delle particelle per ridurre al minimo la dispersione 15,21,25,35,36,37. Altri studi fanno uso di film sottili MOF17 o SURMOFs38,39,40 per aggirare il problema della dispersione; Tuttavia, dal punto di vista dell'applicabilità, il loro uso è piuttosto limitato. Inoltre, alcuni gruppi di ricerca hanno iniziato a realizzare film polimerici di MOF con Nafion o polistirene34, il primo sollevando alcune preoccupazioni per la stabilità dati i gruppi solfonati altamente acidi su Nafion. Traendo ispirazione dalla preparazione di sospensioni semiconduttrici colloidali 41,42, abbiamo riscontrato un grande successo utilizzando polimeri per aiutare a sospendere e stabilizzare le particelle MOF per misure spettroscopiche11. In questo lavoro, stabiliamo linee guida ampiamente applicabili da seguire quando si tratta di preparare sospensioni MOF e caratterizzarle con tecniche di spettroscopia di emissione, nanosecondi (ns) e assorbimento transitorio (TA) ultraveloce (uf).
Protocollo
1. Preparazione delle sospensioni MOF utilizzando uno stabilizzatore polimerico
- Pesare 50 mg di glicole polietilenico con terminazione bis-amminica (PNH2, Mn ~1.500) (vedere Tabella dei materiali) e trasferire in un flaconcino da un dram (Tabella dei materiali). Pesare 1-5 mg di PCN-222(fb) (vedere protocollo sintetico11) e inserirlo nello stesso flaconcino con EPN2.
NOTA: Per ottenere le migliori sospensioni MOF possibili, le condizioni sintetiche richieste per rendere le dimensioni delle particelle MOF devono essere pari o inferiori a 1 μm. - Trova un solvente adatto (se non acqua, usa un solvente anidro come dimetilformammide [DMF] o acetonitrile [ACN]; vedi Tabella dei materiali) per sospendere il MOF, assicurandoti che la finestra del solvente sia abbastanza ampia in modo che il solvente stesso non sia eccitato con la lunghezza d'onda scelta. Trasferire 1-3 mL di solvente nel flaconcino utilizzando un'autopipetta dotata di una punta appropriata.
NOTA: I solventi comunemente usati sopra indicati hanno ampie finestre di solvente-CH3CN: 200 nm di cut-off ad alta energia; e DMF: cut-off di 270 nm. I solventi con indici di rifrazione più elevati (1,4-1,5), come DMF, DMSO e toluene, possono essere utilizzati per ridurre al minimo la dispersione della luce essendo più strettamente allineati con l'indice di rifrazione del vetro al quarzo (ca. 1,46-1,55), riducendo così al minimo la flessione della luce in direzioni indesiderate quando si passa attraverso la cuvetta. - Utilizzando un sonicatore a punta (vedere la tabella dei materiali), sonicare il contenuto del flaconcino per 2-5 minuti al 20%-30% di ampiezza (cioè la distanza in cui la punta del sonicatore si muove longitudinalmente, tipicamente ~ 60 μm per una sonda di 3 mm di diametro al 30% di ampiezza) con intervalli di 2 s on e 2 s off. Questa procedura serve a rompere gli aggregati MOF e aiuta a rivestire le particelle MOF con polimero. Assicurarsi che la sospensione MOF sia ben dispersa e omogenea entro la fine del processo di sonicazione.
NOTA: i tempi di sonicazione variano a seconda di quanto bene il MOF si disperde intrinsecamente. - Aprire una nuova siringa di plastica da 10 mL (Tabella dei materiali) e aspirare la sospensione nella siringa. Rimuovere l'ago della siringa e sostituirlo con un filtro a siringa da 200 nm con maglia di politetrafluoroetilene (PTFE) (tabella dei materiali). Passare la sospensione attraverso il filtro della siringa in un nuovo flaconcino pulito. La sospensione risultante è pronta per misurazioni spettroscopiche di assorbimento transitorio.
NOTA: Dato che le dimensioni medie delle particelle di alcuni MOF superano i 200 nm, la scelta della dimensione appropriata è a discrezione dell'utente.
2. Preparazione di sospensioni MOF filtrate per misure di assorbimento transitorio di nanosecondi (nsTA)
- Con la sospensione MOF filtrata ottenuta nella sezione 1, è necessario ottenere lo spettro di assorbimento della sospensione (Tabella dei materiali). Lavare una cuvetta (lunghezza del percorso di 1 cm) in grado di sigillare e spurgare (Table of Materials) con solvente da tre a cinque volte, quindi riempirla con 3 ml di DMF.
- Con uno spettrofotometro ad assorbimento, scegliere una regione di lunghezza d'onda per misurare il solvente e la sospensione. Misurare lo spettro ultravioletto-visibile (UV-Vis) bianco del solvente nella cuvetta e impostarlo come scansione di fondo da sottrarre dalle scansioni del campione. Svuotare il contenuto di solvente della cuvetta e trasferire la sospensione MOF nella cuvetta.
NOTA: Lo spettro di assorbimento elettronico dello stabilizzatore PNH2 (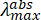 ~250 nm) ha una coda di assorbimento debole che persiste fino a 450 nm, con un'assorbanza di ~0,01 a 450 nm alla concentrazione iniziale.
~250 nm) ha una coda di assorbimento debole che persiste fino a 450 nm, con un'assorbanza di ~0,01 a 450 nm alla concentrazione iniziale. - Misurare lo spettro di assorbimento della sospensione MOF iniziale, tenendo presente la lunghezza d'onda desiderata necessaria per eccitare il campione MOF. Se la sospensione MOF ha un'assorbanza o una densità ottica (OD) >1 alla lunghezza d'onda di eccitazione desiderata, diluire con solvente e misurare lo spettro di assorbanza fino a quando l'OD è ≤1 alla lunghezza d'onda di eccitazione.
NOTA: Per le misure di assorbimento transitorio ad angolo stretto, ripetere le misurazioni di assorbimento per ottenere un OD appropriato alla lunghezza d'onda di eccitazione utilizzando una cella di 2 mm (Tabella dei materiali). Per le misurazioni di assorbimento transitorio di MOF al nanosecondo, è necessaria un'assorbanza o OD di 0,1-1 alla lunghezza d'onda di eccitazione per seguire la legge di Beer. L'OD richiesto è una vasta gamma perché alcuni campioni assorbono fortemente in diverse regioni. Un esempio perfetto di questo sono le porfirine. Le porfirine hanno una forte transizione stretta della banda di Soret tra 400-450 nm, mentre le loro transizioni in banda Q tra 500-800 nm sono piuttosto deboli. Se si volesse eccitare una delle loro bande Q, preparare una soluzione con un OD ~ 0,5 in una delle bande Q mostrerebbe di conseguenza un assorbimento della banda di Soret >3 e il rivelatore di assorbimento transitorio non sarebbe in grado di elaborare quantitativamente i cambiamenti in questa regione. In definitiva, è a discrezione dell'utente determinare la lunghezza d'onda di eccitazione appropriata e l'ampiezza di assorbanza che consente misurazioni quantitative nella finestra spettrale desiderata.
3. Eliminazione della sospensione MOF
- Con la sospensione MOF regolata per avere lo spettro di assorbanza desiderato per le misurazioni TA, posizionare una barra di agitazione di 2 mm x 8 mm (tabella dei materiali) nella cuvetta e sigillare il giunto della cuvetta di ingresso con un setto di gomma.
- Prendere una siringa di plastica da 1 mL (Table of Materials), tagliarne metà con un paio di forbici e tenere la metà della siringa che consente di attaccare gli aghi.
- Con un'estremità di un tubo flessibile collegato a un serbatoio Ar o N2 (tabella dei materiali), inserire la metà della siringa nell'altra estremità del tubo con l'estremità dell'ago all'esterno.
- Avvolgere il gambo della siringa esposta per metà con parafilm (Table of Materials) per creare un sigillo con il tubo e la siringa. Se è disponibile un morsetto per tubo, può essere utilizzato al posto del parafilm per creare una guarnizione con la siringa e il tubo di spurgo.
- Inserire un ago di spurgo lungo (3 pollici, 25 G) (tabella dei materiali) all'estremità della siringa e inserire l'ago nella cuvetta sigillata nella sospensione. Prenda l'ago dalla siringa da 1 mL (punto 3.2) e lo inserisca nella cuvetta. Accendere il flusso Ar o N2 e spurgare la sospensione per 45 min-1 h.
NOTA: Una tecnica nota come "doppio spurgo" viene spesso utilizzata per solventi con un punto di ebollizione <100 °C. Per utilizzare questa tecnica, un matraccio sigillato con solvente viene spurgato con l'ago di ingresso, con un'estremità di una cannula inserita nello spazio di testa del pallone e l'altra estremità della cannula inserita nella sospensione della cuvetta. L'ago di uscita viene inserito nello spazio di testa della cuvetta. Lo spurgo in questo modo riduce al minimo la perdita di solvente dovuta all'evaporazione nel tempo. - Al termine dello spurgo, rimuovere gli aghi e avvolgere il setto della cuvetta con quattro o cinque fette da 2 a parafilm (Tabella dei materiali). Misurare lo spettro di assorbimento del campione per assicurarsi che corrisponda agli standard stabiliti nella sezione 2. Il campione è ora pronto per le misurazioni di assorbimento transitorio.
4. Configurazione dell'assorbimento transitorio del nanosecondo della pompa perpendicolare (nsTA)
- Accendere i sistemi di spettrometri laser e nsTA (Tabella dei materiali; Figura 1). Regolare la potenza di uscita del laser a un livello sufficientemente basso, in modo tale che il posizionamento di un biglietto da visita bianco nel percorso del fascio consenta una chiara visibilità dello spot laser, ma non così luminoso da renderlo accecante.
- Aprire sia l'otturatore laser meccanico che l'otturatore del fascio della sonda in modo che siano entrambi nel percorso del portacampioni.
- Regolare la posizione verticale e orizzontale del raggio laser (Figura 1, P3), in modo che colpisca il centro del supporto della cella del campione (Figura 1, SC1) dove verrà posizionato il campione. Usa un biglietto da visita per confermare la posizione. Posizionare un filtro a densità neutra (ND) (OD 2; Tabella dei materiali) nel percorso del fascio della sonda.
NOTA: Tutti gli specchi e i prismi presenti nel sistema nsTA qui descritto sono montati su supporti cinematici (Table of Materials), e le posizioni del fascio sono regolate ruotando manualmente le manopole verticali e orizzontali sui supporti. Una carta bianca più lunga e larga 1 cm può essere posizionata all'interno di una cuvetta vuota in SC1 per facilitare l'allineamento. - Posizionare un biglietto da visita tagliato (~ 1,5 cm di larghezza) nel portacampioni (o tenerlo nel portacampioni) e inclinarlo attraverso il portacampioni in modo che sia il raggio laser che il raggio della sonda colpiscano lo stesso lato del biglietto da visita. Regolare la posizione del raggio laser verticalmente (P3) per ottenere la migliore sovrapposizione con la parte più intensa del fascio della sonda.
- Chiudere le persiane, rimuovere il filtro ND e posizionare il campione nella camera di campionamento insieme a un agitatore magnetico (Tabella dei materiali). Ora è possibile effettuare misurazioni TA.
- Il sistema e il software utilizzati in questo lavoro sono forniti nella Tabella dei materiali. Nella suite software, ci sono caselle di selezione intitolate Assorbimento spettrale e Assorbimento cinetico per misurare rispettivamente gli spettri TA e la cinetica di assorbimento. Selezionare il pulsante Assorbimento spettrale e selezionare la modalità di impostazione.
- Impostare il tempo zero dell'impulso laser nella finestra di configurazione del software regolando il tempo di ingresso con incrementi di +0,010 μs (ad esempio, -0,020 μs, -0,010 μs, 0,000 μs, 0,010 μs, ecc.) fino a quando l'impulso laser non viene osservato nello spettro del fascio della sonda.
- Con l'impostazione dello zero tempo, ottimizzare la quantità di luce che colpisce il rilevatore CCD (Charge-Coupled Device) nella finestra di configurazione regolando la larghezza di banda, il guadagno e la larghezza del gate per raggiungere un conteggio sufficientemente elevato da ottenere un segnale adeguato senza saturare il rilevatore.
NOTA: lasciamo questo processo all'utente poiché i rilevatori variano da sistema a sistema. - Per raccogliere uno spettro TA, fare clic sul pulsante Multiplo nella scheda Assorbimento spettrale . Assicurarsi che le impostazioni della finestra di configurazione siano presenti in questa finestra. Se il campione emette luce, fare clic sulla scheda Sfondi e fare clic sul pulsante Sottrai sfondo a fluorescenza . Per una scansione superficiale, impostare le medie su 4 per assicurarsi che si ottenga uno spettro TA iniziale di qualità. Se si ottiene uno spettro TA soddisfacente, ottenerne un altro con più medie.
- Per mappare uno spettro TA a diversi ritardi temporali dopo il tempo zero, selezionare il pulsante Mappa nella scheda Assorbimento spettrale . Assicurarsi che i parametri di configurazione non siano stati modificati in questa scheda. Immettere gli intervalli di tempo desiderati per la mappatura, fare clic su Applica, quindi fare clic su Start per mappare gli spettri.
- Per ottenere la cinetica di assorbimento alle lunghezze d'onda desiderate, fare clic sul pulsante Assorbimento cinetico nel software e fare clic sul pulsante Setup nel menu a discesa. Immettere la lunghezza d'onda di interesse nella scheda Controller nella finestra di configurazione e regolare la larghezza di banda a un livello adeguato. Di solito, una larghezza di banda di 1 nm è un buon punto di partenza.
- Nella scheda Oscilloscopio , regolare la finestra temporale del rilevatore del tubo fotomoltiplicatore (PMT) in modo che sia abbastanza lunga da vedere l'intera traccia cinetica, da prima dell'eccitazione laser al decadimento completo del segnale fino alla linea di base. Un punto di partenza abituale è una finestra di 4.000 ns. Regolare l'intervallo di tensione PMT a un livello adeguato, in cui l'intera traccia TA è osservabile sull'asse del segnale. Un intervallo di tensione di 160 mV è ragionevole per iniziare le misurazioni. Fare clic su Applica e quindi su Avvia. Se il segnale è troppo basso o la finestra temporale è troppo breve o troppo lunga, fare clic su Stop e regolare la larghezza di banda e la finestra temporale ai livelli adeguati, assicurandosi di non impostare la larghezza di banda troppo alta per saturare / danneggiare il rilevatore.
- Con la traccia cinetica correttamente impostata, chiudere la finestra Setup e aprire la finestra Multiple dal menu a discesa dopo aver fatto clic sul pulsante Kinetic Absorbing . Verificare che i parametri della finestra Imposta siano gli stessi nella finestra Multipli . Impostare il numero desiderato di misurazioni (colpi laser). Di solito, 20 misurazioni sono soddisfacenti per le regioni ad alto segnale dello spettro TA. Se il campione emette alla lunghezza d'onda della sonda, assicurarsi di controllare il pulsante Sottrai sfondo fluorescenza nella scheda Sfondi . Fare clic su Applica quindi Avvia per raccogliere la cinetica TA.
NOTA: A volte, l'esecuzione di un numero maggiore di scatti (>40) sposta la linea di base del decadimento, positivo o negativo, dall'interferenza di dispersione sonda/laser. Se questo è un problema, eseguire un numero inferiore di scatti (~ 10-20) e ripetere la misurazione più volte per raccogliere più set di dati che possono quindi essere mediati insieme. - Una volta completate le misurazioni TA, misurare successivamente lo spettro di assorbimento del MOF per garantire una degradazione minima.
5. Configurazione nsTA ad angolo stretto
- A volte con le configurazioni perpendicolari pompa-sonda, il segnale ottenuto dalla sospensione MOF è piuttosto debole (<10 ΔmOD) e fluttua ancora dalla dispersione a causa del grande volume di campione eccitato. Per ridurre al minimo le fluttuazioni del segnale e migliorare il segnale, è possibile applicare configurazioni di assorbimento transitorio ultraveloci verso configurazioni nsTA con un orientamento del fascio pompa-sonda ad angolo stretto e lunghezze di percorso inferiori (Figura 2).
- A seconda della configurazione della camera del campione, è possibile mettere a fuoco e dirigere il fascio di eccitazione in modo che i fasci della pompa e della sonda si incrocino ad angoli <45 ° e quindi fornire una maggiore sovrapposizione. Fallo con ottiche di messa a fuoco (Figura 2, lenti concave [CCL] e lenti convesse [CVL]) e specchi cinematici (Figura 2, MM1-3). Accendere il sistema laser/spettrometro e ripetere i passaggi 4.2 e 4.3.
NOTA: Mentre l'uso di lenti concave/convesse è ideale per la messa a fuoco ottica, è possibile utilizzare un diaframma ottico al posto di questi componenti per restringere il fascio. Il restringimento del fascio in questo modo può essere compensato aumentando la potenza; Tuttavia, quando si lavora con lunghezze d'onda inferiori a 400 nm, la degradazione e lo sbiancamento dell'iride sono abbastanza comuni. Alcuni spettrometri TA non hanno breadboard che consentono di montare ottiche nella camera del campione. Lo spettrometro utilizzato qui non ha breadboard, quindi sono stati praticati dei fori e sfruttati nella camera del campione per impostare l'ottica (Figura 2, MM1-3). Se lo spettrometro è ancora in garanzia, contattare il team di supporto dell'azienda per vedere se sono in grado di supportare tale configurazione. - Per ridurre la dimensione dello spot del fascio che colpisce la cuvetta da 2 mm (Table of Materials), installa un telescopio galileiano con una lente concava (Table of Materials, CCL1) che colpisce prima il laser e una lente convessa (Table of Materials, CVL1) che colpisce il laser per secondo. Assicurarsi che la distanza tra le due lenti sia approssimativamente la differenza tra le due distanze focali delle lenti.
NOTA: I laser Spectra-Physics Quanta Ray utilizzati in queste misurazioni hanno una dimensione dello spot di 1 cm. La dimensione dello spot è stata dimezzata con la configurazione del telescopio galileiano. Per i laser che emettono megawatt di potenza, i telescopi galileiani devono essere utilizzati esclusivamente. Un telescopio kepleriano (due lenti convesse) forma plasma tra le due lenti a potenze anche modeste (~10 mW). - Aprire sia l'otturatore laser che quello della sonda. Sostituire il primo specchio dell'otturatore (SM1) con SM2 e posizionare una scheda note nel supporto di serraggio SM2, in modo che il suo orientamento sia completamente rivolto verso il raggio della sonda. Quindi, impostare una serie di mini specchi (MM1-3), approssimativamente come illustrato nella Figura 2. Dirigere il raggio laser in ingresso regolando le manopole di rotazione sul supporto cinematico P3 approssimativamente al centro di MM1. Per ridurre al minimo l'espansione del raggio laser da uno specchio all'altro, posizionare MM2 davanti a MM1 per abbassare l'angolo di riflessione tra i due specchi (Figura 2).
NOTA: Per gli allineamenti laser, una pratica comune è quella di regolare uno specchio/prisma a uno specchio lontano dalla posizione del punto prevista (ad esempio, regolando P2 per colpire con precisione MM1). Tuttavia, P2 negli esperimenti discussi qui è un'ottica fissa che guida il fascio e non dovrebbe essere regolata. Se data la flessibilità, l'allineamento dovrebbe essere fatto con un componente ottico uno specchio lontano dall'ottica di destinazione. - Con il raggio che colpisce approssimativamente il centro su MM1, ruotare MM1 in modo che il raggio laser riflesso colpisca MM2 al centro. Con il raggio che colpisce approssimativamente il centro su MM2, ruotare MM2 in modo che il raggio laser riflesso colpisca MM3 al centro. Con il raggio che colpisce approssimativamente il centro su MM3, ruotare MM3 in modo che il raggio laser riflesso colpisca la scheda della nota di allineamento nello stesso punto del raggio della sonda.
- Regolare con precisione le posizioni del raggio laser su ciascuno degli specchi e della scheda note con le manopole verticali e orizzontali sugli specchi. Assicurarsi che il raggio abbia poco o nessun taglio lungo il suo percorso.
- Ripetere i passaggi 5.5 e 5.6 utilizzando una cuvetta da 2 mm con un giunto interno 14/20 (SC2) e un setto di gomma 14/20 (Tabella dei materiali). Inserire il campione in un supporto per campioni di serraggio (SM2) completamente rivolto verso il percorso del fascio della sonda. Regola con precisione le posizioni del raggio laser su ogni specchio e SM2 con le manopole verticali e orizzontali sugli specchi.
NOTA: Per una maggiore facilità nel passaggio tra configurazioni TA perpendicolari e ad angolo stretto, è possibile utilizzare un supporto a specchio cinematico ribaltabile o magnetico per MM1 al posto di un normale montaggio cinematico per evitare di dover riallineare l'ottica. Il posizionamento di MM2 e MM3 non deve influire sulla pompa incidente o sui fasci di sonda nella configurazione perpendicolare. - Con un agitatore a basso profilo (Table of Materials), agitare moderatamente il campione ed eseguire misurazioni TA. Ripetere i passaggi 4.6-4.14.
NOTA: Per i laser da 1 a 20 Hz, è spesso possibile utilizzare una potenza inferiore (~ 1 mJ / impulso).
6. Misure di assorbimento transitorio ultraveloce (ufTA)
- Allineamento dei fasci della pompa e della sonda per la massima sovrapposizione
- La procedura di sospensione MOF nella sezione 1 non cambia. Le misure di assorbimento pre-TA (sezione 2) non cambiano, tranne che utilizzando SC2 anziché SC1 (Table of Materials). Se necessario, anche il processo di spurgo non cambia.
- Per allineare i fasci della pompa e della sonda per le misurazioni ufTA, iniziare preparando una soluzione di un cromoforo ben noto [ad esempio, Ru(bpy)32+] in una cuvetta di 2 mm con un OD di 0,5-1 alla lunghezza d'onda di eccitazione. Non è necessario eliminare il campione.
NOTA: scegliere un campione standard che presenti uno spettro TA nella stessa regione di lunghezza d'onda del campione MOF. Spesso, il linker MOF può essere utilizzato come standard. - Accendere la sorgente della pompa laser ultraveloce e lo spettrometro (Figura 3). Aprire il software dell'amplificatore ottico parametrico (se presente) e impostarlo sulla lunghezza d'onda di eccitazione desiderata. Apri il software dello spettrometro ufTA e scegli una finestra della sonda (visibile ai raggi UV, visibile o vicino infrarosso [vicino all'infrarosso]).
NOTA: assicurarsi che lo stadio di ritardo ottico sia allineato a ritardi brevi e lunghi. A seconda del sistema, questo viene fatto manualmente o attraverso il software dello spettrometro. La maggior parte dei sistemi commerciali ha un'opzione "Allinea fase di ritardo" nel software che può essere cliccata per allinearlo.
NOTA: Se possibile, spegnere le luci o ridurre al minimo le interferenze luminose quando si osservano i fasci della pompa e della sonda. - Posizionare la cuvetta standard nel portacampioni in linea con il fascio della sonda. Regolare la potenza della sorgente della pompa con una ruota portafiltri ND (Figura 3, ufND) per vedere il fascio della pompa, se necessario. Posizionare una scheda bianca contro il lato della cuvetta rivolto verso la pompa e il raggio della sonda.
- Regolare il punto pompa sulla scheda note con le manopole girevoli sul supporto cinematico, in modo che si trovi alla stessa altezza verticale del fascio della sonda, e regolare orizzontalmente la pompa in modo che si trovi entro 1 mm o 2 mm accanto al raggio della sonda. Senza la scheda note, regolare con precisione le posizioni verticale e orizzontale del fascio della pompa per ottenere il segnale spettrale TA più alto.
- Regolare la messa a fuoco (Figura 3, TS) del raggio della pompa, in modo che sia alla sua dimensione minima quando si colpisce una cuvetta campione standard. La messa a fuoco è nel punto più piccolo in cui si ottiene il segnale massimo. Una volta ottenuto il segnale spettrale più alto, i fasci della pompa e della sonda sono allineati in modo ottimale.
NOTA: I sistemi ufTA commerciali (Table of Materials) hanno tipicamente un'opzione Live View che consente all'utente di impostare il tempo zero e vedere l'intero spettro TA prima di misurare ufficialmente il campione.
- Determinazione della dimensione dello spot del fascio della pompa e della densità di energia
- Con i fasci della pompa e della sonda allineati, sostituire il supporto della cella del campione con una ruota stenopeica montata (fori da 2.000-25 μm; Tabella dei materiali) nel punto focale del raggio laser (Figura supplementare 1, PHW). Assicurarsi che la ruota stenopeica sia quasi (se non esattamente) perpendicolare al percorso del raggio laser.
- Impostare la ruota stenopeica in modo tale che il raggio laser passi attraverso il foro stenopeico da 2.000 μm. Posizionare un rilevatore collegato a un misuratore di potenza (figura supplementare 1, PWR) vicino all'altro lato della ruota stenopeica, in modo che tutto il raggio laser colpisca il rilevatore.
- Regolare la potenza della sorgente della pompa con una ruota portafiltri ND in modo che il rilevatore misuri una potenza sufficiente. Notare la potenza media a quella dimensione stenopeica.
- Ruotare la rotella stenopeica in una dimensione stenopeica più piccola e regolare la posizione verticale e orizzontale del raggio laser per ottenere la massima potenza in uscita su quel foro stenopeico. Notare la potenza per la dimensione del foro stenopeico. Ripetere questo passaggio con fori progressivamente più piccoli fino a raggiungere il foro stenopeico più piccolo.
NOTA: Mentre le misurazioni stenopeiche, sono più di un metodo approssimativo, è sufficiente per le misurazioni quando lo si confronta con il metodo alternativo di utilizzo di una telecamera CCD, che può costare migliaia di dollari. - Nel software di analisi dei dati, tracciare i dati per generare metà di una curva pseudo-gaussiana (non sarà perfetta perché il fascio intrinsecamente non è completamente gaussiano). Per ottenere una curva simmetrica, prendi gli stessi dati e incollali in ordine crescente di dimensioni dello spot.
- Moltiplica i dati per -1, quindi il minimo è ora il massimo. Tracciare i dati e adattarli a una curva gaussiana. Dividere il valore massimo del montato curvo per e2. La larghezza della curva a 1/e2 è il diametro approssimativo della dimensione dello spot.
- Controllo lineare della risposta di potenza
- Per garantire che non siano presenti effetti non lineari a un livello di potenza desiderato (ad esempio, processi di eccitazione multifotonica, decadimenti multiparticellari), il segnale in più punti dello spettro MOF TA subito dopo la risposta chirp deve essere registrato a potenze diverse. Determinare cinque livelli di potenza per comporre una curva.
- Riposizionare la ruota stenopeica con il portacampioni e riposizionare il campione standard nel supporto. Ripetere il punto 6.1 (il processo di riallineamento dovrebbe essere molto più semplice in quanto il fascio della pompa è stato regolato solo leggermente nel punto 6.2).
- Una volta che i fasci della pompa e della sonda sono allineati e il campione MOF si sta agitando nel portacampioni, misurare e registrare la potenza media della pompa con un misuratore di potenza collegato a un rilevatore nel percorso del fascio della pompa.
- Rimuovere il rilevatore dal percorso del fascio e, in modalità Live View TA, registrare il segnale ΔOD del campione MOF in diversi punti dello spettro TA subito dopo la risposta chirp (~2-3 ps). Ripetere i passaggi 6.3.3 e 6.3.4 agli altri quattro livelli di potenza.
NOTA: A volte il segnale è piuttosto debole a livelli di potenza inferiori, quindi se l'opzione è disponibile, aumentare il tempo medio in modalità "live-view" a 5-10 s per ottenere un migliore rapporto segnale-rumore e ridurre le fluttuazioni del segnale del fascio della sonda. Comunemente impostiamo il tempo medio a 2-5 s durante tutte le misurazioni di potenza e registriamo l'OD a una lunghezza d'onda con ogni successivo periodo di media alcune volte per ottenere una deviazione standard a ciascuna potenza. - Tracciare i punti dati registrati come ΔOD rispetto alla potenza incidente nel software di analisi dei dati. Se c'è una risposta di potenza lineare, il grafico risultante forma una linea retta, con l'intercetta y a zero. Se c'è una risposta di potenza non lineare, come previsto, si osservano in genere deviazioni significative da una curva lineare.
- Determinazione della densità di energia che colpisce il campione di sospensione
- Con la dimensione dello spot del fascio della pompa e la potenza incidente che colpisce la sospensione MOF, è possibile determinare la densità di energia approssimativa.
NOTA: ad esempio, un diametro spot approssimativo di 250 μm fornisce un raggio di ~125 μm. Dopo aver convertito il raggio in cm, è possibile calcolare l'area superficiale dello spot: A = πr 2 = π(0,0125 cm)2 ≈ 0,0005 cm 2. Dividendo la potenza incidente (ad esempio, 30 μW) per la frequenza di ripetizione del laser (500 Hz) si ottiene un'energia media per impulso di 0,06 μJ. Infine, dividendo l'energia media per impulso con la superficie spot, si ottiene una densità media di energia per impulso di 120 μJ·cm-2. La densità di energia ideale è quella che fornisce un segnale TA adeguato mentre cade in un intervallo lineare di potenza della pompa; Tuttavia, se è possibile utilizzare una potenza inferiore senza sacrificare troppo segnale, dovrebbe essere utilizzata. Un ΔmOD di ~ 1 a <10 ps è un buon compromesso tra segnale e potenza della pompa.
- Con la dimensione dello spot del fascio della pompa e la potenza incidente che colpisce la sospensione MOF, è possibile determinare la densità di energia approssimativa.
- Esecuzione di misurazioni TA ultraveloci
- Con il campione MOF nel supporto, i fasci della pompa e della sonda sovrapposti e una potenza di eccitazione ideale scelta per il campione, eseguire misure ufTA.
- Controllare la finestra Live View e assicurarsi che il tempo zero sia impostato correttamente sull'inizio del cinguettio del rilevatore.
NOTA: quando si passa dal campione standard al campione MOF, il tempo zero potrebbe essere leggermente spostato, quindi è necessario controllare di nuovo. - Uscire dalla finestra Live View per accedere al software principale dello spettrometro. Assicurarsi che la sospensione MOF fornisca uno spettro TA ottimale per tutta la finestra temporale scansionata impostando i parametri per una scansione rapida e facendo clic sul pulsante Start . I tipici parametri di scansione rapida sono una finestra temporale da -5 ps a 8.000 ps, una scansione, 100 punti dati, una mappa dei punti esponenziale (cioè i 100 punti dati registrati in incrementi che si adattano a una curva esponenziale) e un tempo di integrazione di 0,1 s.
- Una volta che lo spettro ufTA a scansione rapida è terminato e sembra complessivamente buono, modificare i parametri di scansione per una misurazione di qualità superiore e fare clic sul pulsante Start . I parametri tipici sono una finestra temporale da -5 ps a 8.000 ps, tre scansioni, 200-300 punti dati, una mappa dei punti esponenziale e un tempo di integrazione di 2-3 s.
NOTA: Si consiglia generalmente che il tempo di misurazione non superi 1 ora per evitare un degrado prolungato, specialmente a potenze più elevate. - Una volta terminato lo spettro ufTA di alta qualità, estrarre il campione dal supporto del campione e misurare lo spettro di assorbimento del campione per garantire una degradazione minima. Confermare ulteriormente la degradazione minima facendo passare la sospensione attraverso un filtro a siringa da 20 nm (tabella dei materiali) e misurare nuovamente lo spettro di assorbimento.
7. Preparazione dei MOF per le misurazioni delle emissioni
- A seconda della lunghezza d'onda di eccitazione, l'EPN2 emette fluorescenza e viene di conseguenza omessa da questa procedura per ottenere i veri spettri di emissione e la cinetica della sospensione MOF. Inoltre, il processo di filtrazione della siringa nei passaggi 1.7 e 1.8 viene omesso.
NOTA: queste omissioni non influiscono sensibilmente sulle misurazioni delle emissioni. - Pesare 1 mg di MOF e trasferirlo in un flaconcino pulito. Trasferire 3-4 mL di DMF nel flaconcino contenente MOF. Ripetere il passaggio 1.3.
- Misurare lo spettro di assorbanza della sospensione MOF e diluire la sospensione fino a raggiungere un OD di 0,1-0,2 alla lunghezza d'onda di eccitazione (sezione 2).
- Eseguire la suddetta procedura di spurgo (sezione 3). La sospensione MOF è ora pronta per le misurazioni di fluorescenza.
8. Misurazioni delle emissioni MOF
- Accendere il fluorimetro e la lampada ad arco (tabella dei materiali, figura supplementare 2). Aprire il software del fluorimetro e selezionare la modalità di emissione. Posizionare la sospensione MOF spurgata nel supporto del campione e mescolare moderatamente.
- Con la lunghezza d'onda di eccitazione stabilita al punto 7.3, impostare le fessure monocromatiche di eccitazione ed emissione a 5 nm come punto di partenza ed eseguire una scansione di emissione superficiale con un tempo di integrazione di 0,1 s.
- Una volta che le larghezze di banda di emissione sono state ottimizzate per fornire un buon segnale (conteggi di >10.000), misurare lo spettro di emissione MOF utilizzando un tempo di integrazione di 1 s (o più). Quindi, misurare lo spettro di eccitazione del MOF a una lunghezza d'onda di emissione selezionata. Assicurarsi che lo spettro di eccitazione sia quasi identico allo spettro di assorbimento MOF.
- Chiudere la fessura della lampada ad arco e passare dalla modalità dello strumento a TCSPC (conteggio di singoli fotoni correlato al tempo) sul software.
- Selezionare uno dei LED utilizzati per TCSPC con la lunghezza d'onda di eccitazione desiderata e collegarlo a una finestra della camera di campionamento perpendicolare alla finestra del rilevatore. Collegare i fili necessari al LED per integrarlo nel fluorimetro.
- Impostare lo strumento sulla lunghezza d'onda di emissione desiderata, la larghezza di banda a 5 nm (regolare se necessario) e la finestra temporale a 150 ns come punto di partenza (può essere abbreviata a seconda della durata del campione). Applicare queste impostazioni e avviare le misurazioni TCSPC dalla finestra del software.
NOTA: un punto di arresto generale per la maggior parte delle misurazioni TCSPC è quando i conteggi massimi hanno raggiunto un valore di 10.000. Inoltre, la velocità ottimale di conteggio del rilevatore è dell'1% -5% della frequenza di ripetizione dei LED per seguire le statistiche di Poisson. Consultare il produttore del LED TCSPC per ottenere le specifiche del dispositivo, se non già fornite.
- Impostare lo strumento sulla lunghezza d'onda di emissione desiderata, la larghezza di banda a 5 nm (regolare se necessario) e la finestra temporale a 150 ns come punto di partenza (può essere abbreviata a seconda della durata del campione). Applicare queste impostazioni e avviare le misurazioni TCSPC dalla finestra del software.
Risultati
Gli spettri elettronici di assorbimento di PCN-222(fb) con e senza PNH2 e filtraggio sono mostrati nella Figura 4. Il MOF senza PNH2 era solo sonicato e diluito. Quando si confrontano i due spettri, la più grande differenza è la minimizzazione della dispersione della linea di base, che si presenta come un ampio assorbimento verso l'alto con lunghezze d'onda decrescenti e amplia anche le transizioni elettroniche in modo abbastanza evidente. Per un ulteriore confronto, ...
Discussione
Mentre i risultati e il protocollo di cui sopra delineano linee guida generali per ridurre al minimo la dispersione dai MOF nella caratterizzazione spettroscopica, esiste un'ampia variabilità nella dimensione e nella struttura delle particelle MOF che influisce sui risultati spettroscopici e quindi offusca i metodi di interpretazione. Per aiutare a chiarire l'interpretazione e alleviare lo sforzo che deriva dall'analisi dei dati spettroscopici MOF, è fondamentale trovare una procedura per rendere i MOF il più piccoli ...
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dal Dipartimento dell'Energia nell'ambito della sovvenzione DE-SC0012446.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 cm cuvette sample mount (SM1) | Edinburgh Instruments | n/a | Contact company |
| 1 mL disposable syringes | EXELINT | 26044 | |
| 10 mL disposable syringes | EXELINT | 26252 | |
| 1-dram vials | FisherSci | CG490001 | |
| 20 nm syringe filters | VWR | 28138-005 | The filters are made by Whatman/Cytiva, and their catalog number is 6809-1002 |
| 200 nm syringe filters | Cytiva, Whatman | 6784-1302 | |
| Absorption spectrophotometer | Agilent | Cary 5000 Spectrophotometer | Contact company |
| Acetronitrile (ACN) | FisherSci | AA36423 | |
| Ar gas tank | Linde/PraxAir | P-4563 | |
| bis amino-terminated polyethylene glycol (PNH2) | Sigma-Aldrich | 452572 | MOF suspending agent |
| Clamping sample mount for nsTA (SM2) | Ultrafast Systems | n/a | Contact company |
| Concave lens for telescope(CCL1) | Thorlabs | LD1613-A-ML | |
| Convex lens for telescope (CVL1) | Thorlabs | LA1708-A-ML | |
| Custom 1 cm optical cell with 24/40 outer joint | QuarkGlass | QSE-1Q10-2440 (Spectrosil Cat #1-Q-10 | We requested the 1 cm cell to have a joint |
| Custom 2mm optical cell with 14/20 outer joint | QuarkGlass | QSE-1Q2-1420 (Spectrosil Cat # 1-Q-2) | We requested the 2 mm cell to have a joint |
| Dimethylformamide (DMF) | FisherSci | D119 | |
| Dye laser (Nd:YAG pumped) for 415 nm output | Sirah | CobraStretch | |
| Dye laser dye, Exalite 417 | Luxottica | 4170 | |
| Femtosecond laser | Coherent | Astrella | |
| Fluorimeter | Photon Technology Inc. (Horiba) | QuantaMaster QM-200-4E | |
| Fluorimeter arc lamp, 75 W | Newport | 6251NS | |
| Fluorimeter PMT | Hamamatsu | 1527 | |
| Fluorimeter Software | PTI/Horiba | FelixGX | |
| Fluorimeter TCSPC Module | Becker & Hickl GmbH | PMH-100 | |
| lens mounts for telescope | Thorlabs | LMR1 | |
| Long purging needles | STERiJECT | PRE-22100 | |
| Magnetic stirrer | Ultrafast Systems | n/a | Contact company |
| mirror 1 (MM1) 350-700 nm | Newport | 10Q20BB.1 | |
| MM1 mount | Thorlabs | KM100 | |
| MM1 post | Thorlabs | TR2 | |
| MM1 post holder | Thorlabs | PH1.5 | |
| MM2 mount | Thorlabs | MFM05 | |
| MM2,3 mirrors | thorlabs | BB03-E02 | |
| MM2,3 post | Thorlabs | MS3R | |
| MM2,3 post bases | Thorlabs | MBA1 | |
| MM2,3 post holders | Thorlabs | MPH50 | |
| MM3 mount | Thorlabs | MK05 | |
| mounting posts for telescope optics | Thorlabs | TR4 | |
| Nanosecond TA Nd:YAG lasers | Spectra-Physics | QuantaRay INDI Nd:YAG | |
| Nanosecond TA spectrometer | Edinburgh Instruments | LP980 | |
| nsTA ICCD camera | Oxford Instruments | Andor iStar ICCD camera | Contact company |
| nsTA PMT | Hamamatsu | R928 | |
| Optical parametric amplifier | Ultrafast Systems | Apollo | |
| Parafilm | FisherSci | S37440 | |
| Pinhole wheel | Thorlabs | PHW16 | |
| Pinhole wheel post base | Thorlabs | CF125C | |
| Pinhole wheel post holder | Thorlabs | PH1.5 | |
| Pinhole wheel post/mount assembly | Thorlabs | NDC-PM | |
| post bases for telescope optics | Thorlabs | CF125C | |
| post holders for telescope optics | Thorlabs | PH4 | |
| Power detector for ns TA | Thorlabs | S310C | |
| Prism assembly (P2,3) | Edinburgh Instruments | n/a | Contact company |
| Prism mount (P1) | OWIS | K50-FGS | |
| Prism post (P1) | Thorlabs | TR4 | |
| Prism post base (P1) | Thorlabs | CF125C | |
| Prism post holder (P1) | Thorlabs | PH4 | |
| Quartz prisms (P1-P3) | Newport | 10SR20 | |
| Rubber outer joint septa (14/20) | VWR | 89097-540 | |
| Rubber outer joint septa (24/40) | ChemGlass | CG-3022-24 | |
| Sonication tip | Branson | product discontinued | Closest alternative is 1/8" diam. tip from iUltrasonic |
| Square ND filters | Thorlabs | NEK01S | |
| Stir bars | StarnaCells/FisherSci | NC9126395 | |
| Thorlabs power detector for ufTA | Thorlabs | S401C | |
| Thorlabs power meter | Thorlabs | PM100D | |
| Tip sonicator | Branson | Digital Sonifer 450, product discontinued | Closest alternative is SFX550 from iUltrasonic |
| Tygon tubing | Grainger | 8Y589 | |
| ufTA ND filter wheel | Thorlabs | NDC-25C-2-A | |
| ufTA ND filter wheel mount | Thorlabs | NDC-PM | |
| ufTA ND filter wheel post | Thorlabs | PH2 | |
| ufTA ND filter wheel post base | Thorlabs | CF125C | |
| ufTA pump alignment mirror | Thorlabs | PF10-03-F01 | |
| Ultrafast TA telescope assembly | Ultrafast Systems | n/a | Contact company |
| Ultrafast transient absorption spectrometer | Ultrafast Systems | HeliosFire | |
| Xe arc probe lamp | OSRAM | 4050300508788 |
Riferimenti
- Zhou, H. -. C., Long, J. R., Yaghi, O. M. Introduction to metal-organic frameworks. Chemical Reviews. 112 (2), 673-674 (2012).
- Li, H., et al. Recent advances in gas storage and separation using metal-organic frameworks. Materials Today. 21 (2), 108-121 (2018).
- Xie, L. S., Skorupskii, G., Dincă, M. Electrically conductive metal-organic frameworks. Chemical Reviews. 120 (16), 8536-8580 (2020).
- Ye, Y., Zhao, Y., Sun, Y., Cao, J. Recent progress of metal-organic framework-based photodynamic therapy for cancer treatment. International Journal of Nanomedicine. 17, 2367-2395 (2022).
- Gibbons, B., Cai, M., Morris, A. J. A potential roadmap to integrated metal organic framework artificial photosynthetic arrays. Journal of the American Chemical Society. 144 (39), 17723-17736 (2022).
- Wang, Q., Gao, Q., Al-Enizi, A. M., Nafady, A., Ma, S. Recent advances in MOF-based photocatalysis: environmental remediation under visible light. Inorganic Chemistry Frontiers. 7 (2), 300-339 (2020).
- Bavykina, A., et al. Metal-organic frameworks in heterogeneous catalysis: recent progress, new trends, and future perspectives. Chemical Reviews. 120 (16), 8468-8535 (2020).
- Wang, C., Xie, Z., deKrafft, K. E., Lin, W. Doping metal-organic frameworks for water oxidation, carbon dioxide reduction, and organic photocatalysis. Journal of the American Chemical Society. 133 (34), 13445-13454 (2011).
- Wang, Q., Astruc, D. State of the art and prospects in metal-organic framework (MOF)-based and MOF-derived nanocatalysis. Chemical Reviews. 120 (2), 1438-1511 (2020).
- Lan, G., et al. Electron injection from photoexcited metal-organic framework ligands to ru2 secondary building units for visible-light-driven hydrogen evolution. Journal of the American Chemical Society. 140 (16), 5326-5329 (2018).
- Benseghir, Y., et al. Unveiling the mechanism of the photocatalytic reduction of CO2 to formate promoted by porphyrinic Zr-based metal-organic frameworks. Journal of Materials Chemistry A, Materials for Energy and Sustainability. 10 (35), 18103-18115 (2022).
- Rowe, J. M., et al. Sensitized photon upconversion in anthracene-based zirconium metal-organic frameworks. Chemical Communications. 54 (56), 7798-7801 (2018).
- Gharaati, S., et al. Triplet-triplet annihilation upconversion in a MOF with acceptor-filled channels. Chemistry. 26 (5), 1003-1007 (2020).
- Wang, F., et al. Transformable upconversion metal-organic frameworks for near-infrared light-programmed chemotherapy. Chemical Communications. 57 (63), 7826-7829 (2021).
- Roy, I., et al. Photon upconversion in a glowing metal-organic framework. Journal of the American Chemical Society. 143 (13), 5053-5059 (2021).
- Park, J., Xu, M., Li, F., Zhou, H. -. C. 3D long-range triplet migration in a water-stable metal-organic framework for upconversion-based ultralow-power in vivo imaging. Journal of the American Chemical Society. 140 (16), 5493-5499 (2018).
- Lin, S., et al. Photoelectrochemical alcohol oxidation by mixed-linker metal-organic frameworks. Faraday Discussions. 225, 371-383 (2020).
- Jiang, Z. W., Zhao, T. T., Li, C. M., Li, Y. F., Huang, C. Z. 2D MOF-based photoelectrochemical aptasensor for SARS-CoV-2 spike glycoprotein detection. ACS Applied Materials & Interfaces. 13 (42), 49754-49761 (2021).
- Shaikh, S. M., et al. Role of a 3D structure in energy transfer in mixed-ligand metal-organic frameworks. The Journal of Physical Chemistry C. 125 (42), 22998-23010 (2021).
- Shaikh, S. M., et al. Light harvesting and energy transfer in a porphyrin-based metal organic framework. Faraday Discussions. 216, 174-190 (2019).
- Logan, M. W., et al. Systematic variation of the optical bandgap in titanium-based isoreticular metal-organic frameworks for photocatalytic reduction of CO2 under blue light. Journal of Materials Chemistry A, Materials for Energy and Sustainability. 5 (23), 11854-11863 (2017).
- Zhang, Q., et al. Förster energy transport in metal-organic frameworks is beyond step-by-step hopping. Journal of the American Chemical Society. 138 (16), 5308-5315 (2016).
- Kent, C. A., et al. Energy transfer dynamics in metal-organic frameworks. Journal of the American Chemical Society. 132 (37), 12767-12769 (2010).
- Lin, J., et al. Triplet excitation energy dynamics in metal-organic frameworks. The Journal of Physical Chemistry C. 117 (43), 22250-22259 (2013).
- Li, X., Yu, J., Gosztola, D. J., Fry, H. C., Deria, P. Wavelength-dependent energy and charge transfer in MOF: a step toward artificial porous light-harvesting system. Journal of the American Chemical Society. 141 (42), 16849-16857 (2019).
- White, T. A., Arachchige, S. M., Sedai, B., Brewer, K. J. Emission spectroscopy as a probe into photoinduced intramolecular electron transfer in polyazine bridged Ru(II),Rh(III) supramolecular complexes. Materials. 3 (8), 4328-4354 (2010).
- Miller, J. N. Fluorescence energy transfer methods in bioanalysis. Analyst. 130 (3), 265-270 (2005).
- Cao, W., Tang, Y., Cui, Y., Qian, G. Energy transfer in metal-organic frameworks and its applications. Small Structures. 1 (3), 2000019 (2020).
- Lan, G., et al. Titanium-based nanoscale metal-organic framework for type i photodynamic therapy. Journal of the American Chemical Society. 141 (10), 4204-4208 (2019).
- Chen, D., Jin, Z., Xing, H. Titanium-porphyrin metal-organic frameworks as visible-light-driven catalysts for highly efficient sonophotocatalytic reduction of Cr(VI). Langmuir. 38 (40), 12292-12299 (2022).
- Berera, R., van Grondelle, R., Kennis, J. T. M. Ultrafast transient absorption spectroscopy: principles and application to photosynthetic systems. Photosynthesis Research. 101 (2-3), 105-118 (2009).
- Brown, A. M., McCusker, C. E., McCusker, J. K. Spectroelectrochemical identification of charge-transfer excited states in transition metal-based polypyridyl complexes. Dalton Transactions. 43 (47), 17635-17646 (2014).
- Farr, E. P., et al. Introduction to time-resolved spectroscopy: nanosecond transient absorption and time-resolved fluorescence of eosin B. Journal of Chemical Education. 95 (5), 864-871 (2018).
- Pattengale, B., Ostresh, S., Schmuttenmaer, C. A., Neu, J. Interrogating light-initiated dynamics in metal-organic frameworks with time-resolved spectroscopy. Chemical Reviews. 122 (1), 132-166 (2022).
- Santaclara, J. G., et al. Organic linker defines the excited-state decay of photocatalytic MIL-125(Ti)-type materials. ChemSusChem. 9 (4), 388-395 (2016).
- Hanna, L., Long, C. L., Zhang, X., Lockard, J. V. Heterometal incorporation in NH2-MIL-125(Ti) and its participation in the photoinduced charge-separated excited state. Chemical Communications. 56 (78), 11597-11600 (2020).
- Gutierrez, M., Cohen, B., Sánchez, F., Douhal, A. Photochemistry of Zr-based MOFs: ligand-to-cluster charge transfer, energy transfer and excimer formation, what else is there. Physical Chemistry Chemical Physics. 18 (40), 27761-27774 (2016).
- Adams, M., et al. Highly efficient one-dimensional triplet exciton transport in a palladium-porphyrin-based surface-anchored metal-organic framework. ACS Applied Materials & Interfaces. 11 (17), 15688-15697 (2019).
- Hassan, Z. M., et al. Spectroscopic investigation of bianthryl-based metal-organic framework thin films and their photoinduced topotactic transformation. Advanced Materials Interfaces. 9 (13), 2102441 (2022).
- Li, X., et al. Ultrafast relaxation dynamics in zinc tetraphenylporphyrin surface-mounted metal organic framework. The Journal of Physical Chemistry C. 122 (1), 50-61 (2018).
- Triggiani, L., et al. Excitation-dependent ultrafast carrier dynamics of colloidal tio2 nanorods in organic solvent. The Journal of Physical Chemistry C. 118 (43), 25215-25222 (2014).
- Pu, Y., Cai, F., Wang, D., Wang, J. -. X., Chen, J. -. F. Colloidal synthesis of semiconductor quantum dots toward large-scale production: a review. Industrial & Engineering Chemistry Research. 57 (6), 1790-1802 (2018).
- Zhou, L. -. L., et al. One-pot synthetic approach toward porphyrinatozinc and heavy-atom involved Zr-NMOF and its application in photodynamic therapy. Inorganic Chemistry. 57 (6), 3169-3176 (2018).
- Zhao, Y., et al. Metal-organic frameworks with enhanced photodynamic therapy: synthesis, erythrocyte membrane camouflage, and aptamer-targeted aggregation. ACS Applied Materials & Interfaces. 12 (21), 23697-23706 (2020).
- Zeng, J. -. Y., et al. π-extended benzoporphyrin-based metal-organic framework for inhibition of tumor metastasis. ACS Nano. 12 (5), 4630-4640 (2018).
- Cheng, Q., Debnath, S., Gregan, E., Byrne, H. J. Ultrasound-assisted SWNTs dispersion: effects of sonication parameters and solvent properties. The Journal of Physical Chemistry C. 114 (19), 8821-8827 (2010).
- Baig, Z., et al. Investigation of tip sonication effects on structural quality of graphene nanoplatelets (GNPs) for superior solvent dispersion. Ultrasonics Sonochemistry. 45, 133-149 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon