Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un guide technique pour effectuer des mesures spectroscopiques sur des structures organométalliques
Dans cet article
Résumé
Ici, nous utilisons un stabilisateur de polymère pour préparer des suspensions de structure organométallique (MOF) qui présentent une dispersion nettement réduite dans leurs spectres d’absorption à l’état fondamental et transitoire. Avec ces suspensions MOF, le protocole fournit diverses lignes directrices pour caractériser les MOF par spectroscopie afin de produire des données interprétables.
Résumé
Les structures organométalliques (MOF) offrent une plate-forme unique pour comprendre les processus pilotés par la lumière dans les matériaux à semi-conducteurs, compte tenu de leur accordabilité structurelle élevée. Cependant, la progression de la photochimie basée sur les MOF a été entravée par la difficulté de caractériser spectralement ces matériaux. Étant donné que les MOF ont généralement une taille supérieure à 100 nm, ils sont sujets à une diffusion excessive de la lumière, ce qui rend les données provenant d’outils analytiques précieux tels que l’absorption transitoire et la spectroscopie d’émission presque ininterprétables. Pour obtenir des informations significatives sur les processus photochimiques et physiques basés sur les MOF, une attention particulière doit être accordée à la préparation appropriée des MOF pour les mesures spectroscopiques, ainsi qu’aux configurations expérimentales qui recueillent des données de meilleure qualité. Compte tenu de ces considérations, le présent guide fournit une approche générale et un ensemble de lignes directrices pour l’étude spectroscopique des MOF. Le guide aborde les sujets clés suivants : (1) méthodes de préparation des échantillons, (2) techniques/mesures spectroscopiques avec des MOF, (3) configurations expérimentales, (3) expériences de contrôle et (4) caractérisation de la stabilité après l’exécution. Avec une préparation appropriée des échantillons et des approches expérimentales, les progrès pionniers vers la compréhension fondamentale des interactions lumière-MOF sont beaucoup plus réalisables.
Introduction
Les structures organométalliques (MOF) sont composées de nœuds d’oxyde métallique liés par des molécules organiques, qui forment des structures poreuses hiérarchiques lorsque leurs parties constitutives réagissent ensemble dans des conditions solvothermiques1. Les MOF poreux permanents ont été signalés pour la première fois au début des années 2000 et, depuis lors, le domaine en plein essor s’est élargi pour englober un large éventail d’applications, compte tenu de l’accordabilité unique de leurs composants structurels 2,3,4,5,6,7. Au cours de la croissance du domaine des MOF, une poignée de chercheurs ont incorporé des matériaux photoactifs dans les nœuds, les ligands et les pores des MOF pour exploiter leur potentiel dans les processus pilotés par la lumière, tels que la photocatalyse 8,9,10,11, la conversion ascendante12,13,14,15,16 et la photoélectrochimie 17,18. Une poignée de processus entraînés par la lumière des MOF tournent autour du transfert d’énergie et d’électrons entre donneurs et accepteurs 17,19,20,21,22,23,24,25. Les deux techniques les plus couramment utilisées pour étudier l’énergie et le transfert d’électrons dans les systèmes moléculaires sont la spectroscopie d’émission et d’absorption transitoire26,27.
Une grande partie de la recherche sur les MOF s’est concentrée sur la caractérisation des émissions, étant donné la facilité relative de préparation des échantillons, d’exécution des mesures et d’analyse (relativement) simple 19,22,23,24,28. Le transfert d’énergie se manifeste généralement par une perte d’intensité et de durée de vie des émissions du donneur et une augmentation de l’intensité d’émission de l’accepteur chargé dans le squelette MOF 19,23,28. La preuve du transfert de charge dans un MOF se manifeste par une diminution du rendement quantique d’émission et de la durée de vie du chromophore dans le MOF29,30. Bien que la spectroscopie d’émission soit un outil puissant dans l’analyse des MOF, elle n’aborde qu’une partie des informations nécessaires pour présenter une compréhension mécaniste complète de la photochimie MOF. La spectroscopie d’absorption transitoire peut non seulement soutenir l’existence d’un transfert d’énergie et de charge, mais la méthode peut également détecter les signatures spectrales associées aux comportements d’état excité non émissif singulet et triplet, ce qui en fait l’un des outils les plus polyvalents pour la caractérisation31,32,33.
La principale raison pour laquelle des techniques de caractérisation plus robustes comme la spectroscopie d’absorption transitoire sont rarement appliquées aux MOF est due à la difficulté de préparer des échantillons avec une diffusion minimale, en particulier avec des suspensions34. Dans les quelques études réalisant avec succès l’absorption transitoire sur les MOF, les MOF ont une taille de < 500 nm, à quelques exceptions près, soulignant l’importance de réduire la taille des particules pour minimiser la dispersion 15,21,25,35,36,37. D’autres études utilisent des films minces MOF17 ou SURMOF38,39,40 pour contourner le problème de la dispersion; Cependant, du point de vue de l’applicabilité, leur utilisation est assez limitée. En outre, certains groupes de recherche ont commencé à fabriquer des films polymères de MOF avec du Nafion ou du polystyrène34, le premier soulevant certaines préoccupations pour la stabilité étant donné les groupes sulfonate très acides sur Nafion. En nous inspirant de la préparation de suspensions de semi-conducteurs colloïdaux 41,42, nous avons rencontré un grand succès en utilisant des polymères pour aider à suspendre et à stabiliser les particules MOF pour les mesures spectroscopiques11. Dans ce travail, nous établissons des lignes directrices largement applicables à suivre lorsqu’il s’agit de préparer des suspensions MOF et de les caractériser avec des techniques de spectroscopie d’émission, de nanoseconde (ns) et d’absorption transitoire (TA) ultrarapide (uf).
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Préparation de suspensions de MOF à l’aide d’un stabilisant polymère
- Peser 50 mg de polyéthylèneglycol à terminaison bis-amino-terminée (HPN2, Mn ~1 500) (voir le tableau des matières) et transférer dans un flacon à une dram (tableau des matières). Peser 1 à 5 mg de PCN-222(fb) (voir protocolesynthétique 11) et les placer dans le même flacon que PNH2.
REMARQUE : Pour obtenir les meilleures suspensions MOF possibles, les conditions synthétiques requises pour obtenir la taille des particules MOF doivent être égales ou inférieures à 1 μm. - Trouvez un solvant approprié (sinon de l’eau, utilisez un solvant anhydre tel que le diméthylformamide [DMF] ou l’acétonitrile [ACN]; voir le tableau des matériaux) pour suspendre le MOF, en vous assurant que la fenêtre du solvant est suffisamment large pour que le solvant lui-même ne soit pas excité avec la longueur d’onde choisie. Transférer 1 à 3 mL de solvant dans le flacon à l’aide d’une autopipette munie d’un embout de pipette approprié.
NOTE: Les solvants couramment utilisés mentionnés ci-dessus ont de larges fenêtres de solvant - CH3CN: coupure de 200 nm à haute énergie; et DMF : coupure de 270 nm. Les solvants ayant des indices de réfraction plus élevés (1,4-1,5), comme le DMF, le DMSO et le toluène, peuvent être utilisés pour aider à minimiser la diffusion de la lumière en étant plus étroitement alignés avec l’indice de réfraction du verre de quartz (environ 1,46-1,55), minimisant ainsi la flexion de la lumière dans des directions indésirables lors du passage dans la cuvette. - À l’aide d’un sonicateur à pointe (voir le tableau des matériaux), sonicer le contenu du flacon pendant 2 à 5 minutes à une amplitude de 20 % à 30 % (c.-à-d. la distance à laquelle la pointe du sonicateur se déplace longitudinalement, généralement ~60 μm pour une sonde de 3 mm de diamètre à 30 % d’amplitude) avec des intervalles de 2 s allumés et 2 s éteints. Cette procédure sert à briser les agrégats MOF et aide à recouvrir les particules de MOF de polymère. Assurez-vous que la suspension MOF est bien dispersée et homogène à la fin du processus de sonication.
REMARQUE: Les temps de sonication varient en fonction de la façon dont le MOF se disperse intrinsèquement. - Ouvrez une nouvelle seringue en plastique de 10 ml (table des matières) et aspirez la suspension dans la seringue. Retirez l’aiguille de la seringue et remplacez-la par un filtre à seringue à mailles de 200 nm en polytétrafluoroéthylène (PTFE) (tableau des matériaux). Passez la suspension à travers le filtre de la seringue dans un nouveau flacon propre. La suspension résultante est prête pour les mesures spectroscopiques d’absorption transitoire.
REMARQUE: Étant donné que la taille moyenne des particules de certains MOF dépasse 200 nm, le choix de la taille appropriée est à la discrétion de l’utilisateur.
2. Préparation de suspensions MOF filtrées pour les mesures d’absorption transitoire à la nanoseconde (nsTA)
- Avec la suspension MOF filtrée obtenue dans la section 1, le spectre d’absorption de la suspension doit être obtenu (Tableau des matériaux). Lavez une cuvette (longueur de trajet de 1 cm) capable de sceller et de purger (tableau des matériaux) avec du solvant trois à cinq fois, puis remplissez-la de 3 ml de DMF.
- Avec un spectrophotomètre d’absorption, choisissez une région de longueur d’onde pour mesurer le solvant et la suspension. Mesurez le spectre ultraviolet-visible (UV-Vis) blanc du solvant dans la cuvette et définissez-le comme un balayage de fond à soustraire des scans d’échantillon. Vider le contenu en solvant de la cuvette et transférer la suspension MOF dans la cuvette.
NOTE: Le spectre d’absorption électronique du stabilisateur PNH2 (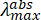 ~250 nm) a une queue d’absorption faible qui persiste jusqu’à 450 nm, avec une absorbance de ~0,01 à 450 nm à la concentration initiale.
~250 nm) a une queue d’absorption faible qui persiste jusqu’à 450 nm, avec une absorbance de ~0,01 à 450 nm à la concentration initiale. - Mesurer le spectre d’absorption de la suspension MOF initiale, en gardant à l’esprit la longueur d’onde souhaitée nécessaire pour exciter l’échantillon MOF. Si la suspension MOF a une absorbance ou une densité optique (DO) >1 à la longueur d’onde d’excitation désirée, diluer avec du solvant et mesurer le spectre d’absorbance jusqu’à ce que la DO soit ≤1 à la longueur d’onde d’excitation.
NOTE: Pour les mesures d’absorption transitoire à angle étroit, répéter les mesures d’absorption pour obtenir une DO appropriée à la longueur d’onde d’excitation à l’aide d’une cellule de 2 mm (Tableau des matériaux). Pour les mesures d’absorption transitoire nanosecondes des MOF, une absorbance ou OD de 0,1-1 à la longueur d’onde d’excitation est nécessaire pour suivre la loi de Beer. La DO requise est large parce que certains échantillons absorbent fortement dans différentes régions. Les porphyrines en sont un parfait exemple. Les porphyrines ont une forte transition étroite de bande de Soret entre 400 et 450 nm, tandis que leurs transitions en bande Q entre 500 et 800 nm sont assez faibles. Si l’on voulait s’enthousiasmer à l’une de leurs bandes Q, préparer une solution avec un OD ~0,5 à l’une des bandes Q présenterait par conséquent une absorption de bande Soret >3, et le détecteur d’absorption transitoire ne serait pas en mesure de traiter quantitativement les changements dans cette région. En fin de compte, il est à la discrétion de l’utilisateur de déterminer la longueur d’onde d’excitation et l’amplitude d’absorbance appropriées qui permettent des mesures quantitatives dans la fenêtre spectrale souhaitée.
3. Purge de la suspension du MOF
- Une fois la suspension MOF ajustée pour avoir le spectre d’absorbance souhaité pour les mesures TA, placez une barre d’agitation de 2 mm x 8 mm (table des matériaux) dans la cuvette et scellez le joint de cuvette d’entrée avec un septum en caoutchouc.
- Prenez une seringue en plastique de 1 ml (tableau des matériaux), coupez-en la moitié avec une paire de ciseaux et conservez la moitié de la seringue qui permet d’y attacher des aiguilles.
- Avec une extrémité d’un tube flexible fixé à un réservoir Ar ou N2 (tableau des matériaux), insérez la moitié de la seringue dans l’autre extrémité du tube avec l’extrémité de l’aiguille à l’extérieur.
- Enveloppez la tige de la seringue exposée à moitié avec du parafilm (tableau des matériaux) pour créer un joint avec le tube et la seringue. Si un collier de serrage est disponible, il peut être utilisé à la place du parafilm pour créer un joint avec la seringue et le tube de purge.
- Fixez une longue aiguille de purge (3 po, 25 g) (table des matières) à l’extrémité de la seringue et insérez l’aiguille dans la cuvette scellée dans la suspension. Prélevez l’aiguille de la seringue de 1 mL (étape 3.2) et insérez-la dans la cuvette. Allumez le flux Ar ou N2 et purgez la suspension pendant 45 min-1 h.
NOTE: Une technique connue sous le nom de « double purge » est souvent utilisée pour les solvants dont le point d’ébullition est <100 °C. Pour utiliser cette technique, une fiole scellée avec solvant est purgée avec l’aiguille d’entrée, avec une extrémité d’une canule insérée dans l’espace de tête de la fiole et l’autre extrémité de la canule insérée dans la suspension de la cuvette. L’aiguille de sortie est insérée dans l’espace de tête de la cuvette. La purge de cette façon minimise la perte de solvant due à l’évaporation au fil du temps. - Une fois la purge terminée, retirez les aiguilles et enveloppez le septum de la cuvette avec quatre à cinq tranches de parafilm 2 dans (table des matériaux). Mesurer le spectre d’absorption de l’échantillon pour s’assurer qu’il correspond aux normes établies à la section 2. L’échantillon est maintenant prêt pour les mesures d’absorption transitoire.
4. Configuration d’absorption transitoire de la pompe perpendiculaire à la nanoseconde (nsTA)
- Allumez les systèmes de spectromètre laser et nsTA (Tableau des matériaux; Graphique 1). Ajustez la puissance de sortie laser à un niveau suffisamment bas, de sorte que le placement d’une carte de visite blanche dans le trajet du faisceau permette une visibilité claire du point laser, mais pas au point d’être aveuglant.
- Ouvrez à la fois l’obturateur laser mécanique et l’obturateur de faisceau de sonde afin qu’ils soient tous deux sur le trajet du porte-échantillon.
- Ajustez la position verticale et horizontale du faisceau laser (Figure 1, P3), de sorte qu’il frappe le centre du support de cellule d’échantillon (Figure 1, SC1) où l’échantillon sera placé. Utilisez une carte de visite pour confirmer le poste. Placer un filtre à densité neutre (ND) (OD 2; Tableau des matériaux) dans le trajet du faisceau de la sonde.
REMARQUE : Tous les miroirs et prismes présents dans le système nsTA décrit ici sont montés sur des supports cinématiques (Table des matériaux), et les positions des faisceaux sont ajustées en tournant manuellement les boutons verticaux et horizontaux des supports. Une carte blanche plus longue, de 1 cm de large, peut être placée à l’intérieur d’une cuvette vide en SC1 pour faciliter l’alignement. - Placez une carte de visite coupée (~1,5 cm de largeur) dans le porte-échantillon (ou tenez-la dans le porte-échantillon) et inclinez-la sur le porte-échantillon de manière à ce que le faisceau laser et le faisceau de sonde frappent le même côté de la carte de visite. Ajustez la position verticale du faisceau laser (P3) pour obtenir le meilleur chevauchement avec la partie la plus intense du faisceau de la sonde.
- Fermez les volets, retirez le filtre ND et placez l’échantillon dans la chambre d’échantillonnage avec un agitateur magnétique (table des matériaux). Les mesures TA peuvent maintenant être prises.
- Le système et les logiciels utilisés dans ce travail sont fournis dans le tableau des matériaux. Dans la suite logicielle, il y a des boîtes de sélection intitulées Absorption spectrale et Absorption cinétique pour mesurer les spectres TA et la cinétique d’absorption, respectivement. Sélectionnez le bouton Absorption spectrale et sélectionnez le mode de configuration.
- Réglez le temps zéro de l’impulsion laser dans la fenêtre de configuration du logiciel en ajustant le temps d’entrée par incréments de +0,010 μs (par exemple, -0,020 μs, -0,010 μs, 0,000 μs, 0,010 μs, etc.) jusqu’à ce que l’impulsion laser ne soit pas observée dans le spectre du faisceau de la sonde.
- Une fois le temps zéro réglé, optimisez la quantité de lumière frappant le détecteur de dispositif à couplage de charge (CCD) dans la fenêtre de configuration en ajustant la bande passante, le gain et la largeur de la porte pour atteindre un nombre suffisamment élevé pour obtenir un signal adéquat sans saturer le détecteur.
REMARQUE: Nous laissons ce processus à l’utilisateur car les détecteurs varient d’un système à l’autre. - Pour collecter un spectre TA, cliquez sur le bouton Multiple dans l’onglet Absorption spectrale . Assurez-vous que les paramètres de la fenêtre de configuration sont présents dans cette fenêtre. Si l’échantillon émet de la lumière, cliquez sur l’onglet Arrière-plans et cliquez sur le bouton Soustraire l’arrière-plan de fluorescence . Pour un balayage superficiel, réglez les moyennes sur 4 pour vous assurer qu’un spectre TA initial de qualité est obtenu. Si un spectre TA satisfaisant est obtenu, obtenez-en un autre avec plus de moyennes.
- Pour cartographier un spectre TA à différents délais après le temps zéro, sélectionnez le bouton Carte dans l’onglet Absorption spectrale . Assurez-vous que les paramètres d’installation n’ont pas changé dans cet onglet. Entrez les intervalles de temps souhaités pour la cartographie, cliquez sur Appliquer, puis cliquez sur Démarrer pour cartographier les spectres.
- Pour obtenir la cinétique d’absorption aux longueurs d’onde souhaitées, cliquez sur le bouton Absorption cinétique dans le logiciel et cliquez sur le bouton Configuration dans le menu déroulant. Entrez la longueur d’onde qui vous intéresse dans l’onglet Contrôleur de la fenêtre de configuration et ajustez la bande passante à un niveau approprié. Habituellement, une bande passante de 1 nm est un bon point de départ.
- Dans l’onglet Oscilloscope , réglez la fenêtre temporelle du détecteur du tube photomultiplicateur (PMT) afin qu’elle soit suffisamment longue pour voir toute la trace cinétique, depuis avant l’excitation laser jusqu’à la désintégration complète du signal jusqu’à la ligne de base. Un point de départ habituel est une fenêtre de 4 000 ns. Ajustez la plage de tension PMT à un niveau approprié, où toute la trace TA est observable sur l’axe du signal. Une plage de tension de 160 mV est raisonnable pour commencer les mesures. Cliquez sur Appliquer , puis sur Démarrer. Si le signal est trop faible ou si la fenêtre de temps est trop courte ou trop longue, cliquez sur Arrêter et ajustez la bande passante et la fenêtre de temps aux niveaux appropriés, en veillant à ne pas régler la bande passante trop haut pour saturer / endommager le détecteur.
- Une fois la trace cinétique correctement configurée, fermez la fenêtre Configuration et ouvrez la fenêtre Plusieurs dans le menu déroulant après avoir cliqué sur le bouton Absorption cinétique . Vérifiez que les paramètres de la fenêtre Configuration sont les mêmes dans la fenêtre Multiple . Réglez le nombre de mesures souhaité (tirs laser). Habituellement, 20 mesures sont satisfaisantes pour les régions à fort signal du spectre TA. Si l’échantillon émet à la longueur d’onde de la sonde, assurez-vous de cocher le bouton Soustraire l’arrière-plan de fluorescence dans l’onglet Arrière-plans . Cliquez sur Appliquer puis sur Commencer pour collecter la cinétique TA.
REMARQUE: Parfois, effectuer un plus grand nombre de tirs (>40) déplace la ligne de base de la désintégration, positive ou négative, de l’interférence de diffusion de sonde / laser. Si c’est un problème, effectuez un nombre inférieur de tirs (~10-20) et répétez la mesure plusieurs fois pour collecter plusieurs ensembles de données qui peuvent ensuite être moyennés ensemble. - Une fois les mesures d’AT terminées, mesurer ensuite le spectre d’absorption du MOF pour assurer une dégradation minimale.
5. Configuration nsTA à angle étroit
- Parfois, avec les configurations perpendiculaires pompe-sonde, le signal obtenu à partir de la suspension MOF est assez faible (<10 ΔmOD) et fluctue encore de la diffusion en raison du grand volume d’échantillon excité. Pour aider à minimiser les fluctuations du signal et améliorer le signal, des configurations d’absorption transitoire ultrarapides peuvent être appliquées aux configurations nsTA avec une orientation de faisceau pompe-sonde à angle étroit et des longueurs de trajet plus petites (Figure 2).
- Selon la configuration de la chambre d’échantillonnage, on peut focaliser et diriger le faisceau d’excitation de sorte que les faisceaux de la pompe et de la sonde se croisent à des angles de <45°, et donc fournir plus de chevauchement. Pour ce faire, utilisez des optiques de mise au point (Figure 2, lentille concave [CCL] et convexe [CVL]) et des miroirs cinématiques (Figure 2, MM1-3). Mettez le système laser/spectromètre sous tension et répétez les étapes 4.2 et 4.3.
REMARQUE: Bien que l’utilisation de lentilles concaves / convexes soit idéale pour la mise au point optique, un diaphragme optique peut être utilisé à la place de ces composants pour réduire le faisceau. Le rétrécissement du faisceau de cette manière peut être compensé en augmentant la puissance; Cependant, lorsque vous travaillez avec des longueurs d’onde inférieures à 400 nm, la dégradation et le blanchiment de l’iris sont assez fréquents. Certains spectromètres TA n’ont pas de planches à pain qui permettent de monter l’optique dans la chambre d’échantillonnage. Le spectromètre utilisé ici n’a pas de planches d’essai, de sorte que des trous ont été percés et taraudés dans la chambre d’échantillonnage pour mettre en place l’optique (Figure 2, MM1-3). Si le spectromètre est toujours sous garantie, contactez l’équipe d’assistance de l’entreprise pour voir si elle peut s’adapter à une telle configuration. - Pour réduire la taille du spot de faisceau frappant la cuvette de 2 mm (Table des matériaux), installez un télescope galiléen avec une lentille concave (Table des matériaux, CCL1) frappant le laser en premier et une lentille convexe (Table des matériaux, CVL1) frappant le laser en second. Assurez-vous que la distance entre les deux lentilles est approximativement la différence entre les deux distances focales des lentilles.
NOTE: Les lasers Spectra-Physics Quanta Ray utilisés dans ces mesures ont une taille de spot de 1 cm. La taille du spot a été réduite de moitié avec la configuration du télescope galiléen. Pour les lasers qui produisent des mégawatts de puissance, les télescopes galiléens doivent être utilisés exclusivement. Un télescope képlérien (deux lentilles convexes) forme du plasma entre les deux lentilles à des puissances même modestes (~10 mW). - Ouvrez les obturateurs laser et sonde. Remplacez le premier miroir d’obturateur (SM1) par SM2 et placez une carte de note dans le support de serrage SM2, de sorte que son orientation soit complètement orientée vers le faisceau de la sonde. Ensuite, installez une série de mini-miroirs (MM1-3), approximativement comme illustré à la figure 2. Dirigez le faisceau laser entrant en ajustant les boutons tournants sur le support cinématique P3 approximativement sur le centre de MM1. Pour minimiser l’expansion du faisceau laser d’un miroir à l’autre, placez MM2 devant MM1 pour abaisser l’angle de réflexion entre les deux miroirs (Figure 2).
REMARQUE : Pour les alignements laser, une pratique courante consiste à ajuster un miroir/prisme à un miroir de l’emplacement prévu (p. ex., ajuster P2 pour frapper MM1 avec précision). Cependant, P2 dans les expériences discutées ici est une optique stationnaire de guidage de faisceau et ne doit pas être ajustée. Si l’on lui donne la flexibilité, l’alignement doit être effectué avec un composant optique situé à un miroir de l’optique cible. - Lorsque le faisceau frappe approximativement le centre sur MM1, faites pivoter MM1 de sorte que le faisceau laser réfléchi frappe MM2 au centre. Lorsque le faisceau frappe approximativement le centre sur MM2, faites pivoter MM2 de sorte que le faisceau laser réfléchi frappe MM3 au centre. Lorsque le faisceau atteint approximativement le centre sur MM3, faites pivoter MM3 de sorte que le faisceau laser réfléchi frappe la carte de note d’alignement au même endroit que le faisceau de la sonde.
- Ajustez les positions du faisceau laser sur chacun des miroirs et de la carte de notes avec les boutons verticaux et horizontaux sur les miroirs. Assurez-vous que le faisceau a peu ou pas d’écrêtage tout au long de son trajet.
- Répétez les étapes 5.5 et 5.6 à l’aide d’une cuvette de 2 mm avec un joint interne 14/20 (SC2) et un septum en caoutchouc 14/20 (Table des matériaux). Insérez l’échantillon dans un support d’échantillon de serrage (SM2) complètement orienté vers le trajet du faisceau de la sonde. Ajustez les positions du faisceau laser sur chaque miroir et SM2 avec les boutons verticaux et horizontaux des miroirs.
REMARQUE: Pour faciliter le passage des configurations TA perpendiculaires et à angle étroit, un support de miroir cinématique pivotant ou magnétique pour MM1 peut être utilisé à la place d’un support cinématique ordinaire pour éviter d’avoir à réaligner l’optique. L’emplacement des MM2 et MM3 ne doit pas affecter les faisceaux de pompe ou de sonde incidents dans la configuration perpendiculaire. - À l’aide d’un agitateur à profil bas (table des matériaux), agiter modérément l’échantillon et effectuer des mesures TA. Répétez les étapes 4.6-4.14.
REMARQUE: Pour les lasers 1-20 Hz, une puissance inférieure peut souvent être utilisée (~ 1 mJ / impulsion).
6. Mesures ultrarapides d’absorption transitoire (ufTA)
- Alignement des faisceaux de pompe et de sonde pour un chevauchement maximal
- La procédure de suspension du MOF prévue à l’article 1 ne change pas. Les mesures d’absorption pré-TA (section 2) ne changent pas, sauf en utilisant SC2 au lieu de SC1 (Table des matériaux). Si nécessaire, le processus de purge ne change pas non plus.
- Pour aligner les faisceaux de la pompe et de la sonde pour les mesures ufTA, commencez par préparer une solution d’un chromophore bien connu [par exemple, Ru(bpy)32+] dans une cuvette de longueur de trajet de 2 mm avec une DO de 0,5-1 à la longueur d’onde d’excitation. Il n’est pas nécessaire de purger l’échantillon.
REMARQUE: Choisissez un échantillon standard qui présente un spectre TA dans la même région de longueur d’onde que l’échantillon MOF. Souvent, l’éditeur de liens MOF peut être utilisé comme norme. - Mettez sous tension la source de la pompe laser ultrarapide et le spectromètre (Figure 3). Ouvrez le logiciel de l’amplificateur paramétrique optique (le cas échéant) et réglez-le sur la longueur d’onde d’excitation souhaitée. Ouvrez le logiciel du spectromètre ufTA et choisissez une fenêtre de sonde (UV-visible, visible ou proche infrarouge [proche IR]).
REMARQUE: Assurez-vous que l’étage de retard optique est aligné à des délais courts et longs. Selon le système, cela se fait manuellement ou via le logiciel du spectromètre. La plupart des systèmes commerciaux ont une option « Aligner l’étape de retard » dans le logiciel qui peut être cliquée pour l’aligner.
REMARQUE: Si possible, éteignez les lumières ou minimisez les interférences lumineuses lorsque vous observez les faisceaux de la pompe et de la sonde. - Placez la cuvette standard dans le porte-échantillon dans l’alignement du faisceau de la sonde. Ajustez la puissance de la source de la pompe à l’aide d’une roue filtrante ND (Figure 3, ufND) pour voir le faisceau de la pompe si nécessaire. Placez une carte blanche contre le côté de la cuvette face au faisceau de la pompe et de la sonde.
- Ajustez l’emplacement de la pompe sur la carte de note avec les boutons tournants sur le support cinématique, de sorte qu’il soit à la même hauteur verticale que le faisceau de la sonde, et réglez horizontalement la pompe de sorte qu’elle se trouve à moins de 1 mm ou 2 mm à côté du faisceau de la sonde. Sans la carte de notes, affinez les positions verticales et horizontales du faisceau de pompe pour obtenir le signal spectral TA le plus élevé.
- Réglez la mise au point (Figure 3, TS) du faisceau de la pompe, de sorte qu’elle soit à sa plus petite taille de point lorsque vous frappez une cuvette d’échantillon standard. La mise au point est au plus petit point où le signal maximum est obtenu. Une fois le signal spectral le plus élevé obtenu, les faisceaux de la pompe et de la sonde sont alignés de manière optimale.
REMARQUE: Les systèmes ufTA commerciaux (Table of Materials) ont généralement une option Live View qui permet à l’utilisateur de régler le temps zéro et de voir l’ensemble du spectre TA avant de mesurer officiellement l’échantillon.
- Détermination de la taille du spot de la pompe et de la densité d’énergie
- Une fois les faisceaux de la pompe et de la sonde alignés, remplacer le porte-cellule d’échantillon par une roue à trous d’épingle montée (trous de 2 000 à 25 μm; Tableau des matériaux) au point focal du faisceau laser (figure supplémentaire 1, PHW). Assurez-vous que la roue sténopé est presque (sinon exactement) perpendiculaire à la trajectoire du faisceau laser.
- Réglez la roue de sténopé de telle sorte que le faisceau laser traverse le trou d’épingle de 2 000 μm. Installez un détecteur fixé à un capteur de puissance (figure supplémentaire 1, REP) de l’autre côté de la roue sténopé, de sorte que tout le faisceau laser frappe le détecteur.
- Ajustez la puissance de la source de la pompe à l’aide d’une roue filtrante ND afin que le détecteur mesure suffisamment de puissance. Notez la puissance moyenne à cette taille de sténopé.
- Faites pivoter la roue du sténopé à une taille de trou d’épingle plus petite et ajustez la position verticale et horizontale du faisceau laser pour atteindre la puissance maximale de sortie à ce trou d’épingle. Notez la puissance de la taille du sténopé. Répétez cette étape avec des trous d’épingle progressivement plus petits jusqu’à ce que le plus petit trou d’épingle soit atteint.
REMARQUE: Bien que les mesures de sténopé soient davantage une méthode approximative, elles sont suffisantes pour les mesures lorsque l’on les compare à la méthode alternative d’utilisation d’une caméra CCD, qui peut coûter des milliers de dollars. - Dans les logiciels d’analyse de données, tracez les données pour générer la moitié d’une courbe pseudo-gaussienne (ce ne sera pas parfait car le faisceau n’est pas intrinsèquement complètement gaussien). Pour obtenir une courbe symétrique, prenez les mêmes données et collez-les dans l’ordre croissant des tailles de points.
- Multipliez les données par -1, de sorte que le minimum est maintenant le maximum. Tracez les données et ajustez-les à une courbe gaussienne. Diviser la valeur maximale de la courbe ajustée par e2. La largeur de la courbe à 1/e2 est le diamètre approximatif du spot.
- Contrôle linéaire de la réponse de puissance
- Pour s’assurer qu’aucun effet non linéaire n’est présent à un niveau de puissance souhaité (par exemple, processus d’excitation multiphotonique, désintégrations de multiparticules), le signal en plusieurs points du spectre MOF TA juste après la réponse du chirp doit être enregistré à différentes puissances. Déterminez cinq niveaux de puissance pour constituer une courbe.
- Remplacez la roue sténopé par le porte-échantillon et replacez l’échantillon standard dans le support. Répétez l’étape 6.1 (le processus de réalignement devrait être beaucoup plus facile car le faisceau de la pompe n’a été que légèrement ajusté à l’étape 6.2).
- Une fois que les faisceaux de la pompe et de la sonde sont alignés et que l’échantillon MOF est agité dans le porte-échantillon, mesurez et enregistrez la puissance moyenne de la pompe à l’aide d’un capteur de puissance fixé à un détecteur dans le trajet du faisceau de pompe.
- Retirez le détecteur du trajet du faisceau et, en mode Live View TA, enregistrez le signal ΔOD de l’échantillon MOF en différents points du spectre TA juste après la réponse du chirp (~2-3 ps). Répétez les étapes 6.3.3 et 6.3.4 aux quatre autres niveaux de puissance.
REMARQUE: Parfois, le signal est assez faible à des niveaux de puissance inférieurs, donc si l’option est disponible, augmentez le temps de moyenne en mode « live-view » à 5-10 s pour obtenir un meilleur rapport signal sur bruit et réduire les fluctuations du signal du faisceau de sonde. Nous réglons généralement le temps moyen à 2-5 s pour toutes les mesures de puissance et enregistrons le DO à une longueur d’onde à chaque période de calcul de moyenne suivante plusieurs fois pour obtenir un écart type à chaque puissance. - Tracez les points de données enregistrés sous forme de ΔOD par rapport à la puissance incidente dans le logiciel d’analyse de données. S’il y a une réponse de puissance linéaire, le tracé résultant forme une ligne droite, avec l’interception y à zéro. S’il y a une réponse de puissance non linéaire, comme prévu, des écarts significatifs par rapport à une courbe linéaire sont généralement observés.
- Détermination de la densité d’énergie frappant l’échantillon de suspension
- Avec la taille du spot du faisceau de pompe et la puissance incidente frappant la suspension MOF connues, la densité d’énergie approximative peut être déterminée.
REMARQUE : Par exemple, un diamètre de point approximatif de 250 μm fournit un rayon de ~125 μm. Après conversion du rayon en cm, la surface du spot peut être calculée: A = πr 2 = π(0,0125 cm)2 ≈ 0,0005 cm 2. En divisant la puissance incidente (par exemple, 30 μW) par le taux de répétition du laser (500 Hz), on obtient une énergie moyenne par impulsion de 0,06 μJ. Enfin, en divisant l’énergie moyenne par impulsion par la surface du spot, on obtient une densité d’énergie moyenne par impulsion de 120 μJ·cm-2. La densité d’énergie idéale est celle qui fournit un signal TA adéquat tout en tombant dans une plage linéaire de puissance de pompe; Cependant, si une puissance inférieure peut être utilisée sans sacrifier trop de signal, elle doit être utilisée. Un ΔmOD de ~1 à <10 ch est un bon compromis entre le signal et la puissance de la pompe.
- Avec la taille du spot du faisceau de pompe et la puissance incidente frappant la suspension MOF connues, la densité d’énergie approximative peut être déterminée.
- Effectuer des mesures TA ultrarapides
- Avec l’échantillon MOF dans le support, les faisceaux de pompe et de sonde se chevauchent, et une puissance d’excitation idéale choisie pour l’échantillon, effectuez des mesures ufTA.
- Vérifiez la fenêtre Live View et assurez-vous que le temps zéro est correctement réglé sur le début du bip du détecteur.
REMARQUE: Lors de la commutation entre l’échantillon standard et l’échantillon MOF, le temps zéro peut être légèrement décalé, d’où la nécessité de vérifier à nouveau. - Quittez la fenêtre Live View pour accéder au logiciel principal du spectromètre. Assurez-vous que la suspension MOF fournit un spectre TA optimal tout au long de la fenêtre de temps numérisée en définissant les paramètres d’une analyse rapide et en cliquant sur le bouton Démarrer . Les paramètres d’analyse rapide typiques sont une fenêtre temporelle de -5 ps à 8 000 ps, un balayage, 100 points de données, une carte de points exponentiels (c’est-à-dire les 100 points de données enregistrés par incréments qui s’adaptent à une courbe exponentielle) et un temps d’intégration de 0,1 s.
- Une fois que le spectre ufTA à balayage rapide est terminé et semble bon dans l’ensemble, modifiez les paramètres de balayage pour une mesure de meilleure qualité et cliquez sur le bouton Démarrer . Les paramètres typiques sont une fenêtre temporelle de -5 ps à 8 000 ps, trois balayages, 200 à 300 points de données, une carte de points exponentielle et un temps d’intégration de 2 à 3 s.
NOTE: Il est généralement conseillé que le temps de mesure ne dépasse pas 1 h pour éviter une dégradation prolongée, en particulier à des puissances de pompe plus élevées. - Une fois le spectre ufTA de haute qualité terminé, retirez l’échantillon du porte-échantillon et mesurez le spectre d’absorption de l’échantillon pour assurer une faible dégradation. Confirmez en outre la dégradation minimale en faisant passer la suspension à travers un filtre à seringue de 20 nm (Tableau des matériaux) et mesurez à nouveau le spectre d’absorption.
7. Préparation des MOF pour la mesure des émissions
- En fonction de la longueur d’onde d’excitation, PNH2 émet une fluorescence et est par conséquent omis de cette procédure pour obtenir les vrais spectres d’émission et la cinétique de la suspension MOF. De plus, le processus de filtration à la seringue aux étapes 1.7 et 1.8 est omis.
NOTA : Ces omissions n’ont pas d’incidence notable sur les mesures des émissions. - Peser 1 mg de MOF et le transférer dans un flacon propre. Transférer 3 à 4 mL de DMF dans le flacon contenant du MOF. Répétez l’étape 1.3.
- Mesurer le spectre d’absorbance de la suspension MOF et diluer la suspension jusqu’à ce qu’une DO de 0,1 à 0,2 soit atteinte à la longueur d’onde d’excitation (section 2).
- Effectuez la procédure de purge susmentionnée (section 3). La suspension MOF est maintenant prête pour les mesures de fluorescence.
8. Mesures des émissions MOF
- Allumez le fluorimètre et la lampe à arc (tableau des matériaux, figure supplémentaire 2). Ouvrez le logiciel du fluorimètre et sélectionnez le mode d’émission. Placer la suspension MOF purgée dans le porte-échantillon et remuer modérément.
- Avec la longueur d’onde d’excitation établie à l’étape 7.3, régler les fentes du monochromateur d’excitation et d’émission sur 5 nm comme point de départ et effectuer un balayage d’émission superficiel avec un temps d’intégration de 0,1 s.
- Une fois que les largeurs de bande d’émission ont été optimisées pour fournir un bon signal (>10 000 comptes), mesurez le spectre d’émission MOF en utilisant un temps d’intégration de 1 s (ou plus). Ensuite, mesurez le spectre d’excitation du MOF à une longueur d’onde d’émission sélectionnée. Assurez-vous que le spectre d’excitation semble presque identique au spectre d’absorption MOF.
- Fermez la fente de la lampe à arc et passez le mode instrument sur TCSPC (comptage de photons uniques corrélé dans le temps) sur le logiciel.
- Sélectionnez l’une des LED utilisées pour TCSPC avec la longueur d’onde d’excitation souhaitée et fixez-la à une fenêtre de chambre d’échantillonnage perpendiculaire à la fenêtre du détecteur. Fixez les fils nécessaires à la LED pour l’intégrer dans le fluorimètre.
- Réglez l’instrument sur la longueur d’onde d’émission souhaitée, la bande passante sur 5 nm (ajustez si nécessaire) et la fenêtre de temps sur 150 ns comme point de départ (elle peut être raccourcie en fonction de la durée de vie de l’échantillon). Appliquez ces paramètres et démarrez les mesures TCSPC à partir de la fenêtre du logiciel.
NOTA : Un point d’arrêt général pour la plupart des mesures du CTSPC est lorsque les nombres maximaux ont atteint une valeur de 10 000. De plus, le taux optimal de comptage du détecteur est de 1% à 5% du taux de répétition des LED afin de suivre les statistiques de Poisson. Consultez le fabricant de DEL du CPCCC pour obtenir les spécifications de l’appareil, si elles ne sont pas déjà fournies.
- Réglez l’instrument sur la longueur d’onde d’émission souhaitée, la bande passante sur 5 nm (ajustez si nécessaire) et la fenêtre de temps sur 150 ns comme point de départ (elle peut être raccourcie en fonction de la durée de vie de l’échantillon). Appliquez ces paramètres et démarrez les mesures TCSPC à partir de la fenêtre du logiciel.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les spectres d’absorption électronique de PCN-222(fb) avec et sans PNH2 et filtrage sont illustrés à la figure 4. Le MOF sans PNH2 était juste sonique et dilué. En comparant les deux spectres, la plus grande différence est la minimisation de la diffusion de base, qui se manifeste par une large absorption ascendante avec des longueurs d’onde décroissantes et élargit également les transitions électroniques de manière assez sensible. À des fins de comparais...
Access restricted. Please log in or start a trial to view this content.
Discussion
Bien que les résultats et le protocole ci-dessus définissent des lignes directrices générales pour minimiser la dispersion des MOF dans la caractérisation spectroscopique, il existe une grande variabilité dans la taille et la structure des particules MOF qui a une incidence sur les résultats spectroscopiques et, par conséquent, brouille les méthodes d’interprétation. Pour aider à clarifier l’interprétation et à alléger la contrainte qui accompagne l’analyse des données spectroscopiques MOF, il est es...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Ce travail a été soutenu par le ministère de l’Énergie dans le cadre de la subvention DE-SC0012446.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1 cm cuvette sample mount (SM1) | Edinburgh Instruments | n/a | Contact company |
| 1 mL disposable syringes | EXELINT | 26044 | |
| 10 mL disposable syringes | EXELINT | 26252 | |
| 1-dram vials | FisherSci | CG490001 | |
| 20 nm syringe filters | VWR | 28138-005 | The filters are made by Whatman/Cytiva, and their catalog number is 6809-1002 |
| 200 nm syringe filters | Cytiva, Whatman | 6784-1302 | |
| Absorption spectrophotometer | Agilent | Cary 5000 Spectrophotometer | Contact company |
| Acetronitrile (ACN) | FisherSci | AA36423 | |
| Ar gas tank | Linde/PraxAir | P-4563 | |
| bis amino-terminated polyethylene glycol (PNH2) | Sigma-Aldrich | 452572 | MOF suspending agent |
| Clamping sample mount for nsTA (SM2) | Ultrafast Systems | n/a | Contact company |
| Concave lens for telescope(CCL1) | Thorlabs | LD1613-A-ML | |
| Convex lens for telescope (CVL1) | Thorlabs | LA1708-A-ML | |
| Custom 1 cm optical cell with 24/40 outer joint | QuarkGlass | QSE-1Q10-2440 (Spectrosil Cat #1-Q-10 | We requested the 1 cm cell to have a joint |
| Custom 2mm optical cell with 14/20 outer joint | QuarkGlass | QSE-1Q2-1420 (Spectrosil Cat # 1-Q-2) | We requested the 2 mm cell to have a joint |
| Dimethylformamide (DMF) | FisherSci | D119 | |
| Dye laser (Nd:YAG pumped) for 415 nm output | Sirah | CobraStretch | |
| Dye laser dye, Exalite 417 | Luxottica | 4170 | |
| Femtosecond laser | Coherent | Astrella | |
| Fluorimeter | Photon Technology Inc. (Horiba) | QuantaMaster QM-200-4E | |
| Fluorimeter arc lamp, 75 W | Newport | 6251NS | |
| Fluorimeter PMT | Hamamatsu | 1527 | |
| Fluorimeter Software | PTI/Horiba | FelixGX | |
| Fluorimeter TCSPC Module | Becker & Hickl GmbH | PMH-100 | |
| lens mounts for telescope | Thorlabs | LMR1 | |
| Long purging needles | STERiJECT | PRE-22100 | |
| Magnetic stirrer | Ultrafast Systems | n/a | Contact company |
| mirror 1 (MM1) 350-700 nm | Newport | 10Q20BB.1 | |
| MM1 mount | Thorlabs | KM100 | |
| MM1 post | Thorlabs | TR2 | |
| MM1 post holder | Thorlabs | PH1.5 | |
| MM2 mount | Thorlabs | MFM05 | |
| MM2,3 mirrors | thorlabs | BB03-E02 | |
| MM2,3 post | Thorlabs | MS3R | |
| MM2,3 post bases | Thorlabs | MBA1 | |
| MM2,3 post holders | Thorlabs | MPH50 | |
| MM3 mount | Thorlabs | MK05 | |
| mounting posts for telescope optics | Thorlabs | TR4 | |
| Nanosecond TA Nd:YAG lasers | Spectra-Physics | QuantaRay INDI Nd:YAG | |
| Nanosecond TA spectrometer | Edinburgh Instruments | LP980 | |
| nsTA ICCD camera | Oxford Instruments | Andor iStar ICCD camera | Contact company |
| nsTA PMT | Hamamatsu | R928 | |
| Optical parametric amplifier | Ultrafast Systems | Apollo | |
| Parafilm | FisherSci | S37440 | |
| Pinhole wheel | Thorlabs | PHW16 | |
| Pinhole wheel post base | Thorlabs | CF125C | |
| Pinhole wheel post holder | Thorlabs | PH1.5 | |
| Pinhole wheel post/mount assembly | Thorlabs | NDC-PM | |
| post bases for telescope optics | Thorlabs | CF125C | |
| post holders for telescope optics | Thorlabs | PH4 | |
| Power detector for ns TA | Thorlabs | S310C | |
| Prism assembly (P2,3) | Edinburgh Instruments | n/a | Contact company |
| Prism mount (P1) | OWIS | K50-FGS | |
| Prism post (P1) | Thorlabs | TR4 | |
| Prism post base (P1) | Thorlabs | CF125C | |
| Prism post holder (P1) | Thorlabs | PH4 | |
| Quartz prisms (P1-P3) | Newport | 10SR20 | |
| Rubber outer joint septa (14/20) | VWR | 89097-540 | |
| Rubber outer joint septa (24/40) | ChemGlass | CG-3022-24 | |
| Sonication tip | Branson | product discontinued | Closest alternative is 1/8" diam. tip from iUltrasonic |
| Square ND filters | Thorlabs | NEK01S | |
| Stir bars | StarnaCells/FisherSci | NC9126395 | |
| Thorlabs power detector for ufTA | Thorlabs | S401C | |
| Thorlabs power meter | Thorlabs | PM100D | |
| Tip sonicator | Branson | Digital Sonifer 450, product discontinued | Closest alternative is SFX550 from iUltrasonic |
| Tygon tubing | Grainger | 8Y589 | |
| ufTA ND filter wheel | Thorlabs | NDC-25C-2-A | |
| ufTA ND filter wheel mount | Thorlabs | NDC-PM | |
| ufTA ND filter wheel post | Thorlabs | PH2 | |
| ufTA ND filter wheel post base | Thorlabs | CF125C | |
| ufTA pump alignment mirror | Thorlabs | PF10-03-F01 | |
| Ultrafast TA telescope assembly | Ultrafast Systems | n/a | Contact company |
| Ultrafast transient absorption spectrometer | Ultrafast Systems | HeliosFire | |
| Xe arc probe lamp | OSRAM | 4050300508788 |
Références
- Zhou, H. -C., Long, J. R., Yaghi, O. M. Introduction to metal-organic frameworks. Chemical Reviews. 112 (2), 673-674 (2012).
- Li, H., et al. Recent advances in gas storage and separation using metal-organic frameworks. Materials Today. 21 (2), 108-121 (2018).
- Xie, L. S., Skorupskii, G., Dincă, M. Electrically conductive metal-organic frameworks. Chemical Reviews. 120 (16), 8536-8580 (2020).
- Ye, Y., Zhao, Y., Sun, Y., Cao, J. Recent progress of metal-organic framework-based photodynamic therapy for cancer treatment. International Journal of Nanomedicine. 17, 2367-2395 (2022).
- Gibbons, B., Cai, M., Morris, A. J. A potential roadmap to integrated metal organic framework artificial photosynthetic arrays. Journal of the American Chemical Society. 144 (39), 17723-17736 (2022).
- Wang, Q., Gao, Q., Al-Enizi, A. M., Nafady, A., Ma, S. Recent advances in MOF-based photocatalysis: environmental remediation under visible light. Inorganic Chemistry Frontiers. 7 (2), 300-339 (2020).
- Bavykina, A., et al. Metal-organic frameworks in heterogeneous catalysis: recent progress, new trends, and future perspectives. Chemical Reviews. 120 (16), 8468-8535 (2020).
- Wang, C., Xie, Z., deKrafft, K. E., Lin, W. Doping metal-organic frameworks for water oxidation, carbon dioxide reduction, and organic photocatalysis. Journal of the American Chemical Society. 133 (34), 13445-13454 (2011).
- Wang, Q., Astruc, D. State of the art and prospects in metal-organic framework (MOF)-based and MOF-derived nanocatalysis. Chemical Reviews. 120 (2), 1438-1511 (2020).
- Lan, G., et al. Electron injection from photoexcited metal-organic framework ligands to ru2 secondary building units for visible-light-driven hydrogen evolution. Journal of the American Chemical Society. 140 (16), 5326-5329 (2018).
- Benseghir, Y., et al. Unveiling the mechanism of the photocatalytic reduction of CO2 to formate promoted by porphyrinic Zr-based metal-organic frameworks. Journal of Materials Chemistry A, Materials for Energy and Sustainability. 10 (35), 18103-18115 (2022).
- Rowe, J. M., et al. Sensitized photon upconversion in anthracene-based zirconium metal-organic frameworks. Chemical Communications. 54 (56), 7798-7801 (2018).
- Gharaati, S., et al. Triplet-triplet annihilation upconversion in a MOF with acceptor-filled channels. Chemistry. 26 (5), 1003-1007 (2020).
- Wang, F., et al. Transformable upconversion metal-organic frameworks for near-infrared light-programmed chemotherapy. Chemical Communications. 57 (63), 7826-7829 (2021).
- Roy, I., et al. Photon upconversion in a glowing metal-organic framework. Journal of the American Chemical Society. 143 (13), 5053-5059 (2021).
- Park, J., Xu, M., Li, F., Zhou, H. -C. 3D long-range triplet migration in a water-stable metal-organic framework for upconversion-based ultralow-power in vivo imaging. Journal of the American Chemical Society. 140 (16), 5493-5499 (2018).
- Lin, S., et al. Photoelectrochemical alcohol oxidation by mixed-linker metal-organic frameworks. Faraday Discussions. 225, 371-383 (2020).
- Jiang, Z. W., Zhao, T. T., Li, C. M., Li, Y. F., Huang, C. Z. 2D MOF-based photoelectrochemical aptasensor for SARS-CoV-2 spike glycoprotein detection. ACS Applied Materials & Interfaces. 13 (42), 49754-49761 (2021).
- Shaikh, S. M., et al. Role of a 3D structure in energy transfer in mixed-ligand metal-organic frameworks. The Journal of Physical Chemistry C. 125 (42), 22998-23010 (2021).
- Shaikh, S. M., et al. Light harvesting and energy transfer in a porphyrin-based metal organic framework. Faraday Discussions. 216, 174-190 (2019).
- Logan, M. W., et al. Systematic variation of the optical bandgap in titanium-based isoreticular metal-organic frameworks for photocatalytic reduction of CO2 under blue light. Journal of Materials Chemistry A, Materials for Energy and Sustainability. 5 (23), 11854-11863 (2017).
- Zhang, Q., et al. Förster energy transport in metal-organic frameworks is beyond step-by-step hopping. Journal of the American Chemical Society. 138 (16), 5308-5315 (2016).
- Kent, C. A., et al. Energy transfer dynamics in metal-organic frameworks. Journal of the American Chemical Society. 132 (37), 12767-12769 (2010).
- Lin, J., et al. Triplet excitation energy dynamics in metal-organic frameworks. The Journal of Physical Chemistry C. 117 (43), 22250-22259 (2013).
- Li, X., Yu, J., Gosztola, D. J., Fry, H. C., Deria, P. Wavelength-dependent energy and charge transfer in MOF: a step toward artificial porous light-harvesting system. Journal of the American Chemical Society. 141 (42), 16849-16857 (2019).
- White, T. A., Arachchige, S. M., Sedai, B., Brewer, K. J. Emission spectroscopy as a probe into photoinduced intramolecular electron transfer in polyazine bridged Ru(II),Rh(III) supramolecular complexes. Materials. 3 (8), 4328-4354 (2010).
- Miller, J. N. Fluorescence energy transfer methods in bioanalysis. Analyst. 130 (3), 265-270 (2005).
- Cao, W., Tang, Y., Cui, Y., Qian, G. Energy transfer in metal-organic frameworks and its applications. Small Structures. 1 (3), 2000019(2020).
- Lan, G., et al. Titanium-based nanoscale metal-organic framework for type i photodynamic therapy. Journal of the American Chemical Society. 141 (10), 4204-4208 (2019).
- Chen, D., Jin, Z., Xing, H. Titanium-porphyrin metal-organic frameworks as visible-light-driven catalysts for highly efficient sonophotocatalytic reduction of Cr(VI). Langmuir. 38 (40), 12292-12299 (2022).
- Berera, R., van Grondelle, R., Kennis, J. T. M. Ultrafast transient absorption spectroscopy: principles and application to photosynthetic systems. Photosynthesis Research. 101 (2-3), 105-118 (2009).
- Brown, A. M., McCusker, C. E., McCusker, J. K. Spectroelectrochemical identification of charge-transfer excited states in transition metal-based polypyridyl complexes. Dalton Transactions. 43 (47), 17635-17646 (2014).
- Farr, E. P., et al. Introduction to time-resolved spectroscopy: nanosecond transient absorption and time-resolved fluorescence of eosin B. Journal of Chemical Education. 95 (5), 864-871 (2018).
- Pattengale, B., Ostresh, S., Schmuttenmaer, C. A., Neu, J. Interrogating light-initiated dynamics in metal-organic frameworks with time-resolved spectroscopy. Chemical Reviews. 122 (1), 132-166 (2022).
- Santaclara, J. G., et al. Organic linker defines the excited-state decay of photocatalytic MIL-125(Ti)-type materials. ChemSusChem. 9 (4), 388-395 (2016).
- Hanna, L., Long, C. L., Zhang, X., Lockard, J. V. Heterometal incorporation in NH2-MIL-125(Ti) and its participation in the photoinduced charge-separated excited state. Chemical Communications. 56 (78), 11597-11600 (2020).
- Gutierrez, M., Cohen, B., Sánchez, F., Douhal, A. Photochemistry of Zr-based MOFs: ligand-to-cluster charge transfer, energy transfer and excimer formation, what else is there. Physical Chemistry Chemical Physics. 18 (40), 27761-27774 (2016).
- Adams, M., et al. Highly efficient one-dimensional triplet exciton transport in a palladium-porphyrin-based surface-anchored metal-organic framework. ACS Applied Materials & Interfaces. 11 (17), 15688-15697 (2019).
- Hassan, Z. M., et al. Spectroscopic investigation of bianthryl-based metal-organic framework thin films and their photoinduced topotactic transformation. Advanced Materials Interfaces. 9 (13), 2102441(2022).
- Li, X., et al. Ultrafast relaxation dynamics in zinc tetraphenylporphyrin surface-mounted metal organic framework. The Journal of Physical Chemistry C. 122 (1), 50-61 (2018).
- Triggiani, L., et al. Excitation-dependent ultrafast carrier dynamics of colloidal tio2 nanorods in organic solvent. The Journal of Physical Chemistry C. 118 (43), 25215-25222 (2014).
- Pu, Y., Cai, F., Wang, D., Wang, J. -X., Chen, J. -F. Colloidal synthesis of semiconductor quantum dots toward large-scale production: a review. Industrial & Engineering Chemistry Research. 57 (6), 1790-1802 (2018).
- Zhou, L. -L., et al. One-pot synthetic approach toward porphyrinatozinc and heavy-atom involved Zr-NMOF and its application in photodynamic therapy. Inorganic Chemistry. 57 (6), 3169-3176 (2018).
- Zhao, Y., et al. Metal-organic frameworks with enhanced photodynamic therapy: synthesis, erythrocyte membrane camouflage, and aptamer-targeted aggregation. ACS Applied Materials & Interfaces. 12 (21), 23697-23706 (2020).
- Zeng, J. -Y., et al. π-extended benzoporphyrin-based metal-organic framework for inhibition of tumor metastasis. ACS Nano. 12 (5), 4630-4640 (2018).
- Cheng, Q., Debnath, S., Gregan, E., Byrne, H. J. Ultrasound-assisted SWNTs dispersion: effects of sonication parameters and solvent properties. The Journal of Physical Chemistry C. 114 (19), 8821-8827 (2010).
- Baig, Z., et al. Investigation of tip sonication effects on structural quality of graphene nanoplatelets (GNPs) for superior solvent dispersion. Ultrasonics Sonochemistry. 45, 133-149 (2018).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon