Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikroinjektion von rekombinantem RCAS(A)-Retrovirus in embryonale Hühnerlinse
In diesem Artikel
Zusammenfassung
Dieses Protokollpapier beschreibt die Methodik der Mikroinjektion eines RCAS(A)-Retrovirus in embryonale Hühnerlinsen als Werkzeug zur Untersuchung der In-situ-Funktion und Expression von Proteinen während der Linsenentwicklung.
Zusammenfassung
Das embryonale Huhn (Gallus domesticus) ist aufgrund seiner hohen Ähnlichkeit mit der menschlichen Linse ein etabliertes Tiermodell für die Untersuchung der Linsenentwicklung und -physiologie. RCAS(A) ist ein replikationskompetentes Hühner-Retrovirus, das sich teilende Zellen infiziert und als leistungsfähiges Werkzeug dient, um die In-situ-Expression und -Funktion von Wildtyp- und Mutantenproteinen während der Linsenentwicklung durch Mikroinjektion in das leere Lumen des Linsenvesikels in frühen Entwicklungsstadien zu untersuchen und seine Wirkung auf die umgebenden proliferierenden Linsenzellen zu beschränken. Im Vergleich zu anderen Ansätzen, wie z.B. transgenen Modellen und ex vivo Kulturen, bietet die Verwendung eines RCAS(A)-replikationskompetenten aviären Retrovirus ein hocheffektives, schnelles und anpassbares System zur Expression exogener Proteine in Kükenembryonen. Insbesondere kann der gezielte Gentransfer auf proliferative Linsenfaserzellen beschränkt werden, ohne dass gewebespezifische Promotoren erforderlich sind. In diesem Artikel geben wir einen kurzen Überblick über die Schritte, die für die Herstellung des rekombinanten Retrovirus RCAS(A) erforderlich sind, geben einen detaillierten, umfassenden Überblick über das Mikroinjektionsverfahren und stellen Beispielergebnisse der Technik zur Verfügung.
Einleitung
Das Ziel dieses Protokolls ist es, die Methodik der Mikroinjektion eines RCAS(A) (replikationskompetentes aviäres Sarkom/Leukose-Retrovirus A) in embryonale Hühnerlinsen zu beschreiben. Die effektive retrovirale Verabreichung in eine embryonale Hühnerlinse hat sich als vielversprechendes Werkzeug für die In-vivo-Untersuchung des molekularen Mechanismus und der Strukturfunktion von Linsenproteinen in normaler Linsenphysiologie, pathologischen Bedingungen und Entwicklung erwiesen. Darüber hinaus könnte dieses experimentelle Modell für die Identifizierung therapeutischer Ziele und das Screening von Medikamenten für Erkrankungen wie den menschlichen kongenitalen Katarakt verwendet werden. Insgesamt zielt dieses Protokoll darauf ab, die notwendigen Schritte für die Entwicklung einer anpassbaren Plattform für die Untersuchung von Linsenproteinen festzulegen.
Embryonale Küken (Gallus domesticus) sind aufgrund ihrer Ähnlichkeit in Linsenstruktur und -funktion mit der menschlichen Linse ein etabliertes Tiermodell für die Untersuchung der Linsenentwicklung und -physiologie 1,2,3,4. Die Verwendung eines RCAS(A)-replikationskompetenten aviären Retrovirus gilt als hocheffektives, schnelles und anpassbares System zur Expression exogener Proteine in Kükenembryonen. Insbesondere hat es eine einzigartige Fähigkeit, den Zielgentransfer auf proliferative Linsenfaserzellen zu beschränken, ohne dass gewebespezifische Promotoren erforderlich sind, wobei der einzigartige embryonale Entwicklungszeitrahmen verwendet wird, in dem das Vorhandensein von leerem Linsenlumen eine In-situ-RCAS(A)-Mikroinjektion in die eingeschränkte Stelle für die Expression exogener Proteine in proliferativen Linsenfaserzellen ermöglicht5, 6,7,8.
Das hier ausführlich beschriebene Verfahren der Mikroinjektion von Kükenembryonen basiert ursprünglich teilweise auf den Arbeiten von Fekete et. al.6 und weiterentwickelt von Jiang et. al.8 und wurde als Mittel verwendet, um sowohl virale als auch nichtvirale Plasmide in die Linse embryonaler Küken einzuführen 1,9,10,11,12,13. Insgesamt zeigt die bisherige Arbeit das Potenzial der Verwendung dieser Methodik zur Untersuchung der Linsenentwicklung, -differenzierung, zellulären Kommunikation und des Fortschreitens von Krankheiten sowie zur Entdeckung und Erprobung therapeutischer Ziele für Linsenerkrankungen wie Katarakte.
Protokoll
Diese Studie wurde in Übereinstimmung mit dem Tierschutzgesetz und der Durchführungsverordnung zum Tierschutz nach den Grundsätzen des Leitfadens für die Pflege und Verwendung von Versuchstieren durchgeführt. Alle Tierbehandlungen wurden vom Institutional Animal Care and Use Committee am Health Science Center der University of Texas in San Antonio genehmigt. Eine Übersicht über das Protokoll finden Sie in Abbildung 1. Einzelheiten zu allen Materialien, Reagenzien und Instrumenten, die in diesem Protokoll verwendet werden, finden Sie in der Materialtabelle .
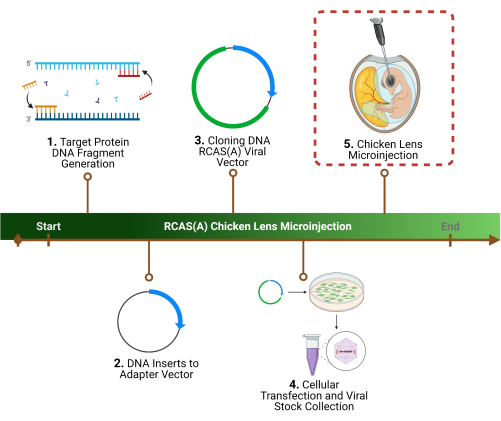
Abbildung 1: Experimentelle Gliederung. 1 . Der erste Schritt des Protokolls ist die Bestimmung eines bestimmten Zielproteins/der spezifischen Zielproteine, die Identifizierung der zugehörigen Gensequenz(en) und die Generierung von DNA-Fragmenten. 2 . Klonierung der Gensequenz(en) in einen retroviralen Vektor durch initiale Klonierung in einen Adaptervektor, 3. gefolgt von einem viralen Vektor . 4 . Herstellung von hochtiterhaltigen Viruspartikeln unter Verwendung von Verpackungszellen zur Ernte und Konzentrierung. 5 . Der letzte Schritt und der Schwerpunkt dieses Protokolls ist die Mikroinjektion der RCAS(A)-Viruspartikel in das Linsenlumen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Herstellung von rekombinanten Retroviren mit hohem Titer
- Polymerase-Kettenreaktion (PCR) zur Herstellung von DNA-Fragmenten des Zielproteins
HINWEIS: Dieser Abschnitt zielt darauf ab, die DNA-Sequenz zu amplifizieren, die dem Ziellinsenprotein entspricht. Weitere Informationen finden Sie unter 7,8.- Entwerfen von Primern für die PCR, die dem interessierenden Protein entsprechen, um DNA-Fragmente mit ihren Carboxyltermini im Rahmen mit oder ohne eine FLAG-Epitopsequenz (5'-GACTACAAGGACGACGACGATGACAAG-3'), ein Stoppcodon und eine Restriktionsenzymstelle (d. h. EcoRI) innerhalb der Polylinkerregion von CLa12NCO) gemäß den in zuvor veröffentlichten Protokollen angegebenen Spezifikationen mit Sequenzen für adäquate Restriktionsenzyme1 herzustellen, 7,8,10,11.
- Führen Sie die PCR-Reaktion10 durch. Kombinieren Sie 100 pmol Sense und Antisense der entworfenen Primer mit 0,5 μg Connexin-cDNA (z. B. Cx50, Cx43 oder chimäre Cx50*43L-Kombinationen) zum PCR-Reaktionspuffer Ihrer Wahl. Führen Sie 30 Zyklen durch, die jeweils aus 94 °C für 1 Minute, 58 °C für 1 Minute und 72 °C für 1 Minute bestehen, gefolgt von einer letzten Verlängerung für 10 Minuten bei 72 °C.
- Isolieren und reinigen Sie PCR-Produkte mit einem Gel-Aufreinigungskit.
- Verdauen Sie die gereinigten PCR-Produkte mit Restriktionsenzymen Ihrer Wahl gemäß den Anweisungen des Herstellers.
- Klonierung von DNA-Inserten in Adapterplasmid
ANMERKUNG: Durch das Einfügen von DNA-Fragmenten in einen Adaptervektor werden keine Helferzellen/Viren benötigt, um die Stabilität des RCAS(A)-Vektors zu erhöhen14. Weitere Informationen finden Sie unter 7,8.- Subklonieren von DNA-Fragmenten in ein Adapterplasmid, Cla12NCO, unter Verwendung einer Klebrigkeits-End-Ligationsreaktion. Mischen Sie die PCR-Fragmente mit Restriktionsenzymen und Cla12NCO in einem Verhältnis von 2-5:1. Führen Sie Ligation und DNA-Transformation mit kompetenten Zellen durch.
- Isolieren Sie DNA mit einem DNA-Isolierungskit.
- Sequenzieren Sie die DNA, um die Genauigkeit zu gewährleisten.
- Klonierung in den viralen RCAS(A)-Vektor
ANMERKUNG: DNA-Fragmente werden in ein Vehikel (RCAS(A)-Retrovirus) eingefügt, um die stabile Transduktion eines Gens in Zellen des sich entwickelnden Kükenembryos zu ermöglichen14,15. Weitere Informationen finden Sie unter 7,8,15.- Das Cla12NCO-DNA-Fragment des interessierenden Vektors wird mit ClaI (1 Einheit pro 1 μg DNA) verdaut und die Fragmente werden gelisoliert.
- Subklonieren Sie die DNA-Fragmente in ein ClaI-linearisiertes RCAS(A)-Plasmid. Verwenden Sie das Restriktionsenzym SalI, um die ClaI-Stelle auf dem RCAS(A)-Plasmid zu unterscheiden.
- Bestätigen Sie die korrekte Ausrichtung der eingefügten Fragmente auf den Konstrukten durch Verdauung mit ClaI- und SalI-Restriktionsenzymen.
- Isolieren Sie DNA mit einem DNA-Isolierungskit.
- Bestimmen Sie die DNA-Konzentration.
- Transfektion von embryonalen Fibroblastenzellen (CEF) von Küken und RCAS(A)-Ernte
HINWEIS: Virusverpackungszellen, CEFs, werden verwendet, um Zellkulturmedien zu gewinnen/zu ernten, die Viruspartikelenthalten 15,16. Weitere Informationen finden Sie unter 7,8,15.- Transfizieren Sie CEF-Zellen mit rekombinanten retroviralen DNA-Konstrukten unter Verwendung des Transfektionsmittels gemäß den Anweisungen des Herstellers.
- Führen Sie ein Western Blot der transfizierten Zellen durch, um ihre Expression des interessierenden Proteins zu untersuchen.
- Wenn die transfizierten Zellen die Konfluenz erreicht haben, beginnen Sie mit dem Sammeln des überstehenden Mediums, verarbeiten/filtern Sie es entsprechend (um Zelltrümmer mit einem 0,22-μm-Filter zu entfernen) und lagern Sie es bei -80 °C, bis es zur Konzentration bereit ist.
- Konzentration und Titrierung von Virusbeständen
HINWEIS: Das Pellet und große Medienmengen, die von den Zellen stammen, die die Viruspartikel enthalten, müssen gefiltert werden. Zusätzlich muss ein Virustiter-Assay durchgeführt werden, um die Stärke des Virus gegen die Wirtszellen zu ermitteln. Weitere Informationen finden Sie unter 6,7,8,15.- Tauen Sie die Nährmedien mit den Virionen auf.
- Drehen Sie das Nährmedium bei 72.000 × g für 2 h bei 4 °C.
- Dekantieren Sie den Überstand und resuspendieren Sie das virale Pellet mit dem Restmedium (~50 μl) und lagern Sie es bis zur Verwendung bei -80 °C in ~10 μl viralen Vorräten.
- Für die Titerisierung werden die Zellen entweder mit QT-6- oder CEF-Zellen mit einer seriellen Verdünnung der Virusbestände transfektiert.
- Nach der Konfluenz fixieren Sie die Zellen mit 4% Formaldehyd.
- Immunfärbung für virale Gag-Proteine oder Prozess für alkalische Phosphatase histochemisch, um den Titer zu erhalten, definiert als (koloniebildende Einheiten) KBE pro Milliliter (KBE/ml).

Abbildung 2: Instrumente und Aufbau für die Mikroinjektion von Kükenlinsen . (A) P-30 manueller vertikaler Mikroelektroden-Mikropipettenzieher. (1) Einschub, der zeigt, wie eine Glasmikropipette gezogen wird. (B) (2) Eier-Inkubator. Hühnerei ~65-68 h in einem 37 °C warmen Inkubator inkubieren, um Stadium 18 (mit einem versiegelten, leeren zentralen Lumen) für die Injektion des Retrovirus zu erreichen. (C) Aufbau der Mikroinjektion. (3) Beleuchtungsgeräte, (4) Pico-Injektor, (5) Präpariermikroskop, (6) Drummond-Mikromanipulator, (7) Computer/Kamera zur Visualisierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Mikroinjektion der Kükenlinse
- Vorbereitung von Vorräten
- Vorbereitung von Glasmikropipetten für die Mikroinjektion17
HINWEIS: Glaskapillaren werden zur Herstellung von Glasmikropipetten mit einer Spitzenspitze und einem Außendurchmesser (OD) von ~11 μm für die Mikroinjektion verwendet. Der Aufbau ist in Abbildung 2A dargestellt.- Befestigen Sie die Borosilikatglaskapillare an den gummigepolsterten Clips des manuellen vertikalen Mikropipettenziehers.
- Heiztemperatur (HEAT 1) auf 950 °C einstellen und Vorziehen durchführen, um eine dünnere und weichere Glaskapillare zu erhalten.
- Stellen Sie die Heiztemperatur (HEAT 2) auf 790 °C ein und führen Sie einen sekundären Zug durch, um die endgültigen Mikropipetten herzustellen.
- Mit einem Mikropipettenschleifer schärfen Sie die Spitzenöffnung auf einen Außendurchmesser von ~11 μm.
- Für zukünftige Experimente bewahren Sie die Glasmikropipetten in einem Schwammklemmkissen in einem Glasgefäß auf.
- Bebrütung befruchteter Eier bis zum Entwicklungsstadium 18
HINWEIS: Während der Linsenentwicklung, bei ~65-68 h der Embryonalentwicklung, trennt sich die Linse vom Ektoderm und bildet ein versiegeltes Vesikel mit einem zentralen Lumen; Injektion in dieses leere Linsenlumen, um die Expression auf proliferative Linsenzellen zu beschränken 7,8,18.- Befruchtete Hühnereier werden ~65-68 h in einem 37 °C befeuchteten Schaukelinkubator bebrütet (Abbildung 2B).
- Vorbereitung von Glasmikropipetten für die Mikroinjektion17
- Öffnen des Hühnereis
HINWEIS: Dieser Schritt beschreibt die Identifizierung und Exposition des Embryos für die Mikroinjektion. Weitere Informationen finden Sie unter 7,8.- Wischen Sie den Arbeitsbereich gründlich mit 70%igem Ethanol ab.
- Nehmen Sie die Eier aus dem Inkubator, besprühen Sie sie stark mit 70%igem Ethanol und lassen Sie sie an der Luft trocknen.
- Legen Sie das Ei mit dem größeren Ende des Eies nach oben auf einen Eierhalter.
- Führe mit einer Pinzette mit scharfen Zähnen ein Loch von ~2 cm Durchmesser am größeren Ende des Eies ein, indem du vorsichtig auf die Eierschale klopfst und Fragmente der Eierschale entfernst (Abbildung 3A).
- Lokalisieren Sie den Embryo mit einem Präpariermikroskop.
- Sobald der Embryo und die Kükenlinse lokalisiert sind, schneiden Sie mit dem Präpariermikroskop und einer feinen Präparierzange und Schere die Amnionmembran ab, die die Oberseite des Embryos unmittelbar bedeckt (Abbildung 3B).
HINWEIS: Schneiden Sie nicht zu weit (nur genug, um den Embryo ~0,5 cm x 0,5 cm freizulegen), da die Embryonen sonst in die Dottermasse sinken könnten; Vermeiden Sie nach Möglichkeit auch das Berühren von Blutgefäßen. - Decken Sie die Öffnung des Eies mit einer 60 mm Petrischale ab, um die nächsten Schritte vorzubereiten.
- Mikroinjektion von konzentriertem Virusmaterial
HINWEIS: Viruspartikel, die DNA-Fragmente des Zielproteins für die Transduktion enthalten, werden in Zellen innerhalb des Linsenlumens eingefügt. Der Aufbau ist in Abbildung 2C dargestellt. Weitere Informationen finden Sie unter 6,7,8.- Tauen Sie die viralen Vorräte auf Eis auf.
- Zur Visualisierung des Virusbestands während der Injektion verdünnen Sie 1 μl 10x Fast green in eine Durchstechflasche mit Virusvorrat mit 10 μl.
- Um sicherzustellen, dass keine großen Brocken ungelösten Materials vorhanden sind, die die Glasmikropipette verstopfen könnten, zentrifugieren Sie die Lösungen 10 s lang bei 10.000 × g bei 4 °C, um "große Brocken" zu pelletieren und die Überstände in neue Röhrchen zu überführen, während die Lösungen auf Eis bleiben.
- Legen Sie auf eine 35 mm x 10 mm große Kulturschale einen gestreckten Labor-Parafilm und geben Sie 1 μl sterile Kochsalzlösung (PBS) auf den Film (nicht sterilisiert, wobei die abgedeckte Seite als "sauber" gilt).
- Schließen Sie eine präparierte Glasmikropipette an einen automatischen Pico-Injektor an.
- Drücken Sie den Füllmodus , um die sterile Kochsalzlösung (PBS) in eine Glasmikropipette zu füllen, und verwenden Sie dann den Injektionsmodus , um die zugewiesenen 1 μl Flüssigkeit zu testen.
- Legen Sie einen zweiten gestreckten Laborfilm auf die Oberfläche einer neuen 35 mm x 10 mm großen Zellkulturschale und geben Sie 1 μl grün gefärbte Virusvorräte von Fast auf die Folie.
- Senken Sie die Spitze der Mikropipette in den Virusvorrat und drücken Sie auf das Füllmodell , um die Glasmikropipette mit ~1 μl Virusmaterial zu füllen.
HINWEIS: Um ein Austrocknen zu vermeiden, legen Sie die Spitze der gefüllten Mikropipette immer dann in sterile Kochsalzlösung (PBS), wenn es eine Pause im Verfahren gibt. - Senken Sie die gefüllte Mikropipette aus Glas, die mit einem automatischen Injektor verbunden ist, mit Hilfe eines Präpariermikroskops in den Zielbereich des Lumens der Embryolinse ab.
- Stellen Sie die Lichtquelle so ein, dass die Umrisse des Linsenvesikels klar sichtbar sind.
HINWEIS: Das Lumen der rechten Linse (mit dem Gesicht nach oben) wird in der Regel für die Injektion verwendet und das Lumen der linken Linse (mit dem Gesicht nach unten) wird als kontralaterale Kontrolle intakt gehalten. - Sobald Sie sicher sind, dass sich die Mikropipette an der richtigen Stelle im Linsenlumen befindet, injizieren Sie 5-40 nL des Virusvorrats (Abbildung 3C).
HINWEIS: Übung ist für eine optimale Injektionsplatzierung sehr notwendig. - Warten Sie ~45 s und entfernen Sie dann vorsichtig die Glasmikropipette.
- Überprüfen Sie mit dem Präpariermikroskop die erfolgreiche Mikroinjektion in das Linsenlumen, indem Sie den Farbstoff Fast Green untersuchen, der im leeren Lumen der Linse verbleiben sollte, ohne dass es zu Leckagen kommt.
- Nach dem Injektionsvorgang wird die Eierschalenöffnung mit Tesafilm verschlossen.
- Der Embryo wird ohne Drehbewegung in den 37 °C warmen Befeuchtungsinkubator zurückgelegt, bis das gewünschte Embryonalalter für die Linsendissektion erreicht ist.
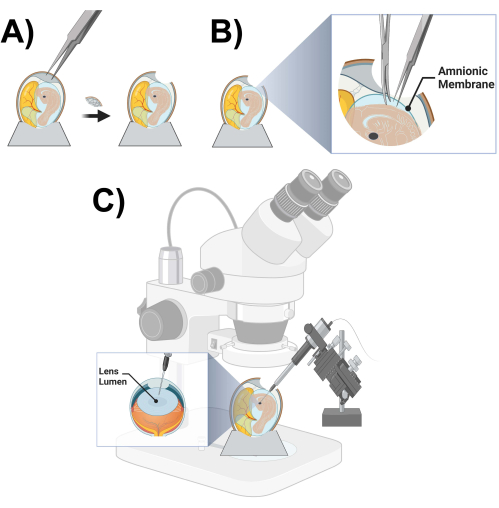
Abbildung 3: Mikroinjektions-Kükenvorbereitung und schematische Darstellung . (A) Öffnen eines Hühnereies. (B) Durchtrennen der Fruchtblase. (C) Schematische Darstellung der Mikroinjektion von Hühnerlinsenlumen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Nach der Bestimmung eines oder mehrerer spezifischer Zielproteine und der Identifizierung der zugehörigen Gensequenz(en) umfasst der experimentelle Gesamtansatz die Klonierung der Gensequenz(en) in einen retroviralen RCAS(A)-Vektor durch die anfängliche Klonierung in einen Adaptervektor, gefolgt von einem viralen Vektor. Zweitens werden hochtitrige Viruspartikel mit Hilfe von Verpackungszellen hergestellt, um die Virionen zu ernten und zu konzentrieren. Diese ersten beiden Hauptschritte wurden an anderer Stelle ausfüh...
Diskussion
Dieses experimentelle Modell bietet die Möglichkeit, das/die interessierende(n) Protein(e) in der intakten Linse zu exprimieren, was zur Untersuchung der funktionellen Relevanz dieser Proteine für die Struktur und Funktion der Linse führt. Das Modell der Mikroinjektion von embryonalen Küken basiert teilweise auf den Arbeiten von Fekete et. al.6 und wurde von Jiang et. al.8 und wurde als Mittel zum Einfügen von viralen Plasmiden und Wirkstoffen wie Agonisten, kleiner in...
Offenlegungen
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Diese Arbeit wurde durch die National Institutes of Health (NIH) Grants: RO1 EY012085 (an J.X.J) und F32DK134051 (an F.M.A.) und die Welch Foundation Grants: AQ-1507 (an J.X.J.) unterstützt. Der Inhalt liegt in der alleinigen Verantwortung der Autoren und stellt nicht unbedingt die offizielle Meinung der National Institutes of Health dar. Die Figuren wurden teilweise mit Biorender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm Filter | Corning | 431118 | For removing cellular debris from media |
| 35 mm x 10 mm Culture Dish | FisherScientific | 50-202-030 | For using during microinjection |
| Centrifuge | Fisherbrand | 13-100-676 | Spinning down solution |
| Constructs | GENEWIZ | - | For generation of constructs |
| Dissecting microscope | AmScope | SM-4TZ-144A | Visualization of lens for microinjection |
| DNA PCR primers | Integrated DNA Technologies | - | Generation of primers: Intracellular loop (IL)-deleted Cx50 (residues 1–97 and 149–400) as well as the Cla12NCO vector were obtained with the following pair of primers: sense, CTCCTGAGAACCTACATCCT; antisense, CACCGCATGCCCAAAGTACAC ILs of Cx43 (residues 98–150) and Cx46 (residues 98–166) were obtained with the following pairs of primers: sense, TACGTGATGAGGAAAGAAGAG; antisense, TCCTCCACGCATCTTTACCTTG; sense, CACATTGTACGCATGGAAGAG; antisense, AGCACCTCCC AT ACGGATTC, respectively Cla12NCO-Cx43 construct template was obtained with the following pair of primers: sense, CTGCTTCGTACTTACATCATC; antisense, GAACAC GTGCGCCAGGTAC ILs of Cx50 (residues 98–148) or Cx46 (residues 98–166) were cloned by using Cla12NCO-Cx50 and Cla12NCO-Cx46 constructs as the templates with the following pair of primers: sense, CACCATGTCCGCATGGAGGAGA; antisense, GGTCCCC TC CAGGCGAAAC; sense, CACATTGTACGCATGGAAGAG; antisense, AGCACCTCCCATACGGATTC, respectively |
| Drummond Nanoject II Automatic Nanoliter Injector | Drummond Scientific | 3-000-204 | Microinjection Pipet |
| Dual Gooseneck Lights Microscope Illuminator | AmScope | LED-50WY | Lighting for visualization |
| Dulbecco’s Modified Eagle Medium (DMEM) | Invitrogen | For cell culture | |
| Egg Holder | - | - | Homemade styrofoam rings with 2-inch diameter and one-half inch height |
| Egg Incubator | GQF Manufacturing Company Inc. | 1502 | For incubation of fertilized eggs |
| Fast Green | Fisher scientific | F99-10 | For visualization of viral stock injection |
| Fertilized white leghorn chicken eggs | Texas A&M University | N/A | Animal model of choice for microinjection (https://posc.tamu.edu/fertile-egg-orders/) |
| Fetal Bovine Serum (FBS) | Hyclone Laboratories | For cell culture | |
| Fluorescein-conjugated anti-mouse IgG | Jackson ImmunoResearch | 115-095-003 | For anti-FLAG 1:500 |
| Forceps | FisherScientific | 22-327379 | For moving things around and isolation |
| Glass capillaries | Sutter Instruments | B100-75-10 | Glass micropipette for microinjection (O.D. 1.0 mm, I.D. 0.75 mm, 10 cm length) |
| Lipofectamine | Invitrogen | L3000001 | For transfection |
| Manual vertical micropipette puller | Sutter Instruments | P-30 | To obtain glass micropipette of the correct size |
| Microcentrifuge Tubes | FisherScientific | 02-682-004 | Dissolving solution |
| Microscope | Keyence | BZ-X710 | For imaging staining |
| Parafilm | FisherScientific | 03-448-254 | Placing solution |
| Penicillin/Streptomycin | Invitrogen | For cell culture | |
| Pico-Injector | Harvard Apparatus | PLI-100 | For delivering small liquid volumes precisely through micropipettes by applying a regulated pressure for a digitally set period of time |
| rabbit anti-chick AQP0 | Self generated | - | Jiang JX, White TW, Goodenough DA, Paul DL. Molecular cloning and functional characterization of chick lens fiber connexin 45.6. Mol Biol Cell. 1994 Mar;5(3):363-73. doi: 10.1091/mbc.5.3.363. |
| rabbit anti-FLAG antibody | Rockland Immunichemicals | 600-401-383 | For staining FLAG |
| Rhodamine-conjugated anti-rabbit IgG | Jackson ImmunoResearch | 111-295-003 | For anti-AQP0 1:500 |
| Sponge clamping pad | Sutter Instruments | BX10 | For storage of glass micropipette |
Referenzen
- Li, Z., Gu, S., Quan, Y., Varadaraj, K., Jiang, J. X. Development of a potent embryonic chick lens model for studying congenital cataracts in vivo. Communications Biology. 4 (1), 325 (2021).
- Chen, Y., et al. γ-Crystallins of the chicken lens: remnants of an ancient vertebrate gene family in birds. The FEBS Journal. 283 (8), 1516-1530 (2016).
- Coulombre, A. J., Coulombre, J. L. Lens development. I. Role of the lens in eye growth. Journal of Experimental Zoology. 156 (1), 39-47 (1964).
- McKeehan, M. S. Induction of portions of the chick lens without contact with the optic cup. The Anatomical Record. 132 (3), 297-305 (1958).
- Kothlow, S., Schenk-Weibhauser, K., Ratcliffe, M. J., Kaspers, B. Prolonged effect of BAFF on chicken B cell development revealed by RCAS retroviral gene transfer in vivo. Molecular immunology. 47 (7-8), 1619-1628 (2010).
- Fekete, D. M., Cepko, C. L. Replication-competent retroviral vectors encoding alkaline phosphatase reveal spatial restriction of viral gene expression/transduction in the chick embryo. Molecular and Cellular Biology. 13 (4), 2604-2613 (1993).
- Jiang, J. X. Use of retroviruses to express connexins. Methods in Molecular Biology. , 159-174 (2001).
- Jiang, J. X., Goodenough, D. A. Retroviral expression of connexins in embryonic chick lens. Investigative Ophthalmology & Visual Science. 39 (3), 537-543 (1998).
- Shestopalov, V. I., Bassnett, S. Expression of autofluorescent proteins reveals a novel protein permeable pathway between cells in the lens core. Journal of Cell Science. 113 (11), 1913-1921 (2000).
- Liu, J., Xu, J., Gu, S., Nicholson, B. J., Jiang, J. X. Aquaporin 0 enhances gap junction coupling via its cell adhesion function and interaction with connexin 50. Journal of Cell Science. 124 (2), 198-206 (2011).
- Li, Z., et al. The second extracellular domain of connexin 50 is important for in cell adhesion, lens differentiation, and adhesion molecule expression. Journal of Biological Chemistry. 299 (3), 102965 (2023).
- Shestopalov, V. I., Bassnett, S. Exogenous gene expression and protein targeting in lens fiber cells. Investigative Ophthalmology & Visual Science. 40 (7), 1435-1443 (1999).
- Shestopalov, V. I., Bassnett, S. Three-dimensional organization of primary lens fiber cells. Investigative Ophthalmology & Visual Science. 41 (3), 859-863 (2000).
- Hughes, S. H., Greenhouse, J. J., Petropoulos, C. J., Sutrave, P. Adaptor plasmids simplify the insertion of foreign DNA into helper-independent retroviral vectors. Journal of Virology. 61 (10), 3004-3012 (1987).
- Yan, R. T., Wang, S. Z. Production of high-titer RCAS retrovirus. Methods in Molecular Biology. 884, 193-199 (2012).
- Kingston, R. E. Introduction of DNA into mammalian cells. Current Protocols in Molecular Biology. 64 (1), 1-95 (2003).
- Li, Y., et al. Studying macrophage activation in immune-privileged lens through CSF-1 protein intravitreal injection in mouse model. STAR Protocols. 3 (1), 101060 (2022).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Developmental Dynamics. 195 (4), 231-272 (1992).
- Hallagan, J. B., Allen, D. C., Borzelleca, J. F. The safety and regulatory status of food, drug and cosmetics colour additives exempt from certification. Food and Chemical Toxicology. 33 (6), 515-528 (1995).
- Okada, T. S., Eguchi, G., Takeichi, M. The expression of differentiation by chicken lens epithelium in in vitro cell culture. Development, Growth & Differentiation. 13 (4), 323-336 (1971).
- Menko, A. S., Klukas, K. A., Johnson, R. G. Chicken embryo lens cultures mimic differentiation in the lens. Developmental Biology. 103 (1), 129-141 (1984).
- Parreno, J., et al. Methodologies to unlock the molecular expression and cellular structure of ocular lens epithelial cells. Frontiers in Cell and Developmental Biology. 10, 983178 (2022).
- Edwards, A., Gupta, J. D., Harley, J. D. Photomicrographic evaluation of drug-induced cataracts in cultured embryonic chick lens. Experimental Eye Research. 15 (4), 495-498 (1973).
- Musil, L. S. Primary cultures of embryonic chick lens cells as a model system to study lens gap junctions and fiber cell differentiation. Journal of Membrane Biology. 245 (7), 357-368 (2012).
- West-Mays, J. A., Pino, G., Lovicu, F. J. Development and use of the lens epithelial explant system to study lens differentiation and cataractogenesis. Progress in Retinal and Eye Research. 29 (2), 135-143 (2010).
- Upreti, A., et al. Lens epithelial explants treated with vitreous humor undergo alterations in chromatin landscape with concurrent activation of genes associated with fiber cell differentiation and innate immune response. Cells. 12 (3), 501 (2023).
- Walker, J. L., Wolff, I. M., Zhang, L., Menko, A. S. Activation of SRC kinases signals induction of posterior capsule opacification. Investigative Ophthalmology & Visual Science. 48 (5), 2214-2223 (2007).
- Briskin, M. J., et al. Heritable retroviral transgenes are highly expressed in chickens. Proceedings of the National Academy of Sciences of the United States of America. 88 (5), 1736-1740 (1991).
- Hughes, S. H. The RCAS vector system. Folia Biologica. 50 (3-4), 107-119 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten