Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Micro-injection d’un rétrovirus RCAS(A) recombinant dans une lentille embryonnaire de poulet
Dans cet article
Résumé
Cet article de protocole décrit la méthodologie de micro-injection embryonnaire d’un rétrovirus RCAS(A) dans le cristallin de poulet en tant qu’outil pour étudier in situ la fonction et l’expression des protéines au cours du développement du cristallin.
Résumé
Le poulet embryonnaire (Gallus domesticus) est un modèle animal bien établi pour l’étude du développement et de la physiologie du cristallin, étant donné son haut degré de similitude avec le cristallin humain. Le RCAS(A) est un rétrovirus de poulet compétent pour la réplication qui infecte les cellules en division, ce qui constitue un outil puissant pour étudier l’expression et la fonction in situ des protéines de type sauvage et mutantes au cours du développement du cristallin par micro-injection dans la lumière vide de la vésicule du cristallin aux premiers stades du développement, limitant son action aux cellules proliférantes environnantes. Par rapport à d’autres approches, telles que les modèles transgéniques et les cultures ex vivo , l’utilisation d’un rétrovirus aviaire compétent pour la réplication RCAS(A) fournit un système très efficace, rapide et personnalisable pour exprimer des protéines exogènes dans les embryons de poussins. Plus précisément, le transfert ciblé de gènes peut être confiné aux cellules prolifératives de la fibre du cristallin sans avoir besoin de promoteurs spécifiques aux tissus. Dans cet article, nous allons brièvement passer en revue les étapes nécessaires à la préparation du RCAS(A) du rétrovirus recombinant, fournir un aperçu détaillé et complet de la procédure de micro-injection et fournir des exemples de résultats de la technique.
Introduction
L’objectif de ce protocole est de décrire la méthodologie de micro-injection embryonnaire de lentilles de poulet d’un RCAS(A) (sarcome aviaire compétent pour la réplication/leucose rétrovirale A). L’administration rétrovirale efficace dans un cristallin embryonnaire de poulet s’est avérée être un outil prometteur pour l’étude in vivo du mécanisme moléculaire et de la structure-fonction des protéines du cristallin dans la physiologie, les conditions pathologiques et le développement normaux du cristallin. De plus, ce modèle expérimental pourrait être utilisé pour l’identification de cibles thérapeutiques et le criblage de médicaments pour des affections telles que la cataracte congénitale humaine. Au total, ce protocole vise à définir les étapes nécessaires au développement d’une plateforme personnalisable pour l’étude des protéines du cristallin.
Les poussins embryonnaires (Gallus domesticus), en raison de leur similitude dans la structure et la fonction du cristallin avec le cristallin humain, sont un modèle animal bien établi pour l’étude du développement et de la physiologie du cristallin 1,2,3,4. L’utilisation d’un rétrovirus aviaire compétent pour la réplication RCAS(A) a été considérée comme un système très efficace, rapide et personnalisable pour exprimer des protéines exogènes dans les embryons de poussins. Notamment, il a une capacité unique à confiner le transfert de gène cible aux cellules prolifératives de la fibre du cristallin sans avoir besoin de promoteurs spécifiques aux tissus, en utilisant le délai de développement embryonnaire unique dans lequel la présence d’une lumière vide du cristallin permet une micro-injection in situ de RCAS(A) dans le site restreint pour l’expression de protéines exogènes dans les cellules prolifératives de la fibre du cristallin5, 6,7,8.
La procédure de micro-injection d’embryons de poussins, décrite en détail ici, est basée à l’origine en partie sur les travaux de Fekete et. al.6 et développé par Jiang et. al.8 et a été utilisé comme moyen d’introduire des plasmides viraux et non viraux dans le cristallin des poussins embryonnaires 1,9,10,11,12,13. Dans l’ensemble, les travaux antérieurs démontrent le potentiel de l’utilisation de cette méthodologie pour étudier le développement du cristallin, la différenciation, la communication cellulaire et la progression de la maladie, ainsi que pour la découverte et le test de cibles thérapeutiques pour les affections pathologiques du cristallin telles que la cataracte.
Protocole
Cette étude a été menée conformément à la Loi sur le bien-être des animaux et au Règlement d’application sur le bien-être des animaux, conformément aux principes du Guide sur le soin et l’utilisation des animaux de laboratoire. Toutes les procédures relatives aux animaux ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux du Centre des sciences de la santé de l’Université du Texas à San Antonio. Pour obtenir une vue d’ensemble du protocole, reportez-vous à la figure 1 ; voir le tableau des matériaux pour plus de détails sur tous les matériaux, réactifs et instruments utilisés dans ce protocole.
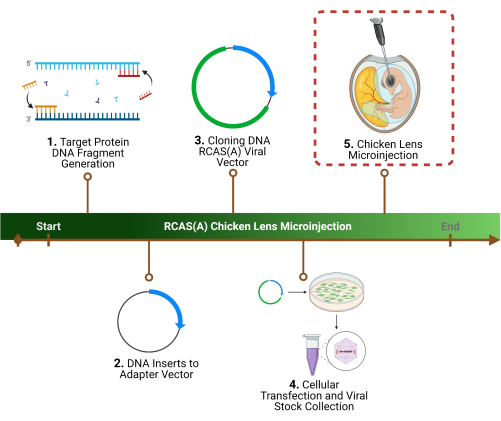
Figure 1 : Plan expérimental. 1. La première étape du protocole est la détermination d’une ou de plusieurs protéines cibles spécifiques, l’identification de la ou des séquences de gènes associées et la génération de fragments d’ADN. 2. Clonage de la ou des séquences de gènes dans un vecteur rétroviral par clonage initial dans un vecteur adaptateur, 3. suivi d’un vecteur viral. 4. Préparation de particules virales à haut titre à l’aide de cellules d’emballage pour la récolte et la concentration. 5. La dernière étape, et l’objectif de ce protocole, est la micro-injection de particules virales RCAS(A) dans la lumière du cristallin. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Préparation de rétrovirus recombinants à haut titre
- Réaction en chaîne par polymérase (PCR) pour fabriquer des fragments d’ADN de protéines cibles
NOTE : Cette section vise à amplifier la séquence d’ADN correspondant à la protéine du cristallin cible. Pour plus de détails, voir 7,8.- Concevoir des amorces pour la PCR, correspondant à la protéine d’intérêt, pour fabriquer des fragments d’ADN avec leurs terminaisons carboxyle dans le cadre avec ou sans séquence d’épitope FLAG (5'-GACTACAAGGACGACGATGACAAG-3'), un codon stop et un site enzymatique de restriction (c’est-à-dire EcoRI) présent à l’intérieur de la région polylinker de CLa12NCO)) selon les spécifications notées dans les protocoles publiés précédemment, avec des séquences pour les enzymes de restriction adéquates1, 7,8,10,11.
- Effectuer la réaction PCR10. Combinez 100 pmol de sens et d’antisens des amorces conçues avec 0,5 μg d’ADNc de connexine (telles que les combinaisons Cx50, Cx43 ou Cx50*43L chimériques), au tampon de réaction PCR de votre choix. Effectuez 30 cycles à 94 °C pendant 1 min, 58 °C pendant 1 min et 72 °C pendant 1 min, suivis d’une extension finale de 10 min à 72 °C.
- Isolez et purifiez les produits PCR à l’aide d’un kit de purification de gel.
- Digérer les produits PCR purifiés à l’aide d’enzymes de restriction de votre choix selon les instructions du fabricant.
- Clonage d’inserts d’ADN dans un plasmide adaptateur
REMARQUE : L’insertion de fragments d’ADN dans un vecteur adaptateur élimine le besoin de cellules/virus auxiliaires pour augmenter la stabilité du vecteur RCAS(A)14. Pour plus de détails, voir 7,8.- Sous-cloner des fragments d’ADN dans un plasmide adaptateur, Cla12NCO, à l’aide d’une réaction de ligature à extrémité collante. Mélangez les fragments de PCR avec des enzymes de restriction et du Cla12NCO dans un rapport de 2 à 5 :1. Effectuer la ligature et la transformation de l’ADN à l’aide de cellules compétentes.
- Isolez l’ADN à l’aide d’un kit d’isolement de l’ADN.
- Séquençez l’ADN pour en assurer l’exactitude.
- Clonage dans le vecteur viral RCAS(A)
NOTE : Des fragments d’ADN sont insérés dans un véhicule (rétrovirus RCAS(A)) pour la transduction stable d’un gène dans les cellules de l’embryon de poussin en développement14,15. Pour plus de détails, voir 7,8,15.- Digérer le fragment d’ADN Cla12NCO du vecteur contenant l’intérêt avec ClaI (1 unité pour 1 μg d’ADN) et isoler les fragments sur gel.
- Sous-cloner les fragments d’ADN dans un plasmide RCAS(A) linéarisé par ClaI. Utilisez l’enzyme de restriction SalI pour distinguer le site ClaI sur le plasmide RCAS(A).
- Confirmer l’orientation correcte des fragments insérés sur les constructions par digestion avec les enzymes de restriction ClaI et Sali.
- Isolez l’ADN à l’aide d’un kit d’isolement de l’ADN.
- Déterminer la concentration d’ADN.
- Transfection de cellules de fibroblastes embryonnaires de poussin (CEF) et récolte de RCAS(A)
NOTA : Les cellules d’emballage de virus, les CEF, sont utilisées pour obtenir/récolter des milieux de culture cellulaire contenant des particules virales15,16. Pour plus de détails, voir 7,8,15.- Transfectez les cellules CEF avec des constructions d’ADN rétroviral recombinantes à l’aide de l’agent de transfection selon les instructions du fabricant.
- Effectuer un transfert Western des cellules transfectées pour examiner leur expression de la protéine d’intérêt.
- Lorsque les cellules transfectées atteignent la confluence, commencez à collecter le milieu surnageant, à le traiter/filtrer de manière appropriée (pour éliminer les débris cellulaires à l’aide d’un filtre de 0,22 μm) et à le stocker à -80 °C jusqu’à ce qu’il soit prêt à être concentré.
- Concentration et titrage des stocks viraux
REMARQUE : La pastille et les grands volumes de milieux dérivés des cellules contenant les particules virales doivent être filtrés. De plus, un test de titre viral doit être effectué pour établir la force du virus contre les cellules hôtes. Pour plus de détails, voir 6,7,8,15.- Décongeler le milieu de culture contenant les virions.
- Essorer le milieu de culture à 72 000 × g pendant 2 h à 4 °C.
- Décanter le surnageant et remettre en suspension la pastille virale avec le milieu résiduel (~50 μL) et conserver à -80 °C jusqu’à utilisation, dans des bouillons viraux de ~10 μL.
- Pour le titrage, à l’aide de cellules QT-6 ou CEF, transfectez les cellules avec une dilution en série des stocks viraux.
- Après la confluence, fixez les cellules à l’aide de 4% de formaldéhyde.
- Immunocoloration pour les protéines gag virales ou procédé pour la phosphatase alcaline par voie histochimique afin d’obtenir le titre, défini comme (unités formant colonie) UFC par millilitre (UFC/mL).

Figure 2 : Instruments et configuration pour la micro-injection de lentilles de poussin. (A) Extracteur manuel de micropipettes à microélectrodes verticales P-30. (1) Encart montrant une micropipette en verre en cours d’extraction. (B) (2) Incubateur d’œufs. Incuber l’œuf de poule pendant ~65-68 h dans un incubateur à 37 °C jusqu’à ce qu’il atteigne le stade 18 (avec une lumière centrale scellée et vide) pour l’injection du rétrovirus. (C) Installation de micro-injection. (3) équipement d’éclairage, (4) pico-injecteur, (5) microscope à dissection, (6) micromanipulateur Drummond, (7) ordinateur/caméra pour la visualisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Micro-injection de lentilles de poussin
- Préparation des fournitures
- Préparation de micropipettes en verre pour micro-injection17
REMARQUE : Les capillaires en verre sont utilisés pour fabriquer des micropipettes en verre avec une pointe et un diamètre extérieur (OD) de ~11 μm pour la micro-injection. La configuration est illustrée à la figure 2A.- Fixez le capillaire en verre borosilicaté aux clips rembourrés en caoutchouc dans l’extracteur de micropipette vertical manuel.
- Réglez la température de chauffage (HEAT 1) à 950 °C et effectuez un pré-tirage pour obtenir un capillaire en verre plus fin et plus doux.
- Réglez la température de chauffage (HEAT 2) à 790 °C et effectuez un tirage secondaire pour produire les micropipettes finales.
- À l’aide d’une meuleuse à micropipettes, affûtez l’ouverture de la pointe à un diamètre extérieur de ~11 μm.
- Pour de futures expériences, conservez les micropipettes en verre dans un tampon de serrage en éponge à l’intérieur d’un bocal en verre.
- Incubation des œufs fécondés jusqu’au stade de développement 18
REMARQUE : Pendant le développement du cristallin, à ~65-68 h de développement embryonnaire, le cristallin se sépare de l’ectoderme et forme une vésicule scellée avec une lumière centrale ; L’injection dans cette lumière vide de la lentille amorce l’expression restreinte aux cellules prolifératives du cristallin 7,8,18.- Incuber les œufs de poule fécondés pendant ~65 à 68 h dans un incubateur à bascule humidifié à 37 °C (figure 2B).
- Préparation de micropipettes en verre pour micro-injection17
- Ouverture de l’œuf de poule
REMARQUE : Cette étape décrit l’identification et l’exposition de l’embryon à la micro-injection. Pour plus de détails, voir 7,8.- Essuyez soigneusement la zone de travail avec de l’éthanol à 70 %.
- Retirez les œufs de l’incubateur, vaporisez-les abondamment avec de l’éthanol à 70 % et laissez-les sécher à l’air libre.
- Placez l’œuf, avec l’extrémité la plus grande de l’œuf vers le haut, sur un porte-œufs.
- À l’aide d’une paire de pinces à dents acérées, faites un trou de ~2 cm de diamètre à l’extrémité la plus large de l’œuf en tapotant soigneusement sur la coquille de l’œuf et en enlevant des fragments de la coquille de l’œuf (figure 3A).
- À l’aide d’un microscope à dissection, localisez l’embryon.
- Une fois que l’embryon et le cristallin du poussin sont localisés, utilisez le microscope à dissection, la pince à dissection fine et les ciseaux pour couper la membrane amnionique qui recouvre immédiatement le haut de l’embryon (Figure 3B).
REMARQUE : Ne coupez pas trop large (juste assez pour exposer l’embryon ~ 0,5 cm x 0,5 cm), sinon les embryons pourraient s’enfoncer dans la masse vitelline ; Évitez également de toucher les vaisseaux sanguins, si possible. - Couvrir l’ouverture de l’œuf avec une boîte de Pétri de 60 mm en préparation des étapes suivantes.
- Micro-injection de stock viral concentré
REMARQUE : Les particules virales contenant des fragments d’ADN de la protéine cible pour la transduction sont insérées dans les cellules à l’intérieur de la lumière du cristallin. La configuration est illustrée à la figure 2C. Pour plus de détails, voir 6,7,8.- Décongeler les stocks de stocks viraux sur la glace.
- Pour visualiser le stock viral pendant l’injection, diluer 1 μL de 10x Fast green dans un flacon de stock viral contenant 10 μL.
- Pour s’assurer qu’il n’y a pas de gros morceaux de matière non dissoute qui pourraient obstruer la micropipette en verre, centrifugez les solutions pendant 10 s à 10 000 × g à 4 °C pour granuler de « gros morceaux » et transférer les surnageants dans de nouveaux tubes, tout en gardant les solutions sur de la glace.
- Sur une boîte de culture de 35 mm x 10 mm, placez un parafilm de laboratoire étiré et ajoutez 1 μL de solution saline stérile (PBS) sur le film (non stérilisé, avec le côté couvert considéré comme « propre »).
- Connectez une micropipette en verre préparée à un pico-injecteur automatique.
- Appuyez sur le mode de remplissage pour remplir la solution saline stérile (PBS) dans une micropipette en verre, puis utilisez le mode d’injection pour tester les 1 μL de liquide alloués.
- Placez un deuxième parafilm de laboratoire étiré sur la surface d’une nouvelle boîte de culture cellulaire de 35 mm x 10 mm et ajoutez 1 μL de bouillons viraux colorés en vert rapide sur le dessus du film.
- Abaissez l’extrémité de la micropipette dans le stock viral et appuyez sur le modèle de remplissage pour remplir la micropipette en verre avec ~1 μL de stock viral.
REMARQUE : Pour éviter le dessèchement, placez l’embout de la micropipette remplie dans une solution saline stérile (PBS) chaque fois qu’il y a une pause dans la procédure. - Abaissez la micropipette en verre remplie, reliée à un injecteur automatique, dans la région cible de la lumière du cristallin embryonnaire à l’aide d’un microscope à dissection.
- Ajustez la source de lumière pour assurer une visualisation claire du contour de la vésicule du cristallin.
REMARQUE : La lumière de la lentille droite (vers le haut) est généralement utilisée pour l’injection et la gauche (vers le bas) est maintenue intacte comme contrôle controlatéral. - Une fois que vous vous êtes assuré que la micropipette est placée au bon endroit à l’intérieur de la lumière de la lentille, injectez 5 à 40 nL de stock viral (Figure 3C).
REMARQUE : La pratique est très nécessaire pour une mise en place optimale de l’injection. - Attendez ~45 s, puis retirez délicatement la micropipette en verre.
- Vérifiez la réussite de la micro-injection dans la lumière de la lentille à l’aide du microscope à dissection en examinant le colorant Fast Green qui doit rester dans la lumière vide de la lentille sans aucune fuite.
- Après la procédure d’injection, scellez l’ouverture de la coquille d’œuf avec du ruban adhésif.
- Remettez l’embryon dans l’incubateur humidifié à 37 °C, sans aucun mouvement de rotation, jusqu’à ce que l’âge embryonnaire souhaité soit atteint pour la dissection du cristallin.
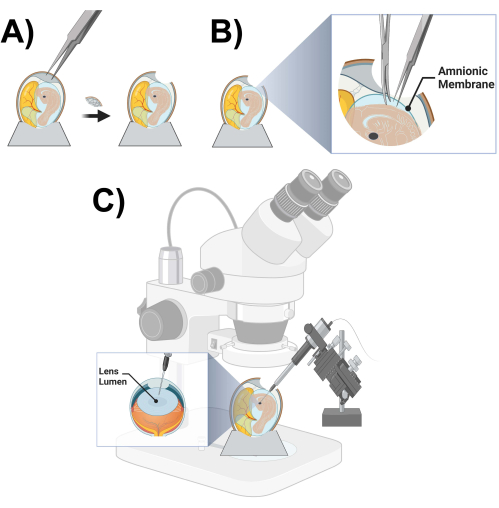
Figure 3 : Préparation et schéma du poussin par micro-injection. (A) Ouverture d’un œuf de poule. (B) Coupe de la membrane amniotique. (C) Schéma de micro-injection de lentilles de poulet. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Après la détermination d’une ou de plusieurs protéines cibles spécifiques et l’identification de la ou des séquences de gènes associées, l’approche expérimentale globale implique le clonage de la ou des séquences de gènes en un vecteur RCAS(A) rétroviral par clonage initial dans un vecteur adaptateur, suivi d’un vecteur viral. Deuxièmement, les particules virales à haut titre sont préparées à l’aide de cellules d’emballage pour récolter et concentrer les virions. Ces deux premières grandes ?...
Discussion
Ce modèle expérimental offre la possibilité d’exprimer la ou les protéines d’intérêt dans le cristallin intact, ce qui conduit à l’étude de la pertinence fonctionnelle de ces protéines dans la structure et la fonction du cristallin. Le modèle de micro-injection embryonnaire de poussin est basé en partie sur les travaux de Fekete et. al.6 et a été développé par Jiang et. al.8 et a été utilisé comme moyen d’insérer à la fois des plasmides viraux et...
Déclarations de divulgation
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Ce travail a été soutenu par les subventions des National Institutes of Health (NIH) : RO1 EY012085 (à J.X.J) et F32DK134051 (à F.M.A), et par la subvention de la Fondation Welch : AQ-1507 (à J.X.J.). Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles des National Institutes of Health. Les figurines ont été partiellement créées avec Biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm Filter | Corning | 431118 | For removing cellular debris from media |
| 35 mm x 10 mm Culture Dish | FisherScientific | 50-202-030 | For using during microinjection |
| Centrifuge | Fisherbrand | 13-100-676 | Spinning down solution |
| Constructs | GENEWIZ | - | For generation of constructs |
| Dissecting microscope | AmScope | SM-4TZ-144A | Visualization of lens for microinjection |
| DNA PCR primers | Integrated DNA Technologies | - | Generation of primers: Intracellular loop (IL)-deleted Cx50 (residues 1–97 and 149–400) as well as the Cla12NCO vector were obtained with the following pair of primers: sense, CTCCTGAGAACCTACATCCT; antisense, CACCGCATGCCCAAAGTACAC ILs of Cx43 (residues 98–150) and Cx46 (residues 98–166) were obtained with the following pairs of primers: sense, TACGTGATGAGGAAAGAAGAG; antisense, TCCTCCACGCATCTTTACCTTG; sense, CACATTGTACGCATGGAAGAG; antisense, AGCACCTCCC AT ACGGATTC, respectively Cla12NCO-Cx43 construct template was obtained with the following pair of primers: sense, CTGCTTCGTACTTACATCATC; antisense, GAACAC GTGCGCCAGGTAC ILs of Cx50 (residues 98–148) or Cx46 (residues 98–166) were cloned by using Cla12NCO-Cx50 and Cla12NCO-Cx46 constructs as the templates with the following pair of primers: sense, CACCATGTCCGCATGGAGGAGA; antisense, GGTCCCC TC CAGGCGAAAC; sense, CACATTGTACGCATGGAAGAG; antisense, AGCACCTCCCATACGGATTC, respectively |
| Drummond Nanoject II Automatic Nanoliter Injector | Drummond Scientific | 3-000-204 | Microinjection Pipet |
| Dual Gooseneck Lights Microscope Illuminator | AmScope | LED-50WY | Lighting for visualization |
| Dulbecco’s Modified Eagle Medium (DMEM) | Invitrogen | For cell culture | |
| Egg Holder | - | - | Homemade styrofoam rings with 2-inch diameter and one-half inch height |
| Egg Incubator | GQF Manufacturing Company Inc. | 1502 | For incubation of fertilized eggs |
| Fast Green | Fisher scientific | F99-10 | For visualization of viral stock injection |
| Fertilized white leghorn chicken eggs | Texas A&M University | N/A | Animal model of choice for microinjection (https://posc.tamu.edu/fertile-egg-orders/) |
| Fetal Bovine Serum (FBS) | Hyclone Laboratories | For cell culture | |
| Fluorescein-conjugated anti-mouse IgG | Jackson ImmunoResearch | 115-095-003 | For anti-FLAG 1:500 |
| Forceps | FisherScientific | 22-327379 | For moving things around and isolation |
| Glass capillaries | Sutter Instruments | B100-75-10 | Glass micropipette for microinjection (O.D. 1.0 mm, I.D. 0.75 mm, 10 cm length) |
| Lipofectamine | Invitrogen | L3000001 | For transfection |
| Manual vertical micropipette puller | Sutter Instruments | P-30 | To obtain glass micropipette of the correct size |
| Microcentrifuge Tubes | FisherScientific | 02-682-004 | Dissolving solution |
| Microscope | Keyence | BZ-X710 | For imaging staining |
| Parafilm | FisherScientific | 03-448-254 | Placing solution |
| Penicillin/Streptomycin | Invitrogen | For cell culture | |
| Pico-Injector | Harvard Apparatus | PLI-100 | For delivering small liquid volumes precisely through micropipettes by applying a regulated pressure for a digitally set period of time |
| rabbit anti-chick AQP0 | Self generated | - | Jiang JX, White TW, Goodenough DA, Paul DL. Molecular cloning and functional characterization of chick lens fiber connexin 45.6. Mol Biol Cell. 1994 Mar;5(3):363-73. doi: 10.1091/mbc.5.3.363. |
| rabbit anti-FLAG antibody | Rockland Immunichemicals | 600-401-383 | For staining FLAG |
| Rhodamine-conjugated anti-rabbit IgG | Jackson ImmunoResearch | 111-295-003 | For anti-AQP0 1:500 |
| Sponge clamping pad | Sutter Instruments | BX10 | For storage of glass micropipette |
Références
- Li, Z., Gu, S., Quan, Y., Varadaraj, K., Jiang, J. X. Development of a potent embryonic chick lens model for studying congenital cataracts in vivo. Communications Biology. 4 (1), 325 (2021).
- Chen, Y., et al. γ-Crystallins of the chicken lens: remnants of an ancient vertebrate gene family in birds. The FEBS Journal. 283 (8), 1516-1530 (2016).
- Coulombre, A. J., Coulombre, J. L. Lens development. I. Role of the lens in eye growth. Journal of Experimental Zoology. 156 (1), 39-47 (1964).
- McKeehan, M. S. Induction of portions of the chick lens without contact with the optic cup. The Anatomical Record. 132 (3), 297-305 (1958).
- Kothlow, S., Schenk-Weibhauser, K., Ratcliffe, M. J., Kaspers, B. Prolonged effect of BAFF on chicken B cell development revealed by RCAS retroviral gene transfer in vivo. Molecular immunology. 47 (7-8), 1619-1628 (2010).
- Fekete, D. M., Cepko, C. L. Replication-competent retroviral vectors encoding alkaline phosphatase reveal spatial restriction of viral gene expression/transduction in the chick embryo. Molecular and Cellular Biology. 13 (4), 2604-2613 (1993).
- Jiang, J. X. Use of retroviruses to express connexins. Methods in Molecular Biology. , 159-174 (2001).
- Jiang, J. X., Goodenough, D. A. Retroviral expression of connexins in embryonic chick lens. Investigative Ophthalmology & Visual Science. 39 (3), 537-543 (1998).
- Shestopalov, V. I., Bassnett, S. Expression of autofluorescent proteins reveals a novel protein permeable pathway between cells in the lens core. Journal of Cell Science. 113 (11), 1913-1921 (2000).
- Liu, J., Xu, J., Gu, S., Nicholson, B. J., Jiang, J. X. Aquaporin 0 enhances gap junction coupling via its cell adhesion function and interaction with connexin 50. Journal of Cell Science. 124 (2), 198-206 (2011).
- Li, Z., et al. The second extracellular domain of connexin 50 is important for in cell adhesion, lens differentiation, and adhesion molecule expression. Journal of Biological Chemistry. 299 (3), 102965 (2023).
- Shestopalov, V. I., Bassnett, S. Exogenous gene expression and protein targeting in lens fiber cells. Investigative Ophthalmology & Visual Science. 40 (7), 1435-1443 (1999).
- Shestopalov, V. I., Bassnett, S. Three-dimensional organization of primary lens fiber cells. Investigative Ophthalmology & Visual Science. 41 (3), 859-863 (2000).
- Hughes, S. H., Greenhouse, J. J., Petropoulos, C. J., Sutrave, P. Adaptor plasmids simplify the insertion of foreign DNA into helper-independent retroviral vectors. Journal of Virology. 61 (10), 3004-3012 (1987).
- Yan, R. T., Wang, S. Z. Production of high-titer RCAS retrovirus. Methods in Molecular Biology. 884, 193-199 (2012).
- Kingston, R. E. Introduction of DNA into mammalian cells. Current Protocols in Molecular Biology. 64 (1), 1-95 (2003).
- Li, Y., et al. Studying macrophage activation in immune-privileged lens through CSF-1 protein intravitreal injection in mouse model. STAR Protocols. 3 (1), 101060 (2022).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Developmental Dynamics. 195 (4), 231-272 (1992).
- Hallagan, J. B., Allen, D. C., Borzelleca, J. F. The safety and regulatory status of food, drug and cosmetics colour additives exempt from certification. Food and Chemical Toxicology. 33 (6), 515-528 (1995).
- Okada, T. S., Eguchi, G., Takeichi, M. The expression of differentiation by chicken lens epithelium in in vitro cell culture. Development, Growth & Differentiation. 13 (4), 323-336 (1971).
- Menko, A. S., Klukas, K. A., Johnson, R. G. Chicken embryo lens cultures mimic differentiation in the lens. Developmental Biology. 103 (1), 129-141 (1984).
- Parreno, J., et al. Methodologies to unlock the molecular expression and cellular structure of ocular lens epithelial cells. Frontiers in Cell and Developmental Biology. 10, 983178 (2022).
- Edwards, A., Gupta, J. D., Harley, J. D. Photomicrographic evaluation of drug-induced cataracts in cultured embryonic chick lens. Experimental Eye Research. 15 (4), 495-498 (1973).
- Musil, L. S. Primary cultures of embryonic chick lens cells as a model system to study lens gap junctions and fiber cell differentiation. Journal of Membrane Biology. 245 (7), 357-368 (2012).
- West-Mays, J. A., Pino, G., Lovicu, F. J. Development and use of the lens epithelial explant system to study lens differentiation and cataractogenesis. Progress in Retinal and Eye Research. 29 (2), 135-143 (2010).
- Upreti, A., et al. Lens epithelial explants treated with vitreous humor undergo alterations in chromatin landscape with concurrent activation of genes associated with fiber cell differentiation and innate immune response. Cells. 12 (3), 501 (2023).
- Walker, J. L., Wolff, I. M., Zhang, L., Menko, A. S. Activation of SRC kinases signals induction of posterior capsule opacification. Investigative Ophthalmology & Visual Science. 48 (5), 2214-2223 (2007).
- Briskin, M. J., et al. Heritable retroviral transgenes are highly expressed in chickens. Proceedings of the National Academy of Sciences of the United States of America. 88 (5), 1736-1740 (1991).
- Hughes, S. H. The RCAS vector system. Folia Biologica. 50 (3-4), 107-119 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon