Method Article
Oligo perfiles Misa (OLIMP) de polisacáridos extracelulares
En este artículo
Resumen
Una manera rápida se describe para obtener información sobre la estructura de los polisacáridos en una matriz extracelular. El método tiene la ventaja de la especificidad de glycosylhydrolases y la sensibilidad de la espectrometría de masas permite pequeñas cantidades de materiales para ser analizados. Esta técnica se puede adaptar para utilizarse directamente sobre el tejido en sí.
Resumen
El contacto directo de las células con el medio ambiente está mediada en muchos organismos por una matriz extracelular. Uno de los aspectos comunes de las matrices extracelulares es que contienen restos de azúcar en forma de complejo de glicoproteínas, proteoglicanos, y / o polisacáridos. Los ejemplos incluyen la matriz extracelular de las células animales y seres humanos que consiste principalmente de proteínas fibrilares y proteoglicanos o las paredes de polisacáridos basados en células de plantas y hongos, y los proteoglicanos / glicolípidos paredes de las células base de bacterias. Todos estos glycostructures juegan un papel vital en la célula a la comunicación celular y celular con el medio ambiente y de señalización.
Un ejemplo extraordinario complejo de una matriz extracelular está presente en las paredes de las células de plantas superiores. Su pared está hecha casi en su totalidad de los azúcares, hasta un 75% del peso seco, y se compone de los biopolímeros más abundantes presentes en este planeta. Por lo tanto, la investigación se lleva a cabo la forma de utilizar estos materiales de la mejor manera un recurso renovable de carbono-neutral para sustituir los productos petroquímicos derivados de combustibles fósiles. El principal desafío para la conversión de combustible sigue siendo la obstinación de las paredes a la degradación enzimática o química debido a la glycostructures únicos presentes en este biocompuesto único.
A continuación, presentamos un método para el análisis rápido y sensible de glycostructures la pared celular vegetal. Este método de generación de perfiles Oligo Misa (OLIMP) se basa en la liberación enzimática de oligosacáridos a partir de materiales de la pared para facilitar glycosylhydrolases específicos y posterior análisis de las mezclas de oligosacáridos solubilizados con láser asistida por matriz de desorción / ionización tiempo de vuelo espectrometría de masas (MALDI-TOF/MS ) 1 (Figura 1). OLIMP requiere paredes de sólo 5000 células para un análisis completo, se puede realizar en el tejido mismo 2, y es susceptible de análisis de alto rendimiento 3. Mientras que la cantidad absoluta de los oligosacáridos solubilizado no se puede determinar por OLIMP la abundancia relativa de los iones de oligosacáridos diferentes pueden ser definidos a partir de los espectros de masas dando ideas acerca de la sustitución de patrón de los polisacáridos nativos presentes en la pared.
OLIMP se puede utilizar para analizar una amplia variedad de polímeros de la pared, sólo limitada por la disponibilidad de enzimas específicas 4. Por ejemplo, para el análisis de polímeros presentes en las enzimas de la pared celular vegetal se encuentran disponibles para analizar el xiloglucano hemicelulosas con un xyloglucanase 5, 11, 12, 13, xilano con un 6,7 endo-β-(1-4)-xilanasa , o de polisacáridos pécticas utilizando una combinación de una poligalacturonasa y metilesterasa 8. Además, utilizando los mismos principios de OLIMP glycosylhydrolase e incluso actividades glicosiltransferasa se puede controlar y decidir 9.
Protocolo
El método se ejemplifica en OLIMP la hemicelulosa principales presentes en las paredes celulares de plantas dicotiledóneas, xiloglucano, utilizando un endoglucanasa como glycosylhydrolase. El método se demuestra con toda plántulas de Arabidopsis como una fuente de tejido de la planta. Material de la matriz extracelular y enzima se puede sustituir en función del análisis deseado utilizando el mismo procedimiento.
1. El aislamiento de la pared celular
- Cosecha de cinco 5 días de plántulas de Arabidopsis toda o la cantidad equivalente de su material deseado y transferirlos a un tubo de reacción 1,5 ml. Asegúrese de que el material se coloca en la parte inferior del tubo.
- Agregue dos bolas de metal de 3 mm para el tubo de reacción en la parte superior de la muestra y la presión de congelación en nitrógeno líquido.
- Triturar la muestra congelada con una molienda (2:30 min, 25 Hz).
- Añadir 1 ml de etanol acuoso al 70% de la muestra. Eliminar las bolas de metal con un imán. Vortex a fondo.
- Centrifugar la muestra a 14.000 rpm durante 10 minutos para que sedimenten los residuos insolubles en alcohol que contiene el material de la pared celular.
- Retire con cuidado el sobrenadante por aspiración. Asegúrese de no perturbar el sedimento.
- Añadir 1 ml de solución de cloroformo / metanol (1:1 v / v). Vortex a fondo para volver a suspender el pellet.
- Centrifugar la muestra a 14.000 rpm durante 10 minutos y retirar con cuidado el sobrenadante por aspiración. Asegúrese de no perturbar el sedimento.
- Secar la muestra utilizando un concentrador.
2. Solubilización de los oligosacáridos
- Para la solubilización del polisacárido particular en forma de sus oligosacáridos resuspender el pellet seco en 25μl de una solución amortiguadora. Para el formato de amonio endoglucanasa 50 mM, pH4.5, se utiliza. Añadir 0.2U de endoglucanasa. Vórtice de la suspensión y el líquido de girar.
- Incubar la muestra durante 16 horas a 37 ° C en una incubadora, con agitación a 300rpm.
- Eliminar el disolvente de la digestión (agua) utilizando un concentrador.
3. MALDI-TOF análisis de los oligosacáridos liberados
- BioRex MSZ 501 perlas de resina de intercambio catiónico se utilizan para eliminar las sales y la enzima de la muestra digerida. Estado de las cuentas mediante la colocación de una alícuota en una columna vacía y el lavado de los granos con grandes cantidades de agua.
- Añadir 5-10 gotas BioRex de la muestra digerida y se secan. A continuación, añadir agua 10μl, por pequeñas cantidades de material de 5μl de agua puede ser utilizada. Sumerja las bolas en la solución de una breve gira el tubo. Incubar durante al menos 10 minutos a temperatura ambiente.
- Lugar 2μl matriz (2,5-ácido hidroxibenzoico (DHB), 10mg/ml en agua) en una placa de MALDI objetivo. Se evapora el disolvente a vacío de la matriz que conduce a cristales homogéneos matriz química.
- 2μl lugar de la solución de la muestra desalada en la parte superior de los cristales de la matriz en el plato blanco.
Si desea detectar un gran número de muestras sólo seguir manchado por un máximo de 3 minutos. Este plazo se asegura de que la primera muestra manchas no está seco todavía. Espere a que un 2 minutos adicionales para asegurar una buena mezcla de re-disuelven la matriz y moléculas de la muestra de oligosacáridos en la última muestra de manchas. Luego, seque la placa de destino en el vacío.
La mezcla de la muestra / matriz debe cristalizar en menos de 1 minuto para permitir la cristalización homogénea. - Lugar de destino en la placa de un espectrómetro de masas MALDI-TOF. La máquina debe estar en modo reflectron positiva con una tensión de aceleración de 20000V y un retraso de 350 nm, el rango de masas seleccionadas deben ser 500 a 3.000 Da (puede cambiar depende de los oligómeros de espera). Empiezan a disparar el láser y recoger 100-200 espectros por muestra, que se compilan para generar un espectro representativo medio (Figura 2A). Iones que representan oligosacáridos específicos se pueden identificar por su masa en carga (m / z) ratio. La intensidad de iones (altura máxima) de todos los iones de interés hay que añadir hasta 100%, resultando en la abundancia relativa de cada uno de oligosacáridos en la muestra (Figura 2B).
4. En el análisis in situ OLIMP
OLIMP también se puede utilizar directamente sobre el tejido omitiendo los pasos de preparación de la pared. A modo de ejemplo etioladas hipocotilos de Arabidopsis como fuente tejido de la planta se utilizan. Una vez más, la endolucanasa se utiliza para determinar la estructura del xiloglucano hemicelulosas. Enzimas y material de tejido puede ser sustituido en función del análisis deseado utilizando el mismo procedimiento.
- Cosecha de una planta de semillero descoloridas y colocarlo en un plato blanco vacío MALDI y dejar que la semilla seca.
- Añadir 0.5μl endoglucanasa (0.4U/μl, disuelto en formato de amonio 50 mM, pH4.5) en la plántula seca en la posición deseada. Asegúrese de que la caída de la enzima toca parte de la placa de destino.
- Coloque la placa de MALDI objetivo en un recipiente cerrado con una humedad de saturación para evitar que la caída de la enzima se seca. Se incuba la placa en la cámara de un6 horas a 37 ° C.
- Secar la placa MALDI objetivo con el tejido de la planta y la caída de la enzima al vacío.
- Añadir 0.5μl matriz (DHB, 10 mg / l) en la parte superior de cada punto enzima seca. Deje reposar por 2 minutos.
- Secar la placa MALDI objetivo al vacío.
- Analizar las muestras con el MALDI-TOF. Lugar de destino placa con el tejido y el punto de enzima / matriz (s) en un espectrómetro de masas MALDI-TOF. La máquina debe estar en modo reflectron positiva con una tensión de aceleración de 20000V y un retraso de 350 nm, el rango de masas seleccionadas deben ser 500 a 3.000 Da (puede cambiar depende de los oligómeros de espera).
- Empiezan a disparar el láser en los cristales / de la matriz siguiente muestra a los tejidos. Asegúrese de que no se alcanza el tejido en sí, como en este caso, el tiempo de vuelo de las moléculas se apagará. Reunir alrededor de 20 a 50 espectros por punto, que se compilan para generar un espectro representativo medio (Figura 3). Iones que representan oligosacáridos específicos se pueden identificar por su masa en carga (m / z) ratio. La intensidad de iones (altura de iones) pueden ser informados y todos los iones de interés hay que añadir hasta 100%, resultando en la abundancia relativa de cada uno de los oligosacáridos en la muestra.
5. Resultados representante
Un ejemplo de un análisis de la OLIMP xiloglucano hemicelulosas presentes en plantas de Arabidopsis se muestra en la Figura 2. Debido a las diferencias de masa de los iones y la enzima conocida bien caracterizados (endoglucanasa) especificidad de los iones pueden ser asignados a determinadas estructuras de oligosacáridos (Figura 2A). Obviamente, isómeros estructurales no pueden ser distinguidos. El supuesto básico para la determinación de la abundancia relativa de los diversos oligosacáridos (Figura 2B) es que su espectrómetro de masas factor de respuesta es muy similar a los oligosacáridos. Como se muestra aquí, la cuantificación OLIMP es altamente reproducible. Sin embargo, tenga en cuenta que la solidez del método depende en gran medida la relación señal-ruido de los iones de oligosacáridos diferentes. Por ejemplo, la contaminación con sales o menores cantidades de oligosacáridos puede disminuir esa proporción.
El análisis OLIMP en el propio tejido (análisis in situ) permite el estudio de áreas muy pequeñas y definidas y consiste en la preparación de muestras muy pequeñas. En el ejemplo que aquí se presenta (Figura 3) no cualitativo (iones mismo), pero las diferencias cuantitativas (variación en la intensidad de iones) se observaron entre los brotes y las raíces de tejidos de la plántula de Arabidopsis. Permutaciones de los OLIMP método de lo que podría dar lugar a tejidos "imagen".
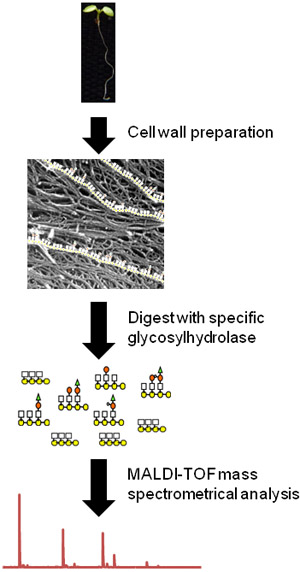
Figura 1. Diagrama de flujo del procedimiento OLIMP con plántulas de Arabidopsis como toda una planta. En primer lugar, el tejido se macera y material de la pared celular se prepara (foto modificada de Fujino et al. 10). A continuación, los oligosacáridos de un polisacárido de pared en particular son liberados con una hidrolasa específica. Por último, la abundancia relativa de los oligosacáridos solubles se determinan mediante MALDI-TOF espectrometría de masas.
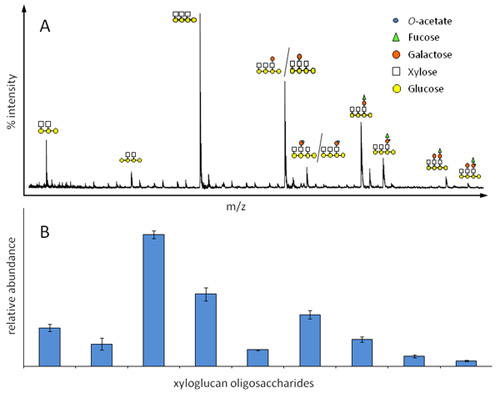
Figura 2. Abundancia relativa de los oligosacáridos xiloglucano en plántulas de Arabidopsis etioladas según lo determinado por OLIMP. A) espectro Representante xiloglucano oligosacáridos de masa, cada ion representa una estructura de oligosacáridos específicos, isómeros estructurales no pueden ser distinguidos. B) diagrama de barras correspondiente para la determinación de la abundancia relativa de oligosacáridos.
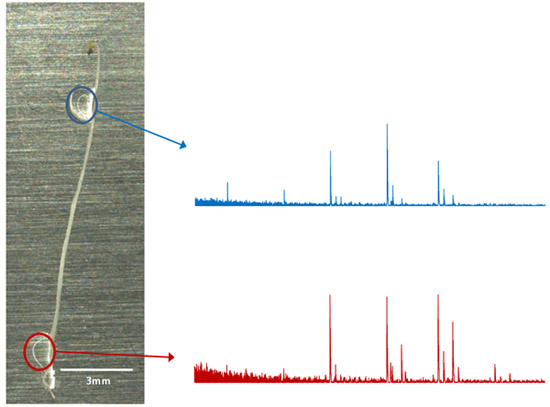
Figura 3. En el análisis de OLIMP situ utilizando plantas de Arabidopsis etioladas como ejemplo. Cada gota de enzimas de digestión / (círculos de colores) pueden ser analizados de forma independiente y un espectro de masas correspondientes pueden ser obtenidos y analizados.
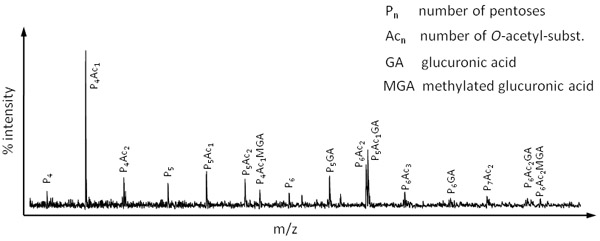
Figura 4. OLIMP espectro del xilano hemicelulosa obtenida por digestión de material de Miscanthus hoja con una xilanasa (Megazyme).
Discusión
El método que aquí se presenta OLIMP permite un análisis muy sensible y rápida de los polímeros presentes en las matrices extracelulares. OLIMP combina la liberación enzimática de oligómeros con posterior análisis MALDI-TOF. La generación de un espectro de MALDI-TOF toma menos de un minuto, por lo que OLIMP es adecuado para una amplia gama de aplicaciones, incluyendo de alto rendimiento estudios tales como pantallas de mutantes. OLIMP no se limita a los polisacáridos de plantas, pero potencialmente se pueden aplicar a una amplia gama de polímeros, sólo limitada por la disponibilidad de determinadas enzimas hidrolíticas. Sin embargo, una limitación de OLIMP es que la abundancia absoluta del polímero no se puede obtener.
Como se mencionó antes OLIMP se puede utilizar para estudiar la estructura de una variedad de polisacáridos presentes en la matriz extracelular de una diversidad de especies. A modo de ejemplo, la Figura 4 representa un espectro OLIMP de la hemicelulosa en las principales especies de gramíneas, xilano. En este caso, el material de la pared celular derivado de la hierba templada Miscanthus fue digerido con una xilanasa.
Divulgaciones
Agradecimientos
Este trabajo fue financiado por la beca del Instituto de Biociencias de la Energía OO0G01.
Materiales
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid | Sigma-Aldrich | 37550 | 10mg/mL in water |
| BioRex MSZ 501(D) Resin | Bio-Rad | 142-7425 | |
| Endoglucanase | Megazyme | E-CELTR | |
| Xylanase M6 | Megazyme | E-XYRU6 | |
| 3mm metal balls | Retsch | 22.455.0011 | |
| Beat mill | Retsch | Mixer Mill MM400 | |
| MALDI-TOF | Shimadzu Corporation | Axima Performance | |
| MALDI target plate | Kratos Analytical | DE4555TA | |
| SpeedVac | Eppendorf | Vacufuge 5301 | |
| Vacuum manifold | EMD Millipore | MSVMHTS00 | |
| Vacuum pump | Welch Allyn | DryFast Ultra 2032 |
Referencias
- Lerouxel, O. Rapid structural phenotyping of plant cell wall mutants by enzymatic oligosaccharide fingerprinting. Plant Physiology. 130 (4), 1754-1754 (2002).
- Obel, N. Microanalysis of plant cell wall polysaccharides. Molecular Plant. 2 (5), 922-922 (2009).
- Mouille, G. Quantitative trait loci analysis of primary cell wall composition in Arabidopsis. Plant Physiology. 141 (3), 1035-1035 (2006).
- Bauer, S. Development and application of a suite of polysaccharide-degrading enzymes for analyzing plant cell walls. PNAS. 103 (30), 11417-11417 (2006).
- Pauly, M. A xyloglucan-specific endo-beta-1,4-glucanase from Aspergillus aculeatus: expression cloning in yeast, purification and characterization of the recombinant enzyme. Glycobiology. 9 (1), 93-93 (1999).
- Aboughe-Angone, S. Cell wall carbohydrates from fruit pulp of Argania spinosa: structural analysis of pectin and xyloglucan polysaccharides. Carbohydr Res. 343 (1), 67-67 (2008).
- Brown, D. M. Comparison of five xylan synthesis mutants reveals new insight into the mechanisms of xylan synthesis. Plant Journal. 52 (6), 1154-1154 (2007).
- Lee, C. The PARVUS gene is expressed in cells undergoing secondary wall thickening and is essential for glucuronoxylan biosynthesis. Plant Cell Physiol. 48 (12), 1659-1659 (2007).
- Obel, N. Pectin may hinder the unfolding of xyloglucan chains during cell deformation: implications of the mechanical performance of Arabidopsis hypocotyls with pectin alterations. Molecular Plant . , (2009).
- Cavalier, D. M., Keegstra, K. Two xyloglucan xylosyltransferases catalyze the addition of multiple xylosyl residues to cellohexaose. Journal of Biological Chemistry. 281 (45), 34197-34197 (2006).
- Leonard, R. Identification of an Arabidopsis gene encoding a GH95 alpha1,2-fucosidase active on xyloglucan oligo- and polysaccharides. Phytochemistry. 69 (10), 1983-1983 (2008).
- Cavalier, D. M., Keegstra, K. Two xyloglucan xylosyltransferases catalyze the addition of multiple xylosyl residues to cellohexaose. Journal of Biological Chemistry. 281 (45), 34197-34197 (2006).
- Lee, C. H. The irregular xylem9 mutant is deficient in xylan xylosyltransferase activity. Plant and Cell Physiology. 48 (11), 1624-1624 (2007).
- Iglesias, N. Apoplastic glycosidases active against xyloglucan oligosaccharides of Arabidopsis thaliana. Plant and Cell Physiology. 47 (1), 55-55 (2006).
- Fujino, T., Sone, Y., Mitsuishi, Y., Itoh, T. Characterization of cross-links between cellulose microfibrils, and their occurrence during elongation growth in pea epicotyl. Plant Cell Physiol. 41 (4), 486-486 (2000).
- Vanzin, G. F. The mur2 mutant of Arabidopsis thaliana lacks fucosylated xyloglucan because of a lesion in fucosyltransferase AtFUT1. PNAS. 99 (5), 3340-3340 (2002).
- Cavalier, D. M. Disrupting two Arabidopsis thaliana xylosyltransferase genes results in plants deficient in xyloglucan, a major primary cell wall component. Plant Cell. 20 (6), 1519-1519 (2008).
- Hilz, H. A comparison of liquid chromatography, capillary electrophoresis, and mass spectrometry methods to determine xyloglucan structures in black currants. Journal of Chromatography A. 1133 (1-2), 275-275 (2006).
- Pauly, M. Effects of the mur1 mutation on xyloglucans produced by suspension-cultured Arabidopsis thaliana cells. Planta. 214 (1), 67-67 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados