Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Las sinapsis cuantificar: un ensayo basado en inmunocitoquímica para cuantificar número de sinapsis
En este artículo
Resumen
Este protocolo detalla la forma de cuantificar el número de sinapsis en cultivos neuronales disociadas y en las secciones del cerebro utilizando inmunocitoquímica. Utilizando anticuerpos específicos contra el compartimiento, que etiqueta los terminales presinápticos, así como los sitios de especialización post-sináptica. Se define como puntos de sinapsis de colocalización entre las señales generadas por estos marcadores.
Resumen
Uno de los objetivos más importantes de la neurociencia es comprender las señales moleculares que dan instrucciones a las primeras etapas de la formación de sinapsis. Como tal, se ha convertido en imprescindible para desarrollar métodos objetivos para cuantificar los cambios en la conectividad sináptica. A partir de la fijación de la muestra, este protocolo detalles de cómo cuantificar el número de sinapsis en cultivos neuronales disociadas y en las secciones del cerebro utilizando inmunocitoquímica. Utilizando anticuerpos específicos contra el compartimiento, que etiqueta los terminales presinápticos, así como los sitios de especialización post-sináptica. Se define como puntos de sinapsis de colocalización entre las señales generadas por estos marcadores. El número de estos colocalizations se cuantifica mediante un enchufe en el Analizador de puntos lagrimales (escrito por Bary Wark, disponibles bajo petición, c.eroglu cellbio.duke.edu @) en la plataforma de software ImageJ análisis. El ensayo de sinapsis se describe en este protocolo se puede aplicar a cualquier tejido neural preparación o la cultura para los que tiene marcadores selectivos de pre-y post-sinápticas. Este ensayo sinapsis es una herramienta valiosa que puede ser ampliamente utilizada en el estudio del desarrollo sináptico.
Protocolo
Soluciones para preparar:
- Anticuerpos Buffer:
- 150 mM NaCl
- 50 mM Tris-Base (Fisher, Cat No:. BP152-5, 50 mM) - 1,21 g
- 1% de BSA (Sigma, Cat No:. A2153, 1%) - 2,0 g
- 100 mM de L-lisina (Sigma, Cat No:. L-1137, 100 mM) - 3,65 g
- Ajustar el pH a 7.4
- 0,04% de azida
- Ajuste el volumen a 200 ml con agua destilada H 2 O.
- Filtrar a través de 0.22μm de filtro (Millipore, Cat No:. SCGPU02RE).
- PFA diluyente:
- 168 ml de 0,5 M Na 2 HPO 4 (dibásico)
- 72 ml 0,5 M Na 2 HPO 4 (monobásico)
- 660 ml de H2O destilada
- 4% PFA fijador para cultivos de neuronas (solución # 2):
- 10 ml 16% PFA solución (Microscopía Electrónica de Ciencias, Cat No:. 15711)
- 30 ml 4% PFA diluyente (solución # 2)
- PFA al 4% en PBS:
- 4 g PFA (Electron Ciencias Microscropy, Cat No:. 19210)
- 100 ml de PBS (Invitrogen, Cat. N º. 20012-027)
- Calor a 40 ° C, agitación durante una noche.
- Filtrar a través de un filtro de 0.22μm (Millipore, Cat No:. SCGPU02RE)
- Tampón de bloqueo (el volumen total (de 24 y placa) = (# cubreobjetos +1) x 200μl)
- 50% de anticuerpos buffer (solución # 1)
- 50% de suero normal de cabra (Gibco, Cat. N º. 16210)
- 0,2% de Triton X-100 (Roche Diagnostics GmbH, Cat No:. 9002-93-1)
- 30% de sacarosa en PBS
- 30 g de sacarosa (MP Biomedicals, Inc., Cat No:. 821713)
- 70 ml de PBS (Invitrogen, Cat. N º. 20012-027)
- Mezclar con un stirbar hasta que la sacarosa se encuentra en disolución.
- Llevar el volumen hasta 100 ml con PBS
- Filtrar con un filtro 0,22 m (Millipore, Cat No:. SCGPU02RE)
Preparación de los cultivos neuronales:
El protocolo aquí descrito es aplicable a cualquier cultivos primarios de neuronas cultivadas en cubreobjetos de 12 mm de vidrio (Karl Hecht, No. O, Cat No:. 99.010) en placas de 24 pocillos (Falcon, 35-3047). Por ejemplo, en nuestro laboratorio que las células ganglionares de la retina de rata cultura (CGR) purificada a partir de retina de la rata cosecha de P5-7 1,2 animales. Las células se cultivaron en cubreobjetos de vidrio recubiertas con poli-D-lisina (Sigma, Cat No:. P6407) (. Cultrex, Cat No: 3400-010-01) y el ratón laminina. Utilizamos esta preparación la cultura en un par de maneras diferentes para nuestro ensayo sinapsis. Una manipulación que llevamos a cabo consiste en el cultivo de CGR, ya sea en la presencia o ausencia de astrocitos factores secretados sinaptogénica. Por otra parte, también se emplean estas diferentes condiciones de tratamiento en los experimentos donde CGR han sido transfectadas para sobreexpresar una proteína de interés. En este último caso, co-transfectar las células con una etiqueta de células (por ejemplo, las buenas prácticas agrarias o tdTomato). Estas aproximaciones experimentales afectan cómo se lleva a cabo ciertos pasos de un ensayo de la sinapsis, que aclaramos a continuación.
1. Fijación disociada CGR purificada
- Eliminar los medios de cultivo de los pozos que contienen RGC y añadir 500 l (para una placa de 24 pocillos) 4% de paraformaldehído (PFA) precalentada a 37 ° C a cada pocillo. Permiten a las células para corregir durante 7 minutos a temperatura ambiente.
- Después de la fijación de enjuague células 3 veces con tampón fosfato salino (PBS) (Invitrogen, Cat. N º. 20.012-027). IMPORTANTE: Las células nunca se debe dejar sin líquido en los pozos, una vez que un buffer se elimina de un bien que debe ser rápidamente reemplazado por el siguiente búfer. En este punto, las células están listas para inmunotinción.
2. El bloqueo no específica los puntos de unión de la CGR
- Prepare el amortiguador de bloqueo que contiene 50% de lo normal de suero de cabra (NGS, Gibco, Cat. N º. 16210) y el 0,2% de Triton X-100 (Roche Diagnostics GmbH, Cat No:. 9002-93-1). Después de la eliminación de PBS de cada pocillo, añadir 200 l de la solución amortiguadora de bloqueo a cada pocillo y bloquear durante 30 minutos a temperatura ambiente.
- Retire el amortiguador de bloqueo y enjuagar tres veces con PBS.
3. La aplicación de la solución de anticuerpo primario
- IMPORTANTE: Asegúrese de elegir anticuerpos primarios de los marcadores pre y post-sinápticas que se obtienen de diferentes especies.
- Prepare una dilución de anticuerpo primario en el buffer de anticuerpos del 90%, 10% de solución de NGS que contiene el par de anticuerpos pre y post-sináptica de su elección. Por ejemplo conejo anti-synapel pecado (marcador presináptico) (1:750, dominio citosólico, Sistemas de Synaptic) y el ratón anti-Homer (marcador postsináptico) (1:500, el ratón, los sistemas de Synaptic). IMPORTANTE: Centrífuga dilución del anticuerpo primario durante 5 minutos a la máxima velocidad en una centrífuga de mesa de trabajo para eliminar los anticuerpos precipitados.
- Añadir 200 l solución de anticuerpo primario en cada pozo.
- Incubar toda la noche a 4 ° C. La placa se debe colocar en un recipiente más grande que se humedece para evitar el secado de la solución primaria. PUNTO RUPTURA: Las células pueden permanecer en la mezcla de anticuerpo primario durante hasta 3 días antes de continuar con el protocolo.
- Al día siguiente, eliminar el anticuerpo primario de cada bien y enjuague los pozos tres veces con PBS.
4. La aplicación de la solución de anticuerpo secundario
- Prepare una solución de anticuerpo secundario que contiene sus anticuerpos secundarios diluido 1:1000 en tampón que contiene anticuerpos NGS 10%. IMPORTANTE: Centrífuga dilución del anticuerpo secundario durante 5 minutos a máxima velocidad en una centrífuga de mesa superior para eliminar el anticuerpo precipitado. Saltarse este paso resulta en el fondo de anticuerpos secundarios.
Las células no transfectadas: En ausencia de una etiqueta de celda, utilice Alexa-594 y Alexa-488 secundarias conjugado para el etiquetado de los marcadores pre y post-sinápticas, respectivamente. Por ejemplo, podemos utilizar cabra anti-conejo Alexa594 para etiquetar los anticuerpos anti-sinapsina y cabra anti-ratón Alexa-488 secundario conjugado con la etiqueta del anticuerpo anti-homer. IMPORTANTE: El uso de Alexa-488 secundarias conjugado de anticuerpos primarios más débiles de la señal.
Células transfectadas: Elija secundaria de anticuerpos que se adaptan a todo el espectro de excitación-emisión de la etiqueta de células fluorescentes. Por ejemplo, cuando llamamos células transfectadas con tdTomato usamos Alexa-647 conjugado de cabra anti-conejo de reconocer el anticuerpo anti-sinapsina y Alexa-488 conjugado de cabra anti-ratón de reconocer el anticuerpo anti-homer. Además, el uso de NGS en este protocolo es el resultado de nuestra elección de secundaria de anticuerpos producidos en cabra. - Añadir 200 l solución secundaria de anticuerpos a cada pocillo.
- Después de la incubación durante dos horas a temperatura ambiente en un lugar oscuro, enjuague 3 a 4 veces con PBS.
5. Cubreobjetos de montaje
- Cubreobjetos se montan en medio de montaje Vectashield con DAPI (Vector Laboratories Inc., Cat No:. H-1200) en portaobjetos de vidrio (VWR científica, Cat No:. 48311-703).
- Aplique suavemente el esmalte de uñas transparente en los bordes del cubreobjetos y dejar secar por lo menos 30 minutos en un lugar seco y oscuro. IMPORTANTE: Evite el codazo o mover el cubreobjetos durante la aplicación del esmalte de uñas ya que esto daría lugar a Sheering de las células.
6. Imágenes
Para la imagen, un microscopio de fluorescencia equipado con una cámara capaz de tomar imágenes en 4 canales diferentes es necesario ser capaz de imagen tanto en los marcadores sinápticos, el relleno de la celda y los núcleos (DAPI / opcional). Las células deben ser fotografiado con un objetivo de 63x de inmersión en aceite. Nos imagen utilizando el microscopio Zeiss AxioImager fluorescencia Zeiss con el Plan-Apochromat DIC aceite 63x/1.4 ∞ / 0.17 objetivo.
- Seleccione las celdas que por lo menos dos diámetros celulares fuera de sus vecinos más cercanos. Para evitar sesgos y asegurar la aleatoriedad de la selección de la celda si la visualización de las células no transfectadas, seleccione las celdas en el canal de DAPI, luego tomar imágenes en todos los canales. Si la visualización de las células transfectadas seleccionar las celdas en el canal correspondiente a la etiqueta fluorescente para identificar las células transfectadas (por ejemplo, tdTomato).
- Adquisición de las imágenes:
Las células no transfectadas: Para cada celda seleccionada, obtener imágenes de 8 bits en la GFP y canales de Texas Red. La imagen superpuesta pseudocolored debe tener sus marcadores pre-y post-sinápticas en rojo y verde, respectivamente.
Células transfectadas: Para cada celda seleccionada obtener imágenes de 8 bits en la GFP, Texas Red y Cy5 (o Cy5.5) canales. La imagen superpuesta pseudocolored debe tener sus marcadores pre-y post-sinápticas en rojo y verde, respectivamente. Pseudo color de su relleno de la celda en azul.
7. Análisis de Imágenes y co-localizados cuantificación puntos lagrimales
- Utilizamos el programa analizador de puntos lagrimales para la cuantificación de co-localizados puntos lagrimales sináptica. Puntos lagrimales plug Analyzer en que está escrito por Bary Wark, y está disponible bajo petición (c.eroglu cellbio.duke.edu @). Analizador de puntos lagrimales se ejecuta en ImageJ 1,26 (http://rsbweb.nih.gov/ij/, las nuevas versiones de ImageJ no se puede ejecutar la aplicación). Para instalar el Analizador de puntos lagrimales sólo tiene que colocar la carpeta de aplicaciones descargadas en la carpeta "Plugins" en el directorio de ImageJ 1.26.
- Abra una de las imágenes con ImageJ. Utilice una de las herramientas de selección en la ImagEJ menú para determinar la región de interés (ROI). Regularmente uso de la herramienta de selección circular para seleccionar una región de aproximadamente un diámetro de células radial alrededor del soma de interés.
- Con su región de interés (ROI) seleccionado, vaya al menú de plugins y seleccione "puntos lagrimales Analyzer".
- En el "Análisis de las opciones" de la ventana que aparece, seleccionar "Canal Rojo", "Canal Verde", el primer "fondo Restar" y "archivo de conjunto de resultados ...." Haga clic en "Aceptar". Se le pedirá para definir una ubicación para guardar los resultados in Estos resultados pueden ser exportados a Excel para su posterior análisis.
- En la ventana que aparece a continuación, asegúrese de que un radio de balanceo de la bola de 50 se selecciona y se desactive el "fondo blanco" (esta modificación no es necesaria pero a menudo es preferido por los usuarios de la aplicación para facilitar la visualización). Haga clic en "Aceptar".
- Una nueva ventana aparecerá al lado de una máscara que corresponde con la imagen del canal rojo. Ajustar el umbral hasta que sienta que la máscara roja corresponde lo mejor posible a la mayor cantidad puntos lagrimales persona discreta, sin introducir mucho ruido. Este es uno de los pasos más subjetiva de este protocolo, así que tenga cuidado para desarrollar un enfoque coherente. Haga clic en "Done". Establecer el tamaño mínimo de puntos lagrimales y 4 píxeles y modificar nada más. Haga clic en "Aceptar".
- Repita el paso anterior, esta vez por el canal verde.
- Una vez completado el paso anterior, el plugin proporcionar datos cuantitativos correspondientes a los puntos lagrimales en cada canal por separado y puntos lagrimales colocalized entre los dos canales.
Secciones del cerebro:
El ensayo de la sinapsis se puede aplicar a cryosections del cerebro, y siempre a cualquier tejido del sistema nervioso otras (como la médula espinal o de la retina) que hay un par marcador adecuado pre-y post-sinápticas (con anticuerpos que funcionan bien en las secciones) que puede ser utilizado para identificar las sinapsis que desea cuantificar. El ensayo de sinapsis puede revelar la regulación temporal de la formación de sinapsis en una región cerebral determinada y se pueden cuantificar los efectos en la conectividad sináptica en animales transgénicos, o en una muestra que ha sido manipulado de alguna otra manera.
1. La recolección de tejido cerebral de ratones
Todos los procedimientos con animales debe hacerse en concordancia con los protocolos de animales IACUC.
- La eutanasia a los ratones del desangrado y la perfusión con PBS. Perfusión con PBS es crucial para la extracción de sangre y reduce la señal de fondo para los procedimientos de tinción. IMPORTANTE: No perfundir con fijadores tales como PFA al 4%. Esto afectará negativamente a los resultados de la tinción.
2. Fijación
- Fix a todo el cerebro en 4% PFA en PBS a 4 ° C durante la noche. Al día siguiente enjuagar el cerebro tres veces con PBS.
- Cryoprotect el cerebro, colocándolos en un 30% de sacarosa en PBS. El tejido inicialmente va a flotar. Mantener a 4 ° C hasta que el tejido se va al fondo. En ese momento el crioprotector es completa.
3. Inclusión / muestras criostáticas
- Insertar los cerebros en la orientación deseada para el corte (por ejemplo, sagital o coronal) en una solución 2:1 de sacarosa al 30%: (. Tissue-Tek, Cat No: 4583) octubre en PBS. Congelar el cerebro incrustado en una superficie plana de hielo seco. Congelados cerebros incorporada se puede colocar en bolsas de congelación y se mantiene a -80 hasta un año antes de cortar.
- Criosección el tejido en 12-16μm secciones y montaje en portaobjetos de vidrio (Sigma, Cat No:. S4651). Las diapositivas se pueden almacenar hasta por una semana a -80 ° C antes de la tinción.
- Diapositivas a teñir se debe secar a 37 ° C durante 30 minutos y se enjuaga con PBS 1x para eliminar octubre residual.
4. Secciones bloqueo
- Bloquear las secciones en el 20% suero normal de cabra (NGS) en PBS durante una hora a temperatura ambiente. IMPORTANTE: No incluya Triton X-100 en esta etapa. Antes de la adición de la solución de bloqueo, puede crear una barrera hidrofóbica en torno a las secciones en la diapositiva utilizando un lápiz PAP Elite (DBS, Cat No:. K039)
5. La aplicación de Anticuerpos primarios
- Diluir los anticuerpos primarios en PBS con 0,3% Triton y NGS 10%.
- En las secciones del cerebro que utilizamos PSD-95 (Zymed, conejo, 1:500) para etiquetar glutamatérgica compartimentos postsináptica y VGlut1 o VGlut2 (Chemicon, conejillo de indias, 1:2500) para etiquetar glutamatérgica terminales presinápticos. Centrífuga dilución del anticuerpo primario durante 5 minutos a máxima velocidad en una centrífuga de mesa superior para eliminar el anticuerpo precipitado si está presente.
- Secciones se incuban en una solución de anticuerpo primario durante 36-60 horas a 4 ° C.
6. La aplicación de anticuerpos secundarios
- Lavar el anticuerpo primario mediante la inmersión de las diapositivas 3 veces en PBS durante 15 minutos cada uno. Después de este paso, asegúrese de proteger a las diapositivas de la luz directa.
- Diluirsecundaria de anticuerpos en una dilución de 1:200 en el mismo buffer como se describe para los anticuerpos primarios. Por ejemplo, para VGlut/PSD95 tinción usamos cabra anti cobaya Alexa 488 (Vglut) y de cabra anti conejo Alexa 594 (PSD-95) (Invitrogen).
- Incubar las secciones en una solución de anticuerpo secundario durante 2 horas a temperatura ambiente en la oscuridad.
- Lave la secundaria anticuerpos no unidos el portaobjetos por inmersión de las diapositivas de 4 veces en PBS durante 15 minutos cada uno.
7. Montaje
- Añadir pequeñas gotas de medio de montaje Vectashield con DAPI (Vector Laboratories Inc.) en portaobjetos de vidrio (VWR científica) y luego cubrir el portaobjetos con cubreobjetos (VWR Scientific, N º 1,5, 48393 241). Aplicar esmalte de uñas para inhibir el movimiento de los cubreobjetos.
8. Imágenes
IMPORTANTE: Un microscopio confocal con un mínimo de 3 canales se requiere para la imagen se describe aquí. Nos imagen en una Leica SP5 láser microscopio confocal de barrido con un objetivo de inmersión 63x.
- Regiones sinápticas del cerebro de interés deben ser seleccionados para el análisis constante entre las secciones. Por ejemplo, en nuestro ensayo sinapsis de las células ganglionares de la retina las sinapsis en las neuronas collicular superior, que la imagen de la región externa collicular superiores al lado del colículo inferior que abarca la capa sináptica que recibe terminales retinocollicular 7,8,9. Nos imagen y cuantificar las sinapsis en la parte superior 150 micras zona sináptica del colículo superior donde CGR son conocidos para establecer contactos sinápticos 9.
- Para cada sección, tanto en los 488 y 594 canales, que la imagen de serie de secciones ópticas a 0,33 m en intervalos de una profundidad total de 5 m para un total de 15 secciones ópticas. Por lo menos 3 secciones de cada animal debe ser reflejado y por lo menos tres animales deben ser incluidos a partir de una determinada condición experimental.
- Proyecciones de máxima intensidad (MIP) se generan a partir de grupos de 3 secciones consecutivas cediendo cinco PIP representa 1μm de la profundidad de cada uno. Estos precios mínimos se han cuantificado.
9. La cuantificación de la imagen
- Puede llevar a cabo exactamente como se describe a CGR, sin embargo, la forma y el tamaño del retorno de la inversión va a cambiar en función de qué región de las imágenes que desea cuantificar.
Claves del éxito:
Purificada CGR:
- Antes de fijar CGR purificado (o la cultura disociada otros), asegúrese de pre-calentamiento PFA al 4% en un baño de agua a 37 ° C durante 20-25 minutos ~ (se almacena a 4 ° C en cualquier otro momento, no usan disoluciones PFA más de 7 días).
- En particular para los cultivos de neuronas, es recomendable no usar una aspiradora durante el lavado de todos los pasos de aclarado. Métodos más suaves tales como el uso de una pipeta Pasteur y una pera de succión mejoran notablemente la calidad de tinción.
- Tenga cuidado de no dejar que las células se secan durante el enjuague pasos.
- Evitar codazos o se mueve el cubreobjetos durante la aplicación de esmalte de uñas ya que al hacerlo puede resultar en la esquila de las células en el portaobjetos.
- De girar todos los anticuerpos primarios y secundarios para eliminar los anticuerpos precipitados que tendrá un impacto negativo de tinción.
- Asegúrese de seleccionar anticuerpos primarios de los marcadores pre-y post-sináptica se crió en las diferentes especies. De lo contrario, eliminará su capacidad para discriminar entre las dos señales después de la aplicación de anticuerpos secundarios.
Las secciones del cerebro:
- No perfundir sus ratones con fijadores como el PFA.
- No incluya Triton X-100 en su solución de bloqueo de las secciones del cerebro. Si lo hace, daña la calidad de la tinción de los marcadores presináptica, en particular los marcadores presináptica que se asocian a las vesículas sinápticas.
- El uso de un microscopio confocal de imágenes se requiere para la adquisición de la imagen que es de buena calidad suficiente para realizar un análisis de la sinapsis.
Los resultados representativos:
El ensayo de sinapsis se ha descrito anteriormente está diseñado para captar los cambios en la conectividad sináptica in vitro e in vivo. En nuestro laboratorio, utilizamos el ensayo de sinapsis para determinar el efecto de cualquiera de las moléculas individuales o múltiples de astrocitos-oculta en la formación de sinapsis. Solemos realizar este ensayo sobre la sinapsis CGR purificada que la cultura in vitro.
Un efecto bien descrito de la aplicación crónica de los astrocitos acondicionado media (ACM) en cultivos purificados RGC es un aumento de varias veces en el número de sinapsis que se forman entre CGR 3,4,5,6. Figura 1A y 1B muestran imágenes representativas de untransfected CGR purificada tratados con cualquiera de los medios de cultivo basal o con ACM. Después de la tinción de los marcadores de excitación pre-y post-sinápticas, el aumento de ACM-inducida en sformación ynapse es cualitativamente evidentes (Figura 1A, 1B). De hecho, este hallazgo ha sido corroborado por varios estudios que han utilizado de electrofisiología para demostrar que ACM inducida por las sinapsis son la microscopía electrónica y funcionales para demostrar que las sinapsis son ultraestructuralmente normales 3,4,6. Otros trabajos en nuestro laboratorio ha identificado la subunidad del canal de calcio α2δ-1 como el receptor neuronal de una molécula muy sinaptogénica astrocito-secretada, trombospondina 3. Aquí se incluyen los resultados de un experimento en el purificada CGR que se realizó para determinar si el aumento de los niveles de α2δ-1 mejora aún más la ACM inducida por la formación de sinapsis (Figura 3).
CGR se cotransfectaron, ya sea con un vector vacío o con una codificación de la construcción de α2δ-1 con una construcción separada de codificación tdTomato después de 5 días in vitro (DIV5). Después de un tratamiento crónico, ya sea con ACM o GM, CGR fueron fijadas y teñidas en DIV 11. Inmunomarcaje siguientes marcadores de pre-y post-sinápticas de las sinapsis excitadoras, vemos un aumento cualitativo evidente en el número de sinapsis en purificado CGR manifieste un vector vacío (pcDNA3.1) o α2δ-1 (Fig. 1C, 1D). Se cuantifica el efecto sinaptogénica de ACM con puntos lagrimales analizador para contar el número de sinapsis (Fig. 2) por lo menos 15 neuronas de cada condición. Una muestra de este tamaño nos permite calcular el número medio de sinapsis por neurona y encontrar una diferencia estadísticamente significativa, aproximadamente 10 veces mayor en las sinapsis formadas por ACM tratados con las neuronas que expresan un vector vacío (Fig. 3, barras grises). Además, nos muestran que la sobreexpresión de α2δ-1 lleva a una potenciación significativa de la formación de sinapsis ACM-inducida (~ 20 veces. Fig. 3, barras de color negro).
Además de los cultivos de neuronas, podemos cuantificar la densidad sináptica en diferentes regiones del cerebro con esta técnica. El colículo superior es una estructura cerebral que recibe las proyecciones retinocollicular, procedentes de la CGR en la retina 7,8,9. Durante el desarrollo postnatal, el número de sinapsis excitadoras formado por CGR en sus objetivos en el colículo superior aumenta drásticamente a partir de P7 a P21 7,8,9.
Utilizando nuestra técnica de cuantificación, se muestra que el número de sinapsis retinocollicular formado en el superior aumenta colículo de P7 a P14. Para ello, se cuantificó la densidad sináptica en P7 y otra vez en el P14. Nos mancha el colículo superior a la PSD-95 (postsináptica) y para VGlut2 (marcador específico de sinapsis presináptica RGC en el colículo superior). La región exterior sináptica del colículo superior fue fotografiada (Fig. 4A) y co-localizados VGlut2/PSD-95 sinapsis se cuantificaron (Fig. 4B, 4C) de al menos 3 secciones por animal y por lo menos de 3 animales por punto de tiempo. La cuantificación de los datos obtenidos demuestran claramente una más de tres veces el aumento significativo en el número de sinapsis entre P7 y P14. Estos resultados están de acuerdo con los resultados publicados anteriormente la utilización de la microscopía electrónica (Fig. 4D) 9.
En conclusión, el método de cuantificación número de sinapsis que describimos aquí es una herramienta útil para determinar el número y la densidad de sinapsis en la cultura y en los tejidos neuronales, lo que nos permite estudiar los efectos de la manipulación de la formación de sinapsis in vitro o in vivo.
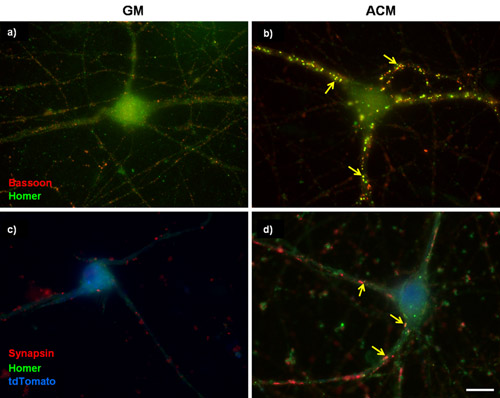
Figura 1: tinción Representante sináptica en purificado CGR. (A y B) 3 días in vitro (DIV) CGR fueron cultivadas, ya sea en (A) medio basal de crecimiento (GM) o (B) a favor de sinaptogénica ratón astrocitos medio condicionado (ACM) por un período adicional de 6 días. Las células se marcaron entonces para fagot (presináptica, rojo) y jonrón (postsináptica, verde). Ratón ACM estimula fuertemente la formación de sinapsis entre CGR según lo determinado por el aumento en el número de co-localizados fagot y puntos lagrimales jonrón. (C y D) CGR 5div fueron transfectadas con un plásmido que sobreexpresan la subunidad del canal de calcio α2δ-1. Las células transfectadas fueron identificados con un relleno de células tdTomato (azul) y se han manchado de sinapsina marcador presináptico y postsináptico jonrón marcador. Las flechas indican las sinapsis. Barra de escala representa el 20 micras.
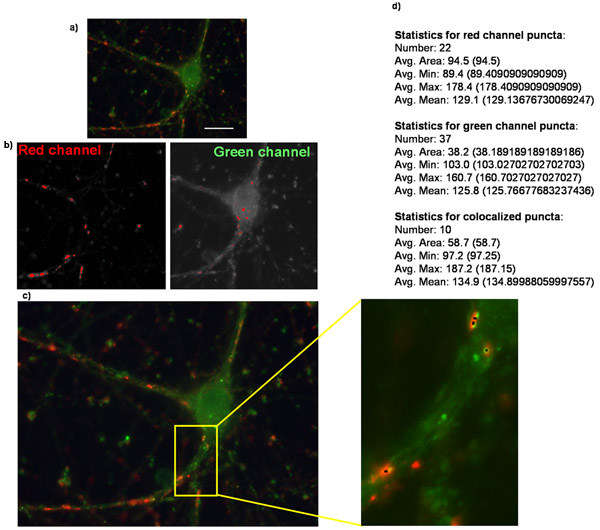
Figura 2:. Cuantificación del número de sinapsis con puntos lagrimales Analizador Aquí se muestra un ejemplo de (a) una imagen original de un purificado de células ganglionares de la retina que sobreexpresan el receptor de trombospondina-1 α2δ y se tiñe de sinapsina marcador presináptico y postsináptico jonrón marcador. (B) Las imágenes correspondientes a las máscaras creadas en cada canal en el análisis de puntos lagrimales en el Analizador de puntos lagrimales. (C) puntos lagrimales Analzyer creará una imagen como la que se muestra aquí, en el que se indican con puntos lagrimales pequeños puntos negro (recuadro). También shown es (d) los resultados numéricos de la aplicación donde se proporcionan varios puntos lagrimales, junto con varios otros parámetros en forma de texto / numérico (texto destacan en negrita).
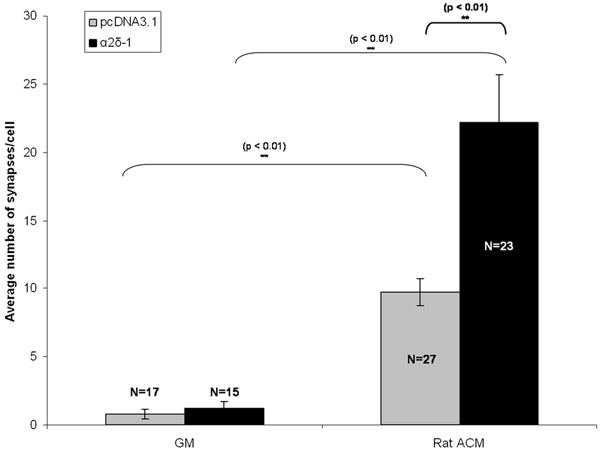
Figura 3:. Representante resultado para el ensayo de sinapsis Aquí se muestra el efecto del tratamiento crónico sinaptogénica de la CGR con los astrocitos acondicionado media (ACM) en la CGR transfectadas que expresan bien el vector vacío (pcDNA3.1, barras grises) o el receptor de trombospondina-1 α2δ . Las barras de error representan el SEM. GM = medios de cultivo. ACM = (Rata) los medios de comunicación contitioned astrocitos.
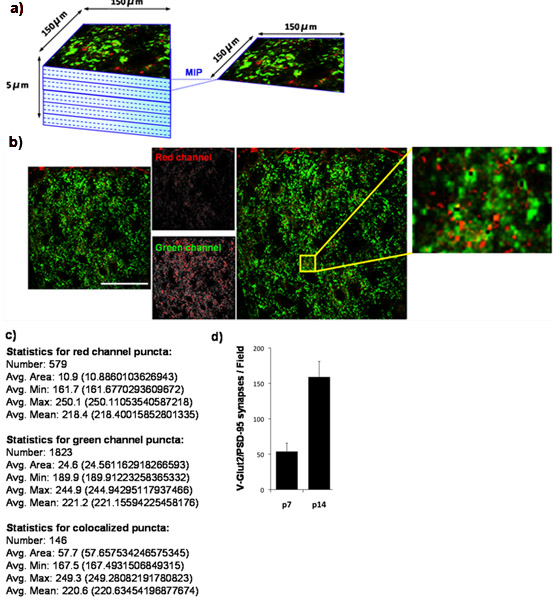
Figura 4:. Cuantificación de la densidad sináptica en el ratón colículo superior (a) Para determinar los cambios evolutivos en el número de sinapsis glutamatérgicas establecido por la CGR en sus objetivos collicular superior en el cerebro de roedores, manchado cryosections de cerebro de ratón con anticuerpos contra el presináptica VGlut2 marcador (verde) y el marcador postsináptica, PSD-95, (rojo). Hemos fotografiado el exterior 150 x 150 m de la región del ratón colículo superior (SC), correspondiente a la región de destino sináptica para CGR mediante el uso de un microscopio confocal de barrido láser. Un z-stack para cada sección SC fue recogido por una profundidad total de 5 m (15 x 0,33 m secciones ópticas). Proyecciones de máxima de imagen (PIP) se han generado para grupos de 3 secciones ópticas consecutivos generando el 5 MIPS / sección de cada uno representando un m de profundidad. A continuación se muestra una MIP representativo tomado de colículo superior de un ratón P14 WT. El marcador presináptico, VGlut2, se muestra en verde y el marcador postsináptica, PSD-95, se muestra en rojo. (C) resultados numéricos producidos por el analizador de puntos lagrimales. (D) La cuantificación de los análisis del número de sinapsis durante al menos 3 secciones por animal con 3 animales por punto de tiempo (barras de error representan SEM). Barra de escala representa 50 micras.
Discusión
El ensayo de sinapsis se ha descrito anteriormente se basa en el contexto de nuestros objetivos experimentales, en el que nos centramos principalmente en las proyecciones de excitación de la CGR, ya sea en la cultura purificada o en la sección del cerebro. Hemos proporcionado un listado de anticuerpos tabla de referencia que funcionan bien para el etiquetado de las sinapsis excitadoras (Tabla 1).
Este ensayo sinapsis pueden ser adaptados para cuantificar el número de sinapsis de una pobla...
Divulgaciones
Agradecimientos
En el laboratorio de Ben A. Barres (Stanford University).: Puntos lagrimales Plug-in para la imagen J fue escrito por Barry Wark (Consultoría Physion dirección actual) Analizador
Financiación;
- Alfred P. Sloan Foundation
- El A. Esther y José Klingenstein Fund Inc.,
- Fundación Broad Investigación Biomédica
- Cura para la Iniciativa de la Enfermedad de Huntington s
Materiales
| Name | Company | Catalog Number | Comments | |||||
| Antígeno | Especies | Monoclonal / policlonales | Vendedor | Número de catálogo | Dilución | Obras en Cultura | Obras en las secciones | |
| Presináptica | Sinapsina | Conejo | Policlonal | Sistemas de Synaptic | 106004 | 1:750 | Y | ND |
| Sinapsina | Ratón | Monoclonales | Sistemas de Synaptic | 106001 | 1:500 | Y | Y | |
| Fagot | Ratón | Monoclonales | Diseño del ensayo | VAM-PS003F | 1:500 | Y | Y | |
| Fagot | Conejillo de Indias | Policlonal | Sistemas de Synaptic | 141004 | 1:1000 | Y | ND | |
| Sinaptotagmina 1 | Conejo | Policlonal | Sistemas de Synaptic | 105002 | 1:750 | Y | N | |
| Sinaptobrevina 2 (C1.69.1) | Ratón | Monoclonales | Sistemas de Synaptic | 104211 | 1:500 | Y | Y | |
| Sinaptofisina (C1.7.2) | Ratón | Monoclonales | Sistemas de Synaptic | 101011 | 1:500 | Y | Y | |
| VGlut1 | Ratón | Monoclonales | Millipore | MAB5502 | 1:2500 | N | Y | |
| VGlut1 | Conejillo de Indias | Policlonal | Millipore | AB5905 | 1:2500 | N | Y | |
| VGlut2 | Conejillo de Indias | Policlonal | Millipore | AB2251 | 1:2500 | N | Y | |
| Postsinápticos | PSD-95 (6G6-1C9 clon) | Ratón | Monoclonales | Afinidad Bio Reactivos | MA1-045 | 1:750 | Y | N |
| PSD-95 | Conejo | Policlonal | Zymed | 51-6900 | 1:500 | N | Y | |
| Homer | Ratón | Monoclonales | Sistemas de Synaptic | 160011 | 1:500 | Y | ND | |
| Homer | Rata | Policlonal | Millipore | AB5875 | 1:500 | Y | Y | |
| Gephyrin | Conejo | Policlonal | Sistemas de Synaptic | 147003 | 1:500 | Y | Y | |
| Gephyrin | Ratón | Monoclonales | Sistemas de Synaptic | 147 | 1:200 | Y | Y |
Tabla 1: lista de ejemplos de buenos marcadores pre-y post-sinápticas que se han utilizado con éxito en nuestro ensayo sinapsis. Tenga en cuenta que esto no es una lista exhaustiva de todas las marcas disponibles. Y = Sí, N = No, ND = no determinado.
| Reactivo | Empresa | Gato. No. |
| PBS | Invitrogen | 20012-027 |
| poli-D-lisina | Sigma | P6407 |
| Laminina | Cultrex | 3400-010-01 |
| Triton X-100 | Roche Diagnostics GmbH | 9002-93-1 |
| Suero normal de cabra | Gibco | 16210 |
| Vectashield con DAPI | Vector Laboratories | H-1200 |
| Octubre | Tissue-Tek | 4583 |
| Tris-base (50 mM) | Pescador | BP152-5 |
| Albúmina de suero bovino | Sigma | A2153 |
| l-lisina | Sigma | L-1137 |
| 16% PFA solución | Microscopía electrónica de Ciencias | 15711 |
| Granular PFA | Microscopía electrónica de Ciencias | 19210 |
| De 24 pocillos placa | Halcón | 35-3047 |
| Cabra anti-ratón conjugado con anticuerpos Alexa | Invitrogen | --- |
| Suministro | Empresa | Gato. No. |
| 12 mm, n º 0 de vidrio cubreobjetos | Karl Hecht Gmbh | 1105209 |
| No. 1.5 cubreobjetos de vidrio (para cortes) | VWR Ciencia | 48393241 |
| Portaobjetos de vidrio | VWR Ciencia | 48311-703 |
Referencias
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Y. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1, 791-803 (1988).
- Meyer-Franke, A., Kaplan, M. R., Pfrieger, F. W., Barres, B. A. Characterization of the signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron. 15, 805-819 (1995).
- Eroglu, C. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 139, 380-392 (2009).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 .
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinocollicular projections in the mouse. J. Comp. Neurol. 230, 552-575 (1985).
- Schmidt, J. T. Formation of retinotopic connections: selective stabilization by an activity-dependent mechanism. Cell. Mol. Neurobiol. 5, 65-84 (1985).
- Sachs, G. M., Jacobson, M., Caviness, V. S. Postnatal changes in arborization patterns of murine retinocollicular axons. J. Comp. Neurol. 246, 395-408 (1986).
- Elmariah, S. B., Oh, E. J., Hughes, E. G., Balice-Gordon, R. J. Astrocytes regulate inhibitory synapse formation via Trk-mediated modulation of postsynaptic GABAA receptors. J. Neurosci. 25, 3638-3650 (2005).
- Hughes, E. G., Elmariah, S. B., Balice-Gordon, R. J. Astrocyte secreted proteins selectively increase hippocampal GABAergic length, branching and synaptogenesis. Moll. Cell. Neurosci. 43, 136-145 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados