Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Quantifizierung der Synapsen: eine Immunzytochemie-basierten Assay zur Synapse Anzahl Quantify
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie zu Synapse Anzahl sowohl in dissoziierten neuronalen Kultur und in Hirnschnitten mittels Immunzytochemie quantifizieren. Mit Fach-spezifische Antikörper, label wir präsynaptischen Terminals sowie Standorte der postsynaptischen Spezialisierung. Wir definieren Synapsen als Punkte der Kolokalisation zwischen den Signalen, die von dieser Marker erzeugt.
Zusammenfassung
Eines der wichtigsten Ziele in den Neurowissenschaften ist es, die molekularen Signale, die frühen Stadien der Synapsenbildung anweisen, zu verstehen. Als solches ist es unumgänglich geworden, um objektive Ansätze zu entwickeln, um Veränderungen der synaptischen Verbindungen zu quantifizieren. Ausgehend vom Beispiel Fixierung dieses Protokoll Details, wie man Synapse Anzahl sowohl in dissoziierten neuronalen Kultur und in Hirnschnitten mittels Immunzytochemie quantifizieren. Mit Fach-spezifische Antikörper, label wir präsynaptischen Terminals sowie Standorte der postsynaptischen Spezialisierung. Wir definieren Synapsen als Punkte der Kolokalisation zwischen den Signalen, die von dieser Marker erzeugt. Die Zahl dieser Kolokalisationen wird unter Verwendung eines Plug in Puncta Analyzer (geschrieben von Bary Wark, auf Anfrage, c.eroglu @ cellbio.duke.edu) unter dem ImageJ-Software-Plattform. Die Synapse-Assay in diesem Protokoll beschrieben, kann auf jeden Nervengewebe oder Kultur Vorbereitung, für die Sie selektiv prä-und postsynaptischen Markern angewendet werden. Diese Synapsen Assay ist ein wertvolles Werkzeug, das weit in das Studium der synaptischen Entwicklung genutzt werden kann.
Protokoll
Lösungen zur Vorbereitung:
- Antikörper-Puffer:
- 150 mM NaCl
- 50 mM Tris-Base (Fisher, Kat. Nr.:. BP152-5, 50 mM) - 1,21 g
- 1% BSA (Sigma, Kat. Nr.:. A2153, 1%) - 2,0 g
- 100 mM L-Lysin (Sigma, Kat. Nr.:. L-1137, 100 mM) - 3,65 g
- Der pH-Wert auf 7,4
- 0,04% Azid
- Anpassen der Lautstärke auf 200 ml mit destilliertem H 2 O.
- Filter durch 0,22 &mgr; m-Filter (Millipore, Cat No:. SCGPU02RE).
- PFA Verdünnungsmittel:
- 168 ml 0,5 M Na 2 HPO 4 (zweibasische)
- 72 ml 0,5 M Na 2 HPO 4 (einbasischen)
- 660 ml destilliertem H 2 O
- 4% PFA Fixativ für kultivierten Neuronen (Lösung # 2):
- 10 ml 16% PFA-Lösung (Electron Microscopy Sciences, Cat No:. 15.711)
- 30 ml 4% PFA Verdünnungsmittel (Lösung # 2)
- 4% PFA in PBS:
- 4 g PFA (Elektronenmikroskopie Sciences, Cat No:. 19.210)
- 100 ml PBS (Invitrogen, Cat No:. 20012-027)
- Hitze bis 40 ° C, über Nacht rühren.
- Filter durch einen 0,22 &mgr; m-Filter (Millipore, Cat No:. SCGPU02RE)
- Blocking-Puffer (Gesamtvolumen (für 24-Well-Platte) = (# Deckgläser +1) x 200 ul)
- 50% Antikörper-Puffer (Lösung # 1)
- 50% normalem Ziegenserum (Gibco, Cat No:. 16.210)
- 0,2% Triton X-100 (Roche Diagnostics GmbH, Cat No:. 9002-93-1)
- 30% Saccharose in PBS
- 30 g Saccharose (MP Biomedicals, Inc., Cat No:. 821713)
- 70 ml PBS (Invitrogen, Cat No:. 20012-027)
- Mix mit einem Rührstab, bis Saccharose ist in Lösung.
- Bringen Sie die Lautstärke von bis zu 100ml mit PBS
- Filter durch einen 0,22 um-Filter (Millipore, Cat No:. SCGPU02RE)
Vorbereitung der neuronalen Kulturen:
Die hier beschriebene Protokoll gilt für alle primären neuronalen Kulturen auf 12 mm Deckgläschen (Karl Hecht, Nr. O, Cat No.: 99010) gewachsen in 24-Well-Platten (Falcon, 35-3047). Zum Beispiel in unserem Labor haben wir Kultur Ratte retinalen Ganglienzellen (RGC) von Ratten Netzhaut von P5-7 Tieren 1,2 geerntet gereinigt. Die Zellen werden auf Deckgläschen mit Poly-D-Lysin (. Sigma, Kat. Nr.: P6407) beschichtet gewachsen (. Cultrex, Bestellnummer: 3400-010-01) und Maus Laminin. Wir nutzen diese Kultur Vorbereitung in ein paar verschiedene Möglichkeiten für unsere Synapsen Assay. Eine Manipulation, die wir durchführen beinhaltet Kultivierung RGCs entweder in Gegenwart oder Abwesenheit von Astrozyten-sezernierten synaptogenic Faktoren. Alternativ setzen wir auch diese unterschiedliche Behandlung Bedingungen in Experimenten, bei denen RGCs transfiziert worden sind, um ein Protein von Interesse überexprimieren. Im letzteren Fall haben wir co-Transfektion von Zellen mit einer Zelle Label (zB GFP oder tdTomato). Diese verschiedenen experimentellen Ansätzen beeinflusst, wie man bestimmte Schritte einer Synapse-Assay, die wir klären unten führt.
1. Fixing Dissoziierte Purified RGCs
- Entfernen Kulturmedien aus der RGC-haltigen Quellen und fügen 500 ul (für eine 24-Well-Platte) 4% Paraformaldehyd (PFA) vorgewärmt auf 37 ° C in jede Vertiefung. Lassen Zellen für 7 Minuten bei Raumtemperatur fest.
- Nach der Fixierung spülen Zellen 3 mal mit Phosphat-gepufferter Salzlösung (PBS) (Invitrogen, Cat No:. 20012-027). WICHTIG: Die Zellen sollten nie ohne Flüssigkeit in den Vertiefungen links, einmal ein Puffer von einem gut sollte es umgehend ersetzt werden durch den nächsten Puffer entfernt. An dieser Stelle werden die Zellen bereit für Immunfärbung.
2. Blockieren unspezifischer Bindungsstellen auf der RGCs
- Bereiten Blockierungspuffer mit 50% normalem Ziegenserum (NGS, Gibco, Cat No:. 16.210) und 0,2% Triton X-100 (Roche Diagnostics GmbH, Cat No:. 9002-93-1). Nach dem Entfernen PBS aus jedem Well, 200 ul des Blocking-Puffer in jede Vertiefung und Block für 30 Minuten bei Raumtemperatur.
- Entfernen Blockierungspuffer und spülen Sie 3 Mal mit PBS.
3. Anwenden von Primary Antibody-Lösung
- WICHTIG: Achten Sie darauf, primären Antikörper für Ihren Vor-und postsynaptischen Markern, die aus unterschiedlichen Spezies gewonnen werden wählen.
- Bereiten Sie ein primärer Antikörper Verdünnung in 90% Antikörper-Puffer, 10% NGS Lösung, welche die Vor-und postsynaptischen Antikörper Paar Ihrer Wahl. Zum Beispiel Kaninchen-Anti-synapsin (präsynaptischen Marker) (1:750, cytosolischen Domäne, Synaptic Systems) und Maus-Anti-Homer (postsynaptische Marker) (1:500, Maus, Synaptic Systems). WICHTIG: Centrifuge primärer Antikörper Verdünnung für 5 Minuten bei maximaler Geschwindigkeit in einer Tischzentrifuge jede ausgefallene Antikörper zu entfernen.
- Geben Sie 200 ul primären Antikörper-Lösung in jede Vertiefung.
- Inkubieren über Nacht bei 4 ° C. Die Platte sollte in einen größeren Behälter, befeuchtet, um zu verhindern Trocknung der primäre Lösung gelegt werden. BREAK POINT: Die Zellen können in primärer Antikörper-Gemisch für bis zu 3 Tage vor bleiben, um mit dem Protokoll fortfahren.
- Am folgenden Tag, zu entfernen Primärantikörper aus jeder Vertiefung und spülen Brunnen 3-mal mit PBS.
4. Anwenden von Sekundär-Antikörper-Lösung
- Bereiten Sie einen sekundären Antikörper-Lösung mit Ihren Sekundärantikörper 1:1000 verdünnt in Antikörper-Puffer mit 10% NGS. WICHTIG: Centrifuge sekundären Antikörper Verdünnung für 5 Minuten bei maximaler Geschwindigkeit in einer Tischzentrifuge für ausgefallene Antikörper zu entfernen. Überspringen Sie diesen Schritt führt zu einer hohen sekundären Antikörper Hintergrund.
Transfizierte Zellen: In Ermangelung einer Zelle Label verwenden Alexa-594 und Alexa-488 konjugierten Secondaries für die Kennzeichnung Vor-und postsynaptischen Markern bzw.. Zum Beispiel verwenden wir Ziege Anti-Kaninchen-Alexa594 die anti-Synapsin-Antikörper und Ziege Label Anti-Maus Alexa-488 konjugierten sekundären auf die anti-homer Antikörper-Label. WICHTIG: Verwenden Alexa-488 konjugierten Secondaries für Primär-Antikörper mit schwächeren Signal.
Die transfizierten Zellen: Wählen Sie Sekundärantikörper, dass die Anregungs-Emissions-Spektrum Ihrer fluoreszierende Zelle Label unterzubringen. Zum Beispiel, wenn wir transfizierten Zellen Etikett mit tdTomato wir Alexa-647 konjugierten Ziege anti-Kaninchen auf die anti-Synapsin-Antikörper erkennen und Alexa-488 konjugierten Ziege anti-Maus, um die anti-homer-Antikörper erkennen. Außerdem ist die Verwendung von NGS in diesem Protokoll Ergebnis unserer Wahl Sekundärantikörper Ziege in produziert. - Geben Sie 200 ul sekundären Antikörper-Lösung in jede Vertiefung.
- Nach Inkubation für 2 Stunden bei Raumtemperatur an einem dunklen Ort, spülen Sie 3 bis 4 mal mit PBS.
5. Montage Deckgläser
- Berg Deckgläser in Vectashield Eindeckmedium mit DAPI (Vector Laboratories Inc., Cat No:. H-1200) auf Glasobjektträger (VWR Scientific, Cat No:. 48311-703).
- Durch leichten klaren Nagellack an den Rändern des Deckglases und lassen Sie für mindestens 30 Minuten lang in einem dunklen, trockenen Ort trocknen lassen. WICHTIG: Vermeiden Sie stupste oder Bewegen der Deckgläser während der Anwendung der Nagellack, da dies in Ausscheren der Zellen führen.
6. Imaging
Für die Bildgebung, einem Fluoreszenz-Mikroskop mit einer Kamera in der Lage Aufnahmen in 4 verschiedenen Kanälen ausgestattet notwendig, um in der Lage sein Bild beiden synaptischen Marker ist, füllen Sie Ihr Handy und Kerne (DAPI / optional). Die Zellen sind abgebildet mit einem Öl-Immersion 63x Ziel sein. Wir Bildes mit dem Zeiss AxioImager Fluoreszenzmikroskop mit dem Zeiss Plan-Apochromat 63x/1.4 Oil DIC ∞ / 0.17 Ziel.
- Markieren Sie die Zellen, die mindestens zwei Zelldurchmesser entfernt sind von ihren nächsten Nachbarn. Zur Vermeidung von Verzerrungen und sorgen für Zufälligkeit der Auswahl der Zellen, wenn die Visualisierung nicht transfizierten Zellen, markieren Sie die Zellen in der DAPI-Kanal, dann nehmen Sie Bilder in allen Kanälen. Wenn Visualisierung transfizierten Zellen Zellen markieren in den Kanal entsprechend der Fluoreszenzmarker an transfizierten Zellen (z. B. tdTomato) zu identifizieren.
- Erwerben Sie Ihre Bilder:
Transfizierte Zellen: Für jede ausgewählte Zelle, erhalten 8-Bit-Bilder in der GFP und Texas Red-Kanäle. Die überlagerten pseudocolored Bild sollte Ihr prä-und postsynaptischen Markern in Rot und Grün haben, bzw..
Die transfizierten Zellen: Für jede ausgewählte Zelle zu erhalten 8-Bit-Bilder in der GFP, Texas Red und Cy5 (oder Cy5.5) Kanäle. Die überlagerten pseudocolored Bild sollte Ihr prä-und postsynaptischen Markern in Rot und Grün haben, bzw.. Pseudo color your cell in Blau zu füllen.
7. Image Analysis and co-lokalisiert Puncta Quantifizierung
- Wir verwenden Puncta Analyzer-Programm für die Quantifizierung co-lokalisiert synaptischen puncta. Puncta Analyzer Plug-in wird von Bary Wark geschrieben und ist auf Anfrage erhältlich (c.eroglu @ cellbio.duke.edu). Puncta Analyzer läuft in ImageJ 1,26 (http://rsbweb.nih.gov/ij/, neuere Versionen von ImageJ kann nicht ausgeführt werden von der Anwendung). So installieren Sie Puncta Analyzer einfach die heruntergeladene Anwendung Ordner in den Ordner "Plugins" in der ImageJ 1,26-Verzeichnis.
- Öffnen Sie eine Ihrer Bilder mit ImageJ. Verwenden Sie eine der Auswahl-Werkzeuge in der IMAGeJ Menü, um die Region of Interest (ROI) zu ermitteln. Wir nutzen regelmäßig die kreisförmige Auswahl-Werkzeug zu einer Region etwa ein Zelldurchmesser radial um das Soma des Interesses auszuwählen.
- Mit Ihrer Region of Interest (ROI) ausgewählt, um die Plugins-Menü und wählen Sie "Puncta Analyzer".
- In der "Analysis Options"-Fenster, das erscheint, wählen Sie "Red Channel", "Green Channel", der erste "Subtract Background" und "Set Ergebnisse Datei ...." Klicken Sie auf "OK". Sie werden aufgefordert, einen Standort zu definieren, um die Ergebnisse zu speichern in. Diese Ergebnisse können nach Excel zur weiteren Analyse exportiert werden.
- In dem Fenster, das als nächstes erscheint, stellen Sie sicher, eine rollende Kugel Radius von 50 ausgewählt ist, und deaktivieren Sie das Kontrollkästchen "Weißer Hintergrund"-Option (diese Änderung ist nicht erforderlich, wird aber oft von den Benutzern der Anwendung zur einfachen Visualisierung bevorzugt). Klicken Sie auf "OK".
- Ein neues Fenster wird neben einer Maske entsprechend mit Ihren roten Kanal Bild erscheinen. Stellen Sie die Schwelle, bis Sie merken, dass die rote Maske so gut wie möglich entspricht, wie viele diskrete individuelle puncta, ohne dabei zu viel Lärm. Dies ist einer der subjektiven Schritte dieses Protokoll, so kümmern sich um ein einheitliches Vorgehen zu entwickeln. Klicken Sie auf "Fertig". Stellen Sie die minimale puncta Größe bis 4 Pixel und ändern nichts anderes. Klicken Sie auf "OK".
- Wiederholen Sie den vorherigen Schritt, diesmal für den grünen Kanal.
- Sobald Sie den vorherigen Schritt abgeschlossen ist, wird das Plugin Quantifizierung entsprechenden Punkte in jeden Kanal separat bereitzustellen und Kolokalisation puncta zwischen den beiden Kanälen.
Hirnschnitten:
Die Synapse-Assay kann Kryoschnitten von Gehirn angewendet werden, und für alle anderen Nervensystem Gewebe (wie Rückenmark oder Retina), sofern es eine geeignete prä-und postsynaptischen Marker-Paar (mit Antikörpern, die gut funktionieren in Sektionen), kann genutzt werden, um die Synapsen Sie zu quantifizieren zu identifizieren. Die Synapse-Assay kann die zeitliche Regulierung der Synapsenbildung in einer bestimmten Region des Gehirns offenbaren und kann Auswirkungen auf die synaptischen Verbindungen in transgenen Tieren oder in einer Probe, die in sonstiger Weise manipuliert worden ist quantifizieren.
1. Harvesting Hirngewebe von Mäusen
Alle tierischen Verfahren sollten in Übereinstimmung mit IACUC Tier-Protokolle durchgeführt werden.
- Euthanize Mäusen durch Ausbluten und Perfusion mit PBS. Perfusion mit PBS ist entscheidend für die Entfernung von Blut und Hintergrund-Signal für die Färbung Verfahren zu reduzieren. WICHTIG: Nicht perfuse mit Fixiermittel wie 4% PFA. Dies wird sich negativ auf Färbeergebnisse.
2. Fixierung
- Fix das gesamte Gehirn in 4% PFA in PBS bei 4 ° C über Nacht. Am nächsten Tag spülen die Gehirne 3-mal mit PBS.
- Cryoprotect das Gehirn, indem sie in 30% Saccharose in PBS. Das Gewebe wird zunächst zu schweben. Halten Sie bei 4 ° C, bis das Gewebe um die Boden sinkt. In diesem Stadium der Kryoschutz abgeschlossen ist.
3. Embedding / Kryoschneiden
- Embed Gehirne in der gewünschten Ausrichtung zum Schneiden (zB sagittal oder koronal) in einer 2:1-Lösung von 30% Saccharose: (. Tissue-Tek, Bestellnummer: 4583) OCT in PBS. Freeze-embedded brains auf einer ebenen Fläche von Trockeneis. Gefrorene embedded brains kann in Gefrierbeutel gelegt und gehalten bei -80 bis zu einem Jahr vor dem Schneiden.
- Gefrier das Gewebe in 12-16μm Schnitte und Montage auf Glas-Objektträgern (Sigma, Kat. Nr.:. S4651). Dias können bis zu einer Woche gelagert werden bei -80 ° C vor dem Färben.
- Slides zu gefärbt werden sollte bei 37 ° C für 30 Minuten getrocknet und gespült werden 1x mit PBS, um restliches Oktober zu entfernen.
4. Blocking Sections
- Block Abschnitte in 20% normalem Ziegenserum (NGS) in PBS für 1 Stunde bei Raumtemperatur. WICHTIG: Verwenden Sie keine Triton X-100 zu diesem Zeitpunkt. Vor der Zugabe des Blocking-Lösung, können Sie eine hydrophobe Barriere um die Abschnitte auf der Folie mit einem Elite PAP Pen (DBS, Cat No:. K039)
5. Die Anwendung Primärantikörper
- Verdünnen Sie Ihre primäre Antikörper in PBS mit 0,3% Triton und 10% NGS.
- In Hirnschnitten wir PSD-95 (Zymed, Kaninchen, 1:500) zu glutamatergen postsynaptischen Kompartimente und VGLUT1 oder VGLUT2 (Chemicon, Meerschweinchen, 1:2500) Etikett glutamatergen präsynaptischen Etikett. Centrifuge primärer Antikörper Verdünnung für 5 Minuten bei maximaler Geschwindigkeit in einer Tischzentrifuge für ausgefallene Antikörper zu entfernen, falls vorhanden.
- Inkubieren Abschnitte in Primärantikörper-Lösung für 36-60 Stunden bei 4 ° C.
6. Die Anwendung Sekundärantikörper
- Waschen Sie die primäre Antikörper durch Eintauchen der Objektträger 3x in PBS für jeweils 15 Minuten. Nach diesem Schritt stellen Sie sicher, Ihre Folien vor direktem Licht schützen.
- VerdünnenSekundärantikörper in einer Verdünnung von 1:200 in dem gleichen Puffer wie für Primär-Antikörper beschrieben. Zum Beispiel für VGlut/PSD95 Färbung verwenden wir Ziege anti Meerschweinchen-Alexa 488 (Vglut) und Ziege anti-Kaninchen Alexa 594 (PSD-95) (Invitrogen).
- Inkubieren Abschnitte in sekundären Antikörper-Lösung für 2 Stunden bei Raumtemperatur im Dunkeln.
- Waschen Sie die ungebundenen Sekundärantikörper Den Objektträger durch Eintauchen der Objektträger 4x in PBS für jeweils 15 Minuten.
7. Montage
- Add kleinen Tropfen Vectashield Eindeckmedium mit DAPI (Vector Laboratories Inc.) auf Glasobjektträger (VWR Scientific) und dann decken die Objektträger mit Deckgläsern (VWR Scientific, Nr. 1,5, 48393 241). Bewerben Nagellack um die Bewegung der Deckgläser hemmen.
8. Imaging
WICHTIG: Ein konfokalen Mikroskop mit mindestens 3 Kanälen ist für die Bildgebung hier beschriebenen erforderlich. Wir Bildes auf einem Leica SP5 Laser-Scanning-konfokalen Mikroskop mit einem 63x Ölimmersionsobjektiv.
- Synaptic Hirnregionen von Interesse sollte für das Scannen konsequent zwischen den Abschnitten ausgewählt werden. Zum Beispiel in unseren Synapsen-Assay von retinalen Ganglienzellen Synapsen auf überlegene collicular Neuronen, wir Bild der äußeren überlegen collicular Bereich neben dem Colliculus inferior, die den synaptischen Schicht, die retinocollicular Terminals 7,8,9 erhält umfasst. Wir image und zu quantifizieren, die Synapsen in den oberen 150 pm synaptischen Zone des Colliculus superior, wo RGCs bekannt, um festzustellen synaptische Kontakte 9 sind.
- Für jeden Abschnitt, in beiden die 488 und 594 Kanäle, wir Bild serielle optische Schnitte von 0,33 mu m Abständen über eine Tiefe von 5 um insgesamt 15 optische Schnitte. Mindestens 3 Abschnitte von jedem Tier muss abgebildet werden und mindestens 3 Tiere müssen aus einem bestimmten experimentellen Bedingungen einbezogen werden.
- Maximum Intensity Projections (MIP) sind aus Gruppen von 3 aufeinanderfolgenden Abschnitten Nachgeben 5 MIPs darstellen 1 &mgr; Tiefe jedes generiert. Diese MIPs quantifiziert.
9. Bild Quantifizierung
- Mai genau durchgeführt werden, wie für RGCs beschrieben, jedoch die Form und Größe der ROI wird als Funktion der, welcher Bereich des Bilder, die Sie wünschen zu quantifizieren zu ändern.
Schlüssel zum Erfolg:
Gereinigtes RGCs:
- Vor der Befestigung gereinigt RGCs (oder andere dissoziierten Kultur) stellen Sie sicher, zur Vorwärmung 4% PFA in ein Wasserbad eingestellt auf 37 ° C für ca. 20-25 Minuten (lagern bei 4 ° C zu allen anderen Zeiten, nicht verwenden PFA Verdünnungen älter als 7 Tage).
- Besonders für kultivierten Neuronen, ist es ratsam, nicht mit einem Staubsauger Sauger während wäscht für alle Spülschritten. Sanfteren Methoden wie die Verwendung einer Pasteurpipette und einer Saugball spürbar verbessern die Qualität Ihrer Färbung.
- Achten Sie darauf, lassen Sie Ihre Zellen austrocknen während Ihres Spülschritten.
- Vermeiden Sie stupste oder das Bewegen der Deckgläser während der Anwendung von Nagellack weil dabei in Scherung der Zellen auf dem Deckglas führen.
- Spin down alle primären und sekundären Antikörper gegen jede ausgefallene Antikörper, die sich negativ auswirken wird Färbung zu beseitigen.
- Achten Sie darauf, primären Antikörper für Ihr prä-und postsynaptischen Markern in verschiedenen Spezies erhoben wählen. Andernfalls wird eliminieren Sie Ihre Fähigkeit, zwischen den beiden Signalen nach dem Aufbringen der Sekundärantikörper diskriminieren.
Brain-Foren:
- Nicht perfuse Ihre Mäuse mit Fixiermittel wie PFA.
- Verwenden Sie keine Triton-X 100 in Ihre Blockierungslösung für Hirnschnitten. Dies schadet der Qualität der Färbung für präsynaptischen Marker, insbesondere präsynaptischen Marker, die mit synaptischen Vesikeln assoziiert sind.
- Die Verwendung eines konfokalen Mikroskops für die Bildgebung ist für die Bildaufnahme, die von guter Qualität zu einem Synapse Analyse durchzuführen ist nicht erforderlich.
Repräsentative Ergebnisse:
Die Synapse oben beschriebenen Test wurde entwickelt, um Veränderungen der synaptischen Verbindungen in vitro und in vivo zu erfassen. In unserem Labor verwenden wir die Synapse Test, um die Wirkung entweder einzelne oder mehrere Astrozyten-sezernierte Moleküle auf Synapsenbildung zu bestimmen. Wir häufig führen diese Synapse Assay auf gereinigten RGCs, dass wir Kultur in vitro.
Eine gut beschriebene Effekt der chronischen Anwendung von Astrozyten-konditioniertem Medium (ACM) in gereinigtem RGC Kulturen ist ein Multiple-fachen Anstieg in der Zahl der Synapsen, die zwischen RGCs 3,4,5,6 gebildet werden. Abbildung 1A und 1B zeigen repräsentative Bilder von untransfizierte gereinigt RGCs entweder mit basalen Wachstum Medien oder mit ACM behandelt. Nach der Färbung für exzitatorische prä-und postsynaptischen Markern, die ACM-induzierte Zunahme der synapse Bildung ist qualitativ deutlich (Abbildung 1A, 1B). In der Tat hat dieser Befund durch mehrere Studien, dass der Elektrophysiologie benutzt haben, um zu zeigen, dass die ACM-induzierte Synapsen funktionell und Elektronenmikroskopie, um zu zeigen, dass die Synapsen ultrastrukturell normal sind 3,4,6 sind bestätigt worden. Andere Arbeiten in unserem Labor hat den Calcium-Kanal-Untereinheit α2δ-1 als neuronaler Rezeptor für einen stark synaptogenic Astrozyten-sekretierten Moleküls, Thrombospondin 3 identifiziert. Hier sind die Ergebnisse eines Experiments in gereinigtem RGCs, die durchgeführt werden, um festzustellen, ob ein höheres Maß an α2δ-1 weiter verbessert ACM-induzierte Synapsenbildung (Abbildung 3) war.
RGCs wurden entweder mit einem leeren Vektor oder mit einem Konstrukt, das α2δ-1 mit einem separaten Bau-Kodierung tdTomato nach 5 Tagen in vitro (DIV5) cotransfiziert. Nach chronischer Behandlung mit ACM oder GM, wurden RGCs fixiert und gefärbt auf DIV 11. Nach Immunomarkierung der prä-und postsynaptischen Markern von Synapsen sehen wir eine qualitativ offensichtliche Zunahme der Synapsen Zahl in gereinigtem RGCs, die entweder einen leeren Vektor (pcDNA3.1) oder α2δ-1 (Abb. 1C, 1D). Wir quantifizieren die synaptogenic Wirkung von ACM mit Puncta Analysator Synapse Zahl (Abb. 2) für mindestens 15 Neuronen zählen von jedem Zustand. Eine Probe dieser Größe ermöglicht es uns, die durchschnittliche Anzahl der Synapsen pro Neuron berechnen und finden Sie einen statistisch signifikanten, ~ 10-fache Erhöhung der Synapsen von ACM-behandelten Neuronen, die Ausdruck einer leeren Vektor (Abb. 3, graue Balken) gebildet werden. Darüber hinaus zeigen wir, dass die Überexpression von α2δ-1 führt zu einer deutlichen Verstärkung der ACM-induzierte Synapsenbildung (~ 20-fach. Abb. 3, schwarze Balken).
Neben kultivierten Neuronen, können wir Synapsendichte in verschiedenen Hirnregionen mit Hilfe dieser Technik zu quantifizieren. Der Colliculus superior ist eine Hirnstruktur, die retinocollicular Projektionen erhält, aus RGCs in der Netzhaut 7,8,9. Über die postnatale Entwicklung, die Anzahl der Synapsen durch RGCs auf ihre Ziele in den Colliculus superior gebildet dramatisch steigt von P7 bis P21 7,8,9.
Mit unserem Quantifizierung Technik zeigen wir, dass die Zahl der retinocollicular Synapsen im Colliculus superior steigt von P7 bis P14 gebildet. Um dies zu tun, wir synaptischen Dichte bei P7 quantifiziert und wieder auf P14. Wir färben die Colliculus superior für PSD-95 (postsynaptischen) und für VGLUT2 (präsynaptischen Marker spezifisch für RGC Synapsen im Colliculus superior). Die äußere synaptischen Region des Colliculus war abgebildet (Abb. 4A) und co-lokalisiert VGlut2/PSD-95 Synapsen wurden quantifiziert (Abb. 4B, 4C) von mindestens 3 Abschnitte pro Tier und von mindestens 3 Tiere pro Zeitpunkt. Die Quantifizierung der gewonnenen Daten zeigt deutlich ein über dreifach signifikanten Anstieg in der Zahl der Synapsen zwischen P7 und P14. Diese Ergebnisse sind in Übereinstimmung mit publizierten Befunden Nutzung Elektronenmikroskopie (Abb. 4D) 9.
Im Ergebnis ist die Methode der Synapse Zahl Quantifizierung beschreiben wir hier ein nützliches Instrument zur Synapse Anzahl und Dichte an Kultur und in neuronalen Gewebe zu bestimmen, so dass wir den Einfluss der Manipulation Synapsenbildung in vitro oder in vivo-Studie.
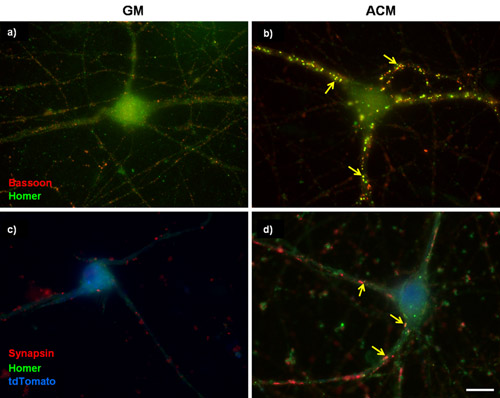
Abbildung 1: Repräsentative synaptischen Färbung in gereinigtem RGCs. (A und B) 3 Tage in vitro (DIV) RGCs wurden entweder in kultivierten (A) basale Wachstum Medien (GM) oder in (B) pro-synaptogenic Maus Astrozyten konditionierte Medium (ACM) für weitere 6 Tage. Die Zellen wurden dann für Fagott (präsynaptischen, rot) und Homer (postsynaptische, grün) gekennzeichnet. Maus ACM stark stimuliert Synapsenbildung zwischen RGCs wie durch die Zunahme der Zahl der co-lokalisiert Fagott und homer puncta bestimmt. (C und D) 5cm RGCs wurden mit einem Plasmid transfiziert, um die Calcium-Kanal-Untereinheit α2δ-1 überexprimieren. Die transfizierten Zellen wurden mit einem tdTomato Zelle zu füllen (blau) identifiziert und für die präsynaptische Marker Synapsin und postsynaptischen Marker homer gefärbt. Die Pfeile zeigen die Synapsen. Scale-Balken repräsentiert 20 um.
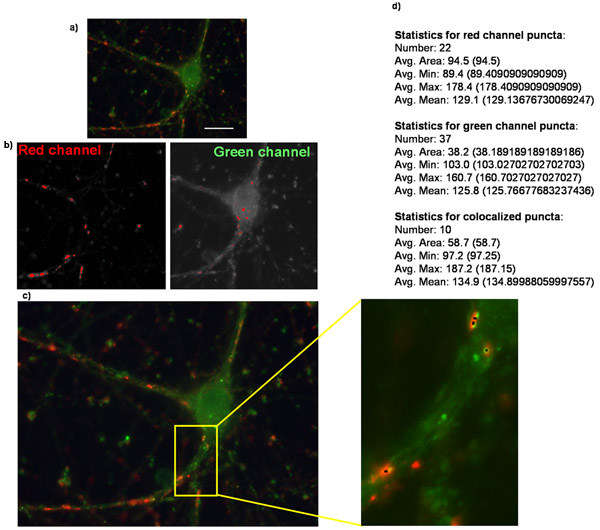
Abbildung 2:. Quantifizierung der Synapse Nummer mit Puncta Analyzer Sehen Sie hier ein Beispiel (a) ein Original-Bild eines gereinigten retinalen Ganglienzellen Überexpression des Thrombospondin-Rezeptor α2δ-1 und ist für präsynaptischen Marker Synapsin und postsynaptischen Marker homer gefärbt. (B) Bilder entsprechend der Masken in jedem Kanal erstellt werden, wenn die Analyse puncta in Puncta Analyzer. (C) Puncta Analzyer erstellt ein Image wie das hier in die puncta durch kleine schwarze Punkte (kleines Bild) angezeigt gezeigt. Auch shown ist (d) die numerische Ausgabe der Anwendung, wo puncta Zahl zusammen mit einigen anderen Parametern in Text / numerischer Form (Fettdruck zur Hervorhebung hinzugefügt) bereitgestellt werden.
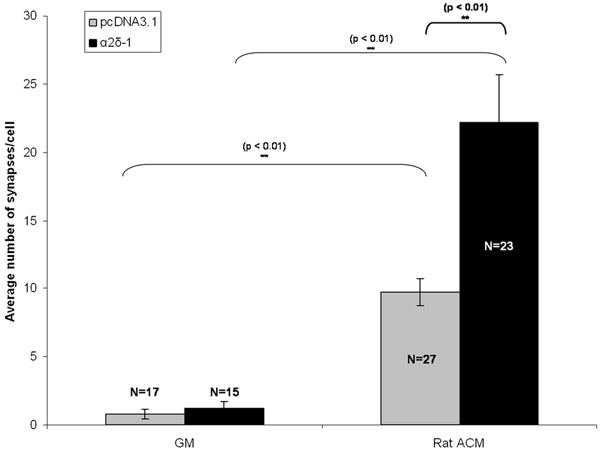
Abbildung 3:. Repräsentatives Ergebnis für Synapse Assay Sehen Sie hier die synaptogenic Effekt der chronischen Behandlung von RGCs mit Astrozyten-konditioniertem Medium (ACM) in transfizierten RGCs, die entweder leeren Vektor (pcDNA3.1, graue Balken) oder Thrombospondin-Rezeptor α2δ-1 . Fehlerbalken stellen den SEM. GM = Growth Media. ACM = (Ratte) Astrocyte Contitioned Media.
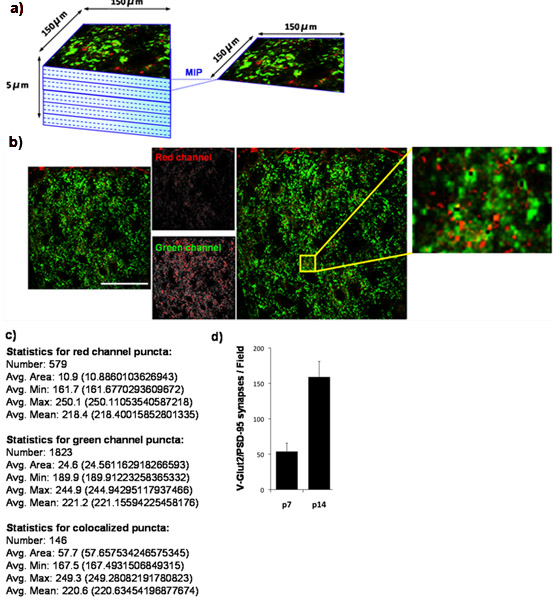
Abbildung 4:. Quantifizierung der synaptischen Dichte in Maus Colliculus superior (a) Um die entwicklungsbedingten Veränderungen in der Zahl der glutamatergen Synapsen durch RGCs auf seine überlegene collicular Ziele in der Nager Gehirn etabliert bestimmen, gebeizt wir Gefrierschnitte aus Mäusehirn mit Antikörpern gegen die präsynaptischen Marker VGLUT2 (grün) und der postsynaptischen Marker, PSD-95, (rot). Wir abgebildet äußeren 150 x 150 pm Region der Maus Colliculus superior (SC), entsprechend dem synaptischen Zielregion für RGCs mit Hilfe eines Laser-Scanning-konfokalen Mikroskop. Ein Z-Stapel für jede SC Abschnitt wurde für eine Gesamttiefe von 5 um (15 x 0,33 um optische Schnitte) gesammelt. Maximale Bild-Projektionen (MIP) wurden für Gruppen von 3 aufeinander folgenden optischen Schnitte Nachgeben 5 MIPs / section erzeugt die jeweils 1 mu m Tiefe. Unten ist eine repräsentative MIP vom Colliculus superior des P14 WT-Maus übernommen. Die präsynaptische Marker, VGLUT2 ist in grün dargestellt und die postsynaptische Marker, PSD-95, ist in rot dargestellt. (C) Numerische Ausgabe von Puncta Analyzer produziert. (D) Quantifizierung der Analyse von Synapse-Nummer für mindestens 3 Abschnitte pro Tier mit 3 Tieren pro Zeitpunkt (Fehlerbalken stellen SEM). Scale-Balken repräsentiert 50 um.
Diskussion
Die Synapse oben beschriebenen Test wird im Rahmen unserer experimentellen Ziele, wobei wir vor allem Fokus auf exzitatorische Projektionen RGCs basieren, entweder in gereinigtem Kultur oder im Gehirn Abschnitt. Wir haben eine Referenz Tabelle mit Antikörpern, die gut für die Kennzeichnung Synapsen (Tabelle 1).
Diese Synapsen Test lässt sich an Synapsen bei jedem neuronalen Population oder einer anderen synaptischen Subtyp, für die es eine selektive prä-und postsynaptischen Marker zu qu...
Offenlegungen
Danksagungen
Puncta Analyzer Plug-in für Bild J von Barry Wark (aktuelle Adresse: Physion Consulting) geschrieben wurde im Labor von Ben A. Barres (Stanford University).
Finanzierung;
- Alfred P. Sloan Foundation
- Die Esther A. und Joseph Klingenstein Fund, Inc.
- Broad Biomedical Research Foundation
- Heilung für Huntington-Krankheit Initiative
Materialien
| Name | Company | Catalog Number | Comments | |||||
| Antigen | Spezies | Monoklonale / polyklonale | Verkäufer | Catalog Number | Verdünnung | Works in Kultur | Works in den Abschnitten | |
| Präsynaptische | Synapsin | Kaninchen | Polyklonale | Synaptic Systems | 106004 | 1:750 | Y | ND |
| Synapsin | Maus | Monoklonale | Synaptic Systems | 106001 | 1:500 | Y | Y | |
| Fagott | Maus | Monoklonale | Assay Designs | VAM-PS003F | 1:500 | Y | Y | |
| Fagott | Guinea Pig | Polyklonale | Synaptic Systems | 141004 | 1:1000 | Y | ND | |
| Synaptotagmin 1 | Kaninchen | Polyklonale | Synaptic Systems | 105002 | 1:750 | Y | N | |
| Synaptobrevin 2 (C1.69.1) | Maus | Monoklonale | Synaptic Systems | 104211 | 1:500 | Y | Y | |
| Synaptophysin (C1.7.2) | Maus | Monoklonale | Synaptic Systems | 101011 | 1:500 | Y | Y | |
| VGLUT1 | Maus | Monoklonale | Millipore | MAB5502 | 1:2500 | N | Y | |
| VGLUT1 | Meerschweinchen | Polyklonale | Millipore | AB5905 | 1:2500 | N | Y | |
| VGLUT2 | Meerschweinchen | Polyklonale | Millipore | AB2251 | 1:2500 | N | Y | |
| Postsynaptischen | PSD-95 (6G6-1C9-Klon) | Maus | Monoklonale | Affinity Bio-Reagenzien | MA1-045 | 1:750 | Y | N |
| PSD-95 | Kaninchen | Polyklonale | Zymed | 51-6900 | 1:500 | N | Y | |
| Homer | Maus | Monoklonale | Synaptic Systems | 160011 | 1:500 | Y | ND | |
| Homer | Ratte | Polyklonale | Millipore | AB5875 | 1:500 | Y | Y | |
| Gephyrin | Kaninchen | Polyklonale | Synaptic Systems | 147003 | 1:500 | Y | Y | |
| Gephyrin | Maus | Monoklonale | Synaptic Systems | 147 | 1:200 | Y | Y |
Tabelle 1: Listen Beispiele für gute prä-und postsynaptischen Markern, die wir erfolgreich in unseren Synapsen Assay genutzt haben. Seien Sie sich bewusst, dass dies nicht eine vollständige Liste aller verfügbaren Markern. Y = Ja, N = Nein, ND = nicht bestimmt.
| Reagens | Firma | Cat. Nein. |
| PBS | Invitrogen | 20012-027 |
| Poly-D-Lysin | Sigma | P6407 |
| Laminin | Cultrex | 3400-010-01 |
| Triton X-100 | Roche Diagnostics GmbH | 9002-93-1 |
| Normalem Ziegenserum | Gibco | 16210 |
| Vectashield mit DAPI | Vector Laboratories | H-1200 |
| Oktober | Tissue-Tek | 4583 |
| Tris-Base (50 mM) | Fischer | BP152-5 |
| Bovine Serum Albumin | Sigma | A2153 |
| L-Lysin | Sigma | L-1137 |
| 16% PFA-Lösung | Electron Microscopy Sciences | 15711 |
| Granular PFA | Electron Microscopy Sciences | 19210 |
| 24-well Platte | Falke | 35-3047 |
| Ziege anti-Maus Alexa konjugierten Antikörpern | Invitrogen | --- |
| Versorgung | Firma | Cat. Nein. |
| 12mm, Nr. 0 Deckgläser | Karl Hecht GmbH | 1105209 |
| Nr. 1,5 Deckglas (für Scheiben) | VWR Scientific | 48393241 |
| Glasobjektträger | VWR Scientific | 48311-703 |
Referenzen
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Y. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1, 791-803 (1988).
- Meyer-Franke, A., Kaplan, M. R., Pfrieger, F. W., Barres, B. A. Characterization of the signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron. 15, 805-819 (1995).
- Eroglu, C. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 139, 380-392 (2009).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 .
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinocollicular projections in the mouse. J. Comp. Neurol. 230, 552-575 (1985).
- Schmidt, J. T. Formation of retinotopic connections: selective stabilization by an activity-dependent mechanism. Cell. Mol. Neurobiol. 5, 65-84 (1985).
- Sachs, G. M., Jacobson, M., Caviness, V. S. Postnatal changes in arborization patterns of murine retinocollicular axons. J. Comp. Neurol. 246, 395-408 (1986).
- Elmariah, S. B., Oh, E. J., Hughes, E. G., Balice-Gordon, R. J. Astrocytes regulate inhibitory synapse formation via Trk-mediated modulation of postsynaptic GABAA receptors. J. Neurosci. 25, 3638-3650 (2005).
- Hughes, E. G., Elmariah, S. B., Balice-Gordon, R. J. Astrocyte secreted proteins selectively increase hippocampal GABAergic length, branching and synaptogenesis. Moll. Cell. Neurosci. 43, 136-145 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten