Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sinapslar miktarının: Synapse Numarası ölçmek için bir İmmünositokimya tabanlı Testi
Bu Makalede
Özet
Bu protokol, ayrışmış nöronal kültür ve immünsitokimya kullanarak beyin bölümlerinde de sinaps sayısını ölçmek için nasıl ayrıntıları. Kompartman-spesifik antikorların kullanarak, presinaptik terminalleri yanı sıra postsinaptik uzmanlık siteleri etiket. Biz bu belirteçler tarafından oluşturulan sinyaller arasındaki sinaps ko noktaları olarak tanımlar.
Özet
Nörobilim en önemli hedeflerinden biri talimat sinaps oluşumu erken aşamalarında moleküler ipuçları anlamak için. Gibi sinaptik bağlantı değişiklikleri ölçmek için objektif yaklaşımlar geliştirmek zorunlu hale gelmiştir. Örnek fiksasyon itibaren, bu protokol detaylarının nasıl ayrışmış nöronal kültür ve immünsitokimya kullanarak beyin bölümlerinde de sinaps sayısı ölçmek için. Kompartman-spesifik antikorların kullanarak, presinaptik terminalleri yanı sıra postsinaptik uzmanlık siteleri etiket. Biz bu belirteçler tarafından oluşturulan sinyaller arasındaki sinaps ko noktaları olarak tanımlar. Bu colocalizations sayısı ImageJ analiz yazılımı platformu altında Puncta Analyzer (istek üzerine Bary Wark, c.eroglu @ cellbio.duke.edu yazılı) bir eklenti kullanarak miktarı. Bu protokol açıklanan sinaps tahlil seçici pre-ve postsinaptik belirteçlerinin sahip olduğunuz herhangi bir sinir doku veya kültür hazırlama uygulanabilir. Bu Sinaps tahlil, sinaptik gelişme çalışmada yaygın olarak kullanılan değerli bir araçtır.
Protokol
Hazırlık için Çözümler:
- Antikor Tampon:
- 150 mM NaCl
- 50 mM Tris-Bankası (Fisher, Kedi No: BP152-5, 50 mM) - 1.21 g
- % 1 BSA (Sigma, Kedi: A2153,% 1) - 2.0 g
- 100 mM L-lisin (Sigma, Kedi No: L-1137, 100 mM) - 3.65 g
- PH 7.4 'e ayarlayın
- % 0.04 Azid
- 200 ml distile H 2 O. ile ses seviyesini ayarlayın .
- (Millipore, Kedi No: SCGPU02RE) 0.22μm filtre süzülür.
- PFA Diluant:
- 168 ml 0,5 M Na 2 HPO 4 (dibazik)
- 72 ml 0,5 M Na 2 HPO 4 (tekbazlı)
- 660 ml saf H 2 O
- Kültürlü nöron (çözüm # 2) için% 4 PFA fiksatif:
- 10 ml% 16 PFA solüsyonu (Elektron Mikroskopi Bilimler, Kedi No: 15.711)
- 30 ml% 4 PFA diluant (çözüm # 2)
- % 4 PFA PBS içinde:
- 4 g PFA (Elektron Microscropy Bilimler, Kedi No: 19.210)
- 100 ml PBS (Invitrogen, Kedi No: 20.012-027)
- Isı - 40 ° C, gece karıştırın.
- 0.22μm filtresi (: SCGPU02RE Millipore, Kedi Hayır) süzülür.
- Engelleme tampon (Toplam hacmi (24 plaka için) = (# lamelleri +1) x 200μl)
- % 50 Antikor tampon (çözüm # 1)
- % 50 Normal keçi serumu (Gibco, Kedi No: 16.210)
- % 0.2 Triton X-100 (Roche Diagnostics GmbH, Kedi No: 9002-93-1)
- PBS içinde 30% Sakkaroz
- 30 g sakaroz (MP Biyomedikal, Inc, Kedi No: 821.713)
- 70 ml PBS (Invitrogen, Kedi No: 20.012-027)
- Sakaroz çözeltisini kadar stirbar ile karıştırın.
- PBS ile 100ml hacmi kadar getirin
- 0.22 mikron filtre (: SCGPU02RE Millipore, Kedi Hayır) süzülür.
Nöronal Kültürler hazırlanması:
(Falcon, 35-3047) 24-kuyucuğu: Burada açıklanan protokol, 12 mm cam lamelleri (99.010 Karl Hecht, No Ç, Kedi Hayır) yetişen herhangi bir primer nöronal kültürlerin için geçerli. Örneğin, bizim laboratuvarda kültür sıçan retina ganglion hücrelerinin (RGCs) P5-7 hayvanların 1,2 hasat sıçan retina arınmış. Hücreler poli-d-lisin (Sigma, Kedi No: P6407) ile kaplı cam lamelleri üzerinde yetiştirilmektedir (Cultrex, Kedi No: 3400-010-01) ve fare laminin. Biz bu kültürün hazırlanması bizim sinaps tayini için farklı şekillerde bir çift kullanır. Yaptığımız Bir manipülasyon astrosit salgılanan synaptogenic faktörlerin varlığı ya da yokluğu ya da kültür RGCs içerir. Alternatif olarak, biz de RGCs bir ilgi protein eksprese transfekte edilmiştir deneylerde bu farklı tedavi koşulları istihdam. İkinci durumda, biz ortak bir hücre etiketi (örn. GFP veya tdTomato) hücreleri transfect. Bu farklı deneysel yaklaşımlar aşağıda açıklık bir sinaps testinin bazı adımlar, nasıl performans etkiler.
1. Grubuyla Saf RGCs Tespit
- RGC içeren kuyu kültür ortamları çıkarın ve 500 ul (24 plaka için)% 4 paraformaldehid (PFA) eklemek ° C her bir kuyunun 37 prewarmed. Hücreleri oda sıcaklığında 7 dakika düzeltmek için izin verin.
- Ardından fiksasyon hücreleri 3 kez durulama, fosfat tamponlu salin (PBS) (Invitrogen, Kedi No: 20.012-027). ÖNEMLİ NOT: bir tampon sonraki tampon iyi derhal değiştirilmesi gerektiğini çıkarıldıktan sonra Hücreleri, kuyularda sıvı olmadan asla. Bu noktada, hücrelerin immün için hazırız.
2. RGCs belirsiz Cilt Siteleri Engelleme
- Ve% 0.2 Triton X-100 (Roche Diagnostics GmbH, Kedi No: 9002-93-1):% 50 normal keçi serumu (16.210 NGS, Gibco, Kedi Hayır) içeren tampon engelleme hazırlayın Her iyi PBS çıkardıktan sonra, oda sıcaklığında 30 dakika süreyle, her bir kuyu ve blok için engelleme tampon 200 ul ekleyin.
- Engelleme tamponu çıkarın ve 3 kez PBS ile yıkayın.
3. İlköğretim Antikor Çözümü uygulamak
- ÖNEMLİ NOT: öncesi ve postsinaptik belirteçlerinin farklı türler elde edilen birincil antikor seçmek için emin olun.
- % 90 antikor tampon, seçim öncesi ve postsinaptik antikor çifti içeren 10% NGS çözüm primer antikor seyreltme hazırlayın. Örneğin tavşan anti-synapsin (presinaptik işaretleyici) (1:750, sitozolik etki alanı Synaptic Sistemleri) ve fare anti-Homer (postsinaptik işaretleyici) (1:500, fare, Synaptic Sistemleri). ÖNEMLİ NOT: maksimum hızda 5 dakika boyunca herhangi bir çöktürülmüş antikor kaldırmak için bir masa üstü santrifüj primer antikor seyreltme santrifüjleyin.
- Her bir kuyunun 200 ul birincil antikor çözüm ekleyin.
- 4 gece inkübe ° C Plaka nemlendirilmiş birincil çözüm kurumasını önlemek için daha büyük bir kap içinde yer almalıdır. KIRILMA NOKTASI: Hücreler protokol ile devam primer antikor karışımı 3 gün kadar önce kalabilirler.
- Ertesi gün, her bir kuyudan primer antikor kaldırmak ve kuyulardan 3 kez PBS ile yıkayın.
4. İkincil Antikor Çözümü uygulamak,
- Ikincil bir antikor antikor tampon içeren% 10 NGS 1:1000 sulandırılmış ikincil antikorlar içeren bir çözüm hazırlayın. ÖNEMLİ NOT: çöktürülmüş antikor kaldırmak için bir masa üstü santrifüj 5 dakika maksimum hızda sekonder antikor seyreltme santrifüjleyin. Yüksek ikincil antikor arka planda bu adımı sonuçları atlanıyor.
Untransfected hücrelerinin bir hücre etiketi yokluğunda, Alexa-594 ve sırasıyla öncesi ve postsinaptik belirteçler etiketleme Alexa-488 konjuge ikinciller kullanabilirsiniz. Örneğin synapsin anti-antikor ve keçi anti-fare Alexa-488 konjuge ikincil bir anti-homer antikor etiket etiket anti-tavşan Alexa594 keçi. ÖNEMLİ NOT: Kullanım Alexa-488 primer antikorları için zayıf sinyal konjuge olarak.
Transfekte hücreler: floresan hücre etiket eksitasyon-emisyon spektrumu karşılamak sekonder antikor seçin. Örneğin, biz tdTomato transfekte hücreler etiketi kullanan Alexa-647 konjuge keçi anti-tavşan anti-synapsin antikor tanımak ve Alexa-488 anti-homer antikor tanımak için konjuge keçi anti-fare. Ayrıca, bu protokol NGS kullanımı keçi üretilen ikincil antikor bizim seçimimiz sonucu. - Her bir kuyunun 200 ul ikincil antikor çözüm ekleyin.
- Iki saat boyunca karanlık bir yerde oda sıcaklığında inkübe sonra, PBS ile 3 ila 4 kez yıkayın.
5. Montaj lameller
- Cam slayt (. 48.311-703 VWR bilimsel, Kedi Hayır) üzerine: Vectashield içine Mount lamelleri DAPI (H-1200. Vector Laboratories Inc, Kedi Hayır) orta montaj.
- Lamel kenarlarında hafifçe açık bir oje sürün ve kuru, karanlık bir yerde en az 30 dakika kurumasını bekleyin. ÖNEMLİ NOT: hücrelerin Sheering neden olacaktır dürtmek veya lamelleri oje uygulama sırasında bu yana hareket kaçının.
6. Görüntüleme
Görüntüleme için, 4 farklı kanallar fotoğraf çekme yeteneğine sahip bir kamera ile donatılmış bir floresan mikroskop görüntü hem de sinaptik belirteçlerinin edebilmek için gerekli olan, hücre (DAPI / isteğe bağlı) doldurmak ve çekirdekler. Hücreler bir immersiyon yağı 63x objektif kullanılarak görüntülü olmalıdır. Biz Zeiss Plan-APOCHROMAT 63x/1.4 Yağ DIC ∞ / 0.17 amacı ile Zeiss AxioImager floresan mikroskop kullanarak görüntü.
- En az iki hücre çapları en yakın komşu uzak hücreleri seçin. Önyargı önlemek ve untransfected hücreleri görselleştirme, DAPI kanal hücreleri seçin, hücre seçiminin rastgelelik sağlamak için, daha sonra tüm kanallar görüntüleri çekmek. Görselleştirme transfekte hücreleri transfekte hücreler (örneğin tdTomato) tanımlamak için floresan etikete uygun kanal hücreleri seçin.
- Görüntüler elde:
Untransfected hücreleri: Seçilen her bir hücre için, GFP ve Texas Red kanal 8 bit görüntüleri edinin . Üst üste yalancı görüntü sırasıyla kırmızı ve yeşil pre-ve postsinaptik işaretleri olmalıdır.
Transfekte hücreler: Seçilen her bir hücre için 8 bit görüntüleri GFP, Texas Kırmızı ve Cy5 (ya da Cy5.5) kanalları edinin . Üst üste yalancı görüntü sırasıyla kırmızı ve yeşil pre-ve postsinaptik işaretleri olmalıdır. Sözde renk hücre mavi doldurun.
7. Görüntü Analizi ve Co-lokalize Puncta Niceleme
- Biz co-lokalize sinaptik puncta kantifikasyon Puncta Analyzer programı kullanabilirsiniz. Puncta Analyzer fiş Bary Wark tarafından yazılmış ve isteği (c.eroglu @ cellbio.duke.edu) üzerine. Puncta Analyzer ImageJ 1.26 (http://rsbweb.nih.gov/ij/, yeni ImageJ sürümleri uygulamayı çalıştırmak) çalışır. Yüklemek için Puncta Analyzer ImageJ 1.26 dizin sadece "Plugins" klasörüne indirilen uygulama klasörüne yerleştirin.
- ImageJ kullanarak resimlerinizi birini açın. Imag seçim araçlarından birini kullanınEJ menü ilgi bölgesi (YG) belirlemek için. Biz düzenli bir bölgeyi seçmek için yaklaşık bir hücre çapı radyal ilgi soma etrafında dairesel bir seçim aracını kullanın.
- Ilgi bölgesi (ROI) seçildiğinde, eklentileri menüsüne gidin ve "Puncta Analyzer" seçin.
- Görünen "Analiz Seçenekleri" penceresinde, "Kırmızı Kanal", "Yeşil Kanal", ilk "Çıkart Arkaplan" ve "Set sonuç dosyası seçmek ...." "Tamam" a tıklayın. Bu sonuçlar, daha fazla analiz için Excel'e içeri sonuçları kaydetmek için bir konum belirlemek için istenecektir.
- Yanında beliren pencerede, 50 yuvarlanan bir top yarıçapı seçili olduğundan emin olun ve "Beyaz Arka Plan" seçeneği (bu değişikliği gerekli değildir ancak sık sık uygulama görselleştirme kolaylığı için kullanıcılar tarafından tercih edilir) işaretini kaldırın. "Tamam" a tıklayın.
- Kırmızı kanal görüntü ile ilgili bir maske yanında yeni bir pencere belirecektir. Kırmızı maske birçok ayrık bireysel puncta olarak tanıtan çok fazla gürültü olmadan mümkün olan en iyi karşılık olduğunu hissedene kadar eşik ayarlayın. Bu protokolün en öznel adımlardan biridir, bu yüzden tutarlı bir yaklaşım geliştirmeye özen. "Bitti" seçeneğini tıklayın. 4 piksel minimum puncta boyutu ayarlayın ve başka bir şey değiştirebilir. "Tamam" a tıklayın.
- Yeşil kanal için bu kez bir önceki adımı tekrarlayın.
- Bir kez bir önceki adımı tamamlamak, eklenti her kanalda ayrı ayrı puncta için uygun kantifikasyon sağlamak ve iki kanal arasında kolokalize puncta.
BEYİN BÖLÜMLER:
Sinaps tahlil uygun bir pre-ve postsinaptik belirteç çifti (bölümlerde çalışan antikorlar) olduğunu beyinden cryosections uygulanır ve herhangi bir diğer sinir sistemi dokusunun (örneğin omurilik veya retina) sağlanan olabilir ölçmek istediğiniz sinaps tanımlamak için kullanılmıştır. Sinaps testi belirli bir beyin bölgesi temporal düzenleme sinaps oluşumu ortaya çıkarabilir ve transgenik hayvanlar ya da diğer bazı moda manipüle edilmiş bir örnek sinaptik bağlantı üzerindeki etkileri ölçmek için.
1. Fare ile Beyin Doku Hasat
Tüm hayvan prosedürleri IACUC hayvan protokolleri ile uyumlu olarak yapılmalıdır.
- PBS ile exsanguination ve perfüzyon fareler Euthanize. PBS ile Perfüzyon kan çıkarılması için çok önemlidir ve boyama işlemleri için arka plan sinyal azaltacaktır. ÖNEMLİ NOT: 4% PFA gibi fiksatif serpmek etmeyin. Bu boyama sonuçları olumsuz etkileyecektir.
2. Tespit
- 4 ° C gecede PBS içinde% 4 PFA tüm beyin sabitleyin. Ertesi gün beyinleri PBS ile 3 kez durulayın.
- PBS içinde% 30 sakaroz içine koyarak beyinleri Cryoprotect. Doku başlangıçta yüzer. 4 tutun ° C doku altına lavabolar kadar. Bu aşamada cryoprotection tamamlandı.
3. Katıştırma / Cryosectioning
- % 30 sukroz 2:1 çözüm (örneğin, sagital ve koronal) kesit için istenen yöne beyinleri Embed: (Doku-Tek, Kedi No: 4583) OCT PBS içinde. Kuru buz düz bir yüzey üzerinde gömülü beyinleri dondurun. Dondurulmuş gömülü beyinleri dondurucu torbaları yerleştirilir ve kesit önce -80 az bir yıl saklanabilir.
- Cryosection 12-16μm bölüme doku ve cam slaytlar monte (Sigma, Kedi No: S4651). Slaytlar -80 ° C boyamadan önce bir hafta kadar saklanabilir.
- Lekelenebilirler Slaytlar 30 dakika 37 ° C'de kurutulur ve kalıntı Ekim kaldırmak için PBS ile 1x durulanır olmalıdır.
4. Engelleme Bölüm
- Oda sıcaklığında bir saat süreyle PBS içinde% 20 normal keçi serumu (NGS) bölümleri engelleyin. ÖNEMLİ: Bu aşamada Triton X-100 dahil etmeyin. Engelleme çözümü ek olarak, önce Elite PAP Kalem kullanarak slayt bölümlerde etrafında hidrofobik bir bariyer oluşturmak (DBS, Kedi No: K039)
5. Primer Antikorlar uygulanması
- % 0.3 Triton ve% 10 NGS PBS birincil antikorlar sulandırınız.
- Beyin bölümlerde glutamaterjik presinaptik terminaller etiket glutamaterjik postsinaptik bölmeleri ve VGlut1 veya VGlut2 (Chemicon, kobay, 1:2500) etiket (Zymed, Tavşan, 1:500) PSD-95. Çöktürülmüş antikor varsa kaldırmak için bir masa üstü santrifüj maksimum hızda 5 dakika için birincil antikor seyreltme santrifüjleyin.
- 4, 36-60 saat birincil antikor çözüm inkübe bölümleri ° C
6. Sekonder Antikorlar uygulanması
- Her biri için 15 dakika PBS slaytlar 3x çeker birincil antikor yıkayınız. Bu adımdan sonra, direkt ışıktan slaytlarınız korumak için emin olun.
- Seyreltikaynı tampon 1:200 titrede ikincil antikorlar primer antikor olarak nitelendirdi. Örneğin VGlut/PSD95 boyama için keçi anti kobay Alexa 488 (Vglut) ve keçi anti tavşan Alexa 594 (PSD-95) (Invitrogen) kullanın.
- Sekonder antikor çözüm bölümleri karanlıkta, oda sıcaklığında 2 saat süreyle inkübe edin.
- Her biri için 15 dakika PBS slaytlar 4x çeker slaytlar kapalı ilişkisiz sekonder antikor yıkayın.
7. Montaj
- Cam slayt (VWR bilimsel) üzerine DAPI (Vektör Laboratories Inc.) Orta montaj Vectashield küçük damla ekleyin ve sonra lamelleri (VWR Bilimsel, No: 1.5, 48.393 241) ile slaytları. Lamelleri hareketini etkisizleştirmek için oje sürün.
8. Görüntüleme
ÖNEMLİ NOT: en az 3 kanallı bir konfokal mikroskop burada açıklanan görüntüleme için gereklidir. 63x immersiyon yağı hedefi kullanarak Leica SP5 lazer tarama konfokal mikroskop görüntüsü.
- Synaptic beyin bölgelerinde ilgi bölümler arasında sürekli tarama için seçilmiş olmalıdır. Örneğin, retina ganglion hücrelerinin sinaps üstün collicular nöronlar üzerine sinaps tayininde, görüntü retinocollicular terminalleri 7,8,9 aldığı sinaptik katmanı kapsar aşağı colliculus bitişik dış üstün collicular bölge. Biz görüntü ve üst 150 mikron RGCs sinaptik temas kurmak için 9 bilinen üstün colliculus sinaptik bölge sinaps ölçmek.
- Her bölüm için, hem de 488 ve 594 kanal, 15 optik bölümleri olmak üzere toplam 5 mikron toplam derinliği üzerinde 0.33 mikron aralıklarla görüntü seri optik bölümleri. Her bir hayvanın en az 3 bölüm görüntülü olmalı ve en az 3 hayvanlar belirli bir deneysel koşulu dahil edilmelidir.
- Maksimum yoğunluk projeksiyonlar (MIPs) arka arkaya 3 bölümden derinliği her 1 mikrona kadar temsil eden 5 MIPs verimli gruplar oluşturulur. Bu MIPs sayısal.
9 - Resim Niceleme
- RGCs için açıklanan tam olarak yapılabilir, ancak şekil ve ROI boyutu ölçmek için istediğiniz resimlerin hangi bölgede bir fonksiyonu olarak değişecektir.
Başarı Tuşları:
Saflaştırılmış RGCs:
- Saflaştırılmış RGCs (ya da diğer ayrışmış kültür) sabitleme önce, 37 ayarlanmış bir su banyosuna, önceden sıcak% 4 PFA emin olun ° C ~ 20-25 dakika (4 mağaza ° C Diğer tüm zamanlarda, PFA dilüsyonları kullanmak için 7 günden daha eski).
- Özellikle kültür nöronlar için, yıkama sırasında bir vakum aspiratör kullanmak için tavsiye edilir adımları durulayın. Pasteur, pipet ve bir emme ampul kullanarak gibi nazik yöntemleri belirgin boyanma kalitesini artırmak.
- Hücreleri durulama adımları sırasında kurumasına izin vermeyin özen gösterin.
- Böylece oje uygulama sırasında lamelleri hareketli lamel üzerinde hücrelerin makaslama sonucu dürtmek ya da kaçının.
- Boyama olumsuz etkileyecek herhangi bir çöktürülmüş antikorların ortadan kaldırmak için tüm birincil ve ikincil antikorlar aşağı spin.
- Farklı türler ortaya pre-ve postsinaptik belirteçler için birincil antikor seçmek için emin olun. Bunu yapmadığınız takdirde sekonder antikor uygulamasından sonra iki sinyal arasında ayrım yeteneğini ortadan kaldıracaktır.
Beyin Bölüm:
- PFA gibi fiksatif fareler serpmek etmeyin.
- Triton-X 100 beyin bölümler için engelleme çözümü dahil etmeyin. Presinaptik belirteçleri, özellikle sinaptik veziküller ile ilişkili presinaptik belirteçlerinin zararlardan böylece boyama kalitesi yapmak.
- Görüntüleme için bir konfokal mikroskop kullanımı bir sinaps analizi gerçekleştirmek için yeterli kalitede görüntü elde etmek için gereklidir.
Temsilcisi Sonuçlar:
Yukarıda açıklanan sinaps testi, in vitro ve in vivo sinaptik bağlantı değişiklikleri yakalamak için tasarlanmıştır . Laboratuvarda, sinaps, sinaps oluşumu ya bireysel ya da birden fazla astrosit salgılanan moleküllerin etkisini belirlemek için tahlil kullanmaktadır. Biz genellikle arıtılmış RGCs bu sinaps tahlil yapmak, in vitro kültür .
RGC kültürler saflaştırılmış astrosit klimalı ortamlar kronik uygulama (ACM) iyi tanımlanmış bir etkisi RGCs 3,4,5,6 arasında oluşan sinaps sayısı birden fazla kat artış . Şekil 1A ve 1B bazal büyüme medya ya da ya da ACM ile tedavi untransfected saflaştırılmış RGCs temsilcisi görüntüleri göstermektedir. Eksitatör pre ve postsinaptik belirteçleri, s ACM-bağlı artış boyama sonraynapse oluşumu (Şekil 1A, 1B) niteliksel açıktır. Gerçekten de, bu bulgu, ACM-bağlı sinaps, sinaps 3,4,6 ultrastructurally normal olduğunu göstermek için, fonksiyonel ve elektron mikroskobu olduğunu göstermek için elektrofizyoloji kullanılan çeşitli çalışmalar tarafından doğrulanmaktadır. Laboratuvarımızda Diğer kalsiyum kanal altbirim α2δ nöronal reseptörü olarak güçlü bir synaptogenic astrosit salgılanan molekülü, trombospondin 3-1 belirlemiştir. Burada α2δ-1 düzeylerinde artış ACM-bağlı sinaps oluşumu (Şekil 3) daha artırır olmadığını belirlemek için yapıldı RGCs saflaştırılmış bir deney sonuçlarını içerir.
RGCs boş bir vektör ya birlikte ya da ayrı bir yapı ile in vitro (DIV5) 5 gün sonra tdTomato kodlama yapı α2δ-1 kodlama ile cotransfected. ACM ya da GM ile kronik tedavi sonrasında, RGCs fikse edildi ve DIV 11 boyandı. Ya boş bir vektör (pcDNA3.1) veya α2δ-1 (Şekil 1C, 1D) ifade RGCs saflaştırılmış sinaps sayısı niteliksel olarak belirgin bir artış görüyoruz eksitatör sinaps öncesi ve postsinaptik belirteçlerinin ardından immunolabeling. Her koşul için en az 15 nöronlar sinaps sayısı (Şekil 2) saymak Puncta analizörü kullanılarak ACM synaptogenic etkisini ölçmek. Bu boyuttaki bir örnek bize nöron ortalama sinaps ortalama sayısını hesaplamak ve boş bir vektörü (Şekil 3, gri bar) ifade olan ACM-tedavi nöronların oluşturduğu bir sinaps, istatistiksel olarak anlamlı ~ 10 kat artış bulmak için sağlar. Ayrıca, ACM-bağlı sinaps oluşumu (~ 20 kat Şekil 3, siyah çubuklar) önemli bir potansiyasyonu α2δ-1 yol açar bu aşırı ekspresyonu göstermektedir.
Kültürlü nöronların yanı sıra, bu tekniği kullanarak, beynin farklı bölgelerinde sinaptik yoğunluğu ölçmek. Üstün colliculus retinocollicular projeksiyonlar alır retina 7,8,9 RGCs menşeli bir beyin yapısı. Postnatal gelişim içinde, üstün colliculus hedeflerine üzerine RGCs oluşturduğu eksitatör sinaps sayısı önemli ölçüde P21 7,8,9 P7 artar.
Bizim kantifikasyon tekniği kullanarak, retinocollicular sinaps sayısı P14 P7 üstün colliculus artar oluştuğunu göstermektedir. Bunu yapmak için, biz P14 tekrar P7 sinaptik yoğunluk ölçülmesi ve. PSD-95 (postsinaptik) ve VGlut2 (üstün colliculus RGC sinaps özgü presinaptik işaretleyici) üstün colliculus leke. Üstün colliculus dış sinaptik bölgede görüntülendi (Şekil 4A) ve co-lokalize VGlut2/PSD-95 sinaps, hayvan başına en az 3 bölüm ve bir zaman noktasında 3 hayvan başına en az (Şekil 4B, 4C) ölçüldü. Çıkan veriler sayısal açıkça P7 ve P14 arasındaki sinapsların sayısının bir fazla üç kat önemli bir artış göstermektedir. Bu sonuçlar, daha önce yayınlanan bulgular elektron mikroskobu (Şekil 4D) 9 kullanan ile anlaşma.
Sonuç olarak, biz burada açıklamak sinaps sayısı kantifikasyon yöntemi, in vitro ve in vivo sinaps oluşumu manipüle etmek için bize etkilerini incelemek amacıyla sağlayan kültür ve sinir dokularında sinaps sayısı ve yoğunluğu belirlemek için bir araçtır .
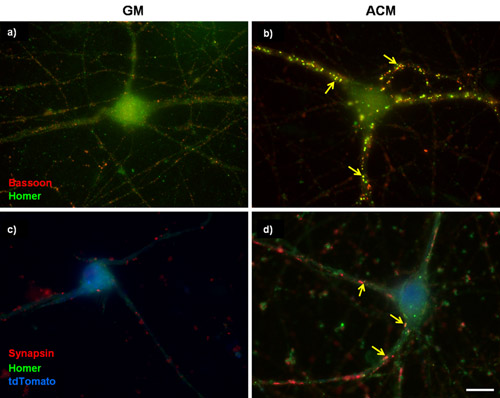
Şekil 1: RGCs saflaştırılmış Temsilcisi sinaptik boyama. (A) (A ve B), in vitro (DIV) RGCs 3 gün ya da kültüre edildi bazal büyüme ortamı (GM) veya (B) ilave bir 6 gün yanlısı synaptogenic fare astrosit klimalı ortam (ACM) . Hücreler daha sonra fagot (presinaptik, kırmızı) ve homer (postsinaptik, yeşil) etiketli. Fare ACM güçlü co-lokalize fagot ve homer puncta sayısındaki artış ile belirlenen RGCs arasındaki sinaps oluşumunu uyarır. (C ve D) 5DIV RGCs, kalsiyum kanal altbirim α2δ-1 eksprese plazmid ile transfekte edildi. Transfekte hücreler tdTomato hücre dolgu (mavi) ile özdeşleşmiş, presinaptik işaretleyici synapsin ve postsinaptik işaretleyici homer lekeli olmuştur. Oklar sinaps göstermektedir. Ölçek çubuğu 20 mikron temsil eder.
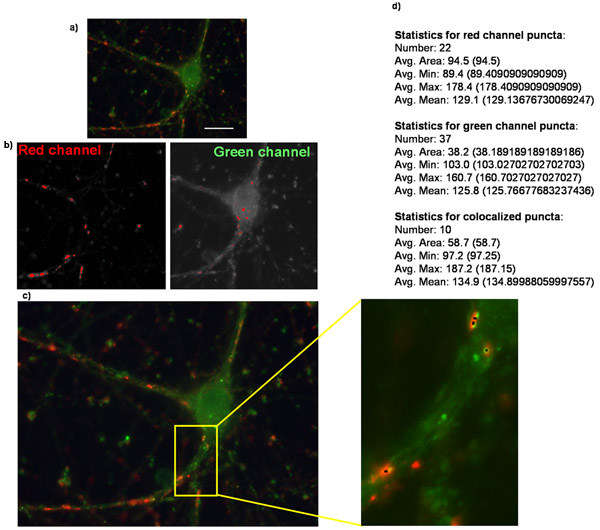
Şekil 2: Puncta Analyzer Burada gösterilen kullanarak sinaps sayısı Niceleme (a) saflaştırılmış bir retina ganglion hücre eksprese trombospondin reseptör α2δ-1 ve özgün bir görüntü, presinaptik işaretleyici synapsin ve postsinaptik işaretleyici homer lekeli bir örnektir . Puncta Analyzer puncta analiz ederken her kanalda oluşturulan maskeler karşılık gelen (b) Görüntüler. (C) Puncta Analzyer puncta küçük siyah noktalar (inset) tarafından belirtilmiştir, burada gösterildiği gibi bir görüntü yaratacaktır. Ayrıca shown (d) birçok diğer parametreler ile birlikte puncta metinsel / sayısal formda (kalın metin vurgu için eklendi) sağlanan uygulama sayısal çıktı.
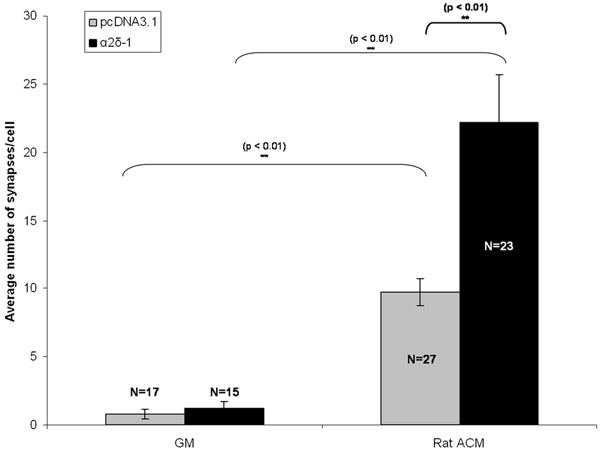
Şekil 3: sinaps tayini için Temsilcisi sonucu Burada gösterilen RGCs boş vektör (pcDNA3.1, gri bar) veya trombospondin reseptör α2δ-1 ya da ifade transfekte RGCs astrosit klimalı ortam (ACM) ile kronik tedavi synaptogenic etkisi . Hata çubukları SEM temsil eder. GM = Büyüme Medya. ACM = (Sıçan) Astrosit Hücre contitioned Medya.
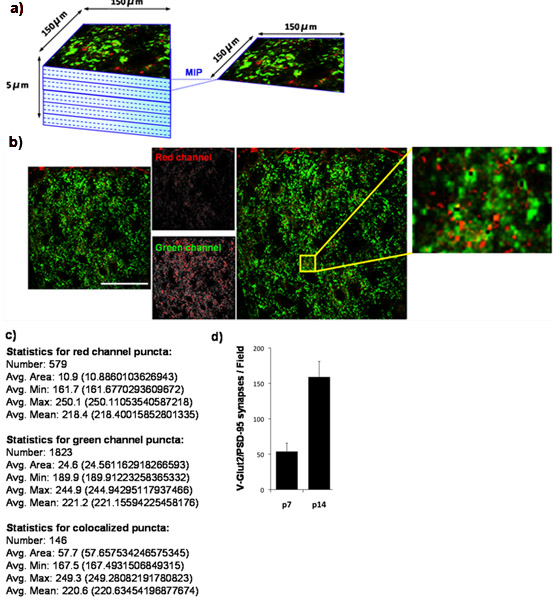
Şekil 4: fare üstün colliculus sinaptik yoğunluk Kantitasyonu (a), kemirgen beyin üstün collicular hedefleri üzerine RGCs tarafından kurulan glutamaterjik sinaps sayısı gelişimsel değişiklikleri belirlemek için, biz presinaptik karşı antikorlar fare beyin cryosections boyandı işaretleyici VGlut2 (yeşil) ve postsinaptik marker, PSD-95, (kırmızı). Biz dış konfokal mikroskop tarama bir lazer kullanarak RGCs sinaptik hedef bölge karşılık gelen fare üstün colliculus (SC) 150 x 150 mikron bölge görüntülenmiş. 5 mikron (15 x 0.33 mikron optik bölümleri) toplam derinlik için her SC bölümü için z-yığını toplanmıştır. Maksimum görüntü projeksiyonlar (MIPs), 5 MIPs / bölümünde verimli 3 ardışık optik bölümden gruplar için oluşturulan her biri 1 mikron derinliğinde temsil eden. Aşağıda gösterilen P14 WT fare üstün colliculus alınan bir temsilcisi MIP. Presinaptik marker, VGlut2, yeşil gösterilir ve postsinaptik marker, PSD-95, kırmızı renkte gösterilmiştir. (C) Sayısal çıkış Puncta Analyzer tarafından üretilmektedir. (D) analiz sinaps sayısı ortalama 3 hayvan bir zaman noktasında (hata bar SEM temsil) ile hayvan başına en az 3 bölümler için Niceleme. Ölçek çubuğu 50 mm temsil eder.
Tartışmalar
RGCs eksitatör projeksiyonlar büyük ölçüde odak neyin deneysel hedefleri bağlamında kültür arıtılmış veya beyin bölümünde, yukarıda açıklanan sinaps tahlil ya dayanır. Biz eksitatör sinapslar (Tablo 1) etiketleme için iyi bir referans masayı antikorları sağladı.
Bu sinaps tahlil, sinaps herhangi bir nöronal nüfusun sayısı ya da seçici bir pre-ve postsinaptik işaretleyici olduğu başka herhangi bir sinaptik alt tipi ölçmek için adapte edilebilir. Örneğin...
Açıklamalar
Teşekkürler
Puncta Analyzer Plug-in Ben A. Barres laboratuar J Barry Wark (Güncel adresi: Physion Danışmanlık) tarafından yazılmıştı (Stanford Üniversitesi).
Finansman;
- Alfred P. Sloan Vakfı
- Esther A. ve Joseph Klingenstein Fonu, Inc.
- Geniş Biyomedikal Araştırma Vakfı
- Cure Huntington Hastalığı Girişimi
Malzemeler
| Name | Company | Catalog Number | Comments | |||||
| Antijen | Tür | Poliklonal / monoklonal | Satıcı | Katalog Numarası | Seyreltme | Kültür çalışır. | İşleri Kısım | |
| Presinaptik | Synapsin | Tavşan | Poliklonal | Synaptic Sistemleri | 106004 | 1:750 | Y | ND |
| Synapsin | Fare | Monoklonal | Synaptic Sistemleri | 106001 | 1:500 | Y | Y | |
| Fagot | Fare | Monoklonal | Testi Tasarımlar | VAM-PS003F | 1:500 | Y | Y | |
| Fagot | Guinea Pig | Poliklonal | Synaptic Sistemleri | 141004 | 1:1000 | Y | ND | |
| Synaptotagmin 1 | Tavşan | Poliklonal | Synaptic Sistemleri | 105002 | 1:750 | Y | N | |
| Synaptobrevin 2 (C1.69.1) | Fare | Monoklonal | Synaptic Sistemleri | 104211 | 1:500 | Y | Y | |
| Sinaptofizin (C1.7.2) | Fare | Monoklonal | Synaptic Sistemleri | 101011 | 1:500 | Y | Y | |
| VGlut1 | Fare | Monoklonal | Millipore | MAB5502 | 1:2500 | N | Y | |
| VGlut1 | Kobay | Poliklonal | Millipore | AB5905 | 1:2500 | N | Y | |
| VGlut2 | Kobay | Poliklonal | Millipore | AB2251 | 1:2500 | N | Y | |
| Postsinaptik | PSD-95 (6G6-1C9 klon) | Fare | Monoklonal | Affinity Bio Reaktifleri | MA1-045 | 1:750 | Y | N |
| PSD-95 | Tavşan | Poliklonal | Zymed | 51-6900 | 1:500 | N | Y | |
| Beysbolde tur vuruşu | Fare | Monoklonal | Synaptic Sistemleri | 160011 | 1:500 | Y | ND | |
| Beysbolde tur vuruşu | Sıçan | Poliklonal | Millipore | AB5875 | 1:500 | Y | Y | |
| Gephyrin | Tavşan | Poliklonal | Synaptic Sistemleri | 147003 | 1:500 | Y | Y | |
| Gephyrin | Fare | Monoklonal | Synaptic Sistemleri | 147 | 1:200 | Y | Y |
Tablo 1: biz bizim sinaps tayininde başarılı bir şekilde kullanılmaktadır olduğunu iyi pre-ve postsinaptik belirteçlerin Listeler örnekler. Bu mevcut tüm belirteçlerin bir liste olmadığını farkında olun. Y = Evet, N = Hayır, ND = Tespit Edilemeyen.
| Reaktif | Şirket | Cat. Hayır. |
| PBS | Invitrogen | 20012-027 |
| poli-d-lisin | Sigma | P6407 |
| Laminin | Cultrex | 3400-010-01 |
| Triton X-100 | Roche Diagnostics GmbH | 9002-93-1 |
| Normal Keçi Serum | Gibco | 16210 |
| DAPI ile VectaShield | Vektör Laboratuvarları | H-1200 |
| Ekim | Doku-Tek | 4583 |
| Tris-Baz (50 mM) | Balıkçı | BP152-5 |
| Sığır Serum Albumin | Sigma | A2153 |
| l-lizin | Sigma | L-1137 |
| % 16 PFA çözüm | Elektron Mikroskopi Bilimler | 15711 |
| Granül PFA | Elektron Mikroskopi Bilimler | 19210 |
| 24 kuyu kültür plaka | Şahin | 35-3047 |
| Keçi anti-fare Alexa konjuge antikorların | Invitrogen | --- |
| Besleme | Şirket | Cat. Hayır. |
| 12mm, No: 0 cam lamelleri | Karl Hecht Gmbh | 1105209 |
| No 1.5 cam lamel (dilim için) | VWR Bilimsel | 48393241 |
| Cam slaytlar | VWR Bilimsel | 48311-703 |
Referanslar
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Y. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1, 791-803 (1988).
- Meyer-Franke, A., Kaplan, M. R., Pfrieger, F. W., Barres, B. A. Characterization of the signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron. 15, 805-819 (1995).
- Eroglu, C. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 139, 380-392 (2009).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 .
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinocollicular projections in the mouse. J. Comp. Neurol. 230, 552-575 (1985).
- Schmidt, J. T. Formation of retinotopic connections: selective stabilization by an activity-dependent mechanism. Cell. Mol. Neurobiol. 5, 65-84 (1985).
- Sachs, G. M., Jacobson, M., Caviness, V. S. Postnatal changes in arborization patterns of murine retinocollicular axons. J. Comp. Neurol. 246, 395-408 (1986).
- Elmariah, S. B., Oh, E. J., Hughes, E. G., Balice-Gordon, R. J. Astrocytes regulate inhibitory synapse formation via Trk-mediated modulation of postsynaptic GABAA receptors. J. Neurosci. 25, 3638-3650 (2005).
- Hughes, E. G., Elmariah, S. B., Balice-Gordon, R. J. Astrocyte secreted proteins selectively increase hippocampal GABAergic length, branching and synaptogenesis. Moll. Cell. Neurosci. 43, 136-145 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır