このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
定量シナプス:シナプス数を定量する免疫細胞ベースのアッセイ
要約
このプロトコルは、解離神経培養および免疫細胞化学を用いて脳切片の両方シナプス数を定量化する方法を詳しく説明します。コンパートメント特異的抗体を用いて、我々は、シナプス前終末だけでなく、シナプス後部の専門のサイトにラベルを付けます。我々は、これらのマーカーによって生成された信号間の共局在のポイントとしてシナプスを定義します。
要約
神経科学における最も重要な目標の1つは、シナプス形成の初期段階を指示する分子の合図を理解することです。このように、それはシナプス接続の変化を定量化するための客観的なアプローチを開発するために必要不可欠になっています。サンプルの固定から始まる、このプロトコルの詳細については、どのように解離神経細胞培養中および免疫細胞化学を用いて脳切片の両方シナプス数を定量化する。コンパートメント特異的抗体を用いて、我々は、シナプス前終末だけでなく、シナプス後部の専門のサイトにラベルを付けます。我々は、これらのマーカーによって生成された信号間の共局在のポイントとしてシナプスを定義します。これらcolocalizationsの数は、ImageJの解析ソフトウェアのプラットフォームの下涙点アナライザ(リクエストも承りますバリーウォーク、、c.eroglu @ cellbio.duke.eduによって書かれた)プラグインを使用して定量される。このプロトコルで説明されているシナプスのアッセイは、選択前と後シナプスマーカーを持っている任意の神経組織や文化を準備するために適用することができます。このシナプスのアッセイは、広くシナプス開発の研究に利用することができる貴重なツールです。
プロトコル
準備するソリューション:
- 抗体のバッファ:
- 150mMのNaCl
- 50mMトリス - 塩基(フィッシャー、カタログ番号:BP152 - 5、50mMの) - 1.21グラム
- 1%BSA(Sigma、カタログ番号:A2153、1%) - 2.0グラム
- 100mMのL -リジン(Sigma、カタログ番号:L - 1137、100mMの) - 3.65グラム
- 7.4にpHを調整する
- 0.04%アジ化
- 蒸留H 2 Oで200mlにボリュームを調整
- 0.22μmフィルターを通してフィルター(ミリポア、カタログ番号:SCGPU02RE)。
- PFA Diluant:
- 168ミリリットル、0.5MのNa 2 HPO 4(二塩基性)
- 72ミリリットル0.5MのNa 2 HPO 4(一塩基)
- 660ミリリットルの蒸留H 2 O
- 培養神経細胞を4%PFAで固定(溶液#2):
- 10ミリリットル16パーセントPFAソリューション(電子顕微鏡の科学、カタログ番号:15711)
- 30ミリリットル4%PFA diluant(解決策#2)
- PBS中4%PFA:
- 4グラムPFA(電子Microscropy科学、カタログ番号:19210)
- 100ミリリットルのPBS(インビトロジェン社、カタログ番号:20012〜027)
- 40〜熱° C、一晩撹拌。
- 0.22μmフィルター(。:SCGPU02REミリポア、猫なし)をフィルタにかける
- ブロッキングバッファー(総容積(24ウェルプレート用)=(#カバースリップ+1)×200μlの)
- 50%の抗体緩衝液(溶液#1)
- 50パーセント正常ヤギ血清(ギブコ社、カタログ番号:16210)
- 0.2%トリトンX - 100(ロシュダイアグノスティックス社、カタログ番号:9002-93-1)
- PBSで30%のショ糖
- 30gのスクロース(MPバイオメディカル社、カタログ番号:821713)
- 70ミリリットルのPBS(インビトロジェン社、カタログ番号:20012〜027)
- ショ糖が溶液になるまで撹拌棒で混ぜる。
- PBSで100mlにボリュームを起動
- 0.22μmのフィルター(。:SCGPU02REミリポア、猫なし)をフィルタにかける
ニューロン培養の調製:
24ウェルプレート(ファルコン、35〜3047)の:ここに記載されたプロトコールは12 mmのガラス製カバースリップ(99010。カールヘクト、第O、猫なし)上に成長させた任意の一次ニューロン培養に適用可能である。例えば、私たちの研究室で我々は、培養ラット網膜神経節細胞(RGCsは)P5 - 7動物の1,2から収穫されたラットの網膜から精製。とマウスラミニン(Cultrex、カタログ番号:3400-010-01):細胞をポリ- D -リジン(。P6407 Sigma、カタログなし)をコーティングしたガラスカバースリップ上に成長されています。私たちは、シナプスのアッセイのためのいくつかの異なる方法でこの文化の準備を活用する。我々は実行することを一つの操作では、アストロサイトから分泌synaptogenic因子の有無のいずれかで培養RGCsを伴います。また、我々はまた、RGCsが目的のタンパク質を過剰発現するトランスフェクトされた実験では、これらの異なる処理条件を採用しています。後者のケースでは、我々は細胞のラベル(例えば、GFPまたはtdTomato)で細胞を同時トランスフェクション。これらのさまざまな実験的アプローチは1つが我々は以下に明らかにシナプスアッセイの特定の手順を実行する方法に影響します。
1。解離精製RGCsを修正
- RGC -含むウェルから培地を除去し、500μlの(24ウェルプレート用)4%パラホルムアルデヒド(PFA)を追加するには° Cを各ウェルに37に温した。細胞は室温で7分間修正することができます。
- 以下の固定はして細胞を3回リンスリン酸緩衝生理食塩水(PBS)(Invitrogen社製、カタログ番号:20012〜027)。重要:バッファは、次のバッファでもそれは速やかに交換する必要がありますから削除されると細胞は、ウェル中の液体に放置しないでください。この時点で、細胞は免疫染色のための準備が整いました。
2。 RGCsで非特異的な結合サイトをブロック
- (:16210。いいえNGS、ギブコ、猫)と0.2%トリトンX - 100(ロシュダイアグノスティックス社、カタログ番号:9002-93-1)50%正常ヤギ血清を含むブロッキングバッファーを準備しない。各ウェルからPBSを除去した後、室温で30分間各ウェルブロックに、ブロッキング緩衝液200μlを加える。
- ブロッキングバッファーを取り除き、PBSで3回リンス。
3。一次抗体溶液を適用する
- 重要:異なる種から得られるより前と後シナプスマーカーの一次抗体を選択してください。
- 90%の抗体バッファ内の一次抗体の希釈、あなたの選択の前と後シナプス抗体のペアを含む10%のNGSの溶液を調製します。例のウサギ抗synap用罪(シナプス前のマーカー)(1:750、細胞質ドメイン、シナプスシステム)およびマウス抗ホーマー(シナプス後のマーカー)(1:500、マウス、シナプスシステム)。重要:いずれかの沈殿抗体を除去するためにベンチトップ遠心機で最高速度で5分間、一次抗体の希釈を遠心分離。
- 各ウェルに200μlの一次抗体溶液を追加。
- 4℃で一晩インキュベート℃、プレートは、主なソリューションの乾燥を防ぐために加湿される大きな容器に配置する必要があります。 Break Pointを:セルはプロトコルを続行する前までの3日間、一次抗体の混合物に滞在することができます。
- 翌日、各ウェルから一次抗体を除去し、PBSでウェルを3回すすいでください。
4。二次抗体溶液を適用する
- 10%のNGSを含む抗体のバッファーで1:1000に希釈して二次抗体を含む二次抗体溶液を準備します。重要:沈殿した抗体を除去するためにベンチトップ遠心機で最高速度で5分間二次抗体の希釈を遠心分離。高い二次抗体のバックグラウンドでこのステップの結果をスキップ。
トランスフェクトされていないセル:セルのラベルがない場合は、それぞれ前と後シナプスマーカーを標識するためのAlexa - 594およびAlexa - 488共役セカンダリを使用してください。例えば、我々は、抗シナプシン抗体とヤギ抗マウス抗ホームランの抗体を標識するためのAlexa - 488標識二次にラベルを付けるためにヤギ抗ウサギAlexa594を使用してください。重要:弱い信号で一次抗体用のAlexa - 488共役セカンダリを使用してください。
トランスフェクションされた細胞:あなたの蛍光細胞標識の励起発光スペクトルに対応する二次抗体を選択してください。例えば、我々はtdTomatoを導入した細胞を標識する際に我々はAlexa - 647標識ヤギ抗ウサギ抗シナプシン抗体と抗ホームランの抗体を認識するためのAlexa - 488標識ヤギ抗マウスを認識するために使用します。また、このプロトコルにNGSの使用は、ヤギで生産された二次抗体の私達の選択の結果です。 - 各ウェルに200μlの二次抗体溶液を追加。
- 暗い場所に室温で2時間インキュベートした後、PBSで3〜4回すすいでください。
5。取付カバーグラス
- ガラススライド(。:48311から703 VWR科学的な、猫なし)上:Vectashieldにマウントカバースリップは、DAPI(H - 1200。ベクターラボラトリーズ社、猫なし)でメディアをマウントする。
- 静かにカバースリップのエッジの周りに透明なマニキュアを適用し、乾燥した、暗い場所で少なくとも30分間乾燥させます。重要:これは細胞のシェアーリングで結果になるので、マニキュアの適用中にカバースリップを少しずつ動かしたり、移動しないでください。
6。イメージング
イメージングのために、4つの異なるチャンネルで写真を撮ることのできるカメラを装備した蛍光顕微鏡画像の両方シナプスのマーカーは、セルの塗りつぶしと核(DAPI /オプション)をできるようにする必要があります。細胞は、油浸63x対物レンズを用いて画像化する必要があります。我々はツァイスプラン - アポクロマート63x/1.4オイルDIC∞/ 0.17目的とツァイスAxioImager蛍光顕微鏡を使用してイメージ。
- 離れて彼らの最も近い隣人から少なくとも二つの細胞の直径であるセルを選択します。バイアスを回避し、トランスフェクトされていない細胞の可視化、DAPIのチャネルのセルを選択した場合、セル選択のランダム性を確保するために、そしてすべてのチャンネルで画像を撮影する。可視化するトランスフェクションされた細胞はトランスフェクトした細胞(例えばtdTomato)を識別するために蛍光標識に対応するチャネルのセルを選択した場合。
- 自分のイメージを取得する:
トランスフェクトされていないセル:選択した各セルには、GFPとテキサスレッドのチャンネルの8ビット画像を得る。重畳疑似画像はそれぞれ、赤と緑のあなたの前および後シナプスマーカーを持つ必要があります。
トランスフェクションされた細胞:選択した各セルにはGFP、テキサスレッドおよびCy5(またはCy5.5)チャネルの8ビットの画像を得る。重畳疑似画像はそれぞれ、赤と緑のあなたの前および後シナプスマーカーを持つ必要があります。擬似カラー、セルは青で記入してください。
7。画像解析と共局在涙点の定量化
- 我々は、定量共局在シナプス涙点のために涙点アナライザプログラムを使用してください。涙点アナライザのプラグインでは、バリーウォークによって書かれ、そしてリクエスト(c.eroglu @ cellbio.duke.edu)により利用可能です。涙点アナライザはImageJ 1.26(http://rsbweb.nih.gov/ij/、新しいImageJのバージョンのアプリケーションを実行することはできません)で実行されます。涙点Analyzerをインストールするには、単にImageJが1.26ディレクトリ内に"plugins"フォルダにダウンロードしたアプリケーションのフォルダを置きます。
- ImageJを使ってイメージのいずれかを開きます。虚数のいずれかの選択ツールを使用して、EJは、メニュー、関心領域(ROI)を決定する。我々は定期的に興味のある細胞体の周囲に放射状に地域の約1セルの直径を選択するために円形の選択ツールを使用してください。
- 興味のある領域(ROI)を選択した状態で、プラグインメニューに移動し、"涙点アナライザ"を選択します。
- 表示される"解析オプション"ウィンドウで、"赤チャンネル"、"グリーンチャンネル"、最初の"減算の背景"と"設定結果のファイルを選択して...." "OK"をクリックします。これらの結果をさらに分析するためにExcelにエクスポートすることができますインチあなたは、あなたの結果を保存する場所を定義するよう求められます。
- 次に表示されるウィンドウで、50のローリングボールの半径が選択されていることを確認し(この変更は必須ではありませんが、しばしば可視化を容易にするためのアプリケーションのユーザーに好まれている)"白背景"オプションを無効にしてください。 "OK"をクリックします。
- 新しいウィンドウが赤チャンネルの画像に対応するマスクの横に表示されます。あなたが赤のマスクがあまりにも多くのノイズを導入することなく、多くの離散的な個々の涙点としてするだけでなく、可能な限り対応していることを感じるまでしきい値を調整します。これは、このプロトコルの最も主観的なステップの一つなので、一貫したアプローチを開発するように注意してください。 "完了"をクリックします。 4ピクセルに最小涙点のサイズを設定し、他には何も変更することはありません。 "OK"をクリックします。
- 、緑のチャンネルにこの時間を、前の手順を繰り返します。
- 一度前のステップを完了する、プラグインは個別に各チャンネルの涙点に対応する定量化を提供し、二つのチャンネル間で共局在涙点になります。
脳切片:
シナプスアッセイが可能な適切な前と後シナプスマーカーのペアは、(セクションでうまく動作する抗体を持つ)があることを脳から凍結切片に適用、および他の神経系組織(例えば、脊髄や網膜など)に提供することができます。あなたが定量化するシナプスを同定するのに利用。シナプスのアッセイは、特定の脳領域でのシナプス形成の時間的調節を明らかにすることができますし、トランスジェニック動物、または他の方法で操作されているサンプルのシナプス接続への影響を定量化できます。
1。マウスの脳組織を収穫
すべての動物の手順はIACUC動物のプロトコルとの一致で行う必要があります。
- PBSで放血し、血流によってマウスを安楽死させる。 PBSで灌流は、血液の除去のための非常に重要ですし、染色手順のためのバックグラウンドのシグナルが減少します。重要:このような4%PFAなどの固定液で灌流しないでください。これは否定的染色の結果に影響します。
2。固定
- 4℃で一晩、PBS中4%PFAで脳全体を修正。翌日は、脳をPBSで3回リンス。
- PBSで30%ショ糖にそれらを置くことによって頭脳をCryoprotect。組織は、最初にフロートします。 4℃で保管°組織が底に沈むまで、C。その段階でcryoprotectionは完了です。
3。埋め込み/ Cryosectioning
- OCT(ティッシュ- Tek社、カタログ番号::。4583)PBSで30%ショ糖の2:1溶液中で(例えば、矢状またはコロナル)切片に所望の向きに脳を埋め込みます。ドライアイスの平らな面に埋め込まれた脳を凍結する。冷凍埋め込まれた脳は、フリーザーバッグに入れと切片の前に年まで-80℃で保存することができます。
- 凍結切片は12 -16μmのセクションにティッシュと(シグマ、カタログ番号:S4651)、スライドガラス上にマウント。スライドは、-80℃で染色する前に週まで保存することができます。
- 染色されるスライドは、30分間37℃で乾燥し、残留OCTを削除するには、PBSで1倍を洗い流してください。
4。ブロッキングセクション
- 室温で1時間PBSで20%正常ヤギ血清(NGS)のセクションをブロックする。重要:この段階でトリトンX - 100を含めないでください。ブロッキング溶液を添加する前に、あなたはエリートPAPペン(。:K039 DBS、猫なし)を使用して、スライド上のセクションの周り疎水性の障壁を作成することができます
5。一次抗体の適用
- 0.3%のトリトンと10%NGSでPBSで一次抗体を希釈する。
- 脳切片では、グルタミン酸作動性シナプス前終末にラベルを付けるためにグルタミン酸作動性シナプス後部コンパートメントとVGlut1またはVGlut2を(Chemicon社、モルモット、1:2500)にラベルを付ける(Zymed社、ウサギ、1:500)PSD - 95を使用してください。存在する場合は沈殿した抗体を除去するためにベンチトップ遠心機で最高速度で5分間、一次抗体の希釈を遠心します。
- 4℃で36〜60時間一次抗体溶液で切片をインキュベート℃に
6。二次抗体の適用
- 15分ごとに、PBSで3倍のスライドを浸漬することにより、一次抗体を洗い流す。このステップの後に直接光からスライドを保護することを確認してください。
- 薄める一次抗体について説明したのと同様の緩衝液で1:200の希釈では二次抗体。 VGlut/PSD95染色の例では、ヤギ抗モルモットアレクサ488(Vglut)、ヤギ抗ウサギアレクサ594(PSD - 95)(Invitrogen)を使用してください。
- 暗所で室温で2時間二次抗体溶液中でのセクションをインキュベートする。
- 15分ごとに、PBSで4倍のスライドを浸漬することにより、スライドから非結合二次抗体を洗浄してください。
7。取り付け
- スライドガラス(VWR科学的)にDAPI(ベクターラボラトリーズ社)を培地に取り付けVectashieldの小滴を追加してから、カバースリップ(VWRサイエンティフィック、第1.5、48393 241)でスライドをカバーしています。カバースリップの動きを阻害するためにマニキュア爪適用されます。
8。イメージング
重要:少なくとも3つのチャネルを持つ共焦点顕微鏡は、ここで説明するイメージングのために必要です。 63x油浸対物レンズを使用してライカSP5レーザー走査型共焦点顕微鏡で我々は、画像。
- 興味のシナプス脳領域は、セクション間で一貫してスキャン用に選択する必要があります。たとえば、優れたcollicularのニューロン上に網膜神経節細胞のシナプスの私達のシナプスアッセイにおいて、我々のイメージretinocollicular端子7,8,9を受け取るシナプス層を包含する下丘に隣接して外側の優れたcollicular領域を。我々は、画像とRGCsがシナプス接点9を確立することが知られている上丘の上限は150μmシナプスゾーンにシナプスを定量化する。
- 各セクションの、両方の488および594のチャネルで、我々は、画像15の光学切片の合計は5ミクロンの合計深さ以上0.33μmの間隔でシリアルの光学切片を。各動物から少なくとも3つのセクションを撮像する必要があり、少なくとも3匹の動物は、特定の実験条件から含まれている必要があります。
- 最大強度投影(MIPは)深さの1μmのそれぞれを表す5 MIPSをもたらす3つの連続したセクションのグループから生成されます。これらのMIPは、定量化されています。
9。画像定量化
- RGCsについて説明したように正確に実行することができる、ROIのしかし、形状や大きさは、定量化する画像の領域の関数として変化します。
成功への鍵:
精製RGCs:
- 精製されたRGCsを(または他の分散培養)修正前に37に設定されて水浴中° C〜20〜25分(4℃で保存他のすべての時間ではC、PFAの希釈液を使用しないプリ暖かい4%PFAに確認してください7日間よりも古い)。
- 特に培養神経細胞のために、それはすべてのすすぎのステップのための洗浄中に真空吸引器を使用しないことをお勧めします。そのようなパスツールピペットや吸引器を使用するなど、穏やかな方法は、著しくご染色の品質を向上させる。
- あなたの細胞があなたのすすぎのステップ中に乾燥させないように注意してください。
- あなたのカバースリップ上の細胞が切断されることができるそうとしてマニキュアの塗布時にカバースリップを少しずつ動かしたり、移動しないでください。
- 否定的染色に影響を与えるあらゆる沈殿した抗体を除去するためにすべての一次および二次抗体をスピンダウンします。
- 別の種で育ったあなたの前と後シナプスマーカーに一次抗体を選択してください。これを怠ると、二次抗体のアプリケーションの後の2つの信号を区別する能力がなくなります。
脳切片:
- このようなPFAとして固定剤を使用してマウスを灌流しないでください。
- 脳切片については、ブロッキング溶液中のトリトンX - 100を含めないでください。特にシナプス前のマーカー、シナプス小胞に関連付けられているシナプス前のマーカーに損害賠償ので染色の品質をして。
- イメージングのための共焦点顕微鏡の使用は、シナプスの解析を行うために十分な品質が高い画像の取得が必要です。
代表的な結果:
上記のシナプスのアッセイは、in vitroおよび in vivo でのシナプス接続の変更を取得するように設計されています。私たちの研究室では、我々はシナプス形成上の個々のまたは複数のアストロサイトから分泌分子のどちらかの効果を決定するためにシナプスアッセイを利用しています。我々は一般的に精製されたRGCsでこのシナプスアッセイを実行することをin vitroで私たちは文化。
RGCの文化を精製におけるアストロサイト馴化培地の慢性的なアプリケーション(ACM)のよく説明する効果はRGCs 3,4,5,6の間に形成されるシナプスの数の複数倍の増加である。図1Aおよび1Bは、どちらかの基礎増殖培地、またはACMで扱わトランスフェクトされていない精製RGCsの代表画像を示す。興奮プリと後シナプスマーカーに染色した後、sのACM誘発性の増加ynapseの形成は、定性的に明らかである(図1A、1B)。確かに、この知見は、ACM誘発性のシナプスは、シナプスが3,4,6 ultrastructurally正常であることを示すために、機能と電子顕微鏡であることを示すために電気生理学を使用しているいくつかの研究によって確証されています。当研究室で他の作業は、カルシウムチャネルのサブユニット強くsynaptogenicアストロサイトから分泌分子、トロンボスポンジン3のニューロン受容体としてのα2δ- 1を同定した。ここでは、α2δ- 1レベルの増加がさらにACM誘発シナプス形成(図3)を向上させるかどうかを判断するために実行されたRGCsを精製実験の結果が含まれています。
RGCsは、in vitroで 5日間(DIV5)の後に独立した構造エンコーディングtdTomatoとα2δ- 1空のベクターのいずれかでまたは構造エンコーディングとトランスフェクションした。 ACMまたはGMのいずれかを伴う慢性治療に続いて、RGCsはDIV 11日に固定し、染色した。プリと興奮性シナプスのシナプス後のマーカーの免疫標識に続いて我々は空のベクトル(したpcDNA3.1)またはα2δ- 1(図1C、1D)を発現するRGCsを精製におけるシナプス数の質的に明らかな増加を参照してください。私たちは、それぞれの状態から少なくとも15ニューロンのシナプス数(図2)をカウントする涙点アナライザを使用してACMのsynaptogenic効果を定量化する。このサイズのサンプルでは、私たちは、ニューロンごとのシナプスの平均数を計算し、空のベクター(図3、灰色のバー)を発現しているACM処理したニューロンによって形成されたシナプスの統計学的に有意な、〜10倍の増加を見つけることができます。さらに、我々は、ACM誘発シナプス形成(〜20倍。図3、黒いバー)の大幅な増強にα2δ- 1のリード線の過剰発現を示す。
培養神経細胞に加えて、我々はこの手法を用いて、異なる脳領域でシナプス密度を定量することができる。上丘は網膜7,8,9でRGCsから発信された、retinocollicular予測を受け取る脳の構造です。生後発達にわたり、上丘での彼らの標的にRGCsによって形成される興奮性シナプスの数が飛躍的にP7からP21 7,8,9に増加する。
私達の定量化技術を使用して、我々はretinocollicularのシナプスの数は、P7からP14への上丘の増加に形成されたことを示している。これを行うには、我々は、P7でシナプス密度を定量化し、再びP14で。我々は、PSD - 95(シナプス後)用とVGlut2(上丘のRGCシナプスに特異的シナプス前のマーカー)のための上丘を染色。上丘の外側のシナプス領域を画像化した(図4A)と共局在VGlut2/PSD-95シナプスは、動物ごとに少なくとも3つのセクションから、時間の点につき少なくとも3匹の動物から(図4B、4C)定量した。得られたデータの定量化は、明らかにP7とP14の間のシナプスの数が3以上倍に有意な増加を示しています。これらの結果は、電子顕微鏡(図4D)9を利用して以前に発表された調査結果と一致している。
結論として、我々はここで説明するシナプス数の定量化の方法は、私たちは、in vitroまたは in vivoでのシナプス形成を操作の効果を研究できるように、文化や神経組織におけるシナプス数と密度を決定する便利なツールです。
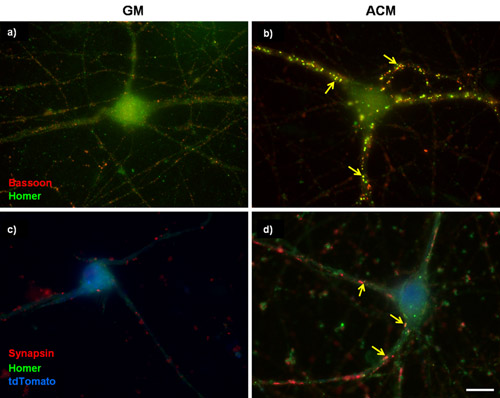
図1:RGCsを精製における代表的なシナプス染色。 試験管内 (DIV)RGCs で (とB)3日間は、さらに6日間(B)プロsynaptogenicマウスアストロサイト馴化培地(ACM)(A)基礎増殖培地(GM)にまたはのいずれかで培養した。次に、細胞をファゴット(赤、シナプス前)とホーマー(緑、シナプス後)のために標識した。マウスACMは強く共局在ファゴットとホームラン涙点の数の増加によって決定されるようRGCs間のシナプス形成を刺激する。 (CとD)5DIV RGCsはα2δ- 1カルシウムチャネルサブユニットを過剰発現するプラスミドでトランスフェクションした。トランスフェクションされた細胞は、tdTomatoのセルの塗りつぶし(青色)で同定し、シナプス前のマーカーシナプシン及び後シナプスマーカーのホームランのために染色されています。矢印はシナプスを示している。スケールバーは20μmを表す。
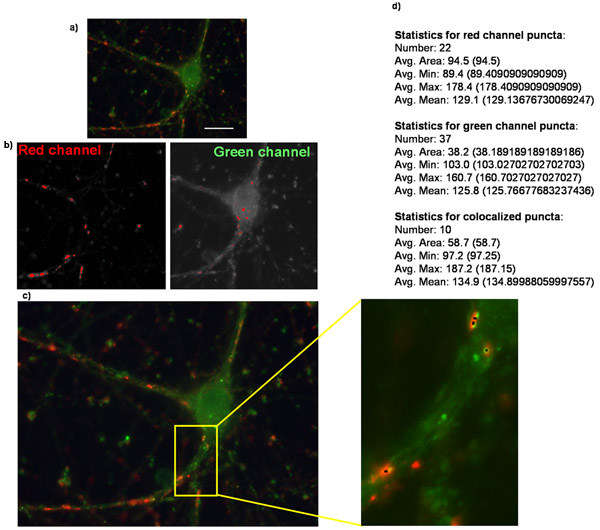
図2:涙点アナライザを使用して、シナプス数の定量化は、ここに示す精製された網膜神経節細胞の過剰発現の(a)はオリジナルのイメージトロンボスポンジンの受容体α2δ- 1の例であり、シナプス前のマーカーシナプシン及び後シナプスマーカーのホームランのために染色される。涙点アナライザで涙点を分析する際に、各チャンネルで作成したマスクに対応する(b)の画像。 (C)涙点Analzyerは、このような小さな黒い点(挿入図)で示されている涙点でここに示すような画像を作成します。また翔WNは、他のいくつかのパラメータと一緒に涙点の数がテキスト/数値形式(強調のために追加された太字)で提供されているアプリケーションの(d)の数値が出力されます。
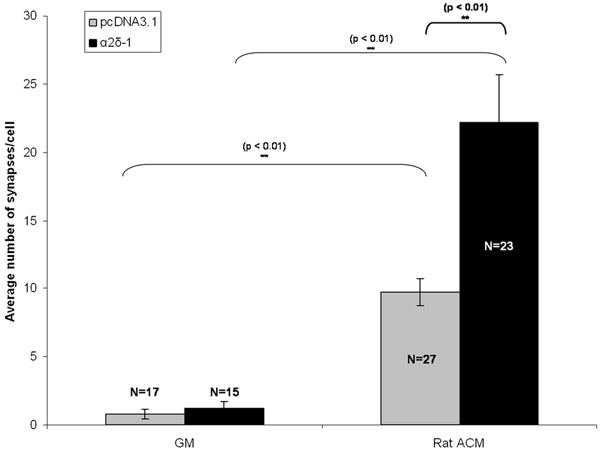
図3:。シナプスのアッセイのための代表的な結果はここに示されているのは空のベクトル(したpcDNA3.1、灰色のバー)やトロンボスポンジンの受容体α2δ- 1のいずれかを発現するトランスフェRGCsにおけるアストロサイト馴化培地(ACM)とRGCsの慢性治療のsynaptogenic効果です。 。エラーバーはSEMを示す。 GM =の増殖培地。 ACM =(ラット)アストロサイトContitionedメディア。
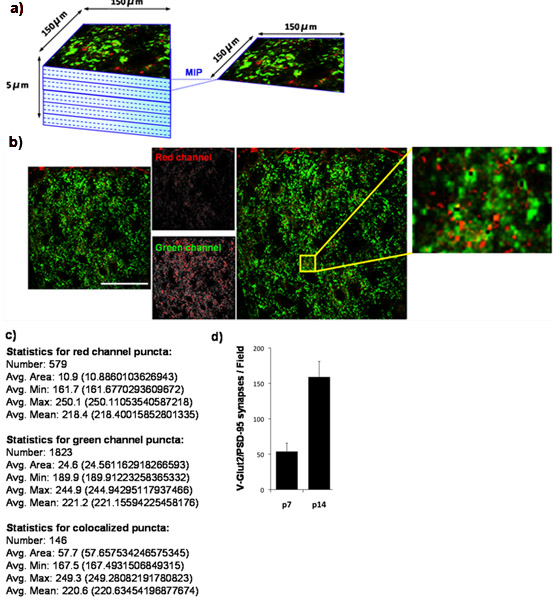
図4:マウス上丘におけるシナプス密度の定量化は、(a)齧歯類の脳における優れたcollicularのターゲット上にRGCsによって設立されたグルタミン酸作動性シナプスの数の発達的変化を決定するために、我々はシナプスに対する抗体でマウス脳から凍結切片を染色したマーカーVGlut2(緑色)と後シナプスマーカー、PSD - 95、(赤)。我々は、共焦点顕微鏡を走査型レーザーを使用してRGCsためのシナプス標的領域に対応するマウス上丘(SC)の外側の150 ×150μmの領域を撮像。各SCのセクションのためのZスタックは、5μm(15 × 0.33μmの光セクション)の合計の深さのために収集された。最大画像の投影(MIPは)5 MIPS /セクションをもたらす3つの連続光学切片のグループ用に生成された深さ1ミクロンを表す。次に示すのは、P14 WTマウスの上丘から採取した代表的なMIPです。前シナプスマーカー、VGlut2は、緑色で示されており、シナプスマーカー、PSD - 95は、赤色で表示されます。 (c)の数値出力は、涙点アナライザによって生成。時点ごとに3匹の動物(エラーバーはSEMを表す)を持つ動物ごとに少なくとも3つのセクションのためのシナプス数の分析の(d)の定量。スケールバーは50μmを表す。
ディスカッション
上記のシナプスのアッセイは、我々の実験の目標、ここで我々は文化を精製や脳のセクションのいずれかで、大きくRGCsの興奮性の予測に焦点を当てるのコンテキストに基づいています。私たちは、興奮性シナプスを(表1)のラベルにうまく参照テーブルのリストの抗体を提供している。
このシナプスのアッセイは、任意の神経集団または選択的なプリと後シナプスマー...
開示事項
謝辞
ベンA.バレス(スタンフォード大学)の研究室で:涙点アナライザプラグインは、イメージのためにJはバリーウォーク(Physionコンサルティング現在のアドレス)によって書かれました。
資金調達;
- アルフレッドP.スローン財団
- エスターA.とジョセフKlingensteinファンド投資法人
- 広範な生物医学研究財団
- ハンチントン病のイニシアティブのために治す
資料
| Name | Company | Catalog Number | Comments | |||||
| 抗原 | 種 | ポリクローナル/モノクローナル | ベンダ | カタログ番号 | 希釈 | 文化の作品 | セクションの作品 | |
| シナプス前の | シナプシン | ウサギ | ポリクローナル | シナプスシステム | 106004 | 1:750 | Y | ND |
| シナプシン | マウス | モノクローナル | シナプスシステム | 106001 | 1:500 | Y | Y | |
| ファゴット | マウス | モノクローナル | アッセイデザイン | VAM - PS003F | 1:500 | Y | Y | |
| ファゴット | モルモット | ポリクローナル | シナプスシステム | 141004 | 1:1000 | Y | ND | |
| シナプトタグミン1 | ウサギ | ポリクローナル | シナプスシステム | 105002 | 1:750 | Y | N | |
| シナプトブレビン2 (C1.69.1) | マウス | モノクローナル | シナプスシステム | 104211 | 1:500 | Y | Y | |
| シナプトフィジン (C1.7.2) | マウス | モノクローナル | シナプスシステム | 101011 | 1:500 | Y | Y | |
| VGlut1 | マウス | モノクローナル | ミリポア | MAB5502 | 1:2500 | N | Y | |
| VGlut1 | モルモット | ポリクローナル | ミリポア | AB5905 | 1:2500 | N | Y | |
| VGlut2 | モルモット | ポリクローナル | ミリポア | AB2251 | 1:2500 | N | Y | |
| シナプス後の | PSD - 95 (6G6 - 1C9クローン) | マウス | モノクローナル | 親和性バイオ試薬 | MA1 - 045 | 1:750 | Y | N |
| PSD - 95 | ウサギ | ポリクローナル | ZYMED | 51から6900 | 1:500 | N | Y | |
| ホーマー | マウス | モノクローナル | シナプスシステム | 160011 | 1:500 | Y | ND | |
| ホーマー | ラット | ポリクローナル | ミリポア | AB5875 | 1:500 | Y | Y | |
| Gephyrin | ウサギ | ポリクローナル | シナプスシステム | 147003 | 1:500 | Y | Y | |
| Gephyrin | マウス | モノクローナル | シナプスシステム | 147 | 1:200 | Y | Y |
表1:我々は成功私たちのシナプスのアッセイで使用されていることを良いプリとシナプス後のマーカーのリストの例。これはすべての利用可能なマーカーの網羅的なリストではないことに注意してください。 Y =はい、N =いいえ、ND =データなし。
| 試薬 | 会社 | ネコ。いいえ |
| PBS | インビトロジェン | 20012-027 |
| ポリ- D -リジン | シグマ | P6407 |
| ラミニン | Cultrex | 3400-010-01 |
| トリトンX - 100 | ロシュダイアグノスティック徳国 | 9002-93-1 |
| 正常ヤギ血清 | ギブコ | 16210 |
| DAPIとVectaShield | ベクターラボラトリーズ | H - 1200 |
| OCT | 組織 - Tek社 | 4583 |
| トリス-ベース(50 mM)を | フィッシャー | BP152 - 5 |
| ウシ血清アルブミン | シグマ | A2153 |
| L -リジン | シグマ | L - 1137 |
| 16パーセントPFAのソリューション | 電子顕微鏡学 | 15711 |
| 粒状のPFA | 電子顕微鏡学 | 19210 |
| 24ウェル培養プレート | ファルコン | 35から3047 |
| ヤギ抗マウスアレクサ標識抗体 | インビトロジェン | --- |
| サプライ | 会社 | ネコ。いいえ |
| 12mmの0号ガラスのカバースリップ | カールヘクト徳国 | 1105209 |
| 第1.5ガラスカバースリップ(スライス用) | VWRサイエンティフィック | 48393241 |
| スライドガラス | VWRサイエンティフィック | 48311-703 |
参考文献
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Y. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1, 791-803 (1988).
- Meyer-Franke, A., Kaplan, M. R., Pfrieger, F. W., Barres, B. A. Characterization of the signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron. 15, 805-819 (1995).
- Eroglu, C. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 139, 380-392 (2009).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 .
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinocollicular projections in the mouse. J. Comp. Neurol. 230, 552-575 (1985).
- Schmidt, J. T. Formation of retinotopic connections: selective stabilization by an activity-dependent mechanism. Cell. Mol. Neurobiol. 5, 65-84 (1985).
- Sachs, G. M., Jacobson, M., Caviness, V. S. Postnatal changes in arborization patterns of murine retinocollicular axons. J. Comp. Neurol. 246, 395-408 (1986).
- Elmariah, S. B., Oh, E. J., Hughes, E. G., Balice-Gordon, R. J. Astrocytes regulate inhibitory synapse formation via Trk-mediated modulation of postsynaptic GABAA receptors. J. Neurosci. 25, 3638-3650 (2005).
- Hughes, E. G., Elmariah, S. B., Balice-Gordon, R. J. Astrocyte secreted proteins selectively increase hippocampal GABAergic length, branching and synaptogenesis. Moll. Cell. Neurosci. 43, 136-145 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved