É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Sinapses quantificar: um ensaio baseado em Imunocitoquímica para a quantificação do número Synapse
Neste Artigo
Resumo
Este protocolo detalhes como quantificar o número sinapse neuronal tanto na cultura dissociada e nas seções do cérebro utilizando imunocitoquímica. Usando compartimento de anticorpos específicos, nós rótulo terminais pré-sinápticos, bem como sites de especialização pós-sináptica. Nós definimos sinapses como pontos de co-localização entre os sinais gerados por estes marcadores.
Resumo
Um dos objetivos mais importantes da neurociência é entender os sinais moleculares que instruem estágios iniciais da formação de sinapses. Como tal, tornou-se imperativo para desenvolver abordagens objetivo de quantificar alterações na conectividade sináptica. A partir de fixação da amostra, este protocolo detalhes como quantificar o número sinapse neuronal tanto na cultura dissociada e nas seções do cérebro utilizando imunocitoquímica. Usando compartimento de anticorpos específicos, nós rótulo terminais pré-sinápticos, bem como sites de especialização pós-sináptica. Nós definimos sinapses como pontos de co-localização entre os sinais gerados por estes marcadores. O número dessas colocalizations é quantificado através de um plug in puncta Analyzer (escrito por Bary Wark, disponível mediante solicitação, c.eroglu cellbio.duke.edu @), sob a plataforma de software de análise de ImageJ. O ensaio sinapse descritos neste protocolo pode ser aplicado a qualquer preparação de tecidos e cultura neural para o qual você tem seletiva marcadores pré-e pós-sináptica. Este ensaio sinapse é uma ferramenta valiosa que pode ser amplamente utilizada no estudo do desenvolvimento sináptica.
Protocolo
Soluções de Preparo:
- Tampão de anticorpos:
- 150 mM NaCl
- 50 mM Tris-Base (Fisher, Cat No:. BP152-5, 50 mM) - 1,21 g
- 1% BSA (Sigma, Cat No:. A2153, 1%) - 2,0 g
- 100 mM L-lisina (Sigma, Cat No:. L-1137, 100 mM) - 3,65 g
- Ajustar o pH para 7,4
- Azida 0,04%
- Ajustar o volume para 200 ml com água destilada H 2 O.
- Filtrar através 0.22μm filtro (Millipore, Cat No:. SCGPU02RE).
- PFA diluente:
- 168 ml 0,5 M Na 2 HPO 4 (dibásico)
- 72 ml 0,5 M Na 2 HPO 4 (monossódico)
- 660 ml H 2 O destilada
- 4% fixador PFA para os neurônios cultivados (solução # 2):
- 10 ml de solução 16% PFA (Microscopia Eletrônica de Ciências, Cat No:. 15711)
- 30 ml PFA 4% diluente (solução 2)
- PFA 4% em PBS:
- 4 g PFA (Electron Microscropy Ciências, Cat No:. 19210)
- 100 ml de PBS (Invitrogen, Cat. No:. 20.012-027)
- Calor a 40 ° C, agitar durante a noite.
- Filtrar com um filtro 0.22μm (Millipore, Cat No:. SCGPU02RE)
- Tampão de bloqueio (volume total (de 24 poços da placa) = (# lamínulas +1) x 200μl)
- Buffer de anticorpos 50% (solução # 1)
- Soro de cabra 50% Normal (Gibco, Cat No:. 16210)
- 0,2% Triton X-100 (Roche Diagnostics Gmbh, Cat No:. 9002-93-1)
- 30% de sacarose em PBS
- 30 g de sacarose (Biomedicals MP, Inc., Cat No:. 821713)
- 70 ml de PBS (Invitrogen, Cat. No:. 20.012-027)
- Misture com uma stirbar até sacarose é em solução.
- Trazer o volume até 100ml com PBS
- Filtrar através de um filtro de 0,22 mM (Millipore, Cat No:. SCGPU02RE)
Preparação das Culturas Neuronal:
O protocolo aqui descrito é aplicável a qualquer culturas primárias de neurônios cultivados em 12 milímetros lamínulas de vidro (Karl Hecht, No. O, Cat No:. 99010) em placas de 24 poços (Falcon, 35-3047). Por exemplo, em nosso laboratório de cultura de ratos células ganglionares da retina (RGCs) purificada da retina de ratos colhidos P5-7 1,2 animais. As células são cultivadas em lamínulas de vidro revestidas com poli-d-lisina (Sigma, Cat No:. P6407) (. Cultrex, Cat No: 3400-010-01) e laminina mouse. Nós utilizamos esta preparação cultura em um par de formas diferentes para o nosso ensaio de sinapse. Uma manipulação que fazemos envolve RGCs cultura ou na presença ou ausência de fatores secretados astrócito-synaptogenic. Alternativamente, nós também empregam essas condições de tratamento diferentes em experimentos onde RGCs foram transfectados para superexpressão uma proteína de interesse. Neste último caso, nós co-transfecção as células com uma etiqueta de células (por exemplo, ou GFP tdTomato). Essas diferentes abordagens experimentais afetam o modo como se realiza a alguns passos de um ensaio de sinapse, que esclarecemos abaixo.
1. Fixação Dissociated RGCs purificada
- Remover meios de cultura dos poços RGC contendo e adicionar 500 mL (para uma placa de 24 poços) paraformaldeído a 4% (PFA) pré-aquecido a 37 ° C a cada poço. Permitir que as células correção para 7 minutos em temperatura ambiente.
- Fixação seguintes células lavar 3 vezes com tampão fosfato (PBS) (Invitrogen, Cat. No:. 20.012-027). IMPORTANTE: Células nunca deve ser deixado sem líquido nos poços, uma vez que um buffer é removido de um bem que deve ser prontamente substituído pelo próximo buffer. Neste ponto, as células estão prontos para a imunocoloração.
2. Bloqueio inespecíficas Sítios de Ligação no RGCs
- Prepare tampão de bloqueio contendo 50% de soro normal de cabra (NGS, Gibco, Cat No:. 16210) e 0,2% Triton X-100 (Roche Diagnostics Gmbh, Cat No:. 9002-93-1). Depois de retirar PBS de cada bem, adicionar 200 l do tampão de bloqueio para cada poço e bloquear por 30 minutos em temperatura ambiente.
- Remover tampão de bloqueio e enxaguar três vezes com PBS.
3. Aplicação de solução anticorpo primário
- IMPORTANTE: Tenha certeza de escolher anticorpos primários marcadores para o seu pré e pós-sináptico que são obtidos de diferentes espécies.
- Prepare uma diluição do anticorpo primário em tampão de anticorpos de 90%, 10% de solução NGS contendo o par de anticorpos pré e pós-sinápticos de sua escolha. Por exemplo coelho anti-synapsin (marcador de pré-sináptica) (1:750, domínio citosólico, Sistemas Synaptic) e mouse anti-Homer (marcador de pós-sináptica) (1:500, mouse, Sistemas Synaptic). IMPORTANTE: Centrífuga diluição do anticorpo primário por 5 minutos na velocidade máxima em uma centrífuga de bancada para remover qualquer anticorpo precipitados.
- Adicionar 200 mL de solução de anticorpo primário para cada poço.
- Incubar overnight a 4 ° C. A placa deve ser colocada em um recipiente maior, que é umidificado para evitar a secagem da solução primária. Point Break: As células podem permanecer na mistura de anticorpos primários para até 3 dias antes de continuar com o protocolo.
- No dia seguinte, retire o anticorpo primário de cada poço e lavar os poços 3 vezes com PBS.
4. Aplicação de solução de anticorpos secundários
- Prepare uma solução de anticorpo secundário contendo seus anticorpos secundários diluído 1:1000 em tampão contendo anticorpo NGS 10%. IMPORTANTE: Centrífuga diluição do anticorpo secundário durante 5 minutos à velocidade máxima em uma centrífuga de bancada para remover anticorpos precipitados. Pular este passo resulta em segundo plano elevados de anticorpos secundários.
Células Untransfected: Na ausência de um rótulo de células, use Alexa-594-488 e Alexa secundários conjugados para a rotulagem marcadores pré e pós-sinápticos, respectivamente. Por exemplo, usamos de cabra anti-coelho Alexa594 para rotular o anticorpo anti-sinapsina e cabra anti-rato-488 Alexa secundário conjugado com o rótulo de anticorpos anti-homer. IMPORTANTE: Use Alexa-488 secundários conjugados de anticorpos primários com sinal mais fraco.
Células transfectadas: Escolha anticorpos secundários, que podem acomodar o espectro de emissão de excitação de sua etiqueta de células fluorescentes. Por exemplo, quando nós rotulamos células transfectadas com tdTomato usamos Alexa-647 conjugada de cabra anti-coelho para reconhecer o anticorpo anti-sinapsina e Alexa-488 de cabra conjugado anti-rato de reconhecer o anticorpo anti-homer. Além disso, o uso de NGS neste protocolo é resultado de nossa escolha de anticorpos secundários produzidos em cabra. - Adicionar 200 mL de solução de anticorpo secundário para cada poço.
- Após incubação por duas horas à temperatura ambiente num local escuro, lavar 3 a 4 vezes com PBS.
5. Lamelas de montagem
- Lamínulas montagem em Vectashield meio de montagem com DAPI (Vector Laboratories Inc., Cat No:. H-1200) em lâminas de vidro (VWR científica, Cat No:. 48.311-703).
- Aplicar suavemente unha polonês clara em torno das bordas da lamínula e deixar secar por pelo menos 30 minutos em um local seco e escuro. IMPORTANTE: Evite empurrando ou movendo as lamelas durante a aplicação da unha polonês já que isso resultará em sheering das células.
6. Imagem
Para geração de imagens, um microscópio de fluorescência equipado com uma câmera capaz de tirar fotos em 4 canais diferentes é necessário ser capaz de imagem ambos os marcadores sinápticos, o seu celular e núcleos de preenchimento (DAPI / opcional). As células devem ser fotografada usando um óleo objetivo 63x de imersão. Nós imagem usando o microscópio Zeiss de fluorescência AxioImager com a Zeiss DIC Oil Plano Apochromat-63x/1.4 ∞ / 0,17 objetiva.
- Selecione as células que são pelo menos dois diâmetros celulares longe de seus vizinhos mais próximos. Para evitar viés e garantir a aleatoriedade da seleção de célula se visualizar células untransfected, selecione as células do canal DAPI, em seguida, tomar imagens em todos os canais. Se visualizar células transfectadas selecionar células no canal correspondente à etiqueta fluorescente para identificar células transfectadas (por exemplo, tdTomato).
- Adquirir as imagens:
Células Untransfected: Para cada célula selecionada, obter 8 imagens bit na GFP e canais Texas Vermelho. A imagem sobreposta pseudocolored deve ter seus marcadores pré-e pós-sinápticos em vermelho e verde, respectivamente.
Células transfectadas: Para cada célula selecionada obter 8 imagens pouco no GFP, Texas Red e Cy5 (ou Cy5.5) canais. A imagem sobreposta pseudocolored deve ter seus marcadores pré-e pós-sinápticos em vermelho e verde, respectivamente. Cor pseudo seu celular preencher azul.
7. Análise de imagem e Co-localizada Quantificação puncta
- Usamos puncta programa Analyzer para a quantificação co-localizada puncta sináptica. Puncta plug-in é Analyzer escrito por Bary Wark, e está disponível mediante pedido (c.eroglu cellbio.duke.edu @). Puncta Analyzer é executado em ImageJ 1.26 (http://rsbweb.nih.gov/ij/, versões mais recentes do ImageJ não pode executar o aplicativo). Para instalar puncta Analyzer basta colocar a pasta de aplicativos baixados na pasta "Plugins" no diretório de 1,26 ImageJ.
- Abra uma das suas imagens usando ImageJ. Use uma das ferramentas de seleção na ImageJ menu para determinar a região de interesse (ROI). Nós regularmente use a ferramenta de seleção circular para selecionar uma região de aproximadamente uma célula de diâmetro radialmente em torno da soma de interesse.
- Com sua região de interesse (ROI) selecionada, vá ao menu plugins e selecione "puncta Analyzer".
- Na "Análise de Opções" janela que aparece, selecione "Channel Red", "Canal Verde", o "Background Subtrair" primeiro e "Set arquivo de resultados ...." Clique em "OK". Você será solicitado a definir um local para salvar seus resultados dentro Estes resultados podem ser exportados para Excel para análise posterior.
- Na janela que aparece ao lado, certifique-se de um raio de bola rolando de 50 está selecionada e desmarque a opção "Fundo Branco" opção (esta modificação não é necessária, mas é muitas vezes preferido pelos usuários do aplicativo para facilitar a visualização). Clique em "OK".
- Uma nova janela irá aparecer ao lado de uma máscara correspondente com a sua imagem de canal vermelho. Ajustar o limite até sentir que a máscara vermelha corresponde da melhor forma possível como puncta discreta muitos individuais sem a introdução de muito barulho. Este é um dos passos mais subjetiva deste protocolo, por isso tome cuidado para desenvolver uma abordagem consistente. Clique em "Done". Definir o tamanho mínimo para puncta 4 pixels e modificar mais nada. Clique em "OK".
- Repita o passo anterior, desta vez para o canal verde.
- Depois de concluir o passo anterior, o plugin irá fornecer quantificação correspondente a puncta em cada canal separadamente e puncta colocalized entre os dois canais.
SEÇÕES DO CÉREBRO:
O ensaio sinapse pode ser aplicado a criosecções do cérebro, e em qualquer tecido do sistema nervoso outros (como medula espinhal ou retina), desde que há um par marcador adequado pré e pós-sináptico (com anticorpos que funcionam bem em seções) que pode ser utilizados para identificar as sinapses você deseja quantificar. O ensaio sinapse pode revelar a regulação temporal da formação de sinapses em uma dada região do cérebro e pode quantificar os efeitos da conectividade sináptica em animais transgênicos ou em uma amostra que foi manipulada de alguma forma outras.
1. Colheita tecido cerebral de ratos
Todos os procedimentos animal deve ser feito em concordância com os protocolos animais IACUC.
- Euthanize ratos por exsangüinação e perfusão com PBS. Perfusão com PBS é crucial para a remoção do sangue e reduzirá sinal de fundo para os procedimentos de coloração. IMPORTANTE: Não perfundir com fixadores, como PFA 4%. Isto irá afetar negativamente os resultados da coloração.
2. Fixação
- Corrigir o cérebro inteiro em PFA 4% em PBS a 4 ° C durante a noite. No dia seguinte, lave o cérebro 3 vezes com PBS.
- Cryoprotect o cérebro, colocando-os em sacarose 30% em PBS. O tecido será inicialmente float. Manter a 4 ° C até o tecido se deposita no fundo. Nessa fase, o crioproteção está completa.
3. Incorporação / Cryosectioning
- Incorporar cérebros na orientação desejada para o corte (por exemplo, sagital ou coronal) em uma solução 2:1 de sacarose 30%: (. Tissue-Tek, Cat n º: 4583) outubro na PBS. Congelar o cérebro incorporado em uma superfície plana de gelo seco. Cérebros congelados embutidos podem ser colocados em sacos de congelação e mantidos à temperatura de -80 até um ano antes do corte.
- Cryosection o tecido em 12-16μm seções e montagem em lâminas de vidro (Sigma, Cat No:. S4651). Lâminas podem ser armazenadas até uma semana a -80 ° C antes da coloração.
- Slides para serem coradas devem ser secas a 37 ° C por 30 minutos e lavadas com PBS 1x para remover outubro residual.
4. Seções bloqueio
- Bloco seções em 20% do normal de cabra soro (NGS) em PBS durante uma hora a temperatura ambiente. IMPORTANTE: Não incluem Triton X-100 nesta fase. Antes da adição da solução de bloqueio, você pode criar uma barreira hidrofóbica em torno das secções no slide usando um Pen PAP Elite (DBS, Cat No:. K039)
5. Aplicando Anticorpos Primários
- Diluir sua anticorpos primários em PBS com Triton 0,3% e 10% NGS.
- Em seções do cérebro que usamos PSD-95 (Zymed, coelho, 1:500) para rotular glutamatérgica compartimentos pós-sináptico e VGlut1 ou VGlut2 (Chemicon, cobaia, 1:2.500) para rotular glutamatérgica terminais pré-sinápticos. Centrífuga diluição do anticorpo primário por 5 minutos na velocidade máxima em uma centrífuga de bancada para remover anticorpos precipitados se presente.
- Seções incubar em solução de anticorpo primário para 36-60 horas a 4 ° C.
6. Aplicação de anticorpos secundários
- Lavar o anticorpo primário off por imersão das lâminas de 3x em PBS por 15 minutos cada. Após esta etapa não se esqueça de proteger os seus slides da luz direta.
- Diluiranticorpos secundários com uma diluição de 1:200 no mesmo tampão, como descrito para os anticorpos primários. Por exemplo, para VGlut/PSD95 coloração usamos cabra anti cobaia Alexa 488 (Vglut) e de cabra anti-coelho Alexa 594 (PSD-95) (Invitrogen).
- Incubar seções em solução de anticorpo secundário por 2 horas em temperatura ambiente no escuro.
- Lavar os anticorpos não ligados secundário fora do slides por imersão das lâminas de 4x em PBS por 15 minutos cada.
7. Montagem
- Adicionar pequenas gotas de Vectashield meio de montagem com DAPI (Vector Laboratories Inc.) em lâminas de vidro (VWR científica) e em seguida, cobrir as lâminas com lamínulas (VWR Scientific, n º 1.5, 48393 241). Aplique unha polonês para inibir o movimento de as lamelas.
8. Imagem
IMPORTANTE: Um microscópio confocal com pelo menos 3 canais é necessário para a imagem aqui descrita. Nós imagem em um microscópio Leica SP5 laser de varredura confocal usando uma objetiva de imersão 63x de petróleo.
- Regiões do cérebro Synaptic de interesse devem ser selecionados para a digitalização de forma consistente entre as seções. Por exemplo, no nosso ensaio sinapse das sinapses das células ganglionares da retina em neurônios coliculares superior, temos a imagem da região coliculares exterior superiores ao lado do colículo inferior, que abrange a camada que recebe os terminais sinápticos retinocollicular 7,8,9. Nós imagem e quantificar as sinapses na parte superior 150 mM zona sináptica do colículo superior, onde RGCs são conhecidos para estabelecer contatos sinápticos 9.
- Para cada seção, em ambos os canais 488 e 594, que imagem seriados óptica em 0,33 mM intervalos mais uma profundidade total de 5 mm para um total de 15 seções ópticas. Pelo menos 3 seções de cada animal deve ser trabalhada e pelo menos 3 animais devem ser incluídos a partir de uma determinada condição experimental.
- Projeções intensidade máxima (MIP) são gerados a partir de grupos de 3 seções consecutivas rendendo 5 MIPs representando 1 Hm de profundidade cada. Estes preços mínimos são quantificados.
9. Quantificação de imagem
- Pode ser realizada exatamente como descrito para RGCs, no entanto a forma eo tamanho do ROI irá mudar em função do qual a região das imagens que você deseja quantificar.
Chaves para o Sucesso:
RGCs purificada:
- Antes de fixar RGCs purificada (ou cultura dissociada outros) certifique-se para pré-aquecer PFA 4%, em banho-maria regulado a 37 ° C para ~ 20-25 minutos (loja a 4 ° C em todas as outras, não use diluições PFA idade superior a 7 dias).
- Especialmente para os neurônios cultivados, é aconselhável não usar um aspirador a vácuo durante a lavagem para todos os passos enxágüe. Métodos mais suaves como o uso de uma pipeta Pasteur e uma bomba de sucção melhorar sensivelmente a qualidade de sua coloração.
- Tome cuidado para não deixar que suas células secar durante o enxágüe passos.
- Evite cutucando ou movendo o lamínulas durante a aplicação da unha polonês como fazer isso pode resultar em ruptura das células no seu lamela.
- Spin para baixo todos os anticorpos primário e secundário para eliminar quaisquer anticorpos precipitados que terá um impacto negativo coloração.
- Certifique-se de selecionar anticorpos primários para o seu marcadores pré-e pós-sinápticos levantadas em diferentes espécies. Não fazer isso irá eliminar a sua capacidade de discriminar entre os dois sinais após a aplicação de anticorpos secundários.
Seções cérebro:
- Não perfundir seu camundongos com fixadores, como PFA.
- Não incluem Triton-X 100 em sua solução de bloqueio para seções cérebro. Se o fizer, prejudica a qualidade de coloração para os marcadores pré-sináptica, particularmente marcadores pré-sináptica que estão associados com vesículas sinápticas.
- Uso de um microscópio confocal para geração de imagens é necessário para a aquisição da imagem que é de qualidade suficiente para realizar uma análise sinapse.
Resultados representativos:
O ensaio sinapse descrito acima é projetado para capturar mudanças na conectividade sináptica in vitro e in vivo. Em nosso laboratório, utilizamos o ensaio de sinapse para determinar o efeito de qualquer moléculas individuais ou múltiplos astrócito-secretado na formação de sinapses. Que comumente realizar este ensaio em sinapse RGCs purificada que a cultura in vitro.
Um efeito bem descrita de aplicação crônica de astrócitos condicionado media (ACM), em culturas puras RGC é um aumento de várias vezes no número de sinapses que se formam entre RGCs 3,4,5,6. Figura 1A e 1B mostram imagens representativas de untransfected RGCs purificada tratadas com meio de cultura basal ou com ACM. Após a coloração para excitatórios marcadores pré-e pós-sinápticos, o aumento ACM-induzida em sformação ynapse é qualitativamente evidente (Figura 1A, 1B). De fato, essa constatação foi corroborada por vários estudos que têm utilizado eletrofisiologia para mostrar que ACM induzida por microscopia de sinapses são funcionais e eletrônica para mostrar que as sinapses são ultra-estruturalmente normais 3,4,6. Outros trabalhos em nosso laboratório identificou a subunidade dos canais de cálcio α2δ-1 como o receptor neuronal para uma molécula fortemente synaptogenic astrócito-secretado, trombospondina 3. Aqui incluímos os resultados de um experimento em purificada RGCs que foi realizado para determinar se aumento dos níveis de α2δ-1 aumenta ainda mais a ACM-induzida a formação de sinapses (Figura 3).
RGCs foram cotransfected com um vetor vazio ou com uma codificação construir α2δ-1 com uma construção separada codificação tdTomato após 5 dias in vitro (DIV5). Após o tratamento crônico com um ACM ou GM, RGCs foram fixados e corados em DIV 11. Imunomarcação seguintes marcadores pré-e pós-sinápticos das sinapses excitatórias vemos um aumento qualitativo evidente no número de sinapses em purificada RGCs expressar tanto um vetor vazio (pcDNA3.1) ou α2δ-1 (Fig. 1C, 1D). Nós quantificar o efeito synaptogenic de ACM usando puncta analisador para contar o número sinapse (Fig. 2) por pelo menos 15 neurônios de cada condição. Uma amostra desse tamanho nos permite calcular o número médio de sinapses por neurônio e encontrar um estatisticamente significativo, aumento de ~ 10 vezes em sinapses formadas por ACM tratados com os neurônios que estão expressando um vetor vazio (Fig. 3, barras cinza). Além disso, mostramos que a superexpressão de α2δ-1 leva a uma potencialização significativa da ACM-induzida a formação de sinapses (~ 20 vezes. Fig. 3, barras pretas).
Além de neurônios cultivados, podemos quantificar a densidade sináptica em diferentes regiões do cérebro usando esta técnica. O colículo superior é uma estrutura do cérebro que recebe projeções retinocollicular, provenientes de RGCs na retina 7,8,9. Sobre o desenvolvimento pós-natal, o número de sinapses excitatórias formado por RGCs em seus alvos no colículo superior aumenta drasticamente a partir de P7 a P21 7,8,9.
Usando a nossa técnica de quantificação, que mostram que o número de sinapses retinocollicular formado nos aumentos superiores colículo de P7 a P14. Para fazer isso, nós quantificamos densidade sináptica em P7 e P14 novamente. Nós manchar o colículo superior para PSD-95 (pós-sináptica) e para VGlut2 (marcador de pré-sinápticos específicos para as sinapses RGC no colículo superior). A região externa sináptica do colículo superior foi fotografada (Fig 4A) e co-localizadas VGlut2/PSD-95 sinapses foram quantificados (Fig 4B, 4C) de pelo menos três seções por animal e de pelo menos três animais por ponto de tempo. Quantificação dos dados resultantes demonstra claramente um aumento de três vezes mais significativa no número de sinapses entre P7 e P14. Estes resultados estão de acordo com os resultados publicados anteriormente, utilizando microscopia eletrônica (Fig. 4D) 9.
Em conclusão, o método de quantificação número sinapse aqui descrita é uma ferramenta útil para determinar o número sinapse e densidade na cultura e nos tecidos neurais, que nos permite estudar os efeitos da manipulação de formação de sinapses in vitro ou in vivo.
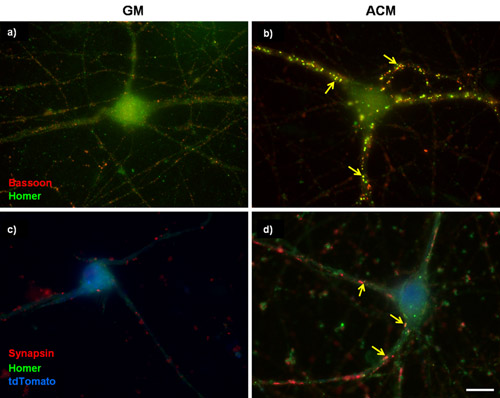
Figura 1: coloração sináptica Representante na RGCs purificada. (A e B) 3 dias in vitro (DIV) RGCs foram cultivados em (A) meios de crescimento basal (GM) ou (B) pro-synaptogenic rato astrócitos media condicionado (ACM) para um adicional de 6 dias. As células foram então marcadas para fagote (pré-sináptica, vermelho) e Homero (pós-sináptico, verde). Rato ACM estimula fortemente a formação de sinapses entre RGCs conforme determinado pelo aumento no número de co-localizada fagote e puncta homer. (C e D) RGCs 5DIV foram transfectadas com um plasmídeo para superexpressão da subunidade de canal de cálcio α2δ-1. Células transfectadas foram identificados com um preenchimento de células tdTomato (azul) e foram coradas para sinapsina marcador pré-sináptico e pós-sinápticos homer marcador. Setas indicam as sinapses. Barra de escala representa 20 mM.
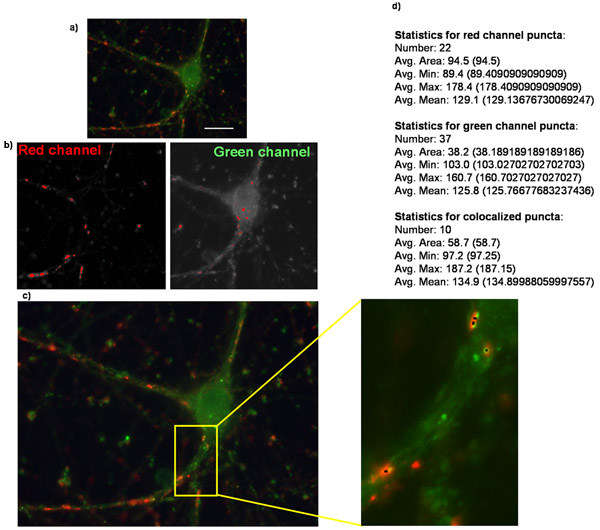
Figura 2:. Quantificação do número de sinapses usando puncta Analyzer Mostrado aqui é um exemplo de (a) uma imagem original de um ganglionares da retina purificada receptor de células com superexpressão do α2δ trombospondina-1 e está manchado de sinapsina marcador pré-sináptico e pós-sinápticos homer marcador. (B) As imagens correspondentes às máscaras criadas em cada canal ao analisar puncta em puncta Analyzer. (C) puncta Analzyer irá criar uma imagem como a mostrada aqui em que puncta são indicadas por pequenos pontos pretos (inset). Também shown é (d) a saída de numérico da aplicação onde puncta número juntamente com vários outros parâmetros são fornecidos em formato textual / numérica (negrito acrescentado para ênfase).
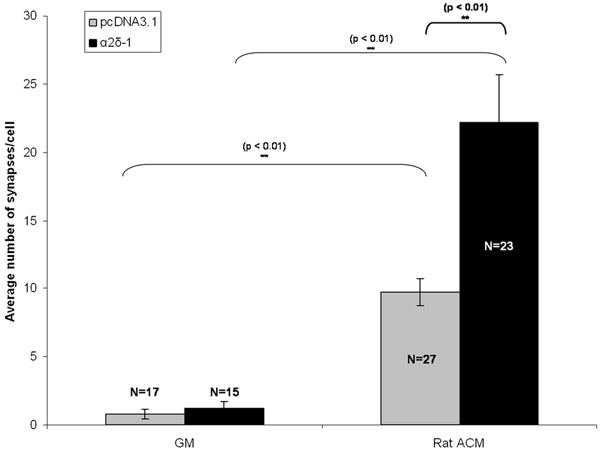
Figura 3:. Resultado Representante para ensaio sinapse Mostrado aqui é o efeito synaptogenic do tratamento crônico da RGCs com astrócitos condicionado media (ACM), em RGCs transfectadas expressar ou vetor vazio (pcDNA3.1, barras cinza) ou o receptor trombospondina α2δ-1 . Barras de erro representam o SEM. Crescimento GM Media =. ACM = (Rat) astrocitária Mídia Contitioned.
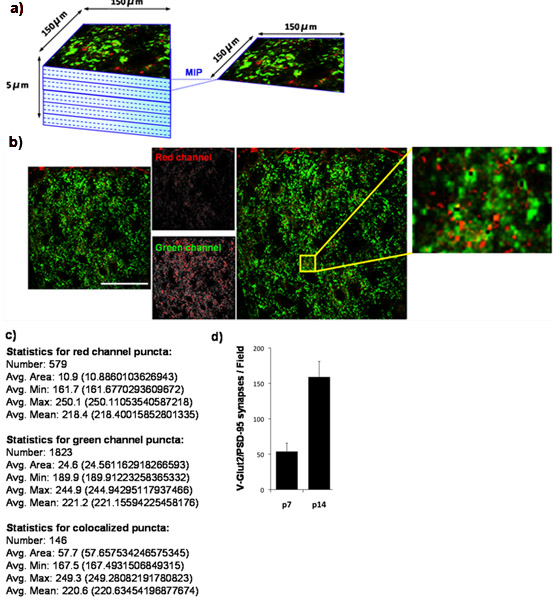
Figura 4:. Quantificação da densidade sináptica no rato superiores colículo (a) Para determinar as mudanças de desenvolvimento no número de sinapses glutamatérgicas estabelecido pelo RGCs sobre seus alvos coliculares superiores no cérebro de roedores, nós manchada criosecções de cérebro de camundongos com anticorpos contra o pré-sináptica VGlut2 marcador (verde) eo marcador pós-sináptica, PSD-95, (vermelho). Nós imaged o exterior 150 x 150 mM região do superior do mouse colículo (SC) correspondente à região alvo synaptic para RGCs usando um microscópio confocal de varredura a laser. A z-stack para cada seção SC foi coletado para uma profundidade total de 5 mm (15 x 0,33 mM secções ópticas). Projeções de imagem máxima (MIP) foram gerados para grupos de 3 consecutivos secções ópticas rendendo 5 MIPs / seção cada um representando 1 mícron de profundidade. Mostrado abaixo é um MIP representativas, extraídas colículo superior de um rato WT P14. O marcador de pré-sináptica, VGlut2, é mostrado em verde eo marcador pós-sináptica, PSD-95, é mostrado em vermelho. (C) saída numérica produzida pelo Analyzer puncta. (D) Quantificação da análise do número de sinapses por pelo menos três seções por animal com três animais por ponto do tempo (barras de erro representam SEM). Barra de escala representa 50 mm.
Discussão
O ensaio sinapse descrito acima é baseado no contexto de nossos objetivos experimental, no qual nos concentramos principalmente em projeções excitatórias do RGCs, seja na cultura ou purificada na seção cérebro. Nós fornecemos uma referência anticorpos tabela listando que funcionam bem para rotulagem sinapses excitatórias (Tabela 1).
Este ensaio sinapse pode ser adaptado para a quantificação do número sinapse de uma população neuronal ou qualquer outro subtipo sináptico para o...
Divulgações
Agradecimentos
Puncta Analyzer Plug-in para o Image J foi escrito por Barry Wark (endereço atual: Consultoria Physion) no laboratório de Ben A. Barres (Stanford University).
Financiamento;
- Alfred P. Sloan Foundation
- O A. Esther e José Klingenstein Fund, Inc.
- Fundação de Pesquisa Biomédica ampla
- Cura para a Iniciativa de Huntington s Disease
Materiais
| Name | Company | Catalog Number | Comments | |||||
| Antígeno | Espécies | Monoclonais / policlonais | Vendedor | Número de catálogo | Diluição | Trabalha em Cultura | Obras nas Seções | |
| Pré-sináptica | Sinapsina | Coelho | Policlonal | Sistemas Synaptic | 106004 | 1:750 | Y | ND |
| Sinapsina | Mouse | Monoclonal | Sistemas Synaptic | 106001 | 1:500 | Y | Y | |
| Fagote | Mouse | Monoclonal | Designs ensaio | VAM-PS003F | 1:500 | Y | Y | |
| Fagote | Cobaia | Policlonal | Sistemas Synaptic | 141004 | 1:1000 | Y | ND | |
| Sinaptotagmina 1 | Coelho | Policlonal | Sistemas Synaptic | 105002 | 1:750 | Y | N | |
| Sinaptobrevina 2 (C1.69.1) | Mouse | Monoclonal | Sistemas Synaptic | 104211 | 1:500 | Y | Y | |
| Sinaptofisina (C1.7.2) | Mouse | Monoclonal | Sistemas Synaptic | 101011 | 1:500 | Y | Y | |
| VGlut1 | Mouse | Monoclonal | Millipore | MAB5502 | 1:2500 | N | Y | |
| VGlut1 | Cobaia | Policlonal | Millipore | AB5905 | 1:2500 | N | Y | |
| VGlut2 | Cobaia | Policlonal | Millipore | AB2251 | 1:2500 | N | Y | |
| Pós-sinápticos | PSD-95 (6G6 1C9-clone) | Mouse | Monoclonal | Afinidade Bio Reagentes | MA1-045 | 1:750 | Y | N |
| PSD-95 | Coelho | Policlonal | Zymed | 51-6900 | 1:500 | N | Y | |
| Pombo-correio | Mouse | Monoclonal | Sistemas Synaptic | 160011 | 1:500 | Y | ND | |
| Pombo-correio | Rato | Policlonal | Millipore | AB5875 | 1:500 | Y | Y | |
| Gephyrin | Coelho | Policlonal | Sistemas Synaptic | 147003 | 1:500 | Y | Y | |
| Gephyrin | Mouse | Monoclonal | Sistemas Synaptic | 147 | 1:200 | Y | Y |
Tabela 1: Lista de exemplos de bons marcadores pré-e pós-sinápticos que temos utilizado com sucesso em nosso ensaio sinapse. Estar ciente de que esta não é uma lista exaustiva de todos os marcadores disponíveis. Y = Sim, N = Não, ND = não determinado.
| Reagente | Companhia | Gato. Não. |
| PBS | Invitrogen | 20012-027 |
| poli-d-lisina | Sigma | P6407 |
| Laminina | Cultrex | 3400-010-01 |
| Triton X-100 | Roche Diagnostics Gmbh | 9002-93-1 |
| Soro normal de cabra | Gibco | 16210 |
| VectaShield com DAPI | Vector Laboratories | H-1200 |
| Outubro | Tissue-Tek | 4583 |
| Tris-Base (50 mM) | Pescador | BP152-5 |
| Albumina de soro bovino | Sigma | A2153 |
| l-lisina | Sigma | L-1137 |
| 16% de solução PFA | Microscopia Eletrônica de Ciências | 15711 |
| PFA granular | Microscopia Eletrônica de Ciências | 19210 |
| 24 poços placa de cultura | Falcão | 35-3047 |
| Anticorpos de cabra anti-camundongo conjugado Alexa | Invitrogen | --- |
| Fornecimento | Companhia | Gato. Não. |
| 12mm, n º 0 lamínulas de vidro | Karl Hecht Gmbh | 1105209 |
| No. 1,5 vidro lamela (para fatias) | VWR Scientific | 48393241 |
| Lâminas de vidro | VWR Scientific | 48311-703 |
Referências
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Y. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1, 791-803 (1988).
- Meyer-Franke, A., Kaplan, M. R., Pfrieger, F. W., Barres, B. A. Characterization of the signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron. 15, 805-819 (1995).
- Eroglu, C. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 139, 380-392 (2009).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 .
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinocollicular projections in the mouse. J. Comp. Neurol. 230, 552-575 (1985).
- Schmidt, J. T. Formation of retinotopic connections: selective stabilization by an activity-dependent mechanism. Cell. Mol. Neurobiol. 5, 65-84 (1985).
- Sachs, G. M., Jacobson, M., Caviness, V. S. Postnatal changes in arborization patterns of murine retinocollicular axons. J. Comp. Neurol. 246, 395-408 (1986).
- Elmariah, S. B., Oh, E. J., Hughes, E. G., Balice-Gordon, R. J. Astrocytes regulate inhibitory synapse formation via Trk-mediated modulation of postsynaptic GABAA receptors. J. Neurosci. 25, 3638-3650 (2005).
- Hughes, E. G., Elmariah, S. B., Balice-Gordon, R. J. Astrocyte secreted proteins selectively increase hippocampal GABAergic length, branching and synaptogenesis. Moll. Cell. Neurosci. 43, 136-145 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados