Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Synapses Quantifier: un dosage à base d'immunocytochimie Quantifier Nombre Synapse
Dans cet article
Résumé
Ce protocole de détails comment quantifier le numéro de synapses neuronales dans la culture à la fois dissociées et dans les sections du cerveau en utilisant l'immunocytochimie. En utilisant des anticorps spécifiques du compartiment, nous appelons les terminaux présynaptiques ainsi que des sites de spécialisation post-synaptiques. Nous définissons les synapses comme des points de colocalisation entre les signaux générés par ces marqueurs.
Résumé
L'un des objectifs les plus importants en neurosciences est de comprendre les signaux moléculaires qui instruisent premiers stades de la formation des synapses. Comme tel, il est devenu impératif de développer des approches pour objectif de quantifier les changements de la connectivité synaptique. A partir de la fixation de l'échantillon, ce protocole décrit comment quantifier le numéro de synapses neuronales dans la culture à la fois dissociées et dans les sections du cerveau en utilisant l'immunocytochimie. En utilisant des anticorps spécifiques du compartiment, nous appelons les terminaux présynaptiques ainsi que des sites de spécialisation post-synaptiques. Nous définissons les synapses comme des points de colocalisation entre les signaux générés par ces marqueurs. Le nombre de ces colocalizations est quantifiée à l'aide d'un bouchon dans puncta Analyzer (écrit par Bary Wark, disponible sur demande, c.eroglu @ cellbio.duke.edu) sous la plateforme logiciel ImageJ analyse. Le dosage de la synapse décrite dans ce protocole peut être appliqué à toute la préparation du tissu neuronal ou d'une culture pour laquelle vous avez sélective des marqueurs pré-et post-synaptiques. Ce test synapse est un outil précieux qui peut être largement utilisée dans l'étude du développement synaptique.
Protocole
Solutions à préparer:
- Tampon d'anticorps:
- 150 mM de NaCl
- 50 mM de Tris-Base (Fisher, Cat No:. BP152-5, 50 mm) - 1,21 g
- 1% (. Sigma, Cat No: A2153, 1%) BSA - 2,0 g
- 100 mM de L-lysine (Sigma, Cat No:. L-1137, 100 mm) - 3,65 g
- Ajuster le pH à 7,4
- Azide 0,04%
- Réglez le volume à 200 ml d'eau distillée H 2 O.
- Filtrer à travers 0.22μm (Millipore, Cat No:. SCGPU02RE).
- PFA Diluant:
- 168 ml à 0,5 M Na 2 HPO 4 (dibasique)
- 72 ml 0,5 M Na 2 HPO 4 (monobasique)
- 660 ml d'eau distillée H 2 O
- 4% fixateur de PFA pour des cultures de neurones (solution n ° 2):
- 10 ml 16% PFA solution (Sciences Electron Microscopy, Cat No:. 15711)
- 30 ml de 4% PFA diluant (solution n ° 2)
- PFA 4% en PBS:
- 4 g PFA (Electron Sciences Microscropy, Cat No:. 19210)
- 100 ml de PBS (Invitrogen, Cat No:. 20012-027)
- Chauffer à 40 ° C, agiter pendant une nuit.
- Filtrer à travers un filtre 0.22μm (Millipore, Cat No:. SCGPU02RE)
- Tampon de blocage (le volume total (pour 24 puits, la plaque) = (# lamelles 1) x 200 pl)
- Anticorps tampon de 50% (solution n ° 1)
- 50% de sérum de chèvre normal (Gibco, Cat No:. 16210)
- 0,2% de Triton X-100 (Roche Diagnostics GmbH, Cat No:. 9002-93-1)
- 30% de saccharose dans du PBS
- 30 g de saccharose (MP Biomedicals, Inc, Cat No:. 821713)
- 70 ml de PBS (Invitrogen, Cat No:. 20012-027)
- Mélanger avec un barreau d'agitation jusqu'à la saccharose est en solution.
- Porter le volume à 100 ml avec du PBS
- Filtrer à travers un 0,22 um (Millipore, réf.: SCGPU02RE) filtre
Préparation des cultures de neurones:
Le protocole décrit ici est applicable à toute les cultures primaires de neurones cultivés sur des lamelles de verre 12 mm (Karl Hecht, n ° O, Cat No:. 99010) dans des plaques 24 puits (Falcon, 35 à 3047). Par exemple, dans notre laboratoire, nous la culture des cellules ganglionnaires de la rétine chez le rat (CGR) purifiée à partir de rétine de rat récolte de P5-7 1,2 animaux. Les cellules sont cultivées sur des lamelles de verre recouvertes de poly-D-lysine (Sigma, Cat No:. P6407) (. Cultrex, Cat No: 3400-010-01) et de la souris laminine. Nous utilisons cette préparation culture dans un couple de différentes manières pour notre test synapse. Une manipulation qui implique que nous effectuons CGR culture soit dans la présence ou l'absence de facteurs sécrétés par les astrocytes synaptogenic. Sinon, nous avons également recours à ces conditions de traitement différentes dans les expériences où CGR ont été transfectées à surexprimer une protéine d'intérêt. Dans ce dernier cas, nous avons co-transfecter les cellules avec une étiquette de cellule (par exemple, la GFP ou tdTomato). Ces différentes approches expérimentales affectent la façon dont on effectue certaines étapes d'un dosage de la synapse, ce qui nous clarifier ci-dessous.
1. Fixation Dissocié CGR purifiée
- Retirez les milieux de culture provenant des puits CJR contenant et ajouter 500 ul (pour une plaque à 24 puits) paraformaldéhyde à 4% (PFA) préchauffé à 37 ° C à chaque puits. Laisser les cellules pour réparer pendant 7 minutes à température ambiante.
- Après fixation des cellules rincer 3 fois avec du tampon phosphate salin (PBS) (Invitrogen, Cat No:. 20012-027). IMPORTANT: Les cellules ne devraient jamais être laissés sans liquide dans le puits, une fois un tampon est retiré d'un puits il devrait être rapidement remplacé par le tampon suivant. À ce stade, les cellules sont prêtes pour immunocoloration.
2. Blocage non spécifique sites de liaison sur l'CGR
- Préparer le tampon de blocage contenant 50% de sérum normal de chèvre (NGS, Gibco, Cat No:. 16210) et 0,2% de Triton X-100 (Roche Diagnostics GmbH, Cat No:. 9002-93-1). Après avoir retiré du PBS dans chaque puits, ajouter 200 ul du tampon de blocage à chaque bien et bloque pendant 30 minutes à température ambiante.
- Retirer le tampon de blocage et rincer 3 fois avec PBS.
3. Appliquer la solution d'anticorps primaire
- IMPORTANT: Veillez à choisir des anticorps primaires pour vos marqueurs pré et post-synaptiques qui sont obtenues à partir de différentes espèces.
- Préparer une dilution des anticorps primaires dans le tampon d'anticorps de 90%, 10% d'une solution contenant du NGS paire d'anticorps pré-et post-synaptiques de votre choix. Pour le lapin par exemple anti-synapsin (marqueur présynaptique) (1:750, domaine cytosolique, Systèmes Synaptic) et de souris anti-Homer (marqueur postsynaptique) (1:500, souris, Systèmes Synaptic). IMPORTANT: Centrifugeuse de dilution d'anticorps primaire pendant 5 minutes à vitesse maximale dans une centrifugeuse de paillasse pour enlever tout anticorps précipité.
- Ajouter 200 ul solution de l'anticorps primaire dans chaque puits.
- Incuber une nuit à 4 ° C. La plaque devrait être placée dans un récipient plus grand qui est humidifié pour éviter le dessèchement de la solution primaire. Point Break: Les cellules peuvent rester dans le mélange d'anticorps primaires jusqu'à 3 jours avant de continuer avec le protocole.
- Le lendemain, retirez anticorps primaire de chaque puits et rincer les puits 3 fois avec du PBS.
4. Appliquer la solution d'anticorps secondaire
- Préparer une solution d'anticorps secondaire contenant votre Anticorps secondaires dilué 1:1000 dans le tampon contenant des anticorps END 10%. IMPORTANT: Centrifugeuse de dilution anticorps secondaire pendant 5 minutes à vitesse maximale dans une centrifugeuse de paillasse pour éliminer l'anticorps précipité. L'omission de cette étape aboutit à fond élevé d'anticorps secondaire.
Cellules non transfectées: En l'absence d'une étiquette de la cellule, utilisez Alexa-594-488 et Alexa secondaires conjugués pour l'étiquetage des marqueurs pré et post-synaptiques, respectivement. Par exemple, nous utilisons de chèvre anti-lapin Alexa594 pour étiqueter les anticorps anti-synapsine et de chèvre anti-souris Alexa-488 secondaire conjugué à l'étiquette de l'anticorps anti-Homère. IMPORTANT: Utiliser Alexa-488 secondaires conjugués d'anticorps primaire avec signal plus faible.
Les cellules transfectées: Choisissez Anticorps secondaires qui accueillent le spectre d'excitation-émission de votre étiquette de cellules fluorescentes. Par exemple, lorsque nous marquons des cellules transfectées avec tdTomato nous utilisons Alexa-647 conjugué anticorps de chèvre anti-lapin de reconnaître l'anticorps anti-synapsine et Alexa-488 conjugué de chèvre anti-souris de reconnaître l'anticorps anti-Homère. En outre, l'utilisation de l'END dans ce protocole est le résultat de notre choix d'anticorps secondaires produites chez la chèvre. - Ajouter 200 ul solution anticorps secondaire dans chaque puits.
- Après une incubation de deux heures à température ambiante dans un endroit sombre, rincer 3 à 4 fois avec du PBS.
5. Lamelles de montage
- Lamelles dans le mont Vectashield milieu de montage avec DAPI (Vector Laboratories Inc, Cat No:. H-1200) sur des lames de verre (VWR Scientific, Cat No:. 48311-703).
- Appliquer délicatement vernis à ongles transparent sur les bords de la lamelle et laisser sécher pendant au moins 30 minutes dans un endroit sec et sombre. IMPORTANT: Éviter poussant ou en déplaçant les lamelles pendant l'application du vernis à ongles car cela aboutirait à la tonte des cellules.
6. Imagerie
Pour l'imagerie, un microscope à fluorescence équipé d'une caméra capable de prendre des photos à 4 canaux différents est nécessaire pour être en mesure de l'image à la fois des marqueurs synaptiques, votre cellule de remplissage et de noyaux (DAPI / option). Les cellules doivent être imagée en utilisant un objectif 63x huile d'immersion. Nous l'image en utilisant le microscope à fluorescence Zeiss AxioImager avec le Zeiss Plan-Apochromat 63x/1.4 DIC huile ∞ / 0,17 objectif.
- Sélectionnez les cellules qui sont au moins deux diamètres de cellules loin de leurs plus proches voisins. Pour éviter les biais et assurer aléatoire de la sélection de cellule si visualisant cellules non transfectées, sélectionnez les cellules dans le canal de DAPI, puis prendre des images dans tous les canaux. Si la visualisation des cellules transfectées sélectionner des cellules dans le canal correspondant à l'étiquette fluorescente pour identifier les cellules transfectées (ex tdTomato).
- Acquérir vos images:
Cellules non transfectées: Pour chaque cellule sélectionnée, obtenir des images 8 bits dans la GFP et le Texas canaux Rouge. L'image superposée pseudocolored devrait avoir vos marqueurs pré-et post-synaptiques en rouge et vert, respectivement.
Les cellules transfectées: Pour chaque cellule sélectionnée d'obtenir des images 8 bits dans la GFP, Texas Red et Cy5 (ou Cy5.5) canaux. L'image superposée pseudocolored devrait avoir vos marqueurs pré-et post-synaptiques en rouge et vert, respectivement. Pseudo couleur de votre cellule de remplir en bleu.
7. Analyse d'Image et Co-localisée quantification lacrymaux
- Nous utilisons le programme Analyzer lacrymaux pour la quantification de co-localisés lacrymaux synaptique. Puncta Analyseur de brancher est écrit par Bary Wark, et est disponible sur demande (c.eroglu @ cellbio.duke.edu). Puncta Analyzer fonctionne dans ImageJ 1,26 (http://rsbweb.nih.gov/ij/, les nouvelles versions de ImageJ peut pas exécuter l'application). Pour installer Analyzer puncta suffit de placer le dossier de l'application téléchargée dans le dossier "Plugins" dans le répertoire ImageJ 1,26.
- Ouvrez une de vos images à l'aide d'ImageJ. Utilisez l'un des outils de sélection dans l'ImageJ menu pour déterminer la région d'intérêt (ROI). Nous utilisons régulièrement l'outil de sélection circulaire pour sélectionner une région d'environ une cellule de diamètre radialement autour du soma d'intérêt.
- Avec votre région d'intérêt (ROI) sélectionné, allez dans le menu plugins et sélectionnez "puncta Analyzer".
- Dans la «Analyse des options" fenêtre qui apparaît, sélectionner "Canal-Rouge», «Green Channel», le «Contexte Soustraire« d'abord et "Set fichier de résultats ...." Cliquez sur "OK". Il vous sera demandé de définir un emplacement pour enregistrer vos résultats po Ces résultats peuvent être exportés vers Excel pour une analyse ultérieure.
- Dans la fenêtre qui apparaît à côté, assurez-vous d'un rayon de 50 bal est sélectionné et décochez la case "Fond blanc" option (cette modification n'est pas obligatoire mais est souvent préféré par les utilisateurs de l'application pour la facilité de visualisation). Cliquez sur "OK".
- Une nouvelle fenêtre va apparaître à côté d'un masque correspondant à votre image canal rouge. Ajustez le seuil jusqu'à ce que vous sentez que le masque rouge correspond aussi bien que possible à autant de points lacrymaux individuelle discrète, sans introduire trop de bruit. C'est l'une des étapes les plus subjectives de ce protocole, afin de prendre soin de développer une approche cohérente. Cliquez sur "Terminé". Définissez la taille minimale lacrymaux à 4 pixels et modifier rien d'autre. Cliquez sur "OK".
- Répétez l'étape précédente, cette fois pour le canal vert.
- Une fois que vous avez terminé l'étape précédente, le plugin permettra la quantification correspondant à lacrymaux dans chaque canal séparément et à lacrymaux colocalisés entre les deux canaux.
Coupes de cerveau:
Le dosage de la synapse peut être appliquée à partir du cerveau cryocoupes, et à tout tissu du système nerveux (telles que la moelle épinière ou de la rétine) à condition que il ya une paire marqueur approprié de pré-et post-synaptiques (avec des anticorps qui fonctionnent bien dans les sections) qui peuvent être utilisés pour identifier les synapses vous souhaitez quantifier. Le dosage de la synapse peut révéler la régulation temporelle de la formation des synapses dans une région donnée du cerveau et peut quantifier les effets sur la connectivité synaptique dans des animaux transgéniques ou dans un échantillon qui a été manipulé de quelque autre façon.
1. La récolte des tissus cérébraux de souris
Toutes les procédures d'animaux doit être fait en concordance avec les protocoles des animaux IACUC.
- Euthanasier les souris par exsanguination et la perfusion avec du PBS. Perfusion avec du PBS est crucial pour l'enlèvement de sang et de réduire le signal de fond pour les procédures de coloration. IMPORTANT: Ne pas perfuser avec des fixateurs tels que PFA 4%. Ce sera un effet négatif sur les résultats coloration.
2. Fixation
- Fixer l'ensemble du cerveau, dans 4% PFA dans du PBS à 4 ° C pendant la nuit. Le lendemain rincer les cerveaux 3 fois avec PBS.
- Cryoprotect les cerveaux en les plaçant dans saccharose à 30% dans le PBS. Le tissu sera d'abord flotter. Conserver à 4 ° C jusqu'à ce que le tissu tombe au fond. A ce stade de la cryoprotection est terminée.
3. Inclusion / Cryosectioning
- Intégrer les cerveaux à l'orientation désirée pour la coupe (par exemple, sagittal ou coronal) dans une solution 2:1 de saccharose à 30%: (. Tissue-Tek, No de cat: 4583) OCT dans le PBS. Gel des cerveaux embarqué sur une surface plane de glace sèche. Frozen cerveaux intégrés peuvent être placés dans des sacs de congélation et conservés à -80 jusqu'à un an avant la coupe.
- Cryosection le tissu en 12-16μm sections et monter sur des lames de verre (Sigma, Cat No:. S4651). Les diapositives peuvent être stockées jusqu'à une semaine à -80 ° C avant la coloration.
- Diapositives à teindre doivent être séchés à 37 ° C pendant 30 minutes et rincer 1x avec du PBS pour éliminer octobre résiduelle.
4. Les articles de blocage
- Bloc sections dans 20% sérum normal de chèvre (NGS) en PBS pendant une heure à température ambiante. IMPORTANT: Ne pas inclure le Triton X-100 à ce stade. Avant l'addition de la solution de blocage, vous pouvez créer une barrière hydrophobe autour des sections sur votre diapositive en utilisant un stylo PAP Elite (DBS, Cat No:. K039)
5. Application Anticorps primaires
- Diluer vos anticorps primaires dans du PBS avec du Triton de 0,3% et 10% de NGS.
- Dans des coupes de cerveau que nous utilisons PSD-95 (Zymed, Lapin, 1:500) pour étiqueter glutamatergique compartiments postsynaptiques et VGLUT1 ou VGlut2 (Chemicon, la Guinée porc, 1:2500) à l'étiquette glutamatergique terminaisons présynaptiques. Centrifugeuse de dilution d'anticorps primaire pendant 5 minutes à vitesse maximale dans une centrifugeuse de paillasse pour éliminer l'anticorps précipité s'il est présent.
- Sections Incuber dans une solution d'anticorps primaire pour 36 à 60 heures à 4 ° C.
6. Application Anticorps secondaires
- Laver les anticorps primaires hors en immergeant les lames dans du PBS pendant 3x 15 minutes chacune. Après cette étape assurez-vous de protéger vos diapositives de la lumière directe.
- DiluerAnticorps secondaires à une dilution de 1:200 dans le même tampon que celle décrite pour les anticorps primaires. Par exemple, pour VGlut/PSD95 coloration que nous utilisons de chèvre anti-cochon Guinée Alexa 488 (Vglut) et de chèvre anti-lapin Alexa 594 (PSD-95) (Invitrogen).
- Incuber sections dans une solution d'anticorps secondaire pendant 2 heures à température ambiante dans l'obscurité.
- Laver les anticorps non secondaire hors de la glisse en immergeant les diapositives 4x dans du PBS pendant 15 minutes chacun.
7. Montage
- Ajouter de petites gouttes de milieu de montage Vectashield au DAPI (Vector Laboratories Inc) sur lames de verre (VWR scientifique), puis recouvrir les lames avec des lamelles (VWR Scientific, n ° 1.5, 48 393 241). Appliquez le vernis à ongles pour empêcher le mouvement de la lamelle.
8. Imagerie
IMPORTANT: Un microscope confocal avec au moins 3 voies est nécessaire pour l'imagerie décrites ici. Nous l'image sur un Leica SP5 laser microscope confocal à balayage utilisant un objectif 63x huile d'immersion.
- Régions du cerveau Synaptic d'intérêt doit être sélectionné pour la numérisation de manière cohérente entre les sections. Par exemple, dans notre test de la synapse synapses des cellules ganglionnaires rétiniennes sur les neurones collicular supérieure, nous l'image de la région collicular extérieure supérieure à côté du colliculus inférieur, qui englobe la couche synaptique qui reçoit terminaux retinocollicular 7,8,9. Nous l'image et de quantifier les synapses dans les 150 um zone supérieure synaptique du colliculus supérieur, où CGR sont connues pour établir des contacts synaptiques 9.
- Pour chaque section, dans les 488 et 594 canaux, nous l'image de série sections optiques à 0,33 um intervalles sur une profondeur totale de 5 microns pour un total de 15 sections optiques. Au moins trois sections de chaque animal doit être imagée et au moins 3 animaux doivent être inclus dans une condition expérimentale donnée.
- Projections intensité maximale (MIP) sont générées à partir des groupes de 3 sections consécutives rendement 5 MIPS représentant 1 um de profondeur chacun. Ces MIP sont quantifiés.
9. Quantification d'images
- Peut être réalisée exactement comme décrit pour CGR, cependant la forme et la taille du ROI va changer en fonction de quelle région de l'image que vous souhaitez chiffrer.
Clés du succès:
CGR purifiée:
- Avant de fixer CGR purifié (ou d'autres cultures dissociées) assurez-vous de préchauffer PFA 4% dans un bain-marie réglé à 37 ° C pendant 20-25 minutes ~ (conserver à 4 ° C en tout autre temps, ne pas utiliser les dilutions PFA plus de 7 jours).
- Particulièrement pour les neurones cultivés, il est conseillé de ne pas utiliser un aspirateur lave cours pour tous les étapes de rinçage. Gentler méthodes telles que l'aide d'une pipette Pasteur et une ampoule d'aspiration d'améliorer sensiblement la qualité de votre coloration.
- Prenez soin de ne pas laisser vos cellules se dessèchent pendant votre étapes de rinçage.
- Évitez poussant ou en déplaçant des lamelles lors de l'application de vernis à ongles car cela peut entraîner en cisaillement des cellules sur votre lamelle.
- Isoler tous les anticorps primaires et secondaires afin d'éliminer tout anticorps précipité qui aura un impact négatif coloration.
- Soyez sûr de sélectionner des anticorps primaires pour vos marqueurs pré-et post-synaptiques soulevées dans différentes espèces. Ne pas le faire permettra d'éliminer de votre capacité à discriminer entre les deux signaux après l'application d'anticorps secondaire.
Coupes de cerveau:
- Ne pas perfuser de votre souris avec des fixateurs tels que le PFA.
- Ne pas inclure de Triton-X 100 dans votre solution de blocage des coupes de cerveau. Cela endommage la qualité de la coloration pour les marqueurs présynaptique, des marqueurs particulièrement présynaptique qui sont associés à des vésicules synaptiques.
- L'utilisation d'un microscope confocal pour l'imagerie est nécessaire pour l'acquisition de l'image qui est d'assez bonne qualité pour effectuer une analyse des synapses.
Les résultats représentatifs:
Le dosage de la synapse décrit ci-dessus est conçu pour capturer les changements de connectivité synaptique in vitro et in vivo. Dans notre laboratoire, nous utilisons le test synapse pour déterminer l'effet des molécules soit individuelles ou multiples astrocytes sécrétée sur la formation des synapses. Nous couramment effectuer ce test sur le CGR synapse purifiée que nous la culture in vitro.
Un effet bien décrits d'application chronique de astrocyte conditionné médias (ACM) dans les cultures purifiées RGC est une augmentation de plusieurs fois dans le nombre de synapses qui se forment entre CGR 3,4,5,6. Figure 1A et 1B montrent des images représentatives de non transfectées CGR purifiée traités soit avec les milieux de croissance basale ou avec ACM. Après coloration des excitateurs marqueurs pré-et post-synaptiques, l'augmentation de l'ACM-induits dans sla formation ynapse est qualitativement évidente (figure 1A, 1B). En effet, cette constatation a été corroborée par plusieurs études qui ont utilisé l'électrophysiologie pour montrer que l'ACM-induite synapses sont la microscopie électronique fonctionnelle et de montrer que les synapses sont ultrastructural normale 3,4,6. D'autres travaux dans notre laboratoire a identifié la sous-unité des canaux calciques α2δ-1 comme récepteur neuronal pour une molécule fortement synaptogenic astrocytes sécrétée, la thrombospondine 3. Ici l'on inclut les résultats d'une expérience dans le CGR purifiée qui a été effectuée afin de déterminer si des niveaux accrus de α2δ-1 améliore encore la formation des synapses ACM-induite (Figure 3).
CGR ont été cotransfectées avec soit un vecteur vide ou avec une construction codant α2δ-1 avec une construction séparée encodage tdTomato après 5 jours in vitro (DIV5). Après un traitement chronique avec soit ACM ou GM, CGR ont été fixées et colorées sur la DIV 11. Après immunomarquage des marqueurs pré-et post-synaptiques des synapses excitatrices nous constatons une augmentation qualitative évidente en nombre dans la synapse purifiée CGR exprimant soit un vecteur vide (pcDNA3.1) ou α2δ-1 (figure 1C, 1D). Nous quantifier l'effet de l'ACM synaptogenic utilisant puncta analyseur pour compter le nombre des synapses (figure 2) pendant au moins 15 neurones à partir de chaque état. Un échantillon de cette taille nous permet de calculer le nombre moyen de synapses par neurone et de trouver une différence statistiquement significative, ~ multipliée par 10 dans les synapses formées par ACM-traitée neurones qui expriment un vecteur vide (Fig 3, barres grises). Par ailleurs, nous montrons que la surexpression de α2δ-1 conduit à une potentialisation significative de la formation des synapses ACM-induite (~ 20 fois. Fig 3, barres noires).
En plus de neurones cultivés, nous pouvons quantifier la densité synaptique dans différentes régions du cerveau en utilisant cette technique. Le colliculus supérieur est une structure du cerveau qui reçoit les projections retinocollicular, originaires de CGR dans la rétine 7,8,9. Plus le développement postnatal, le nombre de synapses excitatrices formé par CGR sur leurs cibles dans le colliculus supérieur augmente de façon spectaculaire à partir de P7 à P21 7,8,9.
Grâce à notre technique de quantification, nous montrons que le nombre de synapses retinocollicular formé dans le colliculus supérieur augmente de P7 à P14. Pour ce faire, nous avons quantifié la densité synaptique au P7 et P14 à nouveau. Nous tacher le colliculus supérieur pour le DSP-95 (postsynaptiques) et pour VGlut2 (marqueur présynaptique spécifiques aux synapses CJR dans le colliculus supérieur). La région extérieure synaptique de la colliculus supérieur a été imagée (figure 4A) et co-localisés VGlut2/PSD-95 synapses ont été quantifiés (figure 4B, 4C) d'au moins 3 sections par animal et par au moins trois animaux par point dans le temps. Quantification des données résultant démontre clairement une sur trois volets augmentation significative du nombre de synapses entre P7 et P14. Ces résultats sont en accord avec les résultats précédemment publiés en utilisant la microscopie électronique (figure 4D) 9.
En conclusion, la méthode de quantification nombre des synapses que nous décrivons ici est un outil utile pour déterminer le nombre et la densité des synapses dans la culture et dans les tissus nerveux, ce qui nous permet d'étudier les effets de la manipulation de la formation des synapses in vitro ou in vivo.
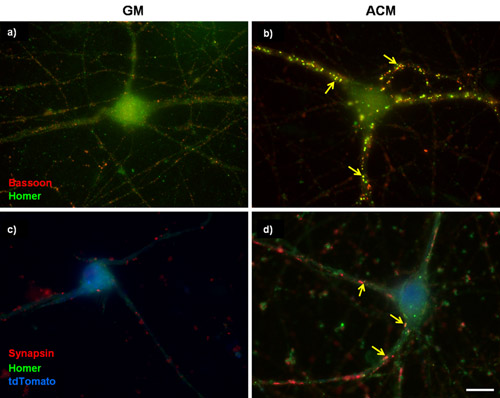
Figure 1: Représentant coloration synaptique dans purifiée CGR. (A et B) 3 jours in vitro (DIV) CGR ont été cultivés soit dans (A) des milieux de croissance basale (GM) ou en (B) pro-synaptogenic souris astrocytes milieux conditionnés (ACM) pour un supplément de 6 jours. Les cellules ont ensuite été étiquetés pour basson (présynaptique, rouge) et Homère (postsynaptique, vert). Souris ACM stimule fortement la formation des synapses entre les CGR tel que déterminé par l'augmentation du nombre de co-localisés basson et Homer lacrymaux. (C et D) CGR 5div ont été transfectées avec un plasmide pour surexprimer la sous-unité des canaux calciques α2δ-1. Les cellules transfectées ont été identifiés avec un remplissage de cellule tdTomato (bleu) et ont été colorées pour synapsine marqueur présynaptique et postsynaptique Homer marqueur. Les flèches indiquent des synapses. La barre d'échelle représente 20 um.
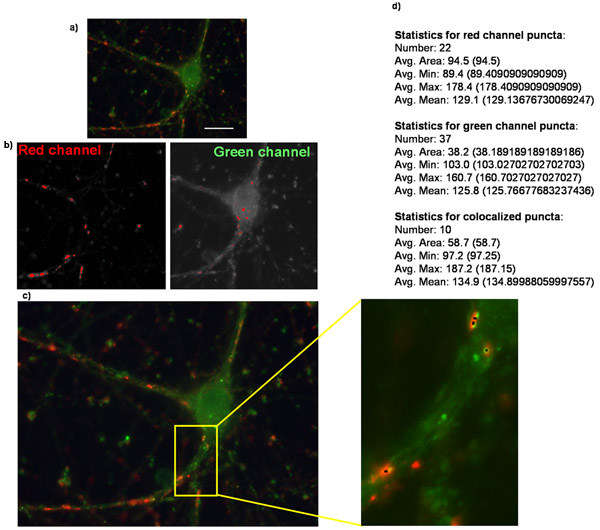
Figure 2:. Quantification du nombre des synapses utilisant puncta Analyzer Montré ici est un exemple de (a) une image originale d'une cellule purifiée ganglionnaires de la rétine une surexpression du récepteur thrombospondine α2δ-1 et est coloré pour synapsine marqueur présynaptique et postsynaptique Homer marqueur. (B) Images correspondant aux masques créés dans chaque canal lors de l'analyse dans les points lacrymaux puncta Analyzer. (C) puncta Analzyer va créer une image, tels que celui montré ici dans lequel lacrymaux sont indiqués par de petits points noirs (en médaillon). Aussi shown est (d) la sortie numérique de l'application où plusieurs points lacrymaux avec plusieurs autres paramètres sont fournis sous forme textuelle / numérique (texte en caractères gras ajoutés pour mettre l'accent).
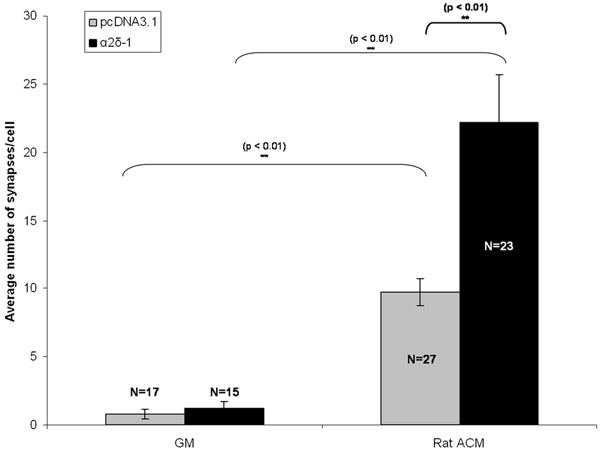
Figure 3:. Résultat représentatif pour le dosage de la synapse Montré ici est l'effet d'un traitement chronique synaptogenic du CGR avec des astrocytes conditionné médias (ACM) dans CGRs transfectées exprimant soit le vecteur vide (pcDNA3.1, barres grises) ou le récepteur thrombospondine-1 α2δ . Les barres d'erreur représentent la SEM. Médias GM = Croissance. ACM = (Rat) astrocytes médias Contitioned.
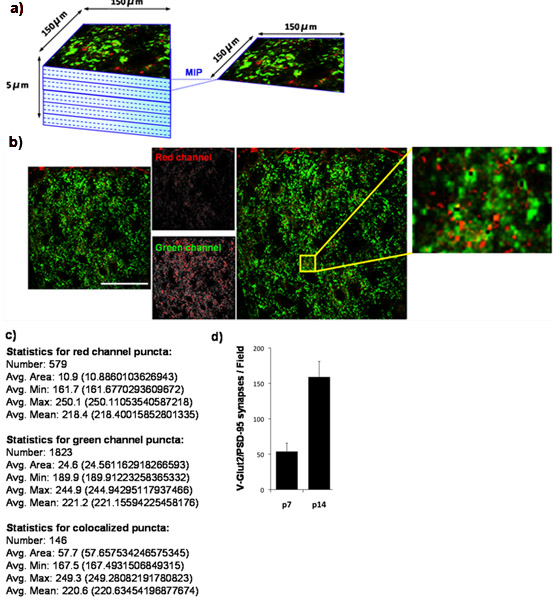
Figure 4:. Quantification de la densité synaptique chez la souris colliculus supérieur (a) Afin de déterminer les changements développementaux dans le nombre de synapses glutamatergiques établies par CGR sur ses objectifs collicular supérieure dans le cerveau des rongeurs, nous teinté cryocoupes du cerveau de souris avec des anticorps contre le présynaptique marqueur VGlut2 (vert) et le marqueur post-synaptique, PSD-95 (rouge). Nous imagé l'extérieur 150 x um région 150 de la souris colliculus supérieur (CS) correspondant à la région cible synaptique pour les CGR en utilisant un microscope confocal à balayage laser. Un z-stack pour chaque section SC ont été recueillies pour une profondeur totale de 5 microns (15 x 0,33 um sections optiques). Projections d'images maximale (MIP) ont été générés pour des groupes de 3 années consécutives sections optiques produisant 5 MIPS / section chacun représentant une um de profondeur. Ci-dessous est une MIP représentatif prélevé colliculus supérieur d'une souris WT P14. Le marqueur présynaptique, VGlut2, est représenté en vert et le marqueur post-synaptique, PSD-95, est représenté en rouge. (C) Sortie numérique produit par l'analyseur lacrymaux. (D) La quantification de l'analyse du nombre des synapses pendant au moins 3 sections par animal avec 3 animaux par point dans le temps (barres d'erreur représentent SEM). La barre d'échelle représente 50 um.
Discussion
Le dosage de la synapse décrit ci-dessus est basé dans le contexte de nos objectifs expérimentaux, où nous nous concentrons essentiellement sur des projections excitatrices du CGR, soit dans la culture purifiée ou dans la section du cerveau. Nous avons fourni un anticorps de référence table listant qui fonctionnent bien pour l'étiquetage des synapses excitatrices (tableau 1).
Ce test synapse peut être adaptée afin de quantifier le numéro de la synapse de toute la population ne...
Déclarations de divulgation
Remerciements
Dans le laboratoire de Ben A. Barres (Stanford University).: Puncta Plug-in pour Image J a été écrit par Barry Wark (Conseil Physion adresse actuelle) Analyseur
Financement;
- Alfred P. Sloan Foundation
- L'A. Esther et Joseph Klingenstein Fund, Inc
- Large Biomedical Research Foundation
- Cure pour l'Initiative maladie de Huntington
matériels
| Name | Company | Catalog Number | Comments | |||||
| Antigène | Espèces | Monoclonaux / polyclonaux | Vendeur | Nombre de catalogue | De dilution | Travaux dans la culture | Travaux dans les sections | |
| Présynaptiques | Synapsin | Lapin | Polyclonaux | Systèmes Synaptic | 106004 | 1:750 | Y | ND |
| Synapsin | Souris | Monoclonaux | Systèmes Synaptic | 106001 | 1:500 | Y | Y | |
| Basson | Souris | Monoclonaux | Assay Designs | VAM PS003F | 1:500 | Y | Y | |
| Basson | Guinée Pig | Polyclonaux | Systèmes Synaptic | 141004 | 1:1000 | Y | ND | |
| Synaptotagmine 1 | Lapin | Polyclonaux | Systèmes Synaptic | 105002 | 1:750 | Y | N | |
| Synaptobrévine 2 (C1.69.1) | Souris | Monoclonaux | Systèmes Synaptic | 104211 | 1:500 | Y | Y | |
| Synaptophysine (C1.7.2) | Souris | Monoclonaux | Systèmes Synaptic | 101011 | 1:500 | Y | Y | |
| VGLUT1 | Souris | Monoclonaux | Millipore | MAB5502 | 1:2500 | N | Y | |
| VGLUT1 | Guinée porc | Polyclonaux | Millipore | AB5905 | 1:2500 | N | Y | |
| VGlut2 | Guinée porc | Polyclonaux | Millipore | AB2251 | 1:2500 | N | Y | |
| Postsynaptiques | PSD-95 (6G6-1C9 clone) | Souris | Monoclonaux | Affinité bio-réactifs | MA1-045 | 1:750 | Y | N |
| PSD-95 | Lapin | Polyclonaux | Zymed | 51-6900 | 1:500 | N | Y | |
| Homer | Souris | Monoclonaux | Systèmes Synaptic | 160011 | 1:500 | Y | ND | |
| Homer | Rat | Polyclonaux | Millipore | AB5875 | 1:500 | Y | Y | |
| Gephyrin | Lapin | Polyclonaux | Systèmes Synaptic | 147003 | 1:500 | Y | Y | |
| Gephyrin | Souris | Monoclonaux | Systèmes Synaptic | 147 | 1:200 | Y | Y |
Tableau 1: exemples de bonnes listes de marqueurs pré-et post-synaptiques que nous avons utilisé avec succès dans notre test synapse. Soyez conscient que ce n'est pas une liste exhaustive de tous les marqueurs disponibles. O = Oui, N = Non, ND = non déterminé.
| Réactifs | Société | Cat. Non |
| PBS | Invitrogen | 20012-027 |
| Poly-D-lysine | Sigma | P6407 |
| La laminine | Cultrex | 3400-010-01 |
| Triton X-100 | Roche Diagnostics GmbH | 9002-93-1 |
| Sérum de chèvre normal | Gibco | 16210 |
| Vectashield au DAPI | Vector Laboratories | H-1200 |
| Octobre | Tissue-Tek | 4583 |
| Tris-Base (50 mM) | Fisher | BP152-5 |
| Albumine de sérum bovin | Sigma | A2153 |
| L-lysine | Sigma | L-1137 |
| 16% d'une solution IFP | Sciences Electron Microscopy | 15711 |
| Granulaire PFA | Sciences Electron Microscopy | 19210 |
| Plaque de culture à 24 puits | Falcon | 35-3047 |
| Chèvre anti-souris conjugué anticorps Alexa | Invitrogen | --- |
| Alimentation | Société | Cat. Non |
| 12mm, n ° 0 des lamelles en verre | Karl Hecht GmbH | 1105209 |
| N ° 1.5 de verre (pour les tranches) lamelle | VWR Scientific | 48393241 |
| Lames de verre | VWR Scientific | 48311-703 |
Références
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Y. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1, 791-803 (1988).
- Meyer-Franke, A., Kaplan, M. R., Pfrieger, F. W., Barres, B. A. Characterization of the signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron. 15, 805-819 (1995).
- Eroglu, C. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 139, 380-392 (2009).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 .
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinocollicular projections in the mouse. J. Comp. Neurol. 230, 552-575 (1985).
- Schmidt, J. T. Formation of retinotopic connections: selective stabilization by an activity-dependent mechanism. Cell. Mol. Neurobiol. 5, 65-84 (1985).
- Sachs, G. M., Jacobson, M., Caviness, V. S. Postnatal changes in arborization patterns of murine retinocollicular axons. J. Comp. Neurol. 246, 395-408 (1986).
- Elmariah, S. B., Oh, E. J., Hughes, E. G., Balice-Gordon, R. J. Astrocytes regulate inhibitory synapse formation via Trk-mediated modulation of postsynaptic GABAA receptors. J. Neurosci. 25, 3638-3650 (2005).
- Hughes, E. G., Elmariah, S. B., Balice-Gordon, R. J. Astrocyte secreted proteins selectively increase hippocampal GABAergic length, branching and synaptogenesis. Moll. Cell. Neurosci. 43, 136-145 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon