Method Article
El aislamiento de los ribosomas traducir contienen peptidil-ARNt para el Análisis Funcional y Estructural
En este artículo
Resumen
Un obstáculo importante para los análisis bioquímicos de los ribosomas que contienen naciente peptidil-ARNt ha sido la presencia de los ribosomas otros en las mismas muestras, los ribosomas no participan en la traducción de la secuencia del ARNm específico que se analiza. Hemos desarrollado una metodología sencilla para purificar, exclusivamente, los ribosomas que contiene la naciente peptidil-tRNA de interés.
Resumen
Recientemente, los estudios estructurales y bioquímicos han detallado muchos de los eventos moleculares que ocurren en el ribosoma durante la inhibición de la síntesis de proteínas por los antibióticos y en la síntesis de polipéptidos nacientes. Algunos de estos antibióticos, reguladores y polipéptidos nacientes en su mayoría en forma de peptidil-ARNt, inhibir o formación del enlace peptídico o terminación de la traducción 7.1. Estos eventos inhibitorios pueden detener el movimiento del ribosoma, un fenómeno denominado "La detención de la traducción". Arresto traducción inducida por un antibiótico o un polipéptido naciente se ha demostrado que regulan la expresión de genes implicados en diversas funciones celulares como el crecimiento celular, resistencia a los antibióticos, la translocación de proteínas y el metabolismo celular 08.13. El conocimiento de cómo los antibióticos y la regulación polipéptidos nacientes alterar la función del ribosoma es esencial si queremos entender el papel completo de los ribosomas en la traducción, en todos los organismos.
Aquí se describe una metodología sencilla que puede ser utilizado para purificar, exclusivamente, para su análisis, los ribosomas traducir un ARNm específico y que contienen un determinado peptidil-tRNA 14. Este procedimiento se basa en el aislamiento selectivo de los ribosomas traducir unido a un ARNm marcado con biotina. Estos complejos de traslación están separados de los ribosomas otros en la misma mezcla, usando cuentas estreptavidina paramagnético (SMB) y un campo magnético (CM). ARNm marcado con biotina son sintetizadas por los ensayos de transcripción escorrentía utilizando como fragmentos de plantillas de ADN generadas por la RCP que contienen promotores de la transcripción T7. T7 ARN polimerasa incorpora biotina-16-UMP de biotina-UTP, en nuestras condiciones aproximadamente diez biotina-16-UMP se incorporan moléculas de ARNm en un 600 nt con un 25% de contenido de la UMP. Estas marcado con biotina ARNm se aíslan, y se utiliza en ensayos de traducción in vitro realizados con factor de liberación de 2 (RF2), depleción de células libres de extractos obtenidos a partir de cepas de Escherichia coli que contiene el tipo salvaje o mutante ribosomas. Ribosomas traducir el marcado con biotina secuencias de ARNm se estancó en la región del codón de parada, debido a la ausencia de la proteína RF2, que normalmente se lleva a cabo la traducción de terminación. Estancado ribosomas que contiene la nueva síntesis de peptidil-tRNA son aislados y retirados de las reacciones de traducción mediante SMB y un MF. Estas cuentas sólo sujetarse a la biotina que contienen los mensajes.
Los complejos aislados, la traducción, se puede utilizar para analizar las características estructurales y funcionales de tipo salvaje o mutante componentes ribosomal, o secuencias de peptidil-tRNA, así como la determinación de interacción ribosoma con antibióticos u otros factores moleculares 1,14-16. Para examinar la función de estos complejos ribosoma aislado, peptidil-transferasa ensayos pueden ser realizados en presencia del antibiótico puromicina 1. Para estudiar los cambios estructurales en los complejos de traslación, los procedimientos bien establecidos pueden ser utilizados, tales como i) la reticulación de 14 aminoácidos específicos y / o ii) ensayos de protección de alquilación 1,14,17.
Protocolo
1. Preparación de células extracto libre.
- Dos gramos de producto seco Escherichia coli sedimento bacteriano obtenido a partir de mediados de los cultivos en fase de registro se lavan dos veces con medio litro de un buffer que contiene 10 mM Tris-acetato, pH 8,0, 14 mM de acetato de magnesio, 60 mM de acetato de potasio y 50 mg / phenylmethanesulphonylfluoride mL (PMSF) por centrifugación a 5.000 X g por 5 min a 4 ° C. Después del lavado, el sedimento bacteriano se resuspendió en 40 ml de tampón A.
- Las células bacterianas se rompen con una prensa francesa, la aplicación de presión de 6,000 psi. Esta presión corresponde a 600 unidades con un pistón de una pulgada. La suspensión se interrumpe recoger en un tubo de vidrio limpio (50 ml).
- La suspensión se interrumpe tratados con 1 mM ditiotreitol (DTT) y se centrifuga a 30.000 xg durante 30 min. El procedimiento de centrifugación se repite, utilizando el sobrenadante resultante. El sobrenadante final se dispensa (1 ml) en microtubos. Por último, las alícuotas se congelan con un hielo seco-etanol o el nitrógeno líquido y se almacenan a -60 ° C o -80 º C.
2. Preparación de los extractos libres de células de RF2 empobrecido.
- 4,5 ml de la proteína A sefarosa 4B cuentas de lodo se mezcla con 5 ml de un anti-RF2 anti-suero con una rueda giratoria a temperatura ambiente, durante una hora. La mezcla se centrifuga a 2500 xg para separar las cuentas del antisuero. Tras desechar el sobrenadante, estas cuentas que contiene los anticuerpos anti-RF2 (anti-RF2 cuentas) son lavados después de resuspensión en 1 ml de tampón B que contiene 35 mM Tris-acetato de pH 7,8, 10 mM de acetato de magnesio, 30 mM de acetato de amonio, 60 mM de glutamato de potasio y 5 mg / ml de inhibidor de la proteasa leupeptina. Las bolas anti-RF2 se separan de tampón B por centrifugación utilizando las mismas condiciones indicadas anteriormente. El procedimiento de lavado se repite dos veces.
- Un ml de extracto libre de células se mezclan con 150 ml de anti-RF2 cuentas con una rueda giratoria, a 4 ° C, durante dos horas. La mezcla se centrifuga a 10.000 xg para separar el extracto libre de células de las cuentas. Se elimina el sobrenadante y se trata de nuevo con otro l 150 de anti-RF2 cuentas. Este procedimiento se repite una vez más con la solución de extracto libre de células resultantes. La final de células libres de la solución de se dispensa (100 l) en microtubos. Las alícuotas se congelan con un hielo seco-etanol o el nitrógeno líquido y se almacenan a -60 ° C o -80 º C.
3. Preparación de una plantilla de ADN.
- Preparar un 1 mL para la reacción PCR mediante la mezcla de 600 femtomoles de la plantilla plásmido que contiene las secuencias que se traduce (Fig. 1), con 0,4 nanomoles de cada uno de los oligodesoxinucleótidos indica en la Figura 1, 0,2 micromoles de cada dNTP y 50 U de Taq- ADN polimerasa en el buffer suministrado por Stratagene Co. realizar la reacción de amplificación en las condiciones siguientes: 94 ° C durante 2 minutos, (94 ° C durante 30 s, 55 ° C durante 30 s, 72 ° C durante 1 minuto, durante 30 ciclos) y 72 ° C durante 12 min.
- Purificar el PCR-productos de la precipitación del ADN mediante la adición de volumen 1 / 10 de acetato de sodio 3 M, pH 5,2, y 2 volúmenes de etanol helado. Repita el procedimiento de precipitación, una vez más. Resuspender el ADN en 100 L de dietil-pirocarbonato (DEPC) de agua tratada.
Normalmente, este procedimiento produce 100 mg de un producto de 600 pb de ADN. - Verificar la integridad de los productos de PCR por electroforesis en geles de agarosa.
4. Preparación de ARNm biotina etiquetados.
- Prepare una l 100 en la reacción de transcripción in vitro en el agua tratada DEPC mediante la mezcla de 5 g de los fragmentos de ADN generados por PCR con 0,5 micromoles de ATP, CTP, GTP, 0,3 micromoles de UTP, 50 nanomoles de biotina-16-UTP, y 10 l de la mezcla de la enzima T7 en el buffer suministrado por Promega Co. Incubar la mezcla de reacción a 37 ° C durante 3 horas.
Para cuantificar la cantidad de ARNm obtenido, la plantilla de ADN debe ser eliminado mediante la adición de RNasa libre de DNasa. Incubar la reacción a 37 ° C durante 10 min. - Purificar los productos de ARNm por la precipitación del ARN mediante la adición de volumen 1 / 10 de acetato de sodio 3 M, pH 5,2, y 2 volúmenes de etanol frío. Repita el procedimiento de precipitación, una vez más. Resuspender el ARNm en 100 L de agua tratada con DEPC.
Por lo general, este procedimiento de rendimientos entre 1.2 mg de biotina 600 nt etiquetado de productos de ARNm. - Verificar la integridad de los productos de ARNm biotina marcada por electroforesis en geles de agarosa.
5. El aislamiento de los ribosomas traducir contiene un peptidil-tRNA.
- Preparar 500 l de una mezcla de reacción in vitro de traducción en el agua tratada DEPC mediante la mezcla de 10-15 mg de biotina marcado ARNm con 75 nanomoles de cada uno de los amino ácidos diecinueve, todos menos el aminoácido que será reemplazado por un aminoácido radiactivo , 50 Ci de un ácido amino radiactivos (37MBq) y 20-5 0 L de RF2-depleción de células extracto libre, en una mezcla de reacción tamponada que contiene 40 mM Tris-acetato, pH 8,0, 10 mM de acetato de magnesio, 175 mM de acetato de potasio, acetato de amonio 10 mM, 2 mM DTT, 2 mM ATP, 0,5 mM GTP, 30 mM fosfoenolpiruvato (PEP), 0,3 U / ml de piruvato quinasa (PK), el 3,5% de polietilenglicol 8000, 1 mM espermidina, 20 mg / ml de ácido folínico, y 250 mg / ml tRNA de E. coli. Incubar la mezcla de reacción a 37 ° C durante 10 minutos.
El orden de adición de los componentes de la reacción es muy importante. El extracto libre de células debe mezclarse primero con la solución tampón que contiene los aminoácidos y la mezcla final se incubaron durante 5 min a temperatura ambiente para permitir la activación de los ribosomas. Más tarde, el marcado con biotina ARNm se agregan. Para el análisis estructural mediante procedimientos de modificación química, la adición de un aminoácido radiactivo no es necesario. - Agregar a la mezcla de reacción de traducción - 3 ml de perlas paramagnéticas de estreptavidina (SMB) en suspensión en tampón C que contiene 35 mM Tris-acetato, pH 8,0, 10 mM de acetato de magnesio, 175 mM de acetato de potasio, 10 mM de acetato de amonio y 1 mM DTT. Incubar la nueva suspensión a temperatura ambiente durante 10 min.
- Separar las pymes de la mezcla mediante la aplicación de un campo magnético (CM) se encuentra con separación magnética.
- Resuspender las pymes en tampón C y separar las cuentas de nuevo con el MF. Repita este procedimiento de lavado dos veces. Volver a suspender las bolas en 500 l de tampón C, conservar la suspensión en el hielo, y realizar el siguiente procedimiento inmediatamente.
6. El análisis de los ribosomas aislados conteniendo la peptidil-tRNA.
Para peptidil-tRNA
- Se mezclan 10 l de la SMB (suspendido en tampón C) con 10 l de un tampón de carga que contiene 50 mM Tris-HCl, pH 6,8, el 2,5% (v / v) de glicerol, el 4% dodecil sulfato de sodio, 2 mM de TDT y de 0,2 mg / ml de azul de bromofenol. Resolver los componentes conectados a las cuentas mediante la ejecución de las muestras en el 10% Tris-tricina geles de poliacrilamida.
- Secar el gel usando un vacío de gel de pelo.
- Verificar la integridad y la purificación de la peptidil-tRNA al exponer el gel seco a una película de rayos-X.
Para el ARN ribosomal
- Añadir 190 l de 2 mM etilendiaminotetraacetato (EDTA) preparada con agua tratada con DEPC, y 200 l de fenol equilibrado con agua a 10 l de una suspensión de bolas. Mezclar la suspensión por agitación vigorosa y separar la fase inorgánica de la fase orgánica por centrifugación a 10.000 xg durante 3 minutos a temperatura ambiente. Recoger la capa superior del agua en un microtubo nuevo.
- Precipitar el ARN de la capa de agua mediante la adición de volumen 1 / 10 de acetato de sodio 3 M, pH 5,2, 1 l de 20 mg / ml de solución de glucógeno, y 2 volúmenes de etanol helado. Resuspender el RNA en 10 l de agua tratada con DEPC.
- Verificar la integridad del ARN ribosomal por electroforesis en geles de agarosa.
Por lo general, 50 l de la suspensión de cuentas de los rendimientos de 1 g de ARN ribosomal.
7. Los resultados representativos:
La figura 2 presenta los resultados de una serie de análisis para evaluar la calidad y la funcionalidad de los ribosomas traducir aisladas mediante el procedimiento descrito. La observación de una única banda resolvieron en geles de poliacrilamida indica la presencia de polipéptidos unidos a los ARNm marcado con biotina unido a las pymes (Figura 2A). La purificación de ARN ribosomal usando este procedimiento establece la presencia de los ribosomas unidos a estos ARNm marcado con biotina, también (Figura 2B). Además de puromicina, un antibiótico que induce la actividad peptidil-transferasa del ribosoma, los resultados de la división de la naciente peptidil-ARNt 1. Esto se observa como un cambio en el patrón de migración del polipéptido aislado en geles de poliacrilamida (Fig. 2C). En conjunto, estos datos indican que la biotina marcado ARNm unido a las pymes contienen ribosomas funcionales con peptidil-tRNA.
El aislamiento de los ribosomas traducir contiene específicos peptidil-ARNt permite el estudio de los efectos de la peptidil-ARNt, antibióticos y otras moléculas, en función de los ribosomas (Figura 3), y en la estructura del ribosoma (Figura 3B). En los ejemplos que aquí se presenta la sparsomycin antibióticos y el aminoácido triptófano (Trp) inhiben la rotura hidrolítica de la naciente tnaC-tRNA peptidil-tRNA inducida por RF2 en los ribosomas aislados (Figura 3). La interacción de sparsomycin o Trp con el ribosoma también induce cambios estructurales en algunos nucleótidos que constituyen el ARNr 23S de los ribosomas traducir (Fig. 3B). En resumen, el material biológico obtenido mediante el procedimiento descrito aquí son útiles para obtener mayor comprensión de los contactos estructurales que participan en la inhibición de la función del ribosoma en su interacción con diferentes factores moleculares.
ove_content ">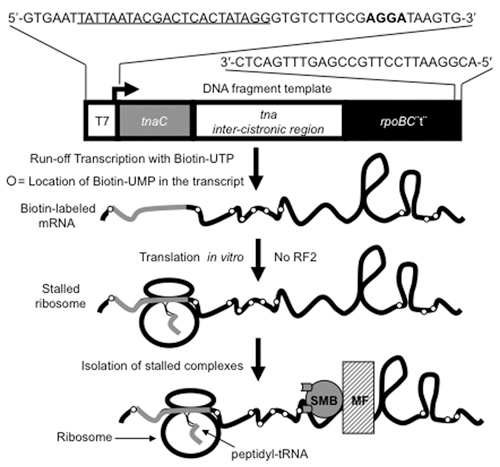
Figura 1. Procedimiento utilizado para producir y purificar los ribosomas traducir contiene peptidil-tRNA. Fragmentos de ADN ca. 650 pb de longitud, que contiene el gen tnaC y su región adyacente, que se muestra en la figura, se utilizan como plantillas en la preparación de los ARNm que contiene biotina, [(bio) UMP] ARNm. Estos fragmentos de ADN son producidas por los procedimientos de PCR utilizando los oligodesoxinucleótidos indicado en la parte superior de la figura. Las letras subrayadas marcar la ubicación del promotor T7 codificada en el primer nucleótido. Letras en negrita indican la secuencia de Shine-Dalgarno que se utiliza en la traducción de las secuencias de ARNm tnaC. El promotor T7 en el fragmento de ADN es reconocida por la ARN polimerasa T7 que se utiliza para transcribir (flecha) la secuencia de tnaC y la posterior secuencia no codificante. La transcripción se termina cuando llega a la RNA polimerasa del extremo 3 'del fragmento de ADN, después de las secuencias rpoBC terminador (rpoBC "t"). La estructura tallo-bucle de la terminación rpoBC protege al ARNm de la 3'-5 'presentan actividad exoribonuclease en los extractos libres de células utilizadas en la reacción de traducción in vitro. El aislado [(bio) UMP] ARNm se utilizan para generar estancado, los ribosomas traducir, por medio de estudios de traducción in vitro. La secuencia tnaC en el [(bio) UMP] ARNm es traducido por un ribosoma que se atasca cuando el último aminoácido se incorpora, debido a la ausencia del factor de liberación (RF2) de la mezcla de reacción. El ribosoma-[(bio) UMP] complejos de ARNm se aisló de la mezcla total de reacción utilizando estreptavidina-magnético-cuentas (SMB) que se unen a la biotina marcado nucleótidos incorporados en el ARNm. Las pymes vinculados al ribosoma-[(bio) UMP] complejos de ARNm se extraen de la mezcla total de reacción mediante un campo magnético (CM).
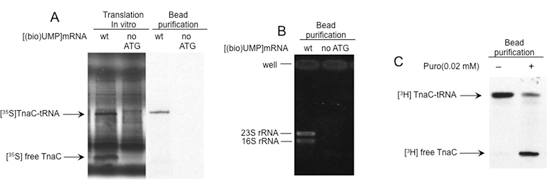
Figura 2. Análisis estructural y funcional de los complejos aislados. A) En las reacciones de traducción in vitro se realizaron con [(bio) UMP] mRNAs en que fue sustituido el codón de inicio del gen tnaC por un codón de parada. Los productos finales fueron aislados utilizando streptavidina cuentas, como se indica en la figura 1. Productos de reacción y las moléculas aisladas fueron analizados por electroforesis en geles de poliacrilamida. El tnaC-tRNA y bandas tnaC péptido están marcados. B) El ARN total fue aislado de los complejos estancado con los procedimientos de extracción con fenol. Cada ARN aislado se resolvió por electroforesis en geles de agarosa. ARN ribosomal (ARNr) se indican. C) que contiene los complejos aislados tnaC-tRNAs se incubaron con (+) o sin (-) 0,02 mM puromycin (Puro) a temperatura ambiente durante 10 min. El péptido tnaC se marcaron durante la traducción con [35S]-metionina (A) o [3H]-prolina (B).
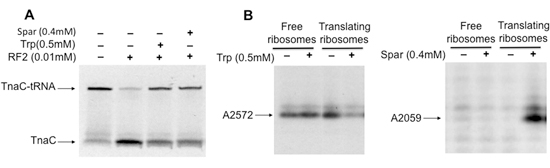
Figura 3. Análisis estructural y funcional de los ribosomas que contienen tnaC-tRNA que están vinculados a la sparsomycin antibióticos, o el aminoácido triptófano. A) que contiene los complejos aislados tnaC-tRNAs se incubaron con (+) o sin (-) sparsomycin (Spar) o triptófano (Trp) a temperatura ambiente durante 5 min. Más tarde, las mezclas se mezclaron con RF2 y se incuba a 37 ° C durante 20 min. B) Análisis de los cambios de metilación en el 23S rRNA inducida por moléculas de unión en el ribosoma. Complejos aislados fueron pre-incubadas con (+) o sin (-) 2 mM Trp o Spar durante 5 min a 37 ° C. Entonces, un agente de alquilación, sulfato de dimetilo, y se añadió la mezcla se incubó a temperatura ambiente por 20 min. ARN total fue extraído y ensayos de extensión del cebador se realizaron con un [32P] marcada oligodeoxynucleotide complementaria a los nucleótidos del ARNr 23S, que están separadas 100 nucleótidos río abajo de las secuencias de nucleótidos modificados. Los productos finales de los ensayos de extensión se resolvieron mediante electroforesis en geles de poliacrilamida. El 23S rRNA nucleótidos afectados por la presencia de Trp o Spar se indican.
Discusión
Este procedimiento de aislamiento descritas en este informe es altamente reproducible. Por desgracia, la presencia de corto peptidil-ARNt producido a partir de las mismas secuencias traducido no puede ser convenientemente evitarse tales peptidil-ARNt puede corresponder a un 15-20% del total del material aislado (Fig. 2C). Estos contaminantes pueden aumentar la concentración en mayores concentraciones de ARNm marcado con biotina se han utilizado o cuando los extractos libres de células utilizadas son viejas o han sido re-usado varias veces. Por lo tanto, es muy importante para controlar la calidad y la concentración de los componentes de las reacciones de traducción in vitro. Por otra parte, una alta eficiencia comercial reconstituido extractos libres de células están disponibles que pueden ser utilizados para los mismos fines (sistema PURE) 18.
Usando este método, biotina-16-UMP se incorporó al azar a lo largo del ARNm objetivo. Existe la posibilidad de que algunos ORFs contienen extensiones uridina puede haber incorporado esta modificación de nucleótidos en sus secuencias, que afectan a su traducción. Variable concentraciones relativas de biotin-16-UTP/UTP tienen que ser probados durante la síntesis del ARNm con el fin de obtener la traducción más eficiente. Métodos alternativos de etiquetado biotina se puede utilizar, dirigida al extremo 5 ', el final más estable de los ARNm. (I) La biotina puede ser fijado al extremo 5 'del ARNm con 3'-NH2ATP (3'-amino, 3'-desoxiadenosina trifosfato) y T4 ligasa ARN 19. (Ii) el extremo 5 'marcado con biotina oligonucleótido puede ser fijado al extremo 5' del mRNA usando ARN ligasa de T4 y 20. (Iii) el extremo 3 'marcado con biotina oligodesoxinucleótidos que corresponden a la secuencia complementaria al extremo 5' del ARNm podría utilizarse también para aislar a los complejos de traducir. Estos oligodesoxinucleótidos biotina marcado se podría unir a las pymes antes de su aislamiento. Más tarde, el SMB unido al marcado con biotina oligodesoxinucleótidos se puede mezclar con la mezcla de reacción de traducción para permitir la interacción con sus secuencias de ARNm complementarios. Tras el aislamiento, el híbrido ARN-ADN región - y la región de hibridación entre la oligodeoxynucleotide marcado con biotina y la secuencia del ARNm - puede ser degradado con RNAsa H, la separación de los complejos se estancó a partir de las perlas de estreptavidina. Este método alternativo puede permitir que los complejos para ser empleados en futuros análisis estructural utilizando métodos de resolución más alta.
Divulgaciones
Agradecimientos
LRC-V. desea dedicar este trabajo a la memoria del Dr. Adriel D. Johnson, un profesor maravilloso cuya prioridad fue siempre la educación de los estudiantes. Te echamos de menos, Adriel. Estamos muy agradecidos a Jacqueline Moreno por su ayuda en la realización de los experimentos descritos en este estudio. Este estudio fue apoyado por una subvención concedida a la CIA de la Fundación Nacional de Ciencia, MCB-0615390, y por la puesta en marcha fondos proporcionados a LRC-V. de la Universidad de Alabama en Huntsville.
Materiales
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Tris base | Sigma | 252859 | ||
| Magnesium acetate | Fluka | 63049 | ||
| Potassium glutamate | Sigma | G1501 | ||
| Ammonium acetate | Fluka | 09688 | ||
| PMSF | Sigma | P7626 | ||
| Protein A sepharose 4B slurry beads | Sigma | P9424 | ||
| Leupeptin inhibitor | Sigma | L9783 | ||
| Taq-DNA polymerase | Stratagene | 201223 | ||
| T7 Maxiprep kit | Promega | P1300 | ||
| SMB | Promega | Z5482 | ||
| Biotin-16-UTP | Roche | 1388908 | ||
| ATP | Sigma | A7699 | ||
| GTP | Sigma | G8877 | ||
| PEP | Sigma | P7002 | ||
| PK | Sigma | P7768 | ||
| Polyethylenglycol 8000 | Fluka | 81268 | ||
| Folinic acid | Fluka | 47612 | ||
| Spermidine | Fluka | 85558 | ||
| tRNA from E. coli | Sigma | R1753 | ||
| DEPC | Sigma | D5758 | ||
| Tricine | Sigma | T5816 | ||
| L-amino acids | Sigma | LAA21 | ||
| DTT | Fluka | 43815 | ||
| magnetic separation stands | Promega | Z5342 |
Referencias
- Cruz-Vera, L. R., Gong, M., Yanofsky, C. Changes produced by bound tryptophan in the ribosome peptidyl transferase center in response to tnaC, a nascent leader peptide. Proc. Natl. Acad. Sci. U. S. A. 103, 3598-3603 (2006).
- Garza-Ramos, G., Xiong, L., Zhong, P., Mankin, A. Binding site of macrolide antibiotics on the ribosome: new resistance mutation identifies a specific interaction of ketolides with rRNA. J. Bacteriol. 183, 6898-6907 (2001).
- Gaynor, M., Mankin, A. S. Macrolide antibiotics: binding site, mechanism of action, resistance. Curr. Top. Med. Chem. 3, 949-961 (2003).
- Polacek, N., Mankin, A. S. The ribosomal peptidyl transferase center: structure, function, evolution, inhibition. Crit. Rev. Biochem. Mol. Biol. 40, 285-311 (2005).
- Steitz, T. A. Structural insights into the functions of the large ribosomal subunit, a major antibiotic target. Keio J. Med. 57, 1-14 (2008).
- Tenson, T., Mankin, A. Antibiotics and the ribosome. Mol. Microbiol. 59, 1664-1677 (2006).
- Xiong, L., Korkhin, Y., Mankin, A. S. Binding site of the bridged macrolides in the Escherichia coli ribosome. Antimicrob Agents Chemother. 49, 281-288 (2005).
- Child, S. J., Miller, M. K., Geballe, A. P. Translational control by an upstream open reading frame in the HER-2/neu transcript. J. Biol. Chem. 274, 24335-24441 (1999).
- Fang, P., Spevak, C. C., Wu, C., Sachs, M. S. A nascent polypeptide domain that can regulate translation elongation. Proc. Natl. Acad. Sci. U. S. A. 101, 4059-4064 (2004).
- Janzen, D. M., Frolova, L., Geballe, A. P. Inhibition of translation termination mediated by an interaction of eukaryotic release factor 1 with a nascent peptidyl-tRNA. Mol. Cell. Biol. 22, 8562-8570 (2002).
- Nakatogawa, H., Ito, K. The ribosomal exit tunnel functions as a discriminating gate. Cell. 108, 629-636 (2002).
- Onouchi, H. Nascent peptide-mediated translation elongation arrest coupled with mRNA degradation in the CGS1 gene of Arabidopsis. Genes Dev. 19, 1799-1810 (2005).
- Raney, A., Law, G. L., Mize, G. J., Morris, D. R. Regulated translation termination at the upstream open reading frame in s-adenosylmethionine decarboxylase mRNA. J. Biol. Chem. 277, 5988-5994 (2002).
- Cruz-Vera, L. R., Rajagopal, S., Squires, C., Yanofsky, C. Features of ribosome-peptidyl-tRNA interactions essential for tryptophan induction of tna operon expression. Mol. Cell. 19, 333-343 (2005).
- Cruz-Vera, L. R., Yanofsky, C. Conserved Residues Asp16 and Pro24 of tnaC-tRNAPro Participate in Tryptophan Induction of tna Operon Expression. J. Bacteriol. 190, 4791-4797 (2008).
- Cruz-Vera, L. R., Yang, R., Yanofsky, C. Tryptophan inhibits Proteus vulgaris tnaC leader peptide elongation, activating tna operon expression. J Bacteriol. 191, 7001-7006 (2009).
- Cruz-Vera, L. R., New, A., Squires, C., Yanofsky, C. Ribosomal features essential for tna operon induction: tryptophan binding at the peptidyl transferase center. J. Bacteriol. 189, 3140-3146 (2007).
- Shimizu, Y. Cell-free translation reconstituted with purified components. Nat. Biotechnol. 19, 751-755 (2001).
- Kinoshita, Y., Nishigaki, K., Husimi, Y. F. l. u. o. r. e. s. c. e. n. c. e. -. isotope- or biotin-labeling of the 5 '-end of single-stranded DNA/RNA using T4 RNA ligase. Nucleic Acids Res. 25, 3747-3748 (1997).
- Nishigaki, K., Taguchi, K., Kinoshita, Y., Aita, T., Husimi, Y. Y-ligation: an efficient method for ligating single-stranded DNAs and RNAs with T4 RNA ligase. Mol Divers. 4, 187-190 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados