Method Article
Isolierung von Ribosomen übersetzen enthaltend Peptidyl-tRNAs für funktionelle und strukturelle Analysen
In diesem Artikel
Zusammenfassung
Ein wesentliches Hindernis für biochemische Analysen von Ribosomen, die im Entstehen begriffenen Peptidyl-tRNAs hat das Vorhandensein von anderen Ribosomen in der gleichen Proben, Ribosomen nicht in der Übersetzung der spezifischen mRNA-Sequenz, die analysiert werden beteiligt. Wir entwickelten eine einfache Methode, um zu reinigen, ausschließlich, den Ribosomen, welche die entstehenden Peptidyl-tRNA von Interesse.
Zusammenfassung
Vor kurzem haben strukturelle und biochemische Studien viele der molekularen Ereignisse, die in den Ribosomen treten bei der Hemmung der Proteinsynthese durch Antibiotika und während entstehenden Polypeptidsynthese detailliert. Einige dieser Antibiotika und regulatorischen entstehenden Polypeptide meist in Form von Peptidyl-tRNAs, hemmen entweder die Bildung der Peptidbindung oder Übersetzung Beendigung 1-7. Diese hemmenden Ereignisse kann die Bewegung des Ribosoms zu stoppen, bezeichnet ein Phänomen der "translationalen verhaften". Übersetzung Verhaftung durch entweder ein Antibiotikum oder einer entstehenden Polypeptid induziert wurde gezeigt, dass die Expression von Genen in verschiedenen zellulären Funktionen wie Zellwachstum, Antibiotika-Resistenz, Protein-Translokation und Zellstoffwechsel 8-13 beteiligt zu regulieren. Wissen, wie Antibiotika und regulatorischen entstehenden Polypeptide verändern ribosomalen Funktion ist unerlässlich, wenn wir die komplette Rolle des Ribosoms in der Übersetzung, in jedem Organismus zu verstehen.
Hier beschreiben wir eine einfache Methode, die verwendet werden, um zu reinigen, ausschließlich für die Analyse, der Umsetzung dieser Ribosomen eine spezifische mRNA und mit einer spezifischen Peptidyl-tRNA 14 kann. Dieses Verfahren beruht auf selektiven Isolierung des Übersetzens Ribosomen gebunden an ein Biotin-markierten mRNA basieren. Diese translationale Komplexe sind aus anderen Ribosomen in der gleichen Mischung getrennt, mit Streptavidin paramagnetischen Kügelchen (SMB) und ein Magnetfeld (MF). Biotin-markierten mRNAs werden von run-off-Transkription Tests unter Verwendung als Vorlagen PCR-generierten DNA-Fragmente, die T7 Transkriptions-Promotoren enthalten synthetisiert. T7-RNA-Polymerase enthält Biotin-16-UMP aus Biotin-UTP; unter unseren Bedingungen etwa zehn Biotin-16-UMP-Moleküle sind in einem 600 nt mRNA mit einem 25% UMP Inhalte integriert. Diese Biotin-markierten mRNAs werden dann isoliert und in ein in vitro-Translation-Assays mit dem Release Faktor 2 (RF2) durchgeführt abgereicherte zellfreien Extrakten von Escherichia coli-Stämme, die Wildtyp-oder mutierte Ribosomen erhalten. Ribosomen übersetzen die Biotin-markierten mRNA-Sequenzen sind in der Stop-Codon Region ins Stocken geraten, wegen der Abwesenheit der RF2-Protein, das normalerweise erreicht Übersetzung Kündigung. Stalled Ribosomen mit den neu synthetisierten Peptidyl-tRNA isoliert und entfernt von der Übersetzung Reaktionen mit SMB und ein MF. Diese Kügelchen binden nur Biotin-haltigen Nachrichten.
Die isolierte, translationale Komplexe können verwendet werden, um die strukturellen und funktionellen Eigenschaften von Wildtyp-oder mutierte ribosomale Komponenten oder Peptidyl-tRNA-Sequenzen, sowie die Bestimmung Ribosom Interaktion mit Antibiotika oder anderen molekularen Faktoren 1,14-16 zu analysieren. Um zu untersuchen, die Funktion dieser isolierten Ribosomen-Komplexe können Peptidyl-Transferase-Assays in Anwesenheit des Antibiotikums Puromycin 1 durchgeführt werden. Zur Untersuchung struktureller Veränderungen in der translationalen Komplexe können etablierte Verfahren eingesetzt, wie i sein) Vernetzung auf bestimmte Aminosäuren 14 und / oder ii) Alkylierung Schutz Assays 1,14,17.
Protokoll
1. Zellfreie Extrakt Vorbereitung.
- Zwei Gramm eines trockenen Escherichia coli Bakterien-Pellet aus der mittleren logarithmischen Phase Kulturen gewaschen, zweimal, mit einem halben Liter Puffer erhalten A mit 10 mM Tris-Acetat, pH 8,0, 14 mM Magnesium-Acetat, 60 mM Kaliumacetat und 50 ug / mL phenylmethanesulphonylfluoride (PMSF) durch Zentrifugation bei 5000 X g für 5 min bei 4 ° C. Nach dem Waschen wird das Bakterienpellet in 40 ml Puffer A resuspendiert
- Die Bakterienzellen werden unterbrochen mit einem Französisch Presse, Anwendung 6000 psi Druck. Dieser Druck entspricht 600 Einheiten mit einem Ein-Zoll-Kolben. Die gestört Suspension wird in ein sauberes Glasröhrchen (50 ml) gesammelt.
- Die gestört Suspension wird mit 1 mM Dithiothreitol (DTT) behandelt und bei 30.000 xg für 30 min zentrifugiert. Die Zentrifugation Vorgang wird solange wiederholt, wobei die resultierende Überstand. Der letzte Überstand wird verzichtet (1 mL) in Röhrchen. Schließlich werden die Aliquots eingefroren mit einem Trockeneis-Ethanol-Gemisch oder flüssigem Stickstoff, und bei -60 ° C gelagert oder -80 ° C.
2. Vorbereitung von zellfreien Extrakten von RF2 Depleted.
- 4,5 ml Protein A-Sepharose 4B Gülle Perlen werden mit 5 ml eines Anti-RF2 anti-Serum mit einem rotierenden Rad bei Raumtemperatur für eine Stunde gemischt. Die Mischung wird bei 2500 xg zentrifugiert, um die Perlen aus dem Antiserum zu trennen. Nach Verwerfen des Überstandes werden diese Kügelchen, die anti-RF2 Antikörper (anti-RF2 Perlen) später durch Resuspendieren in 1 ml Puffer B mit 35 mM Tris-Acetat pH 7,8, 10 mM Magnesium-Acetat, 30 mM Ammoniumacetat, 60 mM Kalium-Glutamat und 5 ug / ml Leupeptin Proteinase-Inhibitor. Die Anti-RF2 Kügelchen werden dann aus dem Puffer B durch Zentrifugation mit den gleichen oben angegebenen Bedingungen getrennt. Der Waschvorgang wird zweimal wiederholt.
- Ein ml der zellfreien Extrakt wird mit 150 ul Anti-RF2 Perlen mit einem sich drehenden Rad, bei 4 ° C gemischt, für zwei Stunden. Die Mischung wird bei 10.000 xg zentrifugiert, um den zellfreien Extrakt aus den Perlen zu trennen. Der Überstand wird entfernt und behandelt erneut mit einem anderen 150 ul Anti-RF2 Perlen. Dieses Verfahren wird noch einmal mit den daraus resultierenden zellfreien Extrakt-Lösung wiederholt. Die endgültige zellfreien Extrakt-Lösung verzichtet wird (100 ul) in Röhrchen. Die Aliquots eingefroren mit einem Trockeneis-Ethanol-Gemisch oder flüssigem Stickstoff, und bei -60 ° C gelagert oder -80 ° C.
3. Erstellung eines DNA-Vorlage.
- Bereiten Sie eine 1 mL PCR-Reaktion durch Mischen 600 Femtomol der Plasmid-Vorlage mit den Sequenzen übersetzt werden (Abb. 1), mit 0,4 Nanomol jedes der Oligodesoxynukleotide in Abb. 1, 0,2 Mikromol je dNTP und 50 U angegeben Taq- DNA-Polymerase in den Puffer durch Stratagene Co. geliefert Führen Sie die Amplifikationsreaktion unter folgenden Bedingungen: 94 ° C für 2 min, (94 ° C für 30 s, 55 ° C für 30 s, 72 ° C für 1 min; für 30 Zyklen) und 72 ° C für 12 min.
- Purify der PCR-Produkte durch Fällung der DNA durch Zugabe von 1 / 10 Volumen 3 M Natriumacetat, pH 5,2 und 2 Volumen eiskaltem Ethanol. Wiederholen Sie die Niederschläge Verfahren noch einmal. Die DNA in 100 ul von Diethyl-(DEPC) behandelt-Wasser.
Normalerweise liefert dieses Verfahren 100 ug eines 600 bp DNA-Produkt. - Überprüfen Sie die Integrität der PCR-Produkte durch Elektrophorese auf Agarosegelen.
4. Vorbereitung von Biotin markiert mRNA.
- Bereiten Sie eine 100 ul in vitro Transkriptions-Reaktion in DEPC behandeltem Wasser durch Mischen von 5 ug des PCR-generierten DNA-Fragment mit 0,5 Mikromol ATP, CTP, GTP, 0,3 Mikromol UTP, 50 Nanomol Biotin-16-UTP und 10 ul von T7 Enzym-Mix in der Puffer von Promega Co. geliefert Inkubieren der Reaktionsmischung bei 37 ° C für 3 Stunden.
Zur Quantifizierung der Menge an mRNA erhalten, sollten die DNA-Matrize durch Zugabe von RNase-freier DNase beseitigt werden. Inkubieren Sie die Reaktion bei 37 ° C für 10 min. - Purify die mRNA-Produkte durch Fällung der RNA durch Zugabe von 1 / 10 Volumen 3 M Natriumacetat, pH 5,2, und 2 Volumina kaltem Ethanol. Wiederholen Sie die Niederschläge Verfahren noch einmal. Resuspendieren des mRNA in 100 ul DEPC-Wasser behandelt.
In der Regel bezeichnet dieses Verfahren Renditen zwischen 1-2 mg eines 600 nt Biotin mRNA Produkt. - Überprüfen Sie die Integrität der Biotin-markierten mRNA-Produkte durch Elektrophorese auf Agarosegelen.
5. Isolierung von Ribosomen übersetzen enthaltend ein Peptidyl-tRNA.
- Bereiten Sie 500 mL einer in vitro Translation Reaktionsgemisch in DEPC behandeltem Wasser durch Mischen 10-15 pg Biotin-markierten mRNA mit 75 Nanomol jedes der neunzehn Aminosäuren-alle außer die Aminosäure, die von einer radioaktiven Aminosäure ersetzt werden , 50 uCi einer radioaktiven Aminosäure (37MBq), und 20-5 0 ul von RF2-abgereicherten zellfreien Extrakt, in einer gepufferten Reaktionsgemisch mit 40 mM Tris-Acetat, pH 8,0, 10 mM Magnesium-Acetat, 175 mM Kaliumacetat, 10 mM Ammoniumacetat, 2 mM DTT, 2 mM ATP, 0,5 mM GTP, 30 mM Phosphoenolpyruvat (PEP), 0,3 U / ml Pyruvatkinase (PK), 3,5% Polyethylenglykol 8000, 1 mM Spermidin, 20 pg / mL Folinsäure und 250 ug / ml tRNA aus E. coli. Inkubieren der Reaktionsmischung bei 37 ° C für 10 Minuten.
Die Reihenfolge der Zugabe der Reaktionspartner ist sehr wichtig. Der zellfreie Extrakt muss zuerst mit der Pufferlösung mit den Aminosäuren und die endgültige Mischung für 5 min bei Raumtemperatur inkubiert, um die Aktivierung der Ribosomen können gemischt werden. Später werden die Biotin-markierten mRNAs aufgenommen. Für strukturelle Analysen mit chemischen Modifikation Verfahren ist die Zugabe eines radioaktiven Aminosäure nicht erforderlich. - Hinzufügen, um die Übersetzung Reaktionsgemisch - 3 ml Streptavidin paramagnetischen Kügelchen (SMB) in Puffer C suspendiert, das 35 mM Tris-Acetat, pH 8,0, 10 mM Magnesium-Acetat, 175 mM Kaliumacetat, 10 mM Ammoniumacetat und 1 mM DTT. Inkubieren Sie die neue Suspension bei Raumtemperatur für 10 min.
- Trennen Sie die SMB aus dem Gemisch durch Anlegen eines Magnetfeldes (MF) mit magnetischen Trennung steht.
- Resuspendieren SMB in Puffer C und trennen Sie die Perlen wieder mit dem MF. Wiederholen Sie diesen Waschvorgang zweimal. Resuspendieren der Beads in 500 ul Puffer C, speichern Sie die Suspension auf Eis, und führen Sie das nächste Verfahren sofort.
6. Analyse der isolierten Ribosomen enthaltend die Peptidyl-tRNA.
Für Peptidyl-tRNA
- Mix 10 ul des SMB (suspendiert in Puffer C) mit 10 ul einer Be-Puffer mit 50 mM Tris-HCl, pH 6,8, 2,5% (v / v) Glycerin, 4% Natriumdodecylsulfat, 2 mM DTT und 0,2 mg / mL Bromphenolblau. Lösen Sie die Komponenten an die Perlen, indem Sie die Proben in 10% Tris-Tricin Polyacrylamidgelen.
- Trocknen Sie die Gele mit Hilfe eines Vakuum-Gel-Trockner.
- Überprüfen Sie die Integrität und die Reinigung der Peptidyl-tRNA, indem die getrockneten Gel ein Röntgenfilm.
Für die ribosomale RNA
- Add 190 &mgr; l 2 mM Ethylendiamintetraacetat (EDTA)-Lösung mit DEPC-behandeltem Wasser hergestellt, und 200 ul Phenol equilibriert mit Wasser auf 10 mL einer Bead-Suspension. Mix der Suspension durch kräftiges Vortexen und trennen Sie die anorganische Phase von der organischen Phase durch Zentrifugation bei 10.000 xg für 3 min bei Raumtemperatur. Sammeln Sie die Top-Wasserschicht in einem neuen Mikroröhrchen.
- Fällung der RNA aus dem Wasser-Schicht, indem 1 / 10 Volumen 3 M Natriumacetat, pH 5,2, 1 ul 20 mg / ml Glykogen-Lösung und 2 Volumen eiskaltem Ethanol. Die RNA in 10 ul DEPC-behandeltem Wasser.
- Überprüfen Sie die Integrität der ribosomalen RNAs durch Elektrophorese auf Agarosegelen.
Normalerweise liefert 50 ul Perlen Aufhängung 1 g der ribosomalen RNA.
7. Repräsentative Ergebnisse:
Abbildung 2 zeigt die Ergebnisse einer Reihe von Analysen der Bewertung der Qualität und Funktionalität der Übersetzung Ribosomen isoliert unter Verwendung des Verfahrens beschrieben. Die Beobachtung einer einzigartigen Band in Polyacrylamidgelen gelöst weist auf das Vorhandensein von Polypeptiden gebunden an die Biotin-markierten mRNAs an der SMB (Abbildung 2A). Die Reinigung der ribosomalen RNAs mit diesem Verfahren stellt die Anwesenheit von Ribosomen gebunden, diese Biotin-markierten mRNAs, sowie (Abbildung 2B). Die Zugabe von Puromycin, ein Antibiotikum, das die Peptidyl-Transferase-Aktivität des Ribosoms induziert, führt zu Spaltung der entstehenden Peptidyl-tRNAs 1. Dies wird als eine Verschiebung der Migration Muster des isolierten Polypeptids in Polyacrylamidgelen (Abb. 2C) beobachtet. Zusammen zeigen diese Daten, die Biotin-markierten mRNAs an der SMB funktionellen Ribosomen enthalten, mit Peptidyl-tRNAs.
Die Isolierung des Übersetzens Ribosomen mit spezifischen Peptidyl-tRNAs ermöglicht die Untersuchung der Auswirkungen der Peptidyl-tRNAs, Antibiotika und anderen Molekülen, auf ribosomalen Funktion (Abbildung 3A), und am Ribosom Struktur (Abbildung 3B). In der hier vorgestellten Beispiele das Antibiotikum Sparsomycin und der Aminosäure Tryptophan (Trp) hemmen die hydrolytische Spaltung der entstehenden tnaC-tRNA Peptidyl-tRNA induziert durch RF2 in den isolierten Ribosomen (Abb. 3A). Das Zusammenspiel von Sparsomycin oder Trp mit dem Ribosom induziert auch strukturelle Veränderungen in einigen Nukleotiden, dass die 23S rRNA der Ribosomen übersetzen (Abb. 3B) darstellen. Zusammenfassend beschrieb das biologische Material unter Verwendung des Verfahrens hier sind nützlich bei der Beschaffung von zusätzlichen Verständnis der strukturellen Kontakte zu einer Hemmung der ribosomalen Funktion auf ihre Wechselwirkung mit verschiedenen molekularen Faktoren beteiligt.
ove_content ">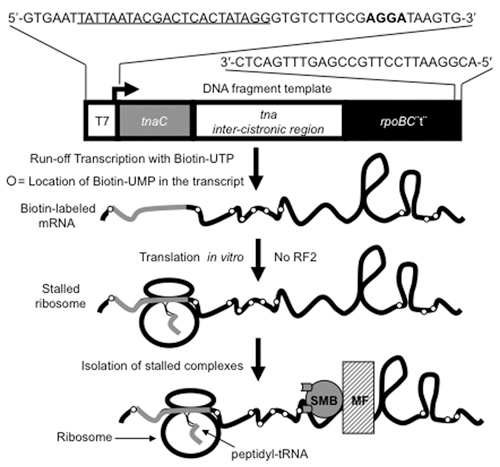
Abbildung 1. Vorgehensweise zur Herstellung und Reinigung der Übersetzung Ribosomen mit Peptidyl-tRNAs. DNA-Fragmente ca. 650 bp in der Länge, mit der tnaC Gens und seiner angrenzenden Region, in der Abbildung dargestellt, werden als Vorlagen bei der Vorbereitung mRNAs mit Biotin, [(bio) UMP] mRNA verwendet. Diese DNA-Fragmente werden durch PCR-Verfahren unter Verwendung der Oligodesoxynukleotide an der Spitze der Figur angegeben hergestellt. Die unterstrichenen Buchstaben kennzeichnen die Lage des T7-Promotors in der Nukleotid-Primer kodiert. Bold Buchstaben geben die Shine-Dalgarno Sequenz, in der Übersetzung der tnaC mRNA-Sequenzen verwendet wird. Der T7-Promotor in das DNA-Fragment wird durch T7-RNA-Polymerase, die zur Transkription (Pfeil) der tnaC Sequenz und die nicht-kodierenden Sequenz stromabwärts erkannt wird. Die Transkription ist beendet, wenn RNA-Polymerase erreicht das 3'-Ende des DNA-Fragments, nach dem rpoBC Terminator-Sequenzen (rpoBC "t"). Die Stamm-Schleife-Struktur der rpoBC Terminator schützt die mRNA aus dem 3'-5 'exoribonuclease Aktivität im zellfreien Extrakten in der in vitro Translation Reaktionen eingesetzt. Die isolierte [(bio) UMP] mRNAs werden verwendet, um ins Stocken geraten, Übersetzung Ribosomen erzeugen, mit der in vitro Translation-Assays. Die tnaC Sequenz in der [(bio) UMP] mRNA wird von einem Ribosom, die bei der letzten Aminosäure eingebaut wird Ständen, wegen der Abwesenheit der Release Factor (RF2) aus dem Reaktionsgemisch übersetzt. Das Ribosom-[(bio) UMP] mRNA-Komplexe werden von der gesamten Reaktionsmischung mit Streptavidin-Magnetic-Beads (SMB), die die Biotin-markierte Nukleotide in die mRNA eingebaut binden isoliert. Der kleine und mittelständische Unternehmen gebunden Ribosom-[(bio) UMP] mRNA-Komplexe sind aus der gesamten Reaktionsmischung durch ein Magnetfeld (MF) extrahiert.
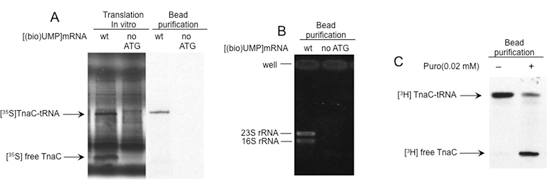
Abbildung 2. Strukturelle und funktionelle Analysen der isolierten Komplexe. A) In-vitro-Translation-Reaktionen wurden mit durchgeführt [(bio) UMP] mRNAs, in denen das Startcodon des tnaC Gen durch ein Stop-Codon ersetzt wurde. Die Endprodukte wurden isoliert mittels Streptavidin-Beads, wie in Abb. 1 zu ersehen. Reaktionsprodukte und isolierten Moleküle wurden dann durch Elektrophorese auf Polyacrylamidgelen analysiert. Die tnaC-tRNA und tnaC Peptid-Bands sind markiert. B) Gesamt-RNA wurde aus den festgefahrenen Komplexe mit Phenol-Extraktion Verfahren isoliert. Jeder isolierte RNA wurde durch Elektrophorese in Agarosegelen aufgelöst. Ribosomalen RNAs (rRNA) sind angegeben. C) isolierten Komplexen mit tnaC-tRNAs wurden inkubiert mit (+) oder ohne (-) 0,02 mM Puromycin (Puro) bei Raumtemperatur für 10 min. Die tnaC Peptid wurden während der Übersetzung mit [35S]-Methionin (A) oder [3H]-Prolin (B) gekennzeichnet.
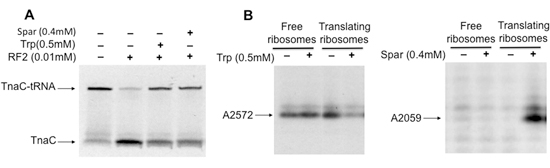
Abbildung 3. Strukturelle und funktionelle Analysen von Ribosomen mit tnaC-tRNA, die gegen das Antibiotikum Sparsomycin oder die Aminosäure Tryptophan gebunden sind. A) isolierten Komplexen mit tnaC-tRNAs wurden mit (+) oder ohne (inkubiert -) Sparsomycin (Spar) oder Tryptophan (Trp) bei Raumtemperatur für 5 min. Später wurden die Mischungen mit RF2 gemischt und bei 37 ° C für 20 min. B) Analyse der Methylierung Veränderungen in 23S rRNA-Moleküle durch Bindung innerhalb des Ribosoms induziert. Isolierte Komplexe wurden mit (+) oder ohne vorinkubiert (-) 2 mM Trp oder Spar für 5 min bei 37 ° C. Dann wurde ein Alkylierungsmittel Dimethylsulfat, zugegeben und die Mischungen bei Raumtemperatur für weitere 20 min inkubiert. Gesamt-RNA wurde extrahiert und Primer-Extension-Assays wurden mit [32P]-markierten Oligodesoxynukleotids komplementär zu den Nukleotiden der 23S rRNA, die 100 Nukleotide beabstandet sind, hinter das modifizierte Nukleotid durchgeführt. Die Endprodukte der Erweiterung Assays wurden durch Elektrophorese in Polyacrylamidgelen aufgelöst. Die 23S rRNA Nukleotide durch die Anwesenheit von Trp oder Spar betroffen sind angegeben.
Diskussion
Diese Isolation Verfahren in diesem Bericht beschrieben wird, in hohem Maße reproduzierbar. Leider kann das Vorhandensein von kurzen Peptidyl-tRNAs aus dem gleichen translatierten Sequenzen produziert nicht bequem vermieden werden, wie Peptidyl-tRNAs kann auf 15-20% der gesamten isolierten Materials (Abbildung 2C) entsprechen. Diese Verunreinigungen können in der Konzentration zu erhöhen, wenn höhere Konzentrationen von Biotin-markierten mRNA verwendet wurden oder wenn die zellfreie Extrakte eingesetzt alt sind oder wurden mehrmals wieder verwendet werden. Daher ist es sehr wichtig, um die Qualität und Konzentration der Komponenten der in-vitro-Translation Reaktionen zu kontrollieren. Alternativ rekonstituierte kommerziellen hohen Wirkungsgrad zellfreie Extrakte zur Verfügung, die für die gleichen Zwecke (PURE-System) 18 verwendet werden.
Mit dieser Methode ist Biotin-16-UMP zufällig entlang der Länge der Ziel-mRNA eingearbeitet. Es besteht die Möglichkeit, dass einige ORFs mit Uridin Verträge eingearbeitet haben diese modifizierte Nukleotid, in ihren Sequenzen die ihre Übersetzung. Variable relativen Konzentrationen von biotin-16-UTP/UTP müssen während der Synthese der mRNA getestet werden, um die effizienteste Übersetzung zu erhalten. Alternative Methoden der Biotin-Markierung verwendet werden, gezielt das 5'-Ende, das stabilste Ende der mRNAs. (I) Biotin kann das 5'-Ende der mRNA mit 3'-NH2ATP (3'-Amino-, 3'-desoxy-Triphosphat) und T4 RNA-Ligase 19 befestigt werden. (Ii) 5'-Ende mit Biotin markierte Oligonukleotid kann das 5'-Ende der mRNA mit Hilfe der T4-RNA-Ligase sowie 20 befestigt werden. (Iii) 3'-Ende Biotin-markierten Oligodesoxynukleotide die an die komplementäre Sequenz am 5'-Ende der mRNA entsprechen könnten auch verwendet werden, um die Übersetzung von Komplexen zu isolieren. Diese Biotin markiert Oligodesoxynukleotide konnte die SMB befestigt werden, bevor die Isolation. Später wurde der SMB, die Biotin-markierten Oligodesoxynukleotide befestigt konnte mit der Übersetzung Reaktionsgemisch, um die Interaktion mit ihren komplementären mRNA-Sequenzen ermöglichen gemischt werden. Nach der Isolierung der Hybrid-RNA-DNA-Region - Hybridisierung und den Bereich zwischen dem Biotin-markierten Oligodesoxynukleotids und die mRNA-Sequenz - konnten abgebaut werden mittels RNAse H, trennt die festgefahrenen Komplexe aus der Streptavidinbeads. Diese alternative Methode können der Komplexe in Zukunft strukturelle Analysen mit höherer Auflösung Methoden eingesetzt werden.
Offenlegungen
Danksagungen
LRC-V. will dieses Papier, die Erinnerung an Dr. Adriel D. Johnson, ein wunderbarer Professor, dessen Priorität Nummer eins war immer die Ausbildung der Studierenden zu widmen. Wir vermissen Dich, Adriel. Wir sind dankbar, dass Jacqueline Moreno für ihre Hilfe bei der Durchführung der Experimente in dieser Studie beschrieben. Diese Studie wurde durch einen Zuschuss zur Verfügung gestellt von der National Science Foundation, MCB-0615390 CY unterstützt und durch eine Anschubfinanzierung zur Verfügung gestellt, um LRC-V. von der University of Alabama in Huntsville.
Materialien
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Tris base | Sigma | 252859 | ||
| Magnesium acetate | Fluka | 63049 | ||
| Potassium glutamate | Sigma | G1501 | ||
| Ammonium acetate | Fluka | 09688 | ||
| PMSF | Sigma | P7626 | ||
| Protein A sepharose 4B slurry beads | Sigma | P9424 | ||
| Leupeptin inhibitor | Sigma | L9783 | ||
| Taq-DNA polymerase | Stratagene | 201223 | ||
| T7 Maxiprep kit | Promega | P1300 | ||
| SMB | Promega | Z5482 | ||
| Biotin-16-UTP | Roche | 1388908 | ||
| ATP | Sigma | A7699 | ||
| GTP | Sigma | G8877 | ||
| PEP | Sigma | P7002 | ||
| PK | Sigma | P7768 | ||
| Polyethylenglycol 8000 | Fluka | 81268 | ||
| Folinic acid | Fluka | 47612 | ||
| Spermidine | Fluka | 85558 | ||
| tRNA from E. coli | Sigma | R1753 | ||
| DEPC | Sigma | D5758 | ||
| Tricine | Sigma | T5816 | ||
| L-amino acids | Sigma | LAA21 | ||
| DTT | Fluka | 43815 | ||
| magnetic separation stands | Promega | Z5342 |
Referenzen
- Cruz-Vera, L. R., Gong, M., Yanofsky, C. Changes produced by bound tryptophan in the ribosome peptidyl transferase center in response to tnaC, a nascent leader peptide. Proc. Natl. Acad. Sci. U. S. A. 103, 3598-3603 (2006).
- Garza-Ramos, G., Xiong, L., Zhong, P., Mankin, A. Binding site of macrolide antibiotics on the ribosome: new resistance mutation identifies a specific interaction of ketolides with rRNA. J. Bacteriol. 183, 6898-6907 (2001).
- Gaynor, M., Mankin, A. S. Macrolide antibiotics: binding site, mechanism of action, resistance. Curr. Top. Med. Chem. 3, 949-961 (2003).
- Polacek, N., Mankin, A. S. The ribosomal peptidyl transferase center: structure, function, evolution, inhibition. Crit. Rev. Biochem. Mol. Biol. 40, 285-311 (2005).
- Steitz, T. A. Structural insights into the functions of the large ribosomal subunit, a major antibiotic target. Keio J. Med. 57, 1-14 (2008).
- Tenson, T., Mankin, A. Antibiotics and the ribosome. Mol. Microbiol. 59, 1664-1677 (2006).
- Xiong, L., Korkhin, Y., Mankin, A. S. Binding site of the bridged macrolides in the Escherichia coli ribosome. Antimicrob Agents Chemother. 49, 281-288 (2005).
- Child, S. J., Miller, M. K., Geballe, A. P. Translational control by an upstream open reading frame in the HER-2/neu transcript. J. Biol. Chem. 274, 24335-24441 (1999).
- Fang, P., Spevak, C. C., Wu, C., Sachs, M. S. A nascent polypeptide domain that can regulate translation elongation. Proc. Natl. Acad. Sci. U. S. A. 101, 4059-4064 (2004).
- Janzen, D. M., Frolova, L., Geballe, A. P. Inhibition of translation termination mediated by an interaction of eukaryotic release factor 1 with a nascent peptidyl-tRNA. Mol. Cell. Biol. 22, 8562-8570 (2002).
- Nakatogawa, H., Ito, K. The ribosomal exit tunnel functions as a discriminating gate. Cell. 108, 629-636 (2002).
- Onouchi, H. Nascent peptide-mediated translation elongation arrest coupled with mRNA degradation in the CGS1 gene of Arabidopsis. Genes Dev. 19, 1799-1810 (2005).
- Raney, A., Law, G. L., Mize, G. J., Morris, D. R. Regulated translation termination at the upstream open reading frame in s-adenosylmethionine decarboxylase mRNA. J. Biol. Chem. 277, 5988-5994 (2002).
- Cruz-Vera, L. R., Rajagopal, S., Squires, C., Yanofsky, C. Features of ribosome-peptidyl-tRNA interactions essential for tryptophan induction of tna operon expression. Mol. Cell. 19, 333-343 (2005).
- Cruz-Vera, L. R., Yanofsky, C. Conserved Residues Asp16 and Pro24 of tnaC-tRNAPro Participate in Tryptophan Induction of tna Operon Expression. J. Bacteriol. 190, 4791-4797 (2008).
- Cruz-Vera, L. R., Yang, R., Yanofsky, C. Tryptophan inhibits Proteus vulgaris tnaC leader peptide elongation, activating tna operon expression. J Bacteriol. 191, 7001-7006 (2009).
- Cruz-Vera, L. R., New, A., Squires, C., Yanofsky, C. Ribosomal features essential for tna operon induction: tryptophan binding at the peptidyl transferase center. J. Bacteriol. 189, 3140-3146 (2007).
- Shimizu, Y. Cell-free translation reconstituted with purified components. Nat. Biotechnol. 19, 751-755 (2001).
- Kinoshita, Y., Nishigaki, K., Husimi, Y. F. l. u. o. r. e. s. c. e. n. c. e. -. isotope- or biotin-labeling of the 5 '-end of single-stranded DNA/RNA using T4 RNA ligase. Nucleic Acids Res. 25, 3747-3748 (1997).
- Nishigaki, K., Taguchi, K., Kinoshita, Y., Aita, T., Husimi, Y. Y-ligation: an efficient method for ligating single-stranded DNAs and RNAs with T4 RNA ligase. Mol Divers. 4, 187-190 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten