Method Article
機能と構造解析のためにペプチジル- tRNAを含む翻訳リボソームの分離
要約
ペプチジル- tRNAの初期段階を含むリボソームの生化学的解析への大きな障害は、同じサンプル中の他のリボソーム、解析対象の特定のmRNA配列の翻訳に関与していないリボソームの存在となっています。我々は、排他的に、興味の発生期のペプチジル- tRNAを含むリボソームを精製するための単純な方法論を開発。
要約
最近、構造的および生化学的研究は、抗生物質によるタンパク質合成の阻害の間と新生ポリペプチド合成中のリボソームに発生する分子事象の多くを紹介しています。これらの抗生物質、および主にペプチジル- tRNAの形で規制の新生ポリペプチドの一部は、ペプチド結合の形成や翻訳終止1から7のいずれかを阻害する。これらの抑制イベントは、リボソームの動き、"トランスレーショナル逮捕"と呼ばれる現象を停止することができます。抗生物質または新生ポリペプチドのいずれかにより誘導される翻訳の停止は、細胞増殖、抗生物質耐性、タンパク質転移と細胞の代謝8月13日などの多様な細胞機能に関与する遺伝子の発現を調節することが示されている。我々はあらゆる生物において、翻訳におけるリボソームの役割を完全に理解したならば、抗生物質と規制の新生ポリペプチドは、リボソームの機能を変更する方法の知識が不可欠です。
ここで、我々は、排他的に、浄化分析のために、それらのリボソームは特定のmRNAを翻訳し、特定のペプチジル- tRNAの14を含むために使用できるシンプルな方法論を説明します。この手順は、ビオチン標識されたmRNAに結合したリボソームの翻訳の選択的分離に基づいています。これらのトランスレーショナル複合体はストレプトアビジン磁性ビーズ(SMB)と磁場(MF)を使用して、同じ混合物中の他のリボソームから分離されています。ビオチン標識mRNAがT7転写プロモーターを含むテンプレートPCR -生成されたDNA断片として使用してランオフ転写アッセイによって合成される。 T7 RNAポリメラーゼは、ビオチン- UTPからビオチン- 16 - UMPを搭載し、我々の条件下で約10ビオチン- 16 - UMPの分子は25%UMPの含有量600 NTのmRNAに組み込まれています。これらのビオチン標識mRNAがその後分離し、放出因子2(RF2)で実行vitro翻訳アッセイにおいて使用されている枯渇野生型または変異型リボソームを含む大腸菌の菌株から得られた無細胞抽出液を。ビオチン標識されたmRNA配列を翻訳するリボソームが原因で、通常、翻訳終結を達成RF2タンパク質の不在に、終止コドンの領域で停滞している。新たに合成されたペプチジル- tRNAを含むストールしたリボソームを単離し、SMBとMFを使用して翻訳反応から削除されます。これらのビーズは、ビオチン含有メッセージをバインドします。
隔離された、翻訳複合体は、野生型または変異型リボソームのコンポーネント、またはペプチジル- tRNAのシーケンスだけでなく、抗生物質または他の分子の要因1,14-16とリボソームの相互作用を決定するための構造的および機能的特徴を分析するために使用することができます。これらの単離されたリボソーム複合体の機能を調べるために、ペプチジル-トランスフェラーゼアッセイは、抗生物質ピューロマイシン1の存在下で行うことができます。翻訳複合体の構造変化を調べるために、十分に確立された手順は、特定のアミノ酸14および/ またはii)アルキル化保護アッセイ1,14,17に)そのような私として、架橋を使用することができます。
プロトコル
1。無細胞抽出物の調製。
- 中期対数増殖期の培養物から得られた乾燥大腸菌細菌ペレットの2グラムはバッファの半リットルを含む10mMのTris -酢酸、pH8.0の14 mMの酢酸マグネシウム、60mMの酢酸カリウム、および50μgを、二回、洗浄されています4℃で5分間5000 × gで遠心分離によって/ mLのphenylmethanesulphonylfluoride(PMSF)℃洗浄後、細菌ペレットを緩衝液A 40mLに再懸濁している
- 細菌細胞は6,000 psiの圧力を加え、フレンチプレスを用いて破砕する。この圧力は、1インチのピストンを使用して600台に相当する。破砕懸濁液を清浄なガラス管(50mL)に収集されます。
- 破砕懸濁液を1mMのdithiotreitol(DTT)で処理され、30分間、30,000 xgで遠心分離されています。遠心分離の手順は、得られた上清を用いて、繰り返されます。最後の上清をマイクロチューブに(1 mL)に分配される。最後に、アリコートをドライアイス - エタノールの混合物または液体窒素を用いて凍結され、-60℃でまたは-80℃で保存されています
2。 RF2が枯渇細胞フリー抽出物の調製。
- プロテインAセファロース4Bのスラリーのビーズの4.5mLのは、1時間、室温で回転するホイールを使用してアンチエイリアスRF2抗血清5mLを混合される。混合物は、抗血清からビーズを分離するために2500 × gで遠心分離されています。廃棄時に上清を、抗- RF2抗体(抗- RF2ビーズ)を含むこれらのビーズは、後に35ミリを含む緩衝液Bの1mLに再懸濁により洗浄し、Tris -酢酸pH7.8の、10mMの酢酸マグネシウム、30mMの酢酸アンモニウム、60 mMのカリウムのグルタミン酸およびロイペプチンプロテイナーゼ阻害剤の5μg/ mLの。抗RF2ビーズを上記と同じ条件を用いて遠心分離することにより、バッファBから分離されています。洗浄手順が2回繰り返されます。
- 無細胞抽出液の一液は4℃、回転するホイールを使用して抗RF2ビーズを150μLと混合され° C、2時間。混合物をビーズから無細胞抽出液を分離するために10,000 × gで遠心分離される。上清を、抗- RF2ビーズの別の150μLで再び削除され、扱われます。この手順は、結果として得られる無細胞抽出液の溶液で1回以上繰り返されます。最後の無細胞抽出液をマイクロチューブに(100μL)分配される。アリコートは、ドライアイス - エタノールの混合物または液体窒素を用いて凍結され、-60℃でまたは-80℃で保存されています
3。 DNAテンプレートの調製。
- 図1に示すオリゴヌクレオチドのそれぞれ0.4ナノモル、各dNTP、0.2マイクロモルとの50 Uで、翻訳される配列を含むプラスミドテンプレート600 femtomoles(図1)を混合することにより、1 mLのPCR反応を準備するTaqポリメラーゼ、ストラタジーン社によって提供されたバッファ内のDNAポリメラーゼは、以下の条件の下で増幅反応を行ない、94℃で2分間、(94℃30秒、55℃30秒、72℃で1分間、30サイクル)、72℃で12分間。
- の3 M酢酸ナトリウム、pHは5.2、および氷冷エタノールを2倍量の1 / 10量を添加することによりDNAを沈殿させることによってPCR産物を精製する。もう一度降水の手順を繰り返します。ジエチル-ピロカーボネート(DEPC)処理水100μLでDNAを再懸濁します。
通常、この手順は、600bpのDNA産物の100μgを得られます。 - アガロースゲル上で電気泳動によってPCR産物の整合性を確認してください。
4。ビオチン標識されたmRNAの調製。
- ATP、CTP、GTP、UTPの0.3マイクロモル、ビオチン- 16 - UTPの50ナノモル、および10μLの0.5マイクロモルでPCR -生成されたDNA断片の5μgを混合することにより、DEPC処理水でのin vitro転写反応で 100μLを準備するプロメガ(株)から提供されたバッファ内のT7酵素ミックスを37℃で反応混合物をインキュベート℃で3時間。
得られたmRNAの量を定量化するため、DNAテンプレートをRNaseフリーのDNaseを添加することにより除去されるべきである。 37反応℃で10分間インキュベートする。 - の3 M酢酸ナトリウム、pHは5.2、および冷エタノール2容量の1 / 10量を添加することによりRNAを沈殿させることによってmRNAの製品を精製する。もう一度降水の手順を繰り返します。 DEPC処理水100μLでmRNAを再懸濁します。
通常、600 NTビオチンの1〜2 mgの間に、この手順の収量は、mRNAの製品のラベルが付いた。 - アガロースゲル電気泳動でビオチン標識されたmRNAの製品の整合性を確認してください。
5。ペプチジルtRNAを含む翻訳リボソームの分離。
- nineteenアミノ酸-すべての放射性アミノ酸に置換されるアミノ酸を除いて、それぞれの75ナノモルとビオチン標識されたmRNAの10〜15μgを混合することにより、DEPC処理水でのin vitro翻訳反応混合物中の500μLを準備50放射性アミノ酸(37MBq)のμCiの、そして20から5 40mMのTris -酢酸、pH8.0の、10mMの酢酸マグネシウム、175 mMの酢酸カリウム、10mMの酢酸アンモニウム、2mMのDTT、2mMのATP、0.5を含む緩衝反応混合物中のRF2枯渇無細胞抽出液の0μL、 mMのGTP、30mMのホスホエノールピルビン酸(PEP)、0.3 U / mLのピルビン酸キナーゼ(PK)、3.5%ポリエチレングリコール8000、1 mMのスペルミジン、20μg/ mLのフォリン酸、および250μgの/ E.からmLのtRNAの大腸菌 。 37℃反応混合物をインキュベート℃で10分間。
反応成分の添加順序は非常に重要です。無細胞抽出液は、アミノ酸とリボソームの活性化を可能にするために室温で5分間インキュベートした最終的な混合物を含む緩衝液で初のミックスされている必要があります。後、ビオチン標識されたmRNAが追加されます。化学修飾の手順を使用して構造解析のために、放射性アミノ酸を付加する必要はありません。 - 35 mMトリス - 酢酸、pH8.0の、10mMの酢酸マグネシウム、175 mMの酢酸カリウム、10mMの酢酸アンモニウムおよび1mM DTTを含む緩衝液Cで中断されたストレプトアビジン磁性ビーズ(SMB)の3mLの - 翻訳反応混合物に追加。 10分間室温で新しいサスペンションをインキュベートする。
- 磁気分離スタンドを使って磁場(MF)を適用することによって混合物からSMBを区切ります。
- バッファーCでSMBを再懸濁し、MFを使用して、再びビーズを区切ります。二度この洗浄操作を繰り返します。バッファーCの500μLでビーズを再懸濁し、氷上でサスペンションを格納し、そしてすぐに次の手順を実行します。
6。ペプチジルtRNAを含む絶縁型リボソームの解析。
ペプチジル- tRNAのための
- 50mMトリス- HCl、pHを6.8、2.5%(v / v)グリセロール、4%のドデシル硫酸ナトリウム、2mMのDTTおよび0.2 mgを含むローディングバッファー10μLでSMBの10μLを(バッファーCで中断)ミックス/ mLのブロモフェノールブルー。 10パーセントトリス-トリシンポリアクリルアミドゲルでサンプルを実行することにより、ビーズに接続しているコンポーネントを解決します。
- 真空ゲル乾燥機を使用してゲルを乾燥させる。
- X -線フィルムに乾燥ゲルを公開することにより、ペプチジル- tRNAの完全性と精製を確認してください。
リボソームRNAのための
- DEPC処理水で調製した2 mMのエチレンジアミン四酢酸(EDTA)溶液を190μL、及びビーズ懸濁液の10μLに、水で平衡化したフェノール200μLを加える。積極的なボルテックスで懸濁液を混合し、室温で3分間、10,000 xgで遠心分離して有機相からの無機相を分離。新しいマイクロチューブの上部に水の層を収集する。
- 1月10日の3 M酢酸ナトリウムの量、pHは5.2、グリコーゲン溶液、および氷冷エタノールの2倍量の20 mg / mLの1μLを加えることにより水層からRNAを沈殿させる。 DEPC処理水10μLのRNAを再懸濁します。
- アガロースゲル上で電気泳動によるリボゾームRNAの整合性を確認してください。
通常、ビーズの懸濁液50μLは、リボソームRNAの1μgのが得られる。
7。代表的な結果:
図2に示した手順を使って分離された翻訳リボソームの品質と機能性を評価する一連の分析の結果を示す。ポリアクリルアミドゲル中で解決されたユニークなバンドの観察は、SMB(図2A)に接続されたビオチン標識mRNAに結合したポリペプチドの存在を示している。この手順を使用して、リボソームRNAの精製は、同様に、これらのビオチン標識mRNAに結合した(図2B)リボソームの存在を確立。ピューロマイシンのほか、リボソームのペプチジル-トランスフェラーゼ活性を誘発する抗生物質、発生期のペプチジル- tRNAの1の切断の結果。これは、ポリアクリルアミドゲルで単離されたポリペプチドの移行パターン(図2C)のシフトとして観測される。一緒に、これらのデータは、SMBに接続されたビオチン標識mRNAがペプチジル- tRNAのと機能的なリボソームが含まれていることを示している。
特定のペプチジル- tRNAを含む翻訳するリボソームの分離は、リボソーム機能(図3A)で、ペプチジル- tRNAは、抗生物質、および他の分子の効果の研究を許可し、リボソームの構造上(図3B)。例ではここに抗生物質sparsomycinを提示し、アミノ酸トリプトファン(Trp)が分離されたリボソーム(図3A)のRF2により誘導された新生tnaC - tRNAはペプチジル- tRNAの加水分解を阻害する。リボソームとsparsomycinまたはTrpの相互作用はまた、翻訳リボソーム(図3B)の23S rRNAを構成するいくつかのヌクレオチドの構造変化を誘導する。要約すると、手順を使用して得られた生物学的物質は、様々な分子の因子との相互作用時にリボソーム機能の阻害に関与する構造的なコンタクトの追加の理解を得る上で有用であるここで説明する。
ove_content">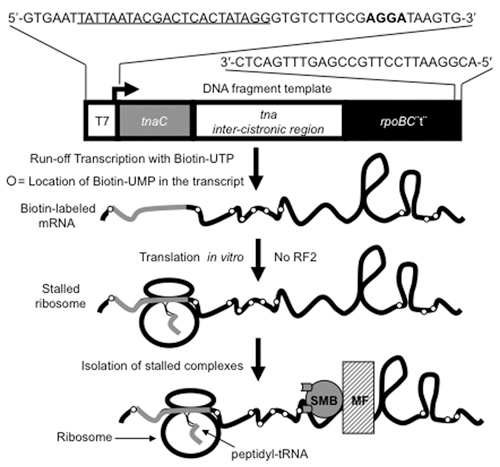
図1。ペプチジル- tRNAを含む翻訳するリボソームを生産し、精製するために使用される手順。 DNAは、CAを断片化します。図に示すように、tnaC遺伝子とその隣接領域を含む長さの650 bpのは、、、ビオチン、[(バイオ)UMP] mRNAを含むmRNAを調製するのにテンプレートとして使用されます。これらのDNA断片は、図の上部に示されるオリゴデオキシヌクレオチドを用いたPCRの手順によって生成されます。下線付きの英字は、ヌクレオチドプライマーでエンコードされたT7プロモーターの位置をマーク。太字はtnaC mRNA配列の翻訳に使用されているシャインダルガーノ配列を示している。 DNA断片のT7プロモーターが(矢印)tnaCシーケンスと非コード配列の下流に転写するために使用されるT7 RNAポリメラーゼによって認識されています。転写は、RNAポリメラーゼがrpoBCターミネーター配列(rpoBC"T")の後、DNA断片の3'末端に達すると終了します。 rpoBCターミネータのステムループ構造は、in vitro翻訳反応でで使用されている無細胞抽出物中に存在する3' - 5'exoribonucleaseの活動からmRNAを保護します。孤立した[(バイオ)UMP] mRNAはin vitro翻訳アッセイを使用して 、停止、翻訳リボソームを生成するために使用されます。 tnaCのシーケンス[(バイオ)UMP] mRNAは、反応混合物から起因リリース因子の不在(RF2)に、最後のアミノ酸を組み込まれているときに失速リボソームによって翻訳されています。リボソーム- [(バイオ)UMP] mRNAの複合体がmRNAに組み込まれてビオチン標識ヌクレオチドを結合するストレプトアビジン磁性ビーズ(SMB)を使用して全反応混合物から分離されています。中堅中小企業は、[(バイオ)UMP]のmRNA複合体を磁場(MF)を使用して全反応混合物から抽出された-リボソームに結合。
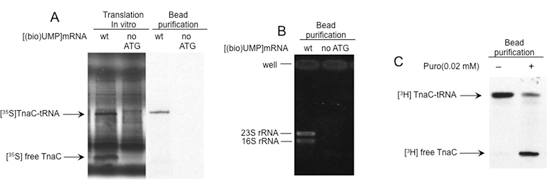
図2分離された複合体の構造と機能解析。 A) で、in vitro翻訳反応は、[(バイオ)UMP]でtnaC遺伝子の開始コドンが終止コドンで置換したmRNAを行った。図1に示されるように最終的な製品は、ストレプトアビジンビーズを用いて単離した。反応生成物と分離された分子をポリアクリルアミドゲル上で電気泳動により分析した。 tnaC - tRNAおよびtnaCペプチドのバンドがマークされます。 B)全RNAはフェノール抽出の手順を使用して停止した複合体から単離された。それぞれの分離されたRNAをアガロースゲルで電気泳動することによって解決されました。リボソームRNA(rRNAs)が示されます。 C)tnaC - tRNAを含む絶縁型錯体は、と(+)またはなしでインキュベートした( - )10分間室温で0.02mMのピューロマイシン(ピューロ)。 tnaCのペプチドは、[35S] -メチオニン(A)または[3 H] -プロリン(B)を使用して、変換中に標識した。
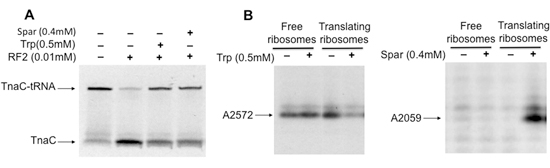
図3。抗生物質sparsomycin、またはアミノ酸のトリプトファンにバインドされているtnaC - tRNAを含むリボソームの構造と機能解析。 A)tnaC - tRNAを含む絶縁型錯体は、と(+)または(なしインキュベートした- )sparsomycin(スパー)または5分間室温でトリプトファン(Trp)。後、混合物はRF2と混合し、37℃で20分間インキュベートした。リボソーム内で結合する分子により誘導された23S rRNAの中のメチル化変化のB)の分析。隔離された複合体は、と(+)またはなしでプレインキュベートした( - )37℃で5分間、2mMのTrpまたはスパー℃にその後、アルキル化剤、硫酸ジメチルは、追加され、混合物は、さらに20分間室温でインキュベートした。トータルRNAを抽出し、プライマー伸長アッセイは、[32P]修飾ヌクレオチドから下流に100塩基の間隔をあけている23S rRNAの塩基に相補的な標識されたオリゴヌクレオチドを用いて行われた。伸長アッセイの最終製品は、ポリアクリルアミドゲルで電気泳動により分離した。 Trpまたはスパーの存在によって影響を受ける23S rRNAの塩基が示されている。
ディスカッション
このレポートに記載されて、この分離手順では、高い再現性です。残念なことに、同じ翻訳配列から生成された短いペプチジル- tRNAの存在が便利に回避することはできません。このようなペプチジル- tRNAのは合計絶縁材料(図2C)の15-20%に対応することがあります。ビオチン標識されたmRNAの高い濃度が使用されているまたは使用される無細胞抽出液が古い場合や、何度も再使用されているときに、これらの汚染物質は、濃度に増加する場合があります。したがって、in vitro翻訳反応でのコンポーネントの品質と濃度を制御するために非常に重要です。また、商業的な高効率無細胞抽出液を再構成した同じ目的(PUREシステム)18のために使用できる利用可能です。
この方法を使用して、ビオチン- 16 - UMPは、ランダムにターゲットmRNAの長さに沿って組み込まれています。ウリジンのトラクトを含むいくつかのORFは、その翻訳に影響を与えず、それらの配列にこの修飾ヌクレオチドを組み込んだている可能性があります。 biotin-16-UTP/UTPの変数の相対濃度は、最も効率的な翻訳を得るために、mRNAの合成中にテストする必要があります。ビオチン標識の代替法は、mRNAの5'末端、最も安定したエンドをターゲットに、使用することができます。 (ⅰ)ビオチンは、3' - NH2ATP(3' -アミノ基、3' -デオキシアデノシン三リン酸)とT4 RNAリガーゼ19を用いて mRNAの5' -末端に結合することができます。 (ⅱ)5'末端ビオチン標識オリゴヌクレオチドは、T4 RNAリガーゼとしても20を用いてmRNAの5' -末端に結合することができます。 (iii)のmRNAの5'末端に相補的な配列に対応する3'末端ビオチン標識オリゴデオキシヌクレオチドはまた、翻訳複合体を分離するために使用することができる。これらのビオチン標識オリゴデオキシヌクレオチドを分離する前に、SMBに接続することができます。後でSMBは、に接続されているビオチン標識オリゴデオキシヌクレオチドは、それらの相補的mRNA配列との相互作用を可能にするために、翻訳反応混合物と混合することができます。単離後、ハイブリッドRNA - DNA領域 - とビオチン標識オリゴヌクレオチドおよびmRNA配列との間でハイブリダイズする領域は、 - ストレプトアビジンビーズから停止複合体を分離し、RNアーゼHを用いて劣化した可能性があります。この代替方法では、複合体は、高解像度の方法を使用して、将来の構造解析に用いることができる可能性があります。
開示事項
謝辞
LRC - V。博士Adriel D.ジョンソン、その最優先事項は、常に学生の教育であった素晴らしい教授のメモリにこの論文を捧げたいと考えている。我々は、Adrielをあなたがいなくて寂しい。我々は本研究で説明されている実験を行うことで彼女の助けのためのジャクリーンモレノに感謝しています。この研究は国立科学財団、MCB - 0615390から、とLRC - Vに提供スタートアップ資金でCYに提供する助成金によって支えられている。ハンツビルのアラバマ大学から。
資料
| Name | Company | Catalog Number | Comments |
| Tris base | Sigma-Aldrich | 252859 | |
| Magnesium acetate | Fluka | 63049 | |
| Potassium glutamate | Sigma-Aldrich | G1501 | |
| Ammonium acetate | Fluka | 09688 | |
| PMSF | Sigma-Aldrich | P7626 | |
| Protein A sepharose 4B slurry beads | Sigma-Aldrich | P9424 | |
| Leupeptin inhibitor | Sigma-Aldrich | L9783 | |
| Taq-DNA polymerase | Stratagene, Agilent Technologies | 201223 | |
| T7 Maxiprep kit | Promega Corp. | P1300 | |
| SMB | Promega Corp. | Z5482 | |
| Biotin-16-UTP | Roche Group | 1388908 | |
| ATP | Sigma-Aldrich | A7699 | |
| GTP | Sigma-Aldrich | G8877 | |
| PEP | Sigma-Aldrich | P7002 | |
| PK | Sigma-Aldrich | P7768 | |
| Polyethylenglycol 8000 | Fluka | 81268 | |
| Folinic acid | Fluka | 47612 | |
| Spermidine | Fluka | 85558 | |
| tRNA from E. coli | Sigma-Aldrich | R1753 | |
| DEPC | Sigma-Aldrich | D5758 | |
| Tricine | Sigma-Aldrich | T5816 | |
| L-amino acids | Sigma-Aldrich | LAA21 | |
| DTT | Fluka | 43815 | |
| magnetic separation stands | Promega Corp. | Z5342 |
参考文献
- Cruz-Vera, L. R., Gong, M., Yanofsky, C. Changes produced by bound tryptophan in the ribosome peptidyl transferase center in response to tnaC, a nascent leader peptide. Proc. Natl. Acad. Sci. U. S. A. 103, 3598-3603 (2006).
- Garza-Ramos, G., Xiong, L., Zhong, P., Mankin, A. Binding site of macrolide antibiotics on the ribosome: new resistance mutation identifies a specific interaction of ketolides with rRNA. J. Bacteriol. 183, 6898-6907 (2001).
- Gaynor, M., Mankin, A. S. Macrolide antibiotics: binding site, mechanism of action, resistance. Curr. Top. Med. Chem. 3, 949-961 (2003).
- Polacek, N., Mankin, A. S. The ribosomal peptidyl transferase center: structure, function, evolution, inhibition. Crit. Rev. Biochem. Mol. Biol. 40, 285-311 (2005).
- Steitz, T. A. Structural insights into the functions of the large ribosomal subunit, a major antibiotic target. Keio J. Med. 57, 1-14 (2008).
- Tenson, T., Mankin, A. Antibiotics and the ribosome. Mol. Microbiol. 59, 1664-1677 (2006).
- Xiong, L., Korkhin, Y., Mankin, A. S. Binding site of the bridged macrolides in the Escherichia coli ribosome. Antimicrob Agents Chemother. 49, 281-288 (2005).
- Child, S. J., Miller, M. K., Geballe, A. P. Translational control by an upstream open reading frame in the HER-2/neu transcript. J. Biol. Chem. 274, 24335-24441 (1999).
- Fang, P., Spevak, C. C., Wu, C., Sachs, M. S. A nascent polypeptide domain that can regulate translation elongation. Proc. Natl. Acad. Sci. U. S. A. 101, 4059-4064 (2004).
- Janzen, D. M., Frolova, L., Geballe, A. P. Inhibition of translation termination mediated by an interaction of eukaryotic release factor 1 with a nascent peptidyl-tRNA. Mol. Cell. Biol. 22, 8562-8570 (2002).
- Nakatogawa, H., Ito, K. The ribosomal exit tunnel functions as a discriminating gate. Cell. 108, 629-636 (2002).
- Onouchi, H. Nascent peptide-mediated translation elongation arrest coupled with mRNA degradation in the CGS1 gene of Arabidopsis. Genes Dev. 19, 1799-1810 (2005).
- Raney, A., Law, G. L., Mize, G. J., Morris, D. R. Regulated translation termination at the upstream open reading frame in s-adenosylmethionine decarboxylase mRNA. J. Biol. Chem. 277, 5988-5994 (2002).
- Cruz-Vera, L. R., Rajagopal, S., Squires, C., Yanofsky, C. Features of ribosome-peptidyl-tRNA interactions essential for tryptophan induction of tna operon expression. Mol. Cell. 19, 333-343 (2005).
- Cruz-Vera, L. R., Yanofsky, C. Conserved Residues Asp16 and Pro24 of tnaC-tRNAPro Participate in Tryptophan Induction of tna Operon Expression. J. Bacteriol. 190, 4791-4797 (2008).
- Cruz-Vera, L. R., Yang, R., Yanofsky, C. Tryptophan inhibits Proteus vulgaris tnaC leader peptide elongation, activating tna operon expression. J Bacteriol. 191, 7001-7006 (2009).
- Cruz-Vera, L. R., New, A., Squires, C., Yanofsky, C. Ribosomal features essential for tna operon induction: tryptophan binding at the peptidyl transferase center. J. Bacteriol. 189, 3140-3146 (2007).
- Shimizu, Y. Cell-free translation reconstituted with purified components. Nat. Biotechnol. 19, 751-755 (2001).
- Kinoshita, Y., Nishigaki, K., Husimi, Y. F. l. u. o. r. e. s. c. e. n. c. e. -. isotope- or biotin-labeling of the 5 '-end of single-stranded DNA/RNA using T4 RNA ligase. Nucleic Acids Res. 25, 3747-3748 (1997).
- Nishigaki, K., Taguchi, K., Kinoshita, Y., Aita, T., Husimi, Y. Y-ligation: an efficient method for ligating single-stranded DNAs and RNAs with T4 RNA ligase. Mol Divers. 4, 187-190 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved