Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Lípidos vesículas mediada por cromatografía de afinidad utilizando magnética clasificación de células activadas (LIMACS): un nuevo método para analizar la interacción de proteínas y lípidos
En este artículo
Resumen
Para probar la interacción de una proteína con su objetivo de lípidos se utilizó MACS y anexina V conjugada con partículas magnéticas y de las vesículas de lípidos sintetizados a partir de los lípidos de destino y fosfatidilserina anexina V vinculante. Proteínas unidas a los lípidos de destino se co-purificados y analizados después de la elución de las cuentas.
Resumen
El análisis de la interacción lípido proteína es difícil debido a los lípidos están incrustados en las membranas celulares y, por tanto, inaccesible para la mayoría de los procedimientos de purificación. Como alternativa, los lípidos pueden estar recubiertas por superficies planas que se utilizan para lípidos ELISA y resonancia de plasmones de la espectroscopia. Sin embargo, los lípidos de la superficie de revestimiento no forman microdominios estructuras, que pueden ser importantes para las propiedades de unión de lípidos. Además, estos métodos no permiten la purificación de grandes cantidades de proteínas de unión a los lípidos de su objetivo.
Para superar estas limitaciones de las pruebas de interacción de proteínas y lípidos para purificar las proteínas de unión de lípidos, hemos desarrollado un nuevo método denominado vesícula lipídica mediada por cromatografía de afinidad utilizando magnético activado por la selección de células (LIMACS). En este método, las vesículas de lípidos son preparados con el objetivo de lípidos y la fosfatidilserina como los lípidos de anclaje para anexina V MACS. Fosfatidilserina es un fosfolípido de la membrana celular omnipresente que muestra una alta afinidad a la proteína anexina V. Con perlas magnéticas conjugadas con anexina V de las vesículas de lípidos que contienen fosfatidilserina se unen a las bolas magnéticas. Cuando las vesículas lipídicas se incuban con un lisado celular de la proteína de unión a los lípidos objetivo también tendrá la obligación de las cuentas y puede ser co-purificado utilizando MACS. Este método también se puede utilizar para comprobar si las proteínas recombinantes reconstruir un complejo de proteínas de unión a los lípidos de destino.
Hemos utilizado este método para mostrar la interacción de la PKC atípicas (aPKC) con la ceramida esfingolípidos y co-purificar respuesta apoptosis de próstata 4 (PAR-4), una proteína de unión a la ceramida asociada aPKC. También hemos utilizado este método para la reconstitución de un complejo de ceramidas asociados de aPKC recombinante con la célula relacionados con la polaridad de las proteínas PAR6 y Cdc42. Desde las vesículas de lípidos pueden ser preparados con una variedad de sphingo o fosfolípidos, LIMACS ofrece una prueba versátil para la interacción lípido-proteína en un ambiente de lípidos que se parece mucho a la de la membrana celular. Otros complejos de lípidos y proteínas pueden ser identificadas mediante análisis de proteómica de proteínas de unión de lípidos co-purifica con las vesículas lipídicas.
Protocolo
1. Introducción
Los lípidos de vesículas mediada por cromatografía de afinidad utilizando magnético activado por la selección de células (LIMACS) técnica fue desarrollada en nuestro laboratorio para aislar la ceramida asociada a complejos de proteínas 1.3. Originalmente, las vesículas lipídicas se hicieron de la ceramida y la fosfatidilserina, lo que permitió el uso de partículas magnéticas MACS-anexina V conjugada (muy afín a la fosfatidilserina) para aislar las vesículas y sus proteínas asociadas. Hemos utilizado la técnica de LIMACS para la reconstitución in vitro de un complejo de ceramidas polaridad asociada y el aislamiento de la ceramida proteínas de unión a partir de lisados celulares 3. LIMACS se puede modificar mediante otros socios de interacción para el aislamiento de las vesículas (por ejemplo, glicolípidos-specifc lectinas y anticuerpos de lípidos).
2. Los procedimientos experimentales
Preparación de vesículas de lípidos y Ensayos aPKCBinding
- Vesículas de lípidos se obtienen a partir de mezclas secas de cantidades equimolares de fosfatidilserina (105 mg) y C16-ceramida (85 mg) después de procedimientos modificados para la preparación de liposomas grandes 1,4-7.
- Las mezclas de lípidos después se volvieron a suspender y se sonica durante 1 h en 100 l de tampón de vesículas que consta de 50 mM Tris / HCl (pH 7,5) y 150 mM NaCl.
- Después de la adición de 300 l de tampón vesícula suplementado con 0,1 mM de MnCl2, las muestras se centrifugan a 12.000 g μ por 20 min a 4 ° C.
- El pellet (vesículas grandes lípidos) se resuspende en 100 l de buffer de la vesícula y se incubaron con 1 nmol de Vybrant CM-dii durante 1 hora a 37 ° C para visualizar la fracción de vesículas después de la separación MACS. Vybrant CM-dii es un tinte rojo fluorescente específicamente incorporar en las membranas lipídicas.
- Un detergente libre de lisado celular se prepara por ultrasonidos / homogeneización de las células en 300 l de tampón hipotónico (10 mM Tris / HCl (pH 7.0) con la proteasa y los inhibidores de la fosfatasa) seguido de la eliminación de los desechos membranosa por centrifugación. Un paso de centrifugación a 100.000 xg durante 1 h, debe añadirse a evitar la contaminación del lisado celular con membranas endógeno que contiene fosfatidilserina.
- El lisado aclarado se añade a la suspensión de vesículas de lípidos, y la mezcla se incuba durante 2 horas a 4 ° C.
- La mezcla de reacción se complementa con 20 l de buffer 20x anexina V vinculante y 50 l de una solución que contiene partículas magnéticas conjugadas con anexina V seguido de la incubación durante 1 hora a 4 ° C.
- MACS se realiza de acuerdo a las instrucciones del fabricante (Miltenyi Biotec, Inc.) de protocolo. La presencia y la cantidad de vesículas de lípidos está determinada por el control de la Vybrant CM-dii de fluorescencia en las fracciones a través del flujo y elución utilizando un lector de microplacas de fluorescencia.
- La correlación lineal entre la cantidad de lípidos vesicular y la intensidad de fluorescencia de la vesícula con destino Vybrant CM-dii es verificada por cuantitativos de alto rendimiento cromatografía en capa fina (HPTLC) de la mezcla de lípidos se aplica a la anexina V-Macs.
- La especificidad de la reacción de unión de proteínas aPKC u otras a las vesículas ceramida / fosfatidilserina es verificada por un ensayo de competición de anticuerpos por medio de 1 mg de anti-PKCζ anticuerpo policlonal de conejo para la incubación del lisado celular durante 1 hora a 4 ° C antes de la incubación con los lípidos vesículas.
- La proteína de unión a vesículas ceramida / fosfatidilserina en el eluido MACS se analizaron por SDS-PAGE e inmunoblotting.
En el complejo de la polaridad de los lípidos in vitro de proteínas
- La reconstitución in vitro de un complejo lípido-proteína de la polaridad se realiza siguiendo el procedimiento LIMACS como se describe en la sección anterior. En breve fosfatidilserina, (420 mg) y C16-ceramida (107 mg), se seca a partir de un disolvente orgánico.
- Los lípidos secos se volvieron a suspender en tratamiento con ultrasonidos en 500 l de buffer de vesícula (50 mM Tris / HCl, pH 7,5, 150 mM NaCl).
- Cinco l de 10 mM MnCl2, 1 l de Vybrant CM-DII, y 500 ng de PKCζ (recombinante humana) se añade la mezcla de reacción se incubó undergentle agitación durante 60 min a 4 ° C.
- Vybrant CM-dii manchada fosfatidilserina / ceramida vesículas se recuperó por centrifugación a 12.000 xg durante 60 min a 4 ° C.
- El pellet (rosa) se resuspende en 100 l de tampón Tris y se complementa con γS-GTP (100 M), el PIB (1 mM), GST-PAR6 (100 ng), o GST-Cdc42 (500 ng) y se incubaron durante 3 horas a 4 ° C (cualquier otra combinación de proteínas recombinantes de interés puede ser utilizado aquí).
- Anexina V-buffer (5 l de una solución madre 20 veces) y anexina V conjugada con partículas magnéticas (50 l) se añadió la mezcla de reacción se incubaron en agitación suave durante 30 min a 4 ° C.
- Anexina V-MACS se realiza siguiendo el protocolo del proveedor como se describió anteriormente.
- La fracción de elución (1 ml) se complementa con 10 mg de albúmina de huevo pura como la ayuda de precipitación. La proteína se concentra por Wessel-Flugge precipitación y analizados por SDS-PAGE/immunoblotting como se describió previamente 8.
- La cantidad de vesículas de lípidos eluidos se cuantifica mediante la detección de Vybrant CM-DII (rosa) en los orgánicos (cloroformo / metanol) fase de la reacción de precipitación Wessel Flugge. La cantidad de proteína analizada se normaliza en la misma cantidad de vesículas de lípidos.
3. Resultados
LIMACS purificación de PKCζ-EGFP y el dominio de unión de la ceramida C20ζ-EGFP
Un lisado con detergente libre de células MDCK expresar toda su longitud PKCζ C-terminal ligada a la proteína verde fluorescente (EGFP FLζ-) o un dominio de unión de la ceramida en el C-terminal de PKCζ (C20ζ-EGFP) se incubó con fosfatidilserina / vesículas ceramida como se describe en los procedimientos experimentales. Tras la elución de la columna de MACS, la proteína se analizó mediante inmunotransferencia y anticuerpos contra PKCζ y EGFP para la detección de la proteína eluye 2.
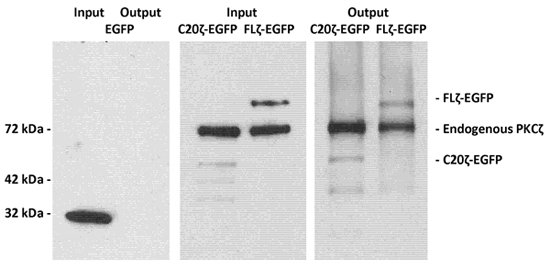
Figura 1. LIMACS de EGFP-etiquetados PKCζ y su C-terminal del fragmento C20ζ utilizando fosfatidilserina / ceramida vesículas.
Detergente libre de lisados de células MDCK que expresan EGFP (como control no vinculante), la longitud total PKCζ-EGFP, o la unión de la ceramida, C-terminal del fragmento C20ζ-EGFP se incubaron con fosfatidilserina / vesículas ceramida como se describe en la sección de Procedimientos experimentales . Después de usar LIMACS, la proteína se eluyó con tampón de muestra SDS y se analizaron por SDS-PAGE e inmunoblotting. El panel izquierdo muestra que EGFP no se unen a las vesículas mantenido con la anexina V-vinculados partículas magnéticas. El panel del medio y la derecha muestra que la longitud total PKCζ-EGFP y C20ζ-EGFP fueron retenidos debido a la unión a la ceramida.
Discusión
Para probar la interacción específica entre un lípido y su unión a proteínas se ve obstaculizada por la incrustación de los lípidos de la membrana celular. La membrana celular consiste en una mezcla de lípidos y proteínas de varios y se organiza en microdominios lipídicos o balsas. Por lo tanto, la co-purificación de microdominios y las proteínas no se pueden distinguir claramente si una proteína se une directamente a un lípido o sólo se enriquece en una estructura de microdominios. Otros métodos que uti...
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por el NIH y R01NS046835 R01AG034389, y la March of Dimes conceder 6FY08-322. Un agradecimiento especial se dedica a la Sra. Eleanor Brown (Miltenyi Biotec, Auburn, CA), que ayudó enormemente con su visión de la tecnología MACS. Miltenyi ha ofrecido generosamente el material utilizado para la demostración de los experimentos, sin costo alguno. También estoy agradecida con el Dr. Wang Guanghu (Medical College of Georgia / Georgia Universidad Ciencias de la Salud, Augusta, GA), que generó la PKCζ líneas celulares que expresan. Apoyo del Instituto de Medicina Molecular de la Facultad de Medicina de Georgia / Ciencias de la Salud de la Universidad de Georgia (bajo dirección del Dr. Lin Mei) también se reconoce.
Materiales
Anexina V conjugada con perlas magnéticas y micro MACS y minicolumnas fueron proporcionados por Miltenyi Biotec, Inc. (Auburn, CA). Todos los lípidos de alta pureza y la obtenida de Avanti Polar Lipids (Alabaster, AL).
Referencias
- Wang, G. Direct binding to ceramide activates protein kinase Czeta before the formation of a pro-apoptotic complex with PAR-4 in differentiating stem cells. J Biol Chem. 280, 26415-26424 (2005).
- Wang, G., Krishnamurthy, K., Umapathy, N. S., Verin, A. D., Bieberich, E. The carboxyl-terminal domain of atypical protein kinase Czeta binds to ceramide and regulates junction formation in epithelial cells. J Biol Chem. 284, 14469-14475 (2008).
- Chalfant, C. E. De novo ceramide regulates the alternative splicing of caspase 9 and Bcl-x in A549 lung adenocarcinoma cells. Dependence on protein phosphatase-1. J Biol Chem. 277, 12587-12595 (2002).
- Simon, C. G., Holloway, P. W., Gear, A. R. Exchange of C(16)-ceramide between phospholipid vesicles. Biochemistry. 38, 14676-14682 (1999).
- Goni, F. M., Contreras, F. X., Montes, L. R., Sot, J., Alonso, A. Biophysics (and sociology) of ceramides. Biochem Soc Symp. , 177-188 (2005).
- Kumagai, K. CERT mediates intermembrane transfer of various molecular species of ceramides. J Biol Chem. 280, 6488-6495 (2005).
- Wessel, D., Flugge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Anal Biochem. 138, 141-143 (1984).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados