Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Lipidvesikel-vermittelte Affinitätschromatographie unter Verwendung von Magnetic Activated Cell Sorting (LIMACS): Eine neue Methode zur Protein-Lipid-Wechselwirkungen Analyze
In diesem Artikel
Zusammenfassung
Um die Wechselwirkung eines Proteins mit seiner Ziel-Lipid verwendeten wir MACS und Annexin V-konjugierten magnetischen Kügelchen und Lipid-Vesikel, die aus der Ziel-Lipid-und Annexin V-Bindung Phosphatidylserin synthetisiert testen. Gebundene Proteine zum Ziel Lipid sind co-gereinigt und analysiert nach der Elution von den Beads.
Zusammenfassung
Die Analyse der Lipid-Protein-Wechselwirkung ist schwierig, da Lipide in Zellmembranen eingebettet sind und somit nicht zugänglich sind, die meisten Reinigungsverfahren. Als Alternative können Lipide auf flachen Oberflächen beschichtet werden, wie für die Lipid-ELISA und Plasmon-Resonanz-Spektroskopie eingesetzt. Allerdings tun Oberflächenbeschichtung Lipide bilden keine Mikrodomänenstruktur Strukturen, die möglicherweise für die Lipid-bindenden Eigenschaften wichtig. Darüber hinaus sind diese Methoden nicht für die Reinigung von größeren Mengen an Proteinen Bindung an ihr Ziel Lipide ermöglichen.
Zur Überwindung dieser Grenzen testen Lipid-Protein-Interaktions-und Lipid-bindende Proteine zu reinigen entwickelten wir eine neuartige Methode bezeichnet Lipidvesikel-vermittelte Affinitätschromatographie unter Verwendung magnetischer Zellsortierung (LIMACS). In diesem Verfahren werden Lipidvesikel mit dem Ziel Lipid Phosphatidylserin und als Anker für die Lipid-Annexin V MACS vorbereitet. Phosphatidylserin ist ein allgegenwärtiges Zellmembran Phospholipid, die eine hohe Affinität zum Protein Annexin V. Mit Magnetic Beads konjugiert Annexin V die Phosphatidylserin-enthaltende Lipid-Vesikel werden die magnetischen Kügelchen binden zeigt. Wenn die Lipid-Vesikel mit einer Zelle inkubiert Lysat die Proteinbindung an die Ziel-Lipid wird auch auf die Kügelchen gebunden und kann co-gereinigt werden mittels MACS. Diese Methode kann auch verwendet werden, um zu testen, ob rekombinanten Proteinen rekonstituieren einen Protein-Komplex Bindung an die Ziel-Lipid.
Wir haben diese Methode benutzt, um die Interaktion von atypischen PKC (aPKC) mit den Sphingolipid Ceramid und die Zusammenarbeit zu reinigen Prostata Apoptose Antwort 4 (PAR-4), ein Protein-Bindung an Ceramid-assoziierten aPKC zeigen. Wir haben auch diese Methode für die Wiederherstellung eines Ceramid-assoziierten Komplex von rekombinanten aPKC mit der Zellpolarität-verwandte Proteine Par6 und Cdc42 verwendet. Da Lipidvesikel mit einer Vielzahl von Sphingo-oder Phospholipiden hergestellt werden können, bietet LIMACS eine vielseitige Test für die Lipid-Protein-Wechselwirkung in einer Lipid-Umgebung, die sehr ähnlich ist, dass der Zellmembran. Weitere Lipid-Protein-Komplexe können unter Verwendung Proteomanalyse von Lipid-bindenden Proteins mit der Lipid-Vesikel co-gereinigt werden.
Protokoll
1. Einführung
Die Lipid-Vesikel-vermittelten Affinitätschromatographie unter Verwendung magnetischer Zellsortierung (LIMACS)-Technik wurde in unserem Labor entwickelt zu isolieren Ceramid-associated Protein-Komplexe 1-3. Ursprünglich waren die Lipidvesikel von Ceramid und Phosphatidylserin, die für MACS mit magnetischen Partikel-konjugierten Annexin V (hoch affine zu Phosphatidylserin) zu den Vesikeln und deren assoziierten Proteinen zu isolieren erlaubt hat. Wir haben die LIMACS verwendete Technik für die in vitro Rekonstitution eines Ceramid-assoziierten Polarität komplexer und die Isolierung von Ceramid-bindenden Proteinen aus Zelllysaten 3. LIMACS modifiziert mit anderen Interaktionspartner für die Isolierung der Vesikel (zB Glycolipid-specifc Lektine oder Lipid-Antikörper) sein.
2. Experimentelle Verfahren
Herstellung von Lipid-Vesikel und aPKCBinding Assays
- Lipidvesikel sind aus getrockneten Mischungen von äquimolaren Mengen von Phosphatidylserin (105 ug) und C16-Ceramid (85 ug) folgende modifizierte Verfahren für große Liposomenzubereitung 1,4-7 erhalten.
- Die Lipid-Gemische werden dann resuspendiert und beschallt für 1 h in 100 ul Vesikel Puffer bestehend aus 50 mM Tris / HCl (pH 7,5) und 150 mM NaCl.
- Nach Zugabe von 300 ul Vesikel-Puffer mit 0,1 mM MnCl 2 ergänzt, werden die Proben bei 12.000 μ g für 20 min bei 4 ° C zentrifugiert
- Das Pellet (große Lipidvesikel) ist in 100 ul Vesikel-Puffer resuspendiert und mit 1 nmol Vybrant CM-DII für 1 h bei 37 ° C, um die Vesikelfraktion nach MACS Trennung zu visualisieren. Vybrant CM-DII ist ein roter Fluoreszenzfarbstoff speziell zur Einbindung in Lipidmembranen.
- Ein Waschmittel-free Zelllysat wird durch Beschallung / Homogenisierung von Zellen in 300 ul hypotonischen Puffer (10 mM Tris / HCl (pH 7,0) mit Protease-und Phosphatase-Inhibitoren) durch Entfernung des membranösen Schutt, gefolgt von Zentrifugation vorbereitet. Ein Zentrifugationsschritt bei 100.000 xg für 1 h sollte hinzugefügt werden, um eine Verunreinigung des Zelllysat mit endogenen Membranen, die Phosphatidylserin zu vermeiden.
- Das geklärte Lysat wird auf die Lipid-Vesikel Suspension zugegeben und das Gemisch wird für 2 h bei 4 ° C inkubiert
- Das Reaktionsgemisch wird mit 20 ul 20x Annexin V-Bindungspuffer und 50 ul einer Lösung mit magnetischen Beads konjugiert Annexin V ergänzt, gefolgt von Inkubation für 1 h bei 4 ° C.
- MACS ist nach Angaben des Herstellers (Miltenyi Biotec, Inc.) Protokoll durchgeführt. Das Vorhandensein und die Menge der Lipid-Vesikel wird durch die Überwachung der Vybrant CM-DII Fluoreszenz in den Flow-Through-und Elutionsfraktionen mit einem Mikrotiterplatten-Fluoreszenz-Reader bestimmt.
- Die lineare Korrelation zwischen der Höhe der vesikulären Lipid-und Fluoreszenz-Intensität der Vesikel-gebundenem Vybrant CM-DII wird durch quantitative Hochleistungs-Dünnschichtchromatographie (HPTLC) der Lipid-Gemisch aufgetragen, um Annexin V-basierten Macs überprüft.
- Die Spezifität der Bindungsreaktion aPKC oder andere Proteine, die Ceramid / Phosphatidylserin Vesikel wird durch einen Antikörper Kompetitionsassay mit 1 ug anti-PKCζ polyklonalen Kaninchen-Antikörpers gegen das Zelllysat für 1 h bei 4 ° C inkubieren vor der Inkubation mit verifizierten die Lipid-Vesikel.
- Die Proteinbindung an Ceramid / Phosphatidylserin Vesikel in der MACS Eluat wird durch SDS-PAGE und Immunoblot analysiert.
In-vitro-Lipid-Protein-Komplex Polarität
- Die in vitro Rekonstitution eines Lipid-Protein-Polarität Komplex ist nach dem LIMACS Verfahren wie im vorherigen Abschnitt beschrieben, durchgeführt. In kurzen, Phosphatidylserin (420 ug) und C16-Ceramid (107 ug) wird aus organischen Lösungsmittel getrocknet.
- Die getrockneten Lipide sind unter Beschallung in 500 ul der Vesikel-Puffer (; 150 mM NaCl 50 mM Tris / HCl, pH 7,5) resuspendiert.
- Fünf ul 10 mM MnCl 2, 1 ul Vybrant CM-DII, und 500 ng PKCζ (humaner rekombinanter) wird zugegeben und das Reaktionsgemisch inkubiert undergentle Agitation für 60 min bei 4 ° C.
- Vybrant CM-DII gebeizt Phosphatidylserin / Ceramid Vesikel werden durch Zentrifugation bei 12.000 xg für 60 min bei 4 ° C wieder
- Das Pellet (pink) wird in 100 ul Tris-Puffer und ergänzt mit γS-GTP (100 uM), BIP (1 mM), GST-Par6 (100 ng), oder GST-Cdc42 (500 ng) und weitere 3 inkubiert h bei 4 ° C (jede andere Kombination von rekombinanter Proteine von Interesse kann hier eingesetzt werden).
- Annexin V-Puffer (5 ul einer 20x Stammlösung) und Annexin V-konjugierten magnetischen Beads (50 ul) zugegeben und die Reaktionsmischung unter leichtem Schütteln für weitere 30 min bei 4 ° C inkubiert
- Annexin V-MACS ist im Anschluss an die Lieferanten-Protokoll wie oben beschrieben durchgeführt.
- Die Elutionsfraktion (1 ml) wird mit 10 pg des reinen Ovalbumin als Niederschlag Hilfe ergänzt. Das Protein wird durch Wessel-Flügge Fällung konzentriert und analysiert SDS-PAGE/immunoblotting wie zuvor 8 beschrieben.
- Die Menge der eluierten Lipidvesikel wird durch den Nachweis von Vybrant CM-DII (rosa) in der organischen (Chloroform / Methanol) Phase des Wessel Flügge Fällungsreaktion quantifiziert. Die Menge an Protein analysiert wird auf gleiche Mengen von Lipidvesikeln normalisiert.
3. Ergebnisse
LIMACS Reinigung von PKCζ-EGFP und die Ceramid-bindende Domäne C20ζ-EGFP
Ein Waschmittel-free Lysat von MDCK-Zellen, die in voller Länge PKCζ C-terminal in Verbindung mit grün fluoreszierende Protein (FLζ-EGFP) oder Ceramid-bindende Domäne in der C-Terminus von PKCζ (C20ζ-EGFP) wurde mit Phosphatidylserin / Ceramid Vesikeln inkubiert beschrieben in experimentelle Verfahren. Nach der Elution der MACS-Säule wurde Protein analysiert mittels Immunoblot und Antikörper gegen PKCζ und EGFP für die Detektion der eluierten Protein 2.
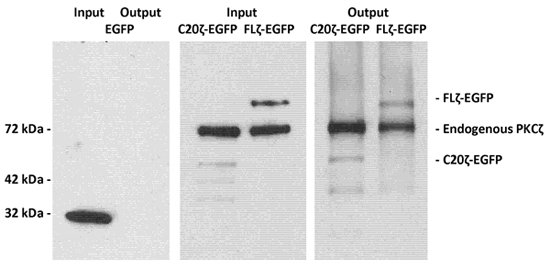
Abbildung 1. LIMACS von EGFP-markierten PKCζ und seine C-terminale Fragment C20ζ mit Phosphatidylserin / Ceramid Vesikel.
Waschmittel-free Lysaten von MDCK-Zellen, die EGFP (als eine unverbindliche Regelung), in voller Länge PKCζ-EGFP oder der Ceramid Bindung, C-terminale Fragment C20ζ-EGFP wurden mit Phosphatidylserin / Ceramid Vesikeln inkubiert, wie in den experimentellen Verfahren beschrieben . Nach der Verwendung LIMACS, wurde Protein mit SDS-Probenpuffer eluiert und durch SDS-PAGE und Immunoblot. Die linke Tafel zeigt, dass EGFP nicht auf die Vesikel mit der Annexin V-linked magnetischen Kügelchen zurückgehalten zu binden. Die mittlere und rechte Bild zeigt die volle Länge PKCζ-EGFP und C20ζ-EGFP wurden durch die Bindung an Ceramid beibehalten.
Diskussion
Um zu testen, die spezifische Interaktion zwischen einem Lipid-und Protein wird durch die Einbettung von Lipiden in der Zellmembran behindert. Die Zellmembran besteht aus einer Mischung von mehreren Lipiden und Proteinen, und es ist in Lipid-Mikrodomänen oder Flöße organisiert. Daher kann die Co-Reinigung von Mikrodomänen und Proteine nicht klar unterscheiden, ob ein Protein direkt bindet an ein Lipid oder nur in einem Mikrodomänenstruktur bereichert. Andere Methoden anhand definierter Lipide auf Oberflächen...
Offenlegungen
Danksagungen
Diese Arbeit wurde durch die NIH gewährt R01NS046835 und R01AG034389 und der March of Dimes gewähren 6FY08-322 unterstützt. Ein besonderer Dank an Frau Eleanor Brown (Miltenyi Biotec, Auburn, CA), die enorm mit ihren Einsichten halfen in die MACS-Technologie gewidmet ist. Miltenyi hat großzügig das Material für die Demonstration der Experimente ohne Kosten verwendet werden, vorausgesetzt. Ich bin auch dankbar, dass Dr. Guanghu Wang (Medical College of Georgia / Georgia Health Sciences University, Augusta, GA), die PKCζ exprimierende Zelllinien generiert. Unterstützung durch das Institut für Molekulare Medizin an der Medical College of Georgia / Georgia Health Sciences University (unter Leitung von Dr. Lin Mei) ist ebenfalls anerkannt.
Materialien
Annexin V-konjugierten magnetischen Beads und MACS Mikro-und Minisäulen wurden von Miltenyi Biotec, Inc. (Auburn, CA) zur Verfügung gestellt. Alle Lipide wurden von höchster Reinheit und erhielt von Avanti Polar Lipids (Alabaster, AL).
Referenzen
- Wang, G. Direct binding to ceramide activates protein kinase Czeta before the formation of a pro-apoptotic complex with PAR-4 in differentiating stem cells. J Biol Chem. 280, 26415-26424 (2005).
- Wang, G., Krishnamurthy, K., Umapathy, N. S., Verin, A. D., Bieberich, E. The carboxyl-terminal domain of atypical protein kinase Czeta binds to ceramide and regulates junction formation in epithelial cells. J Biol Chem. 284, 14469-14475 (2008).
- Chalfant, C. E. De novo ceramide regulates the alternative splicing of caspase 9 and Bcl-x in A549 lung adenocarcinoma cells. Dependence on protein phosphatase-1. J Biol Chem. 277, 12587-12595 (2002).
- Simon, C. G., Holloway, P. W., Gear, A. R. Exchange of C(16)-ceramide between phospholipid vesicles. Biochemistry. 38, 14676-14682 (1999).
- Goni, F. M., Contreras, F. X., Montes, L. R., Sot, J., Alonso, A. Biophysics (and sociology) of ceramides. Biochem Soc Symp. , 177-188 (2005).
- Kumagai, K. CERT mediates intermembrane transfer of various molecular species of ceramides. J Biol Chem. 280, 6488-6495 (2005).
- Wessel, D., Flugge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Anal Biochem. 138, 141-143 (1984).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten