Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Chromatographie d'affinité lipidique des vésicules médiée utilisant magnétique tri cellulaire activé (LIMACS): une nouvelle méthode pour analyser les interactions protéines-lipides
Dans cet article
Résumé
Pour tester l'interaction d'une protéine avec ses cibles lipidiques nous avons utilisé MACS et l'annexine V conjuguée à des billes magnétiques et les vésicules lipidiques synthétisées à partir des lipides cible et l'annexine V-contraignante phosphatidylsérine. Protéines liées à l'lipidiques cibles sont co-purifiés et analysés après élution à partir des perles.
Résumé
L'analyse des interactions protéine lipidique est difficile parce que les lipides sont incorporés dans les membranes cellulaires et donc inaccessible à la plupart des procédures de purification. Comme alternative, les lipides peuvent être enduits sur des surfaces planes que celles utilisées pour des lipides ELISA et spectroscopie de résonance plasmonique. Cependant, les lipides revêtement de surface ne forment pas des structures microdomaines, qui peut être important pour les propriétés des lipides contraignant. De plus, ces méthodes ne permettent pas pour la purification de grandes quantités de protéines se liant à leurs lipides cible.
Pour surmonter ces limitations des tests d'interaction protéine de lipides et de lipides pour purifier des protéines de liaison, nous avons développé une nouvelle méthode appelée chromatographie d'affinité lipidique des vésicules à médiation à l'aide de tri magnétique de cellules activées (LIMACS). Dans cette méthode, des vésicules lipidiques sont préparées avec les cibles lipidiques et la phosphatidylsérine comme lipide d'ancrage de l'annexine V MACS. Phosphatidylsérine est un phospholipide membranaire cellulaire ubiquitaire qui montre une forte affinité pour l'annexine V. protéines utilisant des billes magnétiques conjuguées à l'annexine V les vésicules lipidiques contenant phosphatidylsérine va se lier à des billes magnétiques. Lorsque les vésicules lipidiques sont incubés avec un lysat cellulaire de la protéine de liaison à l'lipidiques cibles seront également lié aux billes et peuvent être co-purifiée en utilisant MACS. Cette méthode peut également être utilisé pour tester si les protéines recombinantes reconstituer un complexe protéine de liaison à l'lipidiques cibles.
Nous avons utilisé cette méthode pour montrer l'interaction de la PKC atypiques (aPKC) avec le céramide sphingolipides et co-purifient réponse apoptose de la prostate 4 (PAR-4), une protéine de liaison à la céramide-aPKC associés. Nous avons aussi utilisé cette méthode pour la reconstitution d'un complexe céramide-associé de la aPKC recombinant avec la cellule de polarité des protéines liées Par6 et Cdc42. Depuis des vésicules lipidiques peuvent être préparés avec une variété de sphingo ou phospholipides, LIMACS propose un test polyvalent pour interactions lipide-protéine dans un environnement lipidique qui ressemble étroitement à celle de la membrane cellulaire. D'autres complexes protéiques des lipides peuvent être identifiés en utilisant une analyse protéomique de protéines liaison aux lipides co-purifiée avec les vésicules lipidiques.
Protocole
1. Présentation
La chromatographie d'affinité lipidique des vésicules à médiation à l'aide de tri magnétique de cellules activées (LIMACS) technique a été développée dans notre laboratoire afin d'isoler les complexes protéiques associés aux céramides 1-3. A l'origine, les vésicules lipidiques ont été faites de céramide et de la phosphatidylsérine, qui a permis de MACS en utilisant des particules magnétiques conjuguées à l'annexine V (très affine à la phosphatidylsérine) pour isoler les vésicules et de leurs protéines associées. Nous avons utilisé la technique LIMACS pour la reconstitution in vitro d'un complexe de polarité céramide-associés et l'isolement de céramide des protéines de liaison à partir de lysats cellulaires 3. LIMACS peut être modifiée à l'aide d'autres partenaires d'interaction pour l'isolement des vésicules (par exemple, glycolipide-specifc lectines ou des anticorps de lipides).
2. Procédures expérimentales
Préparation des vésicules lipidiques et Tests aPKCBinding
- Les vésicules lipidiques sont obtenus à partir de mélanges secs de quantités équimolaires de phosphatidylsérine (105 mg) et C16-céramide (85 mg) en suivant les procédures modifiées pour la préparation des liposomes grande 1,4-7.
- Les mélanges de lipides sont ensuite resuspendues et soniquées pendant 1 h dans 100 ul de tampon de la vésicule constituée de 50 mM Tris / HCl (pH 7,5) et NaCl 150 mM.
- Après l'ajout de 300 ul de tampon de la vésicule supplémenté avec 0,1 mM de MnCl2, les échantillons sont centrifugés à 12000 g μ pendant 20 min à 4 ° C.
- Le culot (vésicules lipidiques de grande taille) est resuspendu dans 100 ul de tampon de la vésicule et incubées avec 1 nmol de Vybrant CM-dii pendant 1 h à 37 ° C pour visualiser la fraction vésiculaire après la séparation MACS. Vybrant CM-Dii est un colorant rouge fluorescent spécifique intégrant dans les membranes lipidiques.
- Un détergent sans lysat cellulaire est préparée par sonication / homogénéisation des cellules dans 300 ul de tampon hypotonique (10 mM Tris / HCl (pH 7,0) avec la protéase et les inhibiteurs de phosphatase) suivie par l'enlèvement des débris membranaires par centrifugation. Une étape de centrifugation à 100000 g pendant 1 h doit être ajoutée pour éviter toute contamination du lysat cellulaire avec des membranes contenant endogènes phosphatidylsérine.
- Le lysat clarifié est ajouté à la suspension de vésicules lipidiques, et le mélange est incubé pendant 2 h à 4 ° C.
- Le mélange réactionnel est complété avec 20 pi de 20x annexine V tampon de liaison et 50 ul d'une solution contenant des billes magnétiques conjuguées à l'annexine V suivie d'une incubation pendant 1 h à 4 ° C.
- MACS est effectuée selon les instructions du fabricant (Miltenyi Biotec, Inc) du protocole. La présence et la quantité de vésicules lipidiques est déterminée par la surveillance de la Vybrant CM-dii fluorescence dans les fractions accréditives et d'élution en utilisant un lecteur de microplaques à fluorescence.
- La corrélation linéaire entre la quantité de lipides vésiculaires et l'intensité de fluorescence des vésicules liés Vybrant CM-Dii est vérifiée par quantitative haute performance chromatographie sur couche mince (HPTLC) du mélange lipidique appliquée à l'annexine V-Macs.
- La spécificité de la réaction de liaison des protéines aPKC ou autres pour les vésicules de céramides / phosphatidylsérine est vérifiée par un test de compétition des anticorps en utilisant 1 ug d'anti-PKCζ anticorps polyclonal de lapin à incuber le lysat cellulaire pendant 1 h à 4 ° C avant l'incubation avec les vésicules lipidiques.
- La protéine de liaison à la céramide / phosphatidylsérine vésicules dans l'éluat MACS est analysé par SDS-PAGE et immunoblotting.
Dans le complexe in vitro de polarité entre protéines et lipides
- La reconstitution in vitro d'un complexe de polarité entre protéines et lipides est réalisée suivant la procédure LIMACS comme décrit dans la section précédente. En bref, la phosphatidylsérine (420 ug) et C16-céramide (107 mg) est séché par un solvant organique.
- Les lipides séchés sont remises en suspension sous sonication dans 500 ul de tampon de la vésicule (50 mM Tris / HCl, pH 7,5, 150 mM NaCl).
- Cinq ul de 10 mM MnCl2, 1 pl de Vybrant CM-dii, et 500 ng d'PKCζ (humaine recombinante) est ajouté et le mélange réactionnel incubés agitation undergentle pendant 60 min à 4 ° C.
- Vybrant CM-dii teinté phosphatidylsérine / céramide vésicules sont récupérées par centrifugation à 12000 xg pendant 60 min à 4 ° C.
- Le culot (rose) est resuspendu dans 100 ul de tampon Tris et complété avec γS-GTP (100 uM), le PIB (1 mM), TPS-Par6 (100 ng), ou GST-Cdc42 (500 ng) et encore incubées pendant 3 h à 4 ° C (toute autre combinaison de protéines recombinantes d'intérêt peuvent être utilisés ici).
- Annexine V-tampon (5 pi d'une solution 20x stock) et l'annexine V conjuguée à des billes magnétiques (50 pi) sont ajoutés et le mélange réactionnel incubées sous agitation douce pendant encore 30 min à 4 ° C.
- Annexine V-MACS est effectué suivant le protocole du fournisseur comme décrit précédemment.
- La fraction d'élution (1 ml) est complétée par 10 ug d'ovalbumine pure que l'aide de précipitation. La protéine est concentrée par Wessel-Flügge précipitations et analysées par SDS-PAGE/immunoblotting comme décrit précédemment 8.
- Le montant de vésicules lipidiques élue est quantifiée par la détection de Vybrant CM-DII (rose) dans le bio (chloroforme / méthanol) la phase de la réaction de précipitation Flügge Wessel. La quantité de protéines analysées est normalisée sur des quantités égales de vésicules lipidiques.
3. Résultats
D'épuration des LIMACS PKCζ-EGFP et le domaine céramide contraignante C20ζ-EGFP
Un lysat sans détergent de cellules MDCK exprimant toute sa longueur PKCζ C-terminale liée à la protéine fluorescente verte (FLζ-EGFP) ou un domaine de liaison dans la céramide C-terminale de PKCζ (C20ζ-EGFP) a été incubée avec la phosphatidylsérine / vésicules céramide tant décrites dans des procédures expérimentales. Après élution de la colonne MACS, les protéines ont été analysées en utilisant des anticorps contre immunoblotting et PKCζ et EGFP pour la détection de la protéine éluée 2.
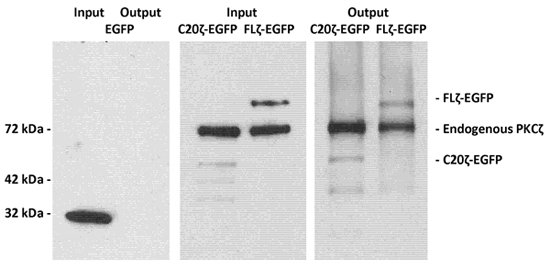
LIMACS Figure 1. EGFP marquée des PKCζ et son fragment C-terminal C20ζ utilisant phosphatidylsérine / céramide vésicules.
Sans détergent lysats de cellules MDCK exprimant l'EGFP (comme un contrôle non contraignant), pleine longueur PKCζ-EGFP, ou la liaison céramide, fragment C-terminal C20ζ-EGFP ont été incubées avec la phosphatidylsérine / vésicules céramide tel que décrit dans la section expérimentale procédures . Après avoir utilisé LIMACS, la protéine a été élue avec un tampon d'échantillon SDS et analysées par SDS-PAGE et immunoblotting. Le panneau de gauche montre que EGFP ne pas se lier à des vésicules conservé avec le annexine V-liée billes magnétiques. Le panneau du milieu et de droite montre que la longueur totale PKCζ-EGFP et C20ζ-EGFP ont été retenus en raison de liant à céramide.
Discussion
Pour tester l'interaction spécifique entre un lipide et sa protéine de liaison est entravée par l'incorporation de lipides dans la membrane cellulaire. La membrane cellulaire est constitué d'un mélange de plusieurs types de lipides et de protéines et il est organisé en microdomaines lipidiques ou radeaux. Par conséquent, la co-purification des microdomaines et les protéines ne peuvent pas distinguer clairement si une protéine se lie directement à un lipide ou est seulement enrichi dans une structu...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par les subventions des NIH et de R01NS046835 R01AG034389, et le Mars des dix sous de subventions 6FY08-322. Un merci tout spécial est consacré à Mme Eleanor Brown (Miltenyi Biotec, Auburn, CA) qui a aidé énormément avec sa perspicacité dans la technologie MACS. Miltenyi a généreusement fourni le matériau utilisé pour la démonstration de l'expérimentation à aucun coût. Je suis également reconnaissant au Dr Wang Guanghu (Medical College of Georgia / Géorgie Université des sciences de la santé, Augusta, Géorgie) qui a généré le PKCζ exprimant des lignées cellulaires. Soutien par l'Institut de médecine moléculaire du Medical College of Georgia / Géorgie Health Sciences University (sous direction du Dr Lin Mei) est également reconnu.
matériels
Annexine V conjuguée à des billes magnétiques et MACS micro et minicolonnes ont été fournis par Miltenyi Biotec, Inc (Auburn, Californie). Tous les lipides étaient de plus grande pureté et obtenu de Avanti Polar Lipids (Alabaster, AL).
Références
- Wang, G. Direct binding to ceramide activates protein kinase Czeta before the formation of a pro-apoptotic complex with PAR-4 in differentiating stem cells. J Biol Chem. 280, 26415-26424 (2005).
- Wang, G., Krishnamurthy, K., Umapathy, N. S., Verin, A. D., Bieberich, E. The carboxyl-terminal domain of atypical protein kinase Czeta binds to ceramide and regulates junction formation in epithelial cells. J Biol Chem. 284, 14469-14475 (2008).
- Chalfant, C. E. De novo ceramide regulates the alternative splicing of caspase 9 and Bcl-x in A549 lung adenocarcinoma cells. Dependence on protein phosphatase-1. J Biol Chem. 277, 12587-12595 (2002).
- Simon, C. G., Holloway, P. W., Gear, A. R. Exchange of C(16)-ceramide between phospholipid vesicles. Biochemistry. 38, 14676-14682 (1999).
- Goni, F. M., Contreras, F. X., Montes, L. R., Sot, J., Alonso, A. Biophysics (and sociology) of ceramides. Biochem Soc Symp. , 177-188 (2005).
- Kumagai, K. CERT mediates intermembrane transfer of various molecular species of ceramides. J Biol Chem. 280, 6488-6495 (2005).
- Wessel, D., Flugge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Anal Biochem. 138, 141-143 (1984).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon